TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL
|
|
|
- Sergio Mora Valenzuela
- hace 7 años
- Vistas:
Transcripción
1 1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de nm, mesoporosos de 2-50 nm y macroporosos de nm. Las áreas superficiales y la distribución del tamaño de los poros de los materiales mesoporosos se puede calcular por adsorción de N 2 ó Ar. Para los materiales microporosos se utiliza otra metodología. La porosidad se calcula como: Pr(%)= (V p / V total ). 100 siendo V total = V denso + V p V p : Volumen del poro en cm 3 g -1 V total : Volumen total de la sustancia (picnometría con Hg a 0.1 MPa) V denso : Volumen del material denso (picnometría con helio) P(%)= (V Hg - V He )/V Hg.100
2 2 Picnómetro: Medidas de Densidad. Las medidas por picnometría están basadas en el método general de evaluar lo más exactamente posible la relación entre la masa del cuerpo y la del mismo volumen de un fluido. El picnómetro es un recipiente de vidrio provisto de un tapón esmerilado con un tubo capilar marcado con una señal. El fluido utilizado es el Queroseno (densidad gr/cm 3 ) y la temperatura se ha mantenido estable en 24 ºC durante la realización de las medidas. El procedimiento a seguir ha consistido en la medida de pesadas del picnómetro con y sin queroseno y/o muestra. Se pesa el picnómetro vació (m1), se introduce una cierta cantidad de muestra y se pesa de nuevo (m2), se enrasa el volumen restante con un liquido de densidad conocida (ρ) y se pesa de nuevo (m3). Se retira la muestra y se enrasa con el líquido de densidad conocida para hacer la última pesada (m4). La masa del compuesto será m2 m1 y su volumen, el del liquido que desaloja (m4 m3 + m2 m1)/ ρ.
3 3 2.- Cálculo del área superficial específica (A: m 2 g -1 ) A= n m a m L a m : área media ocupada por una molécula de adsorbato L: constante de Avogadro n m : capacidad de la monocapa (mol adsorbato /g sólido ) Habitualmente se utiliza la adsorción de N 2 a su punto de ebullición 77.4 K Para a m, según Emmett y Brunauer, la densidad de empaquetamiento del gas adsorbido en la superficie es igual que en el líquido. a m = [(M/ρ L )L] 2/3 a m : 16.2 nm 2 (N 2 ), (Ar), 0.20 (Kr) 1.091: factor de empaquetamiento (12 vecinos, líquido, 6 superficie plana) M: 28 (N 2 ) ρ L : 0.81 gcm -3 (77.4 K) 3.- Adsorción de una monocapa: decripción de Langmuir a) Todos los sitios de adsorción son equivalentes b) La capacidad de una molécula de adsorberse en un sitio es independiente de que los sitios vecinos estén o no ocupados. r ads = K a (p/p 0 ) N(1-θ) r des = K d Nθ r ads : velocidad de adsorción de la superficie no recubierta p/p 0 : presión relativa N: número de sitios 1-θ: parte no recubierta K a : constate de velocidad de adsorción En el equlibrio : r ads = r des K a (p/p 0 ) N(1-θ) = K d Nθ K= exp(- G 0 /RT)= K a /K d Ecuación de Langmuir θ = [K(p/p 0 )] / [1 + K (p/p 0 )]
4 4 Como θ= n/n m, siendo n= número de moles de adsorbato y n m = capacidad de la monocapa, se tiene la forma recíproca: 1/n = 1/n m + [1/(n m K)]. [1/(p/p 0 )] 4.- Adsorción de multicapas: descripción BET Se trata de calcular la capacidad de adsorber de la monocapa en presencia de multicapas. 1.- El calor de adsorción es constante en la primera capa 2.- El calor de adsorción de la segunda capa y todas las demás es constante, e inferior al de la primera, y es del orden del calor de condensación (N 2, Ar) 3.- En principio se pueden adsorber infinitas capas V/V mon = - [(c(p/p 0 )] / [(1-p/p 0 ) {1-(1-c)(p/p 0 )}] V: volumen de gas adsorbido V mon : volumen de gas adsorbido en la monocapa p 0 : presión de vapor por encima de una capa gruesa de líquido sobre la superficie c : exp-( H d - H vap )/RT H d : entalpía de adsorción de la primera monocapa, H vap : calor de vaporización Forma lineal de la ecuación: [(p)/((p 0 -p)v)] = [(1)/(cV mon )] + [((c-1)p)/(cv mon p 0 )] p/p 0 : , isotermas de los tipos II y IV
5 5
6 6
7 7
8 8 V_ADSORBIDO(cmŽ/g 1,4 LIFEFOSFITO ANHIDRO 1,3 1,2 Vol. ads. (cm 3 /g) 1,1 1 0,9 0,8 0,7 0,6 0 0,05 0,1 0,15 0,2 0,25 p/p 0 0,3
9 9
10 10
11 11 (C 5 H 14 N 2 )[(VO) 3 (AsO 4 )(HAsO 4 )(OH)].5H 2 O Volume (cm 3 g -1 ) Desorption 5 Sorption 0 0 0,2 0,4 0,6 0,8 P/P 1 0 Las medidas isotermas de adsorción del (C 5 H 14 N 2 )[(VO) 3 (AsO 4 )(HAsO 4 )(OH)].5H 2 O, realizadas a 77 K, muestran reversible adsorción y desadsorción de N 2 líquido. El área superficial BET es de 30.4(1) m 2 g -1 y el diámetro medio de poro es 11.7(1) Å, ambos valores característicos de materiales microporosos.
12 12 En el esqueleto 3D de este compuesto hay anillos delimitados por 12 unidades SBU-6, que originan canales a lo largo de la dirección [001] con un diámetro de, aproximadamente, 14.8 Å c b a
Picnómetro: Medidas de Densidad.
 1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
a) La presión la podemos calcular a partir de la isoterma de Langmuir sabiendo que la fracción de recubrimiento es 0.5 y que K=0.
 . En un recipiente de L a 98 se introduce una cierta cantidad de adsorbente sólido. Si la constante de adsorción es de 0.8 atm -, a) Qué presión de gas será necesaria para que la fracción de recubrimiento
. En un recipiente de L a 98 se introduce una cierta cantidad de adsorbente sólido. Si la constante de adsorción es de 0.8 atm -, a) Qué presión de gas será necesaria para que la fracción de recubrimiento
UNIDAD 3. FENÓMENOS DE SUPERFICIE. ADSORCIÓN
 UNIDAD 3. FENÓMENOS DE SUPERFICIE. ADSORCIÓN La adsorción puede definirse como la tendencia de un componente del sistema a concentrarse en la interfase, donde la composición interfacial es diferente a
UNIDAD 3. FENÓMENOS DE SUPERFICIE. ADSORCIÓN La adsorción puede definirse como la tendencia de un componente del sistema a concentrarse en la interfase, donde la composición interfacial es diferente a
Tema 7. Superficies sólidas: adsorción y catálisis heterogénea
 Tema 7. Superficies sólidas: adsorción y catálisis heterogénea Parte I 1. Estructura y composición de superficies sólidas 2. Adsorción de gases sobre sólidos 3. Isotermas de adsorción 4. Velocidad de los
Tema 7. Superficies sólidas: adsorción y catálisis heterogénea Parte I 1. Estructura y composición de superficies sólidas 2. Adsorción de gases sobre sólidos 3. Isotermas de adsorción 4. Velocidad de los
Estado líquido y las Fuerzas intermoleculares
 Estado líquido y las Fuerzas intermoleculares Propiedades de los líquidos La tensión superficial es la cantidad de energía requerida para dilatar o aumentar la superficie de un líquido por unidad de área.
Estado líquido y las Fuerzas intermoleculares Propiedades de los líquidos La tensión superficial es la cantidad de energía requerida para dilatar o aumentar la superficie de un líquido por unidad de área.
1.1. La presión la podemos calcular a partir de la isoterma de Langmuir sabiendo que la fracción de recubrimiento es 0.5 y que K=0.
 . En un recipiente de L a 98 se introduce una cierta cantidad de adsorbente sólido. Si la constante de adsorción es de.8 atm -,.. Qué presión de gas será necesaria para que la fracción de recubrimiento
. En un recipiente de L a 98 se introduce una cierta cantidad de adsorbente sólido. Si la constante de adsorción es de.8 atm -,.. Qué presión de gas será necesaria para que la fracción de recubrimiento
1.1. La presión la podemos calcular a partir de la isoterma de Langmuir sabiendo que la fracción de recubrimiento es 0.5 y que K=0.
 1. En un recipiente de 1L a 98 K se introduce una cierta cantidad de orbente sólido. Si la constante de orción es de 0.8 atm -1, 1.1. Qué presión de gas será necesaria para que la fracción de recubrimiento
1. En un recipiente de 1L a 98 K se introduce una cierta cantidad de orbente sólido. Si la constante de orción es de 0.8 atm -1, 1.1. Qué presión de gas será necesaria para que la fracción de recubrimiento
líquido sólido Interfase sólido-líquido
 INTERFASES La mayoría de los procesos fisicoquímicos naturales y artificiales ocurren en sistemas heterogéneos en donde las diferentes fases que las componen están separadas por una interfase, definida
INTERFASES La mayoría de los procesos fisicoquímicos naturales y artificiales ocurren en sistemas heterogéneos en donde las diferentes fases que las componen están separadas por una interfase, definida
Fuerzas intermoleculares y líquidos y sólidos
 Fuerzas intermoleculares y líquidos y sólidos Capítulo 11 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Una fase es la parte homógenea de un sistema en contacto
Fuerzas intermoleculares y líquidos y sólidos Capítulo 11 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Una fase es la parte homógenea de un sistema en contacto
Universidad Tecnológica Nacional Facultad Regional Rosario Cátedra de Ing. De las Reacciones
 Universidad Tecnológica acional Facultad Regional Rosario Cátedra de Ing. De las Reacciones Trabajo practico º 2: dsorción de cido cético en Carbón ctivado Ing. Roque asciarelli - Ing Silvia Stancich -
Universidad Tecnológica acional Facultad Regional Rosario Cátedra de Ing. De las Reacciones Trabajo practico º 2: dsorción de cido cético en Carbón ctivado Ing. Roque asciarelli - Ing Silvia Stancich -
DEFINICION DE MECANICA DE FLUIDOS
 DEFINICION DE MECANICA DE FLUIDOS La Mecánica, es la ciencia que estudia los cuerpos bajo la acción de fuerzas, tanto en estado estacionario y en movimiento. La rama que estudia los cuerpos en movimiento
DEFINICION DE MECANICA DE FLUIDOS La Mecánica, es la ciencia que estudia los cuerpos bajo la acción de fuerzas, tanto en estado estacionario y en movimiento. La rama que estudia los cuerpos en movimiento
Tema 9. Tema 9: Estados de agregación de la materia. 9.1 Características generales de los estados de agregación LARGO ALCANCE ORDEN ALCANCE
 Tema 9: Estados de agregación de la materia 9.1 Características generales de los estados de agregación Desde el punto de vista microscópico: 9.1 Características generales 9.2 Sólidos: estructura cristalina
Tema 9: Estados de agregación de la materia 9.1 Características generales de los estados de agregación Desde el punto de vista microscópico: 9.1 Características generales 9.2 Sólidos: estructura cristalina
Estudio por espectroscopía Raman de vidrios silicobóricos separados en fases y lixiviados.
 Estudio por espectroscopía Raman de vidrios silicobóricos separados en fases y lixiviados. Javier Sanguino, M. Alejandra Mazo, Juan Rubio y José Luis Oteo* *Química Física de Superficies y Procesos, Instituto
Estudio por espectroscopía Raman de vidrios silicobóricos separados en fases y lixiviados. Javier Sanguino, M. Alejandra Mazo, Juan Rubio y José Luis Oteo* *Química Física de Superficies y Procesos, Instituto
Química General. Cap. 3: Gases. Departamento de Química. Universidad Nacional Experimental del Táchira (UNET) San Cristóbal 2007
 Química General Departamento de Química Cap. 3: Gases Universidad Nacional Experimental del Táchira (UNET) San Cristóbal 2007 Propiedades de los Gases: Presión del Gas Presión del gas Fuerza (N) P (Pa)
Química General Departamento de Química Cap. 3: Gases Universidad Nacional Experimental del Táchira (UNET) San Cristóbal 2007 Propiedades de los Gases: Presión del Gas Presión del gas Fuerza (N) P (Pa)
Química General. Fuerzas Intermoleculares. Cap.3:Líquidos, Sólidos y. Departamento de Química. Universidad Nacional Experimental del Táchira (UNET)
 Química General Departamento de Química Cap.3:Líquidos, Sólidos y Fuerzas Intermoleculares Universidad Nacional Experimental del Táchira (UNET) San Cristóbal 2007 Contenido V-1 Fuerzas intermoleculares
Química General Departamento de Química Cap.3:Líquidos, Sólidos y Fuerzas Intermoleculares Universidad Nacional Experimental del Táchira (UNET) San Cristóbal 2007 Contenido V-1 Fuerzas intermoleculares
TEMA 9: CATALIZADORES SÓLIDOS CQA-9/1
 TEMA 9: CATALIZADORES SÓLIDOS CQA-9/1 CONSIDERACIONES GENERALES SOBRE LOS CATALIZADORES SÓLIDOS Sustancias complejas; importancia industrial: estudio de propiedades efectos. Naturaleza química: potencialidad
TEMA 9: CATALIZADORES SÓLIDOS CQA-9/1 CONSIDERACIONES GENERALES SOBRE LOS CATALIZADORES SÓLIDOS Sustancias complejas; importancia industrial: estudio de propiedades efectos. Naturaleza química: potencialidad
Propiedades de los Materiales Cerámicos
 Propiedades de los Materiales Cerámicos PROPIEDADES FÍSICAS Muchas de las aplicaciones de cerámicos se basan en propiedades físicas y térmicas. Por ejemplo los ladrillos de protección de una nave espacial
Propiedades de los Materiales Cerámicos PROPIEDADES FÍSICAS Muchas de las aplicaciones de cerámicos se basan en propiedades físicas y térmicas. Por ejemplo los ladrillos de protección de una nave espacial
Laboratorio de Fisicoquímica
 INSTITUTO POITÉCNICO NACIONA Unidad Profesional Interdisciplinaria de Biotecnología aboratorio de Fisicoquímica Profesoras: Juárez Juárez Minerva Nava Álvarez Raquel Equipo No: 1 Integrantes: Chacon Romero
INSTITUTO POITÉCNICO NACIONA Unidad Profesional Interdisciplinaria de Biotecnología aboratorio de Fisicoquímica Profesoras: Juárez Juárez Minerva Nava Álvarez Raquel Equipo No: 1 Integrantes: Chacon Romero
Ejercicios y respuestas del apartado: Estados de la materia. Cambios de estado. Sobre las propiedades de la materia.
 Ejercicios y respuestas del apartado: Estados de la materia. Cambios de estado. Sobre las propiedades de la materia. Sobre las propiedades de la materia 1. Señala la afirmación correcta. a) El volumen
Ejercicios y respuestas del apartado: Estados de la materia. Cambios de estado. Sobre las propiedades de la materia. Sobre las propiedades de la materia 1. Señala la afirmación correcta. a) El volumen
Problemas de Física 4
 1. Termometría Problemas de Física 4 Termometría y Calorimetría (a) Una serie de mediciones de los volúmenes que ocupan un mol de un gas mantenido a temperatura constante T 0 en función de la presión produce
1. Termometría Problemas de Física 4 Termometría y Calorimetría (a) Una serie de mediciones de los volúmenes que ocupan un mol de un gas mantenido a temperatura constante T 0 en función de la presión produce
TEMA 7 FENÓMENOS DE INTERFASES
 TEM 7 FENÓMENO DE INTERFE uando existen dos o más fases al mismo tiempo, el límite entre dos de ellas es llamado interfase. Las propiedades de las moléculas que forman la interfase son suficientemente
TEM 7 FENÓMENO DE INTERFE uando existen dos o más fases al mismo tiempo, el límite entre dos de ellas es llamado interfase. Las propiedades de las moléculas que forman la interfase son suficientemente
Los Fluidos. Su forma no cambia, salvo por la acción de fuerzas externas. Sólido. Líquido. Estados de la materia
 Estados de la materia { Sólido } Líquido Gas Plasma FLUIDOS Su forma no cambia, salvo por la acción de fuerzas externas. Tienen la propiedad de adoptar la forma del recipiente que los contiene. Líquidos:
Estados de la materia { Sólido } Líquido Gas Plasma FLUIDOS Su forma no cambia, salvo por la acción de fuerzas externas. Tienen la propiedad de adoptar la forma del recipiente que los contiene. Líquidos:
P kt. El plano (1,0,0) del cobre metálico es: a =361 pm. El número de colisiones que recibe por unidad de área y unidad de tiempo es:
 S.- El plano cristalino (00) de una muestra de Cu metálico se pone en contacto con He gas a 80 y una presión de 35 a. Determinar la frecuencia con que los átomos de He golpean a cada uno de los átomos
S.- El plano cristalino (00) de una muestra de Cu metálico se pone en contacto con He gas a 80 y una presión de 35 a. Determinar la frecuencia con que los átomos de He golpean a cada uno de los átomos
Teoría Cinético-Molecular. Fuerzas Intermoleculares y Líquidos y Sólidos. Fase. Fuerzas 18/08/2011
 Fuerzas Intermoleculares y Líquidos y Sólidos Teoría Cinético-Molecular Gases (moleculas bien separadas) Líquidos y Sólidos (moléculas bien cercanas) Qué es una fase? Basado en Capítulo 11 de Química (Chang,
Fuerzas Intermoleculares y Líquidos y Sólidos Teoría Cinético-Molecular Gases (moleculas bien separadas) Líquidos y Sólidos (moléculas bien cercanas) Qué es una fase? Basado en Capítulo 11 de Química (Chang,
Diseño de Reactores Heterogéneos Catalíticos
 Diseño de Reactores Heterogéneos Catalíticos La mayor parte de los procesos de la industria petroquímica primaria son llevados a cabo a través de reacciones catalíticas heterogéneas. Las reacciones son
Diseño de Reactores Heterogéneos Catalíticos La mayor parte de los procesos de la industria petroquímica primaria son llevados a cabo a través de reacciones catalíticas heterogéneas. Las reacciones son
EJERCICIOS N 2 PRIMERA LEY DE LA TERMODINAMICA
 EJERCICIOS N 2 PRIMERA LEY DE LA TERMODINAMICA 2.1.- La dilatación del mercurio se puede expresar mediante: V = V o (1 + 1,814610-4 t + 9,20510-9 t 2 ) FISICOQUIMICA I CARRERA : QUIMICA Y FARMACIA donde
EJERCICIOS N 2 PRIMERA LEY DE LA TERMODINAMICA 2.1.- La dilatación del mercurio se puede expresar mediante: V = V o (1 + 1,814610-4 t + 9,20510-9 t 2 ) FISICOQUIMICA I CARRERA : QUIMICA Y FARMACIA donde
CLASE Nº 1 ESTADO LÍQUIDO
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL UNIDAD III CLASE Nº 1 ESTADO LÍQUIDO 1 El líquido es uno
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL UNIDAD III CLASE Nº 1 ESTADO LÍQUIDO 1 El líquido es uno
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea.
 Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Grado de Activación del Carbón Activado en el Laboratorio 1. FUNDAMENTO
 1. FUNDAMENTO El carbón activo es un adsorbente muy versátil extensamente usado en numerosas aplicaciones industriales (entre ellas la depuración de agua). La naturaleza química de los átomos de carbono
1. FUNDAMENTO El carbón activo es un adsorbente muy versátil extensamente usado en numerosas aplicaciones industriales (entre ellas la depuración de agua). La naturaleza química de los átomos de carbono
Tema Tema 18 (I) Estados de agregación de la materia El estado sólido Estructura cristalina
 Tema 18 (I) Estados de agregación de la materia 18.1 El estado sólido 18.2 Estructura cristalina 18.3 Tipos de cristales 18.4 El estado líquido 18.5 Propiedades particulares del agua 1 2 18.1 El estado
Tema 18 (I) Estados de agregación de la materia 18.1 El estado sólido 18.2 Estructura cristalina 18.3 Tipos de cristales 18.4 El estado líquido 18.5 Propiedades particulares del agua 1 2 18.1 El estado
Seminario 2. Fuerzas Intermoleculares Líquidos y Sólidos
 Seminario 2. Fuerzas Intermoleculares Líquidos y Sólidos 2.. Justificar los datos de la siguiente tabla: PM Punto de ebullición o C 2-metilbutano (CH 3 ) 2 CHCH 2 CH 3 -cloropropano CH 3 CH 2 CH 2 Cl 72
Seminario 2. Fuerzas Intermoleculares Líquidos y Sólidos 2.. Justificar los datos de la siguiente tabla: PM Punto de ebullición o C 2-metilbutano (CH 3 ) 2 CHCH 2 CH 3 -cloropropano CH 3 CH 2 CH 2 Cl 72
Soluciones. DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I)
 Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Capítulo 10. Efectos de superficie. Sistema respiratorio
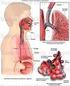 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
La Regla de las Fases. Clase 03 Dr. Abel Moreno Cárcamo
 La Regla de las Fases Clase 03 Dr. Abel Moreno Cárcamo abel.moreno@unam.mx Un fase es una porción homogénea de un sistema. Para describir el estado de equilibrio de un sistema con varias fases y diversas
La Regla de las Fases Clase 03 Dr. Abel Moreno Cárcamo abel.moreno@unam.mx Un fase es una porción homogénea de un sistema. Para describir el estado de equilibrio de un sistema con varias fases y diversas
Superficies Termodinámicas. 8-Sep-06 Alicia Ma. Esponda Cascajares 1
 Superficies ermodinámicas 8-Sep-06 Alicia Ma. Esponda Cascajares 1 Ley de Boyle-Mariotte En 1662 Robert Boyle formuló la generalización que relación el volumen de una masa de gas con la presión ejercida
Superficies ermodinámicas 8-Sep-06 Alicia Ma. Esponda Cascajares 1 Ley de Boyle-Mariotte En 1662 Robert Boyle formuló la generalización que relación el volumen de una masa de gas con la presión ejercida
DETERMINACIÓN DE LA MASA MOLECULAR POR ELEVACIÓN DEL PUNTO DE EBULLICIÓN DE UNA DISOLUCIÓN
 DETERMINACIÓN DE LA MASA MOLECULAR POR ELEVACIÓN DEL PUNTO DE EBULLICIÓN DE UNA DISOLUCIÓN OBJETIVO El alumno determinará la masa molecular de un compuesto puro, por elevación del punto de ebullición de
DETERMINACIÓN DE LA MASA MOLECULAR POR ELEVACIÓN DEL PUNTO DE EBULLICIÓN DE UNA DISOLUCIÓN OBJETIVO El alumno determinará la masa molecular de un compuesto puro, por elevación del punto de ebullición de
Física para Ciencias: Fluidos
 Física para Ciencias: Fluidos Dictado por: Profesor Aldo Valcarce 1 er semestre 2014 Fluidos Cualquier sustancia que tiene la capacidad de fluir es un fluidos (Líquido, Gas, Plasma) Muchos aspectos de
Física para Ciencias: Fluidos Dictado por: Profesor Aldo Valcarce 1 er semestre 2014 Fluidos Cualquier sustancia que tiene la capacidad de fluir es un fluidos (Líquido, Gas, Plasma) Muchos aspectos de
Los siguientes son elementos que pueden existir como gases a una temperatura de 25 C y 1 atm de presión
 Gases Los siguientes son elementos que pueden existir como gases a una temperatura de 25 C y 1 atm de presión Sustancias que existen como gases a una temperatura de 25 C y 1 atm de presión Características
Gases Los siguientes son elementos que pueden existir como gases a una temperatura de 25 C y 1 atm de presión Sustancias que existen como gases a una temperatura de 25 C y 1 atm de presión Características
EQUILIBRIO SÓLIDO-LÍQUIDO-VAPOR CONSTRUCCIÓN DE UN DIAGRAMA DE FASES
 EQUILIBRIO SÓLIDO-LÍQUIDO-VAPOR CONSTRUCCIÓN DE UN DIAGRAMA DE FASES I. OBJETIVO GENERAL Interpretar el diagrama de fases de una sustancia pura, construido a partir de datos de presión y temperatura obtenidos
EQUILIBRIO SÓLIDO-LÍQUIDO-VAPOR CONSTRUCCIÓN DE UN DIAGRAMA DE FASES I. OBJETIVO GENERAL Interpretar el diagrama de fases de una sustancia pura, construido a partir de datos de presión y temperatura obtenidos
TEMA II.4. Propiedad de los Fluidos. Dr. Juan Pablo Torres-Papaqui
 TEMA II.4 Propiedad de los Fluidos Dr. Juan Pablo Torres-Papaqui Departamento de Astronomía Universidad de Guanajuato DA-UG (México) papaqui@astro.ugto.mx División de Ciencias Naturales y Exactas, Campus
TEMA II.4 Propiedad de los Fluidos Dr. Juan Pablo Torres-Papaqui Departamento de Astronomía Universidad de Guanajuato DA-UG (México) papaqui@astro.ugto.mx División de Ciencias Naturales y Exactas, Campus
Las. Estudio. queda retenida
 MOVIMIENTO DEL AGUA EN MEDIOS POROSOS Las prácticas del riego y avenamiento tienen como objetivo mantener una relación aire/agua en el suelo adecuados para la producción del cultivo Estudio de la filtración
MOVIMIENTO DEL AGUA EN MEDIOS POROSOS Las prácticas del riego y avenamiento tienen como objetivo mantener una relación aire/agua en el suelo adecuados para la producción del cultivo Estudio de la filtración
P/T = k V y n ctes. P y T ctes. P y n ctes. T y n ctes. presión. temperatura. escala. absoluta. empírica. absoluta atmosférica manométrica
 presión volumen mol temperatura escala absoluta atmosférica manométrica absoluta empírica Boyle Charles Gay Lussac Avogadro PV = k T y n ctes V/T = k P y n ctes P/T = k V y n ctes V/n = Vm P y T ctes PV
presión volumen mol temperatura escala absoluta atmosférica manométrica absoluta empírica Boyle Charles Gay Lussac Avogadro PV = k T y n ctes V/T = k P y n ctes P/T = k V y n ctes V/n = Vm P y T ctes PV
Física General II. Guía N 1: Hidrostática y Tensión Superficial
 Física General II Guía N 1: Hidrostática y Tensión Superficial Problema 1: En algunos lugares de la placa de hielo sobre la isla de Groenlandia, el espesor es de 1 Km. Calcular la presión sobre el suelo
Física General II Guía N 1: Hidrostática y Tensión Superficial Problema 1: En algunos lugares de la placa de hielo sobre la isla de Groenlandia, el espesor es de 1 Km. Calcular la presión sobre el suelo
INTRODUCCIÓN A LA TERMODINÁMICA
 INTRODUCCIÓN A A TERMODINÁMICA ÍNDICE 1. Introducción 2. Sistema termodinámico 3. Propiedades de un sistema 4. Temperatura y equilibrio térmico 5. Termómetros y escalas de temperatura 6. Dilatación térmica
INTRODUCCIÓN A A TERMODINÁMICA ÍNDICE 1. Introducción 2. Sistema termodinámico 3. Propiedades de un sistema 4. Temperatura y equilibrio térmico 5. Termómetros y escalas de temperatura 6. Dilatación térmica
Unidad Propiedades de las sustancias puras
 Unidad 2 2.1.- Propiedades de las sustancias puras 2.1.1.- Sustancias puras PLANIFICACIÓN Certámenes: Certamen 1 15 de mayo Certamen 2 12 de junio. Certamen 3 6 de julio 2.1.- Propiedades de las sustancias
Unidad 2 2.1.- Propiedades de las sustancias puras 2.1.1.- Sustancias puras PLANIFICACIÓN Certámenes: Certamen 1 15 de mayo Certamen 2 12 de junio. Certamen 3 6 de julio 2.1.- Propiedades de las sustancias
CARBON ACTIVO Los carbones activados
 CARBON ACTIVO Los carbones activados Los productos carbonosos manufacturados, fácil de manejar, industriales, que tienen la estructura porosa y gran superficie interna. Ellos pueden adsorber una amplia
CARBON ACTIVO Los carbones activados Los productos carbonosos manufacturados, fácil de manejar, industriales, que tienen la estructura porosa y gran superficie interna. Ellos pueden adsorber una amplia
0. GLOSARIO Y UNIDADES
 0. GLOSARIO Y UNIDADES ) Área de paso del fluido en la configuración en la que circula únicamente agua. ) Área de intercambio en intercambiador de calor. ) Área de paso del fluido en la configuración en
0. GLOSARIO Y UNIDADES ) Área de paso del fluido en la configuración en la que circula únicamente agua. ) Área de intercambio en intercambiador de calor. ) Área de paso del fluido en la configuración en
XXIX OLIMPIADA DE QUÍMICA Fase Local EXTREMADURA Nombre:
 TEST DE PREGUNTAS MULTIRRESPUESTA (4 puntos) Se deberá marcar con una cruz en la HOJA de RESPUESTAS (al final del test) la respuesta correcta de cada pregunta (sólo hay una respuesta válida en cada pregunta).
TEST DE PREGUNTAS MULTIRRESPUESTA (4 puntos) Se deberá marcar con una cruz en la HOJA de RESPUESTAS (al final del test) la respuesta correcta de cada pregunta (sólo hay una respuesta válida en cada pregunta).
U.L.A. FACULTAD DE INGENIERIA. Mérida, 19/06/2008 ESCUELA DE MECANICA. MECANICA DE FLUIDOS. Sección 01. PRIMER PARCIAL TEORIA.
 U.L.A. FACULTAD DE INGENIERIA. Mérida, 19/06/008 TEORIA. 1. Qué se debe hacer para determinar si un gas se comporta como fluido compresible o incompresible?. Qué es la presión de vapor? 3. Explique el
U.L.A. FACULTAD DE INGENIERIA. Mérida, 19/06/008 TEORIA. 1. Qué se debe hacer para determinar si un gas se comporta como fluido compresible o incompresible?. Qué es la presión de vapor? 3. Explique el
Fuerzas Interparticulares
 Teoría, Dra. Sandra Signorella Profesora Titular Área Química General e Inorgánica Tema FUERZAS INTERPARTICULARES Año 2018 Fuerzas Interparticulares Estado gaseoso, líquido y sólido Gases reales y Ec.
Teoría, Dra. Sandra Signorella Profesora Titular Área Química General e Inorgánica Tema FUERZAS INTERPARTICULARES Año 2018 Fuerzas Interparticulares Estado gaseoso, líquido y sólido Gases reales y Ec.
FISICOQUÍMICA EN BIOPROCESOS
 FISICOQUÍMICA EN BIOPROCESOS UNIDAD 1: Termodinámica. Dimensiones y unidades. Temperatura y escalas de temperatura. Propiedades intensivas y extensivas. Sistemas y estados. Gases ideales Función de estado.
FISICOQUÍMICA EN BIOPROCESOS UNIDAD 1: Termodinámica. Dimensiones y unidades. Temperatura y escalas de temperatura. Propiedades intensivas y extensivas. Sistemas y estados. Gases ideales Función de estado.
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA
 BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
CAPITULO 4. LA OPERACIÓN UNITARIA COMO PROCESO DE TRANSFERENCIA DE MASA, ENERGÍA Y/O CANTIDAD DE MOVIMIENTO PROF. JOSE MAYORGA
 UNIVERSIDAD DE LOS ANDES FACULTAD DE INGENIERIA INGENIERIA QUIMICA INTRODUCCIÓN A LA INGENIERIA QUIMICA CAPITULO 4. LA OPERACIÓN UNITARIA COMO PROCESO DE TRANSFERENCIA DE MASA, ENERGÍA Y/O CANTIDAD DE
UNIVERSIDAD DE LOS ANDES FACULTAD DE INGENIERIA INGENIERIA QUIMICA INTRODUCCIÓN A LA INGENIERIA QUIMICA CAPITULO 4. LA OPERACIÓN UNITARIA COMO PROCESO DE TRANSFERENCIA DE MASA, ENERGÍA Y/O CANTIDAD DE
Problemas de Química General Curso de C. Químicas Grupo 911 Hoja 6
 Problemas de Química General Curso 2017-2018 1 de C. Químicas Grupo 911 Hoja 6 1. A partir de los datos sobre las reacciones que se dan seguidamente, determinar la entalpía de reacción estándar para el
Problemas de Química General Curso 2017-2018 1 de C. Químicas Grupo 911 Hoja 6 1. A partir de los datos sobre las reacciones que se dan seguidamente, determinar la entalpía de reacción estándar para el
HOJA DE PROBLEMAS 4: ENUNCIADOS
 Tema: ESTADOS DE AGREGACIÓN HOJA DE PROBLEMAS 4: ENUNCIADOS 1. ( ) Indicar el número de fases y componentes que constituyen cada uno de los siguientes sistemas: a) NO 2 ; CO 2 ; CH 4 b) CaCO 3 (s); CO
Tema: ESTADOS DE AGREGACIÓN HOJA DE PROBLEMAS 4: ENUNCIADOS 1. ( ) Indicar el número de fases y componentes que constituyen cada uno de los siguientes sistemas: a) NO 2 ; CO 2 ; CH 4 b) CaCO 3 (s); CO
ESTADOS DE AGREGACIÓN DE LA MATERIA
 ESTADOS DE AGREGACIÓN DE LA MATERIA 1 Estados de agregación de la materia Introducción Leyes de los gases Ecuación de estado de los gases ideales Ley de Dalton de las presiones parciales Teoría cinético-molecular
ESTADOS DE AGREGACIÓN DE LA MATERIA 1 Estados de agregación de la materia Introducción Leyes de los gases Ecuación de estado de los gases ideales Ley de Dalton de las presiones parciales Teoría cinético-molecular
ESTADOS DE AGREGACIÓN DE LA MATERIA Y SUS PROPIEDADES
 ESTADOS DE AGREGACIÓN DE LA MATERIA Y SUS PROPIEDADES ESTADO GASEOSO: F atrac.e/molec. > E cinética
ESTADOS DE AGREGACIÓN DE LA MATERIA Y SUS PROPIEDADES ESTADO GASEOSO: F atrac.e/molec. > E cinética
Isoterma de Adsorción de Langmuir
 Considerar el proceso de adsorción: Isoterma de dsorción de Langmuir donde la velocidad neta de adsorción está dada por la velocidad de adsorción menos la velocidad de desadsorción: r ' k P θ k θ = definiendo
Considerar el proceso de adsorción: Isoterma de dsorción de Langmuir donde la velocidad neta de adsorción está dada por la velocidad de adsorción menos la velocidad de desadsorción: r ' k P θ k θ = definiendo
UNIDAD DIDÁCTICA 2. EL MODELO DE PARTÍCULAS DE LA MATERIA PROPUESTA DIDÁCTICA. LA MATERIA Y EL MODELO DOCUMENTO PARA EL ALUMNO
 UNIDAD DIDÁCTICA 2. EL MODELO DE PARTÍCULAS DE LA MATERIA PROPUESTA DIDÁCTICA. LA MATERIA Y EL MODELO DOCUMENTO PARA EL ALUMNO 1. LOS ESTADOS DE AGREGACIÓN DE LA MATERIA. CAMBIOS DE ESTADO Una misma sustancia
UNIDAD DIDÁCTICA 2. EL MODELO DE PARTÍCULAS DE LA MATERIA PROPUESTA DIDÁCTICA. LA MATERIA Y EL MODELO DOCUMENTO PARA EL ALUMNO 1. LOS ESTADOS DE AGREGACIÓN DE LA MATERIA. CAMBIOS DE ESTADO Una misma sustancia
Universidad Nacional Autónoma de México Facultad de Química
 Universidad Nacional Autónoma de México Facultad de Química Departamento de Fisicoquímica Laboratorio de Equilibrio y Cinética PRESIÓN DE APOR Y ENTALPÍA DE APORIZACIÓN DEL AGUA Profesor: M. en C. Gerardo
Universidad Nacional Autónoma de México Facultad de Química Departamento de Fisicoquímica Laboratorio de Equilibrio y Cinética PRESIÓN DE APOR Y ENTALPÍA DE APORIZACIÓN DEL AGUA Profesor: M. en C. Gerardo
PRACTICA N 1: PROPIEDADES DE LOS FLUIDOS: DENSIDAD Y VISCOSIDAD.
 PRACTICA N 1: PROPIEDADES DE LOS FLUIDOS: DENSIDAD Y VISCOSIDAD. INTRODUCCIÓN Para comprender los conceptos relacionados con la estática y dinámica de los fluidos es necesario familiarizarse con algunas
PRACTICA N 1: PROPIEDADES DE LOS FLUIDOS: DENSIDAD Y VISCOSIDAD. INTRODUCCIÓN Para comprender los conceptos relacionados con la estática y dinámica de los fluidos es necesario familiarizarse con algunas
Estudio de la relación entre separación de fases y porosidad en vidrios de tamaño de poro controlado en el sistema Na 2 O-B 2 O 3 -SiO 2
 Estudio de la relación entre separación de fases y porosidad en vidrios de tamaño de poro controlado en el sistema Na 2 O-B 2 O 3 -SiO 2. Javier Sanguino, M. Alejandra Mazo, Juan Rubio y José Luis Oteo*
Estudio de la relación entre separación de fases y porosidad en vidrios de tamaño de poro controlado en el sistema Na 2 O-B 2 O 3 -SiO 2. Javier Sanguino, M. Alejandra Mazo, Juan Rubio y José Luis Oteo*
ANEXO 5. Cálculo del Peso Específico de los agregados pétreos. Normativa NLT 167/74. Densidad relativa de los áridos en aceite de parafina. ANEXO 5.
 ANEXO 5. Cálculo del Peso Específico de los agregados pétreos. Normativa NLT 167/74. Densidad relativa de los áridos en aceite de parafina. Cálculo del Peso Específico de los agregados pétreos. Para la
ANEXO 5. Cálculo del Peso Específico de los agregados pétreos. Normativa NLT 167/74. Densidad relativa de los áridos en aceite de parafina. Cálculo del Peso Específico de los agregados pétreos. Para la
SERIE DE CINÉTICA FECHA DE ENTREGA: 14 de marzo.
 SERIE DE CINÉTICA FECHA DE ENTREGA: 14 de marzo. 1.- A 140 C el régimen de descomposición de la glucosa 0.056 M en una disolución acuosa que contiene HCl 0.35 N, se ha encontrado que es: t (horas)/ 0.5
SERIE DE CINÉTICA FECHA DE ENTREGA: 14 de marzo. 1.- A 140 C el régimen de descomposición de la glucosa 0.056 M en una disolución acuosa que contiene HCl 0.35 N, se ha encontrado que es: t (horas)/ 0.5
Guía de estudio quinto examen parcial. Ciencias II (énfasis en física)
 Guía de estudio quinto examen parcial Ciencias II (énfasis en física) ALUMNO: GRUPO: FECHA DE ENTREGA: _día del examen I. INSTRUCCIONES: RESUELVE COMPLETAMENTE LA GUÍA. NO OLVIDES APRENDERTE LAS FORMULAS
Guía de estudio quinto examen parcial Ciencias II (énfasis en física) ALUMNO: GRUPO: FECHA DE ENTREGA: _día del examen I. INSTRUCCIONES: RESUELVE COMPLETAMENTE LA GUÍA. NO OLVIDES APRENDERTE LAS FORMULAS
DETERMINACIÓN DE LA DENSIDAD
 REV. 0 Pág. 1/7 DETERMINACIÓN DE LA DENSIDAD CURSO: 2016-17 MANUEL GUTIÉRREZ PALMA GRUPO: 1º LACC REV. 0 Pág. 2/7 ÍNDICE 1. INTRODUCCIÓN TEÓRICA.... 3 2. OBJETIVO.... 3 3. MATERIALES Y METODOS... 4 3.1.
REV. 0 Pág. 1/7 DETERMINACIÓN DE LA DENSIDAD CURSO: 2016-17 MANUEL GUTIÉRREZ PALMA GRUPO: 1º LACC REV. 0 Pág. 2/7 ÍNDICE 1. INTRODUCCIÓN TEÓRICA.... 3 2. OBJETIVO.... 3 3. MATERIALES Y METODOS... 4 3.1.
EL ESTADO GASEOSO. Algunas características importantes de los gases son: la expansibilidad, capacidad de difusión, baja densidad y altas presiones.
 EL ESTADO GASEOSO El aire está compuesto, principalmente, de los elementos oxígeno y nitrógeno. Otros elementos no metálicos existen en la naturaleza como gases en condiciones ordinarias como hidrógeno
EL ESTADO GASEOSO El aire está compuesto, principalmente, de los elementos oxígeno y nitrógeno. Otros elementos no metálicos existen en la naturaleza como gases en condiciones ordinarias como hidrógeno
Henry Núñez Coavas. Ondas y ópticas. Henry Núñez Coavas.
 Ondas y ópticas Henry Núñez Coavas hnunez3@cuc.edu.co Escalas de temperatura Escala Celsius ( ) Escala Fahrenheit ( ) Escala Kelvin (K) Centígrada Absoluta T K = T C +273 T F = 9 5 T C+32 Dilatación de
Ondas y ópticas Henry Núñez Coavas hnunez3@cuc.edu.co Escalas de temperatura Escala Celsius ( ) Escala Fahrenheit ( ) Escala Kelvin (K) Centígrada Absoluta T K = T C +273 T F = 9 5 T C+32 Dilatación de
TEMA 1 Cambios de fase
 TEMA 1 Cambios de fase 1.1. Introducción CLIMATIZACIÓN: crear y mantener un ambiente térmico en un espacio para desarrollar eficientemente una determinada actividad CONFORT O BIENESTAR: - Térmico - Lumínico
TEMA 1 Cambios de fase 1.1. Introducción CLIMATIZACIÓN: crear y mantener un ambiente térmico en un espacio para desarrollar eficientemente una determinada actividad CONFORT O BIENESTAR: - Térmico - Lumínico
GASES - PREGUNTAS DE TEST (2016) En la última página se ofrecen las soluciones
 GASES - PREGUNTAS DE TEST (2016) En la última página se ofrecen las soluciones Grupo A - CONCEPTOS GENERALES: CONCEPTO DE GAS Y VAPOR Grupo B - LEYES GENERALES DE LOS GASES IDEALES: Grupo C- LEY DE GRAHAM
GASES - PREGUNTAS DE TEST (2016) En la última página se ofrecen las soluciones Grupo A - CONCEPTOS GENERALES: CONCEPTO DE GAS Y VAPOR Grupo B - LEYES GENERALES DE LOS GASES IDEALES: Grupo C- LEY DE GRAHAM
ESTÁTICA DE FLUIDOS ÍNDICE
 ESTÁTICA DE FLUIDOS ÍNDICE 1. Concepto de fluido 2. Densidad 3. Presión en un fluido estático 4. Medida de la presión 5. Fuerza sobre una presa 6. Principio de Arquímedes BIBLIOGRAFÍA: Cap. 13 del Tipler
ESTÁTICA DE FLUIDOS ÍNDICE 1. Concepto de fluido 2. Densidad 3. Presión en un fluido estático 4. Medida de la presión 5. Fuerza sobre una presa 6. Principio de Arquímedes BIBLIOGRAFÍA: Cap. 13 del Tipler
Problemas de Química General Curso de C. Químicas Grupo 911 Hoja 5
 Problemas de Química General Curso 2014-2015 1 de C. Químicas Grupo 911 Hoja 5 1. A partir de los datos sobre las reacciones que se dan seguidamente, determinar la entalpía de reacción estándar para el
Problemas de Química General Curso 2014-2015 1 de C. Químicas Grupo 911 Hoja 5 1. A partir de los datos sobre las reacciones que se dan seguidamente, determinar la entalpía de reacción estándar para el
LEY DE BOYLE. La presión (p) de un gas ideal varía inversamente a su volumen (V) si la temperatura (T) se mantiene constante.
 Gas un GAS IDEAL tiene las propiedades siguientes: está formado por partículas llamadas moléculas. Estas se mueven irregularmente y obedecen las leyes de Newton del movimiento. El número total de moléculas
Gas un GAS IDEAL tiene las propiedades siguientes: está formado por partículas llamadas moléculas. Estas se mueven irregularmente y obedecen las leyes de Newton del movimiento. El número total de moléculas
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
Fluidos. Cualquier sustancia que tiene la capacidad de fluir es un fluido. Liquido Gas Plasma
 Fluidos Cualquier sustancia que tiene la capacidad de fluir es un fluido. Liquido Gas Plasma Entonces muchos de la teoría se puede aplicar tanto a gases como líquidos. Estados de la materia Sólido Líquido
Fluidos Cualquier sustancia que tiene la capacidad de fluir es un fluido. Liquido Gas Plasma Entonces muchos de la teoría se puede aplicar tanto a gases como líquidos. Estados de la materia Sólido Líquido
física física conceptual aplicada MétodoIDEA Gases Entre la y la 4º de eso Félix A. Gutiérrez Múzquiz
 Entre la y la física física conceptual aplicada MétodoIDEA Gases 4º de eso Félix A. Gutiérrez Múzquiz Contenidos 1. PRESIÓ ATMOSFÉRICA 2. FLOTACIÓ...... 3 5 2 1. PRESIÓN ATMOSFÉRICA 1. El mmhg, unidad
Entre la y la física física conceptual aplicada MétodoIDEA Gases 4º de eso Félix A. Gutiérrez Múzquiz Contenidos 1. PRESIÓ ATMOSFÉRICA 2. FLOTACIÓ...... 3 5 2 1. PRESIÓN ATMOSFÉRICA 1. El mmhg, unidad
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
La estática de fluidos estudia el equilibrio de fluidos. obtiene la ecuación fundamental de la hidrostática.
 FLUIDOS ESTÁTICA DE FLUIDOS La estática de fluidos estudia el equilibrio de fluidos. A partir de los conceptos de densidad y de presión se obtiene la ecuación fundamental de la hidrostática. Principio
FLUIDOS ESTÁTICA DE FLUIDOS La estática de fluidos estudia el equilibrio de fluidos. A partir de los conceptos de densidad y de presión se obtiene la ecuación fundamental de la hidrostática. Principio
P T = P A + P B + P C.
 6. Ley de Dalton: La ley de Dalton establece que en una mezcla de gases cada gas ejerce su presión como si los restantes gases no estuvieran presentes. La presión específica de un determinado gas en una
6. Ley de Dalton: La ley de Dalton establece que en una mezcla de gases cada gas ejerce su presión como si los restantes gases no estuvieran presentes. La presión específica de un determinado gas en una
PROBLEMARIO: Tercer Parcial (B) Prof. Juan Pablo Herrera
 Gases Universidad Nacional Experimental del Táchira Departamento de Química San Cristóbal, Estado Táchira-Venezuela PROBLEMARIO: Tercer Parcial (B) Prof. Juan Pablo Herrera 1. Calcule la altura en metros
Gases Universidad Nacional Experimental del Táchira Departamento de Química San Cristóbal, Estado Táchira-Venezuela PROBLEMARIO: Tercer Parcial (B) Prof. Juan Pablo Herrera 1. Calcule la altura en metros
Tema 12. Gases. Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA
 Tema 12 Gases Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA 2.1 2.1 Variables que determinan el estado de agregación Tipo de material o materia Temperatura Presión 2.2 Elementos que
Tema 12 Gases Química General e Inorgánica A ESTADOS DE AGREGACION DE LA MATERIA 2.1 2.1 Variables que determinan el estado de agregación Tipo de material o materia Temperatura Presión 2.2 Elementos que
Mecánica de Fluidos y Máquinas Hidráulicas
 Mecánica de Fluidos y Máquinas Hidráulicas Tema 01. Introducción a la Mecánica de Fluidos Severiano F. Pérez Remesal Carlos Renedo Estébanez DPTO. DE INGENIERÍA ELÉCTRICA Y ENERGÉTICA Este tema se publica
Mecánica de Fluidos y Máquinas Hidráulicas Tema 01. Introducción a la Mecánica de Fluidos Severiano F. Pérez Remesal Carlos Renedo Estébanez DPTO. DE INGENIERÍA ELÉCTRICA Y ENERGÉTICA Este tema se publica
UNIDAD Nº 2: GASES IDEALES Y CALORIMETRIA
 UNIDAD Nº 2: GASES IDEALES Y CALORIMETRIA UNIVERSIDAD CATÓLICA DE SALTA FAC. DE CS AGRARIAS Y VETERINARIAS AÑO 2008 Farm. Pablo F. Corregidor 1 TEMPERATURA 2 TEMPERATURA Termoreceptores: Externos (piel)
UNIDAD Nº 2: GASES IDEALES Y CALORIMETRIA UNIVERSIDAD CATÓLICA DE SALTA FAC. DE CS AGRARIAS Y VETERINARIAS AÑO 2008 Farm. Pablo F. Corregidor 1 TEMPERATURA 2 TEMPERATURA Termoreceptores: Externos (piel)
mecánica estadística Equilibrio entre especies químicas Capítulo 4
 mecánica estadística Equilibrio entre especies químicas Capítulo 4 Equilibrio entre fases y especies químicas. Una de las aplicaciones más importantes de la mecánica estadística es la predicción del comportamiento
mecánica estadística Equilibrio entre especies químicas Capítulo 4 Equilibrio entre fases y especies químicas. Una de las aplicaciones más importantes de la mecánica estadística es la predicción del comportamiento
COMPLEJO EDUCATIVO SAN FRANCISCO PRIMER PERIODO. Nombre del estudiante: No. CALORIMETRIA Y LEY DE LOS GASES
 COMPLEJO EDUCATIVO SAN FRANCISCO PRIMER PERIODO CIENCIAS NATURALES Segundo año Sección: Nombre del estudiante: No. CALORIMETRIA Y LEY DE LOS GASES 1. Una herradura de hierro de 1,5 Kg inicialmente a 600
COMPLEJO EDUCATIVO SAN FRANCISCO PRIMER PERIODO CIENCIAS NATURALES Segundo año Sección: Nombre del estudiante: No. CALORIMETRIA Y LEY DE LOS GASES 1. Una herradura de hierro de 1,5 Kg inicialmente a 600
Próxima clase lección. Miércoles 20 de Julio
 Próxima clase lección. Miércoles 20 de Julio Qué es la densidad? Ya sabes que, a veces, dos objetos del mismo tamaño pueden tener pesos muy diferentes Qué es la densidad? El trozo de madera y de esponja
Próxima clase lección. Miércoles 20 de Julio Qué es la densidad? Ya sabes que, a veces, dos objetos del mismo tamaño pueden tener pesos muy diferentes Qué es la densidad? El trozo de madera y de esponja
QUÍMICA GENERAL GASES IDEALES
 QUÍMICA GENERAL GASES IDEALES INTRODUCCIÓN TEORÍA CINÉTICA DE LOS GASES LEYES DE LOS GASES IDEALES TEORÍA CINÉTICA DE LOS GASES DEFINICIÓN Entre 1850 y 1880 Clausius y Boltzmann desarrollaron esta teoría,
QUÍMICA GENERAL GASES IDEALES INTRODUCCIÓN TEORÍA CINÉTICA DE LOS GASES LEYES DE LOS GASES IDEALES TEORÍA CINÉTICA DE LOS GASES DEFINICIÓN Entre 1850 y 1880 Clausius y Boltzmann desarrollaron esta teoría,
FÍSICA Y QUÍMICA. 3º ESO LA MATERIA Y SUS ESTADOS CAMBIOS DE ESTADO Y PROPIEDADES DE LOS SISTEMAS
 FÍSICA Y QUÍMICA. 3º ESO LA MATERIA Y SUS ESTADOS CAMBIOS DE ESTADO Y PROPIEDADES DE LOS SISTEMAS 1. En qué proceso un líquido se convierte en gas? a) Fusión. b) Vaporización. c) Condensación. d) Sublimación.
FÍSICA Y QUÍMICA. 3º ESO LA MATERIA Y SUS ESTADOS CAMBIOS DE ESTADO Y PROPIEDADES DE LOS SISTEMAS 1. En qué proceso un líquido se convierte en gas? a) Fusión. b) Vaporización. c) Condensación. d) Sublimación.
EL ESTADO GASEOSO P R E S I Ó N
 EL ESTADO GASEOSO El aire está compuesto, principalmente, de los elementos oxígeno y nitrógeno. Otros elementos no metálicos existen en la naturaleza como gases en condiciones ordinarias como hidrógeno
EL ESTADO GASEOSO El aire está compuesto, principalmente, de los elementos oxígeno y nitrógeno. Otros elementos no metálicos existen en la naturaleza como gases en condiciones ordinarias como hidrógeno
FÍSICA Y QUÍMICA. 3º ESO LA MATERIA Y SUS ESTADOS FICHA 1: CAMBIOS DE ESTADO Y PROPIEDADES DE LOS SISTEMAS
 FICHA 1: CAMBIOS DE ESTADO Y PROPIEDADES DE LOS SISTEMAS 1. En qué proceso un líquido se convierte en gas? a) Fusión. b) Vaporización. c) Condensación. d) Sublimación. En qué proceso un líquido se convierte
FICHA 1: CAMBIOS DE ESTADO Y PROPIEDADES DE LOS SISTEMAS 1. En qué proceso un líquido se convierte en gas? a) Fusión. b) Vaporización. c) Condensación. d) Sublimación. En qué proceso un líquido se convierte
EVALUACIÓN DE LABORATORIO DE QUIMICA GENERAL I Resolución y Rúbrica
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICAS DEPARTAMENTO DE CIENCIAS QUÍMICAS Y AMBIENTALES EVALUACIÓN DE LABORATORIO DE QUIMICA GENERAL I Resolución y 1 (10 puntos).
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICAS DEPARTAMENTO DE CIENCIAS QUÍMICAS Y AMBIENTALES EVALUACIÓN DE LABORATORIO DE QUIMICA GENERAL I Resolución y 1 (10 puntos).
LA TERMODINÁMICA ESTUDIA LA ENERGÍA Y SUS TRANSFORMACIONES
 TERMODINÁMICA LA TERMODINÁMICA ESTUDIA LA ENERGÍA Y SUS TRANSFORMACIONES La energía es la capacidad de realizar trabajo o transferir calor ENERGÍA CINÉTICA Asociada al movimiento de los cuerpos (objetos
TERMODINÁMICA LA TERMODINÁMICA ESTUDIA LA ENERGÍA Y SUS TRANSFORMACIONES La energía es la capacidad de realizar trabajo o transferir calor ENERGÍA CINÉTICA Asociada al movimiento de los cuerpos (objetos
Elementos de Fìsico-Química. UNEXPO Barquisimeto Octubre 2008.
 Capítulo 1 LIQUIDOS COMPARACIÓN ENTRE LOS ESTADOS GASEOSO, SÓLIDO Y LÍQUIDO Tabla 1 Propiedades de gases, líquidos y sólidos. Propiedad Gases Líquidos Sólidos Forma Adoptan la forma del Adoptan la forma
Capítulo 1 LIQUIDOS COMPARACIÓN ENTRE LOS ESTADOS GASEOSO, SÓLIDO Y LÍQUIDO Tabla 1 Propiedades de gases, líquidos y sólidos. Propiedad Gases Líquidos Sólidos Forma Adoptan la forma del Adoptan la forma
Universidad Politécnica de Valencia Instituto de Tecnología Química (UPV-CSIC)
 Universidad Politécnica de Valencia Instituto de Tecnología Química (UPV-CSIC) ESTUDIO DE PROCESOS DE SEPARACIÓN DE CO 2 y CH 4 MEDIANTE EL EMPLEO DE ZEOLITAS PROYECTO FINAL DE MÁSTER MÁSTER QUÍMICA SOSTENIBLE
Universidad Politécnica de Valencia Instituto de Tecnología Química (UPV-CSIC) ESTUDIO DE PROCESOS DE SEPARACIÓN DE CO 2 y CH 4 MEDIANTE EL EMPLEO DE ZEOLITAS PROYECTO FINAL DE MÁSTER MÁSTER QUÍMICA SOSTENIBLE
EL ESTADO GASEOSO. Los gases son fluidos y están compuestos de partículas en movimientos constante y al azar.
 GASES EL ESTADO GASEOSO Los gases son fluidos y están compuestos de partículas en movimientos constante y al azar. Los gases se expanden hasta llenar el recipiente que los contiene y también, se pueden
GASES EL ESTADO GASEOSO Los gases son fluidos y están compuestos de partículas en movimientos constante y al azar. Los gases se expanden hasta llenar el recipiente que los contiene y también, se pueden
Mecánica de fluidos. Fis 018- Ref. Capitulo 10 Giancoli Vol II. 6ta ed. 23 de octubre de 2016
 Mecánica de fluidos Fis 018- Ref. Capitulo 10 Giancoli Vol II. 6ta ed. 23 de octubre de 2016 ESTATICA DE FLUIDOS 1. Estados de la materia 2. Propiedades de los fluidos 3. Volumen, densidad y peso específico,
Mecánica de fluidos Fis 018- Ref. Capitulo 10 Giancoli Vol II. 6ta ed. 23 de octubre de 2016 ESTATICA DE FLUIDOS 1. Estados de la materia 2. Propiedades de los fluidos 3. Volumen, densidad y peso específico,
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Listas de comentarios, ejercicios y soluciones (para quienes tienen el Van Wylen)
 Comentarios Lista 0 - Repaso de Conceptos Básicos 1 2.8 Volumen específico. 2 2.11 Barómetro. 3 2.12 Manómetro. 4 2.14 Pistón con resorte; Considere la figura sin los topes. 5 2.27 Presión y fuerza. 6
Comentarios Lista 0 - Repaso de Conceptos Básicos 1 2.8 Volumen específico. 2 2.11 Barómetro. 3 2.12 Manómetro. 4 2.14 Pistón con resorte; Considere la figura sin los topes. 5 2.27 Presión y fuerza. 6
EVALUACIÓN FINAL DE QUÍMICA
 EVALUACIÓN FINAL DE QUÍMICA ESTADO LÍQUIDO En los líquidos las moléculas se mueven lentamente con respecto a los gases, las fuerzas de atracción moleculares son capaces de mantenerlas juntas dentro de
EVALUACIÓN FINAL DE QUÍMICA ESTADO LÍQUIDO En los líquidos las moléculas se mueven lentamente con respecto a los gases, las fuerzas de atracción moleculares son capaces de mantenerlas juntas dentro de
Meteorología y Climatología. Ciencias Ambientales
 Meteorología y Climatología Ciencias Ambientales TEMA 3. AIRE SECO. AIRE HÚMEDO. Aire seco. Aire Húmedo. Agua en la atmósfera. Cambios de fase. Diagramas Termodinámicos. Procesos Isobáricos Expansión adibática
Meteorología y Climatología Ciencias Ambientales TEMA 3. AIRE SECO. AIRE HÚMEDO. Aire seco. Aire Húmedo. Agua en la atmósfera. Cambios de fase. Diagramas Termodinámicos. Procesos Isobáricos Expansión adibática
