Solución: Son sustancias moleculares la a) y la e), porque los átomos que las forman son de elementos no metálicos.
|
|
|
- María Luz Padilla Domínguez
- hace 7 años
- Vistas:
Transcripción
1 1 El azufre es un elemento que está en el período 3 y el grupo 6 del sistema periódico. Escribe su distribución electrónica en capas. Si capta 2 electrones, qué configuración electrónica adquiere? Será estable? La configuración electrónica en capas será: 2, 8, 6, ya que según su posición en el sistema periódico tendrá 3 capas y 6 electrones de valencia. Al captar 2 electrones, la última capa tendrá 8 electrones, y la configuración electrónica será la del gas noble del mismo período, Argón. Será muy estable porque dicha configuración es la de mayor estabilidad. 2 Cuál es la causa del enlace iónico? Qué elementos químicos se unen para formar compuestos iónicos? El enlace iónico se debe a la atracción electrostática entre iones positivos y negativos. Los elementos químicos que se unen con este enlace son los metales con los no metales. 3 De los siguientes compuestos químicos, cuáles son sustancias moleculares? por qué? a) CO2, b) Na2O, c) CoO, d) Ag, e ) NH3 Son sustancias moleculares la a) y la e), porque los átomos que las forman son de elementos no metálicos. 4 Al reaccionar unos átomos con otros, qué número de electrones tienden a tener en la última capa? Por qué? Tienden a tener 8 electrones en la última capa, porque dicha estructura electrónica es la de mayor estabilidad. 5 Cuándo se producen enlaces covalentes entre dos átomos? Qué elementos forman compuestos covalentes? Se produce un enlace covalente entre dos átomos, cuando comparten parejas de electrones. Los compuestos covalentes los forman elementos no metálicos. 6 Representa la configuración electrónica de los iones positivos que resultan al ceder electrones en los metales siguientes: aluminio (Z = 13), calcio (Z = 20), sodio (Z = 11), y litio (Z = 3). 1
2 7 En qué consiste la corrosión? Hay metales que no la sufren? Cuáles? 2
3 La corrosión es la reacción de los metales con el oxígeno del aire, y se produce cuando estos están expuestos al aire libre. Se forma una fina capa de óxido metálico que altera el aspecto del metal y sus propiedades. Los llamados metales nobles, como el oro, la plata y el platino, no sufren la corrosión. 8 Cuál es el significado de esta representación de un metal? Representa los iones metálicos de un red metálica y la nube electrónica formada por los electrones libres que mantienen a los iones positivos en posiciones fijas. 9 De las siguientes sustancias químicas, cuáles tienen enlace metálico? a) CO2, b) Na2O, c) Co, d) NH3, e) Ag Cobalto y plata, ya que son metales, y por tanto tienden a ceder electrones que forman un nube electrónica que mantiene en posiciones fijas a los iones positivos que se forman. 10 Explica el dibujo. De qué tipo de enlace se trata? Qué compuesto se formará? Se forma un compuesto covalente debido a la unión de un no metal con un no metal. El O necesita dos electrones para completar 8e en la última capa. El H necesita 1electrón para completar su capa. comparten O electrones H H Podríamos representarlo así: 11 Qué deberían hacer los átomos de flúor para adquirir la configuración electrónica del gas noble neón? Y los átomos de sodio? Escribir las distribuciones de sus electrones en capas. 3
4 Los átomos de flúor, que tiene 7 electrones de valencia, deberían captar un electrón, para así tener 8 y tener la configuración del neón. Por su parte los átomos de sodio deberían ceder 1 electrón para tener la misma configuración. Configuraciones electrónicas: del flúor, (2,7), del neón, (2,8), y del sodio, (2,8,1). 12 Definir enlace químico. Es la unión entre dos o más átomos para formar una agrupación estable. 13 a) Representa la distribución de los electrones en capas del flúor y del aluminio. b) Cuántos electrones de valencia tienen cada uno? c) Qué iones tenderán a formarse en cada caso? d) Explica mediante un dibujo el enlace que puede haber entre átomos de flúor y de aluminio. a) b) El aluminio 3 y el flúor 1. c) El aluminio tiende a ceder 3 electrones formando el ion Al 3+ y el flúor capta 1 electrón formando el ion F -. d) 14 Explica la formación del compuesto iónico cloruro de sodio, NaCl. Para ello, tener en cuenta los datos siguientes: Número atómico del sodio, Z =11, y del cloro, Z = 17. 4
5 Un átomo de sodio adquiere la configuración electrónica del gas noble neón si pierde un electrón y pasa a ion Na + ; si el cloro toma ese electrón se convierte en ion Cl -, con la misma configuración que el gas noble argón. El compuesto iónico se forma por la atracción electrostática entre los iones Na + y Cl - procedentes de los átomos de sodio y cloro que han intercambiado electrones. 15 Escribe el diagrama de Lewis de las moléculas de los compuestos H2O y NH3. 16 Cuándo se produce un enlace metálico? Entre que elementos químicos se da? El enlace metálico se produce cuando los iones positivos de un metal comparten una nube de electrones. Se da en todos los metales. 17 De los siguientes compuestos químicos, cuáles son iónicos? por qué? a) KI, b) Zn, c) Ag2 S, d) CO2 ; e) NH3 5
6 Son compuestos iónicos el a) y el c), porque los átomos que los componen son metales con no metales. 18 Por qué son buenos conductores del calor y de la electricidad los compuestos metálicos? Porque tienen electrones libres que han sido cedidos por los átomos del metal y forman la nube electrónica que se mueve, transportando el calor. Si se somete a una diferencia de potencial, los electrones de la nube electrónica tendrán un desplazamiento neto que constituye la corriente eléctrica. 19 Qué son las moléculas? Según el número de átomos, cómo se denominan? Las moléculas son agrupaciones de átomos formadas por un número fijo de los mismos, en general pequeño, pero que puede llegar a ser muy grande. Según el número de átomos que la componen se llaman: diatómicas (2 átomos), triatómicas (3 átomos) 20 Según el tipo de átomos de los que están compuestas, las moléculas pueden ser de dos tipos. De cuáles se trata? Poner ejemplos. Si los átomos que las forman son del mismo elemento, se llaman moléculas de elementos. Por ejemplo: O2, O3, Cl2 Si los átomos que las forman son de distintos elementos, se llaman moléculas de compuestos. Por ejemplo: H2O, SO2, CO 21 A qué pertenecen los dibujos siguientes, a moléculas de elementos o de compuestos? Representan a moléculas diatómicas o triatómicas? 6
7 Nitrógeno, oxígeno, ozono e hidrógeno, representan a moléculas de elementos, porque están formados cada uno de la misma clase de átomos. El amoniaco representa a moléculas de compuesto, porque está formados por átomos de distintos elementos químicos. Nitrógeno, oxígeno e hidrógeno son diatómicas, porque están compuestas de dos átomos. Ozono y amoniaco son triatómicas, porque están formadas por tres átomos. 22 Un compuesto químico tiene punto de fusión de 660ºC, no conduce la electricidad en estado sólido, pero si la conduce disuelto en agua y es difícil de rayar. Qué tipo de compuesto es? Es un compuesto iónico. 23 Qué tienen en común los siguientes aniones, N 3-, O 2-, F -, y los átomos de neón? Tienen en común la misma distribución de electrones en capas. Los iones, al captar 3, 2 y 1 electrones respectivamente, tienen 8 electrones en la última capa, lo mismo que el neón. Las configuraciones de aniones y gas noble son las mismas: 2,8. 24 En qué se parecen y en que se diferencian el átomo de Argón y el ión Cl -.? Datos. Argón; Z = 18, grupo de gases nobles, período 3. Cloro, Z = 17, grupo VIIA, período 3. Se parecen en que tienen la misma configuración electrónica y se diferencian en el número de protones que hay en el núcleo. Argón: 18 protones y 18 electrones. Configuración electrónica: 2,8,8. El argón es un átomo neutro. Cl - : 17 protones y 18 electrones. Configuración : 2,8,8. El Cl - es un ion. 25 Explica el dibujo. De qué tipo enlace se trata? Qué compuesto se formará? 7
8 Los dos átomos de sodio ceden un electrón cada uno al átomo de azufre, formándose dos iones Na + y uno de S 2- Como tienen distinta carga, se atraen electrostáticamente formando un compuesto iónico que se formula como Na2S y se nombra sulfuro de disodio. 26 Escribe el diagrama de Lewis de las moléculas de los elementos Cl2, O2, N2, sabiendo que comparten uno, dos y tres pares de electrones respectivamente. 27 Explica el dibujo. De qué tipo enlace se trata? Qué compuesto se formará? Los dos átomos de bromo captan un electrón cada uno del átomo de calcio, formándose dos iones Br - y uno de Ca 2+. Como tienen distinta carga se atraen electrostáticamente, formando un compuesto iónico que se formula como CaBr2 y se nombra dibromuro de calcio. 28 Un compuesto químico tiene las siguientes propiedades: a) No conduce el calor ni la electricidad. b) Su estado de agregación a temperatura ambiente es sólido. c) La temperatura de fusión es muy alta. d) Es insoluble en agua. De qué tipo de compuesto se trata? Según las propiedades que tiene será un sólido covalente. 29 Un compuesto químico tiene las siguientes propiedades: a) Es sólido a temperatura ambiente. b) Es muy duro. c) Conduce la electricidad en estado sólido. d) Tiene alto el punto de fusión y ebullición. Es un compuesto iónico o metálico? En qué te basas? 8
9 Es un compuesto metálico, porque las propiedades a), b) y d) las tienen los dos tipos de compuestos, pero la c) sólo la tienen los compuestos metálicos. 30 De las siguientes propiedades, cuáles corresponden a los sustancias moleculares? a) Son pocos solubles en agua. b) Son dúctiles y maleables. c) Conducen la electricidad, fundidos o disueltos en agua. d) Presentan temperaturas de fusión muy bajas. e) Son sólidos a temperatura ambiente. f) Buenos conductores del calor y de la electricidad. Las propiedades de los compuestos covalentes, llamados sustancias moleculares, son a) y d). 31 En el enlace metálico, a qué llamamos red metálica? y a qué llamamos nube electrónica? La red metálica es la estructura ordenada formada por los iones positivos originados al ceder electrones los átomos del metal. La nube electrónica está formada por los electrones libres que se mueven entre los iones positivos que forman la red metálica y que los mantienen en posiciones fijas. 32 Qué son las aleaciones? Para que sirven? Las aleaciones son mezclas de varios elementos, de los cuales uno al menos es un metal. En la red metálica de la aleación se intercalan los iones metálicos y los átomos de los elementos que la componen. Sirven para mejorar algunas de las propiedades de los metales. 33 Qué iones positivos componen la red metálica de lo siguientes metales: Aluminio (Z = 13), magnesio (Z = 12), cinc (Z = 30), potasio (Z = 19)? Aluminio: por su configuración electrónica, tiene 3 electrones de valencia, tiende a ceder 3 electrones, y el ion positivo será: Al 3+. Magnesio: tiene 2 electrones de valencia, tiende a ceder 2 electrones, y el ion positivo será: Mg 2+. Cinc: tiene 2 electrones de valencia, tiende a ceder 2 electrones, y el ion positivo será: Zn 2+. Potasio: tiene 1 electrón de valencia, tiende a ceder 1 electrón, y el ion positivo será: K Qué tipos de compuestos químicos covalentes existen? En qué se diferencian? Existen dos tipos de compuestos covalentes: las sustancias moleculares y los sólidos covalentes. En las sustancias moleculares se forman moléculas que son agrupaciones de un número concreto de átomos unidos entre sí por enlaces covalentes, mientras que en los sólidos covalentes no se forman moléculas y los átomos se unen unos con otros formando redes cristalinas tridimensionales. 9
10 35 Para que se forme un compuesto iónico, qué es necesario que intercambien los átomos que los forman? Cómo lo hacen? Es necesario que intercambien electrones. Los átomos de un metal ceden electrones para formar iones positivos, y los átomos de un no metal los toman para formar iones negativos. 36 Escribe el diagrama de Lewis de las moléculas de metano y dióxido de carbono. 37 Por qué se considera que los átomos con 2 u 8 electrones de valencia son más estables? Porque dichos electrones de valencia pertenecen al grupo de los gases nobles, que son inertes, es decir, no reaccionan normalmente con otros elementos. Por lo tanto, esta distribución de electrones en la última capa da una mayor estabilidad al átomo. 38 De los siguientes compuestos iónicos, cuáles están formados por iones poliatómicos? a) KI, b) CuSO4 c) NaNO3 d) CaCl2 Tienen iones poliatómicos los compuestos b) y c). El b), es SO4 2-. El c), es NO Qué propiedades presentan las sustancias moleculares y los sólidos covalentes? 10
11 Sustancias moleculares: a) A temperatura ambiente son gases, líquidos o sólidos de bajo punto de fusión. b) Temperatura de fusión y de ebullición bajas. c) No conducen el calor ni la electricidad. d) Son pocos solubles en agua. Sólidos covalentes: a) Sólidos a temperatura ambiente. b) Temperatura de fusión y de ebullición muy altas. c) Son muy duros. d) No conducen ni el calor ni la electricidad. e) Insolubles en agua. 40 Escribir la distribución de los electrones en capas de los átomos cuyo número atómico es el siguiente: Z = 2, Z = 10, Z = 18, Z = 36, sabiendo que están en el período 1, 2, 3 y 4 respectivamente. Qué tienen en común? Cómo se llaman? Cuál es su propiedad principal? Z = 2 (2); Z = 10 (2,8); Z = 18 (2,8,8); Z = 36 (2,8,18,8). Todos tienen 8 electrones de valencia. Se llaman gases nobles: Helio, Neón, Argón y Kriptón). Su propiedad principal es que son inertes, y por tanto muy estables. 41 Qué tienen en común los siguientes cationes, Na +, Mg 2+, Al 3+, y los átomos de neón? Tienen en común la misma distribución de electrones en capas. Los iones, al ceder 1, 2 y 3 electrones respectivamente, tienen 8 electrones en la última capa, lo mismo que el neón. Las configuraciones de cationes y gas noble son las mismas: 2,8. 42 Para qué sirve la regla del octeto? La regla del octeto es una regla práctica que sirve para predecir la posibilidad y el tipo de enlace entre átomos. 43 Qué diferencias existen entre las agrupaciones de átomos: moléculas y cristales? Las moléculas están formadas por un número fijo de átomos, y suelen ser pequeñas. Los cristales están formados por un gran número de átomos, que depende del tamaño del cristal y de cómo se ordenen los átomos en él. 11
12 44 De las siguientes propiedades, cuáles corresponden a los compuestos iónicos? e) Son poco solubles en agua. f) Son dúctiles y maleables. g) Conducen la electricidad, fundidos o disueltos en agua. h) Presentan temperaturas de fusión muy bajas. i) Son sólidos a temperatura ambiente. j) Son buenos conductores del calor y de la electricidad. Son propiedades de los compuestos iónicos la c) y la f). 45 De las siguientes propiedades, cuáles corresponden a compuesto metálicos? a) Son insolubles en agua. b) Son dúctiles y maleables. c) Conducen la electricidad, disueltos en agua. d) Presentan temperaturas de fusión muy bajas. e) Son sólidos a temperatura ambiente. f) Buenos conductores del calor y de la electricidad. Son propiedades de los compuestos metálicos, la b) y f). La e) es válida sólo si exceptuamos el mercurio. 46 Qué propiedades presentan los compuestos metálicos? e) Sólidos a temperatura ambiente, excepto el mercurio. f) Temperatura de fusión y de ebullición altos. g) Conductores del calor y de la electricidad. h) Dúctiles y maleables. 47 Los compuestos iónicos forman redes cristalinas, y los compuestos metálicos redes tridimensionales. Cuál es la diferencia entre ambos tipos de redes? En el caso de las redes iónicas, hay dos tipos de iones, positivos y negativos. En las redes metálicas, sólo hay iones positivos situados en posiciones fijas. 48 En qué se parecen y en que se diferencian el átomo de Argón y el ión Ca 2+.? Datos. Argón; Z = 18, grupo de gases nobles, período 3. Calcio, Z = 20, grupo IIA, período 4. 12
13 Se parecen en que tienen la misma configuración electrónica y se diferencian en el número de protones que hay en el núcleo. Argón: 18 protones y 18 electrones. Configuración electrónica: 2,8,8. El argón es un átomo neutro. Ca 2+ : 20 protones y 18 electrones. Configuración : 2,8,8. El Ca 2+ es un ion. 49 Qué propiedades presentan los compuestos iónicos? a) Son sólidos a temperatura ambiente. b) Son duros. c) En estado sólido no conducen la electricidad. d) Disueltos en agua o fundidos, conducen la electricidad. 50 Explica la unión covalente para formar la molécula amoniaco a partir de la configuración electrónica de sus átomos. Haz un esquema. Los átomos de nitrógeno tiene la configuración electrónica siguiente: (2,5). Les faltan 3 electrones en la última capa para tener la configuración de gas noble. El hidrógeno tiene 1 electrón y le falta otro para tener la configuración del gas noble helio. La unión covalente para formar el amoniaco se realiza al compartir el átomo de nitrógeno tres electrones, uno con cada uno de los tres átomos de hidrógeno, adquiriendo así los cuatro átomos (uno de nitrógeno y tres de hidrógeno) la configuración de gas noble. Par de electrones compartidos Par de electrones compartidos Par de electrones compartidos 51 Completar los siguientes párrafos. El cloro, que es un.., se une con el silicio, que es un., para formar el compuesto químico, que es un compuesto A los átomos de cloro les falta para tener 8 electrones en la última capa. A su vez, a los átomos de silicio les faltan. para tener 8 electrones en la última capa. En las uniones entre átomos de cloro y de silicio, átomos de cloro comparten cada uno con un átomo de. formando. pares de. y como consecuencia, la molécula. que se formula. 13
14 El cloro, que es un no metal, se une con el silicio, que es un no metal, para formar un compuesto químico covalente. A los átomos de cloro les falta 1 electrón para tener 8 electrones en la última capa. A su vez, a los átomos de silicio les faltan cuatro electrones para tener 8 electrones en la última capa. En las uniones entre átomos de cloro y de silicio, 4 átomos de cloro comparten 1 electrón cada uno con un átomo de silicio, formando 4 pares de enlace y como consecuencia, la molécula de tetracloruro de silicio que se formula como SiCl4. 52 Explica la unión covalente para formar la molécula de flúor a partir de la configuración electrónica de sus átomos. Haz un esquema. La configuración electrónica de los átomos de flúor es (2,7). Es decir, le falta a cada átomo un electrón para tener la configuración de gas noble. La unión covalente entre dos átomos de flúor consiste en compartir dos electrones de la última capa para que así los dos átomos adquieran la configuración electrónica de gas noble: 53 Cuántos electrones se intercambian entre los átomos que forman los compuestos iónicos siguientes: CaF2, RbCl, FeCl2, Na2S? CaF2 : tiene un átomo de Ca, que para formar el ion Ca 2+ cede 2 electrones. Cada uno de ellos es captado por un átomo de flúor, por lo que se forman dos iones F -. Por lo tanto, se intercambian 2 electrones. RbCl : tiene un átomo de rubidio que cede un electrón para formar el ion Rb +. Éste es captado por un átomo de cloro para formar el ion Cl -. Por lo tanto, se intercambia un electrón. FeCl2 : el átomo de Fe cede 2 electrones para formar el ion Fe 2+, cada uno de los cuales es captado por un átomo de cloro. Se han intercambiado dos electrones. Na2S. : tiene dos átomos de sodio, que forman dos iones Na + cediendo un electrón cada uno. Estos son captados por un átomo de azufre, que forma un ion S 2-. Por lo tanto, se intercambian dos electrones. 54 Dada la distribución electrónica del sodio y del oxígeno: a) Representar las estructuras electrónicas de los iones O 2- y Na +. b) Qué compuesto se forma? Explícalo. 14
15 a) b) Se forma el óxido de sodio, Na2O. Dos átomos de sodio ceden 1 electrón cada uno a un átomo de oxígeno, con lo cual se forman dos iones Na + y un ión O 2-, que se atraen y forman el óxido citado. 55 En qué estado de agregación se encuentran los compuestos iónicos? Por qué tienen alto el punto de fusión? Los compuestos iónicos se encuentran en estado sólido. Y tienen alto punto de fusión, porque las fuerzas electrostáticas entre los iones en el cristal son elevadas y es necesaria una gran cantidad de energía para que disminuyan y producir la fusión. 56 Completar el siguiente párrafo. Los átomos de los metales tienen tendencia a.. para completar un octeto y convertirse en En el enlace metálico los iones formados el conjunto de.. Se forma una estructura ordenada de.. llamada, entre los que se mueven los libres que forman una. Los. libres mantienen unidos los en posiciones fijas. Los átomos de los metales tienen tendencia a ceder electrones para completar un octeto y convertirse en iones positivos. En el enlace metálico los iones positivos formados comparten el conjunto de electrones cedidos. Se forma una estructura ordenada de iones positivos llamada red metálica, entre los que se mueven los electrones libres que forman una nube electrónica. Los electrones libres mantienen unidos los iones positivos en posiciones fijas. 57 Qué son los cristales? De cuántos tipos hay? Poner ejemplos. Los cristales son agrupaciones de átomos que están formados por un número variable de los mismos, en general muy grande y que depende del tamaño del cristal. Según el tipo de átomos que los forman, pueden ser cristales de un elemento, cuando todos los átomos son del mismo elemento químico, o bien cristales de un compuesto, cuando los átomos del mismo son de distintos elementos químicos. Un cristal de sodio metálico (Na) es un ejemplo de cristal de un elemento, y un cristal de cloruro de sodio o sal común (NaCl) es un ejemplo de cristal de un compuesto. Existen diferentes 8 tipos diferentes de cristalización. El que se utilice cada uno de ellos depende de los tamaños y cargas de las sustancias que los forman, cristalizando siempre en la estructura energéticamente más estable. 15
16 58 Enjuicia la afirmación siguiente: En el material a que hace referencia el dibujo, pequeñas dislocaciones provocan grandes repulsiones. Por eso es un material maleable. Pon ejemplos de sustancias que se comporten así. En realidad la frase hace referencia al dibujo pero sólo en su primera mitad. En efecto, hay materiales ordenados tal como se muestra en el dibujo, con cargas o iones alternativamente dispuestos. En ellos, una pequeña dislocación puede provocar un corrimiento de las capas con tan mala suerte que todos los positivos se enfrenten y todos los negativos también. La fuerte repulsión que eso provocaría haría que el material "saltase", literalmente, se rompiera por sí solo. Sin embargo a esta propiedad la llamamos fragilidad y es propia de los sólidos cristalinos tipo sal común. La maleabilidad es casi lo contrario: es la posibilidad de desplazar unas capas sobre otras sin que la situación empeore energéticamente respecto a la anterior, de modo que el material no se resista a ello. Es propio de los sólidos metálicos cuya estructura no es la del dibujo. 59 Completar las siguientes frases: El átomo de un metal adquiere la configuración estable de un gas noble si. y se convierte en un ion o ; por el contrario, el átomo de un no metal completa su octeto si. y se convierte en un ion. o El enlace iónico se produce por la entre los. y formados al intercambiar electrones de un. con electrones de un Completar lo siguientes párrafos: El átomo de un metal adquiere la configuración estable de un gas noble si cede electrones y se convierte en un ion positivo o catión ; por el contrario, el átomo de un no metal completa su octeto si toma electrones y se convierte en un ion negativo o anión. El enlace iónico se produce por la atracción electrostática entre los iones positivos y los iones negativos formados al intercambiar electrones de un metal con electrones de un no metal. 60 Completa los siguientes enunciados: El calcio es un y se une al flúor, que es un., para formar un compuesto. El calcio..... electrones, a cada de flúor, y se forman el ion positivo y los iones Como los iones tienen distinta..., se, y se forma el compuesto.. de fórmula.. El calcio es un metal y se une al flúor, que es un no metal, para formar un compuesto iónico. El calcio cede 2 electrones uno a cada átomo de flúor, y se forman el ion positivo Ca 2+ y los iones negativos F - Como los iones tienen distinta carga, se atraen, y se forma el compuesto difluoruro de calcio de fórmula CaF2. 16
17 61 Por qué la temperatura de fusión y de ebullición son muy bajas cuando se trata de sustancias moleculares y muy altas en los sólidos covalentes, si se trata en ambos casos de compuestos covalentes? En las sustancias moleculares, las fuerzas intermoleculares son débiles, por lo que estos compuestos son gases, líquidos o sólidos volátiles a temperatura ambiente. Sin embargo, en los sólidos covalentes las fuerzas son grandes y forman redes cristalinas muy extensas. Como consecuencia de la magnitud de las fuerzas, la cantidad de energía que hay que suministrar en el caso de los sólidos covalentes para que se fundan será mucho mayor que en las sustancias moleculares sólidas. El mismo razonamiento sirve para los puntos de ebullición. 62 Completar el siguiente párrafo: Los átomos de los elementos no metálicos tienden a electrones para completar 8 electrones de valencia. Pero también pueden adquirir la configuración de gas noble si.. electrones. Estas uniones se representan mediante diagramas de.. en los que cada electrón de valencia está representado por un.. y el.. de electrones de enlace por una.. El.. de.. se denomina.. de.. Los átomos de los elementos no metálicos tienden a captar electrones para completar 8 electrones de valencia. Pero también pueden adquirir la configuración de gas noble si comparten electrones. Estas uniones se representan mediante diagramas de Lewis en los que cada electrón de valencia está representado por un punto y el par de electrones de enlace por una raya. El par de electrones se denomina par de enlace. 63 Las siguientes moléculas, F2, Cl2O, CH4, CO2, cuántos pares de enlace tienen? Las siguientes moléculas, F2, Cl2O, CH4, CO2, cuántos pares de enlace tienen? El F2 tiene un par de enlace, porque comparte un par de electrones. F - F. El Cl2O tiene dos pares de enlace, porque cada átomo de cloro comparte un par de electrones con el átomo de oxígeno. Cl - O - Cl. El CH4 tiene cuatro pares de enlace, porque cada átomo de hidrógeno comparte un par de electrones con el átomo de carbono. El CO2 tiene dos pares de enlace dobles, porque el átomo de carbono y cada átomo de oxígeno comparten 2 pares de electrones. O=C=O. 17
TEMA 4: EL ENLACE QUÍMICO
 TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción En la naturaleza, son muy pocos los átomos que se encuentran libres y aislados, sólo los átomos de
UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción En la naturaleza, son muy pocos los átomos que se encuentran libres y aislados, sólo los átomos de
Enlace químico Educación Secundaria Obligatoria Física y Química
 EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
Ejercicios tabla periódica. Enlace 4º ESO
 1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
Uniones químicas o enlaces químicos
 Uniones químicas o enlaces químicos En la naturaleza es muy difícil encontrar átomos libres de los diferentes elementos ya que la gran mayoría (excepto los átomos de los gases inertes) son muy inestables
Uniones químicas o enlaces químicos En la naturaleza es muy difícil encontrar átomos libres de los diferentes elementos ya que la gran mayoría (excepto los átomos de los gases inertes) son muy inestables
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
EL ENLACE QUÍMICO (FisQuiWeb)
 EL ENLACE QUÍMICO (FisQuiWeb) Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden a unirse y no permanecen
EL ENLACE QUÍMICO (FisQuiWeb) Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden a unirse y no permanecen
Electrónica SODIO CLORO NEÓN ARGÓN
 Capítulo 3: UNIONES QUÍMICAS Uniones químicas Los elementos que encontramos en la tabla periódica, en la naturaleza no se hallan aislados. Por qué? Porque buscan lograr la estabilidad, como la piedra que
Capítulo 3: UNIONES QUÍMICAS Uniones químicas Los elementos que encontramos en la tabla periódica, en la naturaleza no se hallan aislados. Por qué? Porque buscan lograr la estabilidad, como la piedra que
UNIDAD 3: EL ENLACE QUÍMICO
 UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
TEMA 2. ENLACES QUIMICOS
 TEMA 2. ENLACES QUIMICOS En la naturaleza los átomos que constituyen la materia se encuentran unidos formando moléculas o agrupaciones más complejas. A pesar de ello existen una serie de elementos que
TEMA 2. ENLACES QUIMICOS En la naturaleza los átomos que constituyen la materia se encuentran unidos formando moléculas o agrupaciones más complejas. A pesar de ello existen una serie de elementos que
Los compuestos químicos
 Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
Unidad 3. Átomos y moléculas
 Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
TEMA 5. Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS
 TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES
 ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA El enlace químico Nº Ejercicios PSU 1. Con respecto a la razón por la que se enlazan los átomos, cuál de las siguientes alternativas es correcta? A) Los átomos se enlazan
Programa Técnico Profesional QUÍMICA El enlace químico Nº Ejercicios PSU 1. Con respecto a la razón por la que se enlazan los átomos, cuál de las siguientes alternativas es correcta? A) Los átomos se enlazan
4º E.S.O. FÍSICA Y QUÍMICA 3. ENLACE QUÍMICO. Dpto. de Física y Química. R. Artacho
 4º E.S.O. FÍSICA Y QUÍMICA 3. ENLACE QUÍMICO R. Artacho Dpto. de Física y Química Índice CONTENIDOS 1. Enlace químico en las sustancias 2. Tipos de enlace entre átomos 3. Enlace iónico 4. Enlace covalente
4º E.S.O. FÍSICA Y QUÍMICA 3. ENLACE QUÍMICO R. Artacho Dpto. de Física y Química Índice CONTENIDOS 1. Enlace químico en las sustancias 2. Tipos de enlace entre átomos 3. Enlace iónico 4. Enlace covalente
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES 1.* Indiquen cuántos electrones tienen en la última capa cada uno de estos elementos. a) C f) O k) K b) F g) P l) S c) Ne h) H m) He d) Br
FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES 1.* Indiquen cuántos electrones tienen en la última capa cada uno de estos elementos. a) C f) O k) K b) F g) P l) S c) Ne h) H m) He d) Br
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
1- Enlaces entre átomos Por qué se unen los átomos? 2- Distintos tipos de enlaces 2.1- Enlace iónico Compuestos iónicos y sus propiedades 2.
 1- Enlaces entre átomos Por qué se unen los átomos? 2- Distintos tipos de enlaces 2.1- Enlace iónico 2.1.1- Compuestos iónicos y sus propiedades 2.2- Enlace covalente 2.2.1-Estructura de Lewis 2.2.2- Compuestos
1- Enlaces entre átomos Por qué se unen los átomos? 2- Distintos tipos de enlaces 2.1- Enlace iónico 2.1.1- Compuestos iónicos y sus propiedades 2.2- Enlace covalente 2.2.1-Estructura de Lewis 2.2.2- Compuestos
Física y Química 4º E.S.O. EL ENLACE ENTRE ÁTOMOS Pág. 1
 Física y Química 4º E.S.O. EL ENLACE ENTRE ÁTOMOS Pág. 1 ÁTOMOS Y MOLÉCULAS Recuerda: Los átomos son eléctricamente neutros porque tienen el mismo número de cargas negativas (electrones) que positivas
Física y Química 4º E.S.O. EL ENLACE ENTRE ÁTOMOS Pág. 1 ÁTOMOS Y MOLÉCULAS Recuerda: Los átomos son eléctricamente neutros porque tienen el mismo número de cargas negativas (electrones) que positivas
Objetivo. Introducción. Palabras clave. Desarrollo. Química Unidad 8 Enlace químico. 1. Interacciones entre átomos
 Química Unidad 8 Enlace químico Objetivo Comprender los conceptos básicos de los modelos de enlace iónico, covalente y metálico. Introducción Los electrones cumplen un papel fundamental en la formación
Química Unidad 8 Enlace químico Objetivo Comprender los conceptos básicos de los modelos de enlace iónico, covalente y metálico. Introducción Los electrones cumplen un papel fundamental en la formación
EL ENLACE QUÍMICO. Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o iones.
 EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
Ejercicios de recuperación de Física y Química de 3 er de ESO 2ª PARTE
 1 Ejercicios de recuperación de Física y Química de 3 er de ESO 2ª PARTE 1. Completar las siguientes frases sobre las ideas de John Dalton. a) La materia está constituida por. b) Los.. son. y no se modifican
1 Ejercicios de recuperación de Física y Química de 3 er de ESO 2ª PARTE 1. Completar las siguientes frases sobre las ideas de John Dalton. a) La materia está constituida por. b) Los.. son. y no se modifican
Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados..
 ENLACE QUÍMICO Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados.. Son de tipo eléctrico. Al formarse un enlace
ENLACE QUÍMICO Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados.. Son de tipo eléctrico. Al formarse un enlace
 En un partido de tenis, dos jugadores no dejan de golpear la pelota hacia adelante y hacia atrás. La pelota rebota de una jugadora a otra, una y otra vez. La pelota hace que las jugadoras se muevan juntas
En un partido de tenis, dos jugadores no dejan de golpear la pelota hacia adelante y hacia atrás. La pelota rebota de una jugadora a otra, una y otra vez. La pelota hace que las jugadoras se muevan juntas
CONOCIMIENTOS PREVIOS
 Enlace Químico INDICE Introducción al enlace químico Conocimientos previos. Tormenta de ideas Por qué se unen los átomos? Concepto de Enlace químico Tipos de enlaces químicos E. iónico(definición, estructura,
Enlace Químico INDICE Introducción al enlace químico Conocimientos previos. Tormenta de ideas Por qué se unen los átomos? Concepto de Enlace químico Tipos de enlaces químicos E. iónico(definición, estructura,
Taller de Recuperación de química Grado: Octavo
 I N S T I T U C I Ó N E D U C A T I V A A L T A V I S T A MEDELLÍN - ANTIOQUIA Creada mediante Resolución N 014898 de diciembre 3 de 2015, y Modificada mediante Resolución N 001263 de febrero 7 de 2017
I N S T I T U C I Ó N E D U C A T I V A A L T A V I S T A MEDELLÍN - ANTIOQUIA Creada mediante Resolución N 014898 de diciembre 3 de 2015, y Modificada mediante Resolución N 001263 de febrero 7 de 2017
Actividades de refuerzo
 Actividades de refuerzo 1. Localiza doce elementos del sistema periódico e indica si son metálicos o no metálicos y a qué grupo pertenecen. A R G O N O S P O I L A S D I G L O E R U N P B T O G I T U M
Actividades de refuerzo 1. Localiza doce elementos del sistema periódico e indica si son metálicos o no metálicos y a qué grupo pertenecen. A R G O N O S P O I L A S D I G L O E R U N P B T O G I T U M
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS
 I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
Tema 2. La agrupación de los átomos en la materia.
 Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS. Cuestiones de evaluación inicial. 2.- Cuántos protones y cuantos neutrones tiene el Carbono?
 UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES Niveles de energía Modelo atómico actual Orbitales Configuración electrónica Tabla periódica Cada electrón puede encontrarse con más probabilidad en
FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES Niveles de energía Modelo atómico actual Orbitales Configuración electrónica Tabla periódica Cada electrón puede encontrarse con más probabilidad en
Enlace iónico. Propiedades de los compuestos iónicos
 Enlace iónico Un ión no es más que un átomo o molécula que ha perdido su neutralidad eléctrica, debido a que ha perdido o ganado electrones de su capa externa El enlace iónico está presente en todos los
Enlace iónico Un ión no es más que un átomo o molécula que ha perdido su neutralidad eléctrica, debido a que ha perdido o ganado electrones de su capa externa El enlace iónico está presente en todos los
Fundamentos 24/10/2018
 Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
TEMA 3. ENLACE QUÍMICO FÍSICA Y QUÍMICA 4º ESO
 TEMA 3. ENLACE QUÍMICO FÍSICA Y QUÍMICA 4º ESO ÍNDICE 1. 2. 3. 4. 5. Enlace químico. Enlace iónico. Enlace covalente. Enlace metálico. Cantidad de sustancia: mol 1. ENLACE QUÍMICO 1. ENLACE QUÍMICO Enlace
TEMA 3. ENLACE QUÍMICO FÍSICA Y QUÍMICA 4º ESO ÍNDICE 1. 2. 3. 4. 5. Enlace químico. Enlace iónico. Enlace covalente. Enlace metálico. Cantidad de sustancia: mol 1. ENLACE QUÍMICO 1. ENLACE QUÍMICO Enlace
ENLACES QUÍMICOS. Enlace iónico
 ENLACES QUÍMICOS De los aproximadamente 90 elementos químicos que se encuentran en la naturaleza sólo en unos pocos casos, los gases nobles, sus átomos constituyen entidades individuales. En los demás
ENLACES QUÍMICOS De los aproximadamente 90 elementos químicos que se encuentran en la naturaleza sólo en unos pocos casos, los gases nobles, sus átomos constituyen entidades individuales. En los demás
elementos reaccionan compuestos
 Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
elementos reaccionan compuestos
 Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO. Fundamentos y Didáctica de la Física y la Química
 Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO Fundamentos y Didáctica de la Física y la Química Según la regla del octeto, una de las estructuras más estables de los elementos es tener ocho
Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO Fundamentos y Didáctica de la Física y la Química Según la regla del octeto, una de las estructuras más estables de los elementos es tener ocho
Departamento de Electrónica y Automática Facultad de Ingeniería Universidad Nacional de San Juan
 Departamento de Electrónica y Automática Facultad de Ingeniería Universidad Nacional de San Juan Año 2018 Definiciones: Departamento de Electrónica y Automática Facultad de Ingeniería UNSJ Mol de moléculas:
Departamento de Electrónica y Automática Facultad de Ingeniería Universidad Nacional de San Juan Año 2018 Definiciones: Departamento de Electrónica y Automática Facultad de Ingeniería UNSJ Mol de moléculas:
29/04 Comisión 1 06/05 Comisión 2
 Química General Clase 3 29/04 Comisión 1 06/05 Comisión 2 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura
Química General Clase 3 29/04 Comisión 1 06/05 Comisión 2 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
CUESTIONARIOS FÍSICA 4º ESO
 DPTO FÍSICA QUÍMICA. IES POLITÉCNICO CARTAGENA CUESTIONARIOS FÍSICA º ESO UNIDADES 8 y 10 Átomos, elementos y compuestos. Las reacciones químicas Mª Teresa Gómez Ruiz 2010 HTTP://WWW. POLITECNICOCARTAGENA.
DPTO FÍSICA QUÍMICA. IES POLITÉCNICO CARTAGENA CUESTIONARIOS FÍSICA º ESO UNIDADES 8 y 10 Átomos, elementos y compuestos. Las reacciones químicas Mª Teresa Gómez Ruiz 2010 HTTP://WWW. POLITECNICOCARTAGENA.
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
TEMA 5: construyen todas las sustancias: agua, madera, metales...varias son las preguntas que surgen:
 TEMA 5: ENLACE QUÍMICO Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias: agua, madera, metales...varias son las preguntas
TEMA 5: ENLACE QUÍMICO Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias: agua, madera, metales...varias son las preguntas
TEMA 6. ENLACE QUÍMICO FÍSICA Y QUÍMICA 4º ESO
 TEMA 6. ENLACE QUÍMICO FÍSICA Y QUÍMICA 4º ESO 1. 2. ÍNDICE 3. 4. 5. Enlace químico. 1.1. Regla del octeto. 1.2. Diagramas de Lewis. Enlace iónico. 2.1. Propiedades sustancias iónicas. Enlace covalente.
TEMA 6. ENLACE QUÍMICO FÍSICA Y QUÍMICA 4º ESO 1. 2. ÍNDICE 3. 4. 5. Enlace químico. 1.1. Regla del octeto. 1.2. Diagramas de Lewis. Enlace iónico. 2.1. Propiedades sustancias iónicas. Enlace covalente.
1. Los elementos químicos
 RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
Física y Química (4º ESO): Estructura del átomo y enlaces químicos 11
 Física y Química (4º ESO): Estructura del átomo y enlaces químicos 11 EL ENLACE QUÍMICO 10.- Concepto y naturaleza del enlace químico Se denomina enlace químico al conjunto de fuerzas que mantiene unidos
Física y Química (4º ESO): Estructura del átomo y enlaces químicos 11 EL ENLACE QUÍMICO 10.- Concepto y naturaleza del enlace químico Se denomina enlace químico al conjunto de fuerzas que mantiene unidos
1 er examen de la 2ª evaluación de 3º ESO A
 1 er examen de la 2ª evaluación de 3º ESO A Nombre: Fecha: 1. Tienes 3500 g de cobre (Cu). Calcula: El número de moles de Cu que tienes. (0,5 puntos) El número de átomos de Cu que tienes. (0,5 puntos)
1 er examen de la 2ª evaluación de 3º ESO A Nombre: Fecha: 1. Tienes 3500 g de cobre (Cu). Calcula: El número de moles de Cu que tienes. (0,5 puntos) El número de átomos de Cu que tienes. (0,5 puntos)
TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO
 TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO. Objetivos / Criterios de evaluación O.5.1 Conocer la importancia de la búsqueda de los elementos químicos. O.5.2 Diferenciar entre metales y no metales. O.5.3
TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO. Objetivos / Criterios de evaluación O.5.1 Conocer la importancia de la búsqueda de los elementos químicos. O.5.2 Diferenciar entre metales y no metales. O.5.3
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
Elementos y compuestos químicos
 5 Elementos y compuestos químicos PARA EMPEZAR Esquema de contenidos Los elementos químicos Clasificación de los elementos La tabla periódica Bioelementos Oligoelementos Agrupación de elementos Moléculas
5 Elementos y compuestos químicos PARA EMPEZAR Esquema de contenidos Los elementos químicos Clasificación de los elementos La tabla periódica Bioelementos Oligoelementos Agrupación de elementos Moléculas
SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1. INTRODUCCIÓN 2. EVOLUCIÓN HISTÓRICA DE LA CLASIFICACIÓN DE LOS ELEMEN- TOS. Lavoisier. Meyer.
 SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1. INTRODUCCIÓN Las sustancias puras pueden ser elementos (sustancias simples) o compuestos (sustancias compuestas) Los elementos están formados por un solo tipo de átomos,
SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1. INTRODUCCIÓN Las sustancias puras pueden ser elementos (sustancias simples) o compuestos (sustancias compuestas) Los elementos están formados por un solo tipo de átomos,
Química General. Clase 3 FECHA: 19/05
 Química General Clase 3 FECHA: 19/05 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura de los compuestos iónicos.
Química General Clase 3 FECHA: 19/05 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura de los compuestos iónicos.
Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza.
 Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza. Tipos de sustancias Sustancias metálicas: tienen puntos de fusión variables,
Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza. Tipos de sustancias Sustancias metálicas: tienen puntos de fusión variables,
Seminario de la Unidad 2. Estructura Atómica: Tabla Periódica y Enlace Químico. A) El átomo: Caracterización
 A) El átomo: Caracterización 9. Rellena cada una de las celdas de la siguiente tabla: 10. Realiza una tabla indicando el número atómico, el número másico, la carga, el tipo de ion, y el número de protones,
A) El átomo: Caracterización 9. Rellena cada una de las celdas de la siguiente tabla: 10. Realiza una tabla indicando el número atómico, el número másico, la carga, el tipo de ion, y el número de protones,
Uniones y Enlaces Químicos. Semana 2 Lida. Lilian Judith Guzmán Melgar
 Uniones y Enlaces Químicos Semana 2 Lida. Lilian Judith Guzmán Melgar Enlace Químico Es la fuerza de atracción que mantiene unidos a los átomos en las moléculas y a los iones en los cristales. A los tipos
Uniones y Enlaces Químicos Semana 2 Lida. Lilian Judith Guzmán Melgar Enlace Químico Es la fuerza de atracción que mantiene unidos a los átomos en las moléculas y a los iones en los cristales. A los tipos
Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico
 Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico Naturaleza del enlace químico Los átomos tienden a adquirir la máxima estabilidad y esto se consigue
Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico Naturaleza del enlace químico Los átomos tienden a adquirir la máxima estabilidad y esto se consigue
Uniones químicas. Electronegatividad. Números de oxidación (valencia)
 Uniones químicas Electronegatividad La electronegatividad es la capacidad relativa (o tendencia) para atraer electrones que tienen los diferentes elementos químicos en una unión química. Los núcleos de
Uniones químicas Electronegatividad La electronegatividad es la capacidad relativa (o tendencia) para atraer electrones que tienen los diferentes elementos químicos en una unión química. Los núcleos de
1. Escribe las ideas principales del modelo atómico de Dalton. 2. Qué descubrió Thomson? Qué modelo atómico sugirió tras este descubrimiento?
 Hoja de actividades 1. Escribe las ideas principales del modelo atómico de Dalton. 2. Qué descubrió Thomson? Qué modelo atómico sugirió tras este descubrimiento? 3. El modelo atómico de Dalton fue una
Hoja de actividades 1. Escribe las ideas principales del modelo atómico de Dalton. 2. Qué descubrió Thomson? Qué modelo atómico sugirió tras este descubrimiento? 3. El modelo atómico de Dalton fue una
Unidad 1: Estructura atómica de la materia
 ACTIVIDADES Unidad 1: Estructura atómica de la materia Para a realización de ditas actividades recoméndase seguir a seguinte páxina de internet do Ministerio de Educación e ciencia na cal se explica de
ACTIVIDADES Unidad 1: Estructura atómica de la materia Para a realización de ditas actividades recoméndase seguir a seguinte páxina de internet do Ministerio de Educación e ciencia na cal se explica de
SOLUCIONARIO Guía Técnico Profesional
 SOLUCIONARIO Guía Técnico Profesional El enlace químico SGUICTC004TC33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 A Comprensión 4 A Comprensión 5 C Comprensión 6 D Aplicación 7
SOLUCIONARIO Guía Técnico Profesional El enlace químico SGUICTC004TC33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 A Comprensión 4 A Comprensión 5 C Comprensión 6 D Aplicación 7
COLEGIO SAN JOSÉ - Hijas de María Auxiliadora C/ Emilio Ferrari, 87 - Madrid Departamento de Ciencias Naturales
 TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS 5. El enlace químico 1. Explica el proceso de formación del enlace iónico en el cloruro de aluminio (AlCl 3 ). a) Escribe las configuraciones electrónicas del
TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS 5. El enlace químico 1. Explica el proceso de formación del enlace iónico en el cloruro de aluminio (AlCl 3 ). a) Escribe las configuraciones electrónicas del
Enlace Químico. Química General I 2012
 Enlace Químico Química General I 2012 Los electrones de valencia son los electrones del último orbital en un átomo, son los causantes de los enlaces químicos. Grupo e - configuración # de valencia 1A ns
Enlace Químico Química General I 2012 Los electrones de valencia son los electrones del último orbital en un átomo, son los causantes de los enlaces químicos. Grupo e - configuración # de valencia 1A ns
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA CENTRO DE ESTUDIOS PREUNIVERSITARIOS SEGUNDO SEMINARIO DE QUIMICA
 UNIVERSIDAD NACIONAL AGRARIA LA MOLINA CENTRO DE ESTUDIOS PREUNIVERSITARIOS SEGUNDO SEMINARIO DE QUIMICA 1. La configuración electrónica del átomo del elemento E es: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA CENTRO DE ESTUDIOS PREUNIVERSITARIOS SEGUNDO SEMINARIO DE QUIMICA 1. La configuración electrónica del átomo del elemento E es: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2018 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 018 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 018 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva,
SISTEMA PERIÓDICO Y ENLACE QUÍMICO
 SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1. Introducción Las sustancias puras pueden ser elementos (sustancias simples) o compuestos (sustancias compuestas) Los elementos están formados por un solo tipo de átomos,
SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1. Introducción Las sustancias puras pueden ser elementos (sustancias simples) o compuestos (sustancias compuestas) Los elementos están formados por un solo tipo de átomos,
ENLACE QUÍMICO PENDIENTES 1º BACHILLERATO
 ENLACE QUÍMICO PENDIENTES 1º BACHILLERATO 1) Dados los elementos: Neón; Magnesio; Fósforo y Cloro: a) Escribe sus configuraciones electrónicas. Indica a qué grupo y período corresponden, así cómo sus valencias
ENLACE QUÍMICO PENDIENTES 1º BACHILLERATO 1) Dados los elementos: Neón; Magnesio; Fósforo y Cloro: a) Escribe sus configuraciones electrónicas. Indica a qué grupo y período corresponden, así cómo sus valencias
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: El átomo y sus enlaces
 1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
Enlace Químico. AUTHOR: VICENTE GUZMÁN BROTÓNS
 Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las distintas sustancias se denominan enlaces
Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las distintas sustancias se denominan enlaces
EJERCICIOS Y PROBLEMAS ENLACE QUÍMICO Y ESTRUCTURA
 EJERCICIOS Y PROBLEMAS ENLACE QUÍMICO Y ESTRUCTURA 14.24 Dibuja un mapa conceptual que contenga los siguientes términos. Sólido cristalino, cristal, estructura molecular, estructura gigante, cristal molecular,
EJERCICIOS Y PROBLEMAS ENLACE QUÍMICO Y ESTRUCTURA 14.24 Dibuja un mapa conceptual que contenga los siguientes términos. Sólido cristalino, cristal, estructura molecular, estructura gigante, cristal molecular,
Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales.
 ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
QUÍMICA 1ºBAT ENLACE QUÍMICO
 1 1. EL ENLACE QUÍMICO En la naturaleza los elementos químicos se hallan habitualmente combinados entre sí, formando compuestos químicos. En éstos los átomos se unen mediante "enlaces químicos". Los átomos
1 1. EL ENLACE QUÍMICO En la naturaleza los elementos químicos se hallan habitualmente combinados entre sí, formando compuestos químicos. En éstos los átomos se unen mediante "enlaces químicos". Los átomos
ENLACE COVALENTE. Z = 1 Hidrógeno H: 1s 1 Z = 6 Carbono C: 1s 2 2s 2 2p 2 Z = 7 Nitrógeno N: 1s 2 2s 2 2p 3 Z = 8 Oxígeno O: 1s 2 2s 2 2p 4 H H H 2
 ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
Guía de Problemas- 5 BTO
 Química Guía de Problemas- 5 BTO Primera Parte Liliana Pagliano 2012 1 Introducción: 1. Qué diferencias existen entre un proceso físico y un proceso químico? 2. Qué es el conocimiento científico? 3. Ante
Química Guía de Problemas- 5 BTO Primera Parte Liliana Pagliano 2012 1 Introducción: 1. Qué diferencias existen entre un proceso físico y un proceso químico? 2. Qué es el conocimiento científico? 3. Ante
Los átomos y sus enlaces
 Los átomos y sus enlaces Unidad 11 El modelo nuclear de átomo Demócrito Dalton Thompson Rutherford 1 El modelo nuclear de átomo Núcleo central / carga positiva / protones. Corteza / carga negativa / electrones.
Los átomos y sus enlaces Unidad 11 El modelo nuclear de átomo Demócrito Dalton Thompson Rutherford 1 El modelo nuclear de átomo Núcleo central / carga positiva / protones. Corteza / carga negativa / electrones.
IES LEOPOLDO QUEIPO. DEPARTAMENTO FÍSICA Y QUÍMICA 4ºESO. Tema 2 : El átomo y sus uniones
 Tema 2 : El átomo y sus uniones Esquema de trabajo: 1.- El átomo. A. Partículas subatómicas. B. Número atómico y número másico C. Estructura interna del átomo: clásica y actual. 2.- Organización de los
Tema 2 : El átomo y sus uniones Esquema de trabajo: 1.- El átomo. A. Partículas subatómicas. B. Número atómico y número másico C. Estructura interna del átomo: clásica y actual. 2.- Organización de los
El enlace químico 3 ESO SEK-CATALUNYA
 El enlace químico 3 ESO SEK-CATALUNYA Contenidos Enlace químico Enlace metálico Propiedades de los metales Enlace iónico Propiedades de los compuestos iónicos Enlace covalente Propiedades de los compuestos
El enlace químico 3 ESO SEK-CATALUNYA Contenidos Enlace químico Enlace metálico Propiedades de los metales Enlace iónico Propiedades de los compuestos iónicos Enlace covalente Propiedades de los compuestos
INSTITUTO SANTA CECILIA FISICOQUIMICA 3 AÑO. PROFESORA: Jorgelina Anabel Ferreiro ALUMNO:
 INSTITUTO SANTA CECILIA FISICOQUIMICA 3 AÑO PROFESORA: Jorgelina Anabel Ferreiro ALUMNO: MODULO DE RECUPERACION DE CONTENIDOS SEGUNDO TRIMESTRE 1 LA TABLA PERIODICA EL ORDENAMIENTO PERIODICO DE LOS ELEMENTOS
INSTITUTO SANTA CECILIA FISICOQUIMICA 3 AÑO PROFESORA: Jorgelina Anabel Ferreiro ALUMNO: MODULO DE RECUPERACION DE CONTENIDOS SEGUNDO TRIMESTRE 1 LA TABLA PERIODICA EL ORDENAMIENTO PERIODICO DE LOS ELEMENTOS
SOLUCIONES FICHA 2: CONFIGURACIÓN ELECTRÓNICA Y PROPIEDADES PERIÓDICAS
 1.- Cuántos electrones pueden existir en los orbitales: 3d, 2p, 4f y 5s? 3d: El número 3 indica que estos orbitales están en el nivel 3. La letra d indica el tipo de orbital en el que están los electrones.
1.- Cuántos electrones pueden existir en los orbitales: 3d, 2p, 4f y 5s? 3d: El número 3 indica que estos orbitales están en el nivel 3. La letra d indica el tipo de orbital en el que están los electrones.
El átomo de S recibe 2 electrones y se transforma en un ión azufre, adquiriendo la configuración del gas noble Argón.
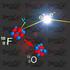 FUNDACIÓN EDUCACIONAL COLEGIO DE LOS SS.CC. - MANQUEHUE - Átomos, iones y moléculas. ENLACE QUÍMICO DEPARTAMENTO DE CIENCIAS PROFESORA: SILVINA IRIBERRI CURSO: SEGUNDO MEDIO Todos los objetos materiales
FUNDACIÓN EDUCACIONAL COLEGIO DE LOS SS.CC. - MANQUEHUE - Átomos, iones y moléculas. ENLACE QUÍMICO DEPARTAMENTO DE CIENCIAS PROFESORA: SILVINA IRIBERRI CURSO: SEGUNDO MEDIO Todos los objetos materiales
Tema 3 Enlace Químico
 Tema 3 Enlace Químico IES Padre Manjón Prof: Eduardo Eisman FYQ 4.º ESO: Tema 3. Enlace químico Curso 2016/17 1 El Enlace Químico CONTENIDOS 1. Enlace químico en las sustancias 2. Tipos de enlace entre
Tema 3 Enlace Químico IES Padre Manjón Prof: Eduardo Eisman FYQ 4.º ESO: Tema 3. Enlace químico Curso 2016/17 1 El Enlace Químico CONTENIDOS 1. Enlace químico en las sustancias 2. Tipos de enlace entre
3 er examen (global) de la 1ª evaluación de Física y Química de 4º de la ESO C
 3 er examen (global) de la 1ª evaluación de Física y Química de 4º de la ESO C Nombre: Fecha: 1. Una sustancia es sólida a temperatura ambiente, dura y frágil. No conduce la electricidad en estado sólido
3 er examen (global) de la 1ª evaluación de Física y Química de 4º de la ESO C Nombre: Fecha: 1. Una sustancia es sólida a temperatura ambiente, dura y frágil. No conduce la electricidad en estado sólido
10/11/2016 EL ENLACE QUÍMICO
 EL ENLACE QUÍMICO Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
EL ENLACE QUÍMICO Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Ejercicios UD. 4 Elementos y Compuestos Física y Química CEPA COSLADA
 1.- En qué consistía la ley de las triadas? Quién la propuso? 2.- Por qué la tabla donde se ordenan los elementos químicos se llama tabla periódica? Los elementos están ordenados en la tabla periódica
1.- En qué consistía la ley de las triadas? Quién la propuso? 2.- Por qué la tabla donde se ordenan los elementos químicos se llama tabla periódica? Los elementos están ordenados en la tabla periódica
ESTRUCTURA DEL NÚCLEO
 ESTRUCTURA DEL NÚCLEO 1. Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes átomos: 7 75 10 12 a) 3Li b) 33As c) 5B d) 6C 2. Calcula
ESTRUCTURA DEL NÚCLEO 1. Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes átomos: 7 75 10 12 a) 3Li b) 33As c) 5B d) 6C 2. Calcula
Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos:
 II EL ÁTOMO EJERCICIOS II Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos: a) b) 5. Determina la estructura atómica de los átomos
II EL ÁTOMO EJERCICIOS II Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos: a) b) 5. Determina la estructura atómica de los átomos
ENLACE QUÍMICO. NaCl. Grafito: láminas de átomos de carbono
 NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
Electrón: LAS PARTÍCULAS SUBATÓMICAS. Electrón: e - Carga eléctrica: 1,602x10-19 C Masa: 9,109x10-31 C
 ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
Las sustancias químicas
 Las sustancias químicas Los elementos químicos Una sustancia elemental está formada por átomos del mismo elemento químico, mientras que un compuesto químico está formado por átomos de diferentes elementos.
Las sustancias químicas Los elementos químicos Una sustancia elemental está formada por átomos del mismo elemento químico, mientras que un compuesto químico está formado por átomos de diferentes elementos.
ENLACES QUÍMICOS. Prof.: Grettel Azofeifa Lizano
 ENLACES QUÍMICOS Prof.: Grettel Azofeifa Lizano Estructura de Lewis Es una representación de símbolos y puntos, propuesta pro Gilbert Lewis. Según las configuraciones electrónicas, se tiene el tronco electrónico
ENLACES QUÍMICOS Prof.: Grettel Azofeifa Lizano Estructura de Lewis Es una representación de símbolos y puntos, propuesta pro Gilbert Lewis. Según las configuraciones electrónicas, se tiene el tronco electrónico
