TEMA 5. EQUILIBRIOS REDOX EN AGUAS NATURALES
|
|
|
- Cristián Casado Acosta
- hace 7 años
- Vistas:
Transcripción
1 TEMA 5. EQUILIBRIOS REDOX EN AGUAS NATURALES 5.1 EQUILIBRIOS REDOX Y pe Ec. de Nernst: DIAGRAMAS DE EQUILIBRIOS REDOX EN AGUAS DIAGRAMAS log C- pe LÍMITES DE ESTABILIDAD EN EL AGUA DIAGRAMA pc pe para Fe(II)/Fe (III) a ph = DIAGRAMA pc pe para HS - /SO 4 2- a ph= DIAGRAMAS pe ph DIAGRAMA pe ph para especies de Fe (II) y Fe (III) COMPORTAMIENTO DEL Fe EN DIFERENTES AMBIENTES EQUILIBRIOS REDOX DE IMPORTANCIA BIOLÓGICA EN EL MEDIO ACUÁTICO ORDEN DE UTILIZACIÓN PREFERENCIAL COMPUESTOS DE AZUFRE COMPUESTOS DE NITRÓGENO COMPUESTOS Fe y Mn COMPUESTOS DE CARBONO...23
2 5.1 EQUILIBRIOS REDOX Y pe Ox1+ Red2 Red1+ Ox2 Oxidación pérdida de electrones Reducción ganancia de electrones. Especie Reducida especie que tiene capacidad de perder electrones. DONANTE de electrones. Especie Oxidada especie que tiene capacidad de ganar electrones. ACEPTADOR de electrones El tratamiento formal de estas semirreacciones escritas en función de los electrones, puede hacerse de dos formas distintas: Mediante el concepto de actividad del electrón (pe) Mediante la ecuación de Nernst (Eh) Ambos tratamientos son equivalentes y los valores de pe y Eh pueden ser fácilmente calculados uno a partir del otro.
3 La intensidad de la oxidación o reducción puede expresarse por el pe pe = - log a e a e = actividad del electrón El potencial de la reacción depende de concentración de reactivos y productos Ec. de Nernst: R = 8.3 J/mol.k T = 298 k F = C/mol n= nº electrones intercambiados. Q = [productos]/ [reactivos] Desde el punto de vista termodinámico En equilibrio:
4 Diagrama de energía libre en soluciones acuosas G = Cambio en la energía de Gibbs
5 5.1.2 DIAGRAMAS DE EQUILIBRIOS REDOX EN AGUAS Ecuaciones de equilibrio redox Balance de masas Balance de electrones TIPOS: DIAGRAMAS pc pe DIAGRAMAS pe - ph
6 5.2 DIAGRAMAS log C- pe LÍMITES DE ESTABILIDAD EN EL AGUA. o OXIDACCIÓN DEL AGUA o REDUCCIÓN DEL AGUA peº = -14
7 5.2.2 DIAGRAMA pc pe para Fe(II)/Fe (III) a ph =2 Equilibrios redox: Fe 2+ + e - Fe 3+ peº = 13 Balance de masas: Balance de electrones: pe =- log [e-] pc = - log C T, Fe Resolución: pe = peº [Fe 2+ ] = [Fe 3+ ]
8 5.2.3 DIAGRAMA pc pe para HS - /SO 4 2- a ph= 10 Equilibrios redox: SO H e - HS - + 4H 2 O peº = 4.25 Balance de masas: C T, S = [SO 4 2- ] + [HS - ] pc = - log C T, S = 4 para ph =10 Balance de electrones: pe =- log [e-] Resolución: pe = peº [SO 2-4 ] = [HS - ] pe = -7 pe < peº [HS - ] >>[SO 2-4 ] log [SO 2-4 ] = 8 pe+ 7+ log C T, S pe > peº [SO 2-4 ] >> [HS - ] log [SO 2-4 ] = -8pE log C T, S Stumm and Morgan
9 5.3 DIAGRAMAS pe ph SISTEMAS REDOX DEL HIERRO Importancia de los equilibrios Redox del Hierro radican: Las reacciones redox del Fe son importantes en aguas naturales y en sistemas de tratamiento La oxidación de materiales de hierro como pirita produce aguas ácidas y problemas adicionales de DRENAJES ÁCIDOS DE MINAS. La oxidación y reducción de Fe en suelos y aguas subterráneas determina el contenido de Fe en las mismas Reacciones redox intervienen en la eliminación de Fe de aguas
10 5.3.1 DIAGRAMA pe ph para especies de Fe (II) y Fe (III) o Valores altos de pe y bajos ph Fe 3+ especie predominante o Valores bajos de pe y bajos ph Fe 2+ especie predominante o ph altos y pe bajos precipita Fe(OH) 2 o ph muy altos y pe bajos precipita Fe(OH) 3 o Gran área de Fe 2+ en ausencia de oxígeno y de Fe(OH) 3 en condiciones aerobias Línea A Fe 3+ + e- Fe 2+ pe = - pk C T, Fe = 10-7 M Sólidos; Fe(OH) 2, Fe(OH) 3 Solución: Fe 3+, Fe 3+, FeOH 2+, FeOH +, FeOH 2 +, Fe 2+ Línea B Fe(OH) 3 + 3H + + e - Fe H 2 O pe = -pk- 3pH + pfe 2+
11
12 5.3.2 COMPORTAMIENTO DEL Fe EN DIFERENTES AMBIENTES Aguas de lluvia o ríos ambiente aireado Fe(OH) 3 + 3H + + e - Fe H 2 O pk =-3 baja solubilización de Fe 3+, a ph bajos aumenta Fe 3+ Aguas subterráneas ambiente no aireado, con predominio de Fe reducido, como sulfuros FeS Fe 2+ + S 2- pk= 17.3 baja solubilización de Fe 2+ Zona intermedia, con predominio de Fe reducido, como carbonatos FeCO 3 + H + + e - Fe 2+ + HCO 3 - alta solubilización de Fe 2+ pk= 0.4
13 DIAGRAMA pe ph. Zonas o ambientes en sistemas naturales
14 5.4 EQUILIBRIOS REDOX DE IMPORTANCIA BIOLÓGICA EN EL MEDIO ACUÁTICO La reactividad, solubilidad y movilidad de elementos esenciales para sistemas biológicos (Fe, S, N, C, P y elementos metálicos) dependen del potencial redox o A potenciales altos Fe y Mn están en estado oxidado y precipitan como hidróxidos no biodisponibles o A potenciales bajos Fe y Mn están como Fe 2+ y Mn 2+, solubles biodisponibles o El potencial redox disminuye en aguas sometidas a estratificación presencia de compuestos reducidos (NH 3, S 2-, Fe 2+, CH 4 ) La distribución espacial de microorganismos aerobios y anaerobios está determinada principalmente por el potencial redox o Microorganismos aerobios activos a potenciales positivos o Microorganismos anaerobios activos a potenciales negativos Existe un orden de utilización preferencial de aceptores de electrones
15 Valores de peº para reacciones en medio acuoso OXIDANTES REDUCTORES
16 5.4.1 ORDEN DE UTILIZACIÓN PREFERENCIAL Perfil vertical de potencial redox (mv) en sedimentos Microorganismos seleccionan de los aceptores de electrones los que le permitan obtener mayor ganancia energética bien de sustrato orgánico (heterótrofos) o inorgánico (quimioligotrofos). * pe (E, mv) (+) microorganismos estrictos aerobios microorganismos facultativos * pe (E, mv) (-) microorganismos estrictos anaerobios
17 condiciones anaerobias y en ausencia de oxígeno, el orden preferencial de aceptador de los electrones provenientes de la oxidación de la materia orgánica sería: MnO 2 > NO 3 - > SO 4 2-
18 EQUILIBRIOS REDOX DE IMPORTANCIA BIOLÓGICA PROCESOS DE OXIDACIÓN DE MATERIA INORGÁNICA AEROBIAS PROCESO Oxidación de sulfuros 4O HS - 2 SO H + Oxidación de hierro O Fe H + 2 Fe H 2 O Nitrificación 2 NH O 2 2NO H H 2 O Oxidación de manganeso 2Mn H 2 O + O 2 2 MnO H + REACCIÓN Oxidación de sulfuro de hierro 2FeS O H 2 O 2 Fe(OH ) SO H + BACTERIAS IMPLICADAS * Hidrógeno B. Oxidadoras de H 2 : Pseudomonas * HS -, Sº B. del azufre: Thiobacillus tiooxidans, Thiobacillus ferroxidans * NH 4 +, NO 2 - B. Nitrificantes: Nitrosomonas, Nitrobacter, Nitroccocus, * Fe +2 Bacterias del hierro Thiobacillus ferroxidans PROCESOS ANAEROBIOS QUE CONSUMEN MATERIA ORGÁNICA Y REDUCEN COMPUESTOS INORGÁNICOS PROCESO REACCIÓN Desnitrificación Reducción de hierro Reducción de manganeso 5 CH 2 O + 4 NO 3-5 H CO N 2 + H + +2 H 2 O CH 2 O+ 4 Fe(OH ) H + 4 Fe 3+ + HCO H 2 O CH 2 O + 2 MnO H + 2 Mn 2+ + HCO H 2 O Reducción de sulfatos 2 CH 2 O + 2 SO 4 2- HS H CO H + Formación de metano 2 CH 2 O + H 2 O CH 4 + H CO 3 + H + BACTERIAS IMPLICADAS Thiobacillus denitrificans Sulfato-reductoras: Desulfovibrio, Desulfobulbus Methanobacterium, Clostridium
19 5.4.2 COMPUESTOS DE AZUFRE DIAGRAMA pe ph. Especies de azufre oxidadas y reducidas Equilibrios ácidos: pka H 2 S / HS - = 7; pka HS - /S 2- = 13.8; - pka HSO 4 / SO 2-4 = 1.8 Equilibrios redox: a) SO H e - HS - + 4H 2 O peº = 4.25 b) H 2 S S (s)+ 2H e - 4H 2 O peº = -2.9 c) SO H e - H 2 S - + 4H 2 O peº = 7.75 d) SO H e - S - (s) + 4H 2 O peº = 6.0 Balance de masas: C T, S = [SO 2-4 ] + [HSO - 4 ] + [H 2 S - ] + [HS - ]+ [S] pc = - log C T, S = 4 Resolución. ejemplo Línea SO 4 2- /HS - a) pe = peº + 1/8 log [SO 4 2- ] [H + ]/[HS - ] pe= /8 ph Stumm and Morgan
20 5.4.3 COMPUESTOS DE NITRÓGENO DIAGRAMA log C- pe N 2 especie predominante en un amplio rango de pe gran cantidad de N 2 en agua, no es así, velocidad lenta, solo por la acción de microorganismos PN 2 =0.77 atm, PO 2 = 0.21 atm, ph = 8 pe = 12.5 predominan NH 4 + ; NO 2 -, NO 3 -
21 COMPUESTOS DE NITRÓGENO DIAGRAMA pe ph.
22 5.4.4 COMPUESTOS Fe y Mn
23 5.4.5 COMPUESTOS DE CARBONO
24 RESUMEN En las aguas naturales aparecen compuestos de C, N, S, Fe y Mn en distinto estado de oxidación Los procesos de tratamiento de aguas utilizan productos químicos (Cl 2, MnO 4, H 2 O 2, O 2, O 3, etc.) que alteran la naturaleza de los constituyentes del agua debido a reac. Redox. Los microorganismos intervienen en muchos procesos redox, tanto en aguas naturales como de tratamiento. En muchos casos los sistemas naturales no están en equilibrio desde el punto de vista redox, debido a que las cinéticas están inhibidas APLICACIONES DEL SISTEMA REDOX: CORROSIÓN Y CLORACIÓN
su potencial redox en el equilibrio se relaciona con las actividades de las especies que intervienen en la reacción, según la ecuación de Nernst:
 Lección 18. Procesos redox. La ecuación de Nerts. El concepto de potencial electroquímico. Diagramas de equilibrio ph-eh. Secuencia de ecuaciones redox. Consumo de oxígeno en los acuíferos. Oxidación de
Lección 18. Procesos redox. La ecuación de Nerts. El concepto de potencial electroquímico. Diagramas de equilibrio ph-eh. Secuencia de ecuaciones redox. Consumo de oxígeno en los acuíferos. Oxidación de
Ecosistemas bacterianos y ciclos biogeoquímicos
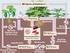 Ecosistemas bacterianos y ciclos biogeoquímicos EN LOS ECOSISTEMAS, LA MATERIA SE RENUEVE CÍCLICAMENTE EL FLUJO DE LA MATERIA EN LOS ECOSISTEMAS (materia orgánica sencilla) Mineralización Materia inorgánica
Ecosistemas bacterianos y ciclos biogeoquímicos EN LOS ECOSISTEMAS, LA MATERIA SE RENUEVE CÍCLICAMENTE EL FLUJO DE LA MATERIA EN LOS ECOSISTEMAS (materia orgánica sencilla) Mineralización Materia inorgánica
Quimiolitótrofos. Los Quimiolitótrofos utilizan compuestos inorgánicos reducidos como fuente energía.
 Quimiolitótrofos Los Quimiolitótrofos utilizan compuestos inorgánicos reducidos como fuente energía. La mayoría usan CO 2 como fuente de carbono (autótrofos). Mixótrofos: utilizan fuente de C orgánica
Quimiolitótrofos Los Quimiolitótrofos utilizan compuestos inorgánicos reducidos como fuente energía. La mayoría usan CO 2 como fuente de carbono (autótrofos). Mixótrofos: utilizan fuente de C orgánica
PARAMETROS FISICO-QUIMICOS: POTENCIAL OXI- REDUCCION
 SEGUNDA PARTE PARAMETROS FISICO-QUIMICOS: POTENCIAL OXI- REDUCCION EL POTENCIAL REDOX (Eh) es un valor relativo medido contra el punto 0 del electrodo normal de hidrógeno (Figura 1) u otro electrodo secundario
SEGUNDA PARTE PARAMETROS FISICO-QUIMICOS: POTENCIAL OXI- REDUCCION EL POTENCIAL REDOX (Eh) es un valor relativo medido contra el punto 0 del electrodo normal de hidrógeno (Figura 1) u otro electrodo secundario
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
4. Un agente oxidante (2 correctas) A) Toma electrones de otra sustancia B) Da electrones a otra sustancia C) Se oxida D) Se reduce
 CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
Memorias del seminario internacional sobre: Tratamiento Integral de Efluentes Complejos de la Industria Petrolera
 Memorias del seminario internacional sobre: Tratamiento Integral de Efluentes Complejos de la Industria Petrolera 10 y 11 de Febrero del 2011 de 9:00 a 15:00 Auditorio del Museo Memoria y Tolerancia Plaza
Memorias del seminario internacional sobre: Tratamiento Integral de Efluentes Complejos de la Industria Petrolera 10 y 11 de Febrero del 2011 de 9:00 a 15:00 Auditorio del Museo Memoria y Tolerancia Plaza
COLEGIO HISPANO AMERICANO PADRES ESCOLAPIOS DEPARTAMENTO DE CIENCIAS
 BALANCEO DE REACCIONES REDOX Material de apoyo. COLEGIO HISPANO AMERICANO PADRES ESCOLAPIOS Este trabajo se hizo con el fin de que los alumnos de Química cuenten con el material de apoyo suficiente para
BALANCEO DE REACCIONES REDOX Material de apoyo. COLEGIO HISPANO AMERICANO PADRES ESCOLAPIOS Este trabajo se hizo con el fin de que los alumnos de Química cuenten con el material de apoyo suficiente para
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX
 TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
Oxidación y Reducción
 Oxidación y Reducción Un poco de Historia En 1718 Georg Stahl propuso la existencia del Flogisto. Cuando un oxido se calienta en presencia de carbono absorben de la atmosfera al flogisto y al hacer combustión
Oxidación y Reducción Un poco de Historia En 1718 Georg Stahl propuso la existencia del Flogisto. Cuando un oxido se calienta en presencia de carbono absorben de la atmosfera al flogisto y al hacer combustión
Metabolismo. Conjunto de reacciones bioquímicas de una célula. El metabolismo comprende dos grandes tipos de reacciones:
 Metabolismo Conjunto de reacciones bioquímicas de una célula El metabolismo comprende dos grandes tipos de reacciones: 1) reacciones de mantenimiento, que suministran a) energía b) poder reductor c) precursores
Metabolismo Conjunto de reacciones bioquímicas de una célula El metabolismo comprende dos grandes tipos de reacciones: 1) reacciones de mantenimiento, que suministran a) energía b) poder reductor c) precursores
CINÉTICA QUÍMICA. Dr. Hugo Cerecetto. Prof. Titular de Química
 CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
Problemas de electrolisis. Resueltos
 Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
SISTEMAS REDOX REACCIONES REDOX
 SISTEMAS REDOX REACCIONES REDOX Existe una familia muy amplia de reacciones que se producen con la pérdida formal de electrones de un átomo y su ganancia por otro átomo. Como la ganancia de electrones
SISTEMAS REDOX REACCIONES REDOX Existe una familia muy amplia de reacciones que se producen con la pérdida formal de electrones de un átomo y su ganancia por otro átomo. Como la ganancia de electrones
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
ANDALUCÍA / JUNIO 2000 LOGSE / QUÍMICA / OPCIÓN A /EXAMEN COMPLETO OPCIÓN A
 OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
6.2.- Reacciones de oxidación reducción
 350 Reacciones de transferencia de electrones 6.2.- Reacciones de oxidación reducción Aspectos teóricos: Valoraciones redox 6.2.1. Valoraciones redox. Equivalentes de oxidación-reducción Las reacciones
350 Reacciones de transferencia de electrones 6.2.- Reacciones de oxidación reducción Aspectos teóricos: Valoraciones redox 6.2.1. Valoraciones redox. Equivalentes de oxidación-reducción Las reacciones
TEMA 3: Equilibrios redox
 TEMA 3: Equilibrios redox Índice 1) Concepto potencial redox. 2) Pila galvánica. 3) Ecuación de Nernst. 4) Espontaneidad y equilibrio. 5) Influencia del ph en el potencial de electrodo. 6) Reacciones de
TEMA 3: Equilibrios redox Índice 1) Concepto potencial redox. 2) Pila galvánica. 3) Ecuación de Nernst. 4) Espontaneidad y equilibrio. 5) Influencia del ph en el potencial de electrodo. 6) Reacciones de
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
QUÍMICA 2º Bachillerato Ejercicios: Reacciones Oxidación Reducción (I)
 1(8) Ejercicio nº 1 a) Identifica el agente oxidante y el agente reductor en la siguiente reacción: 2 H 2 SO 4 + 2KBr Br 2 + K 2 SO 4 + SO 2 + 2H 2 O Indica qué número de oxidación tiene cada elemento.
1(8) Ejercicio nº 1 a) Identifica el agente oxidante y el agente reductor en la siguiente reacción: 2 H 2 SO 4 + 2KBr Br 2 + K 2 SO 4 + SO 2 + 2H 2 O Indica qué número de oxidación tiene cada elemento.
Curso Hidrogeoquímica para Dummies
 Curso Hidrogeoquímica para Dummies Sesión 8 Relación ph-pe www.gidahatari.com ph El ph es una expresión de la concentración de iones H+ en la solución. ph De la reacción de disociación del agua: H 2 O
Curso Hidrogeoquímica para Dummies Sesión 8 Relación ph-pe www.gidahatari.com ph El ph es una expresión de la concentración de iones H+ en la solución. ph De la reacción de disociación del agua: H 2 O
Reacciones redox espontáneas
 Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A
ÁCIDOS Y BASES: DEFINICIÓN Y DISOLUCIONES. CONCEPTO DE ph.
 UNIDAD 4 PROCESOS DE EQUILIBRIO ÁCIDOS Y BASES: DEFINICIÓN Y DISOLUCIONES. CONCEPTO DE ph. Un ácido es una sustancia que, al ser añadida al agua, produce iones hidrógeno (H + ) /hidronio (H 3 O + ). Una
UNIDAD 4 PROCESOS DE EQUILIBRIO ÁCIDOS Y BASES: DEFINICIÓN Y DISOLUCIONES. CONCEPTO DE ph. Un ácido es una sustancia que, al ser añadida al agua, produce iones hidrógeno (H + ) /hidronio (H 3 O + ). Una
Unidad 6: ELECTROQUIMICA
 Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
1. Cuál(es) de los siguientes ejemplos corresponde(n) a una reacción redox? 2 MX 2 M + X 2
 Nº GUÍA PRÁCTICA Óxido reducción I: reacciones redox Ejercicios PSU 1. Cuál(es) de los siguientes ejemplos corresponde(n) a una reacción redox? I) xidación de metales II) Respiración celular III) Procesos
Nº GUÍA PRÁCTICA Óxido reducción I: reacciones redox Ejercicios PSU 1. Cuál(es) de los siguientes ejemplos corresponde(n) a una reacción redox? I) xidación de metales II) Respiración celular III) Procesos
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
BALANCEO DE ECUACIONES QUÍMICAS
 UNIDAD 1 BALANCEO DE ECUACIONES QUÍMICAS DICROMATO DE POTASIO 1 Qué sería de C.S.I. sin la ciencia? Y de la policía sin la química?: por ejemplo el examen (temido por algunos) para el control de alcohol
UNIDAD 1 BALANCEO DE ECUACIONES QUÍMICAS DICROMATO DE POTASIO 1 Qué sería de C.S.I. sin la ciencia? Y de la policía sin la química?: por ejemplo el examen (temido por algunos) para el control de alcohol
Ejercicios redox. I. Para las siguientes valoraciones redox:
 Ejercicios redox I. Para las siguientes valoraciones redox: 1). 50 ml de solución acuosa de sulfato ferroso 0.01 M con dicromato de potasio 0.0 M, a p impuesto igual a 1 y reacción de valoración representativa
Ejercicios redox I. Para las siguientes valoraciones redox: 1). 50 ml de solución acuosa de sulfato ferroso 0.01 M con dicromato de potasio 0.0 M, a p impuesto igual a 1 y reacción de valoración representativa
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA. 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué?
 REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
AJUSTE DE REACCIONES RÉDOX
 AJUSTE DE REACCIONES RÉDOX 1. Razona si son verdaderas o falsas las siguientes afirmaciones. En la reacción: a) Los cationes Ag + actúan como reductores. b) Los aniones NO 3 actúan como oxidantes. c) El
AJUSTE DE REACCIONES RÉDOX 1. Razona si son verdaderas o falsas las siguientes afirmaciones. En la reacción: a) Los cationes Ag + actúan como reductores. b) Los aniones NO 3 actúan como oxidantes. c) El
3.- Cuál de las siguientes formulaciones es la correcta para la sal trioxoclorato (V) de litio (clorato de litio)?
 UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
Reacciones redox: Se llama así a aquellos cambios químicos en que se verifica pérdida o ganancia de electrones
 Guía de actividades Nº 4 Reacciones redox: Se llama así a aquellos cambios químicos en que se verifica pérdida o ganancia de electrones Las reacciones redox o de óxido-reducción son aquellas donde hay
Guía de actividades Nº 4 Reacciones redox: Se llama así a aquellos cambios químicos en que se verifica pérdida o ganancia de electrones Las reacciones redox o de óxido-reducción son aquellas donde hay
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 5 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 5 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio
EJERCICIOS RESUELTOS DE REDOX
 EJERCICIOS RESUELTOS DE REDOX 1. Al hacer reaccionar cobre metálico con ácido nítrico diluido se obtiene monóxido de nitrógeno y nitrato de cobre (II). Plantee, iguale y complete la ecuación redox correspondiente,
EJERCICIOS RESUELTOS DE REDOX 1. Al hacer reaccionar cobre metálico con ácido nítrico diluido se obtiene monóxido de nitrógeno y nitrato de cobre (II). Plantee, iguale y complete la ecuación redox correspondiente,
Logros. Crecimiento bacteriano. Crecimiento. Finalidad de las bacterias
 Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Tema 10: Oxidación-reduccción
 Tema 10: Oxidación-reduccción Francisco García Calvo-Flores Contents 21-1 Electrode Potentials and Their Measurement 21-2 Standard Electrode Potentials 21-3 E cell, ΔG, and K eq 21-4 E cell as a Function
Tema 10: Oxidación-reduccción Francisco García Calvo-Flores Contents 21-1 Electrode Potentials and Their Measurement 21-2 Standard Electrode Potentials 21-3 E cell, ΔG, and K eq 21-4 E cell as a Function
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD
 TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
REACCIONES DE OXIDACIÓN-REDUCCIÓN
 10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: Y ESTEQUIOMETRÍA 1.-/ Iguale por el método del ion-electrón la ecuación: Cu + HNO 3 Cu(NO 3 ) 2 + NO + H 2 O, correspondiente a la reacción del cobre con el ácido
REACCIONES DE TRANSFERENCIA DE ELECTRONES: Y ESTEQUIOMETRÍA 1.-/ Iguale por el método del ion-electrón la ecuación: Cu + HNO 3 Cu(NO 3 ) 2 + NO + H 2 O, correspondiente a la reacción del cobre con el ácido
Tema 10: Importancia del potencial redox en la biogeoquímica de los ecosistemas acuáticos
 Tema 10: Importancia del potencial redox en la biogeoquímica de los ecosistemas acuáticos Salvador Sánchez Carrillo Departamento de Biogeoquímica y Ecología Microbiana Museo Nacional de Ciencias Naturales-CSIC
Tema 10: Importancia del potencial redox en la biogeoquímica de los ecosistemas acuáticos Salvador Sánchez Carrillo Departamento de Biogeoquímica y Ecología Microbiana Museo Nacional de Ciencias Naturales-CSIC
Métodos de tratamiento
 Métodos de tratamiento Qué es el tratamiento del agua? Es someter al liquido a una serie procedimientos, que en el ámbito de la ingeniería de procesos se denominan operaciones y procesos unitarios, los
Métodos de tratamiento Qué es el tratamiento del agua? Es someter al liquido a una serie procedimientos, que en el ámbito de la ingeniería de procesos se denominan operaciones y procesos unitarios, los
CLASE Nº 4 Reacciones REDOX
 UNIVERIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOÉ DE UCRE VICERRECTORADO BARQUIIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLAE Nº Reacciones REDOX 1 Reacciones de oxido reducción:
UNIVERIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOÉ DE UCRE VICERRECTORADO BARQUIIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLAE Nº Reacciones REDOX 1 Reacciones de oxido reducción:
Material de apoyo elaborado por Gustavo Garduño Sánchez Facultad de Química, UNAM. Enero de 2005.
 BALANCEO DE REACCIONES REDOX Material de apoyo elaborado por Gustavo Garduño Sánchez Facultad de Química, UNAM. Enero de 2005. Este trabajo se hizo con el fin de que los alumnos de QUÍMICA GENERAL cuenten
BALANCEO DE REACCIONES REDOX Material de apoyo elaborado por Gustavo Garduño Sánchez Facultad de Química, UNAM. Enero de 2005. Este trabajo se hizo con el fin de que los alumnos de QUÍMICA GENERAL cuenten
Curso Hidrogeoquímica para Dummies
 Curso Hidrogeoquímica para Dummies Sesión 10 Componentes del Agua Subterránea www.gidahatari.com Cuando una especie iónica se encuentra en concentraciones superiores a 1mg/L se le denomina Especie Iónica
Curso Hidrogeoquímica para Dummies Sesión 10 Componentes del Agua Subterránea www.gidahatari.com Cuando una especie iónica se encuentra en concentraciones superiores a 1mg/L se le denomina Especie Iónica
Tema 15: Equilibrio óxido-reducción Reacciones de oxidación-reducción (redox)
 : Equilibrio óxido-reducción 15.1 Reacciones de oxidación-reducción 15.2 Ajuste de reacciones redox: método del ión-electrón 15.3 Volumetrías redox. Indicadores. 15.4 Energía eléctrica asociada a procesos
: Equilibrio óxido-reducción 15.1 Reacciones de oxidación-reducción 15.2 Ajuste de reacciones redox: método del ión-electrón 15.3 Volumetrías redox. Indicadores. 15.4 Energía eléctrica asociada a procesos
PRACTICA No. 6 OXIDO REDUCCION I
 1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 6 OXIDO REDUCCION I INTRODUCCION: El
1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 6 OXIDO REDUCCION I INTRODUCCION: El
DESINFECCION. Eliminación de los microorganismos presentes en el agua.
 DESINFECCION Eliminación de los microorganismos presentes en el agua. DESINFECCION Eliminación de los microorganismos no deseados presentes en el agua. DESINFECCION Agua Potable: Eliminación de microorganismos
DESINFECCION Eliminación de los microorganismos presentes en el agua. DESINFECCION Eliminación de los microorganismos no deseados presentes en el agua. DESINFECCION Agua Potable: Eliminación de microorganismos
Selección de plantas de tratamiento de agua residual
 RALCEA: Eje Calidad de Agua y Saneamiento Curso Tecnologías de Tratamiento de Aguas Residuales para Reuso Módulo 1: Sistemas de Tratamiento de Aguas Residuales y Reuso Selección de plantas de tratamiento
RALCEA: Eje Calidad de Agua y Saneamiento Curso Tecnologías de Tratamiento de Aguas Residuales para Reuso Módulo 1: Sistemas de Tratamiento de Aguas Residuales y Reuso Selección de plantas de tratamiento
UBICACIÓN GEOGRÁFICA
 UBICACIÓN GEOGRÁFICA Minera Aurífera Retamas S.A. MARSA dedicada a la actividad minera subterránea, está ubicada en: Departamento: La Libertad. Provincia : Pataz. Distrito : Parcoy. Altitud : 2950 a 4200
UBICACIÓN GEOGRÁFICA Minera Aurífera Retamas S.A. MARSA dedicada a la actividad minera subterránea, está ubicada en: Departamento: La Libertad. Provincia : Pataz. Distrito : Parcoy. Altitud : 2950 a 4200
A S I G N A T U R A S C O R R E L A T I V A S P R E C E D E N T E S
 UNVERSDAD NACONAL DEL SUR 1 DEPARTAMENTO DE: QUMCA PROGRAMA DE: QUMCA GENERAL BASCA H O R A S D E C L A S E P R O F E S O R R E S P O N S A B L E T E O R C A S P R A C T C A S Por semana Por cuatrimestre
UNVERSDAD NACONAL DEL SUR 1 DEPARTAMENTO DE: QUMCA PROGRAMA DE: QUMCA GENERAL BASCA H O R A S D E C L A S E P R O F E S O R R E S P O N S A B L E T E O R C A S P R A C T C A S Por semana Por cuatrimestre
C/ Fernando Poo 5 Madrid (Metro Delicias o Embajadores).
 Problema 1: Junio 2013-2014 OPCION A Z=3 = = Periodo 2, Grupo 1 =Litio=Li Z=18 = =Periodo 3, Grupo 18 =Argón=Ar Potencial de ionización: energía necesaria para arrancar un electrón de un átomo. El potencial
Problema 1: Junio 2013-2014 OPCION A Z=3 = = Periodo 2, Grupo 1 =Litio=Li Z=18 = =Periodo 3, Grupo 18 =Argón=Ar Potencial de ionización: energía necesaria para arrancar un electrón de un átomo. El potencial
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS ELIJA UNA DE LAS DOS OPCIONES QUÍMICA. CÓDIGO 114
 PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS. 2011 ELIJA UNA DE LAS DOS OPCIONES QUÍMICA. CÓDIGO 114 Opción A 1. Para la molécula CO 2 a) Represente su estructura de Lewis. (0,75 puntos)
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS. 2011 ELIJA UNA DE LAS DOS OPCIONES QUÍMICA. CÓDIGO 114 Opción A 1. Para la molécula CO 2 a) Represente su estructura de Lewis. (0,75 puntos)
KCl + KMnO 4 + H 2 SO 4 KHSO 4 + MnSO 4 + H 2 O +Cl 2
 QBT06Doc AJUSTE DE REACCIONES REDOX POR EL MÉTODO DEL ION ELECTRÓN El número de electrones implicado en la semirreacción de oxidación y en la de reducción es el mismo. KCl + KMnO + H SO KHSO + MnSO + H
QBT06Doc AJUSTE DE REACCIONES REDOX POR EL MÉTODO DEL ION ELECTRÓN El número de electrones implicado en la semirreacción de oxidación y en la de reducción es el mismo. KCl + KMnO + H SO KHSO + MnSO + H
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
Clase 4 Metabolismo bacteriano
 Clase 4 Metabolismo bacteriano Composición química de las bacterias. Fuentes de carbono y energía. Categorías nutricionales. Catabolismo y anabolismo. Reacciones de óxido-reducción, torre de electrones,
Clase 4 Metabolismo bacteriano Composición química de las bacterias. Fuentes de carbono y energía. Categorías nutricionales. Catabolismo y anabolismo. Reacciones de óxido-reducción, torre de electrones,
Estados de oxidación más frecuentes: SO 4. (+2), S o (0), H 2 S
 EL CICLO DEL AZUFRE CICLO DEL AZUFRE Reservorios: Agua de mar (2º anión más abundante) Sulfuros metálicos, azufre, sulfatos (yeso) Combustibles fósiles Biomasa Estados de oxidación más frecuentes: SO 4
EL CICLO DEL AZUFRE CICLO DEL AZUFRE Reservorios: Agua de mar (2º anión más abundante) Sulfuros metálicos, azufre, sulfatos (yeso) Combustibles fósiles Biomasa Estados de oxidación más frecuentes: SO 4
Equilibrio Químico. CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A.
 Equilibrio Químico CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A. Introducción Las reacciones químicas que se ha considerado hasta este punto se denominan irreversibles debido a que ellas proceden
Equilibrio Químico CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A. Introducción Las reacciones químicas que se ha considerado hasta este punto se denominan irreversibles debido a que ellas proceden
Tema 12 Termoquímica. Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad En qué dirección se produce? Reacciones Químicas
 Tema 1 Estequiometría Cuánto se produce? Cuánto reacciona? Tema 15 Equilibrio Cuándo se alcanza? Cómo modificarlo? Tema 12 Termoquímica Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad
Tema 1 Estequiometría Cuánto se produce? Cuánto reacciona? Tema 15 Equilibrio Cuándo se alcanza? Cómo modificarlo? Tema 12 Termoquímica Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad
2.- Enuncie los principios o reglas que controlan el llenado de los niveles de energía atómicos permitidos.
 BLOQUE PRIMERO 1.- Un compuesto contiene 85,7% de carbono y 14,3% de hidrógeno y la masa de la molécula del mismo es 42. Calcule la fórmula del compuesto sabiendo que la masa atómica del carbono. 2.- Enuncie
BLOQUE PRIMERO 1.- Un compuesto contiene 85,7% de carbono y 14,3% de hidrógeno y la masa de la molécula del mismo es 42. Calcule la fórmula del compuesto sabiendo que la masa atómica del carbono. 2.- Enuncie
REACCIONES DE TRANSFERENCIA DE ELECTRONES 2ºBACH
 1. Ajusta las siguientes reacciones redox, utilizando el método del ion electrón: a) HNO 3 + Cu Cu(NO 3 ) 2 + NO 2 + H 2 O b) K 2 Cr 2 O 7 +HI + HClO 4 Cr(ClO 4 ) 3 +I 2 +KClO 4 + H 2 O c) H 2 SO 4 + HI
1. Ajusta las siguientes reacciones redox, utilizando el método del ion electrón: a) HNO 3 + Cu Cu(NO 3 ) 2 + NO 2 + H 2 O b) K 2 Cr 2 O 7 +HI + HClO 4 Cr(ClO 4 ) 3 +I 2 +KClO 4 + H 2 O c) H 2 SO 4 + HI
, H 2 SO 4, HSO 4-. HClO 4, ClO 4-, H 2 O, H 3 O +, OH -, S =, H 2 S, HS -, NH 3, NH 4+, CO 3 =, HCO 3
 1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
SESIÓN 9. Nutrición celular OBJETIVO DE LA SESIÓN. Analizar los diferentes tipos de nutrición celular INTRODUCCIÓN
 SESIÓN 9. Nutrición celular OBJETIVO DE LA SESIÓN Analizar los diferentes tipos de nutrición celular INTRODUCCIÓN Una vez que hemos analizado las formas en las cuales se llevan a cabo las reacciones químicas
SESIÓN 9. Nutrición celular OBJETIVO DE LA SESIÓN Analizar los diferentes tipos de nutrición celular INTRODUCCIÓN Una vez que hemos analizado las formas en las cuales se llevan a cabo las reacciones químicas
Seminario de Química 2º Bachillerato LOGSE Unidad 0: Repaso Química 1º Bachillerato
 A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 8 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 8 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción B Reserva 3, Ejercicio
9. Reacciones de oxidación-reducción
 9. Reacciones oxidación-reducción Conceptos básicos. Contenidos Estado de oxidación; oxidación y reducción; semirreacción; ajuste de reacciones redox; valoraciones redox Electroquímica. Serie electromotriz:
9. Reacciones oxidación-reducción Conceptos básicos. Contenidos Estado de oxidación; oxidación y reducción; semirreacción; ajuste de reacciones redox; valoraciones redox Electroquímica. Serie electromotriz:
COLEGIO AGUSTINIANO CIUDAD SALITRE AREA DE CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL TALLER DE QUIMICA #1 CUARTO PERIODO 2015 GRADO NOVENO
 TALLER DE QUIMICA #1 TEMA: TALLER DE REPASO Y CLASIFICACIÓN DE REACCIONES QUÍMICAS 1. Escriba, clasifique y balancee las siguientes ecuaciones químicas que se describen en los siguientes procesos: A) Se
TALLER DE QUIMICA #1 TEMA: TALLER DE REPASO Y CLASIFICACIÓN DE REACCIONES QUÍMICAS 1. Escriba, clasifique y balancee las siguientes ecuaciones químicas que se describen en los siguientes procesos: A) Se
QUÍMICA Reactividad y equilibrio químico. Oxido - reducción. Tutora: Romina Saavedra
 QUÍMICA Reactividad y equilibrio químico Oxido - reducción Tutora: Romina Saavedra Balance de reacciones de óxido reducción Una reacción redox o de óxido reducción se caracteriza por la existencia de dos
QUÍMICA Reactividad y equilibrio químico Oxido - reducción Tutora: Romina Saavedra Balance de reacciones de óxido reducción Una reacción redox o de óxido reducción se caracteriza por la existencia de dos
Modelos matemáticos de sistemas acuáticos dinámicos \5\
 Modelos matemáticos de sistemas acuáticos dinámicos \5\ 5.3.3. Organismos acumuladores de fosfatos Algunos organismos pueden crecer en condiciones aerobias o anóxicas oxidando sustratos orgánicos almacenados
Modelos matemáticos de sistemas acuáticos dinámicos \5\ 5.3.3. Organismos acumuladores de fosfatos Algunos organismos pueden crecer en condiciones aerobias o anóxicas oxidando sustratos orgánicos almacenados
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
Determinación de la especiación química en solución acuosa
 Determinación de la especiación química en solución acuosa. Constantes de equilibrio, definiciones y nomenclatura. Diagramas de distribución de especies. 2. Métodos experimentales de determinación de constantes.
Determinación de la especiación química en solución acuosa. Constantes de equilibrio, definiciones y nomenclatura. Diagramas de distribución de especies. 2. Métodos experimentales de determinación de constantes.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
JUNIO FASE ESPECÍFICA. QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
HUMEDALES DE TRATAMIENTO DE DRENAJE DE MINA i. Todd Schrauf y Mark Smith
 i Todd Schrauf y Mark Smith Humedales de tratamiento se han demostrado como un método tecnológicamente factible y costo efectivo para tratar el drenaje ácido de roca y otras aguas cargadas con metales.
i Todd Schrauf y Mark Smith Humedales de tratamiento se han demostrado como un método tecnológicamente factible y costo efectivo para tratar el drenaje ácido de roca y otras aguas cargadas con metales.
ELECTROQUÍMICA. 1- Concepto de potencial normal. Electrodo de referencia
 ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
Universidad de Belgrano - Cátedra de Ecología - Dr. Jorge Deschamps y Lic. Morales-Yokobori
 Acidez y ph Conocimiento del problema de la lluvia ácida Lluvia ácida. Dispersión. Reacciones químicas. Origen de los reactivos. Alcances geográficos y efectos. Grande Lagos de Norteamérica, Selva Negra
Acidez y ph Conocimiento del problema de la lluvia ácida Lluvia ácida. Dispersión. Reacciones químicas. Origen de los reactivos. Alcances geográficos y efectos. Grande Lagos de Norteamérica, Selva Negra
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2009 PRIMERA PARTE
 1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
Estimados alumnos: Los esquemas en las páginas 14 a 17 son sólo ilustrativos y no necesitan ser memorizados. PARA MIS ALUMNOS DE Primero Medio
 Estimados alumnos: Los esquemas en las páginas 14 a 17 son sólo ilustrativos y no necesitan ser memorizados PARA MIS ALUMNOS DE Primero Medio 1 2 La fotosíntesis es el proceso que mantiene la vida en nuestro
Estimados alumnos: Los esquemas en las páginas 14 a 17 son sólo ilustrativos y no necesitan ser memorizados PARA MIS ALUMNOS DE Primero Medio 1 2 La fotosíntesis es el proceso que mantiene la vida en nuestro
Materiales recopilados por la Ponencia Provincial de Química para Selectividad TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
Capítulo 4. Reacciones orgánicas.
 apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría (II)
 1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
Química del Medio ambiente
 PARTE II. El agua Introducción Química del Medio ambiente Casi todas las formas de vida en la Tierra dependen del agua. Alrededor de un 97% del agua de nuestro planeta es agua de mar, por lo que no es
PARTE II. El agua Introducción Química del Medio ambiente Casi todas las formas de vida en la Tierra dependen del agua. Alrededor de un 97% del agua de nuestro planeta es agua de mar, por lo que no es
RESPIRACIÓN AEROBIA Y ANAEROBIA
 RESPIRACIÓN AEROBIA Y ANAEROBIA Las células llevan a cabo diversos procesos para mantener su funcionamiento normal, muchos de los cuales requieren energía. La respiración celular es una serie de reacciones
RESPIRACIÓN AEROBIA Y ANAEROBIA Las células llevan a cabo diversos procesos para mantener su funcionamiento normal, muchos de los cuales requieren energía. La respiración celular es una serie de reacciones
TEMA I: REACCIONES Y ESTEQUIOMETRIA
 TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
Sabías que los microbios ayudan a limpiar las aguas residuales? Oscar Monroy Universidad Autónoma Metropolitana
 Tratamiento de aguas residuales Sabías que los microbios ayudan a limpiar las aguas residuales? Oscar Monroy Universidad Autónoma Metropolitana Objetivos Conocer la naturaleza de las aguas residuales y
Tratamiento de aguas residuales Sabías que los microbios ayudan a limpiar las aguas residuales? Oscar Monroy Universidad Autónoma Metropolitana Objetivos Conocer la naturaleza de las aguas residuales y
FERMENTACIONES Y METANOGENESIS
 CUARTA PARTE EN PROCESOS DE FERMENTACION, energía de sustratos orgánicos es transferida a ATP exclusivamente por fosforilación a nivel de sustrato. Como las fermentaciones no requieren de oxígeno y éstas
CUARTA PARTE EN PROCESOS DE FERMENTACION, energía de sustratos orgánicos es transferida a ATP exclusivamente por fosforilación a nivel de sustrato. Como las fermentaciones no requieren de oxígeno y éstas
CAMBIOS QUÍMICOS ACTIVIDADES DE REFUERZO ACTIVIDADES FICHA 1
 FICHA 1 DE REFUERZO 1. Escribe la fórmula y calcula la masa mo lecular de las siguientes sustancias: a) Dióxido de azufre. b) Hidruro de potasio. c) Ácido sulfúrico. d) Cloruro de berilio. 2. En un laboratorio
FICHA 1 DE REFUERZO 1. Escribe la fórmula y calcula la masa mo lecular de las siguientes sustancias: a) Dióxido de azufre. b) Hidruro de potasio. c) Ácido sulfúrico. d) Cloruro de berilio. 2. En un laboratorio
TRABAJO DE RECUPERACIÓN DEL SEGUNDO PARCIAL
 TRABAJO DE RECUPERACIÓN DEL SEGUNDO PARCIAL 2012-2013 ÁREA: QUÍMICA CURSO: PRIMERO DE BACHILLERATO NOMBRE: INDICACIONES GENERALES: El trabajo deberá ser entregado en una carpeta. Si imprime deberá modificar
TRABAJO DE RECUPERACIÓN DEL SEGUNDO PARCIAL 2012-2013 ÁREA: QUÍMICA CURSO: PRIMERO DE BACHILLERATO NOMBRE: INDICACIONES GENERALES: El trabajo deberá ser entregado en una carpeta. Si imprime deberá modificar
ELECTROQUÍMICA. 1. Conceptos de oxidación-reducción
 ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
Electroquímica (I) Procesos redox. Conceptos básicos. Ajuste de ecuaciones
 Electroquímica (I). Conceptos básicos. Ajuste de ecuaciones Denominamos corriente eléctrica a un flujo de cargas eléctricas que circulan entre dos puntos conectados físicamente mediante un material conductor.
Electroquímica (I). Conceptos básicos. Ajuste de ecuaciones Denominamos corriente eléctrica a un flujo de cargas eléctricas que circulan entre dos puntos conectados físicamente mediante un material conductor.
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO
 PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
Características y usos de los diagramas de Pourbaix
 Características y usos de los diagramas de Pourbaix Apellidos, nombre Muñoz Portero, María José (mjmunoz@iqn.upv.es) Departamento Centro Ingeniería Química y Nuclear Escuela Técnica Superior de Ingenieros
Características y usos de los diagramas de Pourbaix Apellidos, nombre Muñoz Portero, María José (mjmunoz@iqn.upv.es) Departamento Centro Ingeniería Química y Nuclear Escuela Técnica Superior de Ingenieros
6. Cuál es el número total de átomos en 0,100 mol de [ Pt (NH 3 ) 2 Cl 2 ]? A. 11 B. 6,02 x 10 22 C. 3,01 x 10 23 D. 6,62 x 10 23
![6. Cuál es el número total de átomos en 0,100 mol de [ Pt (NH 3 ) 2 Cl 2 ]? A. 11 B. 6,02 x 10 22 C. 3,01 x 10 23 D. 6,62 x 10 23 6. Cuál es el número total de átomos en 0,100 mol de [ Pt (NH 3 ) 2 Cl 2 ]? A. 11 B. 6,02 x 10 22 C. 3,01 x 10 23 D. 6,62 x 10 23](/thumbs/20/396963.jpg) 1. Cuál contiene mayor número de iones? A. 1 mol de Al 2 (SO 4 ) 3 B. 1 mol de Mg 3 (PO 4 ) 2 C. 2 moles de K 3 PO 4 D. 3 moles de NaNO 3 2. Cuántos átomos hay en 0,10 mol de PtCl 2 (NH 3 ) 2? A. 6,0 x
1. Cuál contiene mayor número de iones? A. 1 mol de Al 2 (SO 4 ) 3 B. 1 mol de Mg 3 (PO 4 ) 2 C. 2 moles de K 3 PO 4 D. 3 moles de NaNO 3 2. Cuántos átomos hay en 0,10 mol de PtCl 2 (NH 3 ) 2? A. 6,0 x
CATABOLISMO DE GLÚCIDOS.
 CATABOLISMO DE GLÚCIDOS. El Catabolismo de glúcidos consiste en reacciones de oxidación de monosacáridos y consta de los siguientes procesos: 1. Glucólisis. 2. Respiración celular. Respiración aerobia.
CATABOLISMO DE GLÚCIDOS. El Catabolismo de glúcidos consiste en reacciones de oxidación de monosacáridos y consta de los siguientes procesos: 1. Glucólisis. 2. Respiración celular. Respiración aerobia.
Identificación de Compuestos Formados Durante el Pre-tratamiento de la Calcopirita con NaCl-H 2 SO 4
 Identificación de Compuestos Formados Durante el Pre-tratamiento de la Calcopirita con NaCl-H 2 SO 4 Jorge Ipinza 1, Juan Ibáñez 1, Juan Flaquer 2 1 Universidad Técnica Federico Santa María 2 K+S Chile
Identificación de Compuestos Formados Durante el Pre-tratamiento de la Calcopirita con NaCl-H 2 SO 4 Jorge Ipinza 1, Juan Ibáñez 1, Juan Flaquer 2 1 Universidad Técnica Federico Santa María 2 K+S Chile
UNIVERSIDAD EMILIANO ZAPATA
 UNIVERSIDAD EMILIANO ZAPATA OBJETIVO DE LA MATERIA El estudiante describirá la importancia de la química en la ciencia y tecnología, a través del conocimiento de sus principios básicos, con el fin de explicar
UNIVERSIDAD EMILIANO ZAPATA OBJETIVO DE LA MATERIA El estudiante describirá la importancia de la química en la ciencia y tecnología, a través del conocimiento de sus principios básicos, con el fin de explicar
QUÍMICA. Solución: i. Reacción de reducción: la que presente el potencial estándar de reducción más alto. Si sólo escribe correctamente la ecuación.
 QUÍMICA OPCIÓN A 1. (2,5 puntos) Dispone de los pares redox (Cr 2 O 2-7 /Cr 3+ ) y (Ag + /Ag), cuyos potenciales estándar de reducción en medio ácido son, respectivamente, + 1,33 y + 0,80 V. Con ellos
QUÍMICA OPCIÓN A 1. (2,5 puntos) Dispone de los pares redox (Cr 2 O 2-7 /Cr 3+ ) y (Ag + /Ag), cuyos potenciales estándar de reducción en medio ácido son, respectivamente, + 1,33 y + 0,80 V. Con ellos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
