Cómo se corroe el acero en el agua marina?
|
|
|
- Javier Segura Díaz
- hace 7 años
- Vistas:
Transcripción
1 Cómo se corroe el acero en el agua marina? Para entender la protección catódica, primero debemos entender el mecanismo de corrosión. Para que ocurra corrosión, se deben cumplir tres condiciones. 1. Dos metales disimilares 2. Un electrolito (agua con algún tipo de sal o sales disueltas en ella) 3. Un trayecto metálico (conductor) entre los metales disimilares Los dos metales disimilares pueden ser aleaciones totalmente diferentes, como las de acero y aluminio, pero generalmente se trata más de diferencias metalúrgicas microscópicas o macroscópicas en la superficie de una pieza única de acero. Si existen las condiciones anteriores en la superficie metálica más activa (en este caso consideraremos el acero que se corroe libremente, el cual no es uniforme), la siguiente reacción ocurre en los sitios más activos (2 iones de hierro más 4 electrones libres): 2Fe => 2Fe e - Los electrones libres viajan a través del trayecto metálico hacia los sitios menos activos donde ocurre la siguiente reacción (Gas oxígeno convertido en ion oxígeno, al combinarse con los cuatro electrones libres, el cual se combina con agua para formar iones hidroxilo): O 2 + 4e - + 2H 2 0 => 4 OH - Las recombinaciones de estos iones en la superficie activa producen la siguiente reacción, la cual produce el producto de corrosión del hierro hidróxido ferroso. 2Fe + O 2 + 2H 2 O => 2Fe (OH) 2 Esta reacción se explica más comúnmente como flujo de corriente a través del agua desde el ánodo (lugar más activo) hacia el cátodo (lugar menos activo). Cómo la protección catódica detiene la corrosión? La protección catódica previene la corrosión al convertir todos los sitios anódicos (activos) de la superficie metálica en sitios catódicos (pasivos) mediante el suministro de corriente eléctrica (o electrones libres) desde una fuente alterna. Generalmente esto toma la forma de ánodos galvánicos que son más activos que el acero. Este método también se conoce como sistema de protección catódica por ánodos de sacrificio, ya que los ánodos galvánicos se sacrifican a sí mismos para proteger el acero estructural o la tubería de la corrosión. J. M. Arroyo Rosa Página 1
2 En el caso de los ánodos de aluminio, la reacción en la superficie de aluminio es (4 iones de aluminio más 12 electrones libres): 4Al => 4AL e - y en la superficie metálica (Gas oxígeno convertido en iones de oxígeno que se combinan con agua para formar iones hidroxilo): 3O e - + 6H 2 0 => 12OH - Siempre que la corriente (electrones libres) llegue al cátodo (acero) más rápido que el oxígeno, no se presenta corrosión. Figura 1: Sistema de protección catódica por ánodo de sacrificio en agua marina J. M. Arroyo Rosa Página 2
3 Consideraciones básicas para el diseño de sistemas de protección catódica por ánodos de sacrificio La corriente eléctrica que un ánodo descarga es controlada por la ley de Ohm, es decir: I=E/R Donde: I= Flujo de corriente en amperios E= Diferencia de potencial entre el ánodo y el cátodo en voltios R= Resistencia total del circuito en ohmios Inicialmente, la corriente será alta debido a que la diferencia de potencial entre el ánodo y el cátodo es alta, pero a medida que la diferencia de potencial disminuye debido al efecto del flujo de corriente hacia el cátodo, la corriente disminuye gradualmente debido a la polarización del cátodo. La resistencia del circuito incluye tanto el trayecto del agua como el trayecto del metal, incluido cualquier cable en el circuito. El valor dominante en este caso es la resistencia del ánodo al agua de mar. Para la mayoría de las aplicaciones, la resistencia del metal es tan reducida en comparación con la resistencia del agua que puede ignorarse. (Esto no se aplica para trineos o tuberías largas protegidas desde ambos extremos). En general, los ánodos largos y delgados tienen menor resistencia que los ánodos cortos y gruesos. Éstos descargarán más corriente, pero no durarán tanto tiempo. Por lo tanto, el diseñador de protección catódica debe determinar el tamaño de los ánodos de manera que tengan la forma y el área de superficie correctas para descargar suficiente corriente a fin de proteger la estructura, y el peso adecuado para durar el tiempo deseado cuando descarguen esta corriente. Como regla general: La Longitud del ánodo determina cuánta corriente puede producir y, por consiguiente, cuántos metros cuadrados de acero pueden protegerse. La sección transversal (peso) determina por cuánto tiempo el ánodo puede mantener este grado de protección. Sistemas de protección catódica por corriente impresa Debido a las altas corrientes involucradas en muchos sistemas de agua marina, no es inusual utilizar sistemas de corriente impresa. Los sistemas de corriente impresa utilizan una clase de ánodos que no se disuelven fácilmente en iones metálicos, sino que mantienen una reacción alternativa: la oxidación de los iones de cloruro disueltos. 2Cl - => Cl 2 + 2e - Una unidad externa de potencia de corriente directa suministra la corriente. J. M. Arroyo Rosa Página 3
4 Figura 2: Sistema de protección catódica de corriente impresa Cómo sabemos que tenemos suficiente protección catódica? Sabemos que tenemos o no suficiente corriente si comparamos el potencial del acero con el de un electrodo de referencia estándar, generalmente de plata/cloruro de plata (Ag/AgCl agua marina), pero algunas veces de zinc (Zn agua marina). El flujo de corriente en cualquier metal cambia su potencial normal en la dirección negativa. La experiencia ha demostrado que si el acero recibe suficiente corriente para cambiar el potencial a (-) V vs. plata/cloruro de plata, la corrosión esencialmente se detiene. J. M. Arroyo Rosa Página 4
5 Debido a la naturaleza de las películas que se forman, el potencial mínimo ( V) es rara vez el potencial óptimo, y los diseñadores intentan lograr un potencial entre (-) V y (-) V vs. Ag/AgCl agua marina. Figura 3: Medición del potencial de protección catódica (Sin protección a la izquierda Con protección a la derecha) temariosformativosprofesionales.wordpress.com Temariosformativos.foroactivo.com J. M. Arroyo Rosa Página 5
CORROSION. J. M. Arroyo Rosa Página 2
 CORROSION La corrosión es la interacción de un metal con el medio que lo rodea, produciendo el consiguiente deterioro en sus propiedades tanto físicas como químicas. La característica fundamental de este
CORROSION La corrosión es la interacción de un metal con el medio que lo rodea, produciendo el consiguiente deterioro en sus propiedades tanto físicas como químicas. La característica fundamental de este
Definición El fenómeno corrosión se define como el deterioro de los materiales a causa de alguna reacción con el medio ambiente en que son usados.
 Corrosión Definición El fenómeno corrosión se define como el deterioro de los materiales a causa de alguna reacción con el medio ambiente en que son usados. La corrosión es la destrucción lenta y progresiva
Corrosión Definición El fenómeno corrosión se define como el deterioro de los materiales a causa de alguna reacción con el medio ambiente en que son usados. La corrosión es la destrucción lenta y progresiva
Tema 22 Corrosión y degradación de los materiales.
 Tema 22 Corrosión y degradación de los materiales. Sabemos que los metales poseen electrones libres. Estos electrones son el resultado del tipo de enlace que existe entre los átomos metálicos. Los electrones
Tema 22 Corrosión y degradación de los materiales. Sabemos que los metales poseen electrones libres. Estos electrones son el resultado del tipo de enlace que existe entre los átomos metálicos. Los electrones
2.5 CORROSIÓN ELECTROQUÍMICA
 2.5 CORROSIÓN ELECTROQUÍMICA La corrosión es un proceso electroquímico en el cual un metal reacciona con su medio ambiente para formar óxido o algún otro compuesto. Este proceso está formado esencialmente
2.5 CORROSIÓN ELECTROQUÍMICA La corrosión es un proceso electroquímico en el cual un metal reacciona con su medio ambiente para formar óxido o algún otro compuesto. Este proceso está formado esencialmente
CORROSIÓN EN LA INDUSTRIA DE ALIMENTOS
 CORROSIÓN EN LA INDUSTRIA DE ALIMENTOS PARTE I 1. Introducción El acero inoxidable es utilizado extensamente en la fabricación de equipos de proceso en la industria de alimentos, por su resistencia mecánica,
CORROSIÓN EN LA INDUSTRIA DE ALIMENTOS PARTE I 1. Introducción El acero inoxidable es utilizado extensamente en la fabricación de equipos de proceso en la industria de alimentos, por su resistencia mecánica,
ANODOS DE SACRIFICIO ÁNODOS DE SACRIFICIO
 ANODOS DE SACRIFICIO Protección catódica galvánica para todo tipo de aplicaciones, tanto para protección interna como externa de estructuras metálicas, tanques, pilonas de pantalanes, etc. ÁNODOS DE SACRIFICIO
ANODOS DE SACRIFICIO Protección catódica galvánica para todo tipo de aplicaciones, tanto para protección interna como externa de estructuras metálicas, tanques, pilonas de pantalanes, etc. ÁNODOS DE SACRIFICIO
PRÁCTICA Nº 9 y 10 CORROSIÓN I
 PRÁCTICA Nº 9 y 10 CORROSIÓN I OBJETO DE LA PRÁCTICA: CONCEPTO DE ÁNODO Y CÁTODO APLICACIÓN A TRES REACCIONES REDOX CONCEPTO DE ENERGÍA ELÉCTRICA ASOCIADA A CAMBIOS QUÍMICOS Y VICEVERSA REACCIÓN ESPONTÁNEA
PRÁCTICA Nº 9 y 10 CORROSIÓN I OBJETO DE LA PRÁCTICA: CONCEPTO DE ÁNODO Y CÁTODO APLICACIÓN A TRES REACCIONES REDOX CONCEPTO DE ENERGÍA ELÉCTRICA ASOCIADA A CAMBIOS QUÍMICOS Y VICEVERSA REACCIÓN ESPONTÁNEA
CENTRO DE INVESTIGACIONES AVANZADAS EN TECNOLOGÍA DEL HORMIGÓN Córdoba - Argentina CORROSIÓN DEL ACERO
 CORROSIÓN DEL ACERO A nivel macroscópico el hormigón armado puede ser considerado como un material compuesto constituido por dos fases, hormigón y acero, entre las cuales existe, además, una interfase
CORROSIÓN DEL ACERO A nivel macroscópico el hormigón armado puede ser considerado como un material compuesto constituido por dos fases, hormigón y acero, entre las cuales existe, además, una interfase
TERMINALES DE CONEXIÓN PARA TOMA DE TIERRA Y SEGURIDAD
 TERMINALES DE CONEXIÓN PARA TOMA DE TIERRA Y SEGURIDAD La importancia de una conexión a tierra correcta en las instalaciones eléctricas La conexión de las instalaciones eléctricas a tierra es fundamental
TERMINALES DE CONEXIÓN PARA TOMA DE TIERRA Y SEGURIDAD La importancia de una conexión a tierra correcta en las instalaciones eléctricas La conexión de las instalaciones eléctricas a tierra es fundamental
Celdas Galvánicas y Electrolíticas
 Celdas Galvánicas y Electrolíticas Reacciones de óxido-reducción Reacciones en las cuales una o más de las sustancias intervinientes modifica su estado de oxidación. Znº (s) + Cu +2 (ac) Zn 2+ (ac) + Cuº
Celdas Galvánicas y Electrolíticas Reacciones de óxido-reducción Reacciones en las cuales una o más de las sustancias intervinientes modifica su estado de oxidación. Znº (s) + Cu +2 (ac) Zn 2+ (ac) + Cuº
Reacciones redox espontáneas
 Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
Tema 9: Electroquímica
 1.Dado el siguiente diagrama de una celda electroquímica: Pt(s) H 2 (g) H + (ac) Ag + (ac) Ag(s) Cual es la reacción global balanceada de la celda? A) 2H + (ac) + 2Ag + (ac) H 2 (g) + 2Ag(s) B) H 2 (g)
1.Dado el siguiente diagrama de una celda electroquímica: Pt(s) H 2 (g) H + (ac) Ag + (ac) Ag(s) Cual es la reacción global balanceada de la celda? A) 2H + (ac) + 2Ag + (ac) H 2 (g) + 2Ag(s) B) H 2 (g)
OXIDACIÓN Y CORROSIÓN. Julio Alberto Aguilar Schafer
 OXIDACIÓN Y CORROSIÓN Julio Alberto Aguilar Schafer Industria o sector Coste estimado (millones de libras) Ahorro potencial estimado (millones de libras) Construcción 250 ($190.000.000.000) 50 ($38.000.000.000)
OXIDACIÓN Y CORROSIÓN Julio Alberto Aguilar Schafer Industria o sector Coste estimado (millones de libras) Ahorro potencial estimado (millones de libras) Construcción 250 ($190.000.000.000) 50 ($38.000.000.000)
PROTECCIÓN CATÓDICA DEFINICIÒN. MECANISMOS DE CORROSION.
 DANIEL HIDALGO DEFINICIÒN. MECANISMOS DE CORROSION. Se entiende por corrosión, todo proceso electro-químico de degradación por oxidación-reducción de los materiales de construcción de tanques, tuberías
DANIEL HIDALGO DEFINICIÒN. MECANISMOS DE CORROSION. Se entiende por corrosión, todo proceso electro-químico de degradación por oxidación-reducción de los materiales de construcción de tanques, tuberías
UNIDAD 2. TRATAMIENTOS TÉRMICOS DE LOS ACEROS
 UNIDAD 2. TRATAMIENTOS TÉRMICOS DE LOS ACEROS 1. OXIDACIÓN... Pág. 29 2. CORROSIÓN... Pág. 34 2.1. Corrosión. Reacciones electroquímicas... Pág.34 2.2. Tipos de corrosión... Pág. 40 2.3. Medidas de protección
UNIDAD 2. TRATAMIENTOS TÉRMICOS DE LOS ACEROS 1. OXIDACIÓN... Pág. 29 2. CORROSIÓN... Pág. 34 2.1. Corrosión. Reacciones electroquímicas... Pág.34 2.2. Tipos de corrosión... Pág. 40 2.3. Medidas de protección
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca
 1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
Corrosion. Tecnología de los Materiales Metálicos
 Corrosion Tecnología de los Materiales Metálicos La causa principal de todas las reacciones entre los metales y el medio ambiente es una disminución de la energía libre del sistema como resultado de la
Corrosion Tecnología de los Materiales Metálicos La causa principal de todas las reacciones entre los metales y el medio ambiente es una disminución de la energía libre del sistema como resultado de la
CORROSION EN METALES. Ing. Lilian Eperjesi
 CORROSION EN METALES Qué es la Corrosión? La corrosión es la degradación que experimentan los materiales por la acción del medio que los rodea. Se puede hablar de corrosión en: - metales - hormigón - ladrillos
CORROSION EN METALES Qué es la Corrosión? La corrosión es la degradación que experimentan los materiales por la acción del medio que los rodea. Se puede hablar de corrosión en: - metales - hormigón - ladrillos
DE LA CORROSIÓN DE LOS METALES
 INTRODUCCI INTRODUCCIÓN N A LA CORROSIÓN N DEL HORMIGÓN N ARMADO Corrosión de los metales: QUÍMICO FÍSICA Principal proceso: OXIDACION Desde el punto de vista químico, es el aumento (en el sentido positivo)
INTRODUCCI INTRODUCCIÓN N A LA CORROSIÓN N DEL HORMIGÓN N ARMADO Corrosión de los metales: QUÍMICO FÍSICA Principal proceso: OXIDACION Desde el punto de vista químico, es el aumento (en el sentido positivo)
Me n+ + O 2- Me a O b
 4. CORROSION Oxidación Me n Me n+ a) Oxidación (con ausencia de humedad) b) Corrosión electroquímica (en ambiente corrosivo) O 2 + n O 2- Me n+ + O 2- Me a O b Fig 4-1 Velocidad de oxidación (dx/dt): temperatura
4. CORROSION Oxidación Me n Me n+ a) Oxidación (con ausencia de humedad) b) Corrosión electroquímica (en ambiente corrosivo) O 2 + n O 2- Me n+ + O 2- Me a O b Fig 4-1 Velocidad de oxidación (dx/dt): temperatura
QUÍMICA 2º Bachillerato Ejercicios: Electroquímica
 1(8) Ejercicio nº 1 Considera la reacción: Cu(s) + 2Ag + (aq) Cu +2 (aq) + 2Ag(s) a) Escribe las semirreacciones de oxidación y de reducción c) Escribe el esquema de la pila que se puede formar con dicha
1(8) Ejercicio nº 1 Considera la reacción: Cu(s) + 2Ag + (aq) Cu +2 (aq) + 2Ag(s) a) Escribe las semirreacciones de oxidación y de reducción c) Escribe el esquema de la pila que se puede formar con dicha
LA TRIBOCORROSIÓN Y SU DESGASTE EN LOS IMPLANTES
 Máster en Ingeniería Biomédica LA TRIBOCORROSIÓN Y SU DESGASTE EN LOS IMPLANTES Franciso Company Añón. Efraím Conejero Navarro. Fernando José Quevedo González. Diciembre 2010 Qué es la tribocorrosión?
Máster en Ingeniería Biomédica LA TRIBOCORROSIÓN Y SU DESGASTE EN LOS IMPLANTES Franciso Company Añón. Efraím Conejero Navarro. Fernando José Quevedo González. Diciembre 2010 Qué es la tribocorrosión?
RESUMEN DE ELECTROQUÍMICA 2ºBACH
 Toda reacción redox consiste en una transferencia de electrones desde la sustancia que se oxida (reductor)a la que se reduce (oxidante.) Una reacción redox espontánea permite obtener una corriente eléctrica.
Toda reacción redox consiste en una transferencia de electrones desde la sustancia que se oxida (reductor)a la que se reduce (oxidante.) Una reacción redox espontánea permite obtener una corriente eléctrica.
POTENCIOMETRIA KCL. Cl - CELDAS GALVANICAS DEPOSITO DE COBRE SOBRE UNA LAMINA DE ZINC CELDA GALVANICA POTENCIALES REDOX CELDA GALVANICA
 POTENCIOMETRIA TOPICOS: Celdas galvánicas Potenciales estándar de electrodo Ecuación de Nernst Electrodos de referencia: primario y secundario Medición de ph Celdas electrolíticas Titulaciones potenciométricas
POTENCIOMETRIA TOPICOS: Celdas galvánicas Potenciales estándar de electrodo Ecuación de Nernst Electrodos de referencia: primario y secundario Medición de ph Celdas electrolíticas Titulaciones potenciométricas
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
Unidad 6: ELECTROQUIMICA
 Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
OXIDACIÓN Y CORROSIÓN
 OXIDACIÓN Y CORROSIÓN Tecnología Industrial II Índice 1. OXIDACIÓN... 1 1.1. Velocidad de oxidación... 1 1.2. Protección contra la oxidación... 4 2. CORROSIÓN... 4 2.1. Reacciones electroquímicas... 4
OXIDACIÓN Y CORROSIÓN Tecnología Industrial II Índice 1. OXIDACIÓN... 1 1.1. Velocidad de oxidación... 1 1.2. Protección contra la oxidación... 4 2. CORROSIÓN... 4 2.1. Reacciones electroquímicas... 4
EQUIPO IONIZADOR DE LAS TOMAS DE MAR (ANTICORROSÓN E INCRUSTACIÓN)
 EQUIPO IONIZADOR DE LAS TOMAS DE MAR (ANTICORROSÓN E INCRUSTACIÓN) HUELTRIC, S.L. C\ Arqueólogo Garay de Anduaga, nº12 21004 Huelva España Tfno.: +34 959.252.671 Tfno. y Fax: +34 959.282.122 e-mail: hueltric@hueltric.es
EQUIPO IONIZADOR DE LAS TOMAS DE MAR (ANTICORROSÓN E INCRUSTACIÓN) HUELTRIC, S.L. C\ Arqueólogo Garay de Anduaga, nº12 21004 Huelva España Tfno.: +34 959.252.671 Tfno. y Fax: +34 959.282.122 e-mail: hueltric@hueltric.es
PILAS Y ELECTRÓLISIS. Foto: Gabriel Acquistapace
 PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
Paso 2: Escribir las correspondientes semireacciones sin ajustar y. Paso 3: Ajustar en cada semireacción todos los elementos a
 Tema 21 21.1. Reacciones de oxidación-reducción Química y electricidad 21.2. Celdas electroquímicas 21.3. Potencial de electrodo 1 2 21.1. Reacciones de oxidación-reducción (redox) Son reacciones de transferencia
Tema 21 21.1. Reacciones de oxidación-reducción Química y electricidad 21.2. Celdas electroquímicas 21.3. Potencial de electrodo 1 2 21.1. Reacciones de oxidación-reducción (redox) Son reacciones de transferencia
Navega fácilmente por el curso utilizando las flechas del teclado
 Navega fácilmente por el curso utilizando las flechas del teclado back Re Pág Av Pág next ó back next 1 GALVANIZADO DESCRIPCIÓN El galvanizado o galvanización es el proceso electroquímico por el cual se
Navega fácilmente por el curso utilizando las flechas del teclado back Re Pág Av Pág next ó back next 1 GALVANIZADO DESCRIPCIÓN El galvanizado o galvanización es el proceso electroquímico por el cual se
Tema: Electroquímica CÁTEDRA DE FISICOQUÍMICA
 Trabajo Práctico Tema: Electroquímica CÁTEDRA DE FISICOQUÍMICA UNIVERSIDAD TECNOLÓGICA NACIONAL Regional Rosario En el presente se desarrolla una propuesta de trabajo práctico para realizar con los estudiantes
Trabajo Práctico Tema: Electroquímica CÁTEDRA DE FISICOQUÍMICA UNIVERSIDAD TECNOLÓGICA NACIONAL Regional Rosario En el presente se desarrolla una propuesta de trabajo práctico para realizar con los estudiantes
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
Mantenimiento predictivo y correctivo de metales protección ante el desgaste, corrosión y degradación
 Mantenimiento predictivo y correctivo de metales protección ante el desgaste, corrosión y degradación Qué es la corrosión? Corrosión Es un fenómeno natural que ocurre a través del tiempo. Es un proceso
Mantenimiento predictivo y correctivo de metales protección ante el desgaste, corrosión y degradación Qué es la corrosión? Corrosión Es un fenómeno natural que ocurre a través del tiempo. Es un proceso
Cromato de Zinc. VENTAJAS: Tiene gran adherencia a muchos sustratos que son difíciles de recubrir con primarios convencionales.
 Cromato de Zinc DESCRIPCIÓN: Recubrimiento anticorrosivo mate, formulado a base de resina Alquidalicas, pigmentos anticorrosivos, cromato de zinc y solventes. Es un recubrimiento de alta calidad para mantenimiento
Cromato de Zinc DESCRIPCIÓN: Recubrimiento anticorrosivo mate, formulado a base de resina Alquidalicas, pigmentos anticorrosivos, cromato de zinc y solventes. Es un recubrimiento de alta calidad para mantenimiento
ELECTROQUÍMICA. 1- Concepto de potencial normal. Electrodo de referencia
 ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
GALVANIZADO DESCRIPCIÓN
 2 DESCRIPCIÓN El galvanizado o galvanización es el proceso electroquímico por el cual se puede cubrir un metal con otro. Se denomina galvanización pues este proceso se desarrolló a partir del trabajo de
2 DESCRIPCIÓN El galvanizado o galvanización es el proceso electroquímico por el cual se puede cubrir un metal con otro. Se denomina galvanización pues este proceso se desarrolló a partir del trabajo de
CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 1)
 M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 1) Cuando en una reacción química
M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 1) Cuando en una reacción química
ELECTRODO/JABALINA DE ALEACIÓN DE ZINC. Para Puesta a Tierra
 ELECTRODO/JABALINA DE ALEACIÓN DE ZINC Para Puesta a Tierra Electrodo especial de Aleación de Zinc SERTEC para mejorar la vida de las Tomas de Tierra eléctricas y electrónicas Por qué un electrodo especial?
ELECTRODO/JABALINA DE ALEACIÓN DE ZINC Para Puesta a Tierra Electrodo especial de Aleación de Zinc SERTEC para mejorar la vida de las Tomas de Tierra eléctricas y electrónicas Por qué un electrodo especial?
Serie de potenciales de reducción estándar
 Tabla 26 Cerámicas comunes usados en materiales compuestos de matriz cerámica Capítulo 9 Corrosión 1.9. Corrosión química y electroquímica 1.9.1. Serie de potenciales de reducción estándar 88 Tabla 27
Tabla 26 Cerámicas comunes usados en materiales compuestos de matriz cerámica Capítulo 9 Corrosión 1.9. Corrosión química y electroquímica 1.9.1. Serie de potenciales de reducción estándar 88 Tabla 27
MATERIALES ANODOS DE SACRIFICIO Ánodos de Magnesio
 De los metales empleados como ánodos de sacrificio, el magnesio es el que tiene el potencial de circulación más alto, por lo que es el que se suele emplear para proteger catódicamente el acero en electrolitos
De los metales empleados como ánodos de sacrificio, el magnesio es el que tiene el potencial de circulación más alto, por lo que es el que se suele emplear para proteger catódicamente el acero en electrolitos
Estado de oxidación (E.O.)
 Reacciones Redox Estado de oxidación (E.O.) Es la carga que tendría un átomo si todos sus enlaces fueran iónicos. En el caso de enlaces covalentes polares habría que suponer que la pareja de electrones
Reacciones Redox Estado de oxidación (E.O.) Es la carga que tendría un átomo si todos sus enlaces fueran iónicos. En el caso de enlaces covalentes polares habría que suponer que la pareja de electrones
Qué es la corrosión? Principio básico de la corrosión Ánodos y cátodos Proceso electroquímico electroquímico
 Qué es la corrosión? Principio básico de la corrosión Cuando un metal se expone a ciertas condiciones ambientales, tales como agua (incluyendo humedad), productos químicos (ácidos, cáusticos, sales), gases
Qué es la corrosión? Principio básico de la corrosión Cuando un metal se expone a ciertas condiciones ambientales, tales como agua (incluyendo humedad), productos químicos (ácidos, cáusticos, sales), gases
4. Un agente oxidante (2 correctas) A) Toma electrones de otra sustancia B) Da electrones a otra sustancia C) Se oxida D) Se reduce
 CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
Capítulo 19 Electroquímica
 Capítulo 19 Electroquímica En este capítulo se estudian los conceptos elaborados por la termodinámica para describir la conversión de energía química a energía eléctrica. Al terminar este capítulo, el
Capítulo 19 Electroquímica En este capítulo se estudian los conceptos elaborados por la termodinámica para describir la conversión de energía química a energía eléctrica. Al terminar este capítulo, el
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2001 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 001 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 001 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A
LA ELECTRÓLISIS DEL AGUA
 LA ELECTRÓLISIS DEL AGUA Oxidación: 2H + +O +4e - 2 O(l) 4H (aq) 2 (g) Reducción: 2H 2 O(l) + 2e - H 2 (g) + 2OH - (aq) Reacción total en la celda 2H 2 O(l) 2H 2 (g) + O 2 (g) Nota: Obsérvese la diferencia
LA ELECTRÓLISIS DEL AGUA Oxidación: 2H + +O +4e - 2 O(l) 4H (aq) 2 (g) Reducción: 2H 2 O(l) + 2e - H 2 (g) + 2OH - (aq) Reacción total en la celda 2H 2 O(l) 2H 2 (g) + O 2 (g) Nota: Obsérvese la diferencia
TEMA-11 Electroquímica
 QUÍMICA I TEMA-11 Electroquímica Tecnólogo en Minería 1 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos químicos 2 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos
QUÍMICA I TEMA-11 Electroquímica Tecnólogo en Minería 1 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos químicos 2 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos
Redox 3: Celdas electroquímicas 1
 V.Chan Celdas electroquímicas Celda electroquímica Representación simbólica de una celda Celda electroquímica: sistema en el cual se lleva a cabo una reacción redox que utiliza o consume corriente eléctrica.
V.Chan Celdas electroquímicas Celda electroquímica Representación simbólica de una celda Celda electroquímica: sistema en el cual se lleva a cabo una reacción redox que utiliza o consume corriente eléctrica.
Ejercicios de acceso a la Universidad Problemas de Electroquímica
 Ejercicios de acceso a la Universidad Problemas de Electroquímica 57 Dada la reacción en la que el ión permanganato [tetraoxomanganato(vii)] oxida, en medio ácido, al dióxido de azufre, obteniéndose ión
Ejercicios de acceso a la Universidad Problemas de Electroquímica 57 Dada la reacción en la que el ión permanganato [tetraoxomanganato(vii)] oxida, en medio ácido, al dióxido de azufre, obteniéndose ión
ELECTROQUÍMICA. 1. Conceptos de oxidación-reducción
 ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
TEMA 3: Equilibrios redox
 TEMA 3: Equilibrios redox Índice 1) Concepto potencial redox. 2) Pila galvánica. 3) Ecuación de Nernst. 4) Espontaneidad y equilibrio. 5) Influencia del ph en el potencial de electrodo. 6) Reacciones de
TEMA 3: Equilibrios redox Índice 1) Concepto potencial redox. 2) Pila galvánica. 3) Ecuación de Nernst. 4) Espontaneidad y equilibrio. 5) Influencia del ph en el potencial de electrodo. 6) Reacciones de
PILAS ELECTROQUIMICAS
 PILAS ELECTROQUIMICAS En las reacciones de redox existe una transferencia de electrones entre en dador (especie que se oxida) y un aceptor (especie que se reduce).esta transferencia de electrones desde
PILAS ELECTROQUIMICAS En las reacciones de redox existe una transferencia de electrones entre en dador (especie que se oxida) y un aceptor (especie que se reduce).esta transferencia de electrones desde
Celda de combustible AFC casera
 Propuesta de construcción de pila de pila AFC casera: Se trata de conseguir producir la reacción electroquímica de manera económica y sencilla para obtener energía a partir de hidrógeno y oxígeno. Para
Propuesta de construcción de pila de pila AFC casera: Se trata de conseguir producir la reacción electroquímica de manera económica y sencilla para obtener energía a partir de hidrógeno y oxígeno. Para
Componentes del Termo Eléctrico
 Componentes del Termo Eléctrico 1. Chapa de acero prepintada. 2. Aislamiento en poliuretano expandido. 3. Calderín vitrificado a 850ºC para evitar la corrosión. 4. Ánodo de protección del calderín. 5.
Componentes del Termo Eléctrico 1. Chapa de acero prepintada. 2. Aislamiento en poliuretano expandido. 3. Calderín vitrificado a 850ºC para evitar la corrosión. 4. Ánodo de protección del calderín. 5.
La corrosión. Fe(s) Fe+2(ac) + 2e
 La corrosión Los materiales están expuestos continuamente a los más diversos ambientes de interacción material-ambiente provoca, en muchos casos, la pérdida o deterioro de las propiedades físicas del material.corrosión
La corrosión Los materiales están expuestos continuamente a los más diversos ambientes de interacción material-ambiente provoca, en muchos casos, la pérdida o deterioro de las propiedades físicas del material.corrosión
REACCIONES DE TRANSFERENCIA DE ELECTRONES (electrolisis)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (electrolisis) 1 2 Electrólisis Aplicando una f.e.m. adecuada se puede conseguir que tenga lugar una reacción redox en el sentido que no es espontánea. En una
REACCIONES DE TRANSFERENCIA DE ELECTRONES (electrolisis) 1 2 Electrólisis Aplicando una f.e.m. adecuada se puede conseguir que tenga lugar una reacción redox en el sentido que no es espontánea. En una
Electroquímica. Potenciales Electroquímicos
 Electroquímica Potenciales Electroquímicos Celdas Electroquímicas Una celda electroquímica consiste de dos electrodos en contacto con un electrolito. Un electrodo con su electrolito forman el compartimento
Electroquímica Potenciales Electroquímicos Celdas Electroquímicas Una celda electroquímica consiste de dos electrodos en contacto con un electrolito. Un electrodo con su electrolito forman el compartimento
Electroquímic a a tu alcance
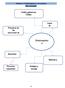 Práctica 2. Electroquímica a tu alcance Mapa conceptual Celdas galvánicas Celdas electroquímicas Principios de las reacciones de óxido reducción Leyes de Faraday Electroquímic a a tu alcance Electrólisi
Práctica 2. Electroquímica a tu alcance Mapa conceptual Celdas galvánicas Celdas electroquímicas Principios de las reacciones de óxido reducción Leyes de Faraday Electroquímic a a tu alcance Electrólisi
MINI - EQUIPO ANTINCRUSTACION Y ANTICORROSION PARA TOMAS DE MAR Y TUBERIAS
 JUNIO 2005 PROTECCION CATODICA (C.I.) DE PEQUEÑAS EMBARCACIONES S.L. MINI - EQUIPO ANTINCRUSTACION Y ANTICORROSION PARA TOMAS DE MAR Y TUBERIAS OBJETIVOS: El primero es matar los organismos marinos que
JUNIO 2005 PROTECCION CATODICA (C.I.) DE PEQUEÑAS EMBARCACIONES S.L. MINI - EQUIPO ANTINCRUSTACION Y ANTICORROSION PARA TOMAS DE MAR Y TUBERIAS OBJETIVOS: El primero es matar los organismos marinos que
QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS
 1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
CATALOGO PARA ANODOS DE ZINC GALVANOPLASTIA
 CATALOGO PARA ANODOS DE ZINC GALVANOPLASTIA Es un proceso en el cual, por medio de la electricidad se deposita un metal sobre otro. Se dimana la corriente eléctrica de las placas sumergidas (ANODOS) hacia
CATALOGO PARA ANODOS DE ZINC GALVANOPLASTIA Es un proceso en el cual, por medio de la electricidad se deposita un metal sobre otro. Se dimana la corriente eléctrica de las placas sumergidas (ANODOS) hacia
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
TEMA 10 Corrosión Electroquímica
 TEMA 10 Corrosión Electroquímica ÍNDICE 1. Fundamentos de Corrosión 2. Corrosión electroquímica 3. Pilas de corrosión 4. Influencia de las heterogeneidades 5. Cinética de Corrosión 6. Métodos de Protección
TEMA 10 Corrosión Electroquímica ÍNDICE 1. Fundamentos de Corrosión 2. Corrosión electroquímica 3. Pilas de corrosión 4. Influencia de las heterogeneidades 5. Cinética de Corrosión 6. Métodos de Protección
ELECTRÓNICA BÁSICA UNIDAD DIDÁCTICA SEGUNDO PERIODO ( PERIODO 2)
 ELECTRÓNICA BÁSICA UNIDAD DIDÁCTICA SEGUNDO PERIODO ( PERIODO 2) CONTENIDO Simbología General. Conceptos y descripción de elementos eléctricos y electrónicos. Conceptos de Voltaje, corriente, Resistencia
ELECTRÓNICA BÁSICA UNIDAD DIDÁCTICA SEGUNDO PERIODO ( PERIODO 2) CONTENIDO Simbología General. Conceptos y descripción de elementos eléctricos y electrónicos. Conceptos de Voltaje, corriente, Resistencia
Actividad de Química: Electroquímica Celdas Galvánicas Guía del Estudiante
 Actividad de Química: Electroquímica Celdas Galvánicas Guía del Estudiante Objetivos: Los estudiantes serán capaces de Definir oxidación y reducción en términos de pérdida o ganancia de electrones. Describir
Actividad de Química: Electroquímica Celdas Galvánicas Guía del Estudiante Objetivos: Los estudiantes serán capaces de Definir oxidación y reducción en términos de pérdida o ganancia de electrones. Describir
Electroquímica. Prof. Leadina Sánchez B
 Electroquímica Unidad IV Prof. Leadina Sánchez B Baterías Aplicaciones de la Electroquímica Células de combustibles como fuente de energía eléctrica. Obtención de productos químicos clave. (Na y Cl2, a
Electroquímica Unidad IV Prof. Leadina Sánchez B Baterías Aplicaciones de la Electroquímica Células de combustibles como fuente de energía eléctrica. Obtención de productos químicos clave. (Na y Cl2, a
Programa Nacional de Formación en Mecánica Trayecto I Prof. Charles Delgado Marzo 2016
 Programa Nacional de Formación en Mecánica Trayecto I Prof. Charles Delgado Marzo 2016 Desarrollar los principios y teorías relacionadas con la energía eléctrica, respondiendo a interrogantes como: qué
Programa Nacional de Formación en Mecánica Trayecto I Prof. Charles Delgado Marzo 2016 Desarrollar los principios y teorías relacionadas con la energía eléctrica, respondiendo a interrogantes como: qué
OXIDACIÓN-REDUCCIÓN. PAU-tipos de problemas
 OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (III)
 LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (III) Se va a presentar la electrólisis de sales de elementos del mismo grupo (el 12), con diferentes aniones a fin de observar la electrodeposición de estos metales.
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (III) Se va a presentar la electrólisis de sales de elementos del mismo grupo (el 12), con diferentes aniones a fin de observar la electrodeposición de estos metales.
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO.
 LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
CORROSIÓN CORROSIÓN: DEFINICIÓN & EJEMPLOS
 CORROSIÓN 1 CORROSIÓN: DEFINICIÓN & EJEMPLOS - Corrosión es el ataque destructivo de un metal por reacción química o electroquímica con su medio ambiente - Es la transformación indeseable de un material
CORROSIÓN 1 CORROSIÓN: DEFINICIÓN & EJEMPLOS - Corrosión es el ataque destructivo de un metal por reacción química o electroquímica con su medio ambiente - Es la transformación indeseable de un material
Capítulo 4: Circuitos de corriente continua
 Capítulo 4: Circuitos de corriente continua Corriente promedio: carga que pasa por A por unidad de tiempo Corriente Instantánea [ I ] = C/s = A (Ampere) J = q n v d Ley de Ohm George Simon Ohm (1789-1854)
Capítulo 4: Circuitos de corriente continua Corriente promedio: carga que pasa por A por unidad de tiempo Corriente Instantánea [ I ] = C/s = A (Ampere) J = q n v d Ley de Ohm George Simon Ohm (1789-1854)
Tecnólogo en Minería Química I. PRÁCTICO DE LABORATORIO Reacciones Redox
 Tecnólogo en Minería Química I PRÁCTICO DE LABORATORIO Reacciones Redox I. INTRODUCCIÓN Las reacciones redox se encuentran entre las reacciones más comunes. Son aquellas que involucran la transferencia
Tecnólogo en Minería Química I PRÁCTICO DE LABORATORIO Reacciones Redox I. INTRODUCCIÓN Las reacciones redox se encuentran entre las reacciones más comunes. Son aquellas que involucran la transferencia
Efectos de corrosión y acumulación de residuos solidos en las superficies de contactos electrónicos
 Efectos de corrosión y acumulación de residuos solidos en las superficies de contactos electrónicos 1. Que es la corrosión? 2. Qué causa la corrosión en los equipos electrónicos? 3. Tipos de corrosión
Efectos de corrosión y acumulación de residuos solidos en las superficies de contactos electrónicos 1. Que es la corrosión? 2. Qué causa la corrosión en los equipos electrónicos? 3. Tipos de corrosión
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
QUÉ ES LA VELOCIDAD DE CORROSIÓN?
 INTRODUCCIÓN A LA CORROSIÓN DEL HORMIGÓN ARMADO 2 Velocidad de corrosión Ensayos para detectar el grado de corrosión de las armaduras Variación del diámetro (técnica medida de dimensiones) QUÉ ES LA VELOCIDAD
INTRODUCCIÓN A LA CORROSIÓN DEL HORMIGÓN ARMADO 2 Velocidad de corrosión Ensayos para detectar el grado de corrosión de las armaduras Variación del diámetro (técnica medida de dimensiones) QUÉ ES LA VELOCIDAD
PROTECCIÓN DE MATERIALES PROTECCIÓN ANÓDICA. Carlos A. Giudice y Andrea M. Pereyra
 PROTECCIÓN DE MATERIALES PROTECCIÓN ANÓDICA Carlos A. Giudice y Andrea M. Pereyra Introducción: -La protección anódica es un método que consiste en recubrir un metal con una fina capa de oxido para que
PROTECCIÓN DE MATERIALES PROTECCIÓN ANÓDICA Carlos A. Giudice y Andrea M. Pereyra Introducción: -La protección anódica es un método que consiste en recubrir un metal con una fina capa de oxido para que
MATERIALES DE ING. QUÍMICA
 MATERIALES DE ING. QUÍMICA Los metales industriales no ferrosos y sus aleaciones son, en general, resistentes a la oxidación y corrosión atmosférica. Pero esta no es la única buena cualidad que los hace
MATERIALES DE ING. QUÍMICA Los metales industriales no ferrosos y sus aleaciones son, en general, resistentes a la oxidación y corrosión atmosférica. Pero esta no es la única buena cualidad que los hace
Problemas de electrolisis. Resueltos
 Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
ESTRUCTURA DE LOS ATOMOS Ing. Alfredo Luis Rojas B.
 CAPITULO 4 ESTRUCTURA DE LOS ATOMOS Ing. Alfredo Luis Rojas B. Aproximadamente 400 a.c. el filosofo griego Democrito sugirió que toda la materia esta formada por partículas minúsculas, discretas e indivisibles,
CAPITULO 4 ESTRUCTURA DE LOS ATOMOS Ing. Alfredo Luis Rojas B. Aproximadamente 400 a.c. el filosofo griego Democrito sugirió que toda la materia esta formada por partículas minúsculas, discretas e indivisibles,
Tratamientos superficiales - Materiales Aeronáuticos
 Muchas piezas pueden ser tratadas superficialmente con el objeto de protegerlas de la corrosión u otorgarles propiedades de dureza o resistencia al desgaste a ciertas necesidades. En muchos casos éstos
Muchas piezas pueden ser tratadas superficialmente con el objeto de protegerlas de la corrosión u otorgarles propiedades de dureza o resistencia al desgaste a ciertas necesidades. En muchos casos éstos
CIRCUITOS ELECTRICOS, COMPONENTES ELECTRÓNICOS, Y APARATOS DE MEDIDA
 CIRCUITOS ELECTRICOS, COMPONENTES ELECTRÓNICOS, Y APARATOS DE MEDIDA Joaquín Agulló Roca 3º ESO CIRCUITOS ELECTRICOS MAGNITUDES ELECTRICAS La carga eléctrica (q) de un cuerpo expresa el exceso o defecto
CIRCUITOS ELECTRICOS, COMPONENTES ELECTRÓNICOS, Y APARATOS DE MEDIDA Joaquín Agulló Roca 3º ESO CIRCUITOS ELECTRICOS MAGNITUDES ELECTRICAS La carga eléctrica (q) de un cuerpo expresa el exceso o defecto
A.- Electrones fluyendo por un buen conductor eléctrico, que ofrece baja resistencia.
 DEPARTAMENTO DE ORIENTACIÓN: TECNOLOGÍA 4E_F Primer trimestre Curso: 2014/2015 TEMA II: ELECTRICIDAD Y ELECTRÓNICA La electrónica forma parte de nuestra vida cotidiana.- Los electrodomésticos, los medios
DEPARTAMENTO DE ORIENTACIÓN: TECNOLOGÍA 4E_F Primer trimestre Curso: 2014/2015 TEMA II: ELECTRICIDAD Y ELECTRÓNICA La electrónica forma parte de nuestra vida cotidiana.- Los electrodomésticos, los medios
Unidad 5 PROTECCIÓN CATÓDICA INGENIERÍA QUÍMICA. Dr. Ricardo Orozco Cruz. Instituto de Ingeniería Universidad Veracruzana
 Unidad 5 PROTECCIÓN CATÓDICA INGENIERÍA QUÍMICA Dr. Ricardo Orozco Cruz Instituto de Ingeniería Universidad Veracruzana Dr. Ricardo Orozco Cruz Unidad AntiCorrosión - II - UV Optativa: Corrosión III Control
Unidad 5 PROTECCIÓN CATÓDICA INGENIERÍA QUÍMICA Dr. Ricardo Orozco Cruz Instituto de Ingeniería Universidad Veracruzana Dr. Ricardo Orozco Cruz Unidad AntiCorrosión - II - UV Optativa: Corrosión III Control
ELECTROLISIS. QUÍMICA 2º bachillerato. 29/05/201
 ELECTROLISIS QUÍMICA 2º bachillerato 29/05/201 www.profesorjano.org www.profesorjano.com www.profesorjano.info 1 ESQUEMA GENERAL Definición - Diferencias con una pila (1) Descripción cualitativa: Electrolisis
ELECTROLISIS QUÍMICA 2º bachillerato 29/05/201 www.profesorjano.org www.profesorjano.com www.profesorjano.info 1 ESQUEMA GENERAL Definición - Diferencias con una pila (1) Descripción cualitativa: Electrolisis
Pilas electrolíticas
 Pilas electrolíticas Apellidos, nombre Departamento Centro Atienza Boronat, Mª Julia (matien@qim.upv.es) Herrero Villén, Mª Asunción (maherrero@qim.upv.es) Morais Ezquerro, Sergi B. (smorais@qim.upv.es)
Pilas electrolíticas Apellidos, nombre Departamento Centro Atienza Boronat, Mª Julia (matien@qim.upv.es) Herrero Villén, Mª Asunción (maherrero@qim.upv.es) Morais Ezquerro, Sergi B. (smorais@qim.upv.es)
QUÍMICA Reactividad y equilibrio químico. Oxido - reducción. Tutora: Romina Saavedra
 QUÍMICA Reactividad y equilibrio químico Oxido - reducción Tutora: Romina Saavedra Balance de reacciones de óxido reducción Una reacción redox o de óxido reducción se caracteriza por la existencia de dos
QUÍMICA Reactividad y equilibrio químico Oxido - reducción Tutora: Romina Saavedra Balance de reacciones de óxido reducción Una reacción redox o de óxido reducción se caracteriza por la existencia de dos
7. Práctica 5: Celdas galvánicas.
 7. Práctica 5: Celdas galvánicas. 7.1. Fundamento teórico En esta práctica se construirán varias celdas voltaicas o galvánicas, a partir de dos semiceldas y de las conexiones apropiadas (circuito externo
7. Práctica 5: Celdas galvánicas. 7.1. Fundamento teórico En esta práctica se construirán varias celdas voltaicas o galvánicas, a partir de dos semiceldas y de las conexiones apropiadas (circuito externo
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva,
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
TÉCNICAS DE MUESTREO, ANÁLISIS E INTERPRETACIÓN DE DATOS. Ingeniería Ambiental
 TÉCNICAS DE MUESTREO, ANÁLISIS E INTERPRETACIÓN DE DATOS Ingeniería Ambiental Problema Elección del método analítico Toma de muestra Tratamiento de la muestra Proceso de medida Tratamiento de los datos
TÉCNICAS DE MUESTREO, ANÁLISIS E INTERPRETACIÓN DE DATOS Ingeniería Ambiental Problema Elección del método analítico Toma de muestra Tratamiento de la muestra Proceso de medida Tratamiento de los datos
OXIDACIÓN REDUCCIÓN QCA 09 ANDALUCÍA
 OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
MATERIALES INDUSTRIALES II. Capitulo 4 CORROSION
 MATERIALES INDUSTRIALES II Capitulo 4 1 introducción RADIACION CALOR DEGRADACION AGRESION QUIMICA ácidos,álcalis y solventes ( polímeros ) ACUOSA agua pura Oxígeno disuelto 2 medición n de la velocidad
MATERIALES INDUSTRIALES II Capitulo 4 1 introducción RADIACION CALOR DEGRADACION AGRESION QUIMICA ácidos,álcalis y solventes ( polímeros ) ACUOSA agua pura Oxígeno disuelto 2 medición n de la velocidad
AISLACION DE CAÑERIAS
 Las cañerías que trabajan a baja temperatura se deben aislar en razón de: Ahorro de energía, Reducción de costos operativos Control de la condensación en la superficie externa Prevenir la condensación
Las cañerías que trabajan a baja temperatura se deben aislar en razón de: Ahorro de energía, Reducción de costos operativos Control de la condensación en la superficie externa Prevenir la condensación
Práctica 5: Termoquímica: Celdas galvánicas
 Práctica 5: Termoquímica: Celdas galvánicas Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Construir, varias celdas galvánicas o voltaicas y medir el potencial
Práctica 5: Termoquímica: Celdas galvánicas Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Construir, varias celdas galvánicas o voltaicas y medir el potencial
OBJETIVOS. General. Específicos
 OBJETIVOS General Entender y explicar la reacción que ocurre cuando se deja una puntilla en el agua, utilizando modelos atómicos y diferentes conceptos de forma clara. Específicos Investigar y estudiar
OBJETIVOS General Entender y explicar la reacción que ocurre cuando se deja una puntilla en el agua, utilizando modelos atómicos y diferentes conceptos de forma clara. Específicos Investigar y estudiar
Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno.
 PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
REAL SOCIEDAD ESPAÑOLA DE FÍSICA. Problema Teórico 3
 REAL SOCIEDAD ESPAÑOLA DE ÍSICA Problema Teórico Problema Electrolisis Para que circule una corriente eléctrica por un medio cualquiera, tiene que contener partículas cargadas libres para desplazarse En
REAL SOCIEDAD ESPAÑOLA DE ÍSICA Problema Teórico Problema Electrolisis Para que circule una corriente eléctrica por un medio cualquiera, tiene que contener partículas cargadas libres para desplazarse En
