COLEGIO SAN PEDRO CLAVER BUCARAMANGA. PROFESOR: SANDRA ROCIO PATIÑO VILLAMIZAR GUÍA 2 NOMBRE: FECHA: Abril 2009
|
|
|
- María Pilar Ojeda Revuelta
- hace 7 años
- Vistas:
Transcripción
1 COLEGIO SAN PEDRO CLAVER BUCARAMANGA AREA: CIENCIAS NATURALES ASIGNATURA: QUÍMICA GRADO: 9º PROFESOR: SANDRA ROCIO PATIÑO VILLAMIZAR GUÍA 2 NOMBRE: FECHA: Abril 2009 Explica la teoría cinética molecular del estado gaseoso con base en el conocimiento científico validado. Sustenta hipótesis sobre el comportamiento de los gases a partir de prácticas experimentales. Soluciona situaciones problemáticas aplicando las leyes de los gases. Manifiesta una posición frente al uso del gas vehicular y su impacto en la economía nacional. 1. Realizo la lectura del artículo Síndrome de Descompresión Rápida y respondo las preguntas propuestas Esta enfermedad se conoce en medicina como Embolia Gaseosa producida por una disminución brusca de la presión atmosférica. Se caracteriza por la aparición pequeñas burbujas e inflamación a nivel subcutáneo, pero los síntomas inequívocos son la aparición de fuertes dolores articulares, entumecimiento, parálisis, pérdida del control vesical o intestinal e incluso la muerte. El síndrome de descompresión rápida se llama enfermedad de los buzos. de La presión es la fuerza aplicada sobre una superficie determinada desde todas las direcciones. La atmósfera que soportamos en superficie, a nivel del mar, es de 1 Atm (1,033 kg / cm2). Cuando descendemos 10 m se pasa a soportar una presión de 2 Atm (aumento del 100%), a los 20 m se pasa a una presión de 3 Atm (aumenta un 50% respecto de los 10 m), a los 30 m se pasa a una presión de 4 Atm (aumenta un 33% respecto de los 20 m), y así sucesivamente. Se puede ver que disminuye el porcentaje de aumento respecto del nivel anterior. Ya vimos que al sumergirnos en el agua, la presión aumenta proporcionalmente en una atmósfera cada 10 m que descendemos, en tanto que disminuye a mayor altitud, aunque no en forma proporcional. Esto se debe a la compresibilidad de los gases. Un ejemplo sería sumergir un recipiente lleno de aire y abierto solo por debajo, se observará que el volumen de agua irá entrando a medida que descendemos comprimiendo el aire en el interior, disminuyendo el volumen a la mitad a los 10 m, a un 33% a los 20 m, etc. y saliendo a medida que ascendemos descomprimiendo el aire.
2 Ahora bien el cuerpo humano es incompresible a excepción de las cavidades que contienen gases que son de 2 tipos: a) las que pueden comprimirse sin complicaciones, como el estómago y los intestinos, y b) las que no pueden comprimirse, como los pulmones, senos paranasales y oídos, a menos que se restablezca el equilibrio entre la presión exterior e interior. Dado que los líquidos pueden absorber gases según la presión que se ejerza, si no variamos la presión y mantenemos la temperatura constante la relación de un líquido y los gases que lo rodean está en equilibrio o se dice que el líquido está saturado. Esas variaciones no son instantáneas por cuanto podemos encontrar 3 estados en un líquido: saturado o en equilibrio, no saturado o absorbiendo gases, sobre saturado o eliminando gases. Si la presión desciende repentinamente nos encontramos en un estado de sobre saturación que genera una liberación rápida del gas sobrante en forma de burbujas. Ejemplo: destapar bruscamente una gaseosa. Si al contrario se abre muy lentamente pueden disminuirse notoriamente las burbujas. Cuando descendemos (aumento de presión) nuestros tejidos absorben gases, este proceso no es instantáneo y lleva un tiempo. También depende de las características de los tejidos, observándose que la sangre es el tejido que restablece más rápido el equilibrio en tanto que los tejidos adiposos son los más lentos. Cuando ascendemos (disminución de presión) se produce el efecto inverso, nuestros tejidos eliminan los gases sobrantes en forma paulatina. Si el ascenso se hace demasiado rápido, los gases liberados formarán gran cantidad de burbujas en la sangre, las cuales pueden producir graves accidentes de descompresión. En tanto que si el ascenso se hace en forma controlada, sobre todo cerca de la superficie donde las variaciones de presión son más grandes, no superando la velocidad de 15 m/minuto, permitiendo a los tejidos restablecer el equilibrio. Si el grado de saturación es muy elevado como consecuencia de la relación tiempo / profundidad del buceo, además de un lento ascenso, deberán hacerse, cerca de la superficie (donde los diferenciales de presión son más altos), paradas de descompresión para dar tiempo a la eliminación de gases sin la formación de burbujas. a) Por qué se dice que la enfermedad de los buzos es consecuencia de la compresibilidad de los gases? b) Cómo afecta la temperatura la forma en la que son absorbidos los gases en la sangre? c) Ya conoces el efecto de la presión en los buzos, ahora cómo afecta el cambio de presión a los astronautas cuando viajan al espacio?
3 d) Participo activamente de la puesta en común para socializar mi trabajo personal. 2. De manera personal, consulto sobre los siguientes temas: Teoría cinética de los gases, propiedades de los gases (presión, volumen, temperatura y cantidad de materia), leyes de los gases y gases reales. 3. Elaboro una síntesis bibliográfica donde comparo el uso de gasolina frente al uso del gas vehicular en Colombia. 4. Elaboro un artículo de opinión donde manifiesto mi posición frente al uso del gas vehicular y como afecta la economía nacional. 5. Participo activamente en la clase comunitaria apoyada por el docente 6. Soluciono las situaciones problemáticas, de manera personal, planteadas en el ANEXO 1 LOS GASES EN MI VIDA y participo activamente en la puesta en común orientada por mi Docente. 7. Realizo, en forma grupal, la práctica de laboratorio del ANEXO 2 LA MATERIA, elaboro el informe de laboratorio de manera personal y participo activamente en la puesta en común orientada por mi Docente. 8. Reflexiono sobre los siguientes cuestionamientos y socializo mi trabajo personal: a) Cuál es la importancia para nuestra vida diaria, conocer las propiedades de los gases? b) Cuál es la importancia del uso de la olla a presión en la cocina? c) Por qué cuando una persona se encuentra en el océano y desciende a mucha profundidad puede sufrir de descompresión rápida? d) Cuál es la diferencia entre el uso de gasolina y el uso de gas vehicular? Qué ventajas y desventajas tienen? e) Por qué, al destapar un frasco de perfume, percibimos rápidamente su olor?
4 f) Qué industrias en Santander utilizan gases? Cómo los emplean? 9. Respondo las siguientes preguntas: a) Cómo te sentiste con el tema visto? b) Del tema visto, que fue lo que mas te llamó la atención y por qué? c) Cómo puedo ir más allá de lo aprendido? d) Fue clara para ti, la explicación del tema por parte del Docente? Por que?
5 COLEGIO SAN PEDRO CLAVER BUCARAMANGA AREA: CIENCIAS NATURALES ASIGNATURA: QUÍMICA GRADO: 9º PROFESOR: SANDRA ROCIO PATIÑO VILLAMIZAR ANEXO 1 GUÍA 2 NOMBRE: FECHA: Abril 2009 TRABAJO EN CLASE 1. Usa la teoría cinética molecular de los gases para explicar como pueds percibir un olor desde muy lejos. 2. Un tanque de oxígeno contiene 20 litros de O 2, a una presión de 15 KPa. Cuando el gas se libera proporciona 300 litros de oxígeno, cuál es la presión ejercida por este gas, al mantenerlo isotérmicamente? 3. Un globo contiene 2500 ml de gas helio a 75ºC cuál es el nuevo volumen del gas cuando la temperatura cambia a -25 ºC 4. Una muestra de gas tiene un presión de 1200 Pa a 36ºC Cuál es la presión del gas después de que la temperatura cae a 0 ºC? 5. Una muestra de argón de 260 ml se encuentra a una presión de 1.2 KPa y a una temperatura de 124 ºF. Cuál es el volumen del gas, en mililitros, cuando la presión cambia a 658 mm de Hg y la temperatura a -15ºF? 6. Cuál es el volumen, en litros de 64 g de gas O 2 a condiciones normales? 7. Cuántos vale el peso molecular de un gas si una muestra de 3.16 gramos de gas a 0.75 atm, 45ºC y ocupa un volumen de 2.05 litros? 8. Una mezcla de oxígeno y helio se prepara para un buzo que descenderá 200 pies bajo el océano. A dicha profundidad, el buzo respira una mezcla gaseosa que tiene una presión total de 7 atm. Si en el tanque se encuentran 2 moles de oxígeno, cuál es la presión parcial (atm) del helio? TRABAJO EN CASA RESPONDE LAS PREGUNTAS 1 A 4 DE ACUERDO A LA SIGUIENTE INFORMACION Nuestros pulmones son estructuras elásticas parecidas a globos contenidos en una cámara aérea llamada cavidad torácica. El diafragma, un músculo, forma el piso flexible de la cavidad. La inspiración, es el proceso de tomar una bocanada de aire comienza cuando el diafragma se aplana y la caja torácica se expande, lo que causa un aumento en el volumen de la cavidad torácica. La elasticidad de los pulmones les permite expandirse cuando se expande la cavidad torácica. La expiración, o fase de de exhalación de la respiración, ocurre cuando el diafragma se relaja y se mueve de vuelta hacia arriba en la cavidad torácica a su posición de reposo. Esto disminuye reduce el volumen de la cavidad torácica, que aprieta los pulmones y disminuye el volumen 1. De acuerdo a la Ley de Boyle, explica: a. Que sucede con la presión en tus pulmones en el momento de la inspiración? b. Qué sucede con el volumen en tus pulmones en la expiración? c. La respiración es un proceso de que tipo isotérmico, isobárico o isocórico?
6 2. Usa la teoría cinética molecular de los gases para explicar el proceso de nuestra respiración 3. Por qué al disminuir la cantidad de aire disponible en nuestra respiración, puede llegar a ocasionar muerte de neuronas? Utiliza la teoría cinética molecular y las leyes de los gases para explicar. Por ejemplo, cuando por alguna razón alérgica la traquea no permite el paso del aire, o tenemos algún objeto extraño obstruyéndonos el flujo de aire. 4. Cómo afecta a nuestra respiración, la calidad del aire del que disponemos de acuerdo al lugar donde nos encontremos? Por ejemplo en el campo y en el centro de la ciudad a mediodía. 5. El aire en un cilindro con un pistón tiene un volumen de 220 ml y una presión de 650 Pa. a. Si se aumenta la presión dentro del cilindro, cuál cilindro, A o B, representa el volumen final? Explica tu respuesta b. Si la presión dentro del cilindro aumenta a 1.2 atm, cuál es el volumen final del cilindro? 6. Indica si el volumen final del gas en cada uno de los siguientes casos es el mismo, mayor o menor que el volumen inicial. a. Un volumen de 505 ml de aire en un día frío de invierno a 5ºC se respira en los pulmones, donde la temperatura corporal es de 37ºC b. Un globo lleno con helio se deja dentro de un carro en un día caluroso en el parque de diversiones 7. Por qué pueden explotar las latas de aerosol si se les calienta? 8. Por qué las crispetas se pueden preparar en el microondas o en la crispetera? Qué sucede? 9. Por qué en una mañana fría las llantas de un automóvil parecen ponchadas? 10. Una muestra de gas tiene una presión de 1200 mm Hg a 155ºC en un proceso isocórico Cuál es la presión final del gas después de que la temperatura cae a 0ºC? 11. Una muestra de gas helio tiene un volumen de 6.5 L a una presión de 845 mm Hg y una temperatura de 25ºC. Cuál es la presión del gas, en atm, cuando el volumen y la temperatura de la muestra de gas cambian a 2.25 L y 12ºC? 12. Una muestra que contiene 4.8 gramos de gas O 2 tiene un volumen de 15 litros, mantenidos en un proceso isobárico e isotérmico. De acuerdo a lo anterior, contesta: a. Cuál es el nuevo volumen si se agregan 0.5 moles de O2? b. Se libera oxígeno hasta que el volumen es de 10 litros, cuántos moles de O2 se quitan? c. Cuál es el volumen después de agregar 4 gramos de He al gas O2 que ya está en el contenedor? 13. Calcula la presión, en atm, de 200 gramos de dióxido de nitrógeno (NO 2 ) en un contenedor de 10 L a 27ºC. 14. En una mezcla de gases, contiene 25 gramos de argón, 36 gramos de neón y 125 gramos de nitrógeno. Si se sabe que la presión total de la mezcla de gases es igual a 895 mm de Hg, cuál es la presión parcial de cada uno de los gases? 15. Un globo contiene 30 Kg de helio. Cuál es el volumen del globo si la presión final es de 125 KPa y la temperatura es 22ºC Cómo cambia la presión si estamos a condiciones normales con esa misma cantidad de masa? 16. Observa el siguiente sistema y calcula la presión total de la mezcla de gases
7 COLEGIO SAN PEDRO CLAVER BUCARAMANGA AREA: CIENCIAS NATURALES ASIGNATURA: QUÍMICA GRADO: 9º PROFESOR: SANDRA ROCIO PATIÑO VILLAMIZAR ANEXO 2 GUÍA 2 NOMBRE: FECHA: Mayo 2009 Sustenta hipótesis sobre el comportamiento de los gases a partir de prácticas experimentales. Criterio: relación entre la practica y la teoría SI NO Los sistemas gaseosos se determinan teniendo en cuenta tres propiedades: la presión, la temperatura y el volumen. La energía cinética de las moléculas de un gas y la gran separación que existe entre ellas, hace que sus partículas se difundan con rapidez y que presenten propiedades como la compresibilidad, baja densidad y gran movilidad. En las experiencias que vamos a realizar a continuación tendremos oportunidad de comprobar algunas propiedades de los gases. Qué espero con el desarrollo de esta práctica? Identificar y utilizar el material de uso común en los laboratorios. Conocer los principios químicos en que se basa el estudio de la materia Elaborar un informe de laboratorio y comunicar los resultados obtenidos. Cuáles habilidades científicas pondré en práctica? Experimentar, Observar, Comparar, Predecir, Deducir. Qué materiales y reactivos necesitaré? MATERIALES Banda elástica Jeringa desechable de 10 ml con aguja sin usar Tapon de caucho REACTIVOS Bebida gaseosa pequeña Qué voy a hacer? PROCEDIMIENTO 1. Elimina una pequeña cantidad del contenido de la bebida gaseosa y luego cambia la tapa de la botella por una goma de caucho, asegurada con una banda elástica. 2. Inserta la jeringa con la aguja a través de la goma, de tal forma que quede un espacio entre la superficie del líquido y la punta de la aguja. 3. Con una mano afirma la botella y con la otra, la jeringa. En esa posición realiza una agitación rápida a la botella y luego déjala en reposo. Anota tus observaciones. 4. Una vez que el émbolo de la jeringa se detenga, mide el volumen alcanzado y registra el valor. 5. Repite el procedimiento (3 veces) para que midas el máximo volumen posible de gas.
8 En este experimento se observará el cambio de volumen de una muestra de aire al aplicar diferentes presiones sobre el émbolo de una jeringa. Estas presiones serán diferentes según la masa utilizada, y deben convertirse a unidades absolutas con la siguiente información: a) El área de la cabeza del émbolo es πr2 b) La masa empleada se divide cada vez entre el área obtenida c) La presión manométrica se calcula considerando que la masa de 1 g sobre un área de 1 cm2 ejerce una presión de Pa. d) La presión absoluta se obtiene sumando la manométrica y la atmosférica. 1. Introduce una jeringa sin aguja sobre un tapón de hule y sujétela a un soporte sobre una mesa de tal manera que se mantenga vertical. 2. Succiona a un volumen fijo el aire 3. Agrega monedas de diferentes denominaciones una a una sobre la plataforma del émbolo iniciando con las de menor valor. Permite que el sistema se estabilice por unos minutos y mide el volumen de aire. 4. Después de cada adición permite que el émbolo regrese a su volumen original. Realiza 5 mediciones, repitiendo el procedimiento agregando los pesos en la misma secuencia. 1. Explica lo ocurrido con la gaseoso, desde el punto de vista de la teoría cinética molecular 2. Qué ocurre con la solubilidad del gas cuando agitas la botella? 3. Qué ocurriría con la solubilidad del gas si calentáramos el sistema en un baño de agua caliente? 1. Haz una gráfica de V vs 1/P 2. Explica desde el punto de vista de ley que relaciona presión-volumen a temperatura y flujo molar constante lo sucedido con la jeringa. 3. En un proceso industrial se calienta nitrógeno en un recipiente a volumen constante hasta 500 K. Si el gas entra en el recipiente a una presión de 100 atm y una temperatura de 300 K Qué presión ejerce el gas a la temperatura de trabajo? Supón un comportamiento ideal. Calcula la presión en atm, Pa y mm de Hg. NOTA: El informe de laboratorio debe presentarse a mano, en hojas de trabajo y se realizará en la hora de clase siguiente al laboratorio. Debe contener lo siguiente: Dibujos de lo observado Análisis de Resultados Conclusiones (3) Bibliografía
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO. Nombre Grupo Matrícula PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P)
 Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón. Trabajo Práctico: Leyes de los gases
 Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
Soluciones. DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I)
 Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
GUIA DE LABORATORIO ESTADO GASEOSO, FACTORES RELACIONADOS CON ÉSTE Y LEYES DE LOS GASES. Nombre: Curso: Fecha:
 GUIA DE LABORATORIO ESTADO GASEOSO, FACTORES RELACIONADOS CON ÉSTE Y LEYES DE LOS GASES Nombre: Curso: Fecha: OBJETIVOS: Comprobar el efecto de la presión sobre fluidos (líquidos y gases) Evidenciar la
GUIA DE LABORATORIO ESTADO GASEOSO, FACTORES RELACIONADOS CON ÉSTE Y LEYES DE LOS GASES Nombre: Curso: Fecha: OBJETIVOS: Comprobar el efecto de la presión sobre fluidos (líquidos y gases) Evidenciar la
PRACTICA No. 3 EL ESTADO GASEOSO
 PRACTICA No. 3 EL ESTADO GASEOSO INTRODUCCION: Las sustancias en Estado Gaseoso tienen propiedades físicas y químicas que las hacen diferentes de otras que se encuentran en un estado físico distinto. A
PRACTICA No. 3 EL ESTADO GASEOSO INTRODUCCION: Las sustancias en Estado Gaseoso tienen propiedades físicas y químicas que las hacen diferentes de otras que se encuentran en un estado físico distinto. A
PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]
![PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica] PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]](/thumbs/50/26203302.jpg) Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES
 TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
LABORATORIO DE FISICOQUIMICA. PRACTICA No. 1 PROPIEDADES DE LOS GASES
 LABORAORIO DE FISICOQUIMICA RACICA No. 1 ROIEDADES DE LOS GASES OBJEIVOS. Al terminar la práctica el alumno será capaz de: 1. Comprobar experimentalmente la ley de Boyle. 2. Comprobar experimentalmente
LABORAORIO DE FISICOQUIMICA RACICA No. 1 ROIEDADES DE LOS GASES OBJEIVOS. Al terminar la práctica el alumno será capaz de: 1. Comprobar experimentalmente la ley de Boyle. 2. Comprobar experimentalmente
SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA
 I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
LEY DE BOYLE: A temperatura constante, el volumen (V) que ocupa una masa definida de gas es inversamente proporcional a la presión aplicada (P).
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES. Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile
 Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Actividad: Cómo ocurren las reacciones químicas?
 Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
La energía interna. Nombre Curso Fecha
 Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
INSTITUTO POLITÉCNICO NACIONAL
 INSTITUTO POLITÉCNICO NACIONAL Centro De Estudios Científicos Y Tecnológicos Wilfrido Massieu LABORATORIO DE FÍSICA II ALUMNO GRUPO EQUIPO PROFESOR FECHA CALIF. PRACTICA No. 7 I. NOMBRE: PRESION ATMOSFERICA.
INSTITUTO POLITÉCNICO NACIONAL Centro De Estudios Científicos Y Tecnológicos Wilfrido Massieu LABORATORIO DE FÍSICA II ALUMNO GRUPO EQUIPO PROFESOR FECHA CALIF. PRACTICA No. 7 I. NOMBRE: PRESION ATMOSFERICA.
FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN
 1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
Capítulo 10. Efectos de superficie. Sistema respiratorio
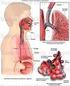 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Física y Química de 2º de ESO Tema Alumno/a: Curso:
 Física y Química de 2º de ESO Tema 1 25-11-2016 Alumno/a: Curso: 1. a) Determina el valor de la densidad del metal a partir de la gráfica. (15) b) De qué metal puede tratarse? (utiliza la tabla de datos)
Física y Química de 2º de ESO Tema 1 25-11-2016 Alumno/a: Curso: 1. a) Determina el valor de la densidad del metal a partir de la gráfica. (15) b) De qué metal puede tratarse? (utiliza la tabla de datos)
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células.
 Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células. La respiración es un proceso involuntario y automático, en que se extrae
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células. La respiración es un proceso involuntario y automático, en que se extrae
HUMEDAD ATMOSFÉRICA
 www.uwm.edu/~vlarson/research.htm HUMEDAD ATMOSFÉRICA Cantidad de vapor de agua que contiene el aire; es la fuente de precipitaciones; influye en los procesos de evapotranspiración y derretimiento de nieves.
www.uwm.edu/~vlarson/research.htm HUMEDAD ATMOSFÉRICA Cantidad de vapor de agua que contiene el aire; es la fuente de precipitaciones; influye en los procesos de evapotranspiración y derretimiento de nieves.
Carlos Martínez B. Ley de Boyle. Carlos Javier Bernal Avila. Viernes, 29 de enero de 2010
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
UNIDAD 1 La materia y sus cambios
 UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
Cuáles de ellas son una disolución? Por qué dices que son disoluciones? Puedes identificar alguna sustancia que las forma?
 : MATERIAL PARA EL ALUMNADO Sustancias solubles y no solubles en agua Actividad 1. Qué sabemos sobre las sustancias solubles? Identificar bebidas que utilizamos en nuestra vida cotidiana. En nuestra vida
: MATERIAL PARA EL ALUMNADO Sustancias solubles y no solubles en agua Actividad 1. Qué sabemos sobre las sustancias solubles? Identificar bebidas que utilizamos en nuestra vida cotidiana. En nuestra vida
COLEGIO ROSARIO SANTO DOMINGO BANCO DE PREGUNTAS TEMA ESTADO GASEOSO GRADO DÉCIMO DOCENTE LAURA VERGARA
 COLEGIO ROSARIO SANTO DOMINGO BANCO DE PREGUNTAS TEMA ESTADO GASEOSO GRADO DÉCIMO DOCENTE LAURA VERGARA PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA 1. A 1 atmosfera de presión y en recipientes
COLEGIO ROSARIO SANTO DOMINGO BANCO DE PREGUNTAS TEMA ESTADO GASEOSO GRADO DÉCIMO DOCENTE LAURA VERGARA PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA 1. A 1 atmosfera de presión y en recipientes
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
Operaciones Básicas de Transferencia de Materia Problemas Tema 6
 1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
Pv = nrt P T P T. Ing. Magno Cuba Atahua
 TEORI CINÉTIC DE LOS GSES Un gas ideal es un gas cuyas moléculas están tan separadas que raramente chocan unas con otras. uesto que éste es el caso para cualquier gas real a baja ideales a baja densidad
TEORI CINÉTIC DE LOS GSES Un gas ideal es un gas cuyas moléculas están tan separadas que raramente chocan unas con otras. uesto que éste es el caso para cualquier gas real a baja ideales a baja densidad
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
Unidad 4: Estado Gaseoso Introducción Teórica
 Unidad 4: Estado Gaseoso Introducción Teórica En esta unidad vamos a ampliar y explicar algunas de las características del estado gaseoso que ya han sido tratadas en la Unidad 1, como por ejemplo la de
Unidad 4: Estado Gaseoso Introducción Teórica En esta unidad vamos a ampliar y explicar algunas de las características del estado gaseoso que ya han sido tratadas en la Unidad 1, como por ejemplo la de
FÍSICA CICLO 5 CAPACITACIÓN La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades.
 UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
Química 2º Bach. Recuperación 1ª Evaluación 13/01/05
 Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
Prof. Jorge Rojo Carrascosa
 Asignatura: FÍSICA Y QUÍMICA EJERCICIOS DE AMPLIACIÓN - SOLUCIONES Fecha finalización: Martes, 8 de marzo de 2011 Nombre y Apellidos JRC 1 Un submarino se encuentra a una profundidad de 400 metros. Cuál
Asignatura: FÍSICA Y QUÍMICA EJERCICIOS DE AMPLIACIÓN - SOLUCIONES Fecha finalización: Martes, 8 de marzo de 2011 Nombre y Apellidos JRC 1 Un submarino se encuentra a una profundidad de 400 metros. Cuál
2 La densidad de una sustancia es ρ, el volumen es V, y la masa es m. Si el volumen se triplica y la densidad no cambia Cuál es la masa?
 Slide 1 / 20 1 Dos sustancias, A tiene una densidad de 2000 kg/m 3 y la B tiene una densidad de 3000 kg/m 3 son seleccionadas para realizar un experimento. Si el experimento necesita de igual masa de cada
Slide 1 / 20 1 Dos sustancias, A tiene una densidad de 2000 kg/m 3 y la B tiene una densidad de 3000 kg/m 3 son seleccionadas para realizar un experimento. Si el experimento necesita de igual masa de cada
PALACORRE. TEMA 2: Los cambios de aspecto de la materia I.E.S. LA CORREDORIA OVIEDO 1º ESO GRUPO: ALUMNO: DPTO. CIENCIAS NATURALES
 PALACORRE I.E.S. LA CORREDORIA OVIEDO DPTO. CIENCIAS NATURALES TEMA 2: Los cambios de aspecto de la materia 1º ESO ALUMNO: GRUPO: TEMA 2: LOS CAMBIOS DE ASPECTO DE LA MATERIA Nombre y apellidos: Fecha:
PALACORRE I.E.S. LA CORREDORIA OVIEDO DPTO. CIENCIAS NATURALES TEMA 2: Los cambios de aspecto de la materia 1º ESO ALUMNO: GRUPO: TEMA 2: LOS CAMBIOS DE ASPECTO DE LA MATERIA Nombre y apellidos: Fecha:
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico.
 FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
ACTIVIDAD GENERAL DE NIVELACIÓN GRADO: 9º
 ACTIVIDAD GENERAL DE NIVELACIÓN GRADO: 9º INSTITUCIÓN EDUCATIVA LUIS PATRON ROSANO ASIGNATURA: QUIMICA JORNADA MATINAL DOCENTE: DAVID SALOMON ALVAREZ LOGROS GRADO NOVENO 1. Define cada una de las etapas
ACTIVIDAD GENERAL DE NIVELACIÓN GRADO: 9º INSTITUCIÓN EDUCATIVA LUIS PATRON ROSANO ASIGNATURA: QUIMICA JORNADA MATINAL DOCENTE: DAVID SALOMON ALVAREZ LOGROS GRADO NOVENO 1. Define cada una de las etapas
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
Ley de Boyle. A temperatura constante, el volumen de una muestra dada de gas es inversamente proporcional a su presión
 LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
TEMPERATURA DILATACIÓN. 9. En la escala Celsius una temperatura varía en 45 C. Cuánto variará en la escala Kelvin y
 TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
GASES IDEALES. P. V = n. R. T
 GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
LABORATORIO 6. TITULO : Propiedades de los Gases
 37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
Clase 2. Estructura de la Atmósfera
 Clase 2 Estructura de la Atmósfera Preguntas claves 1. Qué es la presión y temperatura? 2. Cómo varían con la altura? 3. Cuál es la estructura de la atmósfera? La física y dinámica de la atmósfera puede
Clase 2 Estructura de la Atmósfera Preguntas claves 1. Qué es la presión y temperatura? 2. Cómo varían con la altura? 3. Cuál es la estructura de la atmósfera? La física y dinámica de la atmósfera puede
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea.
 Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
GUÍA DE CIENCIAS II (FÍSICA)
 ESCUELA SECUNDARIA No. 765 JOSÉ VASCONCELOS GUÍA DE CIENCIAS II (FÍSICA) PROFESORA: PAULINA BARRIOS ALUMNO: 15 NOTA: ENTREGAR EN ESTE MISMO DOCUMENTO IMPRESO Y CONTESTADO A TINTA Y LÁPIZ COMPLETO (NO DEJAR
ESCUELA SECUNDARIA No. 765 JOSÉ VASCONCELOS GUÍA DE CIENCIAS II (FÍSICA) PROFESORA: PAULINA BARRIOS ALUMNO: 15 NOTA: ENTREGAR EN ESTE MISMO DOCUMENTO IMPRESO Y CONTESTADO A TINTA Y LÁPIZ COMPLETO (NO DEJAR
CAPITULO V TERMODINAMICA - 115 -
 CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
Respuesta: a) La fracción molar de NaCl es 0,072 b) La concentración másica volumétrica de NaCl es 0,231 g/cc
 Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
V B. g (1) V B ) g, (2) +ρ B. =( m H. m H (3) ρ 1. ρ B. Aplicando al aire la ecuación de estado de los gases perfectos, en la forma.
 Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo.
 ! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
PPT DE APOYO CCNN FÍSICA NIVEL: 8 BÁSICO PROFESORA: GUISLAINE LOAYZA TEMA: LA FUERZA Y LA PRESIÓN
 PPT DE APOYO CCNN FÍSICA NIVEL: 8 BÁSICO PROFESORA: GUISLAINE LOAYZA TEMA: LA FUERZA Y LA PRESIÓN TEMA DE LA CLASE: LA FUERZA Y LA PRESIÓN OBJETIVO DE LA CLASE: Describir la relación entre la fuerza y
PPT DE APOYO CCNN FÍSICA NIVEL: 8 BÁSICO PROFESORA: GUISLAINE LOAYZA TEMA: LA FUERZA Y LA PRESIÓN TEMA DE LA CLASE: LA FUERZA Y LA PRESIÓN OBJETIVO DE LA CLASE: Describir la relación entre la fuerza y
EXPERIMENTOS CON LA MATERIA VALENTÍN ABALO. CEIP. REPÚBLICA DE ECUADOR. MADRID. ENERO, 2013
 EXPERIMENTOS CON LA MATERIA VALENTÍN ABALO. CEIP. REPÚBLICA DE ECUADOR. 1. EXPERIMENTO 1. VOLUMEN Y MASA 1.1. MATERIAL Probeta (y no vaso graduado) Agua Canica de cristal o de acero MADRID. ENERO, 2013
EXPERIMENTOS CON LA MATERIA VALENTÍN ABALO. CEIP. REPÚBLICA DE ECUADOR. 1. EXPERIMENTO 1. VOLUMEN Y MASA 1.1. MATERIAL Probeta (y no vaso graduado) Agua Canica de cristal o de acero MADRID. ENERO, 2013
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Cantidades fundamentales Cantidades básicas y unidaded Unidad I: ropiedades y Leyes de la ermodinámica Cantidades fundamentales ropiedades de estado Función de estado y ecuación de
ERMODINÁMICA AANZADA Cantidades fundamentales Cantidades básicas y unidaded Unidad I: ropiedades y Leyes de la ermodinámica Cantidades fundamentales ropiedades de estado Función de estado y ecuación de
FS-11 GUÍA CURSOS ANUALES. Ciencias Plan Común. Física Trabajo y energía III
 FS-11 Ciencias Plan Común Física 2009 Trabajo y energía III Introducción: La presente guía tiene por objetivo proporcionarte distintas instancias didácticas relacionadas con el proceso de aprendizaje-enseñanza.
FS-11 Ciencias Plan Común Física 2009 Trabajo y energía III Introducción: La presente guía tiene por objetivo proporcionarte distintas instancias didácticas relacionadas con el proceso de aprendizaje-enseñanza.
INGENIERO. JOSMERY SÁNCHEZ
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
Los Gases y la teoría Cinético - Molecular
 Universidad de La Frontera Fac. Ing. Cs. y Adm. Dpto. Cs. Químicas Los Gases y la teoría Cinético - Molecular Prof. Josefina Canales Algunos gases industriales importantes Nombre - Fórmula Origen y uso
Universidad de La Frontera Fac. Ing. Cs. y Adm. Dpto. Cs. Químicas Los Gases y la teoría Cinético - Molecular Prof. Josefina Canales Algunos gases industriales importantes Nombre - Fórmula Origen y uso
Parte I. Escoge la mejor contestación 1) Cuál es la unidad básica para medir cantidades de sustancias? a. Depende del tipo de sustancia que quieras
 Parte I. Escoge la mejor contestación 1) Cuál es la unidad básica para medir cantidades de sustancias? a. Depende del tipo de sustancia que quieras medir b. Litros c. Moles d. Kilogramos 2) Cuál es la
Parte I. Escoge la mejor contestación 1) Cuál es la unidad básica para medir cantidades de sustancias? a. Depende del tipo de sustancia que quieras medir b. Litros c. Moles d. Kilogramos 2) Cuál es la
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
ESTO NO ES UN EXAMEN, ES UNA HOJA DEL CUADERNILLO DE EJERCICIOS. Heroica Escuela Naval
 CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
TEMA 2: PROPIEDADES FÍSICAS DE LOS FLUIDOS
 Manual para el diseño de una red hidráulica de climatización 3 A ntes de comenzar a estudiar cualquier problema de flujo, es necesario conocer algunas características y propiedades físicas de los fluidos,
Manual para el diseño de una red hidráulica de climatización 3 A ntes de comenzar a estudiar cualquier problema de flujo, es necesario conocer algunas características y propiedades físicas de los fluidos,
GASES IDEALES. 1 atm = 760 mmhg = 760 Torr = 1013 hpa
 GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
Guía del docente. 1. Descripción curricular:
 Guía del docente 1. Descripción curricular: - Nivel: 3º medio. - Subsector: Ciencias Físicas. - Unidad temática: Fluidos, hidrostática. - Palabras claves: fluidos, prensa hidráulica, hidrostática, fluidos
Guía del docente 1. Descripción curricular: - Nivel: 3º medio. - Subsector: Ciencias Físicas. - Unidad temática: Fluidos, hidrostática. - Palabras claves: fluidos, prensa hidráulica, hidrostática, fluidos
Física y Química. 2º ESO. LA MATERIA Y SUS PROPIEDADES La materia. La materia es todo aquello que tiene masa y ocupa un espacio.
 La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Práctica 3. Solubilidad
 Práctica 3. Solubilidad PREGUNTS RESPONDER L FINL DE L PRÁTI La concentración es una propiedad intensiva o extensiva? Por qué? Por qué al aumentar la temperatura aumenta la solubilidad de una disolución
Práctica 3. Solubilidad PREGUNTS RESPONDER L FINL DE L PRÁTI La concentración es una propiedad intensiva o extensiva? Por qué? Por qué al aumentar la temperatura aumenta la solubilidad de una disolución
GPRNV013F2-A16V1. Calentamiento global
 GPRNV013F2-A16V1 Calentamiento global ATENCIÓN DESTINAR LOS ÚLTIMOS 20 MINUTOS DE LA CLASE A RESOLVER DUDAS QUE PLANTEEN LOS ALUMNOS SOBRE CONTENIDOS QUE ESTÉN VIENDO EN SU COLEGIO. Profesor(a): Usted
GPRNV013F2-A16V1 Calentamiento global ATENCIÓN DESTINAR LOS ÚLTIMOS 20 MINUTOS DE LA CLASE A RESOLVER DUDAS QUE PLANTEEN LOS ALUMNOS SOBRE CONTENIDOS QUE ESTÉN VIENDO EN SU COLEGIO. Profesor(a): Usted
Ejercicios Tema 2. Versión 16.1
 Ejercicios Tema 2. Versión 16.1 Nombre: FICHA 1 DE REFUERZO 1. Justifica, aplicando la teoría cinética: «Los sólidos tienen forma propia, mientras que los líquidos adoptan la forma del recipiente que los
Ejercicios Tema 2. Versión 16.1 Nombre: FICHA 1 DE REFUERZO 1. Justifica, aplicando la teoría cinética: «Los sólidos tienen forma propia, mientras que los líquidos adoptan la forma del recipiente que los
MATERIAL DE APOYO DE USO ESCLUSIVO DEL CENTRO DE ESTUDIOS MATEMÁTICOS. C.E.M.
 1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
PREGUNTAS DE EJEMPLO CIENCIAS NATURALES TERCER NIVEL BÁSICO
 PREGUNTAS DE EJEMPLO CIENCIAS NATURALES TERCER NIVEL BÁSICO VALIDACIÓN DE ESTUDIOS DECRETO Nº257 1. Cómo actúa nuestro cuerpo para defenderse de organismos que causan enfermedades? A. Los glóbulos blancos
PREGUNTAS DE EJEMPLO CIENCIAS NATURALES TERCER NIVEL BÁSICO VALIDACIÓN DE ESTUDIOS DECRETO Nº257 1. Cómo actúa nuestro cuerpo para defenderse de organismos que causan enfermedades? A. Los glóbulos blancos
Gemelos idénticos o fraternos?
 Alianza para el Aprendizaje de las Ciencias y las Matemáticas (AlACiMa) Actividad de Matemáticas Nivel 4-6 Guía de Maestro Gemelos idénticos o fraternos? TIEMPO: La actividad completa, incluyendo la discusión,
Alianza para el Aprendizaje de las Ciencias y las Matemáticas (AlACiMa) Actividad de Matemáticas Nivel 4-6 Guía de Maestro Gemelos idénticos o fraternos? TIEMPO: La actividad completa, incluyendo la discusión,
Es la medida de la cantidad de materia contenida en un objeto. La unidad SI para masa es el kilogramo (kg)
 Es la medida de la cantidad de materia contenida en un objeto. La unidad SI para masa es el kilogramo (kg) En laboratorio se usa generalmente la unidad de gramo (g). FÓRMULA QUIMICA m = d x v Las unidades
Es la medida de la cantidad de materia contenida en un objeto. La unidad SI para masa es el kilogramo (kg) En laboratorio se usa generalmente la unidad de gramo (g). FÓRMULA QUIMICA m = d x v Las unidades
PRÁCTICA 1 HERRAMIENTAS Y OPERACIONES BÁSICAS EN EL LABORATORIO BIOANALÍTICO
 PRÁCTICA 1 HERRAMIENTAS Y OPERACIONES BÁSICAS EN EL LABORATORIO BIOANALÍTICO INTRODUCCIÓN Todos los instrumentos de medida que se utilizan en el laboratorio tienen algún tipo de escala para medir una magnitud,
PRÁCTICA 1 HERRAMIENTAS Y OPERACIONES BÁSICAS EN EL LABORATORIO BIOANALÍTICO INTRODUCCIÓN Todos los instrumentos de medida que se utilizan en el laboratorio tienen algún tipo de escala para medir una magnitud,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
VII Congreso Nacional de Ciencias Exploraciones fuera y dentro del aula 26 y 27 de agosto, 2005 INBioparque, Santo Domingo de Heredia, Costa Rica
 VII Congreso Nacional de Ciencias Exploraciones fuera y dentro del aula 26 y 27 de agosto, 2005 INBioparque, Santo Domingo de Heredia, Costa Rica EXPERIMENTOS EN CIENCIAS: ESTÁTICA DE FLUIDOS Ing. Carlos
VII Congreso Nacional de Ciencias Exploraciones fuera y dentro del aula 26 y 27 de agosto, 2005 INBioparque, Santo Domingo de Heredia, Costa Rica EXPERIMENTOS EN CIENCIAS: ESTÁTICA DE FLUIDOS Ing. Carlos
Práctica 3. Solubilidad
 PREGUNTS RESPONDER L FINL DE L PRÁTI Práctica 3. Solubilidad Revisaron: M. en. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar QF. Fabiola González Olguín La concentración es una propiedad
PREGUNTS RESPONDER L FINL DE L PRÁTI Práctica 3. Solubilidad Revisaron: M. en. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar QF. Fabiola González Olguín La concentración es una propiedad
Dispositivos Cilindro-Pistón
 Presión ejercida sobre superficies sólidas: sistema cilindro-pistón Un sistema importante desde el punto de vista termodinámico es el sistema cilindro-pistón, ya que se puede estudiar con él el comportamiento
Presión ejercida sobre superficies sólidas: sistema cilindro-pistón Un sistema importante desde el punto de vista termodinámico es el sistema cilindro-pistón, ya que se puede estudiar con él el comportamiento
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Ley de los Gases Unidad II
 Ley de los Gases Unidad II Introducción Presión Volumen Cantidad de gas Ley de Abogadro Enunciado Ejemplos Recurso Educaplus Ley de Boyle Enunciado Ejemplos Ley de Charles Enunciado Ejemplos Actividades
Ley de los Gases Unidad II Introducción Presión Volumen Cantidad de gas Ley de Abogadro Enunciado Ejemplos Recurso Educaplus Ley de Boyle Enunciado Ejemplos Ley de Charles Enunciado Ejemplos Actividades
GASES 09/06/2011. La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: La atmósfera
 La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
COMPORTAMIENTO GASEOSO
 1 COMPORTAMIENTO GASEOSO LABORATORIOS FENÓMENOS DE PRESIÓN CON LA BOMBA DE VACÍO I. BOMBAS DE CUMPLEAÑOS Coloque la campana en acople con la comba de vacío. Introduzca varias bomba, en diferentes grados
1 COMPORTAMIENTO GASEOSO LABORATORIOS FENÓMENOS DE PRESIÓN CON LA BOMBA DE VACÍO I. BOMBAS DE CUMPLEAÑOS Coloque la campana en acople con la comba de vacío. Introduzca varias bomba, en diferentes grados
Ventilación Pulmonar. -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón
 Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
UNIDAD 3 ESTADO GASEOSO
 UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
Estudiando el efecto de invernadero con simulaciones computacionales
 Estudiando el efecto de invernadero con simulaciones computacionales Tarea 8 - Geociencias Introducción Esta es una simulación que busca ilustrar como depende la temperatura de la Tierra del balance entre
Estudiando el efecto de invernadero con simulaciones computacionales Tarea 8 - Geociencias Introducción Esta es una simulación que busca ilustrar como depende la temperatura de la Tierra del balance entre
El sistema respiratorio
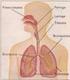 El sistema respiratorio Así como es indispensable incorporar materia del medio, también es importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
El sistema respiratorio Así como es indispensable incorporar materia del medio, también es importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
Hidrodinámica. Conceptos
 Conceptos Hidrostática tica Caudal Es la cantidad de líquido que pasa en un cierto tiempo. Concretamente, el caudal sería el volumen de líquido que circula dividido el tiempo: Sus unidades son volumen
Conceptos Hidrostática tica Caudal Es la cantidad de líquido que pasa en un cierto tiempo. Concretamente, el caudal sería el volumen de líquido que circula dividido el tiempo: Sus unidades son volumen
Ejercicios relacionados con líquidos y sólidos
 Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
CENTRO DE ENSEÑANZA SUPERIOR DON BOSCO EXPERIMENTO FÍSICA FLOTABILIDAD DE LOS CUERPOS
 CENTRO DE ENSEÑANZA SUPERIOR DON BOSCO Ciencia Física Pro: Irene Suarez Lacalle EXPERIMENTO FÍSICA FLOTABILIDAD DE LOS CUERPOS GRUPO 6 Martínez del Egido, Manuel Marfil Arteaga, Juan Lázaro Lopez, Sergio
CENTRO DE ENSEÑANZA SUPERIOR DON BOSCO Ciencia Física Pro: Irene Suarez Lacalle EXPERIMENTO FÍSICA FLOTABILIDAD DE LOS CUERPOS GRUPO 6 Martínez del Egido, Manuel Marfil Arteaga, Juan Lázaro Lopez, Sergio
