Bloque II: Equilibrios Químicos. Profesor: Mª del Carmen Clemente Jul
|
|
|
- Yolanda Peralta Piñeiro
- hace 7 años
- Vistas:
Transcripción
1 Bloque II: Equilibrios Químicos Profesor: Mª del Carmen Clemente Jul
2 LEY DE EQUILIBRIO QUÍMICO. CONSTNTE DE EQUILIBRIO, EQ L LEY DE EQUILIBRIO QUÍMICO ES L EXPRESIÓN MTEMÁTIC DE L LEY DE CCIÓN DE MSS QUE RELCION LS CONCENTRCIONES DE RECTIVOS Y PRODUCTOS EN EL EQUILIBRIO EN TÉRMINOS DE UN CNTIDD DENOMIND CONSTNTE DE EQUILIBRIO. PR L RECCIÓN REVERSIBLE a + bb cc + Dd L CONSTNTE DE EQUILIBRIO ES Y DEPENDE DE L NTURLEZ DE L RECCIÓN L TEMPERTUR C c a D B d b
3 CRCTERÍSTICS DEL EQUILIBRIO QUÍMICO >> 1 : << 1 : NI >> 1 L CNTIDD DE LOS PRODUCTOS EN EL EQUILIBRIO ES MUCHO MYOR QUE L DE LOS RECTIVOS. L CNTIDD DE LOS PRODUCTOS EN EL EQUILIBRIO ES MUCHO MENOR QUE L DE LOS RECTIVOS. NI << 1: L CNTIDD DE LOS PRODUCTOS Y DE LOS RECTIVOS EN EL EQUILIBRIO SON DEL MISMO ORDEN DE MGNITUD.
4 RELCIÓN ENTRE EQUILIBRIO QUÍMICO Y CINÉTIC QUÍMIC + B B L VELOCIDD DIRECT ES: L VELOCIDD INVERS ES: V V f r (en k k el f r [ ][ B] [ B ] equilibrio ) V r f V k [ B ] [ ][ B] V k COMO f 1 : f V r k r k r f [ ][ B ] [ B ] CONSTNTES UN Tª DD CONSTNTE UN Tª DD
5 EQUILIBRIOS HOMOGÉNEOS ES EL ESTDO DINÁMICO QUE SUME UN RECCIÓN QUÍMIC DONDE TODS LS ESPECIES QUE INTERVIENEN ESTÁN EN L MISM FSE SI TODS LS ESPECIES ESTÁN EN FSE DE DISOLUCIÓN SUS CONCENTRCIONES EN EQUILIBRIO SE EXPRESN COMO MOLRIDDES (moles/l). a (ac) bb (ac) b B c a SI TODS LS ESPECIES ESTÁN EN FSE GSEOS SUS CONCENTRCIONES EN EQUILIBRIO SE EXPRESN COMO PRESIONES PRCILES (atm) a (g) b B a bb (g)
6 RELCIÓN ENTRE C Y P a (g) bb (g): SUPONIENDO PR (g) Y B(g) COMPORTMIENTO DE GSES IDELES P.V n RT ; P B V n b RT b B a ( SI n V n V c B SUSTITUYENDO n b RT RT a b a b a (,8T ) (,8T ) MOLES B R RT c b a c RT L. atm,8 :. mol n b a PRODUCTOS MOLES RECTIVOS : c )
7 EQUILIBRIOS HETEROGÉNEOS ES EL ESTDO DINÁMICO QUE SUME UN RECCIÓN QUÍMIC DONDE LS ESPECIES QUE INTERVIENEN ESTÁN EN FSES DIFERENTES CaCO (s) CaO (s) + CO (g) EN EL EQUILIBRIO L EXPRESIÓN DE L CONSTNTE ES c [ CaO][ CO ] [ CaCO ] COMO L CONCENTRCIÓN MOLR DE UN SÓLIDO ES CONSTNTE UN TEMPERTUR DETERMIND E INDEPENDIENTE DE L CNTIDD DE SÓLIDO PRESENTE c [ CaO] [ ] [ ] CO [ CO ] c CaCO [ CO ] CO
8 EQUILIBRIOS MÚLTIPLES SI UN EQUILIBRIO SE PUEDE EXPRESR COMO L SUM DE DOS O MÁS EQUILIBRIOS, L CONSTNTE DE EQUILIBRIO TOTL ES IGUL L PRODUCTO DE LS CONSTNTES DE LOS EQUILIBRIOS PRCILES EQUILIBRIOPRCIL(1) : + B EQUILIBRIOPRCIL() : C + D 1 EL EQUILIBRIO C D E F B C D E F B E F B C + D; E + F; TOTL(1) + () : + B 1 C D B E F C D E + F
9 CÁLCULO DE L CONSTNTE DE EQUILIBRIO TOTL DEL H CO (a 5 ºC) PRTIR DE LS CONSTNTES DE LOS EQUILIBRIOS PRCILES 1) + 7 H CO HCO + H 1 4,.1 (5 º C) ) HCO CO + H + 4, (5 º C) Y TENIENDO EN CUENT QUE EL EQUILIBRIO TOTL ES: H CO CO + H (1 + + ) ( 4,.1 )( 4,8.1 ),. 1 1
10 .4. N (g) + H (g) NH(g) MEZCL EN EL EQUILIBRIO EN UN MTRZ DE 4L: N : 1,8 MOLES H : 1, MOLES NH : 1,6 MOLES ES UN EQUILIBRIO HOMOGÉNEO CUY c N NH H 1,6 MOLES MOLES NH,4 4L L 1,8MOLES MOLES N,7 4L L 1,MOLES MOLES H, 4L L (,4) M c (,7) M / L(,) UNIDDES DE C : / L M / L moles L moles L moles L,16,7,M L
11 EX. NaHCO c (s),5.1 Na CO (a 1 º C) SI UN MTRZ DE L CONTIENE 1 ºC,5 MOLES DE NaHCO,15 MOLES DE Na CO,5.1 - MOLES DE CO 4,.1 - MOLES DE H O SE H LCNZDO EL EQUILIBRIO? ES UN EQUILIBRIO HETEROGÉNEO DONDE: 4 M (s) + CO (g) + H O(g) CO H O,5.1 MOLES MOLES CO 1,5.1 ; L L 4,.1 MOLES MOLES H O.1 L L MOLES MOLES 1,5.1.1,5.1 L L ESTÁ EN EQUILIBRIO 4 M
12 CÁLCULO DE LS PRESIONES EN EL EQUILIBRIO inicial cambio equilibrio (g ) ( ) x ( ) + x B (g ) (B ) x (B ) x C (g ) + x + x x ( x)( B x) SI P ES MUY PEQUEÑ, L CNTIDD DE PRODUCTO QUE SE FORM EN EL EQUILIBRIO TMBIÉN ES MUY PEQUEÑ Y SE PUEDEN HCER LS PROXIMCIONES: -x ; B-x B (VÁLIDS SI x ES MENOR Ó IGUL 5 % )
13 GRDO DE DISOCICIÓN, α α α CMBIO DE CONCENTRCIÓN CONCENTRCIÓN INICIL P x P RT RT P P x x C
14 .1. SO (g) + inicial (SO ) 1atm cambio equilibrio x atm O (g) SO (g) (O ),5atm x atm x atm ( 1 x ) atm (,5 x ) atm x atm COMO EN EL EQUILIBRIO L MEZCL TIENE UN P T 1,5 atm: P T (1-x) + (,5 x) + x 1,5 atm; x,15 CÁLCULO DE LS PRESIONES PRCILES EN EL EQUILIBRIO SO 1- x,15,7 atm; O,5 -,15,5 atm SO x,15, atm SO, SO O,7.,5 ( ) ( ) atm atm.atm,5 atm 1
15 .5. PCl5 (g) PCl(g) + Cl(g) DTOS: MOLES INICILES DE PCl 5 :,1 VOLÚMEN MTRZ: 1L; T 5 ºC α,81 CÁLCULO DE DEL PCl 5 n,1mol atm. L P R T,8 5º 4, 8 V 1L º. mol atm
16 .5. Cont. a) CÁLCULO DE P T EN EL EQUILIBRIO PCl 5 (g) PCl (g) + inicial (PCl 5 )atm cambio x (PCl 5 )atm x (PCl )atm equilibrio ( x )atm x atm Cl (g) x (PCl x atm )atm COMO x. α EN EL EQUILIBRIO: PRESIONES (PCl 5 ) - α (1- α) 4,8 (1-,81) PRCILES (PCl ) α 4,8.,81 (Cl ) α 4,8.,81 P T (1- α) + α 7,76 atm
17 .5. Cont. (PCl) (Cl (PCl ) ) ( 4,8,81)( 4,8,81) 4,8( 1,81) 5 14,8 atm c) c n ( RT) (,8 5) c 1 14,8 c,8 14,8 atm atm.l 5.MOL,45MOL / L
18 .. COCl (g) CO(g) + Cl(g) CÁLCULO DE α: INICIL: DTOS: P T, g iniciales del reactivo y volumen del matraz. CLCULR: α,,5g [ COCl ] COCl,84 COCl atm 1mol COCl PmCOCl (g),5 moles,4l n V RT,14,14,5 99 moles L moles.l,5 1,8 moles atm.l.mol COCl 67
19 EQUILIBRIO: COCl (g) (1 α) CO(g) + Cl α α (g) COMO L PRESIÓN TOTL EN EL EQUILIBRIO ES 76 mmhg 1atm: P T 1 atm (1 α) + α + α + α 1 α 1,84,,84
20 .. Cont. (CO) (Cl (COCl ) ) (α)(α) (1 α) 5.1 atm
21 CÁLCULO DE LS CONCENTRCIONES DE EQUILIBRIO 1) LS CONCENTRCIONES DE EQUILIBRIO SE EXPRESN EN FUNCIÓN DE LS CONCENTRCIONES INICILES Y DE UN SOL INCÓGNIT QUE REPRESENT EL CMBIO DE CONCENTRCIÓN, X (.) H(g) + I(g) 1, mol 1, mol inicial 1L 1L cambio x M x M equilibrio(1 x) M (1 x) M HI(g) x M x M SI C ES MUY PEQUEÑ: 1 x 1; ESTS PROXIMCIONES SON VÁLIDS SI x< 5 % C : [(C x) C ]
22 ) SE FORMUL c EN FUNCIÓN DE LS CONCENTRCIONES EN EQUILIBRIO. COMO SE CONOCE EL VLOR DE c SE CLCUL X ) CON EL VLOR DE X SE CLCULN TODS LS CONCENTRCIONES EN EQUILIBRIO
23 EX. CÁLCULO DE CONCENTRCIONES EN EQUILIBRIO EXPRESDS COMO FRCCIONES MOLRES inicio cambio equilibrio 4HCl (g) + O (g) H O(g) + Cl (g) 1MOL 4MOLES 1L 1L 4x x + x + x 1 4x 4 x + x + x X Cl equilibrio x + x + moles x de Cl x ( 1 4x)( 4 x) 5 x moles de Cl + moles H O + moles O + moles HCl
24 PREDICCIÓN DE L DIRECCIÓN DE UN RECCIÓN QUÍMIC PRTIR DE L CONSTNTE DE EQUILIBRIO SE COMPRN L CONSTNTE DE EQUILIBRIO c Y EL COCIENTE DE RECCIÓN Q c. a + bb cc + dd c C c a D B d b Q c C c a D B d b (, B, C, Y D ) SON CONCENTRCIONES EN EL EQUILIBRIO. (, B, C Y D ) SON CONCENTRCIONES INICILES. Q c > c : PRODUCTOS TRNSFORMÁNDOSE EN RECTIVOS DIRECCIÓN DE L RECCIÓN DE DCH IZQD. Q c < c : RECTIVOS TRNSFORMÁNDOSE EN PRODUCTOS DIRECCIÓN DE L RECCIÓN DE IZQD DCH. Q c c : CONCENTRCIONES INICILES CONCENTRCIONES EN EL EQUILIBRIO.
25 N c + H [ N ],6M ; [ H ],76M ; [ NH ],48M NH,65 a º C PR PREDECIR L DIRECCIÓN DE L RECCIÓN SE COMPRN c Y Q c. Q c N NH H (,48) (,6)(,76),886 CONCLUSIÓN: Q c > c, PRTE DEL NH SE DESCOMPONE EN N e H Y CUNDO SE LCNCE EL EQUILIBRIO EL N Y EL H HBRÁN UMENTDO SU CONCENTRCIÓN Y EL NH L HBRÁ DISMINUIDO. DIRECCIÓN DE L RECCIÓN: DE DCH IZQD.
26 FCTORES QUE FECTN L EQUILIBRIO QUÍMICO PRINCIPIOS DE LE CHTELIER SI UN SISTEM EN EQUILIBRIO SE LE PLIC UN ESFUERZO EXTERNO (CMBIO EN L TEMPERTUR, PRESIÓN, CONCENTRCIÓN O VOLÚMEN) EL SISTEM SE JUST POR SÍ MISMO DE TL FORM QUE EL SISTEM SE CONTRREST PRCILMENTE CMBIOS EN CONCENTRCIONES equilibrio N + H,68M 8,8M NH 1,5M c 5ºC,7.1 SI ÑDIMOS MS NH (,65M) PRTE DEL NH RECCIONRÁ PR DR N e H. SI SE COMPRN Q c, CON c,7.1 -, L RECCIÓN SE DESPLZ DE DERECH IZQUIERD HST QUE Q c c
27 CMBIOS EN PRESIÓN Y VOLÚMEN n ( RT) V EN LS RECCIONES EN FSE GSEOS SI P UMENT (V DISMINUYE) DESPLZMIENTO HCI DONDE DISMINUYE n T N Q c O 4 (g) NO N O 4 NO EN EL EQUILIBRIO Q c c L UMENTR P UMENTN L NO Y N O 4 PERO COMO NO, EL NUMERDOR DE Q c UMENT MÁS RÁPIDMENTE QUE EL DENOMINDOR. PRTE DEL NO SE CONVIERTE EN N O 4 PR QUE Q c c Y SE RESTBLEZC EL EQUILIBRIO c NO N O 4
28 SI L P DISMINUYE (O UMENT V) DESPLZMIENTO HCI DONDE UMENT n T N O4 NO SI P DISMINUYE, DISMINUYEN N O 4 Y NO PERO EL NUMERDOR DE NO DISMINUYE MÁS Q c RPIDMENTE QUE EL DENOMINDOR LUEGO PRTE DEL N O 4 SE CONVIERTE EN NO PR QUE Q c c Y SE RESTBLEZC EL EQUILIBRIO N O 4
29 CMBIOS EN L TEMPERTUR L CONSTNTE DE EQUILIBRIO DEPENDE EXCLUSIVMENTE DE L TEMPERTUR RECCIÓN ENDOTÉRMIC: B; H L UMENTR L TEMPERTUR, SE FCILIT L CONVERSIÓN DE EN B DESPLZMIENTO HCI L DERECH. c B UMENT R RECCIÓN EXOTÉRMIC: B; H R < L UMENTR L TEMPERTUR, SE FCILIT L CONVERSIÓN DE B EN DESPLZMIENTO HCI L IZQUIERD. B c DISMINUYE
30 LEY DE VN T HOFF: ln H R R 1 T 1 T H R : VRICIÓN DE L ENTLPÍ ESTÁNDR DE L RECCIÓN Tª T )
31 SE PUEDE CMBIR L PRESIÓN TOTL, SIN CMBIR EL VOLÚMEN ÑDIENDO UN GS INERTE UMENT P T DISMINUYEN LS FRCCIONES MOLRES DE CD RECTIVO Y PRODUCTO. PERO NO CMBIN LS PRESIONES PRCILES P Ej : Cambian : P T X X B n n n + n + B n n B B (g ) B (g ) no cambian P P X X.P.P T T :
32 ÑDIENDO UN GS INERTE, SI VRÍ EL VOLUMEN, VRÍN LS PRESIONES PRCILES DE LS ESPECIES EN EL EQUILIBRIO VRÍN LS CONCENTRCIONES DE LS ESPECIES EN EL EQUILIBRIO n (EN LS RECCIONES DONDE ) NO VRÍ PORQUE SÓLO DEPENDE DE L T.
33 EFECTO DE LOS CTLIZDORES NO INFLUYEN EN LS CONCENTRCIONES EN EL EQUILIBRIO L CONSTNTE DE EQUILIBRIO SI INFLUYEN EN L VELOCIDD CON QUE SE LCNZ EL EQUILIBRIO DISMINUYEN L ENERGÍ DE CTIVCIÓN TNTO DE L RECCIÓN DIRECT B COMO DE L RECCIÓN INVERS B
34 O (g) O(g) H 84 J 1. UMENT P T :. UMENT O :. UMENT T: 4. DICIÓN DE He (a P cte): 5. DICIÓN DE He (a v cte)
35 O (g) O(g) H 84 J 1. UMENT P T :. UMENT O :. UMENT T: UMENT n T Q c < c RECCIÓN ENDOTÉRMIC 4. DICIÓN DE He (a cte): DESPLZMIENTO HCI L DERECH HST RECUPERR EQUILIBRIO DESPLZMIENTO HCI L DERECH HST RECUPERR EQUILIBRIO DESPLZMIENTO HCI MYOR O Y UMENT C EL EQUILIBRIO NO SE FECT 5. DICIÓN DE He (a v cte): EL EQUILIBRIO NO SE FECT
36 .7. CaCO 1 CaO(s) + CO (g) 678 TORR a 81 º C 18 º 1 TORR a 865 ºC 118 º L CONSTNTE H ln 1 1 y CO H 1 1 cal 1 1, mol 6 cal / mol,6 cal / mol
Tema 12 Termoquímica. Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad En qué dirección se produce? Reacciones Químicas
 Tema 1 Estequiometría Cuánto se produce? Cuánto reacciona? Tema 15 Equilibrio Cuándo se alcanza? Cómo modificarlo? Tema 12 Termoquímica Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad
Tema 1 Estequiometría Cuánto se produce? Cuánto reacciona? Tema 15 Equilibrio Cuándo se alcanza? Cómo modificarlo? Tema 12 Termoquímica Desprende o absorbe calor? Cuánto calor? Criterio de espontaneidad
Psicrometría. nrt. nrt. p p p. nrt. a a. v v
 Estudio de sistems consistentes en ire seco y gu. Aire húmedo: mezcl de ire seco y or de gu. El ire seco se trt como si fuer un comonente uro. L mezcl globl y sus comonentes se comortn como un gs idel
Estudio de sistems consistentes en ire seco y gu. Aire húmedo: mezcl de ire seco y or de gu. El ire seco se trt como si fuer un comonente uro. L mezcl globl y sus comonentes se comortn como un gs idel
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 4, Opción B Junio, Ejercicio 6, Opción A Reserv 1, Ejercicio 4, Opción B Reserv 1, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 4, Opción B Junio, Ejercicio 6, Opción A Reserv 1, Ejercicio 4, Opción B Reserv 1, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 4, Opción B Junio, Ejercicio 6, Opción A Reserv 1, Ejercicio 4, Opción A Reserv 2, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 4, Opción B Junio, Ejercicio 6, Opción A Reserv 1, Ejercicio 4, Opción A Reserv 2, Ejercicio 4, Opción
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo.
 Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
TEMA 3: PROPORCIONALIDAD Y PORCENTAJES.
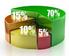 TEM : PROPORCIONLIDD Y PORCENTJES.. Conceptos de Rzón y Proporción. Se define l RZÓN entre dos números como l frcción que se form con ellos. Es decir l rzón entre y es:, con 0. De quí que ls frcciones
TEM : PROPORCIONLIDD Y PORCENTJES.. Conceptos de Rzón y Proporción. Se define l RZÓN entre dos números como l frcción que se form con ellos. Es decir l rzón entre y es:, con 0. De quí que ls frcciones
5. Equilibrio químico
 5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
Capítulo 14: Equilibrio químico
 Capítulo 14: Equilibrio químico Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM 3002 Química general II, Cap. 14: Eq. químico p.1 Concepto
Capítulo 14: Equilibrio químico Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM 3002 Química general II, Cap. 14: Eq. químico p.1 Concepto
TEMA VI: ACIDOS Y BASES
 www.selectividd-cgrnd.com TEMA VI: ACIDOS Y BASES 1.- El ácido clorocético (ClCH COOH) en concentrción 0,01M y 5 C se encuentr disocido en 1%. Clculr: ) L constnte de disocición de dicho ácido. b) El ph
www.selectividd-cgrnd.com TEMA VI: ACIDOS Y BASES 1.- El ácido clorocético (ClCH COOH) en concentrción 0,01M y 5 C se encuentr disocido en 1%. Clculr: ) L constnte de disocición de dicho ácido. b) El ph
EQUILIBRIO QUIMICO QUIMICA-CPAM. FCM 2016
 EQUILIBRIO QUIMICO QUIMICA-CPAM. FCM 2016 Qué es equilibrio? Equilibrio: es un estado en el cual no se observan cambios a medida que transcurre el tiempo. Copyright The McGraw-Hill Companies, Inc. Permission
EQUILIBRIO QUIMICO QUIMICA-CPAM. FCM 2016 Qué es equilibrio? Equilibrio: es un estado en el cual no se observan cambios a medida que transcurre el tiempo. Copyright The McGraw-Hill Companies, Inc. Permission
Ecuaciones de Segundo Grado II
 Alumno: Fech:. ECUACIONES DE SEGUNDO GRADO II Ecuciones de Segundo Grdo II Nturlez de Ríces depende = b - 4c Discriminnte si Propieddes de ls Ríces sum b x x producto c x. x Formción de l Ecución se debe
Alumno: Fech:. ECUACIONES DE SEGUNDO GRADO II Ecuciones de Segundo Grdo II Nturlez de Ríces depende = b - 4c Discriminnte si Propieddes de ls Ríces sum b x x producto c x. x Formción de l Ecución se debe
EQUILIBRIO QUÍMICO SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD. para cada una de las siguientes reacciones reversibles: O (g) FNO. p p.
 8 EQUILIBRIO QUÍMICO SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Constante de equilibrio 1 Escribe la eresión de las constantes de equilibrio K y K c ara cada una de las siguientes reacciones reversibles:
8 EQUILIBRIO QUÍMICO SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Constante de equilibrio 1 Escribe la eresión de las constantes de equilibrio K y K c ara cada una de las siguientes reacciones reversibles:
Colegio Diocesano Sagrado Corazón de Jesús EJERCICIOS MATEMÁTICAS 3º ESO VERANO 2015
 Colegio Diocesno Sgrdo Corzón de Jesús EJERCICIOS MATEMÁTICAS º ESO VERANO º. Amplific ls siguientes frcciones pr que tods tengn denomindor b c d º. Cuál de ls siguientes frcciones es un frcción mplificd
Colegio Diocesno Sgrdo Corzón de Jesús EJERCICIOS MATEMÁTICAS º ESO VERANO º. Amplific ls siguientes frcciones pr que tods tengn denomindor b c d º. Cuál de ls siguientes frcciones es un frcción mplificd
GUÍA N 3: Equilibrio Químico y Cinética Química
 1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
INSTITUTO VALLADOLID PREPARATORIA Página 105 ELIPSE
 INSTITUTO VALLADOLID PREPARATORIA Págin 05 6 LA ELIPSE 6. DEFINICIONES L elipse es el lugr geométrico de todos los puntos cuy sum de distncis dos puntos fijos, llmdos focos, es constnte. En l figur 6.,
INSTITUTO VALLADOLID PREPARATORIA Págin 05 6 LA ELIPSE 6. DEFINICIONES L elipse es el lugr geométrico de todos los puntos cuy sum de distncis dos puntos fijos, llmdos focos, es constnte. En l figur 6.,
2. Derivada: tangente a una curva. Los teoremas de Rolle y Lagrange.
 . Derivd: tngente un curv. Los teorems de Rolle y Lgrnge. Se f : x I f( x) un función definid en un intervlo I y se un punto interior del intervlo I. L pendiente de l rect tngente l curv y f( x), f( )
. Derivd: tngente un curv. Los teorems de Rolle y Lgrnge. Se f : x I f( x) un función definid en un intervlo I y se un punto interior del intervlo I. L pendiente de l rect tngente l curv y f( x), f( )
DINÁMICA Y LAS LEYES DE NEWTON
 DINÁMICA Y LAS LEYES DE NEWTON EXPERIENCIA N 7 Un propiedd de los cuerpos mteriles es su ms inercil. L fuerz es otro concepto nuevo, útil cundo se trt de describir ls intercciones entre cuerpos mteriles.
DINÁMICA Y LAS LEYES DE NEWTON EXPERIENCIA N 7 Un propiedd de los cuerpos mteriles es su ms inercil. L fuerz es otro concepto nuevo, útil cundo se trt de describir ls intercciones entre cuerpos mteriles.
Tipos de Catálisis. Hay dos tipos de catálisis:
 CATáLISIS Un ctlizdor es un sustnci que celer (ctlizdor positivo) o retrd (ctlizdor negtivo o inhibidor) l velocidd de un rección químic, permneciendo éste mismo inlterdo. Un ctlizdor bj l energí de ctivción
CATáLISIS Un ctlizdor es un sustnci que celer (ctlizdor positivo) o retrd (ctlizdor negtivo o inhibidor) l velocidd de un rección químic, permneciendo éste mismo inlterdo. Un ctlizdor bj l energí de ctivción
EL EQUILIBRIO QUÍMICO - PREGUNTAS TIPO TEST (2015)
 EL EQUILIBRIO QUÍMICO - PREGUNTAS TIPO TEST (2015) Grupo A - DEFINICIONES GENERALES: Grupo B - CONSTANTES DE EQUILIBRIO: Grupo C - PRINCIPIO DE LE CHATELIER: Grupo D- CONDICIONES TERMODINÁMICAS DE EQUILIBRIO
EL EQUILIBRIO QUÍMICO - PREGUNTAS TIPO TEST (2015) Grupo A - DEFINICIONES GENERALES: Grupo B - CONSTANTES DE EQUILIBRIO: Grupo C - PRINCIPIO DE LE CHATELIER: Grupo D- CONDICIONES TERMODINÁMICAS DE EQUILIBRIO
A modo de repaso. Preliminares
 UNIDAD I A modo de repso. Preliminres Conjuntos numéricos. Operciones. Intervlos. Conjuntos numéricos Los números se clsificn de cuerdo con los siguientes conjuntos: Números nturles.- Son los elementos
UNIDAD I A modo de repso. Preliminres Conjuntos numéricos. Operciones. Intervlos. Conjuntos numéricos Los números se clsificn de cuerdo con los siguientes conjuntos: Números nturles.- Son los elementos
UNIDAD DIDÁCTICA 4: LOGARITMOS
 Tem 4 UNIDAD DIDÁCTICA 4: LOGARITMOS 1. ÍNDICE 1. Introducción 2. Potencis funciones eponenciles 3. Función rítmic ritmos 4. Ecuciones eponenciles rítmics 2. INTRODUCCIÓN GENERAL A LA UNIDAD Y ORIENTACIONES
Tem 4 UNIDAD DIDÁCTICA 4: LOGARITMOS 1. ÍNDICE 1. Introducción 2. Potencis funciones eponenciles 3. Función rítmic ritmos 4. Ecuciones eponenciles rítmics 2. INTRODUCCIÓN GENERAL A LA UNIDAD Y ORIENTACIONES
1º) Dado el sistema de equilibrio representado por la siguiente ecuación:
 EJERCICIOS DE EQUILIBRIO QUÍMICO 1º) Dado el sistema de equilibrio representado por la siguiente ecuación: NH4HS (s) NH3 (g) + H2S (g) Indique, razonadamente, cómo varían las concentraciones de las especies
EJERCICIOS DE EQUILIBRIO QUÍMICO 1º) Dado el sistema de equilibrio representado por la siguiente ecuación: NH4HS (s) NH3 (g) + H2S (g) Indique, razonadamente, cómo varían las concentraciones de las especies
UNGS - Elementos de Matemática Práctica 7 Matriz insumo producto
 UNGS - Elementos de Mtemátic Práctic 7 Mtriz insumo producto El economist W. Leontief es el utor del modelo o l tbl de insumo producto. Est tbl refle l interrelción entre distintos sectores de l economí
UNGS - Elementos de Mtemátic Práctic 7 Mtriz insumo producto El economist W. Leontief es el utor del modelo o l tbl de insumo producto. Est tbl refle l interrelción entre distintos sectores de l economí
7. Equilibrio ácido-base II
 7. Equilibrios ácido-bse II Químic (1S, Grdo Biologí) UAM 7. Equilibrio ácido-bse II Contenidos Equilibrios ácido-bse II Propieddes ácido-bse de ls sles: hidrólisis. Indicdores ácido-bse Recciones ácido-bse.
7. Equilibrios ácido-bse II Químic (1S, Grdo Biologí) UAM 7. Equilibrio ácido-bse II Contenidos Equilibrios ácido-bse II Propieddes ácido-bse de ls sles: hidrólisis. Indicdores ácido-bse Recciones ácido-bse.
TEMA 4: EL EQUILIBRIO QUÍMICO
 QUÍMICA º BACHILLERATO.- BLOQUE VII: EQUILIBRIO QUÍMICO 1. CONCETO DE EQUILIBRIO QUÍMICO TEMA 4: EL EQUILIBRIO QUÍMICO Las reacciones químicas no tienen lugar siempre a la misma velocidad, ni se alcanza
QUÍMICA º BACHILLERATO.- BLOQUE VII: EQUILIBRIO QUÍMICO 1. CONCETO DE EQUILIBRIO QUÍMICO TEMA 4: EL EQUILIBRIO QUÍMICO Las reacciones químicas no tienen lugar siempre a la misma velocidad, ni se alcanza
GUIA DE ESTUDIO Nº 7: Equilibrio Químico
 Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Estabilidad de los sistemas en tiempo discreto
 Estbilidd de los sistems en tiempo discreto En tiempo discreto tmbién se puede hblr de estbilidd de estdo y de estbilidd de entrd slid de form similr l empled pr los sistems en tiempo continuo. Podemos
Estbilidd de los sistems en tiempo discreto En tiempo discreto tmbién se puede hblr de estbilidd de estdo y de estbilidd de entrd slid de form similr l empled pr los sistems en tiempo continuo. Podemos
INGENIERIA DE EJECUCION EN CLIMATIZACION 15082-15202
 UNIVERSIDAD DE SANTIAGO DE CHILE FACULTAD DE INGENIERÍA Deprtmento de Ingenierí Mecánic CAV/mm. INGENIERIA DE EJECUCION EN CLIMATIZACION 15082-15202 ASIGNATURA MECANICA DE FLUIDOS NIVEL 04 EXPERIENCIA
UNIVERSIDAD DE SANTIAGO DE CHILE FACULTAD DE INGENIERÍA Deprtmento de Ingenierí Mecánic CAV/mm. INGENIERIA DE EJECUCION EN CLIMATIZACION 15082-15202 ASIGNATURA MECANICA DE FLUIDOS NIVEL 04 EXPERIENCIA
Los números racionales:
 El número rel MATEMÁTICAS I 1 1. EL CONJUNTO DE LOS NÚMEROS REALES. LA RECTA REAL 1.1. El conjunto de los números reles. Como y sbes los números nturles surgen de l necesidd de contr, expresr medids, pr
El número rel MATEMÁTICAS I 1 1. EL CONJUNTO DE LOS NÚMEROS REALES. LA RECTA REAL 1.1. El conjunto de los números reles. Como y sbes los números nturles surgen de l necesidd de contr, expresr medids, pr
REPASO DE ECUACIONES (4º ESO)
 TIPOS DE ECUACIONES.- REPASO DE ECUACIONES ( ESO) Eisten diversos tipos de ecuciones, entre ells estudiremos: Polinómics: En ells, l incógnit prece solmente en epresiones polinómics. El grdo de un ecución
TIPOS DE ECUACIONES.- REPASO DE ECUACIONES ( ESO) Eisten diversos tipos de ecuciones, entre ells estudiremos: Polinómics: En ells, l incógnit prece solmente en epresiones polinómics. El grdo de un ecución
TEMA 5 LÍMITES DE FUNCIONES, CONTINUIDAD Y ASÍNTOTAS
 Tem 5 Límites de funciones, continuidd y síntots Mtemátics CCSSII º Bch 1 TEMA 5 LÍMITES DE FUNCIONES, CONTINUIDAD Y ASÍNTOTAS 5.1 LÍMITE DE UNA FUNCIÓN 5.1.1 LÍMITE DE UNA FUNCIÓN EN UN PUNTO Límite de
Tem 5 Límites de funciones, continuidd y síntots Mtemátics CCSSII º Bch 1 TEMA 5 LÍMITES DE FUNCIONES, CONTINUIDAD Y ASÍNTOTAS 5.1 LÍMITE DE UNA FUNCIÓN 5.1.1 LÍMITE DE UNA FUNCIÓN EN UN PUNTO Límite de
CUADERNO DE TRABAJO PARA LA CLASE NÚMEROS REALES
 FUNDAMENTOS DEL ÁLGEBRA CUADERNO DE TRABAJO PARA LA CLASE NÚMEROS REALES NOMBRE ID SECCIÓN SALÓN Prof. Evelyn Dávil Tbl de contenido TEMA A. CONJUNTOS NUMÉRICOS... REGLA PARA LA SUMA DE NÚMEROS REALES...
FUNDAMENTOS DEL ÁLGEBRA CUADERNO DE TRABAJO PARA LA CLASE NÚMEROS REALES NOMBRE ID SECCIÓN SALÓN Prof. Evelyn Dávil Tbl de contenido TEMA A. CONJUNTOS NUMÉRICOS... REGLA PARA LA SUMA DE NÚMEROS REALES...
LÍMITES CONCEPTO INTUITIVO DE LÍMITE
 Mrí Teres Szostk Ingenierí Comercil Mtemátic II Clse Nº, LÍMITES El concepto de ite, es uno de los pilres en que se bs el Análisis Mtemático, se encontrb en 8 en estdo potencil, ern más principios intuitivos
Mrí Teres Szostk Ingenierí Comercil Mtemátic II Clse Nº, LÍMITES El concepto de ite, es uno de los pilres en que se bs el Análisis Mtemático, se encontrb en 8 en estdo potencil, ern más principios intuitivos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
O(0, 0) verifican que. Por tanto,
 Jun Antonio González Mot Proesor de Mtemátics del Colegio Jun XIII Zidín de Grnd SIMETRIA RESPECTO DEL ORIGEN. FUNCIONES IMPARES: Un unción es simétric respecto del origen O, su simétrico respecto de O
Jun Antonio González Mot Proesor de Mtemátics del Colegio Jun XIII Zidín de Grnd SIMETRIA RESPECTO DEL ORIGEN. FUNCIONES IMPARES: Un unción es simétric respecto del origen O, su simétrico respecto de O
Capítulo III AGUA EN EL SUELO
 Cpítulo III AGUA EN EL SUELO Curso de Hidrologí e Hidráulic Aplicds Agu en el Suelo III. AGUA EN EL SUELO III.1 AGUA SUBSUPERFICIAL (Cp. 4 V.T.Chow) Entre l superficie del terreno y el nivel freático (del
Cpítulo III AGUA EN EL SUELO Curso de Hidrologí e Hidráulic Aplicds Agu en el Suelo III. AGUA EN EL SUELO III.1 AGUA SUBSUPERFICIAL (Cp. 4 V.T.Chow) Entre l superficie del terreno y el nivel freático (del
TEMA 5 LÍMITES Y CONTINUIDAD DE FUNCIONES
 TEMA 5 LÍMITES Y CONTINUIDAD DE FUNCIONES 5.1. LÍMITE DE UNA FUNCIÓN EN UN PUNTO. LÍMITES LATERALES 5.1.1. Concepto de tendenci Decimos que " tiende " si tom los vlores de un sucesión que se proim. Se
TEMA 5 LÍMITES Y CONTINUIDAD DE FUNCIONES 5.1. LÍMITE DE UNA FUNCIÓN EN UN PUNTO. LÍMITES LATERALES 5.1.1. Concepto de tendenci Decimos que " tiende " si tom los vlores de un sucesión que se proim. Se
Tema II. Equilibrio químico IES As Telleiras
 EQUILIBRIO QUÍMICO Intuitivamente, se tiene la idea de que una reacción química es una transformación total, por la que unas sustancias desaparecen totalmente dando lugar a los productos. Una idea así
EQUILIBRIO QUÍMICO Intuitivamente, se tiene la idea de que una reacción química es una transformación total, por la que unas sustancias desaparecen totalmente dando lugar a los productos. Una idea así
Grado en Biología Tema 3 Integración. La regla del trapecio.
 Grdo en Biologí Tem Integrción Sección.: Aproximción numéric de integrles definids. Hy funciones de ls que no se puede hllr un primitiv en términos de funciones elementles. Esto sucede, por ejemplo, con
Grdo en Biologí Tem Integrción Sección.: Aproximción numéric de integrles definids. Hy funciones de ls que no se puede hllr un primitiv en términos de funciones elementles. Esto sucede, por ejemplo, con
ACTIVIDADES DE APRENDIZAJE Nº 5... 112
 FACULTAD DE INGENIERÍA - UNJ Unidd : olinomios UNIDAD olinomios Introducción - Epresiones lgebrics - Clsificción de ls epresiones lgebrics - Epresiones lgebrics enters 7 - Monomios 7 - Grdo de un monomio
FACULTAD DE INGENIERÍA - UNJ Unidd : olinomios UNIDAD olinomios Introducción - Epresiones lgebrics - Clsificción de ls epresiones lgebrics - Epresiones lgebrics enters 7 - Monomios 7 - Grdo de un monomio
0,5 =0,7 0,35 0,5 =0,7
 1. El pentacloruro de fósforo se disocia según el equilibrio homogéneo en fase gaseosa: PCl 5 (g) PCl (g) + Cl (g). A una temperatura determinada, se introducen en un matraz de medio litro de capacidad
1. El pentacloruro de fósforo se disocia según el equilibrio homogéneo en fase gaseosa: PCl 5 (g) PCl (g) + Cl (g). A una temperatura determinada, se introducen en un matraz de medio litro de capacidad
I.3.1.3 Hidroformilación bifásica de 1-octeno con sistemas de Rh/fosfina perfluorada P(C 6 H 4 -p-och 2 C 7 F 15 ) 3
 I.3 Discusión de resultdos I.3.1.3 Hidroformilción ifásic de 1-octeno con sistems de Rh/fosfin perfluord P(C 6 H 4 -p-och 2 C 7 F 15 ) 3 Como y se h comentdo en l introducción l ctálisis ifásic en sistems
I.3 Discusión de resultdos I.3.1.3 Hidroformilción ifásic de 1-octeno con sistems de Rh/fosfin perfluord P(C 6 H 4 -p-och 2 C 7 F 15 ) 3 Como y se h comentdo en l introducción l ctálisis ifásic en sistems
CONTROL DE PROCESOS FACET UNT TEMA 1 Nota Auxiliar B ÁLGEBRA DE BLOQUES
 Digrms en Bloques Un sistem de control puede constr de ciert cntidd de componentes. Pr mostrr ls funciones que reliz cd componente se costumr usr representciones esquemátics denominds Digrm en Bloques.
Digrms en Bloques Un sistem de control puede constr de ciert cntidd de componentes. Pr mostrr ls funciones que reliz cd componente se costumr usr representciones esquemátics denominds Digrm en Bloques.
CORPORACION UNIFICADA NACIONAL DE EDUCACION SUPERIOR CUN DEPARTAMENTO DE CIENCIAS BASICAS: MATEMATICAS
 CORPORACION UNIFICADA NACIONAL DE EDUCACION SUPERIOR CUN DEPARTAMENTO DE CIENCIAS BASICAS: MATEMATICAS ACTIVIDAD ACADEMICA: LOGICA Y PENSAMIENTO MATEMATICO DOCENTE: LIC- ING: ROSMIRO FUENTES ROCHA UNIDAD
CORPORACION UNIFICADA NACIONAL DE EDUCACION SUPERIOR CUN DEPARTAMENTO DE CIENCIAS BASICAS: MATEMATICAS ACTIVIDAD ACADEMICA: LOGICA Y PENSAMIENTO MATEMATICO DOCENTE: LIC- ING: ROSMIRO FUENTES ROCHA UNIDAD
PROGRESIONES ARITMETICAS
 PROGRESIONES ARITMETICAS. Hllr l sum de los primeros cien enteros positivos múltiplos de 7. L sum de n términos de un progresión ritmétic viene dd por l expresión: + n Sn n Aplicndo pr 00 términos: + 00
PROGRESIONES ARITMETICAS. Hllr l sum de los primeros cien enteros positivos múltiplos de 7. L sum de n términos de un progresión ritmétic viene dd por l expresión: + n Sn n Aplicndo pr 00 términos: + 00
Unidad 1: Números reales.
 Unidd 1: Números reles. 1 Unidd 1: Números reles. 1.- Números rcionles e irrcionles Números rcionles: Son quellos que se pueden escriir como un frcción. 1. Números enteros 2. Números decimles exctos y
Unidd 1: Números reles. 1 Unidd 1: Números reles. 1.- Números rcionles e irrcionles Números rcionles: Son quellos que se pueden escriir como un frcción. 1. Números enteros 2. Números decimles exctos y
Tema 6: Equilibrio químico.
 Tema 6: Equilibrio químico. Equilibrio en las recciones químicas. Constante de equilibrio. Propiedades de las constantes de equilibrio. Constantes de equilibrio K c y K p. Equilibrio en mezclas heterogéneas.
Tema 6: Equilibrio químico. Equilibrio en las recciones químicas. Constante de equilibrio. Propiedades de las constantes de equilibrio. Constantes de equilibrio K c y K p. Equilibrio en mezclas heterogéneas.
Volumetrías Acido-Base
 olumetrís Acido-Bse Acido Bse Acido /Bse fuerte con se/ ácido fuerte H OH - H 2 O Acido /Bse déil con se/ ácido fuerte AHOH - A - H 2 O B - H BH Acido /Bse déil con se/ ácido déil AHB - A - BH Acido/se
olumetrís Acido-Bse Acido Bse Acido /Bse fuerte con se/ ácido fuerte H OH - H 2 O Acido /Bse déil con se/ ácido fuerte AHOH - A - H 2 O B - H BH Acido /Bse déil con se/ ácido déil AHB - A - BH Acido/se
MECANICA DE FLUIDOS Y MAQUINAS FLUIDODINAMICAS. Guía Trabajos Prácticos N 4 Ecuación de Bernoulli. Mediciones manométricas
 MECNIC DE FLUIDOS Y MQUINS FLUIDODINMICS Guí Trbjos Prácticos N 4 Ecución de Bernoulli. Mediciones mnométrics. L presión mnométric en es -0, Kg/cm. Determinr el peso específico reltivo del líquido mnométrico.
MECNIC DE FLUIDOS Y MQUINS FLUIDODINMICS Guí Trbjos Prácticos N 4 Ecución de Bernoulli. Mediciones mnométrics. L presión mnométric en es -0, Kg/cm. Determinr el peso específico reltivo del líquido mnométrico.
PROPORCIONALIDAD DIRECTA E INVERSA
 PROPORCIONALIDAD DIRECTA E INVERSA Rzón entre dos números Siempre que hblemos de Rzón entre dos números nos estremos refiriendo l cociente (el resultdo de dividirlos) entre ellos. Entonces: Rzón entre
PROPORCIONALIDAD DIRECTA E INVERSA Rzón entre dos números Siempre que hblemos de Rzón entre dos números nos estremos refiriendo l cociente (el resultdo de dividirlos) entre ellos. Entonces: Rzón entre
TEMA 1: FUNCIONES. LÍMITES Y CONTINUIDAD
 Conceptos preinres TEMA : FUNCIONES. LÍMITES Y CONTINUIDAD Un función es un relción entre dos mgnitudes, de tl mner que cd vlor de l primer le sign un único vlor de l segund. Si A y B son dos conjuntos,
Conceptos preinres TEMA : FUNCIONES. LÍMITES Y CONTINUIDAD Un función es un relción entre dos mgnitudes, de tl mner que cd vlor de l primer le sign un único vlor de l segund. Si A y B son dos conjuntos,
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2009 PRIMERA PARTE
 1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
Contenidos. Equilibrios heterogéneos. Importancia en procesos industriales. Equilibrios de precipitación (otra presentación)
 Equilibrio químico Contenidos Programación didáctica: contenidos y criterios de evaluación Conceptos previos Concepto de equilibrio químico. Tipos de equilibrio Ley de acción de masas. Constantes de equilibrio
Equilibrio químico Contenidos Programación didáctica: contenidos y criterios de evaluación Conceptos previos Concepto de equilibrio químico. Tipos de equilibrio Ley de acción de masas. Constantes de equilibrio
APUNTES DE MATEMÁTICAS
 APUNTES DE MATEMÁTICAS TEMA 8: FUNCIONES.LÍMITES º BACHILLERATO FUNCIONES.Límites y continuidd ÍNDICE. LíMITES Y CONTINUIDAD DE FUNCIONES...3. Definición límite de un función en un punto...4 3. Definición
APUNTES DE MATEMÁTICAS TEMA 8: FUNCIONES.LÍMITES º BACHILLERATO FUNCIONES.Límites y continuidd ÍNDICE. LíMITES Y CONTINUIDAD DE FUNCIONES...3. Definición límite de un función en un punto...4 3. Definición
Una magnitud es cualquier propiedad que se puede medir numéricamente.
 Etueri Clses Prticulres Online Tem 4. Proporcionlidd Mgnitudes Un mgnitud es culquier propiedd que se puede medir numéricmente. Ejemplos: longitud, cpcidd de un recipiente, peso, Rzón L rzón es el cociente
Etueri Clses Prticulres Online Tem 4. Proporcionlidd Mgnitudes Un mgnitud es culquier propiedd que se puede medir numéricmente. Ejemplos: longitud, cpcidd de un recipiente, peso, Rzón L rzón es el cociente
LÍMITES DE FUNCIONES
 LÍMITES DE FUNCIONES IDEA INTUITIVA DE LÍMITE DE UNA FUNCIÓN EN UN PUNTO. Ejemplo : Consideremos l gráic de l unción: si < si > Si tom vlores próimos, distintos de y menores que ej.: 9, 99, 999,, se not
LÍMITES DE FUNCIONES IDEA INTUITIVA DE LÍMITE DE UNA FUNCIÓN EN UN PUNTO. Ejemplo : Consideremos l gráic de l unción: si < si > Si tom vlores próimos, distintos de y menores que ej.: 9, 99, 999,, se not
Corriente eléctrica. 1. Corriente eléctrica: Intensidad y densidad de corriente. 2. Ley de Ohm. Resistencia. Conductividad eléctrica.
 Corriente eléctric 1. Corriente eléctric: ntensidd y densidd de corriente. 2. Ley de Ohm. Resistenci. Conductividd eléctric. 3. Potenci disipd en un conductor. Ley de Joule. Fuerz electromotriz. BBLOGRAFÍA:.
Corriente eléctric 1. Corriente eléctric: ntensidd y densidd de corriente. 2. Ley de Ohm. Resistenci. Conductividd eléctric. 3. Potenci disipd en un conductor. Ley de Joule. Fuerz electromotriz. BBLOGRAFÍA:.
Máximo común divisor. 2. Descomposición en primos Ejemplo. Encontrar mcd 504,300 Se descomponen ambos números en primos 504 2 252 2 126 2 63 3 21 3
 Máximo común divisor El máximo común divisor de dos números nturles y es el número más grnde que divide tnto como. se denot mcd,. Lists: (tl vez, el más intuitivo, pero el menos eficiente) Encontrr mcd
Máximo común divisor El máximo común divisor de dos números nturles y es el número más grnde que divide tnto como. se denot mcd,. Lists: (tl vez, el más intuitivo, pero el menos eficiente) Encontrr mcd
POTENCIAS Y LOGARITMOS DE NÚMEROS REALES
 www.mtesrond.net José A. Jiméne Nieto POTENCIAS Y LOGARITMOS DE NÚMEROS REALES. POTENCIAS DE NÚMEROS REALES.. Potencis de eponente entero L potenci de se un número rel eponente entero se define sí: n (
www.mtesrond.net José A. Jiméne Nieto POTENCIAS Y LOGARITMOS DE NÚMEROS REALES. POTENCIAS DE NÚMEROS REALES.. Potencis de eponente entero L potenci de se un número rel eponente entero se define sí: n (
3. El logaritmo de una potencia cuya base es igual a la base del logaritmo es igual al exponente de la potencia: Log a a m = m, ya que a m =a m
 LOGARITMOS Ddo un número rel positivo, no nulo y distinto de 1, ( > 0; 0; 1), y un número n positivo y no nulo (n > 0;n 0), se llm ritmo en bse de n l exponente x l que hy que elevr dich bse pr obtener
LOGARITMOS Ddo un número rel positivo, no nulo y distinto de 1, ( > 0; 0; 1), y un número n positivo y no nulo (n > 0;n 0), se llm ritmo en bse de n l exponente x l que hy que elevr dich bse pr obtener
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
LÍMITES DE FUNCIONES
 LÍMITES DE FUNCIONES Se dice que un función y f() tiene límite "L" cundo l tiende "" y lo representmos por: f() L cundo pr tod sucesión de números reles que se proime "" tnto como quermos, los vlores correspondientes
LÍMITES DE FUNCIONES Se dice que un función y f() tiene límite "L" cundo l tiende "" y lo representmos por: f() L cundo pr tod sucesión de números reles que se proime "" tnto como quermos, los vlores correspondientes
Equilibrio Químico. b) La reacción directa y la reacción inversa conducen al mismo estado de equilibrio.
 . Introuón Equlro Químo ermonám. em 4 El esto e equlro e ls reones químs reversles en sstems y onstntes tene ls sguentes rterísts: ) L omposón e los omponentes e l reón no vrí en el tempo. or eso, es posle
. Introuón Equlro Químo ermonám. em 4 El esto e equlro e ls reones químs reversles en sstems y onstntes tene ls sguentes rterísts: ) L omposón e los omponentes e l reón no vrí en el tempo. or eso, es posle
Funciones cuadráticas
 Funciones cudrátics A l función polinómic de segundo grdo f() + b + c siendo, b, c números reles y 0, se l denomin función cudrátic. Los términos de l función reciben los siguientes nombres: y + b + c
Funciones cudrátics A l función polinómic de segundo grdo f() + b + c siendo, b, c números reles y 0, se l denomin función cudrátic. Los términos de l función reciben los siguientes nombres: y + b + c
accés a la universitat dels majors de 25 anys MATEMÀTIQUES UNIDAD DIDÁCTICA 4: LOGARITMOS
 Unitt d ccés ccés l universitt dels mjors de 25 ns Unidd de cceso cceso l universidd de los mores de 25 ños UNIDAD DIDÁCTICA 4: LOGARITMOS ÍNDICE 1. Introducción 2. Potencis funciones eponenciles 3. Función
Unitt d ccés ccés l universitt dels mjors de 25 ns Unidd de cceso cceso l universidd de los mores de 25 ños UNIDAD DIDÁCTICA 4: LOGARITMOS ÍNDICE 1. Introducción 2. Potencis funciones eponenciles 3. Función
Equilibrio químico. Qué es un equilibrio químico? Reacciones unidireccionales. Variación de la concentración con el tiempo (H 2 + I 2 2 HI)
 Equilibrio químico Carlos Paucar 010 Contenidos 1.- Concepto de equilibrio químico. 1.1. Características. Aspecto dinámico de las reacciones químicas..- Ley de acción de masas. C. 3.- Grado de disociación
Equilibrio químico Carlos Paucar 010 Contenidos 1.- Concepto de equilibrio químico. 1.1. Características. Aspecto dinámico de las reacciones químicas..- Ley de acción de masas. C. 3.- Grado de disociación
Colegio San Patricio A Incorporado a la Enseñanza Oficial Fundación Educativa San Patricio
 NUMEROS IRRACIONALES Conocemos hst hor distintos conjuntos numéricos: - Los n nturles: (, 8,.978), representdos por l letr N - Los n enteros: ( -, -, 8, 68), representdos por l letr Z - Los n rcionles
NUMEROS IRRACIONALES Conocemos hst hor distintos conjuntos numéricos: - Los n nturles: (, 8,.978), representdos por l letr N - Los n enteros: ( -, -, 8, 68), representdos por l letr Z - Los n rcionles
TEMA 11: EQUILIBRIOS ACIDO BASE
 TEMA 11: EQUILIBRIOS AIDO BASE Ls recciones ácidobse, especilmente quells que ocurren en disolución cuos, son de trscendentl importnci pr l químic experimentl, l biologí, l geologí, y por lo tnto, pr numerosos
TEMA 11: EQUILIBRIOS AIDO BASE Ls recciones ácidobse, especilmente quells que ocurren en disolución cuos, son de trscendentl importnci pr l químic experimentl, l biologí, l geologí, y por lo tnto, pr numerosos
Coordinación de Matemática I (MAT021) 1 er Semestre de 2013 Semana 4: Lunes 1 - Viernes 5 de Abril. Contenidos
 Coordinción de Mtemátic I (MAT01) 1 er Semestre de 013 Semn 4: Lunes 1 - Viernes 5 de Abril Complementos Contenidos Clse 1: Funciones trigonométrics. Clse : Funciones sinusoidles y ecuciones trigonométrics.
Coordinción de Mtemátic I (MAT01) 1 er Semestre de 013 Semn 4: Lunes 1 - Viernes 5 de Abril Complementos Contenidos Clse 1: Funciones trigonométrics. Clse : Funciones sinusoidles y ecuciones trigonométrics.
8. MEZCLAS GAS-VAPOR. AIRE HÚMEDO. CARTA PSICROMÉTRICA. PROCESOS DE CONDICIONAMIENTO DE AIRE
 8. MEZCLAS GAS-VAPOR. AIRE HÚMEDO. CARTA PSICROMÉTRICA. PROCESOS DE CONDICIONAMIENTO DE AIRE 8.1 MEZCLAS DE GASES IDEALES Y VAPORES En muchos sistems de ingenierí, tles como ls uniddes de ire condiciondo,
8. MEZCLAS GAS-VAPOR. AIRE HÚMEDO. CARTA PSICROMÉTRICA. PROCESOS DE CONDICIONAMIENTO DE AIRE 8.1 MEZCLAS DE GASES IDEALES Y VAPORES En muchos sistems de ingenierí, tles como ls uniddes de ire condiciondo,
INTEGRACIÓN. CÁLCULO DE
 Cpítulo INTEGRACIÓN. CÁLCULO DE ÁREAS.. Introducción Si el problem del cálculo de l rect tngente llevó los mtemáticos del siglo XVII l desrrollo de ls técnics de l derivción, otro problem, el del cálculo
Cpítulo INTEGRACIÓN. CÁLCULO DE ÁREAS.. Introducción Si el problem del cálculo de l rect tngente llevó los mtemáticos del siglo XVII l desrrollo de ls técnics de l derivción, otro problem, el del cálculo
PROBLEMAS DE OPTIMIZACIÓN
 PROBLEMAS DE OPTIMIZACIÓN Plntemiento y resolución de los problems de optimizción Se quiere construir un cj, sin tp, prtiendo de un lámin rectngulr de cm de lrg por de nch. Pr ello se recortrá un cudrdito
PROBLEMAS DE OPTIMIZACIÓN Plntemiento y resolución de los problems de optimizción Se quiere construir un cj, sin tp, prtiendo de un lámin rectngulr de cm de lrg por de nch. Pr ello se recortrá un cudrdito
TEMA 6 EQUILIBRIO QUÍMICO
 TEMA 6 EQUILIBRIO QUÍMICO ÍNDICE 1. Equilibrio químico homogéneo y heterogéneo 2. Concentraciones en equilibrio 3. Constante de equilibrio K c 4. Constantes de equilibrio K p y K c 5. Cociente de reacción
TEMA 6 EQUILIBRIO QUÍMICO ÍNDICE 1. Equilibrio químico homogéneo y heterogéneo 2. Concentraciones en equilibrio 3. Constante de equilibrio K c 4. Constantes de equilibrio K p y K c 5. Cociente de reacción
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO
 Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm 3 contiene una mezcla gaseosa en equilibrio de 0,003 moles de hidrógeno, 0,003 moles de yodo
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm 3 contiene una mezcla gaseosa en equilibrio de 0,003 moles de hidrógeno, 0,003 moles de yodo
9. EQUILIBRIO QUÍMICO
 - 167-9. EQUILIBRIO QUÍMICO Generalmente, las reacciones químicas no son completas, sino que alcanzan un estado de equilibrio en el que coexisten reactivos y productos. En algunos casos, como ocurre con
- 167-9. EQUILIBRIO QUÍMICO Generalmente, las reacciones químicas no son completas, sino que alcanzan un estado de equilibrio en el que coexisten reactivos y productos. En algunos casos, como ocurre con
TEMA 13: Termodinámica
 QUÍMICA I TEMA 13: Termodinámica Tecnólogo Minero Temario ü Procesos espontáneos ü Entropía ü Segunda Ley de la Termodinámica ü Energía libre de Gibbs ü Energía libre y equilibrio químico Procesos espontáneos
QUÍMICA I TEMA 13: Termodinámica Tecnólogo Minero Temario ü Procesos espontáneos ü Entropía ü Segunda Ley de la Termodinámica ü Energía libre de Gibbs ü Energía libre y equilibrio químico Procesos espontáneos
Ecuaciones de estado termodinámicas
 cuciones de estdo termodinámics Químic Físic del stdo Sólido U A M 4 5 Luis Seijo ontenidos cuciones de estdo termodinámics Repso de funciones termodinámics cuciones de estdo fecto de l presión sobre l
cuciones de estdo termodinámics Químic Físic del stdo Sólido U A M 4 5 Luis Seijo ontenidos cuciones de estdo termodinámics Repso de funciones termodinámics cuciones de estdo fecto de l presión sobre l
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
1.- Obtener, sin calculadora, el valor de x en las siguientes expresiones: (5 ) = = = 5, por tanto 2x=-3/2 y x=-3/4 = ;
 RESOLUCIÓN DE LOS EJERCICIOS BÁSICOS DEFINICIÓN DE LOGARITMO.- Obtener, sin clculdor, el vlor de en ls siguientes epresiones: ) (/) = 7/; 7/= / =(/) =(/) -, por tnto =- b) = ; ( ) = = =, por tnto =-/ y
RESOLUCIÓN DE LOS EJERCICIOS BÁSICOS DEFINICIÓN DE LOGARITMO.- Obtener, sin clculdor, el vlor de en ls siguientes epresiones: ) (/) = 7/; 7/= / =(/) =(/) -, por tnto =- b) = ; ( ) = = =, por tnto =-/ y
DETERMINACIÓN DEL COEFICIENTE ADIABÁTICO DEL AIRE
 Lbortorio de Físic Generl rimer Curso (Termodinánic) DETERMINACIÓN DEL COEFICIENTE ADIABÁTICO DEL AIRE Fech: 07/0/05. Objetivo de l práctic Medir el coeficiente dibático del ire relizndo un expnsión rápid..
Lbortorio de Físic Generl rimer Curso (Termodinánic) DETERMINACIÓN DEL COEFICIENTE ADIABÁTICO DEL AIRE Fech: 07/0/05. Objetivo de l práctic Medir el coeficiente dibático del ire relizndo un expnsión rápid..
FORMULARIO EN DISTINTAS OPERACIONES FINANCIERAS 1. CAPITALIZACIÓN SIMPLE: ( ) ( )
 Isbel Nóvo Arechg FORMULARIO EN DISTINTAS OPERACIONES FINANCIERAS 1. CAPITALIZACIÓN SIMPLE: El tnto i y el tiepo n, tienen que estr correlciondos, es decir, referidos l iso período de tiepo, generlente
Isbel Nóvo Arechg FORMULARIO EN DISTINTAS OPERACIONES FINANCIERAS 1. CAPITALIZACIÓN SIMPLE: El tnto i y el tiepo n, tienen que estr correlciondos, es decir, referidos l iso período de tiepo, generlente
La hipérbola es el lugar geométrico de todos los puntos cuya diferencia de distancias a dos puntos fijos, llamados focos, es constante e igual a 2a.
 INSTITUTO VALLADOLID PREPARATORIA Págin 11 7 LA HIPÉRBOLA 7.1 DEFINICIONES L hipérol es el lugr geométrico de todos los puntos cuy diferenci de distncis dos puntos fijos, llmdos focos, es constnte e igul.
INSTITUTO VALLADOLID PREPARATORIA Págin 11 7 LA HIPÉRBOLA 7.1 DEFINICIONES L hipérol es el lugr geométrico de todos los puntos cuy diferenci de distncis dos puntos fijos, llmdos focos, es constnte e igul.
3. Resuelve y simplifica: 6. Resuelve y simplifica: Nombre y apellidos : Materia: MATEMATICAS (PENDIENTES) Curso: 2º ESO.
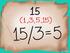 Nombre y pellidos : Mteri: MATEMATICAS PENDIENTES) Curso: º ESO ª entreg Fech: INSTRUCCIONES: Pr est primer entreg deberás trbjr losejercicios del l que quí te djuntmos pr ello debes yudrte de tu cuderno
Nombre y pellidos : Mteri: MATEMATICAS PENDIENTES) Curso: º ESO ª entreg Fech: INSTRUCCIONES: Pr est primer entreg deberás trbjr losejercicios del l que quí te djuntmos pr ello debes yudrte de tu cuderno
1. EXPRESIONES ALGEBRAICAS. CLASIFICACIÓN
 http://www.cepmrm.es ACFGS - Mtemátics ESG - /0 Pág. de Polinomios: Teorí ejercicios. EXPRESIONES ALGEBRAICAS. CLASIFICACIÓN Tnto en mtemátics, como en físic, en economí, en químic,... es corriente el
http://www.cepmrm.es ACFGS - Mtemátics ESG - /0 Pág. de Polinomios: Teorí ejercicios. EXPRESIONES ALGEBRAICAS. CLASIFICACIÓN Tnto en mtemátics, como en físic, en economí, en químic,... es corriente el
OPERACIONES CON FRACIONES
 LEY DE SIGNOS OPERACIONES CON FRACIONES SUMA Y RESTA: Si se sumn dos números con el mismo signo, se sumn los vlores solutos y se coloc el signo común (+) + (+) = + 8 (-) + (-) = - 8 Si se sumn dos números
LEY DE SIGNOS OPERACIONES CON FRACIONES SUMA Y RESTA: Si se sumn dos números con el mismo signo, se sumn los vlores solutos y se coloc el signo común (+) + (+) = + 8 (-) + (-) = - 8 Si se sumn dos números
Resolución ejercicios PRÁCTICO 5
 esolución ejercicios PÁCTICO 5 1. a) H 2 O 2 (g) H 2 (g) + O 2 (g) - [ H 2 O 2 (g)] = [ H 2 (g)] = [ O 2 (g)] t t t (vh 2 O 2 = vh 2 = vo 2 ) b) MnO 2 (s) + Mn(s) 2MnO(s) - [ MnO 2 (s)] = - [ Mn(s)] =
esolución ejercicios PÁCTICO 5 1. a) H 2 O 2 (g) H 2 (g) + O 2 (g) - [ H 2 O 2 (g)] = [ H 2 (g)] = [ O 2 (g)] t t t (vh 2 O 2 = vh 2 = vo 2 ) b) MnO 2 (s) + Mn(s) 2MnO(s) - [ MnO 2 (s)] = - [ Mn(s)] =
PROBLEMAS RESUELTOS SUMA DE VECTORES METODO GEOMÉTRICO
 PROBLEMAS RESUELTOS SUMA DE VECTORES METODO GEOMÉTRICO 1. Los vectores mostrdos en l figur tienen l mism mgnitud (10 uniddes) El vector (+c) + (d+) - c, es de mgnitud: c ) 0 ) 0 c) 10 d) 0 e) 10 d Este
PROBLEMAS RESUELTOS SUMA DE VECTORES METODO GEOMÉTRICO 1. Los vectores mostrdos en l figur tienen l mism mgnitud (10 uniddes) El vector (+c) + (d+) - c, es de mgnitud: c ) 0 ) 0 c) 10 d) 0 e) 10 d Este
RAZONAMIENTO MATEMÁTICO
 RAZONAMIENTO MATEMÁTICO CUATRO OPERACIONES. Por cd cutro docens de mnzns que un comercinte compr, le obsequin dos mnzns. Cuántos son de obsequio si llevó 4800 mnzns? A) 40 ) 76 C) D) 9 E) 84 4 doc 4
RAZONAMIENTO MATEMÁTICO CUATRO OPERACIONES. Por cd cutro docens de mnzns que un comercinte compr, le obsequin dos mnzns. Cuántos son de obsequio si llevó 4800 mnzns? A) 40 ) 76 C) D) 9 E) 84 4 doc 4
3. FUNCIONES VECTORIALES DE UNA VARIABLE REAL
 3. FUNCIONES VECTORIALES DE UNA VARIABLE REAL INDICE 3.1. Definición de función vectoril de un vrile rel, dominio y grficción.2 3.2. Límites y continuidd..3 3.3. Derivción de funciones vectoriles y sus
3. FUNCIONES VECTORIALES DE UNA VARIABLE REAL INDICE 3.1. Definición de función vectoril de un vrile rel, dominio y grficción.2 3.2. Límites y continuidd..3 3.3. Derivción de funciones vectoriles y sus
5. Integral y Aplicaciones
 Métodos Mtemáticos (Curso 203 204) Grdo en Óptic y Optometrí 29 5. Integrl y Aplicciones Primitiv de un función Un función F es un primitiv de f, en un intervlo I, si F (x) = f(x) pr todo x en I. Observción
Métodos Mtemáticos (Curso 203 204) Grdo en Óptic y Optometrí 29 5. Integrl y Aplicciones Primitiv de un función Un función F es un primitiv de f, en un intervlo I, si F (x) = f(x) pr todo x en I. Observción
1. Cuales son los números naturales?
 Guí de mtemátics. Héctor. de bril de 015 1. Cules son los números nturles? Los números nturles son usdos pr contr (por ejemplo, hy cinco moneds en l mes ) o pr imponer un orden (por ejemplo,. Es t es l
Guí de mtemátics. Héctor. de bril de 015 1. Cules son los números nturles? Los números nturles son usdos pr contr (por ejemplo, hy cinco moneds en l mes ) o pr imponer un orden (por ejemplo,. Es t es l
Tema 3. DETERMINANTES
 Tem. DETERMINNTES Definición de determinnte El determinnte de un mtriz cudrd es un número. Pr l mtriz, su determinnte se denot por det() o por. Pr un mtriz de orden,, se define: Ejemplo: Pr un mtriz de
Tem. DETERMINNTES Definición de determinnte El determinnte de un mtriz cudrd es un número. Pr l mtriz, su determinnte se denot por det() o por. Pr un mtriz de orden,, se define: Ejemplo: Pr un mtriz de
Práctico 9 - Cálculo de integrales. 1. Teorema fundamental y regla de Barrow
 Universidd de l Repúblic Cálculo Fcultd de Ingenierí - IMERL Segundo semestre 6 Práctico 9 - Cálculo de integrles. Teorem fundmentl y regl de Brrow. Utilizndo los resultdos del ejercicio 9 del práctico
Universidd de l Repúblic Cálculo Fcultd de Ingenierí - IMERL Segundo semestre 6 Práctico 9 - Cálculo de integrles. Teorem fundmentl y regl de Brrow. Utilizndo los resultdos del ejercicio 9 del práctico
Universidad Central de Venezuela Facultad de Farmacia Matemática - Física Prof. J. R. Morales
 Universidd Centrl de Venezuel Fcultd de Frmci Mtemátic - Físic Prof J R Morles Guí de Vectores (Resumen de l Teorí) 1 En físic distinguiremos dos tipos de cntiddes: vectoriles esclres Ls cntiddes vectoriles
Universidd Centrl de Venezuel Fcultd de Frmci Mtemátic - Físic Prof J R Morles Guí de Vectores (Resumen de l Teorí) 1 En físic distinguiremos dos tipos de cntiddes: vectoriles esclres Ls cntiddes vectoriles
Espacios vectoriales y Aplicaciones Lineales II: Núcleo e imagen. Diagonalización. Ker(f) = {x V f(x) = 0} Im(f) = {f(x) x V}.
 UNIVERSIDAD DE JAÉN ESCUELA POLITÉCNICA SUPERIOR Deprtmento de Mtemátics (Áre de Álgebr) Curso 28/9 PRÁCTICA Nº Espcios vectoriles y Aplicciones Lineles II: Núcleo e imgen. Digonlizción. NÚCLEO E IMAGEN
UNIVERSIDAD DE JAÉN ESCUELA POLITÉCNICA SUPERIOR Deprtmento de Mtemátics (Áre de Álgebr) Curso 28/9 PRÁCTICA Nº Espcios vectoriles y Aplicciones Lineles II: Núcleo e imgen. Digonlizción. NÚCLEO E IMAGEN
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Química
 Equilibrio Químico Programa de Acceso Inclusivo, Equidad y Permanencia RECUERDA QUE: el Equilibrio Químico, se presenta cuando reacciones opuestas ocurren a velocidades iguales. La velocidad a la que se
Equilibrio Químico Programa de Acceso Inclusivo, Equidad y Permanencia RECUERDA QUE: el Equilibrio Químico, se presenta cuando reacciones opuestas ocurren a velocidades iguales. La velocidad a la que se
En cinética, se asume que las reacciones se completan desde los reactivos hacia los productos, es decir, se asume que son irreversibles.
 Resumen 4 FUNDAMENTOS DEL EQUILIBRIO QUÍMICO Adaptado de http://apchemistrynmsi.wikispaces.com/ap+chemistry+class+lecture+notes+and+instructional+videos por el profesor Julio Clavijo para los grupos de
Resumen 4 FUNDAMENTOS DEL EQUILIBRIO QUÍMICO Adaptado de http://apchemistrynmsi.wikispaces.com/ap+chemistry+class+lecture+notes+and+instructional+videos por el profesor Julio Clavijo para los grupos de
10.- Teoremas de Adición.
 Trigonometrí 10.- Teorems de Adición. Rzones trigonométrics de los ángulos A + B y A B. Hy que tener cuiddo de no confundir l rzón trigonométric de l sum de dos ángulos, con l sum de dos rzones trigonométrics.
Trigonometrí 10.- Teorems de Adición. Rzones trigonométrics de los ángulos A + B y A B. Hy que tener cuiddo de no confundir l rzón trigonométric de l sum de dos ángulos, con l sum de dos rzones trigonométrics.
Cuál es su valor de CRF? Es normal? Qué enfermedad le sugiere esta valor de CRF?
 1 Bloque 1 Problem 1. Un niño es conectdo, después de un espirción norml, un bols conteniendo 2 litros de 8% He, 92% O 2. Respir de l bols hst que l mezcl es complet, y en ese momento l concentrción de
1 Bloque 1 Problem 1. Un niño es conectdo, después de un espirción norml, un bols conteniendo 2 litros de 8% He, 92% O 2. Respir de l bols hst que l mezcl es complet, y en ese momento l concentrción de
Qué es la aceleración? Es una magnitud vectorial que nos permite determinar la rapidez con la que un móvil cambia de velocidad. www.fisicaa.
 Qué es el movimiento rectilíneo uniformemente vrido? Es un movimiento mecánico que experiment un móvil donde l tryectori es rectilíne y l celerción es constnte. Qué es l celerción? Es un mgnitud vectoril
Qué es el movimiento rectilíneo uniformemente vrido? Es un movimiento mecánico que experiment un móvil donde l tryectori es rectilíne y l celerción es constnte. Qué es l celerción? Es un mgnitud vectoril
