Elaborado por: Berta Inés Delgado Fajardo
|
|
|
- Enrique Medina Pereyra
- hace 6 años
- Vistas:
Transcripción
1 LAS PROTEINAS 1. GENERALIDADES La palabra proteína se deriva de la palabra griega proteios que significa de primera importancia. Las proteínas son los componentes principales de todas las células del cuerpo. Son mucho más complejas que los carbohidratos y que las grasas. Las plantas sintetizan las proteínas a partir de los materiales presentes en el aire y en el suelo. Los animales no pueden sintetizar las proteínas a partir de esos materiales, y deben obtenerlos a partir de las proteínas de las plantas o de otros animales. Los animales excretan materiales de desecho que contienen muchos compuestos nitrogenados los cuales durante los procesos de descomposición realizados por las bacterias del suelo se convierten en compuestos solubles de nitrógeno. Las plantas usan estos compuestos para la fabricación de más proteínas completando un ciclo en la naturaleza. Una versión simplificada del ciclo de nitrógeno se observa en la figura 1. Proteínas de las plantas Proteínas de los animales Bacterias Nitrógeno Compuesto de nitrógeno soluble Ba denitrifi Producto de desecho animal Fig. 1. Esquema general del ciclo del nitrógeno La función principal de las proteínas en el cuerpo es la construcción de nuevas células, el mantenimiento de células existentes y el reemplazo de células viejas. Las proteínas son fuentes de energía en el cuerpo, la oxidación de un gramo de proteína produce cuatro calorías. Las proteínas son también necesarias para la formación de varias enzimas y hormonas que se encuentran en el cuerpo. 2. ENLACES PEPTIDICOS Atendiendo el punto de vista químico, las proteínas se definen como sustancias cuaternarias complejas, de alto peso molecular, formadas principalmente por -aminoácidos, ligados por uniones peptìdicas (amìdicas). Estas uniones se establecen por la condensación de dos o más aminoácidos, a través de sus grupos COO y N 2 (-COO - y N 3 + ) con pérdida de una molécula de agua.
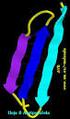
2 Residuo 1 Residuo 2 Residuo 3 Residuo 4 Residuo 5 Gly Ile Val Glu Gln O C 3 C 3 C=O O C O C 2 O N 3 + N C 2 O N C C 3 C 3 N C 2 O N C 2 C 2 O - C-terminal N-terminal C=O N 2 Fig 2. Pentapéptido formado por cinco aminoácidos con cuatro uniones peptídicas Cada unidad de aminoácido en el péptido, se llama residuo. La probabilidad de combinaciones de los 20 aminoácidos que se agrupan en diferente número y orden, es infinita, por lo que es posible la formación de diferentes especies químicas de acuerdo con la secuencia en que se dispongan éstos aminoácidos. Existen por ejemplo cadenas cortas de ocho aminoácidos que forman el polipéptido llamado oxitocina, con acción hormonal y es secretada por la hipófisis. El peso molecular de éste polipéptido es cercano a Sin embargo la mayoría de las proteínas están formadas por miles de aminoácidos, con altos pesos moleculares. El extremo del péptido con el grupo amino (-N3+) libre, se llama extremo N-terminal y generalmente se dibuja a la izquierda. El extremo del péptido con el grupo carboxilo libre (- COO-) se denomina C-terminal y se dibuja a la derecha. Los péptidos se nombran empezando por el aminoácido del extremo N-terminal y todos los aminoácidos excepto el último se nombran terminados en el sufijo il; el último residuo de aminoácido presente se le coloca el nombre completo del mismo. No debemos confundir el término "polipéptido" con el término "proteína." Polipéptido refiere a la estructura de una cadena única. Cada polipéptido tiene un grupo amino libre (N- terminal y un grupo carboxílico libre (C-terminal). Proteína se refiere a la unión funcional total, creada cuando uno o más polipéptidos se pliegan y llegan a ser unidades funcionales. Algunas proteínas consisten en una cadena de polipéptidos plegada, pero muchas proteínas contienen múltiples polipéptidos, y átomos inorgánicos como el zinc, el hierro y el magnesio. Las proteínas por estar formadas de aminoácidos tienen también un punto isoelectrico el cual es diferente para cada proteína. En el punto isoelectrico las proteínas tienen mínimo de solubilidad, mínima viscosidad y mínima presión osmótica. A un p por encima del punto isoelectrico las proteínas tienen mas cargas negativas que positivas. A un p por debajo del punto isoelectrico las proteínas tienen mas cargas positivas que negativas.
3 3. COMPOSICION PORCENTUAL DE LAS PROTEINAS La composición de las proteínas se expresa en términos del porcentaje de cada elemento (carbono, nitrógeno, oxígeno, hidrógeno, azufre, fósforo) en una muestra completamente seca. La tabla 1 muestra la composición porcentual general de las proteínas. Tabla 1. Valor porcentual de los elementos presentes en las proteínas Elemento Porcentaje de Cada Elemento Porcentaje promedio de Cada elemento Carbono Oxigeno Nitrógeno idrógeno Azufre De acuerdo con lo anterior, si cada 100g de proteína contienen 16g de nitrógeno, entonces la proporción de proteína representad por gramo de nitrógeno será de Por esta razón para calcular en general la cantidad de proteína en una muestra, se determina la cantidad de nitrógeno en gramos y se multiplica por Sin embargo este calculo no se aplica siempre porque hay proteínas como las globulinas del suero, que tienen el 17.2% de nitrógeno y en consecuencia el factor será ESTRUCTURA DE LAS PROTEINAS Cuando proteína que se hidroliza se va rompiendo en unidades más pequeñas hasta formar aminoácidos: Proteina 2 O Proteosas 2 O Peptonas 2 O Polipeptidos 2 O Dipeptidos 2 O Aminoacidos Las cadenas de aminoácidos se estructuran en cinco niveles: Estructura primaria: comprende los enlaces covalentes entre aminoácidos, los enlaces peptidicos. Todas las proteinas tienen ésta estructura. Estructura secundaria: se refiere a la disposición de la secuencia de aminoácidos en el espacio. Los aminoácidos a medida que van siendo enlazados durante la sintesis de proteinas y gracias a la capacidad de giro de sus enlaces, adquieren una disposición espacial estable, denominada estructura secundaria. Estas disposiciones espaciales repetitivas generan hélices- y hélices-. Las uniones no son covalentes Estructura terciaria: Resulta de la disposición de la estructura secundaria de un peptido al plegarse sobre si misma, originando una conformación globular. Esta conformación se mantiene estable gracias a la existencia de enlaces entre las cadenas laterales de los aminoácidos que pueden ser puentes disulfuro, puentes de hidrógeno, interacciones electrostáticas, interacciones hidrofobas. Se forma espontáneamente y depende del tamaño, forma y polaridad de los aminoácidos que forman la proteina, los que interactuan entre si y con el medio en que se encuentran. Las uniones no son covalentes Estructura cuaternaria: Se refiere a las uniones entre diferentes polipéptidos o subunidades (protómeros) de una proteina global con estructura terciaria, para formar un complejo proteico. Las uniones no son covalentes. Estructura quinaria: Las proteinas se agrupan entre si o con otras biomoléculas para formar estructuras supramoleculares que tienen carácter permanente Estructura primaria La estructura primaria de una proteína está determinada por el número de aminoácidos y el orden en que están enlazados, lo que se conoce como secuencia de aminoácidos. Los enlaces peptídico que participan en la estructura de una proteína son covalentes y van constituyendo
4 un esqueleto o cadena principal de la proteína a partir de la cual emergen las cadenas laterales de cada aminoácido. La estructura primaria es la que determina los niveles superiores de organización. N-terminal N-terminal Gly Ile Val Glu GlnCys Phe Val Asn Gln is Leu Cys Gly Ser is Leu Cys Ile Ser Thr Asn C-terminal Val Glu Ala Leu TyrLeu Cys Ser Leu Tyr Glu Asn Tyr Cys Gln Leu Cys Gly GluArg Gly Phe Phe Val Tyr C-terminal Thr Pro Lys Thr Fig.3. Estructura primaria de la insulina formada por dos cadenas polipétidicas El conocimiento de la secuencia de aminoácidos es muy importante para el estudio de su estructura y función. Desde el punto de vista funcional y filogenético es muy importante conocer la secuencia de aminoácidos porque cuánto más alejadas estén las especies en el árbol filogenético, mayores diferencias se observarán en la estructura primaria de las proteínas análogas pudiéndose establecer cómo han ido evolucionando con la aparición de nuevas especies. Es común encontrar que un mismo aminoácido aparece en la misma posición en las especies estudiadas (se conocen como aminoácidos invariantes o conservados) y son los que determinan la función y la estructura de la proteína. Cualquier cambio en ésa posición resulta letal para el organismo. Para la determinación de la secuencia de los aminoácidos en una proteína, los métodos más empleados son: el método de Edman, en el cuál se fundamenta el secuenciador de aminoácidos y el análisis de la secuenciación del DNA, que permite secuenciar una proteina. El método de Edman permite identificar cada aminoácido de la secuencia empezando por el extremo N-terminal. El método utiliza el fenilisotiocianato para generar una reacción con el aminoácido N-terminal del péptido produciendo un derivado feniltiohidantoinico y el resto del péptido sin modificar. De ésta forma se van determinando uno a uno los aminoácidos. Con base en ésta reacción opera el Secuenciador de aminoácidos que permite el análisis e identificación de las proteinas, incluidas posibles modificaciones posttraduccionales. Después que se ha separado el derivado feniltiohidantoinico-aminoácido (PT-aminoácido, por la sigla en inglés) éstos se analizan por un sistema capilar de cromatografía de líquidos de alta resolución. El sistema permite análisis de proteinas a nivel subpicomolar, pero solamente detecta entre 30 y 50 aminoácidos. Para continuar el análisis del resto de proteina (cuando ésta tiene más de 50 aminoácidos) deberá hidrolizarse para obtener péptidos más pequeños y a partir de ellos realizar el análisis.
5 1. Reacción del grupo amino libre (N-terminal) con isotiocianato de fenilo N C S N - C - C - N resto de cadena peptídica R O N C S N - C - C - N resto de cadena peptídica R O N C S N - C - C - N resto de cadena peptídica R O Feniltiourea 2. hidrólisis ácida moderada origina la ciclización y expulsión de la cadena más corta del polipéptido S S C C N N N N 2 O C - C - N resto de cadena peptídica C - C - N resto de cadena peptídica R O R O S C 2 O N N + N2 resto de cadena peptídica C - C R O Feniltiohidantoina Peptido con un aminoácido menos El análisis de la secuencia de ADN permite secuenciar una proteina teniendo en cuenta que cada grupo de tres bases de la secuencia del ADN especifica un aminoácido. El código genético (que es el mismo para todos los seres vivos) establece para cada grupo de tres nucleótidos (codón) el aminoácido que codifica. La tabla 2 muestra las primeras bases del codón, representadas por el color verde, el color naranja representa la segunda base y el color gris representa la tercera base.
6 U C A G U C A G Phe Ser Tyr Cys U Phe Ser Tyr Cys C Leu Ser STOP STOP A Leu Ser STOP Trp G Leu Pro is Arg U Leu Pro is Arg C Leu Pro Gln Arg A Leu Pro Gln Arg G Ile Thr Asn Ser U Ile Thr Asn Ser C Ile Thr Lys Arg A Met Thr Lys Arg G Val Ala Asp Gly U Val Ala Asp Gly C Val Ala Glu Gly A Val Ala Glu Gly G U C A G Tabla 2. Bases que codifican aminoácidos 4.2. Estructura Secundaria La estructura secundaria es una estructura plegada debido a la formación de puentes de hidrógeno que se establecen entre los grupos C=O y N de los enlaces peptídicos. Las conformaciones resultantes son de menor energía libre y por lo tanto más estables. Existen diferentes conformaciones que determinan la estructura secundaria: Conformación al azar élice oja Giros Conformación del colágeno Estructuras supersecundarias Conformación al azar. En algunas proteinas no existen interacciones suficientes para constituir un orden superior al de estructura primaria, en éstos casos se clasifican como proteinas de conformación al azar. En ellas la secuencia de los aminoácidos se divide en subsecuencias que constituyen una región independiente denominada dominio. Estos dominios se caracterizan por la presencia del zinc y reciben el nombre de dedos de Zinc. Los dominios zinc fingers son elementos estructurales muy estables cuya particularidad es la coordinación de uno o más átomos de zinc a través de residuos de cisteínas e histidinas. Son muy comunes en proteinas que interaccionan con el ADN. A continuación se presenta un ejemplo general de la estructura de un dominio dedo de zinc
7 C C Zn Zn C C Fig.4. Estructura general del dominio dedo de Zinc élice Se forma al enrollarse helicoidalmente sobre si misma la estructura primaria. El enrollamiento se debe a la formación de enlaces de hidrógeno entre el grupo C=O (C1) del grupo carboxilo y el N del cuarto aminoácido que le sigue en la cadena polipeptídica. Para comprender la estructura secundaria llamada hélice- debemos tener claro que un polipétido está formado por una sucesión de planos péptidicos como se muestra en la figura 5. Fig.5. Configuración de los planos péptidicos La cadena peptídico a lo largo del esqueleto carbonado, C, C1 (del grupo carboxílico) y el nitrógeno (del enlace amídico) está en general libre de rotación sin embargo las rotaciones están representadas por los ángulo de torsión llamados phi ( ), psi ( ), aunque existe un tercer ángulo de torsión denominado omega ( ). Ver fig.6. El ángulo omega generalmente es de 180 debido a la interacción de los pares electrónicos libres del grupo carbonilo con el par electrónico del nitrógeno. El ángulo phi ( ) mide el giro en torno al enlace que une al carbono alfa con el nitrógeno del plano anterior. El ángulo psi ( ): mide el giro en torno al carbono alfa unido al carbono del plano posterior (C1)
8 C Nitrógeno (phi) (psi) Nitrógeno C1 C C1 Nitrógeno Figura 6. Ángulos de torsión en un segmento de la cadena peptídico La fig.7 es otra representación de un segmento de polipéptido donde se muestran las longitudes de enlace y las repeticiones de los angulos de torsión. Fig.7. Ángulos de torsión y longitudes de enlace en un segmento de polipéptido. La conformación global de un polipéptido está definida por los ángulos phi y psi. No todos los valores están permitidos porque se generarían fuertes choques estéricos. El diagrama de Ramachandran 1 se utiliza para establecer los valores permitidos para phi y psi, en los cuales se sitúan la mayoría de los aminoácidos en las proteinas. Para el caso de la hélice-, los valores permitidos están alrededor de -60 y -50. Esta conformación facilita la formación de puentes de hidrógeno entre el grupo carbonilo (C=O) del residuo i y el nitrógeno del residuo i+4, como se observa en la figura 8. las hélices dan una vuelta cada 3.6 aminoácidos y las cadenas laterales salen hacia fuera del cilindro. Las hélices tienen una longitud promedio de 12 aminoácidos y son de configuración R. Las estructuras de hélice- no contienen el aminoácido prolina por el impedimento estérico del anillo y porque el nitrógeno de éste aa no puede formar puentes de hidrógeno. Los aminoácidos Lys y Glu desestabilizan la hélice-, debido a que los puentes de hidrogeno pierden importancia frente a las fuertes interacciones electrostáticas de atracción y repulsión. Por lo anterior la estructura hélice- predomina a valores de p en que los grupos ionizables no estén cargados. 1 Ramachandran utilizó un modelo computarizado para pequeños polipéptidos, variando sistemáticamente phi y psi con el fin de encontrar la conformación más estable.
9 Fig.8. Puentes de hidrógeno en una estructura hélice- La estructura hélice- se encuentra en proteinas fibrosas como la miosina (proteina del músculo) la -queratina (proteina del cabello) la lana y las uñas oja En ésta disposición los aminoácidos forman una cadena en zigzag denominada disposición de lámina plegada o lámina. Esta estructura se genera cuando dos o más aminoácidos consecutivos de una proteina adoptan ángulos phi de -140 y psi de En éste caso aparece solo una hebra. Cuando éstas dos hebras se sitúan una al lado de la otra y forman puentes de hidrógeno entre ellas, se configura la lámina. Todos los grupos C=O y N, forman puentes de hidrógeno con las hebras adyacentes. Cada lámina tiene un promedio de cinco hebras y cada hebra tiene un promedio de cinco residuos de aminoácidos. Las láminas pueden ser paralelas, antiparalelas y mixtas. Esta estructura se encuentra en la fibroina de la seda. Las láminas paralelas se presentan cuando los enlaces nitrógeno-carbono, tienen el mismo sentido, ver fig. 9
10 Fig. 9. Lámina paralela Cuando las hebras tienen diferente sentido, la hoja resultante se denomina antiparalela. Ver fig.10. Fig.10. Lámina antiparalela Giros Los giros son abundantes en las proteinas globulares y generalmente ocurren en la superficie de la molécula en la región donde el polipéptido forma un enlace por puente de hidrógeno entre el grupo carbonilo, C=O y el hidrógeno del nitrógeno i+3. En éstos giros abunda la Gly, Asn y Pro.
11 Estructura del colágeno Es una proteina fibrosa en la que se repiten periódicamente grupos de tres aminoácidos: Gly- Pro(o hidroxiprolina)-cualquier otro aa. La presencia de la prolina condiciona el enrollamiento de la proteina en forma de hélice levógira. La presencia de la glicina, aa caracterizado por no tener cadena lateral, permite el acercamiento de otras hélices de tal forma que tres hélices levógiras se asocian para formar un helicoide dextrógiro. Las moléculas de colágeno se asocian por interacciones hidrófobas para formar largas filas que están entrecruzadas. El entrecruzamiento se debe a los residuos de lisina que se oxidan y experimentan una condensación aldólica. La estructura triple helicoidal es la responsable de sus fuerzas de tensión. -terminal -terminal x, y: corresponden a los residuos de prolina e hidroxiprolina Fig.11. Estructura del colágeno El colágeno está presente en todos los animales multicelulares y es la proteina más abundante de los vertebrados. Es extracelular, las fibras son insolubles y resistentes a la tensión, está presente en huesos, cartílagos, tendones, ligamentos, piel y vasos sanguíneos. En los mamíferos hay 17 cadenas polipeptídicas diferentes que forman distintos tipos de moléculas de colágeno Estructuras supersecundarias Estas clases de estructuras se generan cuando las estructuras secundarias no se combinan al azar sino que antes de alcanzar la estructura terciaria, siguen una serie de patrones que se repiten entre los distintos tipos de proteina. Estos patrones reciben el nombre de motivos estructurales, plegamientos o estructuras supersecundarias. La estructura supersecundaria puede pertenecer a una unidad mayor denominada dominio y puede tener diferente función en proteinas diferentes. Las diferentes estructuras supersecundarias pueden estar formadas solo por hélices, solo por hojas o por una combinación de ambos. En la tabla 3, se relacionan algunos de los modelos de mayor interés.
12 Tabla 3. Estructuras supersecundarias de las proteinas Estructura supersecundaria formada por élices- Clase de estructura supersecundaria élice-giro-hélice élices arrolladas (coiled-coil) Mano EF Características Importancia Esquema estructural Formadas por dos hélices cortas, unidas entre si por un giro (frecuentemente ) Está formada por dos hélices largas yuxtapuestas que interaccionan entre si. La interacción puede establecerse a través de leucinas, formándose una especie de cremalleras de leucinas. Formada por dos hélices cortas, conectadas por un giro y con un átomo de calcio en el giro. Reciben el nombre porque asemejan una mano cogiendo una bola. Características de las proteínas que interaccionan con el ADN La cremallera sirve para unir dos monómeros con el fin de formar una estructura cuaternaria o para interaccionar con el ADN. Característica de proteínas que unen calcio
13 Continuación: Tabla 3. Estructuras supersecundarias de las proteinas Estructura supersecundaria formada por Clase de estructura supersecundaria orquilla Características Importancia Esquema estructural Formadas por dos hojas antiparalelas, conectadas por medio de un segmento con estructura al azar Se encuentra frecuentemente en las proteínas pero aun no se le ha descubierto alguna función concreta. Meandro Formada por varias hojas antiparalelas, conectadas por un giro y por estructuras al azar. Presente en proteínas globulares. élices Barril - - Formada por muchas hojas orientadas de forma antiparalela. Los residuos hidrofóbicos se orientan hacia el interior y la apariencia exterior es similar a un barril. Formada por dos hojas orientadas paralelamente mediante un segmento y dos segmentos con estructura al azar. Este dominio se presenta en la proteína que une retinol. Ocho hojas van adoptando la configuración de barril y en su interior alojan el retinol, que solamente deja por fuera el grupo hidroxilo. élices y ojas Plegamiento de Rosmann Es similar a la estructura - -, pero tiene más de dos subunidades Se encuentra frecuentemente en las proteínas unidas a nucleótidos.
14 4.3. Estructura Terciaria. La estructura terciaria de la proteína es la forma en la que se organizan en el espacio los diferentes tramos de la cadena polipeptídica, que pueden tener una estructura secundaria definida, como las hélices- o las hojas-, o no tenerla. Están representadas por los enrollamientos o superplegamientos de la estructura secundaria, constituyendo formas tridimensionales geométricas muy complicadas que se mantienen por enlaces fuertes. Las fuerzas que mantienen la estructura terciaria son las fuerzas no covalentes y las fuerzas covalentes. Las fuerzas no covalentes son: - Efecto hidrofóbico - Enlaces de hidrógeno - Interacciones iónicas o salinas Las fuerzas covalentes son: - Enlace disulfuro - Enlace amida Desde el punto de vista funcional, esta estructura es la más importante pues, al alcanzarla es cuando la mayoría de las proteinas adquieren su actividad biológica o función. Un ejemplo es la fosfatasa alcalina, proteina con muchos niveles de estructura. Está formada por dos cadenas de polipéptidos que al plegarse contiene regiones considerables de estructuras secundarias y y regiones menos plegadas de espiral aleatoria. Fig.12. Estructura terciaria de la fosfatasa alcalina 4.4. Estructura Cuaternaria La estructura cuaternaria es el nivel de formación en el cual las unidades de estructura terciaria se agregan para formar homomultímeros (formados por subunidades idénticas, ejemplo el dimero de IV-proteasa) o heteromultímeros (las subunidades no so idénticas, ejemplo la insulina, formada por dos cadenas una alfa y otra beta enlazadas por puentes disulfuro). La estructura cuaternaria es muy común en el caso de las enzimas. Se presenta en las proteinas que contienen múltiples cadenas de polipéptidos. Las fuerzas que mantienen
15 la estructura cuaternaria son las mismas que estabilizan la estructura terciaria. Un ejemplo es la proteina piruvato deshidrogenada, que se localiza en las mitocondrias, contiene 72 cadenas polipeptídicas. La hemoglobina que se muestra en la figura 13 es otra proteina con estructura cuaternaria. Fig.13. Los cuatro niveles estructurales de la hemoglobina 4.5. Estructura quinaria La estructura quinaria o supramolecular comprende dos grandes grupos: asociaciones entre proteínas y asociaciones con otras biomoléculas. La tabla 4 presenta las clases de proteínas con estructura quinaria según la asociación a la que pertenecen. 5. Clasificación de las proteínas Las proteinas se clasifican según su composición, según su conformación y según su función. Ver tabla 5.
16 Tabla 4. Estructura quinaria de las proteinas Clase de Asociación Proteína-proteína Proteina- Biomolécula Compuestos que se asocian Características Esquema y -tubulina Forman dímeros que se ensamblan para formar filamentos huecos (microtúbulos) Monómeros de fibrina: se unen por enlaces covalentes para formar la malla tridimensional Proteína-azúcar Estructural. Forman parte de: citoesqueleto de las células, del centríolo (que participa en la mitosis) de los cilios y de los flagelos que participan de la motilidad celular. La malla es característica del trombo o coagulo sanguíneo Proteoglicano también llamado mucopolisacárido : El compuesto glicosídico es superior al 90%. Está formado por dos galactosas y una xilosa N-acetilada que se une a la proteína. Peptido glicano: Formado por una trama de estructuras de polisacáridos paralelas (residuos alternos de N-acetilglucosamina y N-acetilmurámico) unidos covalentemente a un tetrapéptido, caracterizado por poseer D-aminoácidos. Los tetrapéptidos se unen a través de un pentapéptido formado por cinco glicinas O O O O O O O O O O O O O O N O - C -C Proteina C=O Proteina
17 Continuación: Tabla 4. Estructura quinaria de las proteinas Clase de Asociación Proteínasbiomoléculas Compuestos que se asocian Proteínas-Lípidos Proteínas-Ácidos nucleicos Características Esta asociación origina supramoléculas conocidas como lipoproteínas del plasma sanguineo y de las membranas biológicas Originan las supramoléculas: ribosomas, nucleosomas y virus ARNm Esquema Cadenas de aminoácidos Ribosoma Nucleosoma Virus
18 Tabla 5 Clasificación de las Proteínas Según su composición Clasificación Simples Conjugadas Subclase - Ejemplos Prolaminas: Zeina (maiz), gliadina (trigo), hordeina (cebada) Globulares Gluteninas: Glutenina (trigo), orizanina (arroz) Albúminas: Seroalbúminas (sangre), ovoalbumina (huevo), lactoalbumina (leche) ormonas: Insulina, prolactina, tirotropina. Enzimas: idrolasas, oxidasa, ligasas, liasa, transferasas Colágenos: En tejidos conjuntivos, cartilaginosos Fibrosas Queratinas: En formaciones epidérmicas Elastinas: En tendones y en vasos sanguíneos Fibroinas: En hilos de seda Nucleoproteínas Nucleosomas de la cromatina, ribosomas Lipoproteínas Transportan lípidos en sangre Metaloproteinas emoglobina, hemocianina y mioglobina (transportan oxígeno). Citocromos (transportan electrones) Glucoproteinas Ribonucleasa, mucoproteinas, anticuerpos, hormona luteinizante Fosfoproteinas Caseína (leche)
19 Continuación: Tabla 5. Clasificación de las proteínas Según su conformación 2 Clases Fibrosas (cadenas polipeptídicas alineadas en forma paralela, que se entrecruzan de dos formas diferentes) Globulares élices- (fibras que se trenzan sobre si mismas) Láminas- (formación de láminas) Conformaciones de cadenas polipeptídicas enrolladas sobre si mismas. Ejemplos y características Colágeno de los tendones y - queratina del cabello -queratina de la seda Enzimas emoglobina Ovoalbúmina y seroalbúminas Son los principales soportes estructurales de los tejidos. Son insolubles en agua y en soluciones salinas diluidas. Resistentes a los factores que las desnaturalizan Son solubles en agua. Sus principales funciones son el transporte y la catálisis 2 Se entiende por conformación la orientación tridimensional que adquieren los grupos característicos de una molécula en el espacio, en virtud de la libertad de giro de éstos sobre los ejes de sus enlaces
20 Continuación: Tabla 5. Clasificación de las proteínas Clases Características Ejemplos Proteínas de transporte Transportan: emoglobina Según su función Proteínas de movimiento coordinado Proteínas estructurales o de soporte Anticuerpos Oxígeno, electrones y CO2 Provocan contracciones musculares Colágeno -queratina Proteínas altamente específicas Citocromos En el caso de la hemoglobina el metal ( hierro) coordina con el oxígeno para su transporte Tienen la capacidad de modificar su estructura de acuerdo con el cambio en el ambiente electroquímico que las rodea Proteínas fibrosas Constituyen la estructura de soporte de muchos tejidos (huesos, tendones) Identifican sustancias extrañas como virus, bacterias y otros organismos. Proteoreceptores Rodopsina Participan en recepción de impulsos nerviosos Presente en los bastoncillos de la retina del ojo. Participan en la recepción de impulsos nerviosos
PROTEÍNAS : ESTRUCTURA Y FUNCIÓN
 COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
ESTRUCTURA DE PROTEÍNAS
 ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
TEMA 5. LAS PROTEÍNAS.
 TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
PROTEÍNAS. Del griego proteion, primero
 PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS. Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas:
 PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
Contenidos teóricos. Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente. Tema 3. Enzimas. Cinética y regulación.
 Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
CLASIFICACIÓN DE PROTEÍNAS
 CLASIFICACIÓN DE PROTEÍNAS HOLOPROTEÍNAS Atendiendo a la estructura terciaria las proteínas se clasifican: 1. Proteínas globulares o esferoproteínas 2. Proteínas filamentosas o escleroproteínas Proteínas
CLASIFICACIÓN DE PROTEÍNAS HOLOPROTEÍNAS Atendiendo a la estructura terciaria las proteínas se clasifican: 1. Proteínas globulares o esferoproteínas 2. Proteínas filamentosas o escleroproteínas Proteínas
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
Biomoléculas orgánicas III. Las proteínas
 Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
TEMA PROTEINAS.
 TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
Biomoléculas. Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos
 Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI
 CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 Química Biológica Docente a cargo:marta Blanca Mazzetti CEBI_A4_2B :Proteínas ESTRUCTURA SECUNDARIA Se
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 Química Biológica Docente a cargo:marta Blanca Mazzetti CEBI_A4_2B :Proteínas ESTRUCTURA SECUNDARIA Se
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería.
 Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
AMINOÁCIDOS. Funciones:
 AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
ESTRUCTURA DE LAS PROTEÍNAS. La conformación de las proteínas viene definida por cuatro estructuras: Enlaces sencillos de rotación libre
 ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
NOMENCLATURA BASE + AZUCAR + FOSFATO: Base Azúcar Fosfatos Nucleótido Ac. nucleico
 NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
QUÍMICA DE LAS BIOMOLÉCULAS
 QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
Biomoléculas PROTEÍNAS
 Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α-l - AA unidos por Uniones Peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y biosintetizados
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α-l - AA unidos por Uniones Peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y biosintetizados
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
J. L. Sánchez Guillén. IES Pando - Oviedo Departamento de Biología y Geología
 J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
Estructura tridimensional de las proteínas
 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
UNIVERSIDAD DEL QUINDÍO UNIDAD 4: PROTEÍNAS
 UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 4: PROTEÍNAS Las proteínas son biomóleculas formadas básicamente
UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 4: PROTEÍNAS Las proteínas son biomóleculas formadas básicamente
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
PROTEINAS AMINOÁCIDOS FUNCIONES DE LOS AMINOÁCIDOS
 PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
Prof : Javier Cabello Schomburg, MS
 Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
PROTEINAS AMINOÁCIDOS
 PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI QUÍMICA BIOLÓGICA
 CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 QUÍMICA BIOLÓGICA Docente a cargo: Dra. Laura Matković CEBI_A1_1 : Proteínas QUÍMICA BIOLÓGICA La Química
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 QUÍMICA BIOLÓGICA Docente a cargo: Dra. Laura Matković CEBI_A1_1 : Proteínas QUÍMICA BIOLÓGICA La Química
TEMA. Conformación tridimensional de proteínas Niveles estructurales Tipos de enlaces y fuerzas que estabilizan estas estructuras
 TEMA Conformación tridimensional de proteínas Niveles estructurales Tipos de enlaces y fuerzas que estabilizan estas estructuras Primaria Terciaria Cuaternaria Secundaria NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
TEMA Conformación tridimensional de proteínas Niveles estructurales Tipos de enlaces y fuerzas que estabilizan estas estructuras Primaria Terciaria Cuaternaria Secundaria NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
AMINOÁCIDOS Y PROTEÍNAS
 4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Proteínas y su Papel Biológico
 Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por
 PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
BIOQUÍMICA GENERAL. MSc. Dania Martín
 BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
Tema 3. Tema 3. Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos. Péptidos
 Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Aminoácidos, péptidos y proteinas
 Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
Estructura y función de macromoléculas
 Estructura y función de macromoléculas PowerPoint Lectures for Biology, Seventh Edition Neil Campbell and Jane Reece Lectures by Chris Romero Las moléculas de la vida Dentro de las células, moléculas orgánicas
Estructura y función de macromoléculas PowerPoint Lectures for Biology, Seventh Edition Neil Campbell and Jane Reece Lectures by Chris Romero Las moléculas de la vida Dentro de las células, moléculas orgánicas
Unidad IV. Sub-Unidad 4.3.
 República Bolivariana de Venezuela Universidad del Zulia Facultad de Medicina Escuela de Nutrición y Dietética Cátedra de Química General para Nutrición Unidad IV. Sub-Unidad 4.3. Prof. Alfonso R. Bravo
República Bolivariana de Venezuela Universidad del Zulia Facultad de Medicina Escuela de Nutrición y Dietética Cátedra de Química General para Nutrición Unidad IV. Sub-Unidad 4.3. Prof. Alfonso R. Bravo
Formación del enlace peptídico por condensación de dos aminoácidos. Amida
 PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Estructura 3D de proteínas
 Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
Proteínas Polímeros de aminoácidos ( resíduos) PM aa aprox 110 PM prot
 Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLaM 2016
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
U. D. 4 LAS PROTEÍNAS
 U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
Sumario: Principales macromoléculas. El Principio de organización de las macromoléculas (POM).
 CONFERENCIA 4 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PRINCIPIOS DE ORGANIZACIÓN DE LAS MACROMOLÉCULAS. POLISACÁRIDOS Autor: Dr. Daniel Sánchez Serrano. Sumario: Principales macromoléculas. El
CONFERENCIA 4 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PRINCIPIOS DE ORGANIZACIÓN DE LAS MACROMOLÉCULAS. POLISACÁRIDOS Autor: Dr. Daniel Sánchez Serrano. Sumario: Principales macromoléculas. El
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
LAS PROTEÍNAS. Fórmula general
 LAS PROTEÍNAS Las proteínas: Los aminoácidos introducción. Propiedades. Actividad óptica y Comportamiento químico. Carácter anfótero. Clasificación de los aminoácidos proteicos. El enlace peptídico. Estructura
LAS PROTEÍNAS Las proteínas: Los aminoácidos introducción. Propiedades. Actividad óptica y Comportamiento químico. Carácter anfótero. Clasificación de los aminoácidos proteicos. El enlace peptídico. Estructura
SERIE Nº 4. Aminoácidos, Péptidos y Proteínas
 SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Estructura y función de proteínas
 Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
inactivación de materiales tóxicos o peligrosos, etc.).
 Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN
 UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN Tema 1: Introducción a la Bioquímica. Composición del cuerpo humano. Tema 2: Proteínas, Glúcidos, Lípidos y Ácidos Nucleicos.
UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN Tema 1: Introducción a la Bioquímica. Composición del cuerpo humano. Tema 2: Proteínas, Glúcidos, Lípidos y Ácidos Nucleicos.
Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos
 Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos 1. Proteínas 1.1. Introducción 1.2. Aminoácidos, péptidos y proteínas 1.3. Estructura primaria: secuencia 1.4. Estructura secundaria 1.5. Estructura terciaria
Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos 1. Proteínas 1.1. Introducción 1.2. Aminoácidos, péptidos y proteínas 1.3. Estructura primaria: secuencia 1.4. Estructura secundaria 1.5. Estructura terciaria
Las proteínas son las moléculas orgánicas más abundantes en las células, más del 50% del
 LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Las proteínas son biomoléculas orgánicas formadas por C, O, H y N; y en menor proporción S y P, y a veces otros elementos como Fe, Cu, etc.
 LAS PROTEÍNAS Las proteínas son biomoléculas orgánicas formadas por C, O, H y N; y en menor proporción S y P, y a veces otros elementos como Fe, Cu, etc. Las proteínas son macromoléculas de gran complejidad
LAS PROTEÍNAS Las proteínas son biomoléculas orgánicas formadas por C, O, H y N; y en menor proporción S y P, y a veces otros elementos como Fe, Cu, etc. Las proteínas son macromoléculas de gran complejidad
BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS ORGÁNICOS
 BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS ORGÁNICOS LOS PRÓTIDOS Podemos definir a las proteínas como polímeros formados por la unión, mediante enlaces peptídicos, de moléculas de baja masa molecular llamadas
BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS ORGÁNICOS LOS PRÓTIDOS Podemos definir a las proteínas como polímeros formados por la unión, mediante enlaces peptídicos, de moléculas de baja masa molecular llamadas
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PRACTICA N 12. DETERMINACIÓN CUALITATIVAS Y CUANTITATIVAS DE PROTEINAS
 12.1.- Objetivos: PRACTICA N 12. DETERMINACIÓN CUALITATIVAS Y CUANTITATIVAS DE PROTEINAS Demostrar la presencia de proteínas en los alimentos. Observar diferencias entre péptidos de diferentes longitudes.
12.1.- Objetivos: PRACTICA N 12. DETERMINACIÓN CUALITATIVAS Y CUANTITATIVAS DE PROTEINAS Demostrar la presencia de proteínas en los alimentos. Observar diferencias entre péptidos de diferentes longitudes.
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO
 IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
COMPOSICIÓN DE LOS SERES VIVOS
 COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
Unidad IV. Sub-Unidad 4.3.
 República Bolivariana de Venezuela Universidad del Zulia Facultad de Medicina Escuela de Nutrición y Dietética Cátedra de Química General para Nutrición Unidad IV. Sub-Unidad 4.3. Prof. Alfonso R. Bravo
República Bolivariana de Venezuela Universidad del Zulia Facultad de Medicina Escuela de Nutrición y Dietética Cátedra de Química General para Nutrición Unidad IV. Sub-Unidad 4.3. Prof. Alfonso R. Bravo
Análisis de proteínas
 Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
Tema I: Biomoléculas
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
PÉPTIDOS Y PROTEÍNAS
 PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
PROTEINAS. Licda. Lilian Judith Guzmán Melgar
 CONJUGADAS SIMPLES PROTEINAS Licda. Lilian Judith Guzmán Melgar 2016 30 Las proteínas son macromoléculas biológicas, formadas de polímeros lineales de aminoácidos, de dimensión variable. Además de Carbono,
CONJUGADAS SIMPLES PROTEINAS Licda. Lilian Judith Guzmán Melgar 2016 30 Las proteínas son macromoléculas biológicas, formadas de polímeros lineales de aminoácidos, de dimensión variable. Además de Carbono,
Moléculas orgánicas. Proteínas y Lípidos
 Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
