PROPIEDADES GENERALES DE LOS GASES INTRODUCCIÓN
|
|
|
- Carmen Palma Figueroa
- hace 6 años
- Vistas:
Transcripción
1 RESPIRACIÓN El aire es una mezcla de gases entre los cuales se encuentran principalmente el nitrógeno (78,62%), el oxígeno (20,84%), el dióxido de carbono (0,04%) y el agua (0,50%). El oxígeno es indispensable para la vida al ser el aceptor final de la cadena respiratoria ubicada en la membrana mitocondrial interna y además está vinculado en una serie de procesos patológicos denominados en conjunto estrés oxidativo. La difusión del oxígeno a los tejidos es posible gracias a una cascada de gradiente de presión, desde el aire ambiental hasta la mitocondria. A nivel del mar la presión barométrica es de 760 mm Hg y la presión parcial de oxígeno (PO 2 ) a la inspiración es de 160 mm Hg, considerando que el aire que respiran los animales contiene un 21% de oxígeno. A su paso por las vías respiratorias el aire se entibia y humedece; de éste modo la influencia de la presión de vapor de agua a nivel alveolar hace que la PO 2 disminuya a un valor de 110 mm Hg aproximadamente. A continuación, por el efecto de la PCO 2 (presión parcial de dióxido de carbono) y de la difusión a través de la membrana alveolo-capilar, la PO 2 en los capilares pulmonares es de 100 mm Hg y al llegar a la aurícula izquierda se reduce a 95 mm Hg a causa del cortocircuito anatómico. En la sangre que se transporta a los tejidos dicha presión es de 90 mm Hg y en los capilares es de 40 mm Hg. Se cree que la PO 2 intersticial es de mm Hg, que a nivel de la membrana celular es de 10 mm Hg y en la mitocondria oscila entre 1 y 5 mm Hg. Así es como el oxígeno difunde de sitios de mayor presión a menor presión, o sea a favor del gradiente. Lo mismo pero en dirección contraria ocurre con el CO 2, que al producirse por la combustión de moléculas en el interior de las células, tiende a difundir desde tejidos hacia los pulmones y ser eliminado por la espiración del animal. Como veremos más adelante, no todo el CO 2 se elimina completamente sino que parte del mismo se utiliza en reacciones metabólicas, por ejemplo en las carboxilaciones (adición de grupos carboxilo, COO - ). Cuando el oxígeno difunde a través de la membrana alveolo-capilar, el 97% se une a la hemoglobina y el 3% restante permanece disuelto en el plasma.
2 Recordemos que la hemoglobina consiste en cuatro cadenas polipeptídicas y cuatro grupos hemo, estando las cuatro cadenas mantenidas juntas por atracciones no covalentes; cada cadena contiene un grupo hemo que se une al oxígeno (que participa en el intercambio de gases). PROPIEDADES GENERALES DE LOS GASES INTRODUCCIÓN La función primordial de los pulmones es intercambiar gases desde la atmósfera hasta la sangre y desde ésta hacia el aire del ambiente. La mejor manera de saber si el aparato respiratorio realiza correctamente esta función es comprobar el resultado final, es decir, determinar el oxígeno y el dióxido de carbono en la sangre arterial. Pero esta no es la verdadera necesidad biológica del organismo
3 "vivo". Los seres aeróbicos lo son en tanto y en cuanto el oxígeno es utilizado por las células en su metabolismo, en la misma medida que los residuos son eliminados para evitar la intoxicación. Una vez que la membrana alveolo-capilar (verdadera unidad funcional en el pulmón) ha realizado su labor de simple difusión de gases, cada uno de ellos debe alcanzar su destino, el oxígeno debe llegar hasta las mitocondrias y el CO 2 salir a la atmósfera. El paso del oxígeno desde la atmósfera hasta las mitocondrias se realiza a través de la ventilación, la distribución de gas en el pulmón (ventilación/perfusión), la difusión a través de la membrana alvéolo-capilar, el transporte por la sangre y su transferencia hacia el tejido y la célula. El CO 2 debe realizar el mismo camino pero en sentido contrario. Este deambular de los gases por los territorios respiratorio, cardiocirculatorio y sanguíneo puede expresarse en términos físicos mediante el concepto de conductancia, donde en cada lugar del trayecto, la presión parcial del gas es ligeramente inferior a su localización inmediatamente anterior. INTRODUCCIÓN A LA FÍSICA DE GASES La materia (todo aquello que nos rodea) puede encontrarse en tres estados de agregación que conocemos como sólido, líquido y gaseoso. Estos estados dependen fundamentalmente de las condiciones de presión y temperatura a la que la materia esté sometida. En el estado sólido los átomos o moléculas ocupan posiciones fijas aunque se encuentran vibrando en esas posiciones con una capacidad de movimiento limitada. En un líquido las fuerzas de cohesión que mantienen unidas estas moléculas es mucho menor; en este estado las moléculas tienen cierta capacidad de movimiento que está limitada en gran medida por las demás moléculas. En el estado gaseoso las moléculas se encuentran muy alejadas unas de otras y se mueven en todas direcciones con libertad absoluta. Vamos a estudiar el comportamiento de los gases y como la ciencia ha tratado de encontrar una explicación para este comportamiento
4 LEY DE BOYLE (LEY DE MARIOTTE) Esto quiere decir que si el volumen del contenedor aumenta, la presión en su interior disminuye y, viceversa, si el volumen del contenedor disminuye, la presión en su interior aumenta (más grande el recipiente, menor presión del gas en su interior; más pequeño el recipiente, mayor presión del gas en su interior). La ley de Boyle permite explicar la ventilación pulmonar: el aire entra en los pulmones porque la presión interna de estos es inferior a la atmosférica y por lo tanto existe un gradiente de presión. Inversamente, el aire es expulsado de los pulmones cuando estos ejercen sobre el aire contenido una presión superior a la atmosférica. Cuando aumenta la presión el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. LA LEY DE CHARLES Charles describió que el aire seco aumentaba de volumen en una forma exactamente igual al aumento de la temperatura, y que el aire húmedo aumentaba
5 en una forma proporcional al aumento de temperatura según un determinado coeficiente de expansión térmica del gas en cuestión. Esto quiere decir que en un recipiente flexible que se mantiene a presión constante el aumento de temperatura conlleva un aumento del volumen o, en otras palabras, lo que se conocen como Ley de Charles y Gay-Lussac. La ley de Charles se aplica en la respiración cuando el aire entra en los pulmones, generalmente más calientes que el ambiente, se expanden aumentando el volumen pulmonar. Un buen experimento para demostrar esta ley es calentar una lata con un poco de agua, al hervir el agua se sumerge en agua fría y su volumen cambia. La ley fue publicada primero por Gay Lussac en 1875, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La Ley de Charles y Gay-Lussac, o simplemente Ley de Charles, es una de las leyes de los gases ideales. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante, mediante una constante de proporcionalidad directa
6 LEY DE DALTON DE LAS PRESIONES PARCIALES Es decir, la ley de Dalton establece que en una mezcla de gases cada gas ejerce su presión como si los restantes gases no estuvieran presentes. La presión específica de un determinado gas en una mezcla se llama presión parcial, y se representa con la letra p. La presión total de la mezcla se calcula sumando las presiones parciales de todos los gases que la componen. Por ejemplo, la presión atmosférica es: Presión atmosférica (760 mm de Hg) = po 2 (160 mm) + pn 2 (593 mm Hg) + pco 2 (0.3 mm Hg) + ph 2 O (alrededor de 8 mm de Hg) LEY DE HENRY
7 La ley de Henry explica, por ejemplo, la narcosis por nitrógeno o intoxicación que se manifiesta en los buceadores que respiran aire en botellas cuando la presión debida a la profundidad disuelve grandes cantidades de nitrógeno en la sangre. Altas concentraciones de este gas producen un efecto narcotizante. Además, la ley de Henry también explica por qué al retornar a la superficie los buceadores deben subir escalonadamente para permitir que el nitrógeno disuelto en la sangre se libere al disminuir la presión. De no hacerlo así, el buceador corre el riesgo de experimentar los síntomas de la descompresión, resultantes de las burbujas de gas que se desprenden de la sangre al retornar a la presión atmosférica. LEY DE FICK El área de la superficie total de membrana en los pulmones (alvéolos) puede estar en el orden de los 100 m 2 y tiene un grosor de menos de una millonésima de metro, de modo que conforma un interfaz intercambiadora de gas muy efectiva (en otras palabras, posee un gran área de poco grosor). Los factores de los cuales depende la velocidad de paso de un gas a través de una membrana son: Área de intercambio: en el caso de los pulmones, de 70 a 100 m 2 de superficie de intercambio (en algunas alteraciones patológicas este área disminuye). Constante de difusión (D) de un gas: el CO 2 es 20 veces más difusible que el O 2. Diferencia de presiones entre uno y otro lado de la membrana: Inversamente proporcional al grosor de la membrana (G): a pesar de que consta de varias capas, la membrana respiratoria alveolar es finísima: menos de 1 micrómetro de ancho.
8 La sangre demora 0,75 segundos en pasar por el alvéolo, y en solo 0,25 segundos se alcanza el equilibrio de las presiones de los gases. Cuando un animal hace ejercicio la sangre pasa más rápido, e igualmente se alcanza el equilibrio. Cuando la membrana está engrosada (alteración de la difusión), en reposo no hay problema porque puede demorarse 0,50 o 0,75 segundos en alcanzar el equilibrio; pero si se hace ejercicio, la sangre pasa más rápido y ese tiempo no será suficiente para alcanzar el equilibrio y la presión parcial de oxígeno será menor. Las consecuencias de este tipo de alteraciones son evidentes en, por ejemplo, los equinos de carrera. ECUACIÓN DE LOS GASES IDEALES LEY DE LOS GASES IDEALES Según la teoría atómica, las moléculas pueden tener cierta libertad de movimientos en el espacio. La libertad de movimiento de las moléculas de un sólido está restringida a pequeñas vibraciones; en cambio, las moléculas de un gas se mueven aleatoriamente, y sólo están limitadas por las paredes del recipiente que las contiene. Se han desarrollado como hemos visto leyes que relacionan las variables macroscópicas en base a las experiencias en laboratorio. En los gases ideales, estas variables incluyen la presión (p), el volumen (V) y la temperatura (T). Repasando: La ley de Boyle-Mariotte relaciona inversamente las proporciones de volumen y presión de un gas, manteniendo la temperatura constante: P1.V1 = P2.V2 La ley de Gay-Lussac afirma que el volumen de un gas, a presión constante, es directamente proporcional a la temperatura absoluta:
9 La ley de Charles sostiene que, a volumen constante, la presión de un gas es directamente proporcional a la temperatura absoluta del sistema. De las tres se deduce la ley universal de los gases: HIPOTESIS DE AVOGADRO Cada molécula, dependiendo de los átomos que la compongan, deberá tener la misma masa. Es así que puede hallarse la masa relativa de un gas de acuerdo al
10 volumen que ocupe. La hipótesis de Avogadro permite determinar la masa molecular relativa de esos gases. Analicemos el orden lógico que sigue: 1) La masa de 1 litro de cualquier gas es la masa de todas las moléculas de ese gas. 2) Un litro de cualquier gas contiene el mismo número de moléculas de cualquier otro gas 3) Por lo tanto, un litro de un gas posee el doble de masa de un litro de otro gas si cada molécula del primer gas pesa el doble de la molécula del segundo gas. 4) En general las masas relativas de las moléculas de todos los gases pueden determinarse pesando volúmenes equivalentes de los gases. En condiciones normales de presión y temperatura (CNPT) [P = 1 atm y T = -273 ºK] un litro de hidrógeno pesa 0,09 g y un litro de oxígeno pesa 1,43 g. Según la hipótesis de Avogadro ambos gases poseen la misma cantidad de moléculas. La proporción de los pesos entre ambos gases es: 1,43/0,09 = 15,9 (aproximadamente 16); por lo tanto, la relación que existe entre una molécula de oxígeno e hidrógeno es de 16 a 1. Las masas atómicas relativas que aparecen en la tabla periódica están consideradas a partir de un volumen de 22,4 litros en CNPT. Como consecuencia de la hipótesis de Avogadro puede considerarse una generalización de la ley de los gases. Si el volumen molar (volumen que ocupa un mol de molécula de gas) es el mismo para todos los gases en CNPT, entonces podemos considerar que es el mismo para todos los gases ideales a cualquier temperatura y presión que se someta al sistema. Esto es cierto porque las leyes que gobiernan los cambios de volumen de los gases con variaciones de temperatura y presión son las mismas para todos los gases ideales. Estamos relacionando proporcionalmente el número de moles (n), el volumen, la presión y la temperatura: P.V ~ n.t. Para establecer una igualdad debemos añadir una constante (R) quedando:
11 DIFUSIÓN DE LOS GASES RESPIRATORIOS A TRAVÉS DE LA MEMBRANA ALVEOLO-CAPILAR El intercambio pulmonar de gases requiere de la constante renovación del contenido del gas alveolar y de la sangre capilar pulmonar a través de los procesos de la ventilación y la circulación pulmonares. Así se consigue mantener gradientes de presiones parciales de O 2 y de CO 2 a ambos lados de la membrana alveolo-capilar, imprescindible para el proceso de la difusión de los gases a través de la misma. De un lado de la membrana, el aire fresco que aporta la respiración renueva la presión parcial de oxígeno y al otro lado, el componente capilar, que contiene la sangre que recibirá el gas desde el espacio alveolar. El componente capilar representa la totalidad del volumen sanguíneo que está en contacto con la zona de intercambio en el momento de la difusión. La velocidad de paso de esta sangre por el capilar pulmonar, o gasto cardiaco, será el tercer mecanismo participante en el proceso, junto a los componentes de membrana y capilar, por lo que también puede influir en el resultado final de la difusión. Los gases respiratorios, O 2 y CO 2, están afectados por los tres mecanismos anteriormente mencionados. En el intercambio de gases, una vez que el gas inspirado ha conseguido acceder al espacio alveolar a través de los mecanismos de transporte y mezclado en fase gaseosa, comienza el proceso conocido como difusión en fase líquida, que es el que participa en la transferencia o difusión de los gases a través de la membrana
12 alveolo-capilar. Esta membrana, que se interpone en el proceso de la difusión, tiene un grosor aproximado de 0,4 micrómetros y está compuesta por surfactante, epitelio alveolar, membrana basal y endotelio capilar (estos dos últimos están fusionados). Traspasada esta membrana, el gas implicado debe difundir dentro de la sangre y combinarse con la hemoglobina, donde termina el proceso de la difusión. TRANSPORTE ALVEOLO-CAPILAR DE LOS GASES RESPIRATORIOS En el transporte alveolo-capilar de los gases respiratorios, O 2 y CO 2, intervienen los tres factores del transporte alveolo-capilar de los gases. En el caso del oxígeno, el factor de membrana representa la primera limitante, debido a que este gas tiene una tasa de difusión muy baja, es 20 veces menor que la del CO 2. En el lado alveolar de la membrana, la presión parcial de oxígeno varía dependiendo de la ventilación por minuto, pudiéndose apreciar un descenso durante la espiración respecto de la inspiración y puede incrementarse o disminuirse con variaciones de la fracción inspirada de oxígeno. El factor sanguíneo interviene a través de la tasa de recombinación del oxígeno con la hemoglobina. La difusión y la convección directa de las moléculas de oxígeno en el plasma no intervienen en este componente porque son prácticamente instantáneas, pero el factor circulatorio hace que su valor esté limitado por el gasto cardiaco, lo puede apreciarse en los casos de incrementos de gasto cardiaco, o bien durante el ejercicio, en los de descenso del gasto cardiaco, o en la insuficiencia cardiaca. El CO 2 es producto del metabolismo celular el cuál es eliminado por el pulmón durante el ciclo respiratorio. El control en la cinética de este gas en el organismo es muy estricto y depende de una compleja interacción entre el sistema nervioso central, el sistema nervioso autónomo y la función cardiopulmonar. El gas se produce a nivel celular a un ritmo directamente proporcional a la actividad metabólica (producción normal basal de 200 ml/min). Se transporta por la sangre principalmente como ión bicarbonato (HCO - 3, 85%) y en menor proporción como disuelto o combinado con grupos aminos de la hemoglobina.
13 EFECTO BOHR La oxigenación de la Hb aumenta la acidez, o dicho de otra manera, la desoxigenación aumenta la basicidad porque la unión del oxigeno a la Hb implica la participación en el equilibrio del ion hidrógeno: Hb + 4 O > Hb(O 2 ) 4 + H + T R Cuando el CO2 llega al eritrocito se dan dos situaciones: la primera es que el CO 2 reacciona con el H 2 O, reacción catalizada por la anhidrasa carbónica, produciendo H 2 CO 3 en un 90%. La segunda es que el CO 2 en un 7%, se une a la Hb generando carbaminohb. El - ácido carbónico pasa automáticamente a HCO 3 y H +. El H + generado se incorpora a la desoxihb, esto genera HbH +, proceso facilitado por el efecto Bohr. La Hb retiene 2 H + por cada molécula de O 2 que pierde. El HCO - 3 por su parte, difunde a través de la membrana eritrocitaria y en parte se intercambia con iones Cl - del plasma, mecanismo denominado desplazamiento del cloruro. Así se transporta la mayoría del CO 2. El restante, se transporta como CO 2 disuelto (5%) y como reacción del CO 2 con los grupos amino de la Hb, donde se generan entre 1 y 2 equivalentes de H +. En los pulmones se da el proceso inverso, el oxigeno se une a la desoxihb y los H + se liberan. El HCO - 3 que está en sangre entra al eritrocito, y sale el Cl -. El H + reacciona con el HCO - 3 y forma el ácido carbónico, este se desdobla en CO 2 y H2 O. El CO 2 es exhalado y el agua sale a favor de gradiente, a medida que aumenta su concentración. Este fenómeno reversible que se da en el eritrocito, entre pulmón y tejidos es lo que se conoce como Efecto Bohr.
14 EFECTO HALDANE El efecto Haldane es el resultado del simple hecho que la combinación del oxigeno con la hemoglobina en los pulmones hace que la hemoglobina se convierta en un acido más fuerte. Esto a su vez desplaza el dióxido de carbono de la sangre al interior de los alvéolos de dos maneras. En los capilares tisulares, el efecto Haldane produce un aumento de la toma de dióxido de carbono, debido a que el oxigeno sale de la hemoglobina, y en los pulmones produce un aumento en la liberación de dióxido de carbono, porque la hemoglobina toma oxigeno. Por tanto, el efecto Haldane duplica aproximadamente la cantidad de dióxido de carbono liberada por la sangre en los pulmones y duplica aproximadamente la cantidad de dióxido de carbono tomada en los tejidos Al oxigenar la Hb se libera H + de la misma, lo que da lugar a un aumento en la acidez titulable (transporta menos CO 2 como carboxihemoglobina) Los pacientes con problemas pulmonares obstructivos, que por mecanismos de compensación fisiopatologicos (hipoxemia), elevan su concentraciones de Hto y Hb en un 20-30%, por lo tanto considerando las bases fisiológicas del Efecto de Haldane, los pacientes obstructivos y sobre todos los que ya tiene indicación de oxigeno en una internación, se deben manejar con flujos o concentraciones bajas de O 2 (no más de 2 litros por minuto), por el peligro de exacerbar una acidosis respiratoria ó agregar una metabólica; poniendo en peligro la vida del paciente.
DIFUSIÓN - TRANSPORTE DE GASES EN SANGRE. Material de uso interno
 DIFUSIÓN - TRANSPORTE DE GASES EN SANGRE Material de uso interno 2010 Hoy hablaremos de: * Leyes de los gases: aspectos aplicados * Hematosis ó intercambio alvéolo-capilar * Transporte de gases en sangre
DIFUSIÓN - TRANSPORTE DE GASES EN SANGRE Material de uso interno 2010 Hoy hablaremos de: * Leyes de los gases: aspectos aplicados * Hematosis ó intercambio alvéolo-capilar * Transporte de gases en sangre
LEYES DE LOS GASES. El volumen es directamente proporcional a la cantidad de gas:
 LEYES DE LOS GASES LEY DE AVOGADRO: Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura
LEYES DE LOS GASES LEY DE AVOGADRO: Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura
FISIOLOGIA RESPIRATORIA DR. JOSÉ CARLOS MORALES NÁJERA
 FISIOLOGIA RESPIRATORIA DR. JOSÉ CARLOS MORALES NÁJERA PRINCIPIOS BASICOS: FÍSICA DE LOS GASES La ventilación y la perfusión pulmonares y la transferencia de los gases obedecen estrictamente a fuerzas
FISIOLOGIA RESPIRATORIA DR. JOSÉ CARLOS MORALES NÁJERA PRINCIPIOS BASICOS: FÍSICA DE LOS GASES La ventilación y la perfusión pulmonares y la transferencia de los gases obedecen estrictamente a fuerzas
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA
 BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
2. Sobre los valores de las diferentes presiones parciales de los gases, marca con una cruz (X) la respuesta correcta según corresponda.
 Semana 7 Consolidación 7. 1. Acerca de la mecánica de la ventilación pulmonar, escribe en el espacio en blanco (V) si son verdaderos o (F) si son falsos los siguientes planteamientos: a) _F_ Los intercostales
Semana 7 Consolidación 7. 1. Acerca de la mecánica de la ventilación pulmonar, escribe en el espacio en blanco (V) si son verdaderos o (F) si son falsos los siguientes planteamientos: a) _F_ Los intercostales
GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso: Fecha:
 Sector: Naturaleza Nivel: 8 Básico Nombre Profesora: Nancy Erazo Rosa Unidad V : Leyes de los gases GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso:
Sector: Naturaleza Nivel: 8 Básico Nombre Profesora: Nancy Erazo Rosa Unidad V : Leyes de los gases GUÍA ACUMULATIVA/ 8º MEDIO ( Desarrollo de Ejercicios: Leyes de los Gases) Nombre del Alumno: Curso:
SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA
 I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
Física y Química 1º Bach.
 Física y Química 1º Bach. Leyes de los gases. Teoría cinético-molecular 05/11/10 DEPARTAMENTO FÍSICA E QUÍMICA Nombre: OPCIÓN 1 1. Observa el aparato de la Figura. Si la temperatura del aceite se eleva
Física y Química 1º Bach. Leyes de los gases. Teoría cinético-molecular 05/11/10 DEPARTAMENTO FÍSICA E QUÍMICA Nombre: OPCIÓN 1 1. Observa el aparato de la Figura. Si la temperatura del aceite se eleva
UNIDAD 8: LA RESPIRACIÓN DE LOS SERES VIVOS
 UNIDAD 8: LA RESPIRACIÓN DE LOS SERES VIVOS Lee con atención. 1. LA RESPIRACIÓN DE LOS ANIMALES Los animales necesitan toma el gas oxígeno (O 2 ) presente en el medio que les rodea y expulsar el gas dióxido
UNIDAD 8: LA RESPIRACIÓN DE LOS SERES VIVOS Lee con atención. 1. LA RESPIRACIÓN DE LOS ANIMALES Los animales necesitan toma el gas oxígeno (O 2 ) presente en el medio que les rodea y expulsar el gas dióxido
Tarjeta pedagógica EL SISTEMA RESPIRATORIO. Biología. Cómo obtienen los seres vivos la energía de las moléculas? RECOMENDACIONES:
 Así como es indispensable incorporar materia del medio, también es EL SISTEMA RESPIRATORIO importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
Así como es indispensable incorporar materia del medio, también es EL SISTEMA RESPIRATORIO importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
TAREA 1. Nombre Núm. de lista Grupo Turno Núm. de Expediente Fecha
 TAREA 1 Nombre Núm. de lista Grupo Turno Núm. de Expediente Fecha INSTRUCCIONES: Investiga como es el puente de Hidrógeno en las estructuras del H 2 O, NH 3 y HF. Dibuja los modelos resaltando con color
TAREA 1 Nombre Núm. de lista Grupo Turno Núm. de Expediente Fecha INSTRUCCIONES: Investiga como es el puente de Hidrógeno en las estructuras del H 2 O, NH 3 y HF. Dibuja los modelos resaltando con color
En el siglo XVIII la química estableció las medidas precisas de masa y volúmenes que llevaron a enunciar las llamadas leyes ponderales.
 1. LEYES PONDERALES En el siglo XVIII la química estableció las medidas precisas de masa y volúmenes que llevaron a enunciar las llamadas leyes ponderales. Ley de conservación de la masa de Lavoisier Lavosier
1. LEYES PONDERALES En el siglo XVIII la química estableció las medidas precisas de masa y volúmenes que llevaron a enunciar las llamadas leyes ponderales. Ley de conservación de la masa de Lavoisier Lavosier
Pv = nrt P T P T. Ing. Magno Cuba Atahua
 TEORI CINÉTIC DE LOS GSES Un gas ideal es un gas cuyas moléculas están tan separadas que raramente chocan unas con otras. uesto que éste es el caso para cualquier gas real a baja ideales a baja densidad
TEORI CINÉTIC DE LOS GSES Un gas ideal es un gas cuyas moléculas están tan separadas que raramente chocan unas con otras. uesto que éste es el caso para cualquier gas real a baja ideales a baja densidad
GUÍA DE EJERCICIOS GASES
 GUÍA DE EJERCICIOS GASES Área Química Resultados de aprendizaje Aplicar conceptos básicos de gases en la resolución de ejercicios. Desarrollar pensamiento lógico y sistemático en la resolución de problemas.
GUÍA DE EJERCICIOS GASES Área Química Resultados de aprendizaje Aplicar conceptos básicos de gases en la resolución de ejercicios. Desarrollar pensamiento lógico y sistemático en la resolución de problemas.
Dr. Miguel Ángel González Sosa
 Dr. Miguel Ángel González Sosa Presentación realizada en el curso de Clinopatología del Aparato Respiratorio dentro de la Licenciatura de Médico Cirujano del Área Académica de Medicina en el semestre Julio
Dr. Miguel Ángel González Sosa Presentación realizada en el curso de Clinopatología del Aparato Respiratorio dentro de la Licenciatura de Médico Cirujano del Área Académica de Medicina en el semestre Julio
GASES. Contenidos. Leyes de los gases y su aplicación en la resolución de problemas numéricos.
 GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
El sistema respiratorio
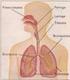 El sistema respiratorio Así como es indispensable incorporar materia del medio, también es importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
El sistema respiratorio Así como es indispensable incorporar materia del medio, también es importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO. Nombre Grupo Matrícula PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P)
 Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
P V = n R T LEYES DE LOS GASES
 P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Reacciones Químicas. Homogéneas.
 Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
GASES IDEALES. P. V = n. R. T
 GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
Ventilación Pulmonar. -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón
 Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
Biofísica de la Respiración. Matías Enrique Puello Chamorro
 Biofísica de la Respiración Matías Enrique Puello Chamorro www.matiaspuello.wordpress.com 10 de octubre de 2014 Índice 1. INTRODUCCIÓN 4 2. BREVE RESEÑA ANATOMICA 5 2.1. Vias respiratorias...............................................
Biofísica de la Respiración Matías Enrique Puello Chamorro www.matiaspuello.wordpress.com 10 de octubre de 2014 Índice 1. INTRODUCCIÓN 4 2. BREVE RESEÑA ANATOMICA 5 2.1. Vias respiratorias...............................................
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
Aspectos destacados del sistema cardiocirculatorio y respiratorio, ligados al entrenamiento deportivo. Dr. Juan Carlos Mazza (Argentina)
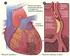 Aspectos destacados del sistema cardiocirculatorio y respiratorio, ligados al entrenamiento deportivo Dr. Juan Carlos Mazza (Argentina) SISTEMA CARDIOVASCULAR Cualquier sistema de circulación requiere
Aspectos destacados del sistema cardiocirculatorio y respiratorio, ligados al entrenamiento deportivo Dr. Juan Carlos Mazza (Argentina) SISTEMA CARDIOVASCULAR Cualquier sistema de circulación requiere
Unidad 0 CÁLCULOS QUÍMICOS. Unidad 0. Cálculos químicos
 Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES
 TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
Profesora: Teresa Esparza Araña ASPECTOS CUANTITATIVOS DE LA QUÍMICA. UNIDAD 2: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Sistema respiratorio CLASE 1
 Sistema respiratorio CLASE 1 En la respiración celular se libera dióxido de carbono y, para obtener energía, las células oxidan compuestos que contienen carbono, en reacciones químicas que requieren oxígeno.
Sistema respiratorio CLASE 1 En la respiración celular se libera dióxido de carbono y, para obtener energía, las células oxidan compuestos que contienen carbono, en reacciones químicas que requieren oxígeno.
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre. La hemoglobina aumenta la capacidad de la sangre para transportar oxígeno.
 Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
ESTADOS DE LA MATERIA
 ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
Capítulo 6. Valoración respiratoria
 498 Capítulo 6. Valoración respiratoria 6.19. La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 6.19 La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 499
498 Capítulo 6. Valoración respiratoria 6.19. La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 6.19 La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 499
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
Director de Curso Francisco J. Giraldo R. EL AIRE El aire seco es una mezcla de gases: El 78% es Nitrógeno. El 21% es Oxígeno. El 1% es Argón. El Dioxido de carbono (CO 2 ), Helio (He), Neón (Ne), Kripton
Proceso de liberación de energía, requiere aporte continuo de oxigeno(o2) y eliminación de bióxido de carbono(co2) principal función del aparato
 Proceso de liberación de energía, requiere aporte continuo de oxigeno(o2) y eliminación de bióxido de carbono(co2) principal función del aparato respiratorio. En condiciones normales la respiración es
Proceso de liberación de energía, requiere aporte continuo de oxigeno(o2) y eliminación de bióxido de carbono(co2) principal función del aparato respiratorio. En condiciones normales la respiración es
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
Capítulo 10. Efectos de superficie. Sistema respiratorio
 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células.
 Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células. La respiración es un proceso involuntario y automático, en que se extrae
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células. La respiración es un proceso involuntario y automático, en que se extrae
TEST APARATO RESPIRATORIO BIR 2015-2016
 1.- Cuál de los siguientes es el estímulo directo para las neuronas del área quimiosensible de la zona bulbar reguladora de la respiración?: 1. po 2. 2. pco 2. 3. CO 3 H 2. 4. CO 3 H -. 5. Concentración
1.- Cuál de los siguientes es el estímulo directo para las neuronas del área quimiosensible de la zona bulbar reguladora de la respiración?: 1. po 2. 2. pco 2. 3. CO 3 H 2. 4. CO 3 H -. 5. Concentración
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Organización Funcional y el Medio Interno
 Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
Gases Respiración Externa
 Gases Respiración Externa Respiración Interna o Celular Externa 1 Respiración Interna o Celular - Común a casi todos los seres vivos - Implica el intercambio de ciertos gases entre el medio y las células.
Gases Respiración Externa Respiración Interna o Celular Externa 1 Respiración Interna o Celular - Común a casi todos los seres vivos - Implica el intercambio de ciertos gases entre el medio y las células.
Verónica Mate García Isabel Moreno Moraleda Gracia Guajardo-Fajardo Adriana Serrano Olave
 Verónica Mate García Isabel Moreno Moraleda Gracia Guajardo-Fajardo Adriana Serrano Olave Introducción Efectos del tabaco fumado Afectaciones por polución aérea Intoxicación por CO Intoxicación por oxígeno
Verónica Mate García Isabel Moreno Moraleda Gracia Guajardo-Fajardo Adriana Serrano Olave Introducción Efectos del tabaco fumado Afectaciones por polución aérea Intoxicación por CO Intoxicación por oxígeno
FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN
 1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
UNIDAD 3 ESTADO GASEOSO
 UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
GUIA DE ESTUDIO Nº 7: Equilibrio Químico
 Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Estequiometría y Leyes Ponderales
 Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
Los gases y la Teoría Cinética
 Para practicar Utiliza tu cuaderno y trata de resolver los siguientes ejercicios: 1.-En una tabla similar a la siguiente, introduce las propiedades características de un SÓLIDO, un LÍQUDO o un GAS, como
Para practicar Utiliza tu cuaderno y trata de resolver los siguientes ejercicios: 1.-En una tabla similar a la siguiente, introduce las propiedades características de un SÓLIDO, un LÍQUDO o un GAS, como
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón. Trabajo Práctico: Leyes de los gases
 Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
Ley de Boyle. A temperatura constante, el volumen de una muestra dada de gas es inversamente proporcional a su presión
 LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica.
 capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica. El CO2 es un producto final del O2 utilizado por las células después del metabolismo celular. Una vez que el CO2 alcanza los pulmones
capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica. El CO2 es un producto final del O2 utilizado por las células después del metabolismo celular. Una vez que el CO2 alcanza los pulmones
DEPARTAMENTO DE FISICA UNIVERSIDAD DE SANTIAGO DE CHILE GASES IDEALES
 INTRODUCCIÓN GASES IDEALES Las dos primeras unidades del programa de cuarto medio estudian temas estrechamente ligados entre si como lo es la teoría cinética, temperatura, calor, termodinámica. Abordaremos
INTRODUCCIÓN GASES IDEALES Las dos primeras unidades del programa de cuarto medio estudian temas estrechamente ligados entre si como lo es la teoría cinética, temperatura, calor, termodinámica. Abordaremos
FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN
 INTRODUCCIÓN. SEMEJANZA ENTRE TRANSFERENCIA DE MASA, CALOR Y MOMENTO (LEYES DE FICK, FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN MOLECULAR. E-mail: williamsscm@hotmail.com TRANSFERENCIA DE MASAS El transporte
INTRODUCCIÓN. SEMEJANZA ENTRE TRANSFERENCIA DE MASA, CALOR Y MOMENTO (LEYES DE FICK, FOURIER Y NEWTON). LEY DE FICK PARA DIFUSIÓN MOLECULAR. E-mail: williamsscm@hotmail.com TRANSFERENCIA DE MASAS El transporte
todoesquimica.bligoo.cl
 todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
Fisiopatología del aparato respiratorio II _ Pruebas complementarias
 Fisiopatología del aparato respiratorio II _ Pruebas complementarias Gasometría arterial (GSA) Gasometría arterial: Punción de una arteria periférica Determina el equilibrio ácido-base: - ph - Las concentraciones
Fisiopatología del aparato respiratorio II _ Pruebas complementarias Gasometría arterial (GSA) Gasometría arterial: Punción de una arteria periférica Determina el equilibrio ácido-base: - ph - Las concentraciones
PRINCIPIOS FISICOS APLICABLES EN VENTILACION MECANICA. Julio Lloréns
 PRINCIPIOS FISICOS APLICABLES EN VENTILACION MECANICA Julio Lloréns No se puede negar que los procesos vitales desempeñan un papel esencial en la función y mantenimiento de la integridad estructural del
PRINCIPIOS FISICOS APLICABLES EN VENTILACION MECANICA Julio Lloréns No se puede negar que los procesos vitales desempeñan un papel esencial en la función y mantenimiento de la integridad estructural del
La materia. Los gases
 1 La materia. Los gases 1 La materia y sus estados de agregación Características de los estados de la materia La materia se puede presentar en varios estados de agregación: sólido, líquido y gas, que tienen
1 La materia. Los gases 1 La materia y sus estados de agregación Características de los estados de la materia La materia se puede presentar en varios estados de agregación: sólido, líquido y gas, que tienen
LAS FUNCIONES DEL APARATO CIRCULATORIO Ó PARA QUÉ SIRVE EL APARATO CIRCULATORIO?
 LAS FUNCIONES DEL APARATO CIRCULATORIO Ó PARA QUÉ SIRVE EL APARATO CIRCULATORIO? En el tema anterior estudiamos que las sustancias nutritivas pasaban a la sangre desde el intestino delgado y el oxígeno
LAS FUNCIONES DEL APARATO CIRCULATORIO Ó PARA QUÉ SIRVE EL APARATO CIRCULATORIO? En el tema anterior estudiamos que las sustancias nutritivas pasaban a la sangre desde el intestino delgado y el oxígeno
EL APARATO RESPIRATORIO
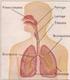 EL APARATO RESPIRATORIO El aparato respiratorio nos permite obtener el oxígeno del aire y expulsar el dióxido de carbono, procedente del metabolismo celular. Las partes de las que se compone el aparato
EL APARATO RESPIRATORIO El aparato respiratorio nos permite obtener el oxígeno del aire y expulsar el dióxido de carbono, procedente del metabolismo celular. Las partes de las que se compone el aparato
DISOLUCIONES. Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables.
 DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
DISOLUCIONES Las disoluciones son mezclas homogéneas de dos o más sustancias (componentes) en proporciones variables. Soluto es la sustancia que se encuentra en menor proporción. Disolvente es la sustancia
GASES 09/06/2011. La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: La atmósfera
 La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
Tema 28 Funciones pulmonares. Mecánica respiratoria. Elasticidad. El surfactante pulmonar.
 Tema 28 Funciones pulmonares. Mecánica respiratoria. Elasticidad. El surfactante pulmonar. 1. Introducción. 2. Anatomía del aparato respiratorio. 3. Mecánica respiratoria. 4. Propiedades elásticas del
Tema 28 Funciones pulmonares. Mecánica respiratoria. Elasticidad. El surfactante pulmonar. 1. Introducción. 2. Anatomía del aparato respiratorio. 3. Mecánica respiratoria. 4. Propiedades elásticas del
FISIOLOGIA RESPIRATORIA
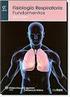 FISIOLOGIA RESPIRATORIA LA RESPIRACION TIENE COMO FUNCION PROPORCIONAR O 2 A LAS CELULAS Y EXTRAER EL EXCESO DE CO 2 PRODUCIDO POR ELLAS Componentes de las vías aéreas TRÁQUEA BRONQUIOS BRONQUÍOLOS ZONA
FISIOLOGIA RESPIRATORIA LA RESPIRACION TIENE COMO FUNCION PROPORCIONAR O 2 A LAS CELULAS Y EXTRAER EL EXCESO DE CO 2 PRODUCIDO POR ELLAS Componentes de las vías aéreas TRÁQUEA BRONQUIOS BRONQUÍOLOS ZONA
UNIDAD IV GASES PROPIEDADES FISICAS DE LOS GASES
 UNIDAD IV GASES PROPIEDADES FISICAS DE LOS GASES Muchas sustancias familiares para nosotros existen a temperatura y presión normal en forma gaseosa, éstas incluyen muchos sustancias elementales (H 2, N
UNIDAD IV GASES PROPIEDADES FISICAS DE LOS GASES Muchas sustancias familiares para nosotros existen a temperatura y presión normal en forma gaseosa, éstas incluyen muchos sustancias elementales (H 2, N
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
La presión y sus efectos Presión en sólidos Actividad:
 La presión y sus efectos Presión en sólidos Por ejemplo, si una persona desea clavar sobre una viga de madera, le resultará mucho más fácil utilizar un clavo cuya punta es fina que otro cuya punta se encuentra
La presión y sus efectos Presión en sólidos Por ejemplo, si una persona desea clavar sobre una viga de madera, le resultará mucho más fácil utilizar un clavo cuya punta es fina que otro cuya punta se encuentra
FÍSICA APLICADA Y FISICOQUÍMICA I. Tema 2. El Primer Principio de la Termodinámica
 María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 2 El Primer Principio de la Termodinámica Esquema Tema 2. Primer Principio de la Termodinámica 2.1 Primer Principio
María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 2 El Primer Principio de la Termodinámica Esquema Tema 2. Primer Principio de la Termodinámica 2.1 Primer Principio
Clasificación de la materia hasta el nivel atómico
 1. Estequiometría Clasificación de la materia hasta el nivel atómico Materia puede separarse por un proceso físico? SÍ NO Mezcla es homogénea? Sustancia puede descomponerse por un proceso químico? SÍ NO
1. Estequiometría Clasificación de la materia hasta el nivel atómico Materia puede separarse por un proceso físico? SÍ NO Mezcla es homogénea? Sustancia puede descomponerse por un proceso químico? SÍ NO
Física y Química 1º Bachillerato LOMCE
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 201 2016 Unidad Didáctica 1 Rev 01 Las Leyes Ponderales y Las Leyes de los Gases Ideales 1.1 Las
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 201 2016 Unidad Didáctica 1 Rev 01 Las Leyes Ponderales y Las Leyes de los Gases Ideales 1.1 Las
GUÍA N 3: Equilibrio Químico y Cinética Química
 1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
1. Estequiometría. 1.Estequiometría
 1. Estequiometría Contenidos Reacciones químicas y ecuaciones químicas Mezclas y sustancias puras; compuestos y elementos; moléculas y átomos; iones Reacciones químicas; estequiometría; ecuaciones químicas
1. Estequiometría Contenidos Reacciones químicas y ecuaciones químicas Mezclas y sustancias puras; compuestos y elementos; moléculas y átomos; iones Reacciones químicas; estequiometría; ecuaciones químicas
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
Termodinámica Temas Selectos de Física 2. Prof. Daniel Valerio Martínez Universidad La Salle Nezahualcóyotl
 Termodinámica Temas Selectos de Física 2 Prof. Daniel Valerio Martínez Universidad La Salle Nezahualcóyotl Conceptos básicos Termodinámica Sistema Sistema abierto Sistema cerrado Sistema aislado Frontera
Termodinámica Temas Selectos de Física 2 Prof. Daniel Valerio Martínez Universidad La Salle Nezahualcóyotl Conceptos básicos Termodinámica Sistema Sistema abierto Sistema cerrado Sistema aislado Frontera
TEMA 2: PRINCIPIOS DE TERMODINÁMICA. MÁQUINA TÉRMICA Y MÁQUINA FRIGORÍFICA
 TEMA 2: PRINCIPIOS DE TERMODINÁMICA. MÁQUINA TÉRMICA Y MÁQUINA FRIGORÍFICA La termodinámica es la parte de la física que se ocupa de las relaciones existentes entre el calor y el trabajo. El calor es una
TEMA 2: PRINCIPIOS DE TERMODINÁMICA. MÁQUINA TÉRMICA Y MÁQUINA FRIGORÍFICA La termodinámica es la parte de la física que se ocupa de las relaciones existentes entre el calor y el trabajo. El calor es una
Gases...1. Características: Volumen:...1. Temperatura:
 Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
CLASE Nº 2 ESTEQUIOMETRÍA
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
GASES IDEALES. Contiene una mezcla de gases CP + O 2. Volumen = 1 litro Temperatura = 23 C = ,15 = 298,15K =585 = 0,7697 =250 = 0,3289
 GASES IDEALES PROBLEMA 10 Mezclas de los gases ciclopropano (C 3H 8) y oxígeno se utilizan mucho como anestésicos. a) Cuántos moles de cada gas están presentes en un recipiente de 1 litro a 23 C, si la
GASES IDEALES PROBLEMA 10 Mezclas de los gases ciclopropano (C 3H 8) y oxígeno se utilizan mucho como anestésicos. a) Cuántos moles de cada gas están presentes en un recipiente de 1 litro a 23 C, si la
Conceptos básicos en estequiometría
 Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
INDICE - Parte 2. Cap 7 Parte 2 p. 1 7.4 TRANSPORTE DE OXIGENO POR LA SANGRE 7.4 TRANSPORTE DE OXIGENO POR LA SANGRE
 Capítulo 7 PARTE 2/3 7.4 TRANSPORTE DE OXIGENO POR LA SANGRE Para tratar de entender cómo el oxígeno es transportado, vamos ahora a MEDIR, en una persona, algunos elementos de la fisiología respiratoria.
Capítulo 7 PARTE 2/3 7.4 TRANSPORTE DE OXIGENO POR LA SANGRE Para tratar de entender cómo el oxígeno es transportado, vamos ahora a MEDIR, en una persona, algunos elementos de la fisiología respiratoria.
GASES IDEALES. 1 atm = 760 mmhg = 760 Torr = 1013 hpa
 GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
Energía y metabolismo
 Energía y metabolismo Sesión 17 Introducción a la Biología Prof. Nelson A. Lagos Los sistemas vivos son abiertos y requieren energía para mantenerse La energía es la capacidad de hacer trabajo. Cinético
Energía y metabolismo Sesión 17 Introducción a la Biología Prof. Nelson A. Lagos Los sistemas vivos son abiertos y requieren energía para mantenerse La energía es la capacidad de hacer trabajo. Cinético
INTERPRETACION DE LOS GASES ARTERIALES
 INTERPRETACION DE LOS GASES ARTERIALES ph PaO2 PaCO2 HCO3 BE Hb SaO2 Bloque 6 Modulo 2 Dr Erick Valencia Anestesiologo Intensivista. Que son los Gases Arteriales? Una muestra de sangre anticoagulada que
INTERPRETACION DE LOS GASES ARTERIALES ph PaO2 PaCO2 HCO3 BE Hb SaO2 Bloque 6 Modulo 2 Dr Erick Valencia Anestesiologo Intensivista. Que son los Gases Arteriales? Una muestra de sangre anticoagulada que
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
Ley de los Gases Unidad II
 Ley de los Gases Unidad II Introducción Presión Volumen Cantidad de gas Ley de Abogadro Enunciado Ejemplos Recurso Educaplus Ley de Boyle Enunciado Ejemplos Ley de Charles Enunciado Ejemplos Actividades
Ley de los Gases Unidad II Introducción Presión Volumen Cantidad de gas Ley de Abogadro Enunciado Ejemplos Recurso Educaplus Ley de Boyle Enunciado Ejemplos Ley de Charles Enunciado Ejemplos Actividades
III. ESTADOS DE LA MATERIA
 III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
Bioquímica Tema 2: Soluciones. Unidades Año: 2013
 TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
Guía de estudio y prueba de conocimientos sobre: CAPITULO 4: Fluidos Hidrostáticos
 Guía de estudio y prueba de conocimientos sobre: CAPITULO 4: Fluidos Hidrostáticos Sección 901. Nombre: Cuenta: Nombre: Cuenta: Instrucciones: Contesta lo que se te pide clara y ordenadamente, si necesitas
Guía de estudio y prueba de conocimientos sobre: CAPITULO 4: Fluidos Hidrostáticos Sección 901. Nombre: Cuenta: Nombre: Cuenta: Instrucciones: Contesta lo que se te pide clara y ordenadamente, si necesitas
GUIA: GASES y LEYES QUE LOS RIGEN
 DEPARTAMENTO DE CIENCIAS QUÍMICA Sèptimo Básico GUIA: GASES y LEYES QUE LOS RIGEN 1_ La ley de Gay-Lussac nos dice que, a volumen constante, la presión y la temperatura de un gas son directamente proporcionales
DEPARTAMENTO DE CIENCIAS QUÍMICA Sèptimo Básico GUIA: GASES y LEYES QUE LOS RIGEN 1_ La ley de Gay-Lussac nos dice que, a volumen constante, la presión y la temperatura de un gas son directamente proporcionales
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Electricidad y calor. Gases. Temas. 3. Gases ideales y estados termodinámicos. Webpage:
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temas 3. Gases ideales y estados termodinámicos. i. Concepto y características del gas ideal.
Propiedades térmicas de la materia
 1 Propiedades térmicas de la materia Ahora que hemos comprendido los conceptos de calor y temperatura, procederemos a estudiar el comportamiento térmico de la materia. Para esto, nos interesan cuatro cantidades
1 Propiedades térmicas de la materia Ahora que hemos comprendido los conceptos de calor y temperatura, procederemos a estudiar el comportamiento térmico de la materia. Para esto, nos interesan cuatro cantidades
UNIDAD I. TEMA III. ESTEQUIOMETRÍA
 REPUBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD EXPERIMENTAL SUR DEL LAGO Jesús María Semprúm PROGRAMA DE INGENIERIA DE ALIMENTOS UNIDAD CURRICULAR: QUIMICA GENERAL UNIDAD I. TEMA III. ESTEQUIOMETRÍA Prof.
REPUBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD EXPERIMENTAL SUR DEL LAGO Jesús María Semprúm PROGRAMA DE INGENIERIA DE ALIMENTOS UNIDAD CURRICULAR: QUIMICA GENERAL UNIDAD I. TEMA III. ESTEQUIOMETRÍA Prof.
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
