Conceptos fundamentales de Termodinámica
|
|
|
- Ricardo de la Fuente Tebar
- hace 8 años
- Vistas:
Transcripción
1 CAPÍTULO Conceptos fundamentales de Termodnámca ESQUEMA DEL CAPÍTULO. Qué es la Termodnámca y por qué es útl?. Defncones báscas necesaras para descrbr los sstemas termodnámcos.3 Termometría.4 Ecuacones de estado y ley del gas deal.5 Una breve ntroduccón a los gases reales La Termodnámca proporcona una descrpcón de la matera a escala macroscópca. En esta aproxmacón, la matera se descrbe en térmnos de las propedades ntensvas, tales como la presón, densdad, volumen y temperatura. En este capítulo se dscuten los conceptos báscos empleados en Termodnámca, tales como sstema, contorno, varables ntensvas y extensvas, paredes adabátcas y datérmcas, equlbro, temperatura y termometría. Tambén se dscute la utldad de las ecuacones de estado, que relaconan las varables de estado, presón, volumen y temperatura, para los gases reales e deales.. Qué es la Termodnámca y por qué es útl? La Termodnámca es la rama de la Cenca que descrbe el comportamento de la matera y la transformacón entre las dferentes formas de energía a escala macroscópca, escala humana o mayor. La Termodnámca descrbe un sstema de nterés en térmnos de sus propedades de conjunto. Solamente son necesaras unas cuantas varables para descrbr el sstema y son, generalmente, accesbles a través de meddas. Una descrpcón termodnámca de la matera no hace referenca a su estructura y comportamento a nvel mcroscópco. Por ejemplo, mol de agua en estado gaseoso, a sufcentemente baja densdad, está descrta completamente medante dos de las tres varables macroscópcas: presón, volumen y temperatura. En cambo, la escala mcroscópca se refere a dmensones del orden del tamaño de las moléculas. A nvel mcroscópco el agua es una molécula tratómca polar, H O, con un ángulo de enlace de 04.5, que forma una red de enlaces de hdrógeno. En este lbro aprenderemos prmero Termodnámca y después Termodnámca Estadístca. La Termodnámca Estadístca (Capítulos 3 a 33) emplea propedades atómcas y moleculares para calcular las propedades macroscópcas de la matera. Por ejemplo, la Termodnámca Estadístca muestra que el agua líquda es la forma estable de agregacón, a la presón de bar y 90 C de temperatura, mentras que el agua gaseosa es la forma estable a bar y 0 C. Usando la Termodnámca Estadístca, se calculan las propedades macroscópcas a partr de las propedades moleculares subyacentes. Dado que la naturaleza mcroscópca de la matera se comprende cada vez mejor, empleando teorías como la mecánca cuántca, por qué es relevante actualmente una cenca macroscópca como la Termodnámca? La utldad de la Termodnámca se puede lustrar descrbendo cuatro aplcacones de la msma:
2 CAPÍTULO Conceptos fundamentales de Termodnámca Imagnemos que hemos construdo una planta para sntetzar NH 3 gas a partr de N e H. Encontramos que el rendmento es nsufcente para hacer rentable el proceso y decdmos ntentar mejorar la salda de NH 3 cambando la temperatura y/o la presón. Sn embargo, no sabemos s aumentar o dsmnur los valores de esas varables. Como se mostrará en el Capítulo 6, el rendmento del amonaco será mayor en el equlbro s la temperatura descende y la presón aumenta. Queremos usar metanol para mpulsar un coche. Un ngenero nos sumnstra un dseño para un motor de combustón nterna que quema metanol efcentemente, de acuerdo con la reaccón CH 3 OH (l) + O (g) CO (g) + H O (l). Un segundo ngenero dseña una célula electroquímca de combustble que lleva a cabo la msma reaccón. Afrma que el vehículo vajará mucho más lejos s se mpulsa con la célula de combustble que con el motor de combustón nterna. Como mostraremos en el Capítulo 5, esta afrmacón es correcta y se puede efectuar una estmacón de las efcencas relatvas de los dos sstemas de propulsón. Nos plantean dseñar una nueva batería que se empleará para mpulsar un coche híbrdo. Debdo a que el voltage requerdo para la conduccón de los motores es mucho mayor que el que puede generar una smple célula electroquímca, se deben conectar varas células en sere. Debdo a que el espaco para la batería es lmtado, sólo es posble utlzar unas pocas células. Nos han dado una lsta de posbles reaccones en las células y nos pden determnar el número de células necesaro en cada caso para generar el voltage requerdo. Como veremos en el Capítulo, este problema se puede resolver usando los valores tabulados de las funcones termodnámcas. Nuestros ntentos de sntetzar un nuevo, y potencalmente muy comercal compuesto, proporconan un rendmento que lo hace mposble de aprovechar para ncar la produccón. Un supervsor sugere un mayor esfuerzo para hacer el compuesto sntetzando un catalzador que faclte la reaccón. Cómo podemos decdr s este esfuerzo es váldo para la nversón requerda? Como veremos en el Capítulo 6, calcularemos prmeramente el máxmo rendmento esperado en condcones de equlbro. S este rendmento es nsufcente, la catálss es nútl.. Defncones báscas necesaras para descrbr los sstemas termodnámcos Un sstema termodnámco está consttudo por todos los materales mplcados en el proceso bajo estudo. Este materal podría ser el contendo de un vaso con los reactvos, una dsolucón de electroltos con una célula electroquímca, o el conjunto formado por el clndro y el pstón móvl de un motor. En Terodnámca, el resto del unverso se llama medo ambente o medo que lo rodea. S un sstema puede ntercambar matera con el medo que lo rodea, se denomna sstema aberto; s no es un sstema cerrado. Ambos sstemas, aberto y cerrado, pueden ntercambar energía con el medo ambente. Los sstemas que no pueden ntercambar n matera n energía con el medo que los rodean se denomnan sstemas aslados. La nterfase entre el sstema y el medo que lo rodea se denomna límte. Los límtes determnan s se puede transferr energía y masa entre el sstema y el medo ambente, dando lugar a la dstncón entre sstemas abertos, cerrados y aslados. Consderemos los océanos de la Terra como un sstema, y el resto del unverso el medo ambente. El límte sstema - medo ambente consta de la nterfase sóldo líqudo entre los contnentes y el fondo de los océanos y la nterfase agua-are en la superfce del océano. Para un vaso aberto en el que el sstema es el contendo, la superfce límte es, justamente, la parte nterna de pared del vaso, y la superfce de la parte superor aberta del vaso. En este caso, puede haber ntercambo de energía, lbremente, entre el sstema y el medo que lo rodea a través de las paredes de las caras y del fondo, y se puede ntercambar energía y matera entre el sstema y el medo ambente a través del límte superor
3 . Defncones báscas necesaras para descrbr los sstemas termodnámcos 3 (a) (b) aberto. En el ejemplo anteror la porcón del límte formada por el vaso se denomna pared. Las paredes son sempre lmtantes, pero un límte no necesaramente es una pared. Las paredes pueden ser rígdas o movbles y permeables o mpermeables. Un ejemplo de una pared movble es la superfce de un balón. El ntercambo de matera y energía a través de los límtes entre el sstema y el medo que lo rodea es central para el mportante concepto de equlbro. El sstema y medo crcundante pueden estar en equlbro con respecto a una o más de las dferentes varables del sstema, tales como: presón (P), temperatura (T) y concentracón. El equlbro termodnámco se refere a la condcón en la que exste equlbro con respecto a P, T y la concentracón. Un sstema puede estar en equlbro con el medo ambente con respecto a sólo una varable dada. El equlbro exste solamente s la varable no camba con el tempo y s tene el msmo valor en todas las partes del sstema y el medo ambente. Por ejemplo, el nteror de una burbuja de jabón (el sstema) y el medo ambente (medo), están en equlbro con respecto a P, debdo a que las paredes móvbles (la burbuja) pueden alcanzar una poscón en que la P sobre ambas caras de la pared es la msma, y debdo a que P tene el msmo valor a través del sstema y del medo. El equlbro con respecto a la concentracón exste sólo s es posble el transporte de todas las especes cruzando los límtes en ambas dreccones. S el límte es una pared movble que no es permeable a todas las especes, puede exstr equlbro con respecto a P, pero no con respecto a la concentracón. Debdo a que N y O no pueden dfundrse a través de una burbuja (dealzada), el sstema y el medo ambente están en equlbro con respecto a P, pero no con respecto a la concentracón. El equlbro con respecto a la temperatura es un caso especal que dscutremos a contnuacón. La temperatura es una cantdad abstracta que se determna ndrectamente, por ejemplo, mdendo el volumen del mercuro confnado en un caplar fno, la fuerza electromotrz generada en la unón de dos metales dferentes, o la resstenca eléctrca de un hlo de platno. A nvel mcroscópco, la temperatura está relaconada con la energía cnétca de las moléculas. Pese a que cada uno de nosotros tenemos un sentdo de una escala de temperatura, basada en los descrptores cualtatvos calente y frío, precsamos una medda cuanttatva de la temperatura más transferble que no cambe en experencas ndvduales. Para hacer más concreta esta dscusón, consderemos un gas dludo bajo las condcones en las que la ley de los gases deales de la Ecuacón (.) descrbe la relacón entre P,T y la densdad molar, r = nv, con precsón sufcente: P= rrt (.) La ley de los gases deales se dscute más adelante en la Seccón.4. En Termodnámca, la temperatura es la propedad de un sstema que determna s el sstema está en equlbro térmco con otros sstemas o el medo que lo rodea. La Ecuacón (.) se puede reescrbr del sguente modo: T P = rr (.) (c) FIGURA. (a) Dos sstemas separados con paredes rígdas y la msma densdad molar tenen dferentes temperaturas. (b) Los dos sstemas se juntan, de forma que las paredes están en contacto drecto. Aún después de transcurrdo mucho tempo la presón de cada sstema no se altera. (c) Como en la parte (b), los dos sstemas se juntan de forma que las paredes están en contacto drecto. Después de transcurrdo sufcente tempo, las presones se gualan. Esta ecuacón muestra que para los gases deales que tengan la msma densdad molar, se puede usar un manómetro para comparar los sstemas y determnar s es mayor T o T. El equlbro térmco entre sstemas exste s P = P, para sstemas gaseosos con la msma densdad molar. Usamos los conceptos temperatura y equlbro térmco para caracterzar las paredes entre un sstema y el medo. Consderemos dos sstemas con paredes rígdas como se muestra en la Fgura.a. Cada sstema tene la msma densdad molar y está equpado con un manómetro. S ponemos los dos sstemas en contacto drecto, se observan dos comportamentos límte. S no camba nnguno de los manómetros, como en la Fgura.b, dremos que las paredes son adabátcas. Debdo a que P P, los sstemas no están en equlbro térmco, y, por tanto, te- En este ejemplo se supone que la tensón superfcal de la burbuja es tan pequeña que puede consderarse nula. Esta suposcón se mantene dentro de la tradcón termodnámca de los pstones sn peso y poleas sn frccón.
4 4 CAPÍTULO Conceptos fundamentales de Termodnámca nen dferentes temperaturas. Un ejemplo de un sstema rodeado por paredes adabátcas es un café en una taza de Spyrofoam con una tapa de Spyrofoam. La experenca demuestra que no es posble unr dos sstemas encerrados entre paredes adabátcas en equlbro térmco, ponéndolos en contacto, debdo de que las paredes adabátcas aslan de la transferenca de calor. S se aproxma una copa de Spyrofoam contenendo café calente haca otra contenendo helo, no alcanzan la msma temperatura. En el Capítulo daremos una defncón termodnámca pensando en su experenca en este punto sobre el sgnfcado de calor. El segundo caso límte se muestra en la Fgura.c. Ponendo los sstemas en contacto drecto, pasado un tempo ambas presones alcanzan el msmo valor. Conclumos que los sstemas tenen la msma temperatura, T =T y decmos que están en equlbro térmco. Dremos que estas paredes son datérmcas. Dos sstemas en contacto, separados por paredes datérmcas alcanzan el equlbro térmco debdo a que las paredes datérmcas conducen el calor. El café calente en una copa de cobre es un ejemplo de sstema rodeado por paredes datérmcas. Debdo a que las paredes son datérmcas, el café alcanzará rápdamente la temperatura ambente La ley cero de la Termodnámca generalza el expermento lustrado en la Fgura. y afrma la exstenca de una temperatura objetva que se puede usar para defnr la condcón de equlbro térmco. El enuncado formal de esta ley es el sguente: Dos sstemas que están, por separado, en equlbro térmco con un tercer sstema están, tambén, en equlbro térmco entre sí. Hay cuatro leyes de la Termodnámca, que son todas generalzacones de la experenca, más que teoremas matemátcos. Se han comprobado rgurosamente a lo largo de más de un sglo de expermentacón y no se han encontrado volacones de esas leyes. La desafortunadamente denomnacón de ley cero se debe al hecho de que se formuló después de la prmera ley de la Termodnámca, pero, lógcamente, la precede. La ley cero nos dce que podemos determnar s dos sstemas están en equlbro térmco sn ponerlos en contacto. Imagne que el tercer sstema es un termómetro, que se defne más precsamente en la seccón sguente. El tercer sstema se puede usar para comparar la temperatura de los otros dos sstemas; s tenen la msma temperatura, estarán en equlbro térmco s se ponen en contacto..3 Termometría La dscusón del equlbro térmco requere, solamente, que exsta un dspostvo, llamado termómetro, que puede medr el calor o frío relatvos. Sn embargo, el trabajo centífco requere una escala cuanttatva. Para cualquer termómetro útl, la temperatura empírca, t, debe ser un valor únco, contnuo y una funcón monótona de alguna propedad del sstema termométrco, desgnada por x. Ejemplos de propedades termométrcas son el volumen de un líqudo, la resstenca eléctrca de un metal o semconductor y la fuerza electromotrz generada en la unón de dos metales dferentes. El caso más smple que podemos magnar es aquel en que la temperatura empírca, t, está relaconada lnealmente con el valor de la propedad termométrca, x: tx ( )= a+ bx En esta dscusón, se supone que el Styrofoam es un aslante perfecto. (.3) La Ecuacón (.3) defne una escala de temperatura en térmnos de una propedad termométrca específca, fjadas las constantes a y b. La constante a determna el cero de la escala de temperatura, ya que t(0) = a, y la constante b determna el tamaño de la undad de temperatura, denomnada grado. Uno de los prmeros termómetros práctcos fue el de mercuro en vdro. Utlza la propedad de que el volumen de mercuro aumenta monótonamente en el ntervalo de temperatura del estado líqudo (entre -38.8ºC y 356.7ºC). En 745 Carolus Lnnaeus proporconó una escala asgnando arbtraramente los valores 0 y 00 a los puntos de congelacón y ebullcón del agua, respectvamente. Este ntervalo se dvdó en 00 grados guales, que
5 .3 Termometría 5 Presón (bar) Temperatura (Celsus) 0. L 0. L 0.3 L 0.4 L 0.5 L 0.6 L FIGURA. Se muestra la presón ejercda por 5.00 x0 3 moles de un gas dludo en funcón de la temperatura medda en la escala Celsus para dferentes volúmenes fjos. La porcón punteada ndca que los datos se extrapolan a temperaturas más bajas que las que pudo alcanzar expermentalmente Boyle. con el msmo tamaño tambén se usan fuera de dcho ntervalo. Debdo a que hay 00 grados entre los dos puntos de calbracón, se denomnó escala centígrada. En la actualdad la escala centígrada se ha vsto reemplazada por la escala Celsus que está más extendda. La escala Celsus (denotada en undades de ºC) es smlar a la escala centígrada. Sn embargo, en lugar de estar determnada por dos puntos fjos, la escala Celsus lo está por un punto de referenca fjo en que el helo, agua líquda y agua gaseosa están en equlbro. Este punto se denomna punto trple (Véase Seccón 8.) y se le asgna el valor 0.0ºC. En la escala Celsus el punto de ebullcón del agua a la presón de atmósfera es ºC. El tamaño del grado es el msmo que en la escala centígrada. Pese a que la escala Celsus es hoy la más empleada del mundo, los valores numércos para esta escala de temperatura son completamente arbtraros. Sería preferble tener una escala de temperatura dervada drectamente de prncpos físcos. Exste tal escala, y se denomna escala de temperatura termodnámca o escala de temperatura absoluta. Para tal escala, la temperatura es ndependente de la substanca usada en el termómetro y la constante a en la Ecuacón (.3) es cero. El termómetro de gas es un termómetros práctco con el que se puede medr la temperatura absoluta. La propedad termométrca es la dependenca de la temperatura con P para un gas dludo a V constante. El termómetro de gas proporcona el estándar nternaconal para la termometría a muy bajas temperaturas. A temperaturas ntermedas el estándar es una resstenca eléctrca de un hlo de platno y a temperaturas muy altas, la energía rradada por la plata ncandescente. Cómo se usa el termómetro de gas para medr la temperatura termodnámca? Las meddas que hzo Robert Boyle en el sglo XIX demostraron que la presón ejercda por una cantdad fja de gas a V constante varía lnealmente con la temperatura de la escala centígrada como se muestra en la Fgura.. En la época de los expermentos de Boyle, no se alcanzaban temperaturas por debajo de -30ºC. Sn embargo, los datos de P frente a T se pueden extrapolar al límte del valor de T para el que P 0. Las líneas rectas obtendas para dferentes valores de V se cortan en un punto del eje T, stuado próxmo a -73ºC. Los datos muestran que a V constante, la presón P varía con la temperatura como P = c+ dt (.4) donde t es la temperatura en la escala Celsus, y c y d son constantes expermentales. La Fgura. muestra que todas las líneas se cortan en un punto, ncluso para gases dferentes. Esto sugere un punto de referenca únco para la temperatura, en lugar de los dos puntos de referenca usados para construr la escala centígrada. El valor cero se da a la temperatura a la que P 0. Sn embargo, esto no es sufcente para defnr la escala de temperatura, debdo a que el tamaño del grado no está defndo. Por conveno, el tamaño del grado de la escala de temperatura absoluta se hace gual al de la escala Celsus, ya que la escala Celsus estaba muy extendda cuando se formuló la escala de la temperatura absoluta. Con estas dos eleccones, las escalas absoluta y Celsus están relaconadas medante la Ecuacón (.5). La escala empleada por el termómetro de gas deal es la escala de temperatura absoluta usada en Termodnámca. La undad de temperatura en esta escala se llama kelvn, abrevada K (sn el sgno de grado): T( K) = T( o C) (.5) Usando como referenca el punto trple del agua la temperatura absoluta T(K), medda por un termómetro de gas deal vene dada por P T( K ) = P pt (.6) donde P pt es la presón correspondente al punto trple del agua. En esta escala, el volumen de un gas deal es drectamente proporconal a su temperatura; s la temperatura se reduce a la mtad del valor ncal, V se reduce tambén a la mtad de su valor ncal. En la práctca, se deben tener en cuenta las desvacones de la ley del gas deal de los gases reales, cuando
6 6 CAPÍTULO Conceptos fundamentales de Termodnámca T (K) Ar He N P (Pa) FIGURA.3 La temperatura medda en un termómetro de gas defnda por la Ecuacón (.6) es ndependente del gas usado solamente en el límte P 0. 0 K 0 0 K 0 8 K 0 6 K 0 4 K 0 K K 0 K 0 4 K Temperatura ambente 0 4 s después del Bng Bang Núcleo de una ggante roja Núcleo del Sol Corona solar Superfce del Sol Herve el mercuro El H O es líquda Herve el oxígeno Herve el helo Temperatura promedo del Unverso 3 He superfludo FIGURA.4 Se muestra la temperatura absoluta sobre una escala logarítmca, con la temperatura de una sere de fenómenos físcos. se use en los termómetros de gas. Los datos obtendos con un termómetro de gas usando He, Ar y N para una temperatura muy próxma a T pt, exhben el comportamento de la Fgura.3. Vemos que la temperatura sólo llega a ser ndependente de P y del gas usado en el termómetro s los datos se extrapolan a presón cero. Es en este límte que el termómetro de gas proporcona una medda de la temperatura termodnámca. Como bar = 0 5 Pa, solamente se obtenen valores de T ndependentes del gas, por debajo de P = 0.0 bar. En la Fgura.4 se muestra la temperatura absoluta en una escala logarítmca junto a los fenómenos físcos asocados..4 Ecuacones de estado y ley del gas deal Los modelos macroscópcos en los que se descrbe el sstema medante una sere de varables están basados en la experenca. Es partcularmente útl formular una ecuacón de estado, que relacone las varables de estado. Usando la escala de temperatura absoluta es posble obtener a partr de la experenca una ecuacón de estado para un gas deal. S se mde la presón del He en funcón del volumen, para dferentes temperaturas, se obtene una sere de hpérbolas que no se ntersectan como las que se muestran en la Fgura.5. Estas curvas se pueden ajustar a la forma funconal PV = at (.7) donde T es la temperatura absoluta defnda en la Ecuacón (.6), tenendo que determnar a que es drectamente proporconal a la masa del gas empleado. Es útl separar esta dependenca escrbendo a = nr, donde n es el número de moles del gas y R es una constante que es ndependente del tamaño del sstema. El resultado es la ecuacón de estado del gas deal (.8) donde las constantes de proporconaldad k y R se denomnan constante de Boltzmann y constante del gas deal, respectvamente; N es el número de moléculas y n es el número de moles de gas. La ecuacón de estado dada por la Ecuacón (.8) se conoce como ley del gas deal. Como las cuatro varables están relaconadas a través de la ecuacón de estado, tres cualesquera de esas varables son sufcentes para descrbr completamente el gas deal. Nótese que es el número total de moles no el número de moles de un componente del gas, ndvdualmente en una mezcla de gases el que ntervene en la ley del gas deal. De esas cuatro varables P y T son ndependentes de la cantdad de gas, mentras que V y n son proporconales a la cantdad de gas. Una varable que es ndependente del tamaño del sstema (por ejemplo, P y T) se denomna varable ntensva, y una que es proporconal al tamaño del sstema (por ejemplo, V) se denomna varable extensva. La Ecuacón (.8) se puede escrbr exclusvamente en térmnos de las varables ntensvas (.8a) Para un número fjo de moles, la ecuacón del gas deal solamente tene dos varables ntensvas ndependentes: cualesquera dos de P,T y r. Para una mezcla de gases deales PV = n RT (.9) y como las moléculas de gas no nteractúan entre s, la Ecuacón (.9) se puede poner en la forma nrt P = = P = P + P + P + V 3... PV = NkT = nrt P= rrt (.0)
7 .4 Ecuacones de estado y ley del gas deal Presón (Pa) K 700 K Volumen (m 3 ) FIGURA.5 Ilustracón de la relacón entre la presón y el volumen de 0.00 moles de He para valores fjos de la temperatura, que dferen en 00 K. En la Ecuacón (.0), P es la presón parcal de cada gas. Esta ecuacón establece que cada gas deal ejerce una presón que es ndependente de los demás gases de la mezcla. Tenemos nrt nrt P V V n = = = = x P nrt nrt n V V (.) que relacona la presón parcal de un componente de una mezcla, P, con la fraccón molar, x = n n, y la presón total, P. En el sstema de undades SI, la presón se mde en las undades Pascal (Pa), sendo Pa = N/m. El volumen se mde en metros cúbcos y la temperatura en kelvn. Sn embargo, frecuentemente se usan otras undades de presón, que están relaconadas con el Pascal, como se ndca en la Tabla.. En esta tabla, los números que no son exactos se dan con cnco cfras sgnfcatvas. La otra undad de volumen comúnmente usada es el ltro (L), sendo m 3 =0 3 L y L= dm 3 =0-3 m 3. En el sstema SI, la constante R que aparece en la ley del gas deal tene el valor de 8.34 J K mol -, sendo el julo (J) la undad de energía en el sstema SI. Para smplfcar los cálculos para otras undades de presón y volumen, en la Tabla. se dan valores de la constante R para dferentes combnacones. PROBLEMA EJEMPLO. Al partr de vaje a las montañas, hnche los neumátcos de su automóvl a la presón remomendada de Pa para un día en que la temperatura es de C. Conduzca haca la playa, donde la temperatura es de 8.0 C. Suponga que el volumen del neumátco ha aumentado un 3%. Cuál es la presón fnal de los neumátcos? El fabrcante del neumátco ndca que no se supere la presón recomendada en más de un 0%. Ha exceddo este límte? Solucón Como el número de moles es constante, PV P V PVT f f f = ; Pf = ; T T VT P f f f PVT f V ( ) = = Pa = Pa VT f 03. V ( ) Esta presón está dentro del 0% de la presón recomendada. TABLA. Undades de presón y factores de conversón Undad de presón Símbolo Valor numérco Pascal Pa N m = kg m s Atmósfera atm atm = 0,35 Pa (exactamente) Bar ba bar = 0 5 Pa Torr o mlímetros de Hg Torr Torr = 0,35/760 = 33.3 Pa Lbras por pulgada cuadrada ps ps = 6,894.8 Pa
8 8 CAPÍTULO Conceptos fundamentales de Termodnámca TABLA. La constante del gas deal, R, en dferentes undades R = 8.34 J K mol - R = 8.34 Pa m 3 K - mol R = L bar K mol R = L atm K mol R = 6.36 L Torr K mol PROBLEMA EJEMPLO. Consdere el sstema compuesto mostrado en la sguente fgura que se mantene a 98 K. Suponendo el comportamento del gas deal, calcular la presón total y la presón parcal de cada componente s se qutan las barreras que separan los compartmentos. Suponga desprecable el volumen de las barreras. He.00 L.50 bar Ne 3.00 L.50 bar Xe.00 L.00 bar Solucón El número de moles de He, Ne y Xe venen dados por PV nhe = RT =.50 bar.00 L L bar K mol = 0. mol 98 K PV.50 bar 3.00 L nne = = = mol RT L bar K mol 98 K PV nxe = RT =.00 bar.00 L = mol L bar K mol 98 K n= nhe + nne + nxe = Las fraccones molares son La presón total vene dada por x x x He Ne Xe nhe 0. = = = 0. 6 n nne = = = n nxe = = = n ( nhe + nne + nxe ) RT mol L bar K mol 98 K P = = V 6.00 L =.9 bar Las presones parcales sone entonces PHe = xhep = bar = 0.50bar PNe = xnep = bar =.5 bar PXe = xxe P = bar = 0.65bar
9 .5 Una breve ntroduccón a los gases reales 9.5 Una breve ntroduccón a los gases reales V(r) 0 0 r V=0 Gas real Gas deal r transcón r La ley del gas deal proporcona un prmer ndco de la utldad de descrbr un sstema en térmnos de parámetros macroscópcos. Sn embargo, tambén resaltaremos los nconvenentes de no tener en cuenta la naturaleza mcroscópca del sstema. Por ejemplo, la ley del gas deal sólo vale para gases a bajas densdades. Los expermentos demuestran que la Ecuacón (.8) es precsa para valores bajos de presón y altos de temperatura, tanto para el He como para el NH 3. Por qué ocurre esto? Los gases reales se dscutrán en detalle en el Capítulo 7. Sn embargo, como necestamos tener en cuenta el comportamento del gas no deal en los Capítulos al 6, ntroducmos en esta Seccón una ecuacón de estado que es válda a densdades elevadas. Un gas deal se caracterza medante dos suposcones: los átomos o moléculas de un gas deal no nteractúan entre sí, y los átomos o moléculas se pueden tratar como masas puntuales. Estas suposcones tenen un rango de valdez lmtada, que podemos dscutr usando la funcón energía potencal típca de un gas real, como se muestra en la Fgura.6. Esta fgura muestra la energía potencal de nteraccón de dos moléculas de gas en funcón de la dstanca entre ellas. El potencal ntermolecular se puede dvdr en regones en las que la energía potencal es esencalmente nula (r > r transcón ), negatva (nteraccón atractva) (r transcón > r > r V=0 ), y postva (nteraccón repulsva) (r < r V=0 ). La dstanca r transcón no está defnda unívocamente y depende de la energía de la molécula. Puede estmarse a partr de la relacón V( rtranscón) kt. Cuando la densdad aumenta desde valores muy bajos, las moléculas se aproxman entre sí hasta stuarse a unos pocos dámetros moleculares y expermentan una fuerza de van der Waals atractva de largo alcance, debdo a los momentos dpolares moleculares fluctuantes en el tempo. Esta fuerza de nteraccón atractva es proporconal a la polarzabldad de la carga electrónca de la molécula y es, por tanto, dependente de la substanca. En la regón atractva, P es menor que la calculada usando la ley del gas deal, debdo a que la nteraccón atractva acerca los átomos o moléculas a dstancas menores que s no nteractuaran. A densdades sufcentemente bajas, los átomos o moléculas expermentan una nteraccón repulsva de corto alcance debda al solapamento de las dstrbucones de la carga electrónca. A causa de esta nteraccón, Pes mayor que la calculada usando la ley del gas deal. Vemos que para un gas real, P puede ser mayor o menor que el valor del gas deal. Nótese que el potencal llega a ser repulsvo para un valor de r mayor que cero. Como consecuenca, el volumen de un gas que esté muy por encma de su temperatura de ebullcón, se aproxma a un valor límte fnto conforme P aumenta. En contraste, la ley del gas deal predce que V 0 cuando P Dada la funcón energía potencal descrta en la Fgura.6, bajo qué condcones es válda la ecuacón del gas deal? Un gas real se comporta dealmente sólo a bajas densdades para las que r > r transcón, y el valor de r transcón es dependente de la substanca. Los gases reales se dscutrán con mayor detalle en el Capítulo 7. Sn embargo, en este punto ntroducmos una ecuacón de estado del gas real, ya que se usará en los sguentes capítulos. La ecuacón de estado de van der Waals ncorpora ambos, el tamaño fnto de las moléculas y el potencal atractvo. Tene la forma FIGURA.6 Se muestra la energía potencal para la nteraccón de dos moléculas o átomos en funcón de su separacón, r. La curva naranja muestra la funcón de energía potencal para un gas deal. La línea azul punteada ndca un valor aproxmado, r, por debajo del cual se debe usar una ecuacón de estado más exacta que la del gas deal. V(r) = 0 a r = r V=0 y conforme r. nrt P = V nb na V (.) Esta ecuacón de estado tene dos parámetros que dependen de la substanca y deben determnarse expermentalmente. Los parámetros b y a ncluyen el tamaño fnto de las moléculas y la fuerza de la nteraccón atractva, respectvamente. (Los valores de a y b se relaconan en la Tabla 7.4 para unos gases selecconados). La ecuacón de van der Waals es más precsa para calcular la relacón entre P, V y T que la ley del gas deal, debdo a que a y b se han optmzado usando resultados expermentales. Sn embargo, hay otras ecuacones de estado más precsas y váldas en un rango mayor que la ecuacón de van der Waals. Tales ecuacones de estado ncluyen hasta 6 parámetros, dependentes de la substanca.
10 0 CAPÍTULO Conceptos fundamentales de Termodnámca PROBLEMA EJEMPLO.3 Los parámetros de van der Waals se tabulan, generalmente, en uno de estos dos conjuntos de undades: a: Pa m 6 mol o bar dm 6 mol b: m 3 mol o dm 3 mol Determne el factor de conversón para convertr un sstema de undades en otro. Nótese que dm 3 = 0 3 m 3 = L. Solucón bar 06 dm6 Pa m6 mol = 0 bar dm mol 05 Pa m6 03 dm3 m3 mol = 03 dm3 mol m3 6 En el Problema ejemplo.4, se compara el volumen molar para el N calculado a baja y alta presón, usando las ecuacones de estado del gas deal y de van der Waals. PROBLEMA EJEMPLO.4 a. Calcular la presón ejercda por N a 300 K para volúmenes molares de 50 y 0.00 L usando las ecuacones de estado del gas deal y de van der Waals. Los valores de los parámetros a y b para N son.370 bar dm 6 mol y dm 3 mol, respectvamente. b. Comparar los resultados de los cálculos a las dos presones. S la presón P calculada usando la ecuacón de van der Waals es mayor que la calculada con la ley del gas deal, podemos conclur que la nteraccón repulsva de las moléculas de N superan la nteraccón atractva para el valor dado de la densdad. Un enuncado smlar se puede hacer para la nteraccón atractva. Es mayor la nteraccón atractva o la repulsva para el N a 300 K y V m = 0.00 L? Solucón a. Las presones calculadas a partr de la ecuacón de estado del gas deal son P nrt mol L bar mol K 300 K = = = bar V 50 L P = nrt mol L bar mol K 300 K = = 49 bar V 0.00 L Las presones calculadas a partr de la ecuacón de estado de van der Waals son nrt na P = V nb V mol L bar mol K 300 K ( mol).370 bar dm mol = 50 L mol dm3 mol ( 50 L) = bar mol L bar mol K 300 K ( mol).370 bar dm mol P = 0. L mol dm3 mol ( 0. L) = 70 bar 6 6 b. Nótese que el resultado es déntco al de la ley del gas deal para V m = 50 L, y el obtendo para V m = 0.00 L se desvía del resultado de la ley del gas deal. Como Preal > Pdeal, conclumos que la nteraccón repulsva es más mportante que la nteraccón atractva para estos valores específcos de volumen molar y temperatura.
11 Problemas Vocabularo adabátca constante de Boltzmann constante del gas deal datérmca ecuacón de estado ecuacón de estado de van der Waals equlbro equlbro térmco equlbro termodnámco escala Celsus escala centígrada escala de temperatura escala de temperatura absoluta escala de temperatura termodnámca escala kelvn escala macroscópca escala mcroscópca fraccón molar ley cero de la termodnámca ley del gas deal límte medo crcundante pared pared mpermeable pared movble pared permeable pared rígda presón parcal sstema sstema aberto sstema aslado sstema cerrado temperatura Termodnámca Estadístca termómetro termómetro de gas varable extensva varable ntensva varables del sstema varables macroscópcas Cuestones sobre Conceptos C. La poscón de los límtes entre el sstema y el medo crcundante es una eleccón que debe hacer el termodnámco. Consdere un recpente con agua hrvendo en una habtacón hermétca. S el límte se establece justamente en la parte de fuera del agua líquda, el sstema es aberto o cerrado? S el límte se establece justamente dentro de las paredes de la habtacón, el sstema es aberto o cerrado? C. Las paredes reales nunca son totalmente adabátcas. Ordene las sguentes paredes en orden crecente de datermtcdad: hormgón de cm de espesor, vacío de cm de espesor, cobre de cm de espesor, corcho de cm de espesor. C.3 Por qué la posbldad de ntercambo de matera o energía apropada para la varable de nterés es una condcón necesara para el equlbro entre dos sstemas? C.4 A temperaturas sufcentemente elevadas, la ecuacón de van der Waals tene la forma P RT ( Vm b). Nótese que la parte atractva del potencal no tene nfluenca en esta expresón. Justfque este comportamento usando el dagrama de energía potencal de la Fgura.6. C.5 El parámetro a en la ecuacón de van der Waals es mayor para el H O que para el He. Qué dce esto de la forma de la funcón potencal de la Fgura.6 para los dos gases? Problemas P. Un matraz sellado con una capacdad de.00 dm 3 contene 5.00 g de etano. El matraz es tan débl que reventará s la presón supera Pa. A qué temperatura la presón del gas excederá la correspondente a la temperatura de explosón? P. Consdere una mezcla de gas en un matraz de.00 dm 3 a 7.0 C. Para cada una de las mezclas sguentes, calcule la presón parcal de cada gas, la presón total y la composcón de la mezcla en porcentaje molar: a..00 g H y.00 g O b..00 g N y.00 g O c..00 g CH 4 y.00 g NH 3 P.3 Suponga que se mde el producto PV de mol de un gas dludo y se encuentra que PV =.98 L atm a 0 C y 3.8 L atm a 00 C. Suponga que es válda la ley del gas deal con T = t( C) + a, y que el valor de R no se conoce. Determne R y a a partr de las meddas sumnstradas. P.4 Un clndro de gas comprmdo contene g de N gas a una presón de Pa y una temperatura de 7. C. Qué volumen de gas se ha lberado a la atmósfera s la presón fnal en el clndro es de Pa? Suponga comportamento deal y que la temperatura permanece nalterada. P.5 Un globo lleno con 0.50 L de Ar a 8.0 C y atm ascende en la atmósfera a una altura en que la presón es de 48 Torr y la temperatura es de C. Cuál es el volumen fnal del globo? P.6 Consdere una muestra de 0.0 L de are húmedo a 60 C y atm en la que la presón parcal del vapor de agua es 0.0 atm.
12 CAPÍTULO Conceptos fundamentales de Termodnámca Suponga que el are seco tene una composcón de 78.0 % molar de N,.0 % molar de O, y un.00 % molar de Ar. a. Cuáles son los porcentajes molares de cada uno de los gases presentes en la muestra? b. El porcentaje de humedad relatva se defne como %RH = P P* HO donde P HO HO es la presón parcal del agua en la muestra y P HO = 0.97 atm es la presón del vapor del agua en equlbro a 60 C. El gas se comprme a 60 C hasta que la humedad relatva es del 00%. Qué volumen contene ahora la mezcla? c. Qué fraccón del agua se condensará, s la presón total de la mezcla aumenta sotérmcamente hasta 00 atm? P.7 Una mezcla de g de O, moles de N, y moléculas de CO se ponen en un recpente de 3.50 L a 5.0 C. a. Calcule la presón total del recpente. b. Calcule las fraccones molares y las presones parcales de cada gas. P.8 El N líqudo tene una densdad de kg m 3 en su punto de ebullcón normal. Qué volumen tendrá un globo a 8.5 C y a una presón de.00 atm s se nyectan L de N líqudo? P.9 Un recpente rígdo de volumen m 3 contenendo H a 0.5 C y a una presón de Pa se conecta a un segundo recpente rígdo de volumen m 3 contenendo Ar a 3. C a una presón de Pa. Se abre una válvula que los separa y ambos se enfrían a una temperatura de 4.5 C. Cuál es la presón fnal en los recpentes? P.0 Se stúa una muestra de propano (C 3 H 8 ) en un recpente cerrado con una cantdad de O que es 3.00 veces la cantdad precsa para oxdar totalmente el propano a CO y H O a temperatura constante. Calcule la fraccón molar de cada componente en la mezcla resultante, después de la oxdacón, suponendo que el H O está presente como gas. P. Una ampolla de vdro de volumen 0.36 L contene g de gas a Torr y 99.5 C. Cuál es la masa molar del gas? P. La presón total de una mezcla de oxígeno e hdrógeno es.00 atm. La mezcla se nflama y se elmna el agua. El gas remanente es hdrógeno puro y ejerce una presón de atm cuando se mde a los msmos valores de T y V que la mezcla orgnal. Cuál era la composcón de la mezcla orgnal en porcentaje molar? P.3 Se sabe que una muestra de gas es una mezcla de etano y butano. Una ampolla que tene 00.0 cm 3 de capacdad se llena con gas a una presón de Pa a 0.0 C. S el peso del gas en la ampolla es de g, cuál es el porcentaje molar del butano en la mezcla? P.4 Cuando Julo César expró, su últma exhalacón tuvo un volumen de 500 cm 3 y contenía un.00 % molar de argón. Suponga que T = 300 K y P =.00 atm en el lugar de su fallecmento. Suponga, además, que T y P usualmente tenen los msmos valores en cualquer punto de la atmósfera. S todas las moléculas de CO exhaladas se dstrbuyen unformemente en la atmósfera (que para nuestros cálculos tomamos un espesor de.00 km), cuántas nhalacones de 500 cm 3 debemos hacer para nhalar una molécula de Ar exhalada en la últma expracón de César? Suponga que el rado de la Terra es m. [Sugerenca: calcule el número de átomos de Ar en la atmósfera para la geometría smplfcada de un plano de área gual a la de la superfce de la Terra y altura gual al espesor de la atmósfera. Véase el Problema.5 para la dependenca de la presón barométrca con la altura por encma de la superfce de la Terra.] P.5 La presón barométrca en la atmósfera de la Terra dsmnuye con la altura por encma del nvel del mar en la Mgz RT forma P = P0 e donde P es la presón parcal a la altura z, P0 es la presón parcal del componente a nvel del mar, g es la aceleracón de la gravedad, R es la constante de los gases y T es la temperatura absoluta. Consdere una atmósfera que tene la composcon xn = y xco = y que T = 300 K. Cerca del nvel del mar, la presón total es.00 bar. Calcule las fraccones molares de los dos componentes a la altura de 50.0 km. Por qué es dferente la composcón de su valor a nvel del mar? P.6 Suponga que el are tene una masa molar meda de 8.9 g mol y que la atmósfera tene una temperatura de 5.0 C. Calcule la presón barométrca en Denver, donde z = 600 m. Use la nformacón del Problema P.5. P.7 Calcule la presón ejercda por Ar para un volumen molar de.4 L a 300 K usando la ecuacón de estado de van der Waals. Los parámetros de van der Waals a y b, para el Ar son.355 bar dm 6 mol y dm 3 mol, respectvamente. En esas condcones es domnante la porcón del potencal atractva o la repulsva? P.8 Calcule la presón ejercda por el benceno para un volumen molar de.4 L a 790 K usando la ecuacón de estado de Redlch-Kwong: RT a nrt na P = V b = TV( V + b) V nb TVV ( + nb) m m m Los parámetros Redlch-Kwong a y b para el benceno son 45.0 bar dm 6 mol - K / y dm 3 mol -, respectvamente. En esas condcones es domnante la porcón del potencal atractva o la repulsva? P.9 Idee una escala de temperatura, abrevadamente G, para la que la constante del gas deal sea.00 J G - mol -. P.0 Una mezcla de oxígeno e hdrógeno se analza pasándola sobre óxdo de cobre calente y a través de un tubo de secado. El hdrógeno reduce el CuO, de acuerdo con la reaccón CuO + H Cu + H O, y el oxígeno vuelve a oxdar al cobre formado de acuerdo con Cu + / O CuO. A 5 C y 750 Torr, 00.0 cm 3 de la mezcla rnden 84.5 cm 3 de oxígeno seco, meddo a 5 C y 750 Torr después de pasar sobre CuO y el desecador. Cuál es la composcón orgnal de la mezcla?
Unidad I. 1. 1. Definición de reacción de combustión. 1. 2. Clasificación de combustibles
 2 Undad I.. Defncón de reaccón de combustón La reaccón de combustón se basa en la reaccón químca exotérmca de una sustanca (o una mezcla de ellas) denomnada combustble, con el oxígeno. Como consecuenca
2 Undad I.. Defncón de reaccón de combustón La reaccón de combustón se basa en la reaccón químca exotérmca de una sustanca (o una mezcla de ellas) denomnada combustble, con el oxígeno. Como consecuenca
16/07/2012 P= F A. Pascals. Bar
 El Estado Gaseoso El Estado Gaseoso Undad I Característcas de los Gases Las moléculas ndvduales se encuentran relatvamente separadas. Se expanden para llenar sus recpentes. Son altamente compresbles. enen
El Estado Gaseoso El Estado Gaseoso Undad I Característcas de los Gases Las moléculas ndvduales se encuentran relatvamente separadas. Se expanden para llenar sus recpentes. Son altamente compresbles. enen
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Undad III: ermodnámca del Equlbro Fugacdad Fugacdad para gases, líqudos y sóldos Datos volumétrcos 9/7/ Rafael Gamero Fugacdad ropedades con varables ndependentes y ln f ' Con la dfncón
ERMODINÁMICA AANZADA Undad III: ermodnámca del Equlbro Fugacdad Fugacdad para gases, líqudos y sóldos Datos volumétrcos 9/7/ Rafael Gamero Fugacdad ropedades con varables ndependentes y ln f ' Con la dfncón
Capitalización y descuento simple
 Undad 2 Captalzacón y descuento smple 2.1. Captalzacón smple o nterés smple 2.1.1. Magntudes dervadas 2.2. Intereses antcpados 2.3. Cálculo de los ntereses smples. Métodos abrevados 2.3.1. Método de los
Undad 2 Captalzacón y descuento smple 2.1. Captalzacón smple o nterés smple 2.1.1. Magntudes dervadas 2.2. Intereses antcpados 2.3. Cálculo de los ntereses smples. Métodos abrevados 2.3.1. Método de los
EQUILIBRIO LÍQUIDO VAPOR EN UN SISTEMA NO IDEAL
 EQUILIBRIO LÍQUIDO VAPOR EN UN SISTEMA NO IDEAL OBJETIVO El alumno obtendrá el punto azeotrópco para el sstema acetona-cloroformo, calculará los coefcentes de actvdad de cada componente a las composcones
EQUILIBRIO LÍQUIDO VAPOR EN UN SISTEMA NO IDEAL OBJETIVO El alumno obtendrá el punto azeotrópco para el sstema acetona-cloroformo, calculará los coefcentes de actvdad de cada componente a las composcones
DEFINICIÓN DE INDICADORES
 DEFINICIÓN DE INDICADORES ÍNDICE 1. Notacón básca... 3 2. Indcadores de ntegracón: comerco total de benes... 4 2.1. Grado de apertura... 4 2.2. Grado de conexón... 4 2.3. Grado de conexón total... 5 2.4.
DEFINICIÓN DE INDICADORES ÍNDICE 1. Notacón básca... 3 2. Indcadores de ntegracón: comerco total de benes... 4 2.1. Grado de apertura... 4 2.2. Grado de conexón... 4 2.3. Grado de conexón total... 5 2.4.
Histogramas: Es un diagrama de barras pero los datos son siempre cuantitativos agrupados en clases o intervalos.
 ESTADÍSTICA I. Recuerda: Poblacón: Es el conjunto de todos los elementos que cumplen una determnada propedad, que llamamos carácter estadístco. Los elementos de la poblacón se llaman ndvduos. Muestra:
ESTADÍSTICA I. Recuerda: Poblacón: Es el conjunto de todos los elementos que cumplen una determnada propedad, que llamamos carácter estadístco. Los elementos de la poblacón se llaman ndvduos. Muestra:
EXPERIMENTACIÓN COMERCIAL(I)
 EXPERIMENTACIÓN COMERCIAL(I) En un expermento comercal el nvestgador modfca algún factor (denomnado varable explcatva o ndependente) para observar el efecto de esta modfcacón sobre otro factor (denomnado
EXPERIMENTACIÓN COMERCIAL(I) En un expermento comercal el nvestgador modfca algún factor (denomnado varable explcatva o ndependente) para observar el efecto de esta modfcacón sobre otro factor (denomnado
Si consideramos un sistema PVT con N especies químicas π fases en equilibrio se caracteriza por: P v =P L = =P π
 EQUILIBRIO DE FASES Reglas de las fases. Teorema de Duhem S consderamos un sstema PVT con N especes químcas π fases en equlbro se caracterza por: P, T y (N-1) fraccones mol tal que Σx=1 para cada fase.
EQUILIBRIO DE FASES Reglas de las fases. Teorema de Duhem S consderamos un sstema PVT con N especes químcas π fases en equlbro se caracterza por: P, T y (N-1) fraccones mol tal que Σx=1 para cada fase.
TERMODINÁMICA AVANZADA
 TERMODINÁMICA AVANZADA Undad III: Termodnámca del Equlbro Ecuacones para el coefcente de actvdad Funcones de eceso para mezclas multcomponentes 9/7/0 Rafael Gamero Funcones de eceso en mezclas bnaras Epansón
TERMODINÁMICA AVANZADA Undad III: Termodnámca del Equlbro Ecuacones para el coefcente de actvdad Funcones de eceso para mezclas multcomponentes 9/7/0 Rafael Gamero Funcones de eceso en mezclas bnaras Epansón
Tema 3. Estadísticos univariados: tendencia central, variabilidad, asimetría y curtosis
 Tema. Estadístcos unvarados: tendenca central, varabldad, asmetría y curtoss 1. MEDIDA DE TEDECIA CETRAL La meda artmétca La medana La moda Comparacón entre las meddas de tendenca central. MEDIDA DE VARIACIÓ
Tema. Estadístcos unvarados: tendenca central, varabldad, asmetría y curtoss 1. MEDIDA DE TEDECIA CETRAL La meda artmétca La medana La moda Comparacón entre las meddas de tendenca central. MEDIDA DE VARIACIÓ
Calorimetría - Soluciones. 1.- Cuántas calorías ceden 5 kg de cobre (c = 0,094 cal/g C) al enfriarse desde 36 o C hasta -4 C?
 Calormetría - Solucones 1.- Cuántas calorías ceden 5 kg de cobre () al enfrarse desde 3 o C hasta -4 C? m = 5 kg = 5.000 g T = 3 C T f = - 4 C = - T = - (T f T ) = - 5.000 g 0,094 cal/g C (-4 C 3 C) =
Calormetría - Solucones 1.- Cuántas calorías ceden 5 kg de cobre () al enfrarse desde 3 o C hasta -4 C? m = 5 kg = 5.000 g T = 3 C T f = - 4 C = - T = - (T f T ) = - 5.000 g 0,094 cal/g C (-4 C 3 C) =
INSTITUTO POLITÉCNICO NACIONAL ESCUELA NACIONAL DE CIENCIAS BIOLÓGICAS INGENIERÍA EN SISTEMAS AMBIENTALES
 ESCUELA NACONAL DE CENCAS BOLÓGCAS NGENERÍA EN SSTEMAS AMBENTALES HORAS DE TEORÍA 5 ASGNATURA TERMODNÁMCA BÁSCA HORAS DE PRÁCTCA 4 SEMESTRE 3 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ CORRECTAMENTE LA
ESCUELA NACONAL DE CENCAS BOLÓGCAS NGENERÍA EN SSTEMAS AMBENTALES HORAS DE TEORÍA 5 ASGNATURA TERMODNÁMCA BÁSCA HORAS DE PRÁCTCA 4 SEMESTRE 3 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ CORRECTAMENTE LA
Fugacidad. Mezcla de gases ideales
 Termodnámca del equlbro Fugacdad. Mezcla de gases deales rofesor: Alí Gabrel Lara 1. Fugacdad 1.1. Fugacdad para gases Antes de abarcar el caso de mezclas de gases, debemos conocer como podemos relaconar
Termodnámca del equlbro Fugacdad. Mezcla de gases deales rofesor: Alí Gabrel Lara 1. Fugacdad 1.1. Fugacdad para gases Antes de abarcar el caso de mezclas de gases, debemos conocer como podemos relaconar
De factores fijos. Mixto. Con interacción Sin interacción. No equilibrado. Jerarquizado
 Análss de la varanza con dos factores. Introduccón Hasta ahora se ha vsto el modelo de análss de la varanza con un factor que es una varable cualtatva cuyas categorías srven para clasfcar las meddas de
Análss de la varanza con dos factores. Introduccón Hasta ahora se ha vsto el modelo de análss de la varanza con un factor que es una varable cualtatva cuyas categorías srven para clasfcar las meddas de
Smoothed Particle Hydrodynamics Animación Avanzada
 Smoothed Partcle Hydrodynamcs Anmacón Avanzada Iván Alduán Íñguez 03 de Abrl de 2014 Índce Métodos sn malla Smoothed partcle hydrodynamcs Aplcacón del método en fludos Búsqueda de vecnos Métodos sn malla
Smoothed Partcle Hydrodynamcs Anmacón Avanzada Iván Alduán Íñguez 03 de Abrl de 2014 Índce Métodos sn malla Smoothed partcle hydrodynamcs Aplcacón del método en fludos Búsqueda de vecnos Métodos sn malla
TERMÓMETROS Y ESCALAS DE TEMPERATURA
 Ayudantía Académca de Físca B EMPERAURA El concepto de temperatura se basa en las deas cualtatvas de calente (temperatura alta) y río (temperatura baja) basados en el sentdo del tacto. Contacto térmco.-
Ayudantía Académca de Físca B EMPERAURA El concepto de temperatura se basa en las deas cualtatvas de calente (temperatura alta) y río (temperatura baja) basados en el sentdo del tacto. Contacto térmco.-
Equilibrio termodinámico entre fases fluidas
 CAPÍTULO I Equlbro termodnámco entre fases fludas El conocmento frme de los conceptos de la termodnámca se consdera esencal para el dseño, operacón y optmzacón de proyectos en la ngenería químca, debdo
CAPÍTULO I Equlbro termodnámco entre fases fludas El conocmento frme de los conceptos de la termodnámca se consdera esencal para el dseño, operacón y optmzacón de proyectos en la ngenería químca, debdo
Trabajo y Energía Cinética
 Trabajo y Energía Cnétca Objetvo General Estudar el teorema de la varacón de la energía. Objetvos Partculares 1. Determnar el trabajo realzado por una fuerza constante sobre un objeto en movmento rectlíneo..
Trabajo y Energía Cnétca Objetvo General Estudar el teorema de la varacón de la energía. Objetvos Partculares 1. Determnar el trabajo realzado por una fuerza constante sobre un objeto en movmento rectlíneo..
INSTITUTO POLITÉCNICO NACIONAL ESCUELA NACIONAL DE CIENCIAS BIOLÓGICAS INGENIERÍA EN SISTEMAS AMBIENTALES
 NSTTUTO POLTÉCNCO NACONAL ESCUELA NACONAL DE CENCAS BOLÓGCAS NGENERÍA EN SSS AMBENTALES HORAS DE TEORÍA 5 ASGNATURA TERMODNÁMCA BÁSCA HORAS DE PRÁCTCA 4 SEMESTRE 3 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ
NSTTUTO POLTÉCNCO NACONAL ESCUELA NACONAL DE CENCAS BOLÓGCAS NGENERÍA EN SSS AMBENTALES HORAS DE TEORÍA 5 ASGNATURA TERMODNÁMCA BÁSCA HORAS DE PRÁCTCA 4 SEMESTRE 3 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ
Relaciones entre variables
 Relacones entre varables Las técncas de regresón permten hacer predccones sobre los valores de certa varable Y (dependente), a partr de los de otra (ndependente), entre las que se ntuye que exste una relacón.
Relacones entre varables Las técncas de regresón permten hacer predccones sobre los valores de certa varable Y (dependente), a partr de los de otra (ndependente), entre las que se ntuye que exste una relacón.
Guía de ejercicios #1
 Unversdad Técnca Federco Santa María Departamento de Electrónca Fundamentos de Electrónca Guía de ejerccos # Ejercco Ω v (t) V 3V Ω v0 v 6 3 t[mseg] 6 Suponendo el modelo deal para los dodos, a) Dbuje
Unversdad Técnca Federco Santa María Departamento de Electrónca Fundamentos de Electrónca Guía de ejerccos # Ejercco Ω v (t) V 3V Ω v0 v 6 3 t[mseg] 6 Suponendo el modelo deal para los dodos, a) Dbuje
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA. Ingeniería Química
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA Ingenería Químca Undad I. Introduccón a los cálculos de Ingenería Químca
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA Ingenería Químca Undad I. Introduccón a los cálculos de Ingenería Químca
PROCESOS DE SEPARACION UTILIZANDO EQUIPOS DE ETAPAS DE EQUILIBRIO
 PROCESOS DE SEPARACION UTILIZANDO EQUIPOS DE ETAPAS DE EQUILIBRIO Concepto de equlbro físco Sstema Fase Componente Solubldad Transferenca Equlbro Composcón 2 Varables de mportanca en el equlbro de fases:
PROCESOS DE SEPARACION UTILIZANDO EQUIPOS DE ETAPAS DE EQUILIBRIO Concepto de equlbro físco Sstema Fase Componente Solubldad Transferenca Equlbro Composcón 2 Varables de mportanca en el equlbro de fases:
12-16 de Noviembre de 2012. Francisco Javier Burgos Fernández
 MEMORIA DE LA ESTANCIA CON EL GRUPO DE VISIÓN Y COLOR DEL INSTITUTO UNIVERSITARIO DE FÍSICA APLICADA A LAS CIENCIAS TECNOLÓGICAS. UNIVERSIDAD DE ALICANTE. 1-16 de Novembre de 01 Francsco Javer Burgos Fernández
MEMORIA DE LA ESTANCIA CON EL GRUPO DE VISIÓN Y COLOR DEL INSTITUTO UNIVERSITARIO DE FÍSICA APLICADA A LAS CIENCIAS TECNOLÓGICAS. UNIVERSIDAD DE ALICANTE. 1-16 de Novembre de 01 Francsco Javer Burgos Fernández
Tema 1: Estadística Descriptiva Unidimensional Unidad 2: Medidas de Posición, Dispersión y de Forma
 Estadístca Tema 1: Estadístca Descrptva Undmensonal Undad 2: Meddas de Poscón, Dspersón y de Forma Área de Estadístca e Investgacón Operatva Lceso J. Rodríguez-Aragón Septembre 2010 Contendos...............................................................
Estadístca Tema 1: Estadístca Descrptva Undmensonal Undad 2: Meddas de Poscón, Dspersón y de Forma Área de Estadístca e Investgacón Operatva Lceso J. Rodríguez-Aragón Septembre 2010 Contendos...............................................................
COMPARADOR CON AMPLIFICADOR OPERACIONAL
 COMAADO CON AMLIFICADO OEACIONAL COMAADO INESO, COMAADO NO INESO Tenen como msón comparar una tensón arable con otra, normalmente constante, denomnada tensón de referenca, dándonos a la salda una tensón
COMAADO CON AMLIFICADO OEACIONAL COMAADO INESO, COMAADO NO INESO Tenen como msón comparar una tensón arable con otra, normalmente constante, denomnada tensón de referenca, dándonos a la salda una tensón
DELTA MASTER FORMACIÓN UNIVERSITARIA C/ Gral. Ampudia, 16 Teléf.: 91 533 38 42-91 535 19 32 28003 MADRID
 DELTA MATE OMAÓN UNETAA / Gral. Ampuda, 6 8003 MADD EXÁMEN NTODUÓN A LA ELETÓNA UM JUNO 008 El examen consta de ses preguntas. Lea detendamente los enuncados. tene cualquer duda consulte al profesor. Todas
DELTA MATE OMAÓN UNETAA / Gral. Ampuda, 6 8003 MADD EXÁMEN NTODUÓN A LA ELETÓNA UM JUNO 008 El examen consta de ses preguntas. Lea detendamente los enuncados. tene cualquer duda consulte al profesor. Todas
CÁLCULO DE INCERTIDUMBRE EN MEDIDAS FÍSICAS: MEDIDA DE UNA MASA
 CÁLCULO DE INCERTIDUMBRE EN MEDIDAS FÍSICAS: MEDIDA DE UNA MASA Alca Maroto, Rcard Boqué, Jord Ru, F. Xaver Rus Departamento de Químca Analítca y Químca Orgánca Unverstat Rovra Vrgl. Pl. Imperal Tàrraco,
CÁLCULO DE INCERTIDUMBRE EN MEDIDAS FÍSICAS: MEDIDA DE UNA MASA Alca Maroto, Rcard Boqué, Jord Ru, F. Xaver Rus Departamento de Químca Analítca y Químca Orgánca Unverstat Rovra Vrgl. Pl. Imperal Tàrraco,
Fisicoquímica CIBEX Guía de Trabajos Prácticos 2010. Trabajo Práctico N 7. - Medida de la Fuerza Electromotriz por el Método de Oposición-
 Fscoquímca CIBX Guía de Trabajos Práctcos 2010 Trabajo Práctco N 7 - Medda de la Fuerza lectromotrz por el Método de Oposcón- Objetvo: Medr la fuerza electromotrz (FM) de la pla medante el método de oposcón
Fscoquímca CIBX Guía de Trabajos Práctcos 2010 Trabajo Práctco N 7 - Medda de la Fuerza lectromotrz por el Método de Oposcón- Objetvo: Medr la fuerza electromotrz (FM) de la pla medante el método de oposcón
Análisis de Regresión y Correlación
 1 Análss de Regresón y Correlacón El análss de regresón consste en emplear métodos que permtan determnar la mejor relacón funconal entre dos o más varables concomtantes (o relaconadas). El análss de correlacón
1 Análss de Regresón y Correlacón El análss de regresón consste en emplear métodos que permtan determnar la mejor relacón funconal entre dos o más varables concomtantes (o relaconadas). El análss de correlacón
Introducción a Vacío
 Introduccón a Vacío Sstema de vacío Partes generales de un sstema de vacío: Fgura 1: Sstema de vacío con bomba mecánca y dfusora Fgura 2: Prncpo de funconamento de la bomba mecánca La Fg. 2 muestra el
Introduccón a Vacío Sstema de vacío Partes generales de un sstema de vacío: Fgura 1: Sstema de vacío con bomba mecánca y dfusora Fgura 2: Prncpo de funconamento de la bomba mecánca La Fg. 2 muestra el
Pruebas Estadísticas de Números Pseudoaleatorios
 Pruebas Estadístcas de Números Pseudoaleatoros Prueba de meda Consste en verfcar que los números generados tengan una meda estadístcamente gual a, de esta manera, se analza la sguente hpótess: H 0 : =
Pruebas Estadístcas de Números Pseudoaleatoros Prueba de meda Consste en verfcar que los números generados tengan una meda estadístcamente gual a, de esta manera, se analza la sguente hpótess: H 0 : =
TERMODINÁMICA DEL EQUILIBRIO CAPÍTULO V. EQUILIBRIO DE REACCIÓN QUÍMICA
 Ing. Federco G. Salazar Termodnámca del Equlbro TERMODINÁMICA DEL EQUILIBRIO CAPÍTULO V. EQUILIBRIO DE REACCIÓN QUÍMICA Contendo 1. Conversón y Coordenada de Reaccón. 2. Ecuacones Independentes y Regla
Ing. Federco G. Salazar Termodnámca del Equlbro TERMODINÁMICA DEL EQUILIBRIO CAPÍTULO V. EQUILIBRIO DE REACCIÓN QUÍMICA Contendo 1. Conversón y Coordenada de Reaccón. 2. Ecuacones Independentes y Regla
v i CIRCUITOS ELÉCTRICOS (apuntes para el curso de Electrónica)
 IUITOS EÉTIOS (apuntes para el curso de Electrónca) os crcutos eléctrcos están compuestos por: fuentes de energía: generadores de tensón y generadores de corrente y elementos pasos: resstores, nductores
IUITOS EÉTIOS (apuntes para el curso de Electrónca) os crcutos eléctrcos están compuestos por: fuentes de energía: generadores de tensón y generadores de corrente y elementos pasos: resstores, nductores
Clase 25. Macroeconomía, Sexta Parte
 Introduccón a la Facultad de Cs. Físcas y Matemátcas - Unversdad de Chle Clase 25. Macroeconomía, Sexta Parte 12 de Juno, 2008 Garca Se recomenda complementar la clase con una lectura cudadosa de los capítulos
Introduccón a la Facultad de Cs. Físcas y Matemátcas - Unversdad de Chle Clase 25. Macroeconomía, Sexta Parte 12 de Juno, 2008 Garca Se recomenda complementar la clase con una lectura cudadosa de los capítulos
TEMA 4 Variables aleatorias discretas Esperanza y varianza
 Métodos Estadístcos para la Ingenería Curso007/08 Felpe Ramírez Ingenería Técnca Químca Industral TEMA 4 Varables aleatoras dscretas Esperanza y varanza La Probabldad es la verdadera guía de la vda. Ccerón
Métodos Estadístcos para la Ingenería Curso007/08 Felpe Ramírez Ingenería Técnca Químca Industral TEMA 4 Varables aleatoras dscretas Esperanza y varanza La Probabldad es la verdadera guía de la vda. Ccerón
www.fisicaeingenieria.es
 2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA. 2.1.- Experencas de Joule. Las experencas de Joule, conssteron en colocar una determnada cantdad de agua en un calorímetro y realzar un trabajo, medante paletas
2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA. 2.1.- Experencas de Joule. Las experencas de Joule, conssteron en colocar una determnada cantdad de agua en un calorímetro y realzar un trabajo, medante paletas
Balances de Energía. Balance general de energía. Acumulación Entrada Salida Adición neta Producción
 Balances de Energía Los balances macroscópcos de energía se pueden deducr a partr del prmer prncpo de la termodnámca. Éste, en dstntas formas de presentacón se puede defnr como: a) dq dw 0 c c O sea que
Balances de Energía Los balances macroscópcos de energía se pueden deducr a partr del prmer prncpo de la termodnámca. Éste, en dstntas formas de presentacón se puede defnr como: a) dq dw 0 c c O sea que
Matemática Financiera Sistemas de Amortización de Deudas
 Matemátca Fnancera Sstemas de Amortzacón de Deudas 7 Qué aprendemos Sstema Francés: Descomposcón de la cuota. Amortzacones acumuladas. Cálculo del saldo. Evolucón. Representacón gráfca. Expresones recursvas
Matemátca Fnancera Sstemas de Amortzacón de Deudas 7 Qué aprendemos Sstema Francés: Descomposcón de la cuota. Amortzacones acumuladas. Cálculo del saldo. Evolucón. Representacón gráfca. Expresones recursvas
1.SISTEMA AIRE AGUA: PSICOMETRÍA 2. TERMODINÁMICA DE LAS REACCIONES QUÍMICAS. 3. COMBUSTIÓN 4. ANÁLISIS EXERGÉTICO. TEMA 7: Psicometría y combustión
 TEMA 7: Pscometría y combustón 1.SISTEMA AIRE AGUA: PSICOMETRÍA Humedad específca y relatva del are. Temperatura de punto de rocío, de saturacón adabátca y de bulbo húmedo. Dagrama pscrométrco.. TERMODINÁMICA
TEMA 7: Pscometría y combustón 1.SISTEMA AIRE AGUA: PSICOMETRÍA Humedad específca y relatva del are. Temperatura de punto de rocío, de saturacón adabátca y de bulbo húmedo. Dagrama pscrométrco.. TERMODINÁMICA
Unidad II: Análisis de la combustión completa e incompleta. 2. 1. Aire
 4 Undad II: Análss de la combustón completa e ncompleta. 1. Are El are que se usa en las reaccones de combustón es el are atmosférco. Ya se djo en la Undad I que, debdo a que n el N n los gases nertes
4 Undad II: Análss de la combustón completa e ncompleta. 1. Are El are que se usa en las reaccones de combustón es el are atmosférco. Ya se djo en la Undad I que, debdo a que n el N n los gases nertes
LOS GASES Y SUS LEYES DE
 EMA : LOS GASES Y SUS LEYES DE COMBINACIÓN -LAS LEYES DE LOS GASES En el siglo XII comenzó a investigarse el hecho de que los gases, independientemente de su naturaleza, presentan un comportamiento similar
EMA : LOS GASES Y SUS LEYES DE COMBINACIÓN -LAS LEYES DE LOS GASES En el siglo XII comenzó a investigarse el hecho de que los gases, independientemente de su naturaleza, presentan un comportamiento similar
Electricidad y calor
 Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
Electricidad y calor. Un repaso... Temas. 4. Primera ley de la Termodinámica. Webpage: Algunas definiciones
 Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
CONCEPTOS GENERALES DEL CAMPO MAGNÉTICO
 CONCEPTOS GENERALES DEL CAMPO MAGNÉTICO 1 ÍNDICE 1. INTRODUCCIÓN 2. EL CAMPO MAGNÉTICO 3. PRODUCCIÓN DE UN CAMPO MAGNÉTICO 4. LEY DE FARADAY 5. PRODUCCIÓN DE UNA FUERZA EN UN CONDUCTOR 6. MOVIMIENTO DE
CONCEPTOS GENERALES DEL CAMPO MAGNÉTICO 1 ÍNDICE 1. INTRODUCCIÓN 2. EL CAMPO MAGNÉTICO 3. PRODUCCIÓN DE UN CAMPO MAGNÉTICO 4. LEY DE FARADAY 5. PRODUCCIÓN DE UNA FUERZA EN UN CONDUCTOR 6. MOVIMIENTO DE
ACTIVIDADES INICIALES
 Soluconaro 7 Números complejos ACTIVIDADES INICIALES 7.I. Clasfca los sguentes números, dcendo a cuál de los conjuntos numércos pertenece (entendendo como tal el menor conjunto). a) 0 b) 6 c) d) e) 0 f)
Soluconaro 7 Números complejos ACTIVIDADES INICIALES 7.I. Clasfca los sguentes números, dcendo a cuál de los conjuntos numércos pertenece (entendendo como tal el menor conjunto). a) 0 b) 6 c) d) e) 0 f)
Consecuencias del Primer Principio 22 de noviembre de 2010
 Índce 5 CELINA GONZÁLEZ ÁNGEL JIMÉNEZ IGNACIO LÓEZ RAFAEL NIETO Consecuencas del rmer rncpo 22 de novembre de 2010 1. Ecuacón calórca del gas deal 1 Cuestones y problemas: C 2.4,10,11,12,16,19 1.1,3 subrayados
Índce 5 CELINA GONZÁLEZ ÁNGEL JIMÉNEZ IGNACIO LÓEZ RAFAEL NIETO Consecuencas del rmer rncpo 22 de novembre de 2010 1. Ecuacón calórca del gas deal 1 Cuestones y problemas: C 2.4,10,11,12,16,19 1.1,3 subrayados
1. GENERALIDADES DEL ÁLGEBRA GEOMÉTRICA. Definición del álgebra geométrica del espacio-tiempo
 EL ÁLGEBRA GEOMÉTRICA DEL ESPACIO Y TIEMPO. GENERALIDADES DEL ÁLGEBRA GEOMÉTRICA Defncón del álgebra geométrca del espaco-tempo Defno el álgebra geométrca del espaco y tempo como el álgebra de las matrces
EL ÁLGEBRA GEOMÉTRICA DEL ESPACIO Y TIEMPO. GENERALIDADES DEL ÁLGEBRA GEOMÉTRICA Defncón del álgebra geométrca del espaco-tempo Defno el álgebra geométrca del espaco y tempo como el álgebra de las matrces
PROBLEMAS DE ELECTRÓNICA ANALÓGICA (Diodos)
 PROBLEMAS DE ELECTRÓNCA ANALÓGCA (Dodos) Escuela Poltécnca Superor Profesor. Darío García Rodríguez . En el crcuto de la fgura los dodos son deales, calcular la ntensdad que crcula por la fuente V en funcón
PROBLEMAS DE ELECTRÓNCA ANALÓGCA (Dodos) Escuela Poltécnca Superor Profesor. Darío García Rodríguez . En el crcuto de la fgura los dodos son deales, calcular la ntensdad que crcula por la fuente V en funcón
GUIAS DE ACTIVIDADES Y TRABAJO PRACTICO Nº 22
 DOCENTE: LIC.GUSTO DOLFO JUEZ GUI DE TJO PCTICO Nº 22 CES: POFESODO Y LICENCITU EN IOLOGI PGIN Nº 132 GUIS DE CTIIDDES Y TJO PCTICO Nº 22 OJETIOS: Lograr que el lumno: Interprete la nformacón de un vector.
DOCENTE: LIC.GUSTO DOLFO JUEZ GUI DE TJO PCTICO Nº 22 CES: POFESODO Y LICENCITU EN IOLOGI PGIN Nº 132 GUIS DE CTIIDDES Y TJO PCTICO Nº 22 OJETIOS: Lograr que el lumno: Interprete la nformacón de un vector.
FISICOQUÍMICA FARMACÉUTICA (0108) UNIDAD 1. CONCEPTOS BÁSICOS DE CINÉTICA QUÍMICA
 FISICOQUÍMICA FARMACÉUTICA (008) UNIDAD. CONCEPTOS BÁSICOS DE CINÉTICA QUÍMICA Mtra. Josefna Vades Trejo 06 de agosto de 0 Revsón de térmnos Cnétca Químca Estuda la rapdez de reaccón, los factores que
FISICOQUÍMICA FARMACÉUTICA (008) UNIDAD. CONCEPTOS BÁSICOS DE CINÉTICA QUÍMICA Mtra. Josefna Vades Trejo 06 de agosto de 0 Revsón de térmnos Cnétca Químca Estuda la rapdez de reaccón, los factores que
POTENCIAL QUÍMICO ACTIVIDAD Y FACTOR DE ACTIVIDAD GRADOS DE LIBERTAD DE UN SISTEMA REGLA DE LAS FASES PROPIEDADES COLIGATIVAS
 FISICOQUÍMICA SEMINARIO N 2: EQUILIBRIO POTENCIAL QUÍMICO ACTIVIDAD Y FACTOR DE ACTIVIDAD GRADOS DE LIBERTAD DE UN SISTEMA REGLA DE LAS FASES PROPIEDADES COLIGATIVAS FORMULAS BASICAS dg dn 0, en el equlbro
FISICOQUÍMICA SEMINARIO N 2: EQUILIBRIO POTENCIAL QUÍMICO ACTIVIDAD Y FACTOR DE ACTIVIDAD GRADOS DE LIBERTAD DE UN SISTEMA REGLA DE LAS FASES PROPIEDADES COLIGATIVAS FORMULAS BASICAS dg dn 0, en el equlbro
Econometría. Ayudantía # 01, Conceptos Generales, Modelo de Regresión. Profesor: Carlos R. Pitta 1
 Escuela de Ingenería Comercal Ayudantía # 01, Conceptos Generales, Modelo de Regresón Profesor: Carlos R. Ptta 1 1 cptta@spm.uach.cl Escuela de Ingenería Comercal Ayudantía 01 Parte 01: Comentes Señale
Escuela de Ingenería Comercal Ayudantía # 01, Conceptos Generales, Modelo de Regresón Profesor: Carlos R. Ptta 1 1 cptta@spm.uach.cl Escuela de Ingenería Comercal Ayudantía 01 Parte 01: Comentes Señale
Departamento de Física Laboratorio de Termodinámica MOTOR TÉRMICO
 Departamento de Físca Laboratoro de Termodnámca Grupo de práctcas Fecha de sesón Alumnos que realzaron la práctca Sello de control Fecha de entrega MOTOR TÉRMICO Nota: Inclur undades y errores en todas
Departamento de Físca Laboratoro de Termodnámca Grupo de práctcas Fecha de sesón Alumnos que realzaron la práctca Sello de control Fecha de entrega MOTOR TÉRMICO Nota: Inclur undades y errores en todas
PRÁCTICA 1. IDENTIFICACIÓN Y MANEJO DE MATERIAL DE LABORATORIO: PREPARACIÓN DE DISOLUCIONES Y MEDIDA DE DENSIDADES
 PRÁCTICA 1. IDENTIFICACIÓN Y MANEJO DE MATERIAL DE LABORATORIO: PREPARACIÓN DE DISOLUCIONES Y MEDIDA DE DENSIDADES OBJETIVOS ESPECÍFICOS 1) Identfcar y manejar el materal básco de laboratoro. ) Preparar
PRÁCTICA 1. IDENTIFICACIÓN Y MANEJO DE MATERIAL DE LABORATORIO: PREPARACIÓN DE DISOLUCIONES Y MEDIDA DE DENSIDADES OBJETIVOS ESPECÍFICOS 1) Identfcar y manejar el materal básco de laboratoro. ) Preparar
CÁLCULO VECTORIAL 1.- MAGNITUDES ESCALARES Y VECTORIALES. 2.- VECTORES. pág. 1
 CÁLCL ECTRIAL 1. Magntudes escalares y vectorales.. ectores. Componentes vectorales. ectores untaros. Componentes escalares. Módulo de un vector. Cosenos drectores. 3. peracones con vectores. 3.1. Suma.
CÁLCL ECTRIAL 1. Magntudes escalares y vectorales.. ectores. Componentes vectorales. ectores untaros. Componentes escalares. Módulo de un vector. Cosenos drectores. 3. peracones con vectores. 3.1. Suma.
Fundamentos de Física Estadística: Problema básico, Postulados
 Fundamentos de Físca Estadístca: Problema básco, Postulados y Formalsmos. Problema básco de la Mecánca Estadístca del Equlbro (MEE) El problema básco de la MEE es la determnacón de la relacón termodnámca
Fundamentos de Físca Estadístca: Problema básco, Postulados y Formalsmos. Problema básco de la Mecánca Estadístca del Equlbro (MEE) El problema básco de la MEE es la determnacón de la relacón termodnámca
Física I. TRABAJO y ENERGÍA MECÁNICA. Apuntes complementarios al libro de texto. Autor : Dr. Jorge O. Ratto
 ísca I Apuntes complementaros al lbro de teto TRABAJO y ENERGÍA MECÁNICA Autor : Dr. Jorge O. Ratto Estudaremos el trabajo mecánco de la sguente manera : undmensonal constante Tpo de movmento varable bdmensonal
ísca I Apuntes complementaros al lbro de teto TRABAJO y ENERGÍA MECÁNICA Autor : Dr. Jorge O. Ratto Estudaremos el trabajo mecánco de la sguente manera : undmensonal constante Tpo de movmento varable bdmensonal
DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE INTEGRACION III
 DEPRTMENTO DE INGENIERI QUIMIC Undad 2: Presón de vapor CTEDR DE INTEGRCION III Problema Nº 1: a) Tomando los datos necesaros de una tabla físca, representar una curva que relacone la presón de vapor del
DEPRTMENTO DE INGENIERI QUIMIC Undad 2: Presón de vapor CTEDR DE INTEGRCION III Problema Nº 1: a) Tomando los datos necesaros de una tabla físca, representar una curva que relacone la presón de vapor del
LEY DE BOYLE: A temperatura constante, el volumen (V) que ocupa una masa definida de gas es inversamente proporcional a la presión aplicada (P).
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
FENÓMENOS DE TRASPORTE EN METALURGIA EXTRACTIVA Clase 01/05 Transporte de Masa
 FENÓMENOS DE TRSPORTE EN METLURGI EXTRCTIV Clase 01/05 Transporte de Masa Prof. Leandro Vosn, MSc., Dr. cadémco Unversdad de Chle. Jefe del Laboratoro de Prometalurga. Investgador Senor - Tohoku Unversty,
FENÓMENOS DE TRSPORTE EN METLURGI EXTRCTIV Clase 01/05 Transporte de Masa Prof. Leandro Vosn, MSc., Dr. cadémco Unversdad de Chle. Jefe del Laboratoro de Prometalurga. Investgador Senor - Tohoku Unversty,
APLICACIÓN DEL MATHCAD EN EL EQUILIBRIO DE FASES Marco Antonio Núñez Esquer Departamento de Ingeniería Química y Metalurgia, Universidad de Sonora
 APCACÓN DE MATHCAD EN E EQUBRO DE FASES Marco Antono Núñez Esquer Departamento de ngenería Químca y Metalurga, Unversdad de Sonora Nvel Superor Resumen El Equlbro de Fases es fundamental en la práctca
APCACÓN DE MATHCAD EN E EQUBRO DE FASES Marco Antono Núñez Esquer Departamento de ngenería Químca y Metalurga, Unversdad de Sonora Nvel Superor Resumen El Equlbro de Fases es fundamental en la práctca
IES Menéndez Tolosa (La Línea) Física y Química - 1º Bach - Gráficas
 IES Menéndez Tolosa (La Línea) Físca y Químca - 1º Bach - Gráfcas 1 Indca qué tpo de relacón exste entre las magntudes representadas en la sguente gráfca: La gráfca es una línea recta que no pasa por el
IES Menéndez Tolosa (La Línea) Físca y Químca - 1º Bach - Gráfcas 1 Indca qué tpo de relacón exste entre las magntudes representadas en la sguente gráfca: La gráfca es una línea recta que no pasa por el
Disoluciones. Disolución ideal. Disolución ideal. Disolución ideal. Disolución ideal
 Dsolucones TEM. Dsolucones reales. otencal químco en dsolucones reales. Concepto de actvdad. Una dsolucón es una mezcla homogénea de un componente llamado dsolvente () que se encuentra en mayor proporcón
Dsolucones TEM. Dsolucones reales. otencal químco en dsolucones reales. Concepto de actvdad. Una dsolucón es una mezcla homogénea de un componente llamado dsolvente () que se encuentra en mayor proporcón
PRIMER PRINCIPIO DE LA TERMODINÁMICA
 PRIMER PRINCIPIO DE LA ERMODINÁMICA ERMODINÁMICA estuda la transormacón de la energía de un sstema partcular, y como es el ntercambo de energía con el medo que lo rodea (medo ambente o unverso). Medo ambente
PRIMER PRINCIPIO DE LA ERMODINÁMICA ERMODINÁMICA estuda la transormacón de la energía de un sstema partcular, y como es el ntercambo de energía con el medo que lo rodea (medo ambente o unverso). Medo ambente
PROPORCIONAR RESERVA ROTANTE PARA EFECTUAR LA REGULACIÓN PRIMARIA DE FRECUENCIA ( RPF)
 ANEXO I EVALUACIÓN DE LA ENERGIA REGULANTE COMENSABLE (RRmj) OR ROORCIONAR RESERVA ROTANTE ARA EFECTUAR LA REGULACIÓN RIMARIA DE FRECUENCIA ( RF) REMISAS DE LA METODOLOGÍA Las pruebas dnámcas para la Regulacón
ANEXO I EVALUACIÓN DE LA ENERGIA REGULANTE COMENSABLE (RRmj) OR ROORCIONAR RESERVA ROTANTE ARA EFECTUAR LA REGULACIÓN RIMARIA DE FRECUENCIA ( RF) REMISAS DE LA METODOLOGÍA Las pruebas dnámcas para la Regulacón
Tema 3: Adaptadores de Señal
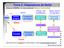 Tema 3: Adaptadores de Señal Sstema GENERAL de nstrumentacón (bloques( funconales): Señal sensor Fltrado, A/D Amplfcacón Rado, nternet bus de datos Medo Sensor prmaro Transductor de entrada Adaptacón de
Tema 3: Adaptadores de Señal Sstema GENERAL de nstrumentacón (bloques( funconales): Señal sensor Fltrado, A/D Amplfcacón Rado, nternet bus de datos Medo Sensor prmaro Transductor de entrada Adaptacón de
CAPÍTULO 4 MARCO TEÓRICO
 CAPÍTULO 4 MARCO TEÓRICO Cabe menconar que durante el proceso de medcón, la precsón y la exacttud de cualquer magntud físca está lmtada. Esta lmtacón se debe a que las medcones físcas sempre contenen errores.
CAPÍTULO 4 MARCO TEÓRICO Cabe menconar que durante el proceso de medcón, la precsón y la exacttud de cualquer magntud físca está lmtada. Esta lmtacón se debe a que las medcones físcas sempre contenen errores.
TEMA 10. OPERACIONES PASIVAS Y OPERACIONES ACTIVAS.
 GESTIÓN FINANCIERA. TEMA 10. OPERACIONES PASIVAS Y OPERACIONES ACTIVAS. 1.- Funconamento de las cuentas bancaras. FUNCIONAMIENTO DE LAS CUENTAS BANCARIAS. Las cuentas bancaras se dvden en tres partes:
GESTIÓN FINANCIERA. TEMA 10. OPERACIONES PASIVAS Y OPERACIONES ACTIVAS. 1.- Funconamento de las cuentas bancaras. FUNCIONAMIENTO DE LAS CUENTAS BANCARIAS. Las cuentas bancaras se dvden en tres partes:
Análisis de Resultados con Errores
 Análss de Resultados con Errores Exsten dos tpos de errores en los expermentos Errores sstemátcos errores aleatoros. Los errores sstemátcos son, desde lejos, los más mportantes. Errores Sstemátcos: Exsten
Análss de Resultados con Errores Exsten dos tpos de errores en los expermentos Errores sstemátcos errores aleatoros. Los errores sstemátcos son, desde lejos, los más mportantes. Errores Sstemátcos: Exsten
Qué es la EN81-28? Atrapado en el ascensor?
 Qué es la EN81-28? Atrapado en el ascensor? www.safelne.se La podemos ayudar! Hsselektronk desarrolla y produce electrónca para ascensores. Nuestra gama de productos consste prncpalmente en teléfonos de
Qué es la EN81-28? Atrapado en el ascensor? www.safelne.se La podemos ayudar! Hsselektronk desarrolla y produce electrónca para ascensores. Nuestra gama de productos consste prncpalmente en teléfonos de
Leyes de tensión y de corriente
 hay6611x_ch03.qxd 1/4/07 5:07 PM Page 35 CAPÍTULO 3 Leyes de tensón y de corrente CONCEPTOS CLAVE INTRODUCCIÓN En el capítulo 2 se presentaron la resstenca así como varos tpos de fuentes. Después de defnr
hay6611x_ch03.qxd 1/4/07 5:07 PM Page 35 CAPÍTULO 3 Leyes de tensón y de corrente CONCEPTOS CLAVE INTRODUCCIÓN En el capítulo 2 se presentaron la resstenca así como varos tpos de fuentes. Después de defnr
ELECTRICIDAD Y MAGNETISMO FIZ 1300 FIS 1532 (6a)
 ELECTRICIDAD Y MAGNETISMO FIZ 1300 FIS 1532 Rcardo Ramírez Facultad de Físca, Pontfca Unversdad Católca, Chle 1er. Semestre 2008 Corrente eléctrca CORRIENTE ELECTRICA Corrente eléctrca mplca carga en movmento.
ELECTRICIDAD Y MAGNETISMO FIZ 1300 FIS 1532 Rcardo Ramírez Facultad de Físca, Pontfca Unversdad Católca, Chle 1er. Semestre 2008 Corrente eléctrca CORRIENTE ELECTRICA Corrente eléctrca mplca carga en movmento.
Comparación entre distintos Criterios de decisión (VAN, TIR y PRI) Por: Pablo Lledó
 Comparacón entre dstntos Crteros de decsón (, TIR y PRI) Por: Pablo Lledó Master of Scence en Evaluacón de Proyectos (Unversty of York) Project Management Professonal (PMP certfed by the PMI) Profesor
Comparacón entre dstntos Crteros de decsón (, TIR y PRI) Por: Pablo Lledó Master of Scence en Evaluacón de Proyectos (Unversty of York) Project Management Professonal (PMP certfed by the PMI) Profesor
TÉCNICAS AUXILIARES DE LABORATORIO
 TÉCNICAS AUXILIARES DE LABORATORIO I.- ERRORES 1.- Introduccón Todas las meddas epermentales venen afectadas de una mprecsón nherente al proceso de medda. Puesto que en éste se trata, báscamente, de comparar
TÉCNICAS AUXILIARES DE LABORATORIO I.- ERRORES 1.- Introduccón Todas las meddas epermentales venen afectadas de una mprecsón nherente al proceso de medda. Puesto que en éste se trata, báscamente, de comparar
Calibración del termómetro
 Calibración del termómetro RESUMEN En esta práctica construimos un instrumento el cual fuera capaz de relacionar la temperatura con la distancia, es decir, diseñamos un termómetro de alcohol, agua y gas
Calibración del termómetro RESUMEN En esta práctica construimos un instrumento el cual fuera capaz de relacionar la temperatura con la distancia, es decir, diseñamos un termómetro de alcohol, agua y gas
TEMA 6 AMPLIFICADORES OPERACIONALES
 Tema 6 Amplfcadores peraconales ev 4 TEMA 6 AMPLIFICADES PEACINALES Profesores: Germán llalba Madrd Mguel A. Zamora Izquerdo Tema 6 Amplfcadores peraconales ev 4 CNTENID Introduccón El amplfcador dferencal
Tema 6 Amplfcadores peraconales ev 4 TEMA 6 AMPLIFICADES PEACINALES Profesores: Germán llalba Madrd Mguel A. Zamora Izquerdo Tema 6 Amplfcadores peraconales ev 4 CNTENID Introduccón El amplfcador dferencal
2.2 TASA INTERNA DE RETORNO (TIR). Flujo de Caja Netos en el Tiempo
 Evaluacón Económca de Proyectos de Inversón 1 ANTECEDENTES GENERALES. La evaluacón se podría defnr, smplemente, como el proceso en el cual se determna el mérto, valor o sgnfcanca de un proyecto. Este proceso
Evaluacón Económca de Proyectos de Inversón 1 ANTECEDENTES GENERALES. La evaluacón se podría defnr, smplemente, como el proceso en el cual se determna el mérto, valor o sgnfcanca de un proyecto. Este proceso
Bases Físicas del Medio Ambiente. Sistemas Termodinámicos
 Bases Físicas del Medio Ambiente Sistemas Termodinámicos Programa VII. SISTEMAS TERMODINÁMICOS. (1h) Introducción. Sistema termodinámico. Estados de equilibrio. Procesos termodinámicos. Equilibrio termodinámico.
Bases Físicas del Medio Ambiente Sistemas Termodinámicos Programa VII. SISTEMAS TERMODINÁMICOS. (1h) Introducción. Sistema termodinámico. Estados de equilibrio. Procesos termodinámicos. Equilibrio termodinámico.
FUNDAMENTOS QUIMICOS DE LA INGENIERIA
 FUNDAMENTOS QUIMICOS DE LA INGENIERIA (BLOQUE DE INGENIERIA QUIMICA) GUION DE PRACTICAS DE LABORATORIO ANTONIO DURÁN SEGOVIA JOSÉ MARÍA MONTEAGUDO MARTÍNEZ INDICE PRACTICA PAGINA BALANCE MACROSCÓPICO DE
FUNDAMENTOS QUIMICOS DE LA INGENIERIA (BLOQUE DE INGENIERIA QUIMICA) GUION DE PRACTICAS DE LABORATORIO ANTONIO DURÁN SEGOVIA JOSÉ MARÍA MONTEAGUDO MARTÍNEZ INDICE PRACTICA PAGINA BALANCE MACROSCÓPICO DE
Colegio : Liceo Miguel de Cervantes y Saavedra Dpto. Física (3 ero Medio) Profesor: Héctor Palma A.
 Tópico Generativo: La presión en vasos comunicantes. Aprendizajes Esperados: 1.-Aplicar la definir conceptual de presión y aplicarla a vasos comunicante. 2.- Caracterizar la presión en función de la fuerza
Tópico Generativo: La presión en vasos comunicantes. Aprendizajes Esperados: 1.-Aplicar la definir conceptual de presión y aplicarla a vasos comunicante. 2.- Caracterizar la presión en función de la fuerza
1.1 Ejercicios Resueltos Tema 1
 .. EJERCICIOS RESUELTOS TEMA. Ejerccos Resueltos Tema Ejemplo: Probarque ++3+ + n 3 + 3 +3 3 + + n 3 n (n +) Ã n (n +)! - Para n es certa, tambén lo comprobamos para n, 3,... ( + ) + 3 (+) supuesto certa
.. EJERCICIOS RESUELTOS TEMA. Ejerccos Resueltos Tema Ejemplo: Probarque ++3+ + n 3 + 3 +3 3 + + n 3 n (n +) Ã n (n +)! - Para n es certa, tambén lo comprobamos para n, 3,... ( + ) + 3 (+) supuesto certa
Índice de Precios de las Materias Primas
 May-15 Resumen Ejecutvo El objetvo del (IPMP) es sntetzar la dnámca de los precos de las exportacones de Argentna, consderando la relatva establdad en el corto plazo de los precos de las ventas externas
May-15 Resumen Ejecutvo El objetvo del (IPMP) es sntetzar la dnámca de los precos de las exportacones de Argentna, consderando la relatva establdad en el corto plazo de los precos de las ventas externas
CAPÍTULO IV. IV.1 Correlación de los resultados experimentales
 CAPÍTULO IV IV. Correlacón de los resultados expermentales La aplcacón de modelos de solucón para correlaconar los resultados que se obtenen en los expermentos, resulta de gran mportanca para amplar la
CAPÍTULO IV IV. Correlacón de los resultados expermentales La aplcacón de modelos de solucón para correlaconar los resultados que se obtenen en los expermentos, resulta de gran mportanca para amplar la
CAPÍTULO 5 REGRESIÓN CON VARIABLES CUALITATIVAS
 CAPÍTULO 5 REGRESIÓN CON VARIABLES CUALITATIVAS Edgar Acuña Fernández Departamento de Matemátcas Unversdad de Puerto Rco Recnto Unverstaro de Mayagüez Edgar Acuña Analss de Regreson Regresón con varables
CAPÍTULO 5 REGRESIÓN CON VARIABLES CUALITATIVAS Edgar Acuña Fernández Departamento de Matemátcas Unversdad de Puerto Rco Recnto Unverstaro de Mayagüez Edgar Acuña Analss de Regreson Regresón con varables
8 MECANICA Y FLUIDOS: Calorimetría
 8 MECANICA Y FLUIDOS: Calormetría CONTENIDOS Dencones. Capacdad caloríca. Calor especíco. Equlbro térmco. Calormetría. Calorímetro de las mezclas. Marcha del calorímetro. Propagacón de Errores. OBJETIVOS
8 MECANICA Y FLUIDOS: Calormetría CONTENIDOS Dencones. Capacdad caloríca. Calor especíco. Equlbro térmco. Calormetría. Calorímetro de las mezclas. Marcha del calorímetro. Propagacón de Errores. OBJETIVOS
RESISTENCIAS EN SERIE Y LEY DE LAS MALLAS V 1 V 2 V 3 A B C
 RESISTENCIS EN SERIE Y LEY DE LS MLLS V V 2 V 3 C D Fgura R R 2 R 3 Nomenclatura: Suponemos que el potencal en es mayor que el potencal en, por lo tanto la ntensdad de la corrente se mueve haca la derecha.
RESISTENCIS EN SERIE Y LEY DE LS MLLS V V 2 V 3 C D Fgura R R 2 R 3 Nomenclatura: Suponemos que el potencal en es mayor que el potencal en, por lo tanto la ntensdad de la corrente se mueve haca la derecha.
Probabilidad Grupo 23 Semestre Segundo examen parcial
 Probabldad Grupo 3 Semestre 015- Segundo examen parcal La tabla sguente presenta 0 postulados, algunos de los cuales son verdaderos y otros son falsos. Analza detendamente cada postulado y elge tu respuesta
Probabldad Grupo 3 Semestre 015- Segundo examen parcal La tabla sguente presenta 0 postulados, algunos de los cuales son verdaderos y otros son falsos. Analza detendamente cada postulado y elge tu respuesta
Respuesta A.C. del FET 1/14
 espuesta A.C. del FET 1/14 1. Introduccón Una ez que se ubca al transstor dentro de la zona saturada o de corrente de salda constante, se puede utlzar como amplfcador de señales. En base a un FET canal
espuesta A.C. del FET 1/14 1. Introduccón Una ez que se ubca al transstor dentro de la zona saturada o de corrente de salda constante, se puede utlzar como amplfcador de señales. En base a un FET canal
Determinación de Puntos de Rocío y de Burbuja Parte 1
 Determnacón de Puntos de Rocío y de Burbuja Parte 1 Ing. Federco G. Salazar ( 1 ) RESUMEN El cálculo de las condcones de equlbro de fases líqudo vapor en mezclas multcomponentes es un tema de nterés general
Determnacón de Puntos de Rocío y de Burbuja Parte 1 Ing. Federco G. Salazar ( 1 ) RESUMEN El cálculo de las condcones de equlbro de fases líqudo vapor en mezclas multcomponentes es un tema de nterés general
INTRODUCCION A LOS METODOS ELECTROANALITICOS
 Introduccón a los Métodos Electro-analítcos 2 Tema 7 INTRODUCCION A LOS METODOS ELECTROANALITICOS Los métodos electroquímcos de análss, o métodos electro-analítcos, son, en general, menos utlzados que
Introduccón a los Métodos Electro-analítcos 2 Tema 7 INTRODUCCION A LOS METODOS ELECTROANALITICOS Los métodos electroquímcos de análss, o métodos electro-analítcos, son, en general, menos utlzados que
ALN - SVD. Definición SVD. Definición SVD (Cont.) 29/05/2013. CeCal In. Co. Facultad de Ingeniería Universidad de la República.
 9/05/03 ALN - VD CeCal In. Co. Facultad de Ingenería Unversdad de la Repúblca Índce Defncón Propedades de VD Ejemplo de VD Métodos para calcular VD Aplcacones de VD Repaso de matrces: Una matrz es Untara
9/05/03 ALN - VD CeCal In. Co. Facultad de Ingenería Unversdad de la Repúblca Índce Defncón Propedades de VD Ejemplo de VD Métodos para calcular VD Aplcacones de VD Repaso de matrces: Una matrz es Untara
Unidad Central del Valle del Cauca Facultad de Ciencias Administrativas, Económicas y Contables Programa de Contaduría Pública
 Undad Central del Valle del Cauca Facultad de Cencas Admnstratvas, Económcas y Contables Programa de Contaduría Públca Curso de Matemátcas Fnanceras Profesor: Javer Hernando Ossa Ossa Ejerccos resueltos
Undad Central del Valle del Cauca Facultad de Cencas Admnstratvas, Económcas y Contables Programa de Contaduría Públca Curso de Matemátcas Fnanceras Profesor: Javer Hernando Ossa Ossa Ejerccos resueltos
Tema 4: Variables aleatorias
 Estadístca 46 Tema 4: Varables aleatoras El concepto de varable aleatora surge de la necesdad de hacer más manejables matemátcamente los resultados de los expermentos aleatoros, que en muchos casos son
Estadístca 46 Tema 4: Varables aleatoras El concepto de varable aleatora surge de la necesdad de hacer más manejables matemátcamente los resultados de los expermentos aleatoros, que en muchos casos son
Universidad Simón Bolívar Conversión de Energía Eléctrica - Prof. José Manuel Aller
 Unversdad Smón Bolívar Conversón de Energía Eléctrca Prof José anuel Aller 41 Defncones báscas En este capítulo se estuda el comportamento de los crcutos acoplados magnétcamente, fjos en el espaco El medo
Unversdad Smón Bolívar Conversón de Energía Eléctrca Prof José anuel Aller 41 Defncones báscas En este capítulo se estuda el comportamento de los crcutos acoplados magnétcamente, fjos en el espaco El medo
ESTADOS DE AGREGACIÓN DE LA MATERIA
 ESADOS DE AGREGACIÓN DE LA MAERIA. Propiedades generales de la materia La materia es todo aquello que tiene masa y volumen. La masa se define como la cantidad de materia de un cuerpo. Se mide en kg. El
ESADOS DE AGREGACIÓN DE LA MAERIA. Propiedades generales de la materia La materia es todo aquello que tiene masa y volumen. La masa se define como la cantidad de materia de un cuerpo. Se mide en kg. El
Disipación de energía mecánica
 Laboratoro de Mecáa. Expermento 13 Versón para el alumno Dspacón de energía mecáa Objetvo general El estudante medrá la energía que se perde por la accón de la uerza de rozamento. Objetvos partculares
Laboratoro de Mecáa. Expermento 13 Versón para el alumno Dspacón de energía mecáa Objetvo general El estudante medrá la energía que se perde por la accón de la uerza de rozamento. Objetvos partculares
Termómetros de resistencia de platino y la escala internacional de temperatura EIT-90
 Termómetros de resstenca de platno y la escala nternaconal de temperatura EIT- Víctor Martínez Fuentes La EIT- La Escala Internaconal de Temperatura de 19 (EIT- ) se adoptó por el CIPM en 1989 para reemplazar
Termómetros de resstenca de platno y la escala nternaconal de temperatura EIT- Víctor Martínez Fuentes La EIT- La Escala Internaconal de Temperatura de 19 (EIT- ) se adoptó por el CIPM en 1989 para reemplazar
Capítulo 6. Valoración respiratoria
 498 Capítulo 6. Valoración respiratoria 6.19. La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 6.19 La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 499
498 Capítulo 6. Valoración respiratoria 6.19. La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 6.19 La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 499
