En profundidad. Qué se sabe de la TOXOPLASMOSIS. Febrero 2008 Centro de Información del Medicamento
|
|
|
- Juan Sosa Plaza
- hace 6 años
- Vistas:
Transcripción
1 En profundidad Qué se sabe de la TOXOPLASMOSIS? AUTORA: Carmen Dolz Izquierdo Febrero 2008 Centro de Información del Medicamento
2
3 ÍNDICE INTRODUCCIÓN Y BREVE RESEÑA HISTÓRICA... ETIOLOGÍA... CICLO BIOLÓGICO... VIAS DE INFECCIÓN... PATOGENIA... MANIFESTACIONES CLÍNICAS... PREVENCIÓN... IMPORTANCIA DE LA TOXOPLASMOSIS... PREVALENCIA E INCIDENCIA DE TOXOPLASMOSIS... TOXOPLASMOSIS CONGÉNITA... PREVALENCIA E INCIDENCIA: EN ANIMALES DE PRODUCCIÓN Y SILVESTRES... DIAGNÓSTICO... CONTROL Y TRATAMIENTO DE ANIMALES... TRATAMIENTO EN HUMANOS... CONCLUSIONES... REFERENCIAS... ANEXOS Qué se sabe de la TOXOPLASMOSIS? 3
4
5 INTRODUCCIÓN Y BREVE RESEÑA HISTÓRICA Las enfermedades zoonóticas se transmiten de los animales al hombre y viceversa. Estas enfermedades son importantes no sólo en medicina humana sino también veterinaria, al comprometer la salud pública y ocasionar daños en la economía ya que provocan problemas reproductivos en los animales de consumo humano. Entre las zoonosis más comunes, se encuentra la toxoplasmosis. Esta zoonosis parasitaria está causada por el protozoo Toxoplasma gondii, descrito por Nícolle y Manceaux en 1909, cuando lo aislaron de un roedor existente en el Norte de África, el Ctenodactylus gundi. Las primeras descripciones de casos clínicos de toxoplasmosis humana fueron realizadas por Castellani en 1913, Janku en 1923 y Walf y Cowen en En 1965, Hutchinson hizo la observación que cuando los gatos comían ratones infectados por Toxoplasma, la infección podía transmitirse a ratones, conejos y otros animales mediante las heces del gato. Definitivamente en 1970, Frenkel en Estados Unidos y Hutchinson en Inglaterra, logran establecer la verdadera forma de transmisión en la naturaleza, donde el gato ocupa un lugar preponderante. No es lo mismo toxoplasmosis que infección toxoplásmica. La toxoplasmosis describe la enfermedad clínica o tisular causada por Toxoplasma y es diferente de la infección por Toxoplasma, que es habitualmente asintomática en los pacientes inmunocompetentes y el cuadro clínico dependerá del estado inmune del paciente. Las principales vías de transmisión al hombre son la oral, sobre todo al ingerir quistes tisulares contenidos en carnes poco hechas, crudas o semicrudas y la transplacentaria. Asimismo, es una enfermedad oportunista que afecta a personas inmunosuprimidas con el Síndrome de Inmunodeficiencia Adquirida (SIDA) o con tratamiento de quimioterapia contra el cáncer. Los problemas reales que plantea Toxoplasma siguen siendo los mismos que hace diez años, la prevención de la infección en gestantes seronegativas y el desarrollo de tratamientos más eficaces en pacientes inmunocomprometidos e infecciones congénitas, sin olvidar que aunque en la actualidad se conoce bien el ciclo evolutivo del parásito y se dispone de nuevas técnicas, estamos ante una enfermedad con muchos interrogantes y continúan los problemas de interpretación en su diagnóstico. ETIOLOGÍA 1000x. Foto EXOPOL. Toxoplasma gondii es un protozoo parásito intracelular obligado. Su nombre se debe a la forma arqueada (del griego toxos que significa arcos y plasma, forma). Puede presentarse bajo tres formas: Taquizoítos o trofozoítos (formas invasivas de división rápida), pseudoquistes o quistes tisulares (formas de resistencia de multiplicación lenta que contienen bradizoítos) y ooquistes (que contienen esporozoítos en su interior). En la foto (tinción Giemsa), se observa la típica forma semilunar o en arco denominada trofozoíto (antes taquizoíto) fuera de las células, con un polo anterior más aguzado, una cara convexa y la otra generalmente cóncava. Los zoítos libres miden de 4 a 6 µm de largo y de 2 a 4 de ancho, es decir tienen aproximadamente el tamaño de un eritrocito. Se encuentra en situación extracelular en los exudados de las cavidades corporales, el líquido cerebro-espinal y a veces en la sangre; y durante la fase de infestación aguda aparecen estas formas proliferativas situadas directamente en el citoplasma de las células. En los animales vivos con clínica, la eliminación de estas formas de T.gondii se realiza a través de la orina, saliva, secreciones nasales, oculares, vaginales, leche, heces, semen... lo que facilita el diagnóstico directo. En el curso de la infestación crónica el sistema inmune controla la multiplicación, produciendo pseudoquistes que persisten de por vida en los tejidos de los animales infestados y aparecen en diversos órganos, con especial predilección por el cerebro, corazón y músculos. El tamaño oscila entre µm y contienen hasta miles de bradizoitos que se multiplican lenta y continuamente pero sin romper la gruesa membrana de recubrimiento que tiene. Puede observarse la salida de los bradizoítos cuando los quistes tisulares estallan, y entonces las infecciones latentes son reactivadas con síntomas Qué se sabe de la TOXOPLASMOSIS? 5
6 de septicemia generalizada. Las reactivaciones coinciden con depresiones transitorias o permanentes de la inmunidad celular como consecuencia de infecciones concurrentes, stress del embarazo...etc. La sangre transporta en forma continua y en cantidades elevadas una toxina teratogénica elaborada por los T.gondii. La septicemia fetal se produce por difusión del parásito a los tejidos. EXOPOL MEB X y X Los taquizoítos son formas sensibles a la desecación, la congelación y las secreciones gástricas. Los bradizoítos no resisten la congelación a -20ºC ni la temperatura superior a 60ºC, pero las secreciones gástricas rompen la cápsula del quiste y liberan microorganismos viables que atraviesan la mucosa y se diseminan por el organismo. T.gondii puede además encontrarse en la naturaleza, en forma de ooquiste. Este mide entre µm y se produce en el intestino del huésped definitivo (gato y otros felinos) en los cuales el parásito sufre un ciclo completo. Fuera del intestino, si existen unas condiciones favorables de humedad y temperatura (4-37ºC), esporula y da lugar a formas muy resistentes que pueden llegar a mantener su capacidad infectante durante incluso más de un año (hasta 18 meses). La ebullición o bien el calor seco a más de 66ºC los destruye. CICLO BIOLÓGICO: Toxoplasma gondii Realiza dos ciclos de vida independientes: (figuras 1 y 2). GATO Taquizoitos Bradizoitos Esquizontes Gametos Ooquistes OOQUISTES Suelo Esporogonia CB directo Taquizoitos Bradizoitos CB indirecto HOSPEDADOR INTERMEDIARIO Taquizoitos Bradizoitos HOMBRE Autoinfección, trasplantes, recidiva Fig. Nº 1 Fig. Nº 2 1- Ciclo Intestinal o directo (solamente en felinos, único hospedador definitivo). Cuando un felino (doméstico o salvaje) se infecta por carnivorismo con quistes contenidos en tejidos animales o bien con ooquistes infectantes del medio ambiente, los parásitos pasan al intestino, se reproducen y vuelven a formar ooquistes, 6 Qué se sabe de la TOXOPLASMOSIS?
7 que se eliminan con la materia fecal: Una vez en el epitelio de las vellosidades en la porción baja del intestino delgado, penetran en las células y crecen adquiriendo un aspecto ameboide (trofozoito), que pronto divide su núcleo y cada porción nuclear se rodea con una parte citoplasmática, constituyendo el esquizonte inmaduro, que luego madura hasta formar numerosos merozoitos. La célula posteriormente estalla y libera los merozoitos. Al cabo de tres, cinco o más días, algunos merozoitos evolucionan hacia formas sexuadas o gametos. El microgametocito masculino madura hasta producir entre 12 y 32 microgametos. La fecundación del macrogameto ocurre dentro de la célula y el cigoto resultante sale al intestino recubierto por una envoltura traslúcida (ooquiste), que es expulsado al exterior con las heces del gato. El gato comienza a eliminar ooquistes 3 a 5 días después de haberse infectado. Ooquiste esporulado: dos esporoblastos con cuatro esporozoítos Esporozoito Si la infección del gato ocurre con taquizoitos (ingestión de animales con infección aguda) o con esporozoitos (ingestión de ooquistes), se produce primero una infección tisular con taquizoitos, seguida de producción de bradizoitos capaces de iniciar el ciclo intestinal, con un período prepatente de días, tiempo que tarda en eliminar ooquistes. Sin embargo cuando el gato ingiere pseudoquistes (quistes tisulares) se vuelve infectante en 3-4 días. Esporocisto Puede excretar hasta 10 millones de ooquistes diarios con las heces, durante 1-3 semanas. Los ooquistes de T. gondii son eliminados en estado inmaduro, pero aunque inmaduros (no infectantes) al principio, en condiciones adecuadas continúan su desarrollo en el medio externo, formando en su interior dos esporoblastos con cuatro esporozoitos cada uno. Este ciclo tiene en el gato 3 fases: cuerpo residual esporocistico Fase esquizogónica: El zoíto penetra en las células de la pared intestinal del felino, forma allí esquizontes que después se rompen. Fase gamogónica: El zoíto penetra a las células de la pared intestinal del felino formando micro y macro gametos Fase esporogónica: Los gametos se fecundan formando un cigoto que sale a la luz intestinal - ooquiste no esporulado- y no infectante al principio. Al cabo de 1-5 días maduran (en el medio ambiente) y se convierten en ooquistes infectantes (conteniendo 2 esporoblastos con 4 esporozoítos cada uno). Estos ooquistes eliminados se diseminan por aire, agua e insectos. 2- Ciclo extraintestinal, tisular o indirecto, también llamado asexual o esquizogónico: Sucede en el hospedador intermediario, pudiendo ocurrir en cualquier animal de sangre caliente (incluyendo también a los felinos), siendo por tanto éstos últimos, hospedadores completos del parásito. Si los ooquistes maduros son ingeridos por otros animales o por el hombre, el parásito pasa del intestino a la sangre y por esta vía se dirige a cualquier tejido del organismo (se ha encontrado en músculo, ojos, tejido nervioso, ganglios, hígado etc.). Los toxoplasmas, para multiplicarse, deben penetrar obligadamente en una célula, lo cual puede suceder por movimientos propios del parásito o por fagocitosis). Son capaces de parasitar cualquier célula nucleada, pero sobre todo Qué se sabe de la TOXOPLASMOSIS? 7
8 se encuentran en células del sistema retículo endotelial, del sistema nervioso central y en las células musculares. La multiplicación intracelular es compleja: ocurre en una vacuola parasitófora de la célula hospedadora y se inicia por un proceso de brote interno o endogenia, que remata con la formación de 2 individuos hijos (endodiogenia), los cuales prosiguen su proliferación en forma sucesiva, mediante este mismo mecanismo (se trata de un proceso asexuado, en el cual los individuos hijos son formados en el seno de la célula materna antes de llegar a ser libres). La multiplicación intracelular acelerada de toxoplasmas (taquizoitos), concluye con la formación de pseudoquistes; es decir, de células hospedadoras repletas de parásitos. El proceso culmina con la destrucción de estas células parasitadas y con la liberación de nuevos zoitos, los cuales localmente, en el mismo tejido, o a distancia por vía hemática o linfática, se diseminan por todo el organismo, invadiendo nuevas células. Si el ritmo de reproducción es más atenuado, el proceso terminará con la formación de quistes. Los parásitos de multiplicación lenta (bradizoitos), segregan precipitados granulares que se adosan a la membrana vacuolar circundante. Esta membrana se expande lentamente, a medida que se multiplican en su interior. Por último, al fusionarse las granulaciones, se forma una membrana sólida, la membrana quística. En este caso, se trata de quistes verdaderos cuya membrana envolvente deriva de componentes del parásito y de la célula hospedadora y contienen en su interior decenas, cientos o miles de bradizoitos (ver fotos de EXOPOL al inicio). Para enfatizar la velocidad de reproducción del T. gondii en los tejidos, Frenkel propuso llamar taquizoitos a los parásitos de reproducción rápida dentro del pseudoquiste, y bradizoitos a los de reproducción lenta dentro de los quistes. En suma, en los mamíferos y en las aves el toxoplasma se puede observar como zoito libre, taquizoito, y como bradizoito (quistes). Resumiendo, se distinguen en este ciclo (dentro del hospedador intermediario, incluido el hombre) 2 fases: Fase proliferativa: Una vez que llegan al órgano, los zoítos penetran en las células, se multiplican (en forma asexual -por endodiogenia-), y rompen la célula liberando taquizoítos. Fase quística: Los zoítos que penetraron en una célula forman una membrana quística, se multiplican por endodiogenia y degeneran la célula formando un pseudoquiste (quiste tisular) que provoca una reacción inflamatoria y una reacción inmunológica con la formación de anticuerpos, que limitan el crecimiento del mismo, quedando los parásitos de su interior en estado latente, durante toda la vida del huésped. De esta forma, no producen ninguna sintomatología clínica, excepto si el hospedador (que puede ser también un humano) por cualquier razón, sufre inmunodepresión, y en este caso el parásito comenzará a reproducirse activamente. Estos quistes tisulares que se desarrollan en los huéspedes intermediarios son infectantes cuando son ingeridos por otro huésped carnívoro (incluido el hombre), lo que es trascendental en el mantenimiento de la cadena epidemiológica. VIAS DE INFECCIÓN Tal como se deduce de los ciclos epidemiológicos, la infección en el hombre se puede producir por cualquiera de las formas zoíticas del protozoo: 1. Taquizoítos por vía parenteral o a través de la placenta. 2. Ingestión de ooquistes esporulados, procedentes de heces de gatos infectados, contaminando agua o alimentos, 3. Y lo que es más frecuente, por la ingestión de quistes tisulares con bradizoítos (en carne y vísceras insuficientemente cocinadas). Las principales vías de transmisión al hombre son la oral y la transplacentaria. No hay descrito contagio interhumano, pero sí la posibilidad de adquirirse a través de transfusiones de productos hemáticos (sangre total o leucocitos) provenientes de pacientes en fase de diseminación hematógena, o bien a través de órganos trasplantados que contengan quistes del parásito. Al igual que por inoculación accidental en personal de laboratorio (ya que los taquizoítos pueden sobrevivir en sangre total citratada y conservada a 4ºC, hasta 50 días). 8 Qué se sabe de la TOXOPLASMOSIS?
9 PATOGENIA La diversidad de la patogenia de la toxoplasmosis guarda una estrecha relación con la evolución del protozoo en tres o cuatro fases características: 1- Fase parasitaria. Tras la ingestión de quistes tisulares u ooquistes maduros, su pared es destruida por las secreciones gástricas, liberándose bradizoítos o esporozoítos resistentes a la pepsina, los cuales invaden las células epiteliales y monocitarias del intestino, transformándose en trofozoítos invasivos de multiplicación rápida. A partir de allí se diseminan por todo el organismo, con predilección por el sistema linfático, y también en otros órganos como el SNC, miocardio, músculo esquelético, retina y placenta, donde el parásito se reproduce, lisando las células que le albergan e invadiendo las células vecinas. El acantonamiento en determinadas localizaciones, como el sistema nervioso o el feto, se debería a la entrada en refugios inmunológicos. La fase de parasitemia intensa suele durar unas 2 semanas hasta que se desarrolla la respuesta inmunitaria, aunque en individuos inmunodeprimidos puede prolongarse. 2- Fase inmunitaria. Los trofozoítos son muy sensibles a cualquier agresión, y la propia inmunidad inespecífica impide ya su proliferación extracelular (parásito intracelular obligado). La aparición de anticuerpos específicos en la segunda semana de la infección es mucho más eficaz para eliminar los parásitos extracelulares (incluso en el corto periodo entre la lisis de una célula y la invasión de células vecinas), pero no puede eliminar los parásitos intracelulares, capaces de sobrevivir incluso en el interior de los macrófagos. La inmunidad mediada por células y las linfoquinas son fundamentales para el control de la infección. El interferón gamma (IFN-γ) activa los macrófagos, confiriéndoles capacidad microbicida frente a Toxoplasma. Asimismo, se estimulan linfocitos T citotóxicos capaces de eliminar parásitos extracelulares y también células parasitazas. 3- Fase crónica o de quiescencia inmunitaria. En 2 ó 3 meses se ha completado la respuesta inmunitaria y se han eliminado los trofozoítos, pero persistirán indefinidamente en quistes titulares localizados sobre todo en músculos y en zonas de difícil acceso para anticuerpos, linfocitos CD4+ y linfocitos CD8+, como el SNC y la retina. 4- Reactivación. La infección suele persistir quiescente a lo largo de toda la vida, pero en casos de inmunodepresión importante, los quistes pueden reactivarse y originar una nueva fase de parasitemia activa. MANIFESTACIONES CLÍNICAS El espectro clínico de la enfermedad en el adulto es muy variado, dependiendo fundamentalmente del estado inmunitario del huésped: Toxoplasmosis adquirida en individuos inmunocompetentes. Suele ser asintomática o bien producir leves síntomas que pasan inadvertidos en el 80-90% de los casos. Cuando existen manifestaciones clínicas, suele tratarse de adenopatías laterocervicales, con menor frecuencia se afectan los ganglios supraclaviculares, occipitales, inguinales, mediastínicos o cualquier otra cadena ganglionar, existiendo adenopatías generalizadas en el 20-30% de casos. Suelen ser nódulos de 1-3 cm, poco o nada dolorosos, duros, sin signos inflamatorios y que no supuran. El % de pacientes con adenopatías presentan además otros síntomas o signos de infección (fiebre, afectación del estado general, artromialgias, astenia, sudoración nocturna, odinofagia, y/o erupción cutánea maculopapulosa no pruriginosa que respeta palmas y plantas. La toxoplasmosis es causa del 3-7% de las consultas médicas por adenopatías cervicales en pacientes jóvenes, debiendo realizarse el diagnóstico diferencial con los linfomas, tuberculosis, sarcoidosis, la enfermedad por arañazo de gato y los síndromes mononucleósicos (alrededor del 1% de los síndromes mononucleósicos son causados por T.gondii, con un cuadro clínico indiferenciable del ocasionado por VIH, el virus de Epstein-Barr (VEB) o citomegalovirus). El cuadro clínico de la toxoplasmosis aguda suele ser benigno y autolimitarse en menos de 1 mes y aunque las adenopatías pueden permanecer algunos meses, e incluso los síntomas mantenerse más tiempo, la progresión de la enfermedad es extremadamente rara en pacientes inmunocompetentes. Toxoplasmosis en pacientes inmunodeprimidos. La mayoría de casos se deben a la reactivación de una infección latente, aunque puede tratarse de una toxoplasmosis aguda de origen exógeno a partir de la ingesta de carnes poco cocinadas, trasfusiones sanguíneas o trasplantes (principalmente en trasplantes cardiacos si el receptor es seronegativo y el donante seropositivo). La presentación más habitual (sobre todo en pacientes con SIDA, y con mucha menor frecuencia en otros tipos de inmunodepresión), es la cerebral, constituyendo la infección oportunista del SNC más frecuente Qué se sabe de la TOXOPLASMOSIS? 9
10 en estos enfermos. Se trata de un cuadro de instauración subaguda con síntomas inespecíficos como fiebre y cefalea que puede durar semanas. Puede haber después alteración del nivel de conciencia hasta llegar al coma, así como diversas focalidades neurológicas (hemiplejía, afasia, alteraciones sensoriales, convulsiones y parálisis de nervios craneales). Como todas las infecciones oportunistas, en el SIDA cualquier órgano es susceptible de ser infectado, aunque las manifestaciones extracerebrales en órganos vitales como pulmón, retina, corazón... son irrelevantes comparadas en cuanto a su repercusión en la morbi-mortalidad, con la afectación cerebral. PREVENCIÓN La infección intraútero por el toxoplasma gondii, puede dar lugar a defectos congénitos como hidrocefalia, corio-retinitis y retraso mental. Estos defectos pueden presentarse al nacimiento o posteriormente. 1 La prevención, puede llevarse acabo de distintas formas: 1. Prevención primaria (medidas higiénico-dietéticas). 2. Prevención secundaria o prenatal (screening serológico en la mujer gestante). 3. Prevención terciaria o postnatal (diagnóstico precoz de la infección en el recién nacido). Prevención primaria (medidas higiénico-dietéticas): Debemos tratar de romper la cadena epidemiológica, tomando medidas de prevención en las distintas especies que pueden adquirir la enfermedad, y en el ser humano, sobre todo en la mujer gestante. Para el HOMBRE: Con respecto a las carnes y otros alimentos Ingerir carnes y vísceras cocidas a más de 70ºC en todo su espesor y por más de 10 minutos. Lavar las manos después de manipular carne cruda. La congelación, curación y ahumado no suprime del todo el riesgo en carne cruda/semicruda. No ingerir leche ni huevos crudos. Lavar bien las frutas y verduras antes de su consumo. Con respecto al gato Utilizar el cajón sanitario para la materia fecal y eliminarla diariamente. Evitar la contaminación de jardines, huertas, areneros de juegos etc. con materia fecal de gatos. Utilizar guantes para tareas de jardinería y limpieza del cajón sanitario. Extremar los cuidados en todos los aspectos en mujeres embarazadas y en especial las que tienen serología negativas para toxoplasma. Para el GATO: Evitar la ingestión de carnes y vísceras crudas. Evitar la ingestión de presas vivas como roedores, pájaros, cucarachas, etc. Un collar con cascabel puede ser útil para evitar la captura de presas vivas. Evitar el contacto con materias fecales de otros gatos (sobre todo de vida libre). Controlar especialmente las hembras madres, ya que también puede haber transmisión transplacentaria en el gato. Hacerle exámenes periódicos por el veterinario, sobre todo en edades tempranas, que es cuando la excreción de ooquistes es epidemiologicamente importante. 2 Prevención secundaria o prenatal (screening serológico en la mujer gestante): Una segunda medida preventiva se basa en el screening serológico durante el embarazo para poder identificar la infección. Si se descubre temprano, se puede iniciar una terapia precoz en las gestantes infectadas para evitar la transmisión y el posible daño al feto. El tratamiento durante el embarazo da lugar a una reducción significativa en la incidencia de infección fetal y severidad de las secuelas en el neonato. En Francia, se practica tamización mensual a las embarazadas seronegativas para demostrar infecciones agudas por la seroconversión. Se inicia tratamiento con espiramicina en caso de que ocurra y se realiza amniocentesis para el diagnós- 10 Qué se sabe de la TOXOPLASMOSIS?
11 tico de infección fetal. Si ésta se confirma, se cambia a pirimetamina/sulfadiazina. Los estudios de las observaciones muestran descenso en la incidencia de la infección congénita, y sobre todo de la severidad de la Toxoplasmosis Congénita. Países como Austria, también tienen estos programas, aunque la tamización serológica varía, pues se hace por trimestre. La serología permite detectar a las gestantes susceptibles a la infección por T. gondii, así como la detección precoz de la infección primaria por la demostración de la seroconversión o de un incremento significativo del título de anticuerpos IgG obtenido entre dos muestras separadas 2 ó 4 semanas y estudiadas en paralelo. Estos hechos han justificado la existencia de un programa serológico de cribado en la gestante. Cuando se demuestre o sospeche que se ha producido la infección, se deberán aplicar protocolos específicos de diagnóstico de la infección fetal. Un resultado positivo de la IgG en la prueba de cribado, en una mujer asintomática e inmunocompetente, se corresponde en la mayor parte de los casos, con una infección previa al embarazo, evidencia de inmunización y ausencia de riesgo de infección primaria aguda en éste y sucesivos embarazos. Existe sin embargo, la posibilidad de que la presencia de IgG se deba a una infección adquirida al inicio de la gestación lo cual ha dado lugar a dos planteamientos distintos del control serológico de la toxoplasmosis durante el embarazo, según que el objetivo perseguido sea la detección de las gestantes susceptibles o de las que son inmunes. A) Detección de gestantes susceptibles: El objetivo es detectar a las gestantes seronegativas para recomendar las medidas de prevención a adoptar (higiénicas y culinarias) encaminadas a evitar su primoinfección así como la identificación precoz de las que experimenten seroconversión durante el embarazo, mediante la realización de un control serológico trimestral. B) Detección de gestantes inmunes: Se fundamenta en la necesidad de disponer de datos globales sobre la incidencia de primoinfección por T.gondii en la gestante y de la toxoplasmosis congénita en España. Según este planteamiento, un resultado positivo de la IgG-antitoxoplasma en la prueba de cribado, implicará la determinación de IgM específica. Si la IgM es negativa (lo que sucede en más del 90% de casos, y la gestante es inmunocompetente) queda descartada la infección primaria aguda en éste y sucesivos embarazos. Si la IgM es positiva, será necesaria la obtención de una segunda muestra en las 2-3 semanas posteriores y la determinación y titulación de IgG en ambas y en un mismo ensayo, para observar si existe o no un incremento significativo del título. Además, se valorará la posibilidad de analizar otros marcadores serológicos de infección aguda (IgA y avidez de IgG) y la titulación de IgG en la primera muestra. El incremento significativo del título de IgG indica infección reciente y supone proceder como en el caso de una seroconversión. Las situaciones en las que el título de IgG se mantenga estable, pero se detecte algún marcador de infección aguda, deben valorarse individualmente. En la actualidad, existe controversia en nuestro país, sobre la pertinencia del cribado prenatal de la toxoplasmosis a todas las gestantes, debido a las dudas surgidas respecto al impacto sanitario de dichos programas, el coste derivado de los mismos y los problemas diagnósticos que plantea la realización de pruebas serológicas encaminadas a descartar la primoinfección en las seropositivas. Estos últimos se fundamentan, principalmente, en los siguientes hechos: 1- No existe ningún marcador serológico que, con una determinación aislada, pueda distinguir una infección aguda/reciente de una infección pasada. Asimismo, la realización conjunta de pruebas serológicas en una sola muestra de suero, tampoco permite establecer con seguridad el momento en que se produjo la infección. 2- La presencia de IgM específica no es sinónimo de infección reciente, debido a que puede persistir desde seis meses hasta varios años después de producirse la primoinfección. Esta característica condiciona la realización de pruebas serológicas adicionales para intentar concretar la fecha de la infección. 3- La investigación de IgA específica como indicador de infección reciente, tampoco aclara la situación. Puede persistir hasta un año después de producirse la infección y su ausencia no excluye ésta, debido a que en un 5-15% de los casos no se detecta nunca. 4- El estudio de la avidez de los anticuerpos IgG para diferenciar la infección primaria aguda de la respuesta IgM específica mantenida en el tiempo sigue sin resolver la situación. Aunque teóricamente es una prueba que permite documentar el tiempo de evolución de la infección con una sola muestra, tampoco suministra resultados definitivos debido a que los anticuerpos de baja avidez pueden persistir más de cinco meses, e incluso un año después de haberse producido la infección. Asimismo, en una proporción considerable de sueros, los resultados de la avidez de IgG son indeterminados y, por tanto, no son interpretables. Por otra parte, hay que tener en cuenta que la prueba no está estandarizada y que su re Qué se sabe de la TOXOPLASMOSIS? 11
12 alización no excluye la investigación de IgM debido a que algunos estudios han demostrado que en más de un 16% de los casos, existe simultáneamente baja avidez de IgG e IgM negativa. 5- La recomendación de efectuar en las seropositivas la determinación en paralelo de IgG en dos muestras separadas entre 2 y 4 semanas para valorar la cinética de los anticuerpos IgG, puede plantear problemas de interpretación y debe tenerse en cuenta, que sólo podrá observarse el incremento del título de anticuerpos IgG en aquellas gestantes en las que el primer control se haya realizado en la fase inicial de la infección. Si no es así, el mantenimiento del título de IgG no descarta la infección durante ese embarazo. La Red Europea para la Investigación de la Toxoplasmosis Congénita (ERNCT) define cinco categorías excluyentes entre sí para considerar la probabilidad de infección en la gestante. En la tabla siguiente se muestran los criterios de inclusión en las diferentes categorías. Sólo los casos clasificados como cierta y no infectada son indiscutibles. PACIENTES CATEGORÍA DE LA INFECCIÓN DEFINICIÓN DEL CASO Cierta 1- Seroconversión. Ambas muestras obtenidas después de la concepción a 2- Cultivo positivo de sangre materna b 3- Demostración de infección congénita en el niño Infección primaria materna durante el embarazo Cierta 1- Seroconversión. La primera muestra obtenida en los dos meses previos a la concepción 2- Aumento significativo de los títulos de IgG con presencia de IgM o IgA c 3- Títulos altos de IgG, presencia de IgM o IgA y adenopatías durante el embarazo c Posible 1- Títulos de IgG estables, sin IgM en la segunda mitad del embarazo c 2- Títulos altos de IgG en presencia de IgM y/o IgA en la primera mitad del embarazo c Rara 1- Títulos estables y bajos de IgG con o sin IgM c 2- Títulos estables de IgG sin IgM al comienzo del embarazoc No infectada 1- Seronegativa (durante el embarazo) 2- Seropositiva antes del embarazo 3- IgM o IgA positivas, sin aparición de IgG c Clasificación y definición del caso de infección por Toxoplasma gondii en mujeres gestantes inmunocompetentes (a) Debería confirmarse con una tercera muestra. (b) Incluye cultivo e inoculación al ratón. (c) En dos muestras tomadas durante el embarazo, con 2 ó 3 semanas de intervalo. 3 Prevención terciaria postnatal: Se basa en la detección de IgM anti-toxoplasma en la sangre del talón del recién nacido, obtenida sobre papel secante para el cribado sistemático de enfermedades metabólicas. Este cribado neonatal conlleva asumir que no es posible realizar tratamiento in útero del feto afectado, ni saber el número de gestantes con primoinfección durante el embarazo. Sólo países como Dinamarca, Suecia, ciertas provincias en Polonia, y el estado de Massachussets en EEUU, hacen tamización al recién nacido. Argumentan que dada la baja incidencia de la infección y como la mayoría de los niños que nacen tienen infección subclínica, es más costo efectivo esta estrategia de tamizaje y el tratamiento postnatal, pero no 12 Qué se sabe de la TOXOPLASMOSIS?
13 hacer el diagnóstico al recién nacido y dejarlo sin tratamiento lo llevaría a la aparición tardía de secuelas oculares o neurológicas. El seguimiento de estos niños con infección congénita asintomática o leve (con cualquiera de las estrategias) ha sido favorable, pues parece que a los tres años de edad el desarrollo neurológico es semejante al de los niños sin esta infección. En niños más sintomáticos, el tratamiento postnatal por un año disminuye las secuelas neurológicas, sensoriales y la recurrencia de enfermedad ocular. Estos hallazgos refuerzan la importancia de descubrir y tratar a los niños con toxoplasmosis congénita. Es importante anotar que pese a su baja incidencia, la Toxoplasmosis Congénita es igual o más frecuente que otras enfermedades que se tamizan en los recién nacidos como la fenilcetonuria o el hipotiroidismo congénito. Pero esta forma de prevención está todavía en evaluación pues su utilidad real necesita más estudios que demuestren las ventajas e inconvenientes de su aplicación, y además establecer las cifras de seroprevalencia en donde su realización puede ser más coste-eficaz. Por todo lo anterior, en sitios donde en la actualidad no hay una política de salud pública al respecto, la elección de una u otra estrategia debe hacerse en el contexto de los estudios epidemiológicos respectivos. La coincidencia de datos entre regiones podría ampliar las recomendaciones, o incluso universalizarlas, pero lo que no es aconsejable son políticas personales que sólo conducen a desinformación y desigualdad. Se recomienda estudiar a todo recién nacido de gestante infectada a pesar de que se encuentre asintomática, siempre que la historia gestacional sea explícita o altamente sospechosa. El protocolo de estudio del recién nacido debe constar de analítica general, serología del cordón, que debe repetirse a la semana, con determinación de IgG, IgM, y si es posible IgA, punción lumbar, fondo de ojo, ecografía cerebral o bien tomografía computarizada. Puesto que IgM e IgA pueden ser falsamente negativas entre 20-30% de recién nacidos infectados, una buena opción es incluir el estudio de PCR para toxoplasma en sangre, orina y líquido cefalorraquídeo (LCR), aunque su negatividad tampoco descarta la infección del niño. La inoculación al ratón de la sangre del cordón o de la placenta tienen una sensibilidad muy baja, además de ser técnicas complejas. La Avidez de IgG al nacer tampoco es útil, ya que las inmunoglobulinas maternas ocultan las del niño. Por todo ello, en un elevado número de casos el único método diagnóstico seguro en el niño nacido de madre con toxoplasmosis gestacional es el seguimiento de la IgG. También se ha descrito un método recientemente que permite diferenciar las inmunoglobulinas maternas de las infantiles y que si se confirma podría resultar de valiosa ayuda. IMPORTANCIA DE LA TOXOPLASMOSIS Debido a que la infección primaria en los comienzos del embarazo, puede ocasionar la infección del feto en desarrollo, con lesiones incluso en el SNC (hidrocefalia, microcefalia), coriorretinitis, hepato-esplenomegalia, etc. y que además los pacientes inmunodeprimidos, presentan riesgo especial de enfermedad grave; resulta de extraordinaria importancia el estudio y control de esta enfermedad de transmisión en el hombre. Hay que aclarar que: No es lo mismo la toxoplasmosis que la infección toxoplásmica. La infección toxoplásmica aguda, adquirida después del nacimiento, es usualmente asintomática. Se puede decir que la morbi-mortalidad asociada es aparentemente baja, su ocurrencia ha estado mayormente ligada a cuadros de carácter subclínico, y el interés de esta parasitosis estaba circunscrita sólo a mortalidad neonatal y abortos, siendo muy baja la frecuencia de casos clínicos. Muy pocos humanos presentan síntomas de enfermedad, ya que con un sistema inmunológico competente, cualquier persona puede contrarrestar al parásito. De los que presentan síntomas, la mayoría tiene la forma linfoganglionar (con fiebre, inflamación de ganglios, hepatomegalia y esplenomegalia). Sin embargo, representa un importante problema para la salud pública, cuando está ligada a mujeres embarazadas (por la posibilidad de transmisión congénita) y también a individuos inmunosuprimidos. Su incidencia durante el embarazo varía según las zonas geográficas y de acuerdo a las características socio-culturales de cada país. El mayor riesgo se produce cuando la infección se contrae durante los primeros meses del mismo, presentándose abortos y malformaciones fetales. Si se produce antes o en el último tercio hay muy pocas posibilidades de tener complicaciones. Las embarazadas seronegativas (susceptibles de contraer la primoinfección) son consideradas de alto riesgo, por lo cual deben extremar los cuidados para evitar el contagio y es aquí donde procede una tarea educacional. Qué se sabe de la TOXOPLASMOSIS? 13
14 Otro grupo de población de alto riesgo son los inmunosuprimidos (trasplantados, infectados con VIH, bajo tratamiento oncológico o de enfermedades inmunomediadas). En estas personas los quistes tisulares se pueden activar al no tener el freno inmunológico, y provocar la enfermedad clínica. Es de resaltar, que esta protozoonosis se ha convertido en motivo de preocupación por parte de autoridades sanitarias internacionales de salud, por haberse constituido en una de las más importantes y frecuentes enfermedades oportunistas asociadas con SIDA. Estas instituciones recomiendan actualmente la revisión de aspectos epidemiológicos, patogenia, diagnóstico, tratamiento y prevención de la toxoplasmosis. En este contexto, las especies de animales domésticos de consumo humano han adquirido gran importancia, dado que la principal forma de transmisión de la toxoplasmosis hacia el hombre, está representada por el consumo de carne infectada insuficientemente cocida. PREVALENCIA E INCIDENCIA DE TOXOPLASMOSIS Es la zoonosis parasitaria más frecuente en los seres humanos debido a la amplia variedad de hospedadores que puede utilizar. Su hallazgo en más de 300 especies de mamíferos, reptiles y aves, incluyendo también al hombre, han hecho de esta antropozoonosis, una de las infecciones parasitarias más difundida en la naturaleza, de ahí su distribución universal, en todos los climas, y en todas las agrupaciones animales de sangre caliente. Según encuestas serológicas, generalmente esta parasitosis presenta una prevalencia del 20-60% de la población a nivel mundial, lo cual significa que en algún momento el parásito entró en el organismo y produjo la formación de anticuerpos. La incidencia y la prevalencia de la toxoplasmosis en la población en general, varían mucho de unos países a otros, incluso dentro del propio país, por lo que no se pueden hacer extrapolaciones. Las tasas de prevalencia más elevadas se encuentran en Francia y Centro América, con porcentajes superiores al 60% mientras que en Estados Unidos y Reino Unido, raramente superan el 20% (varía entre el 8-20% según áreas geográficas). La prevalencia puede ser el doble en poblaciones rurales respecto a las urbanas, y muy diferente en poblaciones de distinta raza dentro de una misma comunidad, lo cual está relacionado con los hábitos de alimentación cárnica, la ingestión de productos hortícolas contaminados con tierra, la presencia de gatos callejeros en el hogar, la ruralización de viviendas y otros factores todavía por determinar. En España desconocemos la prevalencia de Toxoplasmosis, aunque existen algunos datos aislados recogidos en distintas revisiones destacando las aportadas por Guerra et al. (1996), y Xercavins et al. (1990) que encuentran un 45%, o Pumarola et al. (1989) que refieren un 50% de gestantes con anticuerpos frente a Toxoplasma en Cataluña y en Málaga, Guerra y Fernández (1996) dan cifran más bajas, entorno al 25%. Pero, la importancia de esta enfermedad no se relaciona con su frecuencia, sino como se ha dicho ya anteriormente, con la gravedad de las lesiones y con la posibilidad de que pueda ser diagnosticada y tratada a tiempo. TOXOPLASMOSIS CONGÉNITA 1 El riesgo de la Toxoplasmosis Congénita en los neonatos se relaciona directamente con tres factores: 1. La edad gestacional en la que la mujer embarazada adquirió la infección. 2. La incidencia de la infección aguda en las mujeres durante el embarazo. 3. Los programas de salud pública. La edad gestacional en la que la mujer embarazada adquirió la infección. El riesgo de Toxoplasmosis Congénita varía mucho de acuerdo con el momento de la gestación cuando la madre se infecta y éste aumenta a medida que avanza la gravidez. El trabajo de Dunn et al. concluye que el riesgo durante el primer trimestre puede variar de 3% a 11%, en el segundo trimestre de 16% a 30% y para el tercer trimestre puede ser de 30% y más de 60%. Así, el riesgo global de transmisión es 29%, pero depende sobre todo de la edad gestacional en el momento de la infección materna. 14 Qué se sabe de la TOXOPLASMOSIS?
15 La transmisión de la toxoplasmosis es menos frecuente cuando la infección se adquiere antes de la semana 10 de gestación y es rara si la infección se ha adquirido antes de la concepción; y especialmente en las 4 primeras semanas la incidencia de infección fetal es muy baja (del 1-2%) pero cuando ocurre es muy grave para el feto. La infección materna precoz puede producir la muerte del feto intraútero y abortos espontáneos. Riesgo de secuelas clínicas en el niño infectado congénitamente: El riesgo de transmisión materno-fetal y el riesgo de secuelas en el feto se relacionan de modo inverso con la edad del embarazo. Las infecciones tempranas de la madre en la primera mitad, tienen menor riesgo de transmisión materno-fetal, pero si se contamina el feto, podrá resultar en infección congénita severa, muerte fetal in útero o aborto espontáneo. Por el contrario, en las infecciones maternas tardías en el embarazo, si el feto se infecta, por lo general resulta en neonatos que parecen normales. La frecuencia de infección subclínica en neonatos puede ser tan alta como 85% y si no se trata a tiempo, algunos de ellos desarrollarán coriorretinitis en la segunda o tercera décadas de la vida. El riesgo de desarrollar por lo menos uno de los signos clínicos clásicos (calcificaciones intracraneales, coriorretinitis y/o hidrocefalia) antes de los tres años de edad en el niño congénitamente infectado, tiene una asociación muy fuerte con el momento de la seroconversión materna. Algunos autores consideran que el periodo gestacional más crítico se presenta en las infecciones que ocurren entre las semanas 10 y 24. (Ver tabla y gráficas 1 y 2 del ANEXO). Es importante entender que el riesgo de secuelas en el neonato en infecciones maternas ocurridas temprana o tardíamente durante el embarazo es menor. Esto se debe a que el riesgo de transmisión materno-fetal durante las primeras semanas de gestación es bajo, y el riesgo de secuelas severas de infecciones tardías es menor (usualmente subclínicas) ya que ha terminado la etapa de organogénesis en el feto. En cambio si la infección ocurre en este periodo crítico, la placenta es ya grande para infectarse y al mismo tiempo el feto es demasiado inmaduro y puede por tanto sufrir daños importantes. Es muy importante recalcar que todos estos estudios sobre Toxoplasmosis congénita, se hicieron en países donde hay una estrategia de detección prenatal y que a casi todas las mujeres infectadas durante el embarazo se les suministró espiramicina para disminuir la transmisión vertical. Por tanto, estos resultados no se pueden extrapolar por completo en poblaciones donde no se utilice la misma estrategia. Es posible que los riesgos sean mayores que lo estimado donde no se usen tales conductas. Además de lo anterior, el aborto es legal en estos países, y algunos casos de infección fetal severa pudieron haber sido abortados, y no incluirse en las estadísticas. Esto puede introducir un efecto minimizador, al seleccionar las infecciones más leves, y subestimar el riesgo final de enfermedad grave, al abortar los casos severos. 2 La incidencia de la infección aguda en las mujeres durante el embarazo. No hay datos generales sobre la incidencia de la toxoplasmosis congénita y gestacional. La mayoría de estudios son de prevalencia, y existen pocos estudios epidemiológicos locales porque resultan caros, complejos y no siempre concluyentes para un mismo territorio, ya que pueden variar las cifras según el modelo de cálculo utilizado. La prevalencia de la infección por T.gondii en la gestante, y por tanto la incidencia de toxoplasmosis congénita, también difiere de unos países a otros, lo que condiciona las estrategias de prevención a adoptar. La prevalencia mundial de la Toxoplasmosis Congénita en recién nacidos puede variar de 1 a 10 por nacidos vivos (NV), sin embargo varía según el área geográfica: Suecia: 1/ NV, Brasil: 3/ NV, Francia: 10/ NV). En Estados Unidos se han estimado cifras tan dispares de Toxoplasmosis Congénita como 400 a 4000 casos anuales. En este mismo sentido un estudio realizado por la Universidad Complutense de Madrid en 1999, encuentra una incidencia real de toxoplasmosis gestacional basada en seroconversión del 1,9, que sube al 17, si se incluye la positividad de IgM, lo que confirma la disparidad de datos según los criterios aplicados. En España, la seroprevalencia en la población de mujeres en edad fértil ha disminuido en los últimos años, siendo inferior al 40%, aunque existen diferencias según las distintas áreas geográficas. Se realizó un estudio epidemiológico de la toxoplasmósis gestacional en el área de Madrid, determinando una seroprevalencia del 25,4%, mostrando un descenso importante. Los factores de riesgo asociados a la infección fueron relacionados con el consumo de carne poco hecha, la frecuencia del consumo de hamburguesas y el contacto con gatos. Los resultados obtenidos en La Rioja, de serología IgG toxoplasma, realizada a gestantes en el primer trimestre, para detectar si están inmunizadas, fueron en el año 2000 los siguientes: 57,72% negativas, 37,18% positivas y 0,95 % dudosas. No hubo casos de afectación fetal. Qué se sabe de la TOXOPLASMOSIS? 15
16 Un estudio prospectivo realizado en el área de Barcelona en 1999 sobre gestantes da una seroprevalencia del 28,6%, y describe un porcentaje de primoinfección durante el embarazo del 1,02, con una incidencia de toxoplasmosis congénita del 0,4. Hay un estudio de prevalencia del Laboratorio de Microbiología del Hospital General de Albacete. Para conocer la prevalencia se revisaron los resultados de las determinaciones de IgG anti-t. gondii en mujeres embarazadas que dieron a luz en el año En mujeres nacidas en España fue del 16% y aumentó con la edad desde el 9% en menores de 25 años hasta el 22% en mayores de 34. El 51% de las mujeres inmigrantes fueron seropositivas. La prevalencia de la infección por T. gondii en mujeres nacidas en España fue la más baja de las publicadas hasta ahora. Para estimar la incidencia se realizó un estudio longitudinal retrospectivo de mujeres seronegativas con determinaciones de IgG anti-t. gondii repetidas durante al menos un año. Se concluye que la incidencia de seroconversiones fue baja. El hecho de existir una población mayor de mujeres susceptibles (sin infección previa) no necesariamente significa un mayor riesgo de infección durante el embarazo, debido a que este riesgo también depende de la circulación del parásito en la población general. Si esta circulación disminuye en la población, la prevalencia disminuye, y aunque aumente el número de mujeres susceptibles, disminuirá la incidencia de la infección en las embarazadas. En cambio, en una población con una alta circulación del parásito, habrá un menor número de mujeres susceptibles (muchas mujeres se habrán infectado antes del embarazo), pero tendrán mayor riesgo de infectarse durante el embarazo. 3 Programas de Salud Pública instituidos para prevenir, diagnosticar y tratar la infección durante el embarazo: No se han adoptado como estrategia universal. Muchos países no han evaluado el verdadero impacto de la enfermedad en la población, y no han decidido ninguna acción al respecto. Países como Francia, con altas tasas de incidencia, tienen incluido por ley el control de las embarazadas. En los países desarrollados (como EEUU) la prevalencia de toxoplasmosis ha disminuido, y establecer un programa para descubrir la enfermedad, podría carecer de efectividad por el costo. En los países en vías de desarrollo, con tal vez una mayor prevalencia, no se conoce el impacto de la infección en los habitantes. Ciertas naciones no tienen el presupuesto para ejecutar el programa, o hay otras enfermedades más comunes, o con intervenciones más costo-efectivas sin resolver. En ausencia de estas políticas de salud pública, las soluciones se dejan a la libre decisión de los médicos y las embarazadas. En España, si se confirma un descenso de la infección no sería ni práctico ni económico, pero el impacto y el miedo de obstetras y pediatras a las formas graves, inclinan a muchos médicos por el control serológico de la gestante. PREVALENCIA E INCIDENCIA: EN ANIMALES DE PRODUCCIÓN Y SILVESTRES En España existen pocos datos sobre la incidencia porque la mayoría de estudios han sido de prevalencia y el diagnóstico del laboratorio sólo se solicita cuando se ha producido el aborto. Hay un estudio retrospectivo durante el periodo , sobre muestras llegadas de toda España al laboratorio de EXOPOL en Zaragoza, con el fin de hacer una llamada de atención sobre la problemática del diagnóstico y prevención de la toxoplasmosis congénita en el sector veterinario. Se evaluó la participación de Toxoplasma gondii en los casos de abortos y muerte perinatal (previamente notificados), de diferentes especies productivas (ovinos, caprinos, bovinos, porcinos y conejos) de diferentes regiones de España. Los animales en granjas con problemas de abortos muestran altas seroprevalencias de toxoplasmosis, lo que es indicativo de una alta exposición a los ooquistes del parásito. Los datos de prevalencias no discriminan si la infestación es aguda o crónica, y como la primoinfección suele ser asintomática en la mayoría de adultos, sólo el estudio de la dinámica de los anticuerpos específicos puede poner de manifiesto la infestación aguda de la madre y a partir de ella poder diagnosticar al feto. En este estudio, los resultados serológicos permitieron agrupar a los animales en 3 status inmunológicos: - Los verdaderos negativos: Reactores negativos a IgM y negativos a IgG (por ambas técnicas AD y ELISA). - Con infestación activa: Reactores positivos a IgM o reactores positivos a IgG con títulos 1280 UI/ml o valores E/P 200% en ELISA. - Inmunes: Todos los IgG positivos (tanto en AD como en ELISA), sin infestación activa. Los datos encontrados en este estudio revelan que: 1) Entre las hembras de ovino, caprino y bovino investigadas por aborto, el 23,1% se primo-infestaron con T.gondii en el curso de la gestación, lo que tiene valor predictivo de toxoplasmosis congénita. 16 Qué se sabe de la TOXOPLASMOSIS?
17 2) Dentro de los baremos serológicos de infestación activa, las especies ovina y caprina fueron las más comprometidas, con el 30,8% y 28,46% de reactores positivos respectivamente. Las reacciones positivas a IgM y en ELISA E/P 200% sólo fueron encontradas en estas especies, lo que indica que son focos de alta incidencia de toxoplasmosis en estas ganaderías. En la especie bovina, el 4,95% de los animales, tenían títulos muy altos de IgG, pero no se encontró infestación activa con ELISA ni reactores positivos a IgM con una encuesta epidemiológica realizada. Esto concuerda con otro estudio realizado en Las Palmas de Gran Canaria en 1993 donde de 71 explotaciones de ganado caprino, en 29 de ellas se describieron procesos abortivos y mortalidad perinatal asociada a toxoplasmosis, y sólo un 2,2% de hembras bovinas presentaban infestación activa 3) Los animales inmunes en el grupo estudiado en Zaragoza era inferior al 50% (vacas 44,3%; ovejas 33,7%; cabras 25,54% y cerdas 11,11%). En el estudio de Canarias, la seropositividad de los bovinos considerados latentes está entre el 50-55% y 63% en los caprinos, ubicándose los porcinos entre 41-44%. Por otro lado, el jabalí por su dieta, cuenta con numerosas enfermedades entre ellas la toxoplasmosis destacando junto al corzo entre los ungulados silvestres españoles, como las especies que presentan mayores seroprevalencias de anticuerpos frente a toxoplasma. En definitiva, muchas infestaciones de T.gondii son crónicas o latentes, los animales inmunocompetentes están protegidos de subsiguientes reinfecciones, por la inmunidad celular y humoral; pero son portadores de quistes en sus carnes y productos derivados, por lo que constituyen fuentes de infección de la enfermedad para el hombre y los animales cuando consumen tales alimentos con baja cocción. DIAGNÓSTICO Diagnóstico de toxoplasmosis en el ser humano El diagnóstico clínico es difícil de establecer, dada la ausencia o diversidad de sintomatología, por lo que el diagnóstico específico se fundamenta en investigar la inmunidad humoral y en detectar el parásito. Además, puede plantear problemas en el diagnóstico las reacciones cruzadas descritas con diversos agentes infecciosos, entre ellos el virus de Epstein-Barr (VEB). Son anticuerpos específicos de utilidad clínica: IgG, IgM, IgA y, menos usada y poco útil, IgE. La formación, el ascenso y la duración de los anticuerpos frente a la toxoplasmosis son totalmente diferentes a los de otras enfermedades infecciosas: La IgM puede permanecer largo tiempo, superior a los 6 meses (puede llegar a 2 años e incluso se ha descrito casos de 14 años de IgM positiva), por lo que una positividad de IgM resulta poco útil para determinar el momento en que se produjo la infección. La IgA tiene una duración más corta, entre 4 y 5 meses, a pesar de lo cual tampoco resulta demasiado precisa. La IgG se eleva lentamente durante 2-4 meses, se mantiene alta entre 12 y 24 meses y después desciende para permanecer positiva toda la vida (salvo excepciones), por lo cual tampoco una cifra elevada supone infección aguda. MÉTODOS DIAGNÓSTICOS Hasta la aparición de las técnicas de biología molecular, el diagnóstico etiológico de la toxoplasmosis se ha basado, casi exclusivamente, en la detección de anticuerpos específicos en suero, reservándose las técnicas de inoculación al ratón y el cultivo celular para las infecciones graves o potencialmente peligrosas, como la infección aguda en la embarazada, la toxoplasmosis cerebral y la infección congénita. -Demostración de anticuerpos específicos: Anticuerpos IgG La presencia de anticuerpos IgG implica que ha habido contacto entre el paciente y el parásito en algún momento de la vida. La infección aguda o relativamente reciente suele acompañarse con títulos elevados, pero en modo alguno se trata de un criterio diagnóstico definitivo. Si existe la evidencia de una seroconversión o de un aumento significativo del título de IgG entre dos muestras separadas 3-4 semanas, es diagnóstica de infección reciente. En las embarazadas y en los pacientes con inmunodeficiencia grave, el principal valor de las IgG consiste en la discriminación de individuos seronegativos. Qué se sabe de la TOXOPLASMOSIS? 17
18 Anticuerpos IgM Clásicamente, su detección fue considerada como el marcador de la fase aguda de la enfermedad. La evidencia de que los títulos de IgM anti-toxoplasma pueden permanecer detectables durante muchos meses, o incluso años, después de producida la infección primaria ha cambiado sustancialmente este concepto. En este sentido, el principal valor de las IgM radica en que su ausencia prácticamente descarta la infección reciente. La presencia de IgM, por el contrario, implica la necesidad de proseguir el estudio de un paciente determinado. Anticuerpos IgA Considerado también como un marcador de fase aguda, se ha comprobado que, si bien al igual que la IgM puede también permanecer positivo varios meses después de la primoinfección, el porcentaje de IgA residuales es mucho menor que el de las IgM. En el adulto, la cinética de la producción de IgA específica es prácticamente paralela a la de la IgM, aunque aparece un poco más tarde y desaparece más precozmente. Anticuerpos IgE Algunos estudios iniciales sugieren que las IgE antitoxoplasma aparecen pronto, al inicio de la enfermedad, y desaparecen más rápidamente que los anticuerpos de las clases IgM e IgA. Sin embargo, esta técnica no está comercializada y por el momento existe poca experiencia para establecer qué puede aportar al diagnóstico. Avidez de los anticuerpos IgG Método descrito por Hedman et al en 1989, se basa en la distinta fuerza de la unión entre antígeno y anticuerpo en la infección aguda y en la crónica. En las primeras fases predominan las IgG con baja avidez, mientras que en la infección crónica se produce la situación contraria. En realidad, existen IgG de elevada y baja avidez siempre; lo que varía es la proporción relativa de uno y otro tipo según la fase de la enfermedad. Al parecer, la presencia de anticuerpos IgG de elevada avidez en proporción superior al 30% excluye la infección aguda. Más difícil es interpretar el resultado cuando las IgG son mayoritariamente de baja avidez, ya que no se reconoce con exactitud cuándo cambia la avidez de los anticuerpos y porqué en determinadas situaciones, como por ejemplo el tratamiento específico, se alarga el tiempo de las IgG de baja avidez. Parece claro que será necesario adquirir mayor experiencia con esta técnica para establecer el verdadero valor de la misma. Las técnicas desarrolladas para el diagnóstico serológico son: 1) Dye-test (o de Sabín-Feldman): Se sigue considerando como técnica de referencia por su especificidad y sensibilidad (100%) para detectar anticuerpos IgG, pero dado el riesgo de trabajar con el parásito vivo, sólo se realiza en centros especializados de referencia. También permiten detectar anticuerpos IgG de manera satisfactoria otras dos técnicas mucho más sencillas: IFI y ELISA- IgG. 2) Inmunofluorescencia Indirecta (IFI), cuya curva de evolución de la IgG es muy similar a la obtenida en dye-test. Cabe destacar, el hecho de que en pacientes inmunocompetentes, esta técnica puede dar falsos positivos cuando están presentes factor reumatoide y anticuerpos antinucleares. 3) Técnicas inmunoenzimáticas cuali-cuantitativas (ELISA-IgG). Suelen detectarse títulos positivos (1/10) a partir de la segunda semana, que alcanzan el máximo a las 6-8 semanas ( 1/1000) y luego descienden paulatinamente, persistiendo títulos variables toda la vida (entre 1/8 y 1/1000). El aumento de títulos de anticuerpos IgG en cuatro veces con un intervalo de 3 semanas, establece el diagnóstico de toxoplasmosis aguda, pero en esta fase será más precoz la determinación de anticuerpos IgM. Los anticuerpos IgM pueden detectarse al final de la primera semana, alcanzan concentraciones máximas en pocas semanas, descienden rápidamente y se negativizan en pocos meses, aunque a veces persisten más de un año. Por tanto, una excesiva confianza en la prueba de anticuerpos IgM puede llevar a un número injustificado de diagnósticos. Los anticuerpos de tipo IgA también son indicativos de infección aguda. Las dos pruebas más eficaces para determinar IgM e IgA son: 4) Ensayo de inmunoabsorbancia ligada a enzima, ELISA IGM/IgA de captura, con una sensibilidad (91-98%) dependiendo del laboratorio que manufacturan las pruebas, y especificidad hasta 99%. 5) Técnica de inmunoabsorción por aglutinación, ISAGA-IgM/IgA, con sensibilidad (80-90%) y especificidad entre (89-95%). 18 Qué se sabe de la TOXOPLASMOSIS?
19 6)Por otro lado, la técnica ELISA de Avidez de IgG, que mide la fuerza de unión antígeno-anticuerpo, mediante el grado de disociación de la unión constituye un excelente marcador al discriminar entre IgG de reciente formación e IgG antigua. Así se diferencia los Ac de baja avidez (producidos en la fase temprana de la infección) de los de alta avidez, propios de la fase tardía). Esta determinación aproxima mucho el instante de la parasitemia, de modo que una baja avidez de IgG indica formación de anticuerpos inferior a 3 meses. De esta manera, los criterios serológicos de infección reciente o activa son: A) Seroconversión o aumento significativo en el título de alguno de los anticuerpos (lo que es raro de observar). B) Presencia de IgM, IgA y una baja avidez de IgG. DIAGNÓSTICO DE LA INFECCIÓN GESTACIONAL (en base al estudio inmunológico específico): IgG antes del embarazo: El estudio de la IgG sirve para detectar pacientes susceptibles al toxoplasma y debe hacerse antes del embarazo. Esto permite detectar a las pacientes que tienen títulos positivos de IgG, y que por tanto, ya han sufrido una infección antes del embarazo. IgG durante el embarazo: Debe realizarse el estudio de la IgG específico desde el primer control prenatal. Los resultados que pueden presentarse aparecen en un protocolo general hipotético, en una hoja del ANEXO al final del documento). En realidad puede haber pequeñas variaciones según disponibilidad de técnicas en los centros hospitalarios. DIAGNÓSTICO DE TOXOPLASMOSIS CONGÉNITA: Deben estudiarse los niños sintomáticos (aunque no se haya confirmado infección materna), y también los asintomáticos en que se ha confirmado infección aguda materna en el embarazo. El diagnóstico se hace al aislar el parásito de la sangre fetal o del líquido amniótico; en presencia de una PCR positiva en el líquido amniótico o de la IgM específica en sangre fetal positiva. 1- Se debe solicitar PCR en líquido amniótico o en sangre materna a las mujeres con sospecha de toxoplasmosis (después de la semana 20 de gestación): Seroconversión, IgG con valores en aumento e IgM positiva. 2- Serología del RN (IgM e IgG específicas) en dos determinaciones separadas en 2 semanas) 3- Fondo de ojo (para descartar coriorretinitis) y medir perímetro craneal (microcefalia). 4- El estudio RX y ECO cerebral es importante y debe realizarse mensualmente (después de la semana 30 de gestación) para investigar compromiso fetal (hidrocefalia, calcificaciones intracerebrales, ascitis, RCIU, microcefalia, hepatomegalia, calcificaciones hepáticas Después del parto debe enviarse la placenta de toda paciente que haya recibido tratamiento para Toxoplasmosis, para estudio microbiológico y patológico. Además se hace necesario utilizar métodos de detección directa del propio parásito o de sus componentes (en el caso de fetos, neonato y pacientes inmunocomprometidos) donde la respuesta inmune es de difícil interpretación. En pacientes con SIDA, no suele detectarse IgM a lo largo de la enfermedad aguda (reactivación) y la mejor ayuda diagnóstica se obtiene cuando la investigación de anticuerpos IgG es negativa, ya que prácticamente descarta la toxoplasmosis (en más del 97% de estos pacientes con toxoplasmosis cerebral resultan positivos). Se utilizan: 1) Técnicas inmunohistoquímicas, 2) Aislamiento en cultivos celulares e inoculación en animales de experimentación (ratones). 3) Técnicas de biología molecular, como la reacción en cadena de la polimerasa (PCR) para la detección del genoma del parásito, mediante amplificación de un fragmento específico del ADN, en diversas muestras del paciente (tejidos y fluidos corporales) 4) ELISA de detección de antígenos parasitarios circulantes en sangre, aunque los resultados negativos no excluyen la infección. Qué se sabe de la TOXOPLASMOSIS? 19
20 Diagnóstico de toxoplasmosis en el gato La toxoplasmosis intestinal se puede determinar por análisis de materia fecal y de sangre. Los coccidios de pequeño tamaño que se observan en un análisis coproparasitológico, pueden hacer sospechar la infección, aunque no es un diagnóstico definitivo porque hay otros coccidios pequeños, pero son para tener en cuenta. Es importante hacer estos controles periódicamente 2 ó 3 veces por año en lugares de alto riesgo como criaderos, refugios, gatos de vida libre etc. La toxoplasmosis extra intestinal se diagnostica por análisis serológicos seriados, donde se detectan los anticuerpos contra el parásito, que generalmente están muy altos. Se deben hacer varios, con intervalo de 2-3 semanas para no confundirlos con los producidos en una antigua infección ya superada. Otros métodos complementarios como la radiografía de tórax, el fondo de ojo y la citología de líquidos corporales son útiles para aproximarse al diagnóstico. CONTROL Y TRATAMIENTO DE ANIMALES PARA REDUCIR LA TRANSMISIÓN TANTO ENTRE ANIMALES COMO A SERES HUMANOS Hasta el momento no hay medicamentos para matar a T.gondii en quistes tisulares de animales ni humanos. Como el diagnóstico clínico precoz es difícil, la quimioprofilaxis es una medida factible en la prevención de los abortos por Toxoplasma en pequeños rumiantes. Así, la utilización de anticoccidiósicos mediante suministro oral, con efecto local en el intestino sobre los esporozoítos sería suficiente para controlar la ingestión de ooquistes. En este sentido se han ensayado fármacos como la monensina y el decoquinato con buenos resultados, reduciendo la parasitemia en la hembra gestante sin inhibir el desarrollo de inmunidad protectora frente a posibles reinfecciones. En lo que concierne a inmunoprofilaxis se han utilizado inoculaciones con taquizoítos inactivados con o sin adyuvante incompleto de Freund, induciendo en la oveja una elevada respuesta de anticuerpos específicos. Hasta el momento, los mejores resultados de inmunización se han obtenido con una vacuna viva a base de una mutante incompleta de Toxoplasma, denominada S48, que evita el aborto en ganado ovino. El interés de esta cepa es su incapacidad de producir bradizoítos y, por tanto, de persistir en el hospedador, confiriéndole a pesar de ello, una inmunidad protectora de tipo esterilizante. Se encuentra disponible en Nueva Zelanda, Reino Unido y Europa. Finalmente, en cuanto a profilaxis además de las medidas preventivas aplicables sobre la población felina, se harán campañas de divulgación dirigidas a los ganaderos que deben conocer el riesgo que conlleva la presencia de gatos en las explotaciones. Es también conveniente incinerar las placentas y los fetos ovinos y caprinos abortados. El control higiénico-sanitario se basa en evitar la entrada de gatos en las explotaciones, prevenir el canibalismo mediante la retirada inmediata de animales muertos, controlar la proliferación de roedores mediante raticidas, mantener los piensos y forrajes a cubierto y evitar el suministro de desperdicios crudos a los cerdos. En las explotaciones extensivas y semiextensivas la contaminación del terreno anejo a las granjas, con ooquistes o animales portadores muertos (roedores principalmente y aves en menor medida) constituye una fuente de infección importante. En este sentido, la frecuencia de explotaciones porcinas con toxoplasmosis es significativamente mayor entre las de régimen abierto o semiabierto que en régimen cerrado. En el caso del ganado porcino, los anticoccidiósicos, principalmente los compuestos de pirimetamina más sulfaquinoxalina, están indicados frente a la toxoplasmosis clínica porcina, tanto con fines terapéuticos como profilácticos. En el plano inmunoprofiláctico, se han realizado ensayos vacunales con taquizoítos vivos de cepas no persistentes de Toxoplasma gondii, con buenos resultados. En la medida que los gatos son importantes eliminadores de ooquistes en sus heces, los intentos que se han hecho en el pasado para inmunizar a los gatos han requerido la infección primaria de los mismos, seguido de tratamiento quimioprofiláctico; lo cual genera el fenómeno que se pretende evitar (la eliminación de ooquistes), y por tanto se considera deficiente. Una vacuna viva con bradizoitos, que incluye una cepa mutante de T.gondii, T.263 se está desarrollando en los EE.UU., para reducir la eliminación de ooquistes por los gatos. Esta vacuna inmuniza al 84% de gatos sin necesidad de quimioprofilaxis, y consigue un nivel de inmunización similar al tratamiento usado en EE.UU. (Pat. Nº ). 20 Qué se sabe de la TOXOPLASMOSIS?
21 TRATAMIENTO EN HUMANOS El tratamiento de la infección por T. gondii en la mujer embarazada, no es necesario para ella. Se administra para prevenir y/o tratar la infección por T. gondii del feto, lo cual podría reducir la incidencia y severidad de la infección fetal. Actualmente son numerosos los medicamentos utilizados en el tratamiento de la toxoplasmosis. Entre ellos disponemos de antagonistas del ácido fólico y para-amino- benzoico (pirimetamina, sulfamidas, sulfadiazina, sulfadoxina, sulfametoxazol, dapsona), asociaciones (pirimetamina-sulfadiazina, pirimetamina-sulfadoxina), folinato cálcico, macrólidos y lincosánidos (espiramicina, roxitromicina, azitromicina, claritromicina, clindamicina) y una variedad de fármacos que incluyen las ciclinas, metotrexato, trimetrexato, piritrexina, artemisina, arprinocida, hidroxinaftoquinona, inmunomoduladores, ciclosporina A, 5-fluorouracilo, corticoides. Aunque existen varios fármacos que han probado ser eficaces, de la mayoría se tiene poca o nula experiencia en humanos. El cotrimoxazol (trimetoprim más sulfametoxazol) ha probado ser eficaz en animales, in vitro, pero apenas hay datos de su eficacia en toxoplasmosis humanas, y en todo caso su actividad es inferior a la de la asociación (pirimetamina mas sulfadiazina). El trimetrexate (un potente inhibidor de la dihidrofolato reductasa) presenta una potente actividad in vitro e in vivo frente a T.gondii, con una buena respuesta inicial, aunque los pacientes presentan una rápida recaída cuando termina el tratamiento. Los corticoides no están recomendados, pues pueden favorecer la diseminación de taquizoítos o reactivar focos latentes. Sin embargo, en los casos de retinocoroiditis, en los que los fenómenos de hipersensibilidad son importantes en el desarrollo de las lesiones, está justificado su empleo. Fuera de esta indicación los corticoides están contraindicados en el tratamiento de la toxoplasmosis. En definitiva, no existe ningún tratamiento totalmente satisfactorio para combatir la toxoplasmosis, aunque se ha conseguido mejoría clínica con alguno de ellos: Entre los principios activos utilizados en humanos, destaca el uso de la combinación de sulfadiazina y pirimetamina, siendo éste último el tratamiento de elección por su efecto sinérgico, excepto en mujeres embarazadas con infección aguda, donde se sustituye por espiramicina (por ser la pirimetamina embriotóxica antifólico- y está contraindicado en las primeras 16 semanas de embarazo. Aún así, es posible que se obvie la contraindicación, y se instaure tratamiento de elección si se considera de ayuda para disminuir las secuelas en el feto. PIRIMETAMINA Mecanismo de Acción: Inhibición altamente selectiva (efecto deleznable en mamíferos) de la dihidrofolato-reductasa, impidiendo la síntesis de tetrahidrofolato. Debido al sinergismo, la pirimetamina se suele usar combinada con sulfadoxina, antibiótico análogo del PABA (Combinación: Fansidar ), o también con otra sulfonamida adecuada. Farmacocinética: Buena absorción oral aunque lenta. Difunde a los tejidos, se acumula en el riñón, hígado, pulmón y bazo y pasa a leche materna, mantiene concentraciones terapéuticas en sangre hasta 2 semanas después de suspendida. Se metaboliza parcialmente en el hígado. Toxicidad: Administrada diariamente durante periodos prolongados puede provocar frecuentemente deficiencia de ácido fólico, manifestada por trastornos gastrointestinales, insomnio, erupciones cutáneas, y lo que es más importante, anemia megaloblástica y depresión de la médula ósea. Al tratamiento suele añadirse folinato cálcico para evitar estos efectos adversos hematológicos. El ácido folínico, es la forma activa del ácido fólico (un factor nutricional esencial para el organismo, pues participa en varios procesos metabólicos, como la síntesis de purinas, del nucleótido pirimidina y el metabolismo de los aminoácidos). El ácido folínico liberado del folinato cálcico, se convierte con rapidez en el ácido 5-metiltetrahidrofólico activo (5-metil THF) "rescate con folinato cálcico". A diferencia del ácido fólico, el ác. folínico (leucovorina -sal cálcica-no necesita ser reducido por la dihidrofolato reductasa; y por tanto los bloqueadores de esta última no tienen ningún efecto sobre el folínico. Por ello se utiliza para disminuir la toxicidad y contrarrestar la acción de los antagonistas del folato. Qué se sabe de la TOXOPLASMOSIS? 21
22 En realidad, no existe evidencia de que todos estos tratamientos sean efectivos in vivo. La espiramicina ni siquiera alcanza la dosis mínima inhibitoria en líquido amniótico y su actividad parece quedar limitada a los taquizoítos, pues no atraviesa la membrana del quiste. Y con respecto a la asociación sulfadiazina y pirimentamina aunque es eficaz para inhibir la replicación de trofozoítos, sólo se ha demostrado que disminuye el número de quistes en la placenta y que la tasa de IgG del recién nacido (RN) es cuando la madre fue tratada durante la gestación; pero no se demuestra la disminución de los signos clínicos ni de su gravedad, ni de la tasa de transmisión materno-fetal, si el tratamiento es prenatal. El uso de sulfadiazina y pirimentamina en el periodo antenatal, está basado en la efectividad real sobre la disminución de secuelas a largo plazo en el RN, pero en realidad el bradizoíto, que sería la forma de T.gondii que se encuentra en los tejidos después de la infección, no es susceptible de antibióticos, ni siquiera in vitro. Por todo ello, el manejo de la infección por Toxoplasmosis durante la gestación y en el neonato se realiza en la actualidad mediante elaboración de algoritmos que dependerán del especialista y del hospital, de acuerdo con las recomendaciones de la Sociedad Española de Ginecología y Obstetricia (SEGO) y de la Cochrane. Los adultos inmunocompetentes con toxoplasmosis aguda, no requieren tratamiento, a menos que los síntomas sean anormalmente intensos o persistentes, o que la infección se haya adquirido a través de una transfusión o por un accidente de laboratorio. La Toxoplasmosis congénita, la coriorretinitis, y la que afecta a embarazadas e inmunodeprimidos deben tratarse siempre. La valoración de la eficacia de sulfadiazina y pirimentamina en pacientes con capacidad inmunológica se ha limitado por la gran variabilidad de la evolución clínica y la frecuencia de mejoría espontánea. Sin embargo el tratamiento específico puede acortar el periodo sintomático de fiebre y fatiga, aunque no la linfadenopatía. Generalmente, aunque depende del especialista, se administran 100 mg de pirimetamina el primer día, seguidos de mg/día en inmunocompetentes, o mg./día en inmunodeprimidos; y sulfadiazina (4-6 g./día divididos en 4 tomas, Debe administrarse ácido folínico (10-15 mg/día para antagonizar la acción antifolínica de estos fármacos sobre las células humanas (megaloblastosis, mielosupresión) sin inhibir su acción antiparasitaria (el ác. fólico sí inhibiría su acción antitoxoplásmica y no se debe administrar). En el embarazo, para el tratamiento de la toxoplasmosis aguda se administra espiramicina a dosis de 3 g/día. También se utiliza sulfadiazina asociada a pirimitamina pero tras el primer trimestre. En el Anexo final aparecen unas tablas con ejemplos de algunas pautas de tratamiento, tanto en mujeres embarazadas como en el recién nacido y en la encefalitis toxoplásmica. Adultos / niños 6 años: Pirimetamina (inicialmente 50 mg, seguidos de 25 mg/día). Y sulfadiazina (37,5 mg/kg/6h.) Niños de 2 a 6 años: Pirimetamina (inicialmente 25 mg, seguidos de 12,5 mg/día). Y sulfadiazina (37,5 mg/kg/6h.) El uso de una sulfonamida alternativa puede requerir ajuste de dosis. La duración del tratamiento generalmente es de 3 a 6 semanas. Si se indica terapia adicional, intercalar 2 semanas entre los tratamientos. En cuanto a si hay que tratar a los niños asintomáticos hasta que la evolución de la IgG determine la posible infección, los investigadores se inclinan a realizar un tratamiento precoz desde el nacimiento. En los recién nacidos sin diagnóstico, es aconsejable una buena información del embarazo y un estudio completo del recién nacido. Si el niño está asintomático y el estudio es negativo es importante conocer el mes de la infección gestacional: Si la infección materna ocurrió en las primeras semanas, es difícil que el recién nacido esté infectado, pues el daño fetal en esos momentos es habitual. En este caso, se puede esperar la evolución de la IgG sin tratamiento. Si por el contrario, la infección materna tuvo lugar en el tercer trimestre, debe instaurarse un tratamiento temprano, aunque el laboratorio no confirme la infección, ya que en ese periodo gestacional se producen con frecuencia infecciones neonatales subclínicas. En cualquier caso, se decida o no tratar al niño nacido, de madre con toxoplasmosis gestacional confirmada o posible, debe ser vigilado y controlado hasta que la IgG se haga negativa. Existe información evidente de que muchos casos asintomáticos al nacer terminan por presentar lesiones oculares años más tarde, y sólo la negatividad de la IgG permite tener seguridad de que esto no va a ocurrir. La asociación de pirimetamina con sulfadiazina, o con clindamicina ha sido eficaz en pacientes con inmunodepresión y afección diseminada para controlar la disfunción específica de órganos. En esta fase del parásito, parece ser de gran utilidad los nuevos tratamientos con hidroxinaftoquinona (atovaquona) y azitromicina, actuando tanto sobre las formas 22 Qué se sabe de la TOXOPLASMOSIS?
23 replicativas como frente a los quistes, es una alternativa en la toxoplasmosis crónica grave y que ha sido utilizada en casos de toxoplasmosis cerebral en pacientes con sida con resultados aceptables, como terapia salvadora y escasos efectos secundarios. ATOVAQUONA Reduce el riesgo de recaídas en las encefalitis por T. gondii y es considerada como una alternativa al tratamiento convencional (pirimetamina + sulfadiazina o clindamicina) Mecanismo de acción: No es un antagonista del folato. La actividad antiprotozoaria de la atovaquona se debe muy probablemente a su capacidad para inhibir selectivamente el transporte de electrones de la mitocondria con lo que se inhibe la síntesis de las pirimidinas. El sitio donde se lleva a cabo esta inhibición parece ser el complejo del citocromo bc1. No se conoce el mecanismo de su acción frente al Toxoplasma gondii. A diferencia de las células de los mamíferos que pueden utilizar pirimidinas prefabricadas, los protozoos necesitan de estas sustancias para su vida. Por este motivo, la atovaquona mata los organismos en lugar de inhibir su crecimiento como hacen otros fármacos antiprotozoarios. Para el tratamiento de la encefalitis toxoplásmica aguda y crónica debida al Toxoplasma gondii, se recomienda para adultos y adolescentes 750 mg cuatro veces al día. Los datos existentes sugieren que estas dosis son bien toleradas para la erradicación de la toxoplasmosis en pacientes con SIDA. Existen datos limitados que sugieren que la atovaquona puede ser eficaz en la toxoplasmosis ocular. Para la profilaxis de la toxoplasmosis, se recomiendan dosis de 1500 mg una vez al día con o sin pirimetamina y leucovorina como terapia alternativa. También, según estudios realizados en ratones inmunodeprimidos, el interferón (IFN) alfa y gamma, y las interleucinas ofrecen una respuesta satisfactoria, ante la infección aguda, aplicadas en dosis inmunomoduladoras, de haberse realizado quimioterapia, con buenos resultados. CONCLUSIONES La toxoplasmosis es una zoonosis parasitaria causada por Toxoplasma gondii y constituye una de las infecciones más frecuentes en los seres humanos en todo el mundo. Es además una infección con posibilidad de transmisión vertical, en la que predominan las formas subclínicas. Sólo la infección primaria en la madre se ha asociado con esta vía de transmisión, y dependiendo de las semanas de gestación en las que se encuentre la gestante, tiene distinta relevancia, en cuanto a las alteraciones fetales que puede producir. El mayor riesgo se produce cuando la infección se contrae durante los primeros 5 ó 6 meses del mismo, presentándose abortos y malformaciones. Las embarazadas seronegativas (susceptibles de contraer la primoinfección) son consideradas de alto riesgo, por lo cual deben extremar los cuidados para evitar el contagio; y es aquí donde procede una tarea educacional. También cabe destacar, que una vez que se produce la infección por el parásito, éste persiste en forma de quistes en el tejido muscular, y que el mantenimiento de la integridad de éstos depende de la funcionalidad del sistema inmune, y por tanto la inmunosupresión puede facilitar la rotura de los mismos y la reactivación de la infección. Es por ello que otro grupo de población de alto riesgo son los pacientes inmunosuprimidos (infectados con VIH, bajo tratamiento oncológico o de enfermedades inmunomediadas). Por tanto, se puede decir que la toxoplasmosis sería una enfermedad intrascendente si no fuera por estas dos situaciones concretas: La reactivación de la forma latente en los individuos muy inmunodeprimidos y la afectación fetal por la primoinfección de la mujer embarazada. Hasta el momento, se conoce bien la biología del parásito y su ciclo vital, pero prácticamente todos los demás aspectos de la toxoplasmosis congénita generan una gran confusión. Por otro lado, al no ser una enfermedad de declaración obligatoria, el conocimiento de los datos epidemiológicos se ve altamente dificultado. Qué se sabe de la TOXOPLASMOSIS? 23
24 En cuanto a las pruebas de laboratorio, existe una gran variedad de métodos, EIA: enzimoinmunoensayo; MEIA: enzimoinmunoensayo de micropartículas; ELFA: enzimoinmunoensayo fluorescente. IQL: inmunoquimioluminiscencia; ECLIA: enzimoinmunoensayo electroquimioluminiscente; IFI: inmunofluorescencia indirecta; ICMA: inmunocromatografía de membrana; etc. La selección del más apropiado en cada caso, se basará en evaluaciones técnicas que demuestren su sensibilidad y especificidad, optando cada laboratorio por técnicas automatizadas o manuales de aglutinación más sencillas de realizar, pero en este último caso debe tenerse en cuenta el fenómeno prozona, que puede producirse en muestras con alta concentración de anticuerpos, dando un resultado falsamente negativo si no se repite el estudio con dilución previa de la muestra. La prevención de la infección congénita por T.gondii se basa en evitar la infección en la gestante (prevención primaria) y en el diagnóstico precoz de la primoinfección, con el fin de adoptar medidas para disminuir la transmisión (prevención secundaria). La prevención terciaria (cribado neonatal) en nuestro país todavía está en evaluación, y existe controversia sobre la pertinencia del cribado prenatal, debido a las dudas surgidas no sólo a nivel del impacto sanitario de estos programas y el coste derivado de los mismos, sino también por los problemas diagnósticos que plantea la realización de pruebas serológicas encaminadas a descartar la primoinfección en gestantes seropositivas. En cuanto a la prevención primaria, decir que respecto a los animales de consumo humano, hay pocos estudios en España sobre prevalencia e incidencia de toxoplasmosis. Un estudio retrospectivo durante el periodo , sobre muestras llegadas de toda España al laboratorio de EXOPOL en Zaragoza muestra que los animales inmunes en el grupo estudiado era inferior al 50%: vacas (44,3%; ovejas 33,7%; cabras 25,54% y cerdas 11,11%). Por otro lado, la carne cruda de ungulados silvestres españoles como el corzo y el jabalí, son las especies que presentan mayores seroprevalencias de anticuerpos frente a toxoplasma. Muchas infestaciones de T.gondii son crónicas o latentes en los animales inmunocompetentes estando protegidos de reinfecciones, pero son portadores de quistes en sus carnes y productos derivados, por lo que constituyen fuentes de infección de la enfermedad para el hombre cuando se consumen tales alimentos con baja cocción. Existe consenso sobre la eficacia de no tener contacto con gatos, no comer carne poco cocida y aunque la congelación no evita el riesgo en su totalidad, sí lo disminuye, por tanto si es posible, congelar previamente (-20ºC durante 24 horas), lavar verduras y frutas y utilizar guantes en los trabajos de jardinería o cuando se manipule la tierra que ha estado en contacto con las deyecciones de los gatos. La adopción de estas medidas durante la gestación puede disminuir hasta un 60% la incidencia de primoinfecciones por este parásito, siendo recomendable que la embarazada seronegativa reciba estas instrucciones oportunas y a ser posible por escrito en cuanto a la adopción de medidas higiénicas y culinarias. Además en las gestantes seronegativas, se realizará un control serológico trimestral para poder detectar a aquéllas que experimenten una seroconversión, y en su caso adoptar las medidas necesarias para evitar la transmisión al feto. La prevalencia de la infección por T.gondii en la gestante varía según las diferentes áreas geográficas. Los estudios llevados a cabo en países con una seroprevalencia baja (Dinamarca, Suecia y Finlandia) frente a T.gondii, encuentran una tasa de infección primaria en las gestantes seronegativas del 0,5 al 3, mientras que países con una seroprevalencia más elevada (Francia, Bélgica y Austria) la tasa de infección aguda durante el embarazo puede ascender al 8-9. Y aunque su tendencia al descenso es un hecho, no es posible asumir que la mayor parte de la población de mujeres en edad fértil es susceptible. No existe consenso con respecto a las estrategias de prevención de la Toxoplasmosis Congénita en el mundo. En España, hasta disponer de más información o que se produzcan cambios epidemiológicos es recomendable continuar con el cribado serológico de la toxoplasmosis, con el planteamiento que se considere más adecuado, ya que no existe un criterio unánime al respecto. Asimismo sería conveniente incidir en la importancia de realizar el primer control serológico (investigación de anticuerpos IgG antitoxoplasma) en la consulta preconcepcional lo antes posible y dentro del primer trimestre de la gestación. Respecto al tratamiento de esta parasitosis, también es motivo de controversia, debido a que no existe ningún tratamiento totalmente satisfactorio y aunque existe varios fármacos que han probado ser eficaces, de la mayoría se tiene poca o nula experiencia en humanos y de otros sólo se ha podido conseguir una mejoría clínica. Sólo deben tratarse las infecciones agudas que presenten una sintomatología grave. La necesidad y duración dependerá del cuadro clínico. En la mayoría de adultos con competencia inmunológica y afección linfadenopática sin ninguna otra anomalía, no se requiere tratamiento específico. Los pacientes con síntomas constitucionales graves o prolongados, con 24 Qué se sabe de la TOXOPLASMOSIS?
25 disfunción de órganos específicos y tal vez los infectados por inoculación directa (personal de laboratorio y receptores de transfusiones) también deben tratarse. Se debe tratar a la madre en caso de infección aguda y al recién nacido con Toxoplasmosis Congénira durante un año, así sea la infección subclínica. El tratamiento de elección es la pirimetamina asociada normalmente a una sulfamida (sulfadiazina). Ambos compuestos inhiben el metabolismo de los folatos y actúan sinérgicamente para destruir los trofozoitos siendo capaces de controlar la fase de proliferación del parásito; sin embargo, no actúan sobre los quistes tisulares. En esta fase del parásito, parece ser de gran utilidad los nuevos tratamientos con hidroxinaftoquinona (atovacuona) y azitromicina, actuando tanto sobre las formas replicativas como frente a los quistes, siendo una alternativa en la toxoplasmosis crónica grave. La espiramicina es menos tóxica, aunque menos activa que la pirimetamina, y puede emplearse asociada con ésta o con las sulfamidas. Desafortunadamente no atraviesa la placenta y por tanto no trata al embrión (feto), pero se puede usar en el recién nacido (RN) en caso de Toxoplasmosis Congénita. Aunque el tratamiento más utilizado es la combinación de pirimetamina y sulfadiazina, más el ácido folínico para evitar los efectos tóxicos de la pirimetamina. El uso de sulfadiazina y pirimentamina en el periodo antenatal, está basado en la efectividad real sobre la disminución de secuelas a largo plazo en el RN, pero en realidad el bradizoíto, que sería la forma de T.gondii que se encuentra en los tejidos después de la infección, no es susceptible de antibióticos, ni siquiera in vitro. Y los corticoides están contraindicados salvo en los casos de retinocoroiditis donde únicamente se justifica su empleo. Por todo ello, el manejo de la infección por Toxoplasmosis durante la gestación y en el neonato se realiza en la actualidad mediante elaboración de algoritmos que dependerán del especialista y del hospital, de acuerdo con las recomendaciones de la Sociedad Española de Ginecología y Obstetricia (SEGO) y de la Cochrane. REFERENCIAS Villa Espinosa et al. Toxoplasmosis gestacional y congénita en los animales de producción. Una mirada al diagnóstico. En: Rodríguez PE. Seroprevalencia de la Toxoplasmosis en las especies humana, caprina y bovina en Gran Canaria. Base de datos de tesis doctorales (TSSEO) Universidad de Las Palmas de Gran Canaria. Biblioteca Digital Gaus, C.B., et al. (2005). Seroprevalence of Toxoplasma gondii in (sus scrofa) from Spain. Vet. Parasitol., 15, Fernández-Llario, P. et al. 2005b. Jabalíes y toxoplasmosis, un nuevo problema para la salud humana y animal? Parte I. Presencia del parásito en los jabalíes y factores que condicionan la incidencia. Caza Mayor 78: Martínez-Fernández, A.R., Fuentes Corripio, I. *, Rodríguez Ferrer, M.* y Domingo Fernández, C.J.*: Departamento de Parasitología. Facultad de Farmacia. Universidad Complutense. *Centro nacional de Microbiología. Instituto de Salud Carlos III, Majadahonda. Madrid. Toxoplasmosis. Medicine 1998, 7(81): MARTÍNEZ PARAJÓ, E. et al. (1999). Seroprevalencia de la infección humana y animal por Toxoplasma en Galicia. VI Congreso Ibérico de Parasitología. Córdoba. José Marín Sánchez Murillo. Jefe de Sección de Parasitología Toxoplasmosis en animales de renta. Aspectos generales. Laboratorio Regional de Sanidad Animal. Junta de Extremadura. Frenkel, J.K., and Smith, D.D. Inmunization of cats against shedding of Toxoplasma oocyst. Journal of Parasitology 68 (5): , Choromanski L, Freyre A, Brown K, Popiel I, Shibley G. Safety aspects of a vaccine for cats containing a Toxoplasma gondii mutant strain. Miles Inc., Agriculture Division, Shawnee Mission, KS PMID: [PubMed - indexed for MEDLINE] Buxton D, Maley SW, Wright SE, Rodger S, Bartley P, Innes EA. Ovinos toxoplasmosis: transmisión, el resultado clínico y el control. PMID: [PubMed - indexed for MEDLINE] PMID: [PubMed - indexado para MEDLINE] Dubey JP.Estrategias para reducir la transmisión de Toxoplasma gondii a los animales y los seres humanos. PMID: [PubMed - indexed for MEDLINE] PMID: [PubMed - indexado para MEDLINE] Alejos Monzón, A., Ezquerro Ezquerro, A., Olivan Soto, V., Hernández Hernández, J. y Manzanera Bueno, G: Servicio de Obstetricia y Ginecología. Complejo Hospitalario San Millán-San Pedro Logroño. Toxoplasmosis en el Qué se sabe de la TOXOPLASMOSIS? 25
26 embarazo: Prevención y tratamiento. Protocolos de seguimiento en el Hospital San Millán San Pedro. Zubía Monográfico núm.12 (2000), pp ISSN Fuentes Corripio, Isabel de (2004) Desarrollo de técnicas de ADN para el diagnóstico y caracterización de "Toxoplasma gondii" : aplicación a estudios epidemiológicos. Tesis Doctoral.Texto completo disponible en URL Oficial: González González, N.L. y González Lorenzo, A.: Obstetricia y Ginecología Hospital Universitario de Canarias Facultad de Medicina. Universidad de La Laguna. Programas de prevención de la toxoplasmosis congénita. Actitud diagnóstico-terapéutica. BSCP Can Ped 2003; 27 - nº1. Por qué toxoplasmosis?. Publicado en Correofarmaceutico.com el 23/02/2004. "Estudios serológicos en la prevención de la infección congénita y perinatal". Documento científico 2004 en: /protocolos/microbiología/cap4a.htm Díaz-Suárez, O., Parra A.M. y Araujo-Fernández M.: Cátedra de Parasitología. Facultad de Medicina, Universidad del Zulia, Maracaibo. Venezuela. Seroepidemiología de la toxoplasmosis en una comunidad marginal del Municipio Maracaibo, Estado Zulia, Venezuelsa. Invest. Clín v.42 n.2 maracaibo abr Bartolomé Alvarez, J., Martínez Serrano, M. Moreno Parrado, L. Lorente Ortuño, S. y Crespo Sánchez M.D.: Laboratorio de Microbiología. Complejo Hospitalario Universitario De Albacete. Prevalencia e incidencia de la infección por Toxoplasma gondii en mujeres en edad fértil en Albacete ( ). Rev. Esp. Salud Pública [online]. 2008, vol. 82, no.3 [citado ], pp Disponible en: < ISSN Del Castillo Martín, F. Unidad de Enfermedades Infecciosas. Hospital Infantil La Paz. Madrid. España. Toxoplasmosis congénita. Una enfermedad con demasiados interrogantes. An Pediatr (Barc). 2004;61: MAINAR et al. (1996). Prevalence of agglutinating antibodies to Toxoplasma gondii in small ruminant of the Madrid region. Veterinary Research Comunications, 20: MARCA et al. (1996). Prevalencia de toxoplasmosis ovina en la provincia de Zaragoza. Medicina Veterinaria, 13: LOSTE et al. (1995). Toxoplasmosis ovina : detección de anticuerpos por inmunofluorescencia indirecta en la zona oeste de la provincia de Zaragoza. VI Jornadas sobre producción animal. Vol. Extra nº 16, Tomo II: López-Franco, E.1, Gracia M.1, Lozano P.1, Benito R.2, Pardo J.1, Lalana M.P.3 1 Departamentos de Pediatría y 2 Microbiología. Hospital Clínico Universitario de Zaragoza.3 A. Primaria. Zaragoza. "Prevención de toxoplasmosis durante el embarazo". Sierra López y Doreste Alonso J.L. Epidemiología y prevención de la leptospirosis, toxoplasmosis y rabia. En: En: Piédrola Gil. Medicina Preventiva y Salud Pública. Barcelona. 9ª edición. Masson P Martínez Comendador J.M. y Martínez-Vazquez J.M. Toxoplasmosis. En: Rodés Teixidor J, Guardia Massó J dir. Medicina Interna. Barcelona: Masson; p Montoya J.G. and Liesenfedd O. The Lancet. Vol June 12, Base de Datos del Medicamento del Consejo General de Colegios Oficiales de Farmacéuticos (BOT PLUS). 26 Qué se sabe de la TOXOPLASMOSIS?
27 ANEXO Qué se sabe de la TOXOPLASMOSIS? 27
28
29 GLOSARIO (algunos términos específicos para Toxoplasmosis) Bradizoítos: De brady, lento. Zoítos de reproducción lenta. Se diferencian de los taquizoitos en que carecen del ciclo del ácido tricarboxílico y cadena respiratoria funcional en su mitocondria. Infectan mejor por la vía del carnivorismo. Esporozoítos: Zoitos infectantes formados dentro de las esporas (esporocistos) en el interior de oooquistes. Incidencia: Se define como el número de nuevos casos que se producen en un periodo determinado de tiempo. Por convención se suele expresar en Nº de nuevos casos al año por cada habitantes. Ooquiste: Forma de transmision post reproducción sexual de Toxoplasma en el intestino de felinos. Es una forma de resistencia con doble membrana, y encierra el zigoto formado por la fecundación del macrogameto por el microgameto. En el suelo esporula, la célula (esporonte) se divide en dos esporoblastos y cada uno de estos, se transforma en una espora con cuatro esporozoitos en su interior. Quiste tisular: Forma de resistencia, que en el caso de infección por Toxoplasma, contiene bradizoítos y es capaz de persistir indefinidamente en los tejidos del huesped (sobre todo en miocardio, músculo esquelético y cerebro) de los individuos infectados. Screening serológico: Estrategia de tamizaje, filtro o cribado, mediante pruebas serológicas de despistaje para el control de la toxoplasmosis al inicio de la gestación y en neonatos, con el fín de instaurar medidas preventivas muy estrictas destinadas a evitar el contagio en las seronegativas (susceptibles), o bien instaurar tratamiento y mejorar o evitar las secuelas en los niños en caso de infección materna y/o fetal. Seroprevalencia: Porcentaje de personas en un lugar y tiempo determinados que tiene anticuerpos contra alguna enfermedad, lo que indica que ha tenido contacto con un agente infeccioso específico. Taquizoítos: De tachos, rápido. Forma de transmisión asexual invasiva, típica de las formas agudas de la infección por Toxoplasma. Son zoítos de reproducción rápida en pseudoquistes (clones o agrupamientos) en cualquier célula distinta a la del epitelio intestinal. Provoca una fuerte respuesta inflamatoria, destrucción de tejido y por lo tanto manifestaciones clínicas. Los taquizoitos se transforman en bradizoitos bajo la presión de la respuesta inmune para formar quistes. Qué se sabe de la TOXOPLASMOSIS? 29
30 TABLAS Técnicas Dye test Aglutinación directa (AD) Inmunofluorescencia indirecta (IFI) Fijación de complemento Hemaglutinación indirecta (HAI) Látex ELISA ELISA avidez Diagnóstico serológico Antígeno utilizado Trofozoitos vivos Trofozoitos fijados Trofozoitos fijados Trofozoitos Lisados Trofozoitos Lisados Trofozoitos Lisados Antígenos citoplasmáticos y de membrana Antígenos de membrana Anticuerpos detectados IgG + IgM IgG + IgM IgG ó IgM IgG + IgM IgG + IgM IgG + IgM IgG, IgM ó IgA (Según los conjugados enzimáticos utilizados) IgG Diagnóstico parasitológico directo Diagnóstico Técnica a) Tinción de Glemsa, hematoxilina-eosina b) Inmunohistoquímica c) Inmunofluorescencia d) Microscopia electrónica Detección Valoración Histológico Trofozoitos y quistes Rápido pero poco sensible siendo b y c las técnicas más específicas y sensibles Aislamiento En cultivo celulares Inoculación animales de experimentación (ratón) Efecto citopático (8-30 días) Trofozoitos intra y extra celulares por Glemsa o IFI A las 4-6 semanas seroconversión y quistes cerebrales Rápido (a partir del tercer día post-inoculación hasta 30). Específico. Sensibilidad variable Mayor sensibilidad Lento Detección del genoma del parásito Técnicas de biología molecular. PCR ADN de Toxoplasma gondii Sensibilidad similar o mayor que aislamiento en ratón. Específico. Rápido. Detección de antígenos ELISA de detección de antígenos Antígenos parasitarios circulantes en fluidos corporales Específico. Sensibilidad variable PCR: reacción en cadena de la polimerasa. Tamización serológica inicial con pruebas comerciales disponibles Resultados IgG (-) / IgM (-) IgG (+) / IgM (-) IgG (+) / IgM (+) IgG (-) / IgM (+) Comentarios La madre no se ha expuesto al parásito. El feto no está a riesgo de infección congénita a menos que la madre se exponga al parásito durante el embarazo. Reforzar medidas de educación sobre cómo evitar la exposición a Toxoplasma gondii o infección primaria Repetir si es necesario IgG/Igm cada mes o trimestre. La madre se expuso al párasito antes del embarazo (infección crónica adquirida antes de la gestación), si las pruebas se obtuvieron en las pimeras 24 semanas de gravidez. La interpretación de estos resultados en el tercer trimestre es un poco más difícil pues la IgM pudo haber sido positiva inicialmente y hacerse negativa hacia el final del embarazo. El feto no está a riesgo de Toxoplasmosis Congénita a menos que la madre esté inmunosuprimida (por ejemplo, SIDA) Infección aguda vs infección crónica. Por consiguiente se sugiere una prueba de avidez Avidez alta (>30% o 50% según el fabricante de la prueba): infección crónica adquirida antes de la gestación. (Si la prueba se obtuvo durante el periodo inicial de la gestación para el cual el kit de avidez puede excluir infección aguda). Avidez baja o equívoca: Hay posibilidad de infección aguda. El feto podría estar a riesgo de TC. Requiere evaluación fetal. Hay dos posibilidades: la infección es muy temprana, o la lgm es un falso positivo. Repetir lgg / lgm en tres a cuatro semanas después de la primera muestra. Di la lgg se vuelve positiva (+) probablemente infección aguda-seroconversión. Si la G permanece negativa (-) lo más probable es un falso positivo. 30 Qué se sabe de la TOXOPLASMOSIS?
31 Niños nacidos de mujeres que adquirieron la infección de T. gondii durante el embarazo Infection acquired First trimester Second trimester Third trimester Outcome in offspring Congenital toxoplasmosis Subclinical Clinically apparent Perinatal death or stillbirth 9.0% 22.2% 77.8% 5.0% 27.0% 74.4% 15.6% 2.0% 59.0% 89.8% 10.2% 0% Resumen de los tres conceptos de riesgo de transmisión y de secuelas para el niño nacido con infección congénita. Semanas de gestación a la seroconversación materna Riesgo de infección congénita a (%) Riesgo de desarrollar signos clínicos dada la infección congénita b (%) Riesgo de desarrollar signos clínicos dada la infección materna c Seis semanas antes la concepción Virtualmente 0 d >80 Muy bajo riesgo (Muy bajo riesgo de transmisión) Concepción a la semana Bajo riesgo (bajo riesgo de transmisión) Semanas 10 a Alto riesgo (se incrementa la transmisión y los signos clínicos) Semana 30 al parto Bajo riesgo (infección congénita es frecuente pero usualmente subclínica) a. b. c. d. Riesgo de infección congénita (transmisión materno-fetal) (Gráfica 1). Riesgo de desarrollar signos clínicos pues ocurrió la infección congénita (no necesariamente sintomáticas antes de los tres años de edad (Gráfica 2). Riesgo de secuela de la infección materna, sin conocer la infección congénita (no necesariamente síntomas antes de los tres años de edad). Se han descrito casos de transmisión fetal aun tres meses antes de la primoinfección. Los porcentajes se dan como un rango de acuerdo con lo observado en mujeres, cuya mayoría se trató con espiramicina durante el embarazo. Es importante enfatizar que estas probabilidades se basan en mujeres embarazadas no inmunocomprometidas. 100% Riesgo IC 95% Semanas de gestación a la seroconversión materna Gráfica 1. Riesgo de infección congénita por edad gestacional a la seroconversión materna. Adaptada de Dunn et al. Riesgos de signos clínicos % Riesgo IC 95% Semanas de gestación a la seroconversión materna Gráfica 2. Riesgo de desarrollar signos clínicos antes de los 3 años de edad dada la infección congénita de acuerdo con la semana de gestación en la cual ocurrió la seroconversión materna semana. Adaptada de Dunn et al. Qué se sabe de la TOXOPLASMOSIS? 31
32 Tratamiento de infección aguda por T. Gondii en mujeres embarazadas Medicamento Dosis Duración de la terapia Embarazada infectada durante las primeras 18 semanas de gestación o hasta el término si el feto no se encuentra infectado al examen de amniocentesis o por ecografía a la semana 18 Espiramicina (Tabletas por 1g = UI) 1 g cada 8 horas No dar con comidas a. Si se desconoce la infección fetal, continuar durante todo el embarazo b. Si la infección fetal se documenta o se sospecha, cambiar a pirimetamina / sulfadizina y ácido fólínico después de la semana 18 de gestación c. Si se excluyó la infección fetal por PCR del LA, continuar la espiramicina hasta el parto. Embarazada donde la infección fetal se confirme después de las 18 semanas de gestación y en todas las embarazadas infectadas después de la semana 24 de gestación Pirimetamina (tableta x 25 mg) + sulfadiazina (tab. x 500 mg) + Dosis de carga: 100 mg/día dividido en dos dosis por 2 días y luego 50 mg día. Dosis de carga: 75 mg/kg por día dividido en dos dosis (máximo 4 g/d) por 2 días y luego 100 mg/día dividido en dos dosis (máximo 4 g/d) Si la infección fetal se sospecha o se confirma, continuar con pirimetaminia / sulfadiazina / ácido folínico hasta el parto Si la infección fetal se excluye por PCR en LA y el seguimiento de ultrasonido es negativo, considerar el paso a espiramicina Ácido folínico (tab. x 5, 10, 15, 25 mg) mg al día Durante y por una semana después de la terapia de pirimetamina. Adaptado de: Montoya, Rosso Tratamiento en el recién nacido con diagnósitco o sospecha de infección congénita por T. gondii Pirimetamina + Sulfadiazina + Ácido folínico Medicamento Corticoesteroides cuando las proteínas en el líquido cefalorraquídeo son mayores de 1 g/dl, y cuando la coriorretinitis activa amenaza la visión. Dosis Dosis de carga: 2 mg/kg/d por 2 días, y luego 1mg/kg/d por 2 ó 6 meses, después esta misma dosis tres veces por semana. 100 mg/kg/d dividida en 2 dosis 10 mg tres veces por semana Prednisona 1mg/kg/día dividido en dos dosis Duración 1año 1año Durante y por una semana después de la terapia de pirimetamina Hasta resolución de los niveles de proteínas en el líquido cefalorraquídeo o la coriorretinitis activa Tratamiento antiparasitario Tratamiento de la encefalitis toxoplásmica Fármaco Dosis diarias/adultos Horas Elección Fármacos Pirimetamina Sulfadiazina Folinato cálcico Espiramicina Clindamicina Atovacuona Claritromicina Azitromicina Roxitromicina Ciclinas Trimetoprima Sulfametoxazol Cotrimoxazol Ataque: mg (1-2 días) Mantenimiento: mg Ataque: 100 mg/kg Mantenimiento: mg 3-15 mg mg Ataque: mg Manteniemiento: mg mg mg 500 mg 300 mg mg mg 320 mg mg Primera Segunda Tercera Cuarta Quinta** Pirimentamina + Sulfadiazina Pirimentamina + Clindamicina* Pirimentamina + Macrólidos Pirimentamina Atovacuona, macrólidos, ambos *No tolerancia a la sulfadiazina; **No tolerancia a la pirimentamina 32 Qué se sabe de la TOXOPLASMOSIS?
33 PROTOCOLO GENERAL PARA EL DIAGNÓSTICO DE INFECCIÓN AGUDA DURANTE EL EMBARAZO (en base al estudio inmunológico específico): Determinación de IgG en el primer trimestre IgG Negativa (-) 1 2 IgG Positiva (+) No inmune. Susceptible Se realizará Prevención Primaria exhaustiva (con información oral y escrita) Seguimiento (determinación de IgG cada mes o cada trimestre, según centros, hasta finalización de embarazo 1.1 IgG (-) e IgM (-): Paciente de riesgo. Evitar contagio y seguir repitiendo serología. 1.2 IgG (-) e IgM (+): a) Falso negativo b) Infección muy temprana (donde todavía no hay respuesta IgG. 1.3 IgG (+): Seroconversión (infección aguda) IgM (-): La infección ocurrió antes de la concepción IgM(+): Orienta a una infección reciente. Se requiere confirmar con pruebas complementarias en laboratorio de referencia Para descartar se debe repetir la prueba IgG entre 1-3 semanas (según centros) Si IgG(-): Falso positivo Si IgG(+): Seroconversión (indicativo de infección aguda) Estaría indicado tratamiento placentario y descartar posibilidad de infección fetal. 2.1 IgG (+) con IgG (+) pregestacional: Paciente inmunizada. Se recomienda no continuar estudios durante el embarazo. 2.2 IgG (+) con IgG (-) pregestacional: Se considera seroconversión. Se recomienda iniciar tratamiento placentario y descartar infección fetal. 2.3 IgG (+) con IgG desconocida antes del embarazo: Hay 2 posibilidades a) Paciente inmunizada b) Adquirió la infección durante el embarazo. Se recomienda solicitar IgG e IgM 2 semanas después). O bien, directamente Avidez de IgG, y dependiendo de su resultado, investigar con otras pruebas. Si IgG(+) y estable con IgM(-): Se etiqueta a la paciente como inmune. Infección pasada (crónica) con mínimo riesgo de infección congénita. No requiere tratamiento ni más controles. Mantener en observación al RN y hacer serología. Si IgG (+) e IgM(+): Confirmar con el mismo suero. Y además: a) Si IgM aumenta 3 ó 4 veces en 2 determinaciones separadas 2-3 semanas. Se confirma infección reciente y se inicia tratamiento. b) Si IgM mantiene títulos estables es muy probable infección previa al embarazo. Solicitar IgA y Avidez de IgG. Una alta avidez significa infección previa, de lo contrario no se puede descartar infección aguda materna. Qué se sabe de la TOXOPLASMOSIS? 33
34
35
36 Avda. Tenor Fleta 57-C 1º Zaragoza Tel Fax: FARMACÉUTICOS AL SERVICIO DE LA SALUD
Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico
 TOXOPLASMOSIS Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico 2002-2003 TOXOPLASMOSIS * Infección producida por T. Gondii, que es un protozoo intracelular que
TOXOPLASMOSIS Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico 2002-2003 TOXOPLASMOSIS * Infección producida por T. Gondii, que es un protozoo intracelular que
Toxoplasmosis. Toxoplasma gondii
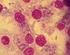 Toxoplasmosis Toxoplasma gondii Toxoplasma gondii Morfología Trofozoíto, taquizoíto o bradizoíto en forma de arco y mide de 7 μm de largo por 3 μm de ancho. En la parte anterior se encuentra el complejo
Toxoplasmosis Toxoplasma gondii Toxoplasma gondii Morfología Trofozoíto, taquizoíto o bradizoíto en forma de arco y mide de 7 μm de largo por 3 μm de ancho. En la parte anterior se encuentra el complejo
Toxoplasmosis. Dr. Renzo Tassara Oliveri. Profesor Asociado de Pediatría Depto. de Pediatría y Unidad de Parasitología Hospital San Juan de Dios
 Dr. Renzo Tassara Oliveri Profesor Asociado de Pediatría Depto. de Pediatría y Unidad de Parasitología Hospital San Juan de Dios Facultad de Medicina, Universidad de Chile Protozoo coccidio Zoonosis Parásito
Dr. Renzo Tassara Oliveri Profesor Asociado de Pediatría Depto. de Pediatría y Unidad de Parasitología Hospital San Juan de Dios Facultad de Medicina, Universidad de Chile Protozoo coccidio Zoonosis Parásito
TOXOPLASMOSIS LA CULPA NO ES DEL GATO SINO DEL QUE LE DA DE COMER. Dr. Rubén Mario Gatti (*) INTRODUCCIÓN
 TOXOPLASMOSIS LA CULPA NO ES DEL GATO SINO DEL QUE LE DA DE COMER INTRODUCCIÓN Dr. Rubén Mario Gatti (*) La toxoplasmosis es una enfermedad producida por un parásito protozoario (microscópico) de la familia
TOXOPLASMOSIS LA CULPA NO ES DEL GATO SINO DEL QUE LE DA DE COMER INTRODUCCIÓN Dr. Rubén Mario Gatti (*) La toxoplasmosis es una enfermedad producida por un parásito protozoario (microscópico) de la familia
Grupo de Estudio de Medicina Felina de AVEPA TOXOPLASMOSIS, GATOS Y EMBARAZO
 Grupo de Estudio de Medicina Felina de AVEPA TOXOPLASMOSIS, GATOS Y EMBARAZO Toxoplasma gondii es un coccidio, parásito intracelular obligado, que infecta prácticamente a todas las especies de sangre caliente
Grupo de Estudio de Medicina Felina de AVEPA TOXOPLASMOSIS, GATOS Y EMBARAZO Toxoplasma gondii es un coccidio, parásito intracelular obligado, que infecta prácticamente a todas las especies de sangre caliente
Realidades de la tenencia de gatos y la transmisión de toxoplasmosis. Dra. Gilda Aguirre Médica Patóloga clínica
 Realidades de la tenencia de gatos y la transmisión de toxoplasmosis Dra. Gilda Aguirre Médica Patóloga clínica Objetivo Conocer algunos datos importantes sobre el párasito, quíenes pueden afectarse, gravedad
Realidades de la tenencia de gatos y la transmisión de toxoplasmosis Dra. Gilda Aguirre Médica Patóloga clínica Objetivo Conocer algunos datos importantes sobre el párasito, quíenes pueden afectarse, gravedad
Epidemiología de enfermedades infecciosas Escuela de Salud Pública Universidad del Valle, Cali TOXOPLASMOSIS
 TOXOPLASMOSIS Modificado de: La Toxoplamosis por M.V. Rubén Mario Gatti, Argentina y toxoplasmosis por Dra. Teresa Uribarren Berrueta Departamento de Microbiología y Parasitología, Facultad de Medicina,
TOXOPLASMOSIS Modificado de: La Toxoplamosis por M.V. Rubén Mario Gatti, Argentina y toxoplasmosis por Dra. Teresa Uribarren Berrueta Departamento de Microbiología y Parasitología, Facultad de Medicina,
Tema 52. Protozoos III: Esporozoos
 Tema 52 Protozoos III: Esporozoos Clasificación de los protozoos Clase Organela de locomoción Método de reproducción Hábitat Esporozoos Ninguna Esquizogonia Esporogonia sangre y tejidos Tracto intestinal
Tema 52 Protozoos III: Esporozoos Clasificación de los protozoos Clase Organela de locomoción Método de reproducción Hábitat Esporozoos Ninguna Esquizogonia Esporogonia sangre y tejidos Tracto intestinal
GUÍA ACTUALIZADA: TOXOPLASMOSIS CONGÉNITA
 GUÍA ACTUALIZADA: TOXOPLASMOSIS CONGÉNITA S E R V I C I O D E N E O N A T O L O G Í A H G U A S H E I L A S E G U R A S Á N C H E Z R 3 T U T O R : H O N O R I O S Á N C H E Z Z A P L A N A Contenido Introducción
GUÍA ACTUALIZADA: TOXOPLASMOSIS CONGÉNITA S E R V I C I O D E N E O N A T O L O G Í A H G U A S H E I L A S E G U R A S Á N C H E Z R 3 T U T O R : H O N O R I O S Á N C H E Z Z A P L A N A Contenido Introducción
ALGORITMOS PARA EL DIAGNÓSTICO DE LA TOXOPLASMOSIS. María Cristina Salomón
 ALGORITMOS PARA EL DIAGNÓSTICO DE LA TOXOPLASMOSIS María Cristina Salomón La toxoplasmosis es una zoonosis parasitaria producida por un protozoo del PhylumApicomplexa llamado Toxoplasma gondii. El parásito
ALGORITMOS PARA EL DIAGNÓSTICO DE LA TOXOPLASMOSIS María Cristina Salomón La toxoplasmosis es una zoonosis parasitaria producida por un protozoo del PhylumApicomplexa llamado Toxoplasma gondii. El parásito
ENFERMEDADES PARASITARIAS
 ENFERMEDADES PARASITARIAS Anderson Machado M.V. TOXOPLASMOSIS El Toxoplasma gondii es un parásito tipo coccidia de vida intra celular obligatorio que afecta virtualmente todas las especies de sangre caliente,
ENFERMEDADES PARASITARIAS Anderson Machado M.V. TOXOPLASMOSIS El Toxoplasma gondii es un parásito tipo coccidia de vida intra celular obligatorio que afecta virtualmente todas las especies de sangre caliente,
Jornada ANICE PROCARSE
 Jornada ANICE PROCARSE Avances en investigación sobre el riesgo de Toxoplasma gondii en derivados cárnicos curado-madurados Mª Carmen Rota García Profesora Titular de Nutrición y Bromatología Facultad
Jornada ANICE PROCARSE Avances en investigación sobre el riesgo de Toxoplasma gondii en derivados cárnicos curado-madurados Mª Carmen Rota García Profesora Titular de Nutrición y Bromatología Facultad
Infección de transmisión vertical y Embarazo. Susana Loyola Infectología Hospital Materno Neonatal
 Infección de transmisión vertical y Embarazo Susana Loyola Infectología Hospital Materno Neonatal Toxoplasmosis y Embarazo Toxoplasmosis y Embarazo La primoinfección materna origina la infección del feto.
Infección de transmisión vertical y Embarazo Susana Loyola Infectología Hospital Materno Neonatal Toxoplasmosis y Embarazo Toxoplasmosis y Embarazo La primoinfección materna origina la infección del feto.
Clase de Parasitología Profa. Zilka Terrientes TOXOPLASMOSIS
 Clase de Parasitología Profa. Zilka Terrientes TOXOPLASMOSIS Vamos a empezar con Toxoplasma gondii, forma parte del grupo de los coccidios. Es una de las infecciones mas comunes en los humanos y otros
Clase de Parasitología Profa. Zilka Terrientes TOXOPLASMOSIS Vamos a empezar con Toxoplasma gondii, forma parte del grupo de los coccidios. Es una de las infecciones mas comunes en los humanos y otros
Generalidades de los Parásitos
 Generalidades de los Parásitos Autor: Bióloga Natalia Ocampo Fernández Enero 2014 http://www.uaeh.edu.mx/virtual TEMA 54.- GENERALIDADES DE LOS PARÁSITOS Introducción. Parásito y parasitismo. Parásito:
Generalidades de los Parásitos Autor: Bióloga Natalia Ocampo Fernández Enero 2014 http://www.uaeh.edu.mx/virtual TEMA 54.- GENERALIDADES DE LOS PARÁSITOS Introducción. Parásito y parasitismo. Parásito:
Programa de Diagnóstico de Toxoplasmosis Materna en Armenia
 Rev. Salud Pública. 4 (Sup. 2): 23-28, 2002 Programa de Diagnóstico de Toxoplasmosis Materna en Armenia Maria Teresa Montoya,Bacterióloga. Parasitologa, Laboratorio Solidaridad, Armenia, Quindio D urante
Rev. Salud Pública. 4 (Sup. 2): 23-28, 2002 Programa de Diagnóstico de Toxoplasmosis Materna en Armenia Maria Teresa Montoya,Bacterióloga. Parasitologa, Laboratorio Solidaridad, Armenia, Quindio D urante
Salud materno-infantil
 Salud materno-infantil Cómo se miden los nacimientos? Tasa de natalidad Razón de fecundidad (o fertilidad) Índice sintético de fecundidad Tasa de natalidad Número de nacidos vivos durante 1 año Población
Salud materno-infantil Cómo se miden los nacimientos? Tasa de natalidad Razón de fecundidad (o fertilidad) Índice sintético de fecundidad Tasa de natalidad Número de nacidos vivos durante 1 año Población
Generalidades TOXOPLASMOSIS. Infección Toxoplásmica. Importancia. Zoonosis Cosmopolita Ubicua Pantrópica Gran adaptación parasitaria
 Infección Toxoplásmica Importancia Generalidades Zoonosis Cosmopolita Ubicua Pantrópica Gran adaptación parasitaria Prevalencia de la infección humana Capacidad nosógena (toxoplasmosis congénita, ocular,
Infección Toxoplásmica Importancia Generalidades Zoonosis Cosmopolita Ubicua Pantrópica Gran adaptación parasitaria Prevalencia de la infección humana Capacidad nosógena (toxoplasmosis congénita, ocular,
Toxoplasmosis en Costa Rica. Encuestas dirigidas a diferentes áreas sociales y profesionales relacionadas a la enfermedad
 Toxoplasmosis en Costa Rica Encuestas dirigidas a diferentes áreas sociales y profesionales relacionadas a la enfermedad Encuesta realizadas a infectólogos, ginecólogos, obstetras, enfermeros, médicos
Toxoplasmosis en Costa Rica Encuestas dirigidas a diferentes áreas sociales y profesionales relacionadas a la enfermedad Encuesta realizadas a infectólogos, ginecólogos, obstetras, enfermeros, médicos
6.Prevención de la salud. Giardiasis
 6 6.Prevención de la salud Giardiasis La giardiasis es una enfermedad parasitaria que afecta al intestino y que produce diarrea. Está producida por un parásito microscópico unicelular que vive en el intestino
6 6.Prevención de la salud Giardiasis La giardiasis es una enfermedad parasitaria que afecta al intestino y que produce diarrea. Está producida por un parásito microscópico unicelular que vive en el intestino
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
Toxoplasmosis. Dra. Pamela Grimaldi, Dra. Pamela Correa Clínica Ginecotocológica C
 Toxoplasmosis Dra. Pamela Grimaldi, Dra. Pamela Correa Clínica Ginecotocológica C Descubrimiento Parásito descubierto en el gondi por Darling en 1908 y encontrado de nuevo por Janku en 1923 en quistes
Toxoplasmosis Dra. Pamela Grimaldi, Dra. Pamela Correa Clínica Ginecotocológica C Descubrimiento Parásito descubierto en el gondi por Darling en 1908 y encontrado de nuevo por Janku en 1923 en quistes
Un VIRUS que debemos prevenir. Edición: Comunicaciones C. - Enero de 2016
 Un VIRUS que debemos prevenir Edición: Comunicaciones C. - Enero de 2016 Qué es la enfermedad por el virus del Zika? Es una infección causada por la picadura de mosquitos infectados del género Aedes, suele
Un VIRUS que debemos prevenir Edición: Comunicaciones C. - Enero de 2016 Qué es la enfermedad por el virus del Zika? Es una infección causada por la picadura de mosquitos infectados del género Aedes, suele
TOXOPLASMOSIS CONGÉNITA. CASO 542
 TOXOPLASMOSIS CONGÉNITA. CASO 542 Mujer de 34 años primípara, gestante de 32 semanas con gestación controlada, sin patología conocida y sin sintomatología clínica, que acude al ginecólogo para la visita
TOXOPLASMOSIS CONGÉNITA. CASO 542 Mujer de 34 años primípara, gestante de 32 semanas con gestación controlada, sin patología conocida y sin sintomatología clínica, que acude al ginecólogo para la visita
1. Conceptos de infectología
 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS VETERINARIAS Y PECUARIAS DEPARTAMENTO DE MEDICINA PREVENTIVA 1. Conceptos de infectología Características de los agentes patógenos 1. Conceptos de infectología.
UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS VETERINARIAS Y PECUARIAS DEPARTAMENTO DE MEDICINA PREVENTIVA 1. Conceptos de infectología Características de los agentes patógenos 1. Conceptos de infectología.
Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt
 Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt Fase aguda: Entre el 40% a 90% sintomáticos (similar mononucleosis) Fase crónica: asintomaticos El
Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt Fase aguda: Entre el 40% a 90% sintomáticos (similar mononucleosis) Fase crónica: asintomaticos El
Tema 1. Epidemiología y control de las enfermedades transmisibles
 Tema 1 Epidemiología y control de las enfermedades transmisibles Definición de enfermedad transmisible Enfermedad transmisible es aquella que precisa la existencia de un agente causal infeccioso que desencadena
Tema 1 Epidemiología y control de las enfermedades transmisibles Definición de enfermedad transmisible Enfermedad transmisible es aquella que precisa la existencia de un agente causal infeccioso que desencadena
EXPRESIONES EN PATOLOGÍA INFECCIOSA TOXOPLASMOSIS
 XXV Congreso de la Sociedad Española de Anatomía Patológica NUEVAS EXPRESIONES EN PATOLOGÍA INFECCIOSA TOXOPLASMOSIS Cristian Perna TOXOPLASMA GONDII (TG) PROTOZOO INTRACELULAR de células nucleadas del
XXV Congreso de la Sociedad Española de Anatomía Patológica NUEVAS EXPRESIONES EN PATOLOGÍA INFECCIOSA TOXOPLASMOSIS Cristian Perna TOXOPLASMA GONDII (TG) PROTOZOO INTRACELULAR de células nucleadas del
El periodo de incubación de la enfermedad por rotavirus es de unos 2 días hasta la aparición de los síntomas tras el contagio.
 Información general Rotavirus El Rotavirus produce una infección intestinal, siendo la causa más común de diarrea severa en niños, especialmente entre los 6 meses y los 5 años de vida. Las gastroenteritis
Información general Rotavirus El Rotavirus produce una infección intestinal, siendo la causa más común de diarrea severa en niños, especialmente entre los 6 meses y los 5 años de vida. Las gastroenteritis
Sitio Argentino de Producción Animal NEOSPOROSIS. Dr. Pedro Bañales. Tacuarembó 22 de setiembre/2011. Neosporosis: qué es?
 NEOSPOROSIS Dr. Pedro Bañales Tacuarembó 22 de setiembre/2011 Neosporosis: qué es? Enfermedad de distribución mundial, causada por el protozoario Neospora caninum Afecta seriamente a caninos y bovinos,
NEOSPOROSIS Dr. Pedro Bañales Tacuarembó 22 de setiembre/2011 Neosporosis: qué es? Enfermedad de distribución mundial, causada por el protozoario Neospora caninum Afecta seriamente a caninos y bovinos,
1 de Diciembre, Día Mundial del Sida
 1 de Diciembre, Día Mundial del Sida El Sida hoy: Informe Especial Según los últimos datos aportados por el Programa Conjunto de las Naciones Unidas sobre el VIH-sida (ONUSIDA), en 2010 vivían en el mundo
1 de Diciembre, Día Mundial del Sida El Sida hoy: Informe Especial Según los últimos datos aportados por el Programa Conjunto de las Naciones Unidas sobre el VIH-sida (ONUSIDA), en 2010 vivían en el mundo
Es frecuente la infección crónica por el virus de hepatitis B (VHB)?
 HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
2º BACHILLERATO BIOLOGÍA 3ªEVALUACIÓN (2) ACTIVIDADES DE LA 3ªEVALUACIÓN (2) BLOQUE 5 (2):
 ACTIVIDADES DE LA 3ªEVALUACIÓN (2) BLOQUE 5 (2): UNIDAD 18 Y UNIDAD 19 : EL PROCESO INMUNITARIO Y ANOMALÍAS DEL SISTEMA INMUNE 1.- Con relación a la inmunidad: a.- Defina inmunidad y respuesta inmune (0,75
ACTIVIDADES DE LA 3ªEVALUACIÓN (2) BLOQUE 5 (2): UNIDAD 18 Y UNIDAD 19 : EL PROCESO INMUNITARIO Y ANOMALÍAS DEL SISTEMA INMUNE 1.- Con relación a la inmunidad: a.- Defina inmunidad y respuesta inmune (0,75
ENCUESTA EPIDEMIOLÓGICA DE SARAMPIÓN
 Servicio Canario de la Salud DIRECCIÓN GENERAL DE SALUD PÚBLICA ENCUESTA EPIDEMIOLÓGICA DE SARAMPIÓN DATOS DEL MÉDICO DECLARANTE Y DE LA DECLARACIÓN Nombre y Apellidos: Teléfono: Centro Sanitario: Municipio:
Servicio Canario de la Salud DIRECCIÓN GENERAL DE SALUD PÚBLICA ENCUESTA EPIDEMIOLÓGICA DE SARAMPIÓN DATOS DEL MÉDICO DECLARANTE Y DE LA DECLARACIÓN Nombre y Apellidos: Teléfono: Centro Sanitario: Municipio:
PAMI 8: Diagnóstico de la infección por VIH
 PAMI 8: Diagnóstico de la infección por VIH SITUACIÓN ACTUAL DEL DIAGNÓSTICO EN ESPAÑA NUEVOS DIAGNÓSTICOS DE LA INFECCIÓN A finales del año 2013 la tasa anual de nuevos diagnósticos fue de 70,4/100.000.000
PAMI 8: Diagnóstico de la infección por VIH SITUACIÓN ACTUAL DEL DIAGNÓSTICO EN ESPAÑA NUEVOS DIAGNÓSTICOS DE LA INFECCIÓN A finales del año 2013 la tasa anual de nuevos diagnósticos fue de 70,4/100.000.000
TOXOPLASMOSIS. Dr. Jaime Altcheh Servicio de Parasitología Hospital de Niños Ricardo Gutiérrez
 TOXOPLASMOSIS Dr. Jaime Altcheh Servicio de Parasitología Hospital de Niños Ricardo Gutiérrez Epidemiología No tengo la culpa!! Los felinos son huéspedes definitivos (ciclo sexuado y asexuado). Los humanos
TOXOPLASMOSIS Dr. Jaime Altcheh Servicio de Parasitología Hospital de Niños Ricardo Gutiérrez Epidemiología No tengo la culpa!! Los felinos son huéspedes definitivos (ciclo sexuado y asexuado). Los humanos
Leishmaniosis canina. Generalidades
 Leishmaniosis canina Generalidades La leishmaniosis son un conjunto de enfermedades causadas por protozoos parásitos pertenecientes al género Leishmania, que afecta a numerosas especies de mamíferos, incluido
Leishmaniosis canina Generalidades La leishmaniosis son un conjunto de enfermedades causadas por protozoos parásitos pertenecientes al género Leishmania, que afecta a numerosas especies de mamíferos, incluido
Seroconversión de Toxoplasma durante el embarazo
 Seroconversión de Toxoplasma durante el embarazo Introducción La toxoplasmosis es una zoonosis causada por el Toxoplasma Gondii, en la que huésped definitivo es el gato y otros animales, mientras que el
Seroconversión de Toxoplasma durante el embarazo Introducción La toxoplasmosis es una zoonosis causada por el Toxoplasma Gondii, en la que huésped definitivo es el gato y otros animales, mientras que el
ENFERMEDAD DE CHAGAS Pediátrica en Área no Endémica. Dra Victoria Fumadó
 ENFERMEDAD DE CHAGAS Pediátrica en Área no Endémica Dra Victoria Fumadó Caso clínico Mujer de 23 años, natural de Capinota, Cochabamba, Bolivia. En nuestro país desde hace cuatro años Acude a urgencias
ENFERMEDAD DE CHAGAS Pediátrica en Área no Endémica Dra Victoria Fumadó Caso clínico Mujer de 23 años, natural de Capinota, Cochabamba, Bolivia. En nuestro país desde hace cuatro años Acude a urgencias
Preguntas de Selectividad sobre inmunología.
 Preguntas de Selectividad sobre inmunología. 1. Existen virus que producen en los humanos enfermedades mortales por inmunodeficiencia. Sin embargo, la muerte del individuo no es provocada directamente
Preguntas de Selectividad sobre inmunología. 1. Existen virus que producen en los humanos enfermedades mortales por inmunodeficiencia. Sin embargo, la muerte del individuo no es provocada directamente
Detección de las posibles complicaciones asociadas a la infección por virus Zika durante el embarazo
 Detección de las posibles complicaciones asociadas a la infección por virus Zika durante el embarazo DESCRIPCIÓN DE LA ENFERMEDAD La enfermedad por virus Zika se transmite a través de la picadura de mosquitos
Detección de las posibles complicaciones asociadas a la infección por virus Zika durante el embarazo DESCRIPCIÓN DE LA ENFERMEDAD La enfermedad por virus Zika se transmite a través de la picadura de mosquitos
Entamoeba coli Entamoeba histolytica Endolimax nana
 Entamoeba coli Entamoeba histolytica Endolimax nana HISTORIA Feder Losch (1875), encontró amebas en las muestras de heces, pero sólo los consideraba responsables de mantener el proceso inflamatorio, no
Entamoeba coli Entamoeba histolytica Endolimax nana HISTORIA Feder Losch (1875), encontró amebas en las muestras de heces, pero sólo los consideraba responsables de mantener el proceso inflamatorio, no
Mononucleosis infecciosa (MI) Dr. Daniel Stamboulian
 Mononucleosis infecciosa (MI) Dr. Daniel Stamboulian Mononucleosis infecciosa Es causada por el virus EB en el 90 al 95% de los casos. Clínicamente, la MI se presenta con mayor frecuencia en la adolescencia
Mononucleosis infecciosa (MI) Dr. Daniel Stamboulian Mononucleosis infecciosa Es causada por el virus EB en el 90 al 95% de los casos. Clínicamente, la MI se presenta con mayor frecuencia en la adolescencia
SISTEMA SISTEM INMUNE
 CONDICIÓN DEL SISTEMA INMUNE DEL RECIÉN NACIDO PROFESOR MTRN. SERGIO PAVIÉ CORONADO ENFM-121 2009 GENERALIDADES I SISTEMA INMUNE DEL RN El Sistema Inmunológico es un conjunto de estructuras anatómicas,
CONDICIÓN DEL SISTEMA INMUNE DEL RECIÉN NACIDO PROFESOR MTRN. SERGIO PAVIÉ CORONADO ENFM-121 2009 GENERALIDADES I SISTEMA INMUNE DEL RN El Sistema Inmunológico es un conjunto de estructuras anatómicas,
INFORMACIÓN PARA EL PACIENTE CON LMC
 INFORMACIÓN PARA EL PACIENTE CON LMC LA LEUCEMIA MIELOIDE CRÓNICA La Leucemia Mieloide Crónica (LMC) es una enfermedad neoplásica de la médula ósea, en la cual se producen una cantidadexcesiva de glóbulos
INFORMACIÓN PARA EL PACIENTE CON LMC LA LEUCEMIA MIELOIDE CRÓNICA La Leucemia Mieloide Crónica (LMC) es una enfermedad neoplásica de la médula ósea, en la cual se producen una cantidadexcesiva de glóbulos
Examen de laboratorio: Chagas. Obtención de sangre Cantidad Características Conservación Procesa miento En capilares Heparinizados.
 Examen de laboratorio: Chagas Examen de laboratorio Microconcentra ción en Micrométodo en tubo centración Strout ELISA IFI HAI Tipo de muestra venosa o Venosa Suero o plasma sanguíneo Obtención de sangre
Examen de laboratorio: Chagas Examen de laboratorio Microconcentra ción en Micrométodo en tubo centración Strout ELISA IFI HAI Tipo de muestra venosa o Venosa Suero o plasma sanguíneo Obtención de sangre
Introducción a la Epidemiología. Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA-EP
 Introducción a la Epidemiología Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA-EP Salud: Definición OMS (1946) La salud es el completo estado de bienestar físico, mental y social, y no la mera ausencia
Introducción a la Epidemiología Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA-EP Salud: Definición OMS (1946) La salud es el completo estado de bienestar físico, mental y social, y no la mera ausencia
Diagnóstico precoz de la infección VIH en Atención Primaria. María José Monedero Mira. MF CS Rafalafena. Castellón 1 de Diciembre 2016
 Diagnóstico precoz de la infección VIH en Atención Primaria María José Monedero Mira. MF CS Rafalafena. Castellón 1 de Diciembre 2016 QUÉ SON LA INFECCIÓN POR EL VIH Y EL SIDA? La palabra sida corresponde
Diagnóstico precoz de la infección VIH en Atención Primaria María José Monedero Mira. MF CS Rafalafena. Castellón 1 de Diciembre 2016 QUÉ SON LA INFECCIÓN POR EL VIH Y EL SIDA? La palabra sida corresponde
Generalidades de Protozoos
 Generalidades de Protozoos Protozoos: Organismos unicelulares (microscópicos, formados por una sola célula) eucariontes (material genético protegido por una membrana nuclear). Estructura y Metabolismo
Generalidades de Protozoos Protozoos: Organismos unicelulares (microscópicos, formados por una sola célula) eucariontes (material genético protegido por una membrana nuclear). Estructura y Metabolismo
Boletín Herpes. La pieza clave para fortalecer el sistema inmunológico
 Hoy en día, el Factor de Transferencia se ofrece como un complemento de los tratamientos convencionales, ya que al ser un inmunomodulador, es capaz de enseñar al sistema inmunológico a reaccionar de una
Hoy en día, el Factor de Transferencia se ofrece como un complemento de los tratamientos convencionales, ya que al ser un inmunomodulador, es capaz de enseñar al sistema inmunológico a reaccionar de una
EL VIRUS DE INMUNODEFICIENCIA ADQUIRIDA HUMANA Y SIDA. (VIH Y SIDA).
 EL VIRUS DE INMUNODEFICIENCIA ADQUIRIDA HUMANA Y SIDA. (VIH Y SIDA). 2 Qué es el VIH? y el sida? El VIH es el virus de la inmunodeficiencia humana, que se transmite de diferentes maneras, y que, en su
EL VIRUS DE INMUNODEFICIENCIA ADQUIRIDA HUMANA Y SIDA. (VIH Y SIDA). 2 Qué es el VIH? y el sida? El VIH es el virus de la inmunodeficiencia humana, que se transmite de diferentes maneras, y que, en su
Información sobre la enfermedad por virus Ébola. Octubre 2014
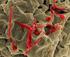 Información sobre la enfermedad por virus Ébola Octubre 2014 Enfermedad por el virus Ébola (EVE) Es una enfermedad transmisible grave causada por la infección de un virus, el virus Ébola. El virus Ébola
Información sobre la enfermedad por virus Ébola Octubre 2014 Enfermedad por el virus Ébola (EVE) Es una enfermedad transmisible grave causada por la infección de un virus, el virus Ébola. El virus Ébola
UNIDAD V. Principios de Inmunología Generalidades Inmunidad Vacunas. Prof. Ely Gómez P.
 UNIDAD V Principios de Inmunología Generalidades Inmunidad Vacunas Prof. Ely Gómez P. Maturín, Junio 2011 Inmunología: Es la ciencia que estudia el sistema inmunológico del organismo. Antiguamente era
UNIDAD V Principios de Inmunología Generalidades Inmunidad Vacunas Prof. Ely Gómez P. Maturín, Junio 2011 Inmunología: Es la ciencia que estudia el sistema inmunológico del organismo. Antiguamente era
AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública
 Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
MONITOREO DE LABORATORIO DE EMBARAZADAS CON VIH, COINFECCIONES Y ENFERMEDADES EMERGENTES. Ingrid Escobar Laboratorio de Enfermedades Infecciosas
 MONITOREO DE LABORATORIO DE EMBARAZADAS CON VIH, COINFECCIONES Y ENFERMEDADES EMERGENTES Ingrid Escobar Laboratorio de Enfermedades Infecciosas GENERALIDADES Las infecciones de VIH, Hepatitis y Sífilis
MONITOREO DE LABORATORIO DE EMBARAZADAS CON VIH, COINFECCIONES Y ENFERMEDADES EMERGENTES Ingrid Escobar Laboratorio de Enfermedades Infecciosas GENERALIDADES Las infecciones de VIH, Hepatitis y Sífilis
CONVULSIONES FEBRILES
 CONVULSIONES FEBRILES 1. ETIOLOGIA Se reconoce un componente genético importante (cromosomas 8 t 19) y una predisposición familiar, con posible patrón autonómico dominante. La fiebre que da origen a la
CONVULSIONES FEBRILES 1. ETIOLOGIA Se reconoce un componente genético importante (cromosomas 8 t 19) y una predisposición familiar, con posible patrón autonómico dominante. La fiebre que da origen a la
Todo lo que necesitas saber sobre la Rabia Humana. Programa de Salud Pública. Salud y Seguridad en el Trabajo. Organización Sanitas Internacional
 Todo lo que necesitas saber sobre la Rabia Humana Programa de Salud Pública. Qué es la Rabia Humana? Es una enfermedad vírica casi siempre mortal, una vez que han aparecido los síntomas clínicos. En el
Todo lo que necesitas saber sobre la Rabia Humana Programa de Salud Pública. Qué es la Rabia Humana? Es una enfermedad vírica casi siempre mortal, una vez que han aparecido los síntomas clínicos. En el
Centro de prensa Hepatitis E
 Centro de prensa Hepatitis E Nota descriptiva N. 280 Junio de 2014 Datos y cifras Cada año se registran unos 20 millones de casos de infección por el virus de la hepatitis E, más de tres millones de casos
Centro de prensa Hepatitis E Nota descriptiva N. 280 Junio de 2014 Datos y cifras Cada año se registran unos 20 millones de casos de infección por el virus de la hepatitis E, más de tres millones de casos
Zika - Actualización Epidemiológica 17 de marzo de 2016 Virus del Zika - Incidencia y tendencia Figura 1 Figura 1. Fuente:
 Zika - Actualización Epidemiológica 17 de marzo de 2016 Virus del Zika - Incidencia y tendencia De acuerdo a los datos disponibles notificados por los Estados Miembros, la tendencia sugiere una disminución
Zika - Actualización Epidemiológica 17 de marzo de 2016 Virus del Zika - Incidencia y tendencia De acuerdo a los datos disponibles notificados por los Estados Miembros, la tendencia sugiere una disminución
VIGILANCIA EPIDEMIOLÓGICA DE ENFERMEDAD POR VIRUS DEL ÉBOLA
 VIGILANCIA EPIDEMIOLÓGICA DE ENFERMEDAD POR VIRUS DEL ÉBOLA Dra. Fátima Garrido Octubre de 2.014 VIGILANCIA EPIDEMIOLÓGICA Es el análisis, interpretación y difusión sistemática de datos colectados, usando
VIGILANCIA EPIDEMIOLÓGICA DE ENFERMEDAD POR VIRUS DEL ÉBOLA Dra. Fátima Garrido Octubre de 2.014 VIGILANCIA EPIDEMIOLÓGICA Es el análisis, interpretación y difusión sistemática de datos colectados, usando
Dra. FLOR TERESA GARCÍA HUAMÁN
 Dra. FLOR TERESA GARCÍA HUAMÁN La parasitología es una rama de la biología que estudia el fenómeno del parasitismo. Estudia a los organismos vivos parásitos, y la relación de ellos con sus hospedadores
Dra. FLOR TERESA GARCÍA HUAMÁN La parasitología es una rama de la biología que estudia el fenómeno del parasitismo. Estudia a los organismos vivos parásitos, y la relación de ellos con sus hospedadores
Lic. Enfermería Enfermería del Niño y Adolescente II ANAMNESIS PERINATAL
 Lic. Enfermería Enfermería del Niño y Adolescente II ANAMNESIS PERINATAL Concepto de anamnesis perinatal Los hechos que permiten evaluar a un recién nacido comienzan con el período prenatal que va desde
Lic. Enfermería Enfermería del Niño y Adolescente II ANAMNESIS PERINATAL Concepto de anamnesis perinatal Los hechos que permiten evaluar a un recién nacido comienzan con el período prenatal que va desde
febrer, 2015 Dra. Magda Campins
 febrer, 2015 SALUT MATERNOINFANTIL: SALUT DE LA DONA i SALUT INFANTIL Dra. Magda Campins Hospital Universitari Vall d Hebron. Facultat de Medicina. UAB SALUT MATERNOINFANTIL Objetivo: Conseguir un óptimo
febrer, 2015 SALUT MATERNOINFANTIL: SALUT DE LA DONA i SALUT INFANTIL Dra. Magda Campins Hospital Universitari Vall d Hebron. Facultat de Medicina. UAB SALUT MATERNOINFANTIL Objetivo: Conseguir un óptimo
Hepatitis A. AUTOR. Dr. Joan Pericas Bosch. Pediatra
 Hepatitis A AUTOR. Dr. Joan Pericas Bosch. Pediatra La hepatitis A está causada por un virus que afecta al hígado. Desde el intestino de las personas enfermas pasa a las aguas residuales, pudiendo contaminar
Hepatitis A AUTOR. Dr. Joan Pericas Bosch. Pediatra La hepatitis A está causada por un virus que afecta al hígado. Desde el intestino de las personas enfermas pasa a las aguas residuales, pudiendo contaminar
TBC Congénita y Perinatal. Dra. Johanne Jahnsen K. Enero de 2012
 TBC Congénita y Perinatal Dra. Johanne Jahnsen K. Enero de 2012 Tendencia de la epidemia de TBC en 9 regiones diferentes en el mundo Bacilo de Calmette Guerin (BCG) Es la vacuna más utilizada Se desarrolló
TBC Congénita y Perinatal Dra. Johanne Jahnsen K. Enero de 2012 Tendencia de la epidemia de TBC en 9 regiones diferentes en el mundo Bacilo de Calmette Guerin (BCG) Es la vacuna más utilizada Se desarrolló
VIH/SIDA SAN MARCOS 13 DE MAYO 2003 PREVENIR EL SIDA ES RESPONSABILIDAD DE TODOS Y TODAS
 VIH/SIDA SAN MARCOS 13 DE MAYO 2003 ANTECEDENTES SIDA identificado en 1981 1,983 se aisla el VIH por el equipo del Dr. Luc Montacnier. Desde 1994 a 2002 en Guatemala se han reportado 4369 casos ( 37 por
VIH/SIDA SAN MARCOS 13 DE MAYO 2003 ANTECEDENTES SIDA identificado en 1981 1,983 se aisla el VIH por el equipo del Dr. Luc Montacnier. Desde 1994 a 2002 en Guatemala se han reportado 4369 casos ( 37 por
SITUACIÓN EPIDEMIOLÓGICA DEL VIH/SIDA RESUMEN DE SITUACIÓN A 30 DE JUNIO DE 2013
 SITUACIÓN EPIDEMIOLÓGICA DEL VIH/SIDA RESUMEN DE SITUACIÓN A 3 DE JUNIO DE 213 A nivel mundial: El número de nuevas infecciones por el VIH entre adolescentes y adultos sigue descendiendo en todo el mundo.
SITUACIÓN EPIDEMIOLÓGICA DEL VIH/SIDA RESUMEN DE SITUACIÓN A 3 DE JUNIO DE 213 A nivel mundial: El número de nuevas infecciones por el VIH entre adolescentes y adultos sigue descendiendo en todo el mundo.
Clínica de Enfermedades Infecciosas Hospital Roosevelt Febrero 2016
 Clínica de Enfermedades Infecciosas Hospital Roosevelt Febrero 2016 Requiere de evaluación: Clínica: Signos y Síntomas (la mayoría asintomáticos) Bioquímica Serológica Histológica Virológica Determinar
Clínica de Enfermedades Infecciosas Hospital Roosevelt Febrero 2016 Requiere de evaluación: Clínica: Signos y Síntomas (la mayoría asintomáticos) Bioquímica Serológica Histológica Virológica Determinar
4. Defunciones y tasas de la mortalidad neonatal tardía según causa y trienio, por área de salud. Casos y tasas por nacidos vivos.
 01-54. Todas las causas 12 1,3 14 1,4 8 0,9 I. 01-05. Enfermedades infecciosas y parasitarias 1. Enfermedades infecciosas intestinales 2. Enfermedad meningocócica 3. SIDA 4. VIH+ (portador, evidencias
01-54. Todas las causas 12 1,3 14 1,4 8 0,9 I. 01-05. Enfermedades infecciosas y parasitarias 1. Enfermedades infecciosas intestinales 2. Enfermedad meningocócica 3. SIDA 4. VIH+ (portador, evidencias
Peste Porcina. Qué es la Peste Porcina?
 Peste Porcina Qué es la Peste Porcina? Enfermedad infectocontagiosa que afecta exclusivamente al ganado porcino, y cerdos salvajes de todas las edades, producida por un virus de carácter hemorrágico que
Peste Porcina Qué es la Peste Porcina? Enfermedad infectocontagiosa que afecta exclusivamente al ganado porcino, y cerdos salvajes de todas las edades, producida por un virus de carácter hemorrágico que
Microbiología Clínica Interacción con los microorganismos
 Microbiología Clínica 2006-2007 Interacción con los microorganismos MICCLIN2007 Interacción con los microorganismos Concepto de flora normal. Localización de la flora normal. Interacción patogénica entre
Microbiología Clínica 2006-2007 Interacción con los microorganismos MICCLIN2007 Interacción con los microorganismos Concepto de flora normal. Localización de la flora normal. Interacción patogénica entre
ESTIMULACIÓN MÚLTIPLE TEMPRANA. Dra. Carmen Montserrat Gómez Juárez R4 Medicina de Rehabilitación
 ESTIMULACIÓN MÚLTIPLE TEMPRANA Dra. Carmen Montserrat Gómez Juárez R4 Medicina de Rehabilitación Con los avances en la atención del recién nacido se ha logrado una tasa creciente de supervivencia entre
ESTIMULACIÓN MÚLTIPLE TEMPRANA Dra. Carmen Montserrat Gómez Juárez R4 Medicina de Rehabilitación Con los avances en la atención del recién nacido se ha logrado una tasa creciente de supervivencia entre
PATÓGENA: Entamoeba histolytica COMENSALES: diferenciar, índice de fecalismo.
 AMEBIASIS PATÓGENA: Entamoeba histolytica COMENSALES: diferenciar, índice de fecalismo. Citoplasma Dos zonas: Endoplasma: granuloso Ectoplasma: hialino Se movilizan por pseudópodos. Pseudópodos: extensiones
AMEBIASIS PATÓGENA: Entamoeba histolytica COMENSALES: diferenciar, índice de fecalismo. Citoplasma Dos zonas: Endoplasma: granuloso Ectoplasma: hialino Se movilizan por pseudópodos. Pseudópodos: extensiones
SALUT MATERNOINFANTIL: SALUT DE LA DONA i SALUT INFANTIL
 Nov. 2011 SALUT MATERNOINFANTIL: SALUT DE LA DONA i SALUT INFANTIL Dra. Magda Campins Hospital Universitari Vall d Hebron. d Facultat de Medicina. UAB SALUT MATERNOINFANTIL Objetivo: Conseguir un óptimo
Nov. 2011 SALUT MATERNOINFANTIL: SALUT DE LA DONA i SALUT INFANTIL Dra. Magda Campins Hospital Universitari Vall d Hebron. d Facultat de Medicina. UAB SALUT MATERNOINFANTIL Objetivo: Conseguir un óptimo
SIDA. Duración en horas: 60
 SIDA Duración en horas: 60 OBJETIVOS: La importancia que ha adquirido la infección por VIH/SIDA y sus consecuencias en la clínica diaria son muy importantes, tanto a nivel hospitalariocomo a nivel ambulatorio.
SIDA Duración en horas: 60 OBJETIVOS: La importancia que ha adquirido la infección por VIH/SIDA y sus consecuencias en la clínica diaria son muy importantes, tanto a nivel hospitalariocomo a nivel ambulatorio.
MICROBIOLOGÍA CLÍNICA Y SANITARIA CARACTERÍSTICAS GENERALES DE LOS PARÁSITOS
 Concepto Tipos de parásitos Clasificación Protozoos Helmintos o gusanos Artrópodos Tipos de ciclos Patogenia Diagnóstico SIMBIOSIS Comensalismo. Mutualismo. PARASITISMO: Hospedador Parásito TIPOS DE PARÁSITOS
Concepto Tipos de parásitos Clasificación Protozoos Helmintos o gusanos Artrópodos Tipos de ciclos Patogenia Diagnóstico SIMBIOSIS Comensalismo. Mutualismo. PARASITISMO: Hospedador Parásito TIPOS DE PARÁSITOS
3. Defunciones y tasas de la mortalidad neonatal según causa y periodo, por sexo. Casos y tasas por nacidos vivos.
 2005-2013 2005-2007 2008-2010 Casos Tasa Casos Tasa Casos Tasa 01-54. Todas las causas 240 2,9 97 3,5 68 2,4 I. 01-05. Enfermedades infecciosas y parasitarias 1. Enfermedades infecciosas intestinales 2.
2005-2013 2005-2007 2008-2010 Casos Tasa Casos Tasa Casos Tasa 01-54. Todas las causas 240 2,9 97 3,5 68 2,4 I. 01-05. Enfermedades infecciosas y parasitarias 1. Enfermedades infecciosas intestinales 2.
INFORMACIÓN GENERAL QUÉ ES EL ZIKA?
 INFORMACIÓN GENERAL QUÉ ES EL ZIKA? El Zika es un virus transmitido por la picadura de un zancudo hembra infectado del género Aedes. También puede transmitirse a través de relaciones sexuales sin protección
INFORMACIÓN GENERAL QUÉ ES EL ZIKA? El Zika es un virus transmitido por la picadura de un zancudo hembra infectado del género Aedes. También puede transmitirse a través de relaciones sexuales sin protección
Técnico en Hematología y Hemoterapia. Sanidad, Dietética y Nutrición
 Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
Linfocitos T e inmunidad celular. Inmunidad humoral.
 Linfocitos T e inmunidad celular. Inmunidad humoral. García Servicio de Alergología H.U.V.A - Murcia La inmunidad o respuesta inmune es la respuesta a sustancias extrañas (antígenos), incluyendo microorganismos,
Linfocitos T e inmunidad celular. Inmunidad humoral. García Servicio de Alergología H.U.V.A - Murcia La inmunidad o respuesta inmune es la respuesta a sustancias extrañas (antígenos), incluyendo microorganismos,
Inmunizaciones. Vacunas Infantiles. Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Objetivo:
 Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
EL VIRUS VIH (VIRUS DE LA INMUNODEFICIENCIA HUMANA) Infecta linfocitos T CD4+
 Infección causada por un virus Infección crónica Infecta linfocitos T CD4+ Consecuencias de la infección crónica Epidemiología de la enfermedad en el mundo y en Murcia Formas de contagio Predicción de
Infección causada por un virus Infección crónica Infecta linfocitos T CD4+ Consecuencias de la infección crónica Epidemiología de la enfermedad en el mundo y en Murcia Formas de contagio Predicción de
MEDIDAS PREVENTIVAS EMBARAZADAS O EN LACTANCIA
 RUBEOLA con niños infectados y con sus secreciones respiratorias. con objetos contaminados. - Procesado y análisis de muestras, fundamentalmente las operaciones que generan aerosoles. - Manejo de objetos
RUBEOLA con niños infectados y con sus secreciones respiratorias. con objetos contaminados. - Procesado y análisis de muestras, fundamentalmente las operaciones que generan aerosoles. - Manejo de objetos
LINEAMIENTOS DE LA UTILIZACION DEL DIAGNÓSTICO Y VIGILANCIA DE LABORATORIO PARA LA ENFERMEDAD DE ZIKA, CHIKUNGUNYA Y DENGUE
 LINEAMIENTOS DE LA UTILIZACION DEL DIAGNÓSTICO Y VIGILANCIA DE LABORATORIO PARA LA ENFERMEDAD DE ZIKA, CHIKUNGUNYA Y DENGUE LABORATORIO NACIONAL DE SALUD Unidad Central de Referencia para la Vigilancia
LINEAMIENTOS DE LA UTILIZACION DEL DIAGNÓSTICO Y VIGILANCIA DE LABORATORIO PARA LA ENFERMEDAD DE ZIKA, CHIKUNGUNYA Y DENGUE LABORATORIO NACIONAL DE SALUD Unidad Central de Referencia para la Vigilancia
Título: Algunas consideraciones sociales sobre la Tuberculosis
 FACULTAD DE TECNOLOGIA DE LA SALUD TRABAJO PARA OPTAR POR LA CATEGORIA DE PROFESOR AUXILIAR Título: Algunas consideraciones sociales sobre la Tuberculosis Autor: MSc. Luis alberto Rivero Capote Ciudad
FACULTAD DE TECNOLOGIA DE LA SALUD TRABAJO PARA OPTAR POR LA CATEGORIA DE PROFESOR AUXILIAR Título: Algunas consideraciones sociales sobre la Tuberculosis Autor: MSc. Luis alberto Rivero Capote Ciudad
LEUCOSIS VIRAL BOVINA : enfermedad infecciosa que afecta a la producción
 LEUCOSIS VIRAL BOVINA : enfermedad infecciosa que afecta a la producción Prof. Dr. Antonio Rodríguez S. (*) La leucosis bovina (LB) es una enfermedad infecciosa producida por el retrovirus de la familia
LEUCOSIS VIRAL BOVINA : enfermedad infecciosa que afecta a la producción Prof. Dr. Antonio Rodríguez S. (*) La leucosis bovina (LB) es una enfermedad infecciosa producida por el retrovirus de la familia
Ictericia Neonatal. Ictericia e hiperbilirrubinemia son conceptos semejantes. Hiperbilirrubinemia se refiere al alza sérica de la bilirrubina.
 Ictericia Neonatal Ictericia e hiperbilirrubinemia son conceptos semejantes. Ictericia es el signo clínico. Hiperbilirrubinemia se refiere al alza sérica de la bilirrubina. Es la coloración amarillenta
Ictericia Neonatal Ictericia e hiperbilirrubinemia son conceptos semejantes. Ictericia es el signo clínico. Hiperbilirrubinemia se refiere al alza sérica de la bilirrubina. Es la coloración amarillenta
Diagnóstico microbiológico de las hepatitis virales. Juan Carlos Rodríguez S. Microbiología Hospital General Universitario de Alicante
 Diagnóstico microbiológico de las hepatitis virales Juan Carlos Rodríguez S. Microbiología Hospital General Universitario de Alicante Hepatitis A. Características generales Provoca enfermedad aguda en
Diagnóstico microbiológico de las hepatitis virales Juan Carlos Rodríguez S. Microbiología Hospital General Universitario de Alicante Hepatitis A. Características generales Provoca enfermedad aguda en
Diagnóstico microbiológico de la infección por HIV
 Diagnóstico microbiológico de la infección por HIV Juan Carlos Rodríguez Díaz S. Microbiología Hospital General Universitario de Alicante E-mail: rodriguez_juadia@gva.es http://microbiología-alicante.umh.es
Diagnóstico microbiológico de la infección por HIV Juan Carlos Rodríguez Díaz S. Microbiología Hospital General Universitario de Alicante E-mail: rodriguez_juadia@gva.es http://microbiología-alicante.umh.es
RECIEN NACIDO HIJO DE MADRE HBsAg. Congreso Nacional de VIH Dr. Julio W. Juárez Guatemala septiembre 2013
 RECIEN NACIDO HIJO DE MADRE HBsAg Congreso Nacional de VIH Dr. Julio W. Juárez Guatemala septiembre 2013 TRANSMISION VERTICAL La transmisión puede ocurrir in útero solo en un 2-10% asociada con niveles
RECIEN NACIDO HIJO DE MADRE HBsAg Congreso Nacional de VIH Dr. Julio W. Juárez Guatemala septiembre 2013 TRANSMISION VERTICAL La transmisión puede ocurrir in útero solo en un 2-10% asociada con niveles
DIAGNÓSTICO DE LABORATORIO DE LA INFECCIÓN POR EL VIRUS DE LA DIARREA VÍRICA BOVINA (BVDV)
 DIAGNÓSTICO DE LABORATORIO DE LA INFECCIÓN POR EL VIRUS DE LA DIARREA VÍRICA BOVINA (BVDV) Debido a los distintos cuadros que puede originar el BVDV el diagnóstico clínico es complicado. En función de
DIAGNÓSTICO DE LABORATORIO DE LA INFECCIÓN POR EL VIRUS DE LA DIARREA VÍRICA BOVINA (BVDV) Debido a los distintos cuadros que puede originar el BVDV el diagnóstico clínico es complicado. En función de
AISLAMIENTO UNIVERSAL
 AISLAMIENTO UNIVERSAL OBJETIVO: Llevar a cabo las medidas de protección que deben observarse de forma sistemática y generalizada en el ámbito hospitalario. 1 EQUIPAMIENTO NECESARIO: Jabón antiséptico y
AISLAMIENTO UNIVERSAL OBJETIVO: Llevar a cabo las medidas de protección que deben observarse de forma sistemática y generalizada en el ámbito hospitalario. 1 EQUIPAMIENTO NECESARIO: Jabón antiséptico y
Niño de 10 días de vida RNT (39 semanas) APEG: Peso: kg nacido de parto vaginal. Madre de 27 años sana. Padre de 30 años cursando un cuadro
 Buenos Aires14 al 16 de abril de 2011 Sesión Interactiva Interpretación de los métodos diagnósticos en infecciones perinatales Sábado 16 de abril 10:30 hs a 12:15 hs Casos relacionados con el diagnostico
Buenos Aires14 al 16 de abril de 2011 Sesión Interactiva Interpretación de los métodos diagnósticos en infecciones perinatales Sábado 16 de abril 10:30 hs a 12:15 hs Casos relacionados con el diagnostico
premium Test de Cribado Prenatal No Invasivo en sangre materna
 Test de Cribado Prenatal No Invasivo en sangre materna Software de resultados BGI con marcado CE para la trisomía 21 Detecta las trisomías fetales de los cromosomas 21, 18 y 13 Informa de las trisomías
Test de Cribado Prenatal No Invasivo en sangre materna Software de resultados BGI con marcado CE para la trisomía 21 Detecta las trisomías fetales de los cromosomas 21, 18 y 13 Informa de las trisomías
LABORATORIO No. 6 HELMINTOS/PLATELMINTOS
 LABORATORIO No. 6 HELMINTOS/PLATELMINTOS PARTE II: PLATELMINTOS B. CESTODOS O TENIAS: Son gusanos planos de forma acintada, constituídos por escólex, cuello y estróbilo el cual esta constituído por segmentos
LABORATORIO No. 6 HELMINTOS/PLATELMINTOS PARTE II: PLATELMINTOS B. CESTODOS O TENIAS: Son gusanos planos de forma acintada, constituídos por escólex, cuello y estróbilo el cual esta constituído por segmentos
LA ECOGRAFÍA DE LAS SEMANAS
 LA ECOGRAFÍA DE LAS 22-26 SEMANAS 16 esta edad de embarazo, el feto pesa entre 400 600 grs y mide entre 23 30 cm desde la cabeza al talón. La madre ya percibe los movimientos fetales. En este periodo,
LA ECOGRAFÍA DE LAS 22-26 SEMANAS 16 esta edad de embarazo, el feto pesa entre 400 600 grs y mide entre 23 30 cm desde la cabeza al talón. La madre ya percibe los movimientos fetales. En este periodo,
La supervivencia de las especies requiere que sus individuos se multipliquen para reemplazar a los que mueren.
 1. LA REPRODUCCIÓN Y EL CICLO VITAL La supervivencia de las especies requiere que sus individuos se multipliquen para reemplazar a los que mueren. La reproducción es la función por la cual los seres vivos
1. LA REPRODUCCIÓN Y EL CICLO VITAL La supervivencia de las especies requiere que sus individuos se multipliquen para reemplazar a los que mueren. La reproducción es la función por la cual los seres vivos
Dirección de Redes en Salud Pública
 Dirección de Redes en Salud Pública Recolección de muestras para el estudio de Microcefalias y otras mal formaciones del SNC posiblemente asociadas a infección por virus Zika 22 de Febrero de 2016 Confirmación
Dirección de Redes en Salud Pública Recolección de muestras para el estudio de Microcefalias y otras mal formaciones del SNC posiblemente asociadas a infección por virus Zika 22 de Febrero de 2016 Confirmación
Si desea ampliar la información de estos y otros eventos pueden consultar en nuestro sitio Web medellin.gov.co/salud
 Boletín Epidemiológico Boletín número 3, año 2013 Presentación El Boletín Epidemiológico Medellín, Ciudad Saludable es una publicación de la Secretaría de Salud de Medellín, que pretende ofrecer a los
Boletín Epidemiológico Boletín número 3, año 2013 Presentación El Boletín Epidemiológico Medellín, Ciudad Saludable es una publicación de la Secretaría de Salud de Medellín, que pretende ofrecer a los
