Cristal iónico. U 0 experimental. H atm. 108 kj/mol Na + (g) atm. AE -354 = H f ( H kj/mol = H atm. H f
|
|
|
- Pablo Vidal Domínguez
- hace 6 años
- Vistas:
Transcripción
1 Cistal iónico Na + (g + Cl- (g NaCl (s Hº ed U expeimental Na (s Na (g H atm 18 kj/mol Na (g Na + (g EI 5 ½ Cl (g Cl (g H atm 11 Cl (g Cl - (g AE -354 Na + (g + Cl- (g NaCl (s Hº ed = H f ( H Na atm + EI + H Cl atm + AE Na (s + ½ Cl (g NaCl (s H f -411 kj/mol H f = H atm Na + EI + H atm Cl + AE + Hº ed Hº ed = -411 ( = -788 J/mol
2 U Calc U = U + U c B + U L + U Z + coección x T +... U Calc U C U c = - 6 N A z + z - e + 1 N A z + z - e U c = - N A z + z - e [ ] 3 5 U c = - N A z + z - e A
3 U c = - N A z + z - e A kj/mol A constante de Madelung = (distancia inteiónica =.814 x1 1 m N A = 6.3 x 1 3 e caga del e = x 1 19 C ε = x 1 1 C /Jm = x 1 3 mol -1 (1 (1 (1.618 ( x 1 19 C ( π ( x 1 1 C /Jm (.814( x1 1 m C /mol J/mol (C /Jm m U B U B 1 / n U = N B A B / n paa un pa iónico n coef. de Bon, n = depende de la densidad de la nube electónica expeimental, de la compesibilidad del cistal, esistencia de un ión a acecase lo máximo a oto. B cte. de popocionalidad que se disciene en equilibio cuando la fza atactiva y epulsiva se igualan, = du = = d (U c +U B d d
4 Ec. de Bon- Landé = U + U c B = - N A z + z - e A + N A B n factoizando: = - N A z + z - e A (1 1/n A = constante de Madelung n = exponente de Bon = = (distancia inteiónica nica z + y z - = cagas catión y anión N A = 6.3 x 1 3 e caga del e = x 1 19 C ε = x 1 1 C /Jm du = = N A z + z - e A - nn A B d (= De donde se despeja B n+1 B = z + z - e A ( n-1 n Y se sustituye en Ión tipo Ej n He-He Ne-Ne LiH 5 NaF, MgO 7 * NaCl 8 A-A K-K Xe-Xe KCl, CaS, CuCl 9 RbB, AgB 1 CsI 1
5 U paa el NaCl A constante de Madelung = n exponente de Bon = (distancia inteiónica =.814 x1 1 m z + y z - = 1 N A = 6.3 x 1 3 e caga del e = x 1 19 C ε = x 1 1 C /Jm = 6.3 x 1 3 mol -1 (1 (1 (1.618 ( x 1 19 C (1.748 (1 1/8 4π ( x 1 1 C /Jm (.814( x1 1 m =.757x1-14 (7/8C /mol J/mol 3.139x1 - ( C /Jm m = (7/8 = J/mol x 1kJ = kj/mol 1J U c = U B = U paa el NaCl Ec Bon-Lande (U c B Hº ed KJ/mol % 1% U c =
6 U L Enegía de London Las expesiones de Bon-Landéy Bon-Maye no toman en cuenta las fuezas atactivas de London. U = + N B N N NU AAz e C D o = - N A z + z - e A A exp (1 1/n A 6 A 8 ρ Enegía de London (U L Donde : C 6 D 8 Componente de las fuezas de dispesión dipolo-dipolo Componente de las fuezas de dispesión dipolo- cuadupolo Cálculo del valo de la constante C dipolo-dipolo J. E. Maye (1933 Paa un pa de iones M + X - 1 Ccistal = kc+ + k ( C++ + C C 3 E E 1 = ( E1 E α α C 3 = E α C 3 = E α 4
7 C 3 E E 1 = ( E1 E α α C 3 = E α C 3 = E α 4 Donde: α 1 y α es la polaizabilidad de cada ión, E1 y E son las enegías caacteísticas de los dos iones La enegía caacteística teóicamente esta dada po hν, donde ν es la fecuencia de absoción máxima en el ultavioleta del ión en el cistal. Sin embago, en la páctica se utilizan solo apoximaciones de éstas enegías. Paa el AgCl Datos: Polaizabilidad α Ag+ = 1.7 x 1-3 m 3 (Calculados po Pauling α Cl- = 3.45 x 1-3 m 3 Enegía caacteística E+ = 3.1 x 1-18 J / molécula (El 9 % del potencial de ionización = 1.48 ev E- = x 1-18 J / molécula (Calculado del especto de absoción UV C cistal = 79.5 x 1-78 J m 6 / molécula =.77 x 1-1 m Entonces: C = x 1 = -1.9 ev = -16 kj/mol -18 J/molécula 6
8 dipolo-cuadupolo D De manea geneal, la contibución de la inteaccción dipolocuadupolo coesponde al 1- % del valo de la inteacción dipolo-dipolo. Inteacción dipolo-cuadupolo D 8 = 19 KJ / mol Entonces, la enegía total de dispesión de London paa el AgCl es : U L = -16 KJ / mol - 19 KJ / mol = -15 KJ/mol U L = N A C N D 6 A 8 el AgCl es un cistal con estuctua de NaCl = U + U c B + U L U = U o = - N A z + zn - e B A (1 1/n N N N AAz e C D A exp A 6 A 8 ρ = x 1 3 mol -1 (1 (1 (1.618 ( x 1 19 C (1.748 (1 1/8 15 [KJ/mol] 4π ( x 1 1 C /Jm (.96( x1 1 m = -.757x1-14 (7/8 [J/mol] -15 [KJ/mol] x1 - U C = kj/mol U B = kj/mol = [KJ/mol] - 15 [KJ/mol] = KJ/mol Ec Bon-Lande
9 Ag (s Ag (g H atm 86 KJ/mol Ag (g Ag + (g EI 73.8 ½ Cl (g Cl (g H atm 11 Cl (g Cl - (g -AE -354 Ag + (g + Cl- (g Ag Cl (s Hº ed = H f ( H atm Ag + EI + H atm Cl + AE Ag (s + ½ Cl (g AgCl (s H f -17 kj/mol Hº ed = Ec Bon-Lande Ec Bon-Lande + U L Hº ed KJ/mol KJ/mol % 95.6% 1% Factoes que povocan el aumento en la enegía de London Un alto númeo de coodinación. Una distancia intenuclea pequeña. Iones con altos valoes de polaizabilidad.
10 Polaizabilidad α+ Li + Be + Cu + Zn + Al Na + Mg + Ag + Cd + Ga k + Ca + Au + Hg + In Rb + S + Tl α- H - F - O Cl - S B - Se I - Te Cs + Ba Enegía de punto ceo (U Z La U a T = OK donde pesisten la vibaciones de la ed (fecuencia de Debye 1 U Z = N A hv max
11 Componentes de la enegía de ed (kj/mol H 98 H 98 Compuesto U (calc U C U B U L U Z (calc. (ciclo Bon NaCl CsI AgI CuB AgCl NaCl -77 es del 97.9% CsI -58 es del 96.4 % AgI -795 es del 89.% CuB -87 es del 89 % AgCl -84 es del 9.% Simplificando la Ec de Bon-Lande U = - N A A z + z - e (1-1/ 1/n ( U = x 1-4 A z + z - (1-1/ 1/n (J m/mol (distancia inteiónica, m ( pm = 1x1-1 m = 1 - Ả U = x 1 5 A z + z - (1-1/ 1/n (kj pm /mol ( (distancia inteiónica,pm pm
12 Ecuación de Kapustinsky Usada en casos donde los datos expeimentales son escasos paa el calculo de la enegía de ed. Pincipalmente cuando no se conoce el tipo de estuctua del cistal. Ecuación de Kapustinsky Bon-Landé N AAZ e 1 U = 1 n U N AAe v ZcZa 1 = 1 + n c a Bon-Maye U N AAz e ρ = 1 U N AAe v ZcZ a ρ = 1 c + a c + a Donde: v es el númeo de iones en la fomula simple, Z c y Z a son las cagas del catión y el anión, c y a son los adios iónicos Pauling o de Goldschmidt
13 Genealización de los datos del NaCl a otas estuctuas: U N AAZ e 1 = 1 n A A NaCl = c + a nm n 8 N Ae = 11.4 ZcZa U = -18 v K + c a
14 Ecuación de Bon-Landé N AAz e 1 U = 1 n *MgF tiene estuctua de utilo, la constante de Madelung A=.48 *Distancia intenuclea expeimental Mg +, F - =.1 nm, =.1 x 1-1 m *z=1, Ejemplo : MgF U = x 1-4 A z + z - (1-1/ 1/n J/mol ( (m Ecuación de Kapustinsky *Zc = +, Za = -1 *v = 3 Mg+.78 nm, F- =.133 nm.11nm ZcZa U = 18v K + c a * n=8 U = -76 KJ/mol U = - KJ/mol Ejemplo : MgF Del ciclo de Bon-Habe Mg (s H atm 149 kj/mol EI 1 +EI y 145 ½ F (g H atm 79 -AE -339 MgF (s Hº ed = MgF (s H f -113 kj/mol
15 Radio temodinámico Cómo sabe cual es el adio de un ión poliatómico? O cuanta enegía equiee la fomación de un ión poliatómico? Sean dos compuestos A= Na SO 4 y B = K SO 4 paa los cuales se conocen sus H f y los adios iónicos de los cationes son conocidos: U A U B = [ H f (NaSO 4 - H f (K SO 4 ] [ H f Na + (g - H f K+ (g ] Al evalua la difeencia en la enegía de ed es posible sustitui en la ecuación de Kapustinsky y tene como única incógnita el adio del anión. Los adios obtenidos mediante este tatamiento se conocen como adios temodinámicos. kj/mol ΔH (Na + 1 Poceso eal? AE - 1+ (SO4 =? ΔH (SO4 -??? 1+ Hº ed Na SO 4(s kj/mol H f H ed NaSO4 NaSO4 = H f - ΔH (Na + - ΔH (SO - 4 = ΔH (SO - 4
16 kj/mol ΔH (K + 1 Poceso eal? AE - 1+ (SO4 =? ΔH (SO4 -??? 1+ K SO 4(s kj/mol H f Hº ed H ed KSO4 KSO4 = H f - ΔH (K + - ΔH (SO - 4 = - ΔH (SO - 4 H ed NaSO4 NaSO4 = H f - ΔH (Na + - ΔH (SO - 4 = ΔH (SO - 4 H edkso4 edkso4 = H f - ΔH (K + - ΔH (SO - 4 = ΔH (SO - 4 H KSO4 H NaSO4 = (Na+ (Na+ = 116 pm =.116 nm (K+ = 15 pm.15 nm (K+
17 Regla de los adios Apoximación paa pedeci el # de coodinación de los iones. La azón de R = + / - da una guía de cuantos cationes pueden acomodase alededo de un anión. # coodinación 4 td debajo de oct ente.414 y.73 8 cúbico ente.73 y 1 1 dodecaedo 1 Se asumen esfeas duas po lo que pueden desviaciones impotantes, Ej. ZnS.5 peo es #4 Reglas de FAJAN S gado de ionicidad y pode polaizante Gado de ionicidad depende del pode polaizante (PP del catión y de la polaizabilidad (P de anión Paa un catión A n+ PP seá ne /(4/3 π A3 Paa un anión B m- P seá me (4/3 π B3 Reglas de Fajans Cuanto más m polaizante es el catión, mayo seá el caácte cte covalente del enlace. El caácte covalente se incementa al decece el tamaño del Catión y/o incementase la caga del mismo Cuanto más polaizable es el anión, n, mayo el caácte cte covalente, que se incementa al incementase el tamaño y/o la caga del anión La polaización del enlace (y po lo tanto el caácte covalente aumenta cuando el catión no tiene configuación n de gas noble. Esto se da en los metales de tansición (gupos 3-1 y en el bloque f debido a que sus obitales d y f se extienden lejos del núcleo y po tanto son más fáciles de polaiza, ya que están menos ataídos po el núcleo
18 Ejemplo NaX F Cl B I kj/mol H atm Na EI H atm X -AE H ed H f
19 Ejemplo MI Li Na K Rb Cs kj/mol H atm M EI H atm I -AE H ed H f M (s + ½ X (g MX (s
VARIACIONES PERIÓDICAS. Z = 53 Z = 53 Z = 53 Electrones = 54 Electrones = 53 Electrones = 52
 RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
Ilustración 15.1. El número de coordinación en el NaCl es 6:6. Cada ion esta rodeado por seis iones que tienen carga opuesta a él.
 ENLACE IÓNICO Tú sabes que existen sustancias que forman sólidos cristalinos con altos puntos de fusión, que no conducen la corriente en estado sóliso pero se vuelven buenos conductores al fundirlos o
ENLACE IÓNICO Tú sabes que existen sustancias que forman sólidos cristalinos con altos puntos de fusión, que no conducen la corriente en estado sóliso pero se vuelven buenos conductores al fundirlos o
La tabla periódica. Julius Lothar Meyer. Dimitri Ivanovich Mendeleev
 La tabla periódica Julius Lothar Meyer Dimitri Ivanovich Mendeleev Silvia Ponce López ITESM, Julio 2007 Contenidos Organización de los elementos en la tabla periódica Propiedades periódicas: radio atómico,
La tabla periódica Julius Lothar Meyer Dimitri Ivanovich Mendeleev Silvia Ponce López ITESM, Julio 2007 Contenidos Organización de los elementos en la tabla periódica Propiedades periódicas: radio atómico,
Líquidos Tensión superficial, viscosidad, presión de vapor. Sólidos Sólidos covalentes, iónicos, moleculares y metálicos
 Fuerzas intermoleculares Estados de agregación de la materia Gases Gases ideales y reales Líquidos Tensión superficial, viscosidad, presión de vapor Sólidos Sólidos covalentes, iónicos, moleculares y metálicos
Fuerzas intermoleculares Estados de agregación de la materia Gases Gases ideales y reales Líquidos Tensión superficial, viscosidad, presión de vapor Sólidos Sólidos covalentes, iónicos, moleculares y metálicos
CAPITULO 2 LA TABLA PERIODICA
 1.0079 1 H HIDROGENO 6.941 3 Li LITIO 22.989 11 Na SODIO 30.098 19 K POTASIO CAPITULO 2 LA TABLA PERIODICA ORDENAMIENTO ACTUAL GRUPOS Y PERIODOS PROPIEDADES PERIODICAS TAMAÑO POTENCIAL DE IONIZACION AFINIDAD
1.0079 1 H HIDROGENO 6.941 3 Li LITIO 22.989 11 Na SODIO 30.098 19 K POTASIO CAPITULO 2 LA TABLA PERIODICA ORDENAMIENTO ACTUAL GRUPOS Y PERIODOS PROPIEDADES PERIODICAS TAMAÑO POTENCIAL DE IONIZACION AFINIDAD
FÍSICA I TEMA 0: INTRODUCCIÓN
 FÍSICA I TEMA 0: INTRODUCCIÓN 1. Expesa en los sistemas cegesimal, intenacional y técnico el peso y la masa de un cuepo de 80 Kg. de masa. CEGESIMAL Centímeto, gamo y segundo. 80 Kg 80 Kg * 1000 g /Kg
FÍSICA I TEMA 0: INTRODUCCIÓN 1. Expesa en los sistemas cegesimal, intenacional y técnico el peso y la masa de un cuepo de 80 Kg. de masa. CEGESIMAL Centímeto, gamo y segundo. 80 Kg 80 Kg * 1000 g /Kg
Tema 3. Relaciones periódicas entre los elementos
 Tema 3. Relaciones periódicas entre los elementos. Desarrollo de la tabla periódica. Clasificación de los elementos. Variaciones periódicas de propiedades físicas: carga nuclear efectiva, radio atómico,
Tema 3. Relaciones periódicas entre los elementos. Desarrollo de la tabla periódica. Clasificación de los elementos. Variaciones periódicas de propiedades físicas: carga nuclear efectiva, radio atómico,
Tema 5: El enlace iónico
 - - BIBLIOGRAFÍA: * Química. Cuso Univesitaio B.M. Mahan y R.J. Myes * Temas básicos de Química J. Mocillo * Fundamentos de Química Geneal J.L. Lozano y J.L. Vigata * Intoducción al Enlace Químico S. Tolosa
- - BIBLIOGRAFÍA: * Química. Cuso Univesitaio B.M. Mahan y R.J. Myes * Temas básicos de Química J. Mocillo * Fundamentos de Química Geneal J.L. Lozano y J.L. Vigata * Intoducción al Enlace Químico S. Tolosa
Química Inorgánica-63.13- Dra.Silvia E. Jacobo. Sólidos. Estructuras Cristalinas
 Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
13.6. Cuál de los siguientes átomos tiene la primera energía de ionización más baja? a) Ne b) F c) He d) Li e) O (O.Q.N.
 Problemas y Cuestiones de las Olimpiadas de Química 373 13. SISTEMA PERIÓDICO 13.1 Cuál de los siguientes átomos tiene la primera energía de ionización más alta? a) Be b) He c) N d) Ne e) B (O.Q.N. Navacerrada
Problemas y Cuestiones de las Olimpiadas de Química 373 13. SISTEMA PERIÓDICO 13.1 Cuál de los siguientes átomos tiene la primera energía de ionización más alta? a) Be b) He c) N d) Ne e) B (O.Q.N. Navacerrada
FIS Átomos de Múltiples Electrones
 FIS-433- Átomos de Múltiples Electones Todos los átomos contienen vaios electones, po consiguiente el poblema que hemos estudiado hasta ahoa paece no tene mucho valo. Existen apoximadamente 90 tipos de
FIS-433- Átomos de Múltiples Electones Todos los átomos contienen vaios electones, po consiguiente el poblema que hemos estudiado hasta ahoa paece no tene mucho valo. Existen apoximadamente 90 tipos de
!G o =!H o " T!S o. Tema 5: Termodinámica Inorgánica. Qué es un proceso físico espontáneo? Dirección de procesos espontáneos
 Estructura de la materia Temas 1 a 4 Módulo 12555- Química Inorgánica Título: Ingeniería Química Responsable: Juan José Borrás http://www.uv.es/~borrasj curso 2006-07!G o =!H o " T!S o Reactividad Química
Estructura de la materia Temas 1 a 4 Módulo 12555- Química Inorgánica Título: Ingeniería Química Responsable: Juan José Borrás http://www.uv.es/~borrasj curso 2006-07!G o =!H o " T!S o Reactividad Química
4 El enlace químico. 4.1 La formación de pares iónicos
 acultad de armacia. Universidad de Alcalá 41 4 El enlace químico 4.1 La formación de pares iónicos 4.2 La formación de sólidos iónicos: entalpía de red 4.3 Influencia de la entalpía de red en algunas propiedades
acultad de armacia. Universidad de Alcalá 41 4 El enlace químico 4.1 La formación de pares iónicos 4.2 La formación de sólidos iónicos: entalpía de red 4.3 Influencia de la entalpía de red en algunas propiedades
ENLACE QUÍMICO Y ESTRUCTURA DE LA MATERIA
 PROBLEMAS DE LA ASIGNATURA: ENLACE QUÍMICO Y ESTRUCTURA DE LA MATERIA ÁREA DE QUÍMICA INORGÁNICA 1º CURSO. LICENCIATURA EN CIENCIAS QUÍMICAS CURSO 2006/2007 PROFESOR RESPONSABLE: - Dr. Luis Sánchez Granados
PROBLEMAS DE LA ASIGNATURA: ENLACE QUÍMICO Y ESTRUCTURA DE LA MATERIA ÁREA DE QUÍMICA INORGÁNICA 1º CURSO. LICENCIATURA EN CIENCIAS QUÍMICAS CURSO 2006/2007 PROFESOR RESPONSABLE: - Dr. Luis Sánchez Granados
ORGANIZACIÓN DE LOS ELEMENTOS EN LA TABLA PERIÓICA PROPIEDADES PERIÓDICAS
 Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Problemario de Talleres de Estructura de la Materia. DCBI/UAM-I. Obra Colectiva del. / Revisión octubre del 2012 UNIDAD 2
 UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
Enlaces químicos I: conceptos básicos. Capítulo 9
 Enlaces químicos I: conceptos básicos Capítulo 9 Los electrones de valencia son los últimos electrones de un orbital en un átomo, que son los causantes de los enlaces químicos. Grupo e - configuración
Enlaces químicos I: conceptos básicos Capítulo 9 Los electrones de valencia son los últimos electrones de un orbital en un átomo, que son los causantes de los enlaces químicos. Grupo e - configuración
v L G M m =m v2 r D M S r D
 Poblemas de Campo Gavitatoio 1 Calcula la velocidad media de la iea en su óbita alededo del ol y la de la luna en su óbita alededo de la iea, sabiendo que el adio medio de la óbita luna es 400 veces meno
Poblemas de Campo Gavitatoio 1 Calcula la velocidad media de la iea en su óbita alededo del ol y la de la luna en su óbita alededo de la iea, sabiendo que el adio medio de la óbita luna es 400 veces meno
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
Objetivos del tema. Tema 4 Propiedades atómicas. Contenido del tema. El tamaño de los atomos. Bibliografía!Tema 10 del Petrucci (pag.
 Módulo 12865- Enlace Químico y Estructura de la Materia Responsable: Juan José Borrás (juan.j.borras@uv.es) Grupo D- Aula F-11 http://www.uv.es/~borrasj Tema 4 Propiedades atómicas Bibliografía!Tema 10
Módulo 12865- Enlace Químico y Estructura de la Materia Responsable: Juan José Borrás (juan.j.borras@uv.es) Grupo D- Aula F-11 http://www.uv.es/~borrasj Tema 4 Propiedades atómicas Bibliografía!Tema 10
Dieléctricos Campo electrostático
 Dielécticos Campo electostático 1. Modelo atómico de un dieléctico. 2. Dielécticos en pesencia de campos elécticos:, D y. 4. negía en pesencia de dielécticos. 3. Ruptua dieléctica. BIBLIOGRAFÍA: Tiple.
Dielécticos Campo electostático 1. Modelo atómico de un dieléctico. 2. Dielécticos en pesencia de campos elécticos:, D y. 4. negía en pesencia de dielécticos. 3. Ruptua dieléctica. BIBLIOGRAFÍA: Tiple.
LA TABLA PERIÓDICA. 1
 LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
la radiación lección 2 Teledetección Dpto. de Ingeniería Cartográfica Carlos Pinilla Ruiz 1 Ingeniería Técnica en Topografía
 Dpto. de Ingenieía Catogáfica la adiación Calos Pinilla Ruiz 1 lección 2 Ingenieía Técnica en Topogafía la adiación Calos Pinilla Ruiz 2 Dpto. de Ingenieía Catogáfica sumaio Ingenieía Técnica en Topogafía
Dpto. de Ingenieía Catogáfica la adiación Calos Pinilla Ruiz 1 lección 2 Ingenieía Técnica en Topogafía la adiación Calos Pinilla Ruiz 2 Dpto. de Ingenieía Catogáfica sumaio Ingenieía Técnica en Topogafía
EJERCICIOS PROPUESTOS
 Solucionario 13 Sistema periódico EJERCICIOS PROPUESTOS 13.1 Identifica el período y bloque al que pertenece cada uno de los elementos cuya configuración electrónica es: a) [Kr] 4d 10 5s 5p 1 c) [Xe] 4f
Solucionario 13 Sistema periódico EJERCICIOS PROPUESTOS 13.1 Identifica el período y bloque al que pertenece cada uno de los elementos cuya configuración electrónica es: a) [Kr] 4d 10 5s 5p 1 c) [Xe] 4f
Tabla 4.1. Reglas de solubilidad para compuestos iónicos a 25ºC
 La disolución y la precipitación de compuestos son fenómenos que se presentan corrientemente en la naturaleza. Por ejemplo la preparación de muchos productos químicos industriales, como el Na 2 CO 3, está
La disolución y la precipitación de compuestos son fenómenos que se presentan corrientemente en la naturaleza. Por ejemplo la preparación de muchos productos químicos industriales, como el Na 2 CO 3, está
PSU QUIMICA 2010 RAOV - CYQ
 1 PSU QUIMICA 2010 RAOV - CYQ 2 NUMERO ATOMICO Y NUMERO MASICO 1.- Si los átomos A, B y C presentan la siguiente cantidad de partículas subatómicas: A.- 12 protones, 14 neutrones, 12 electrones B.- 12
1 PSU QUIMICA 2010 RAOV - CYQ 2 NUMERO ATOMICO Y NUMERO MASICO 1.- Si los átomos A, B y C presentan la siguiente cantidad de partículas subatómicas: A.- 12 protones, 14 neutrones, 12 electrones B.- 12
Contenido. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades periódicas:
 LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
El E.O. no tiene porqué ser la carga real que tiene un átomo, aunque a veces coincide.
 EQUILIBRIOS DE OXIDACIÓN-REDUCCIÓN (REDOX) 2º BACHILLERATO QUÍMICA 1.- Estado de oxidación. 2.- Concepto de oxidación y reducción. 3.- Ajuste de ecuaciones redox por el método del ión-electrón. 3.1. Reacciones
EQUILIBRIOS DE OXIDACIÓN-REDUCCIÓN (REDOX) 2º BACHILLERATO QUÍMICA 1.- Estado de oxidación. 2.- Concepto de oxidación y reducción. 3.- Ajuste de ecuaciones redox por el método del ión-electrón. 3.1. Reacciones
PROBLEMAS Y CUESTIONES DE FÍSICA Y QUÍMICA DE 3º ESO :
 PROBLEMAS Y CUESTIONES DE FÍSICA Y QUÍMICA DE 3º ESO : Tema 1 : La medida y el método científico 1).- Efectúa las siguientes conversiones de unidades : convertir : convertir : convertir: convertir: 20
PROBLEMAS Y CUESTIONES DE FÍSICA Y QUÍMICA DE 3º ESO : Tema 1 : La medida y el método científico 1).- Efectúa las siguientes conversiones de unidades : convertir : convertir : convertir: convertir: 20
7-2.- Propiedades periódicas de los elementos. UdeC/FCQ/M E König Unidad 7 (7-2)
 7-2.- Propiedades periódicas de los elementos. 1 7-2. Propiedades periódicas de los elementos Todo comportamiento físico y químico de los elementos se basa fundamentalmente en las configuraciones electrónicas
7-2.- Propiedades periódicas de los elementos. 1 7-2. Propiedades periódicas de los elementos Todo comportamiento físico y químico de los elementos se basa fundamentalmente en las configuraciones electrónicas
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
Electrostática. Campo electrostático y potencial
 Electostática Campo electostático y potencial 1. Caga eléctica Electostática estudio de las cagas elécticas en eposo ++ +- -- epulsión atacción Unidad de caga el electón e 1.602177x 10-19 19 C 1.1 Constituyentes
Electostática Campo electostático y potencial 1. Caga eléctica Electostática estudio de las cagas elécticas en eposo ++ +- -- epulsión atacción Unidad de caga el electón e 1.602177x 10-19 19 C 1.1 Constituyentes
Masa y composición isotópica de los elementos
 Masa y composición isotópica de los elementos www.vaxasoftware.com Z Sím A isótopo Abndancia natral Vida Prodcto 1 H 1 1,00782503207(10) 99,9885(70) 1,00794(7) estable D 2 2,0141017780(4) 0,0115(70) estable
Masa y composición isotópica de los elementos www.vaxasoftware.com Z Sím A isótopo Abndancia natral Vida Prodcto 1 H 1 1,00782503207(10) 99,9885(70) 1,00794(7) estable D 2 2,0141017780(4) 0,0115(70) estable
INSTITUTO POLITECNICO NACIONAL
 INSTITUTO POLITECNICO NACIONAL CECYT NO. 1 GONZALO VÁZQUEZ VELA GUÍA DE QUÍMICA I PERIÓDO ESCOLAR 2015-2016 ACADEMIA DE QUÍMICA TURNO VESPERTINO 1 Materia y Energía 1.- Calcula la energía, en Joules y
INSTITUTO POLITECNICO NACIONAL CECYT NO. 1 GONZALO VÁZQUEZ VELA GUÍA DE QUÍMICA I PERIÓDO ESCOLAR 2015-2016 ACADEMIA DE QUÍMICA TURNO VESPERTINO 1 Materia y Energía 1.- Calcula la energía, en Joules y
Actividad: Cómo son las configuraciones electrónicas?
 Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
Reacciones de transferencia de electrones
 Reacciones de transferencia de electrones Las reacciones de transferencia de electrones o reacciones de oxidación-reducción son aquellas en las que dos o más elementos cambian su número de oxidación. Número
Reacciones de transferencia de electrones Las reacciones de transferencia de electrones o reacciones de oxidación-reducción son aquellas en las que dos o más elementos cambian su número de oxidación. Número
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
TEMA 2 TEMA PROPIEDADES PERIÓDICAS DE LOS PROPIEDADES PERIÓDICAS DE ELEMENT LOS
 Tema 2 La Tabla Periódica TEMA 2 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS 1. Períodos y grupos. La clasificación de Mendeléev. 2. Periodicidad de las estructuras electrónicas. 3. Periodicidad de las propiedades
Tema 2 La Tabla Periódica TEMA 2 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS 1. Períodos y grupos. La clasificación de Mendeléev. 2. Periodicidad de las estructuras electrónicas. 3. Periodicidad de las propiedades
Examen de Selectividad de Física. Septiembre 2008. Soluciones.
 Depatamento de Física y Química. I. E.. Atenea (.. Reyes, Madid) Examen de electividad de Física. eptiembe 2008. oluciones. Pimea pate Cuestión 1. Calcule el módulo del momento angula de un objeto de 1000
Depatamento de Física y Química. I. E.. Atenea (.. Reyes, Madid) Examen de electividad de Física. eptiembe 2008. oluciones. Pimea pate Cuestión 1. Calcule el módulo del momento angula de un objeto de 1000
Introducción a la Formulación y Nomenclatura de las Sustancias Inorgánicas
 D EPA R T A M ENTO D E FÍSICA Y Q UÍM ICA Introducción a la Formulación y Nomenclatura de las Sustancias Inorgánicas José Manuel Ramírez Fernández Valencias y estados, grados o números de oxidación Con
D EPA R T A M ENTO D E FÍSICA Y Q UÍM ICA Introducción a la Formulación y Nomenclatura de las Sustancias Inorgánicas José Manuel Ramírez Fernández Valencias y estados, grados o números de oxidación Con
ELECTROQUÍMICA. 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday.
 ELECTROQUÍMICA 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday. Química 2º bachillerato Electroquímica 1 0. CONOCIMIENTOS
ELECTROQUÍMICA 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday. Química 2º bachillerato Electroquímica 1 0. CONOCIMIENTOS
CAMPO GRAVITATORIO FCA 04 ANDALUCÍA
 CAPO GAVIAOIO FCA 04 ANDALUCÍA. a) Al desplazase un cuepo desde una posición A hasta ota B, su enegía potencial disminuye. Puede aseguase que su enegía cinética en B es mayo que en A? azone la espuesta.
CAPO GAVIAOIO FCA 04 ANDALUCÍA. a) Al desplazase un cuepo desde una posición A hasta ota B, su enegía potencial disminuye. Puede aseguase que su enegía cinética en B es mayo que en A? azone la espuesta.
Fluidos: generalidades y definiciones.
 Fluidos: genealidades y definiciones. Intoducción a la Física Ambiental. Tema 4. Tema 4. IFA (Pof. RAMOS) 1 Tema 4.- Fluidos Genealidades y Definiciones. El fluido como medio continuo. Mecánica de los
Fluidos: genealidades y definiciones. Intoducción a la Física Ambiental. Tema 4. Tema 4. IFA (Pof. RAMOS) 1 Tema 4.- Fluidos Genealidades y Definiciones. El fluido como medio continuo. Mecánica de los
Tema 4: Propiedades periódicas de los elementos - 1 -
 Tema 4: Propiedades periódicas de los elementos - - BIBLIOGRAFÍA: * Estructura atómica y enlace químico J. Casabó i Gispert * Química. Curso Universitario B.M. Mahan y R.J. Myers * Química General R.H.
Tema 4: Propiedades periódicas de los elementos - - BIBLIOGRAFÍA: * Estructura atómica y enlace químico J. Casabó i Gispert * Química. Curso Universitario B.M. Mahan y R.J. Myers * Química General R.H.
Uniones Interatómicas Clasificación Elementos
 Universidad de La Frontera Fac. Ing. Cs. y Adm. Dpto. Cs. Químicas Uniones Interatómicas Clasificación Elementos Prof. Josefina Canales La Materia puede clasificarse ampliamente en 3 tipos: Elemento: Tipo
Universidad de La Frontera Fac. Ing. Cs. y Adm. Dpto. Cs. Químicas Uniones Interatómicas Clasificación Elementos Prof. Josefina Canales La Materia puede clasificarse ampliamente en 3 tipos: Elemento: Tipo
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015)
 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
En un grupo. En un período
 Propiedades Periódicas Radio atómico Potencial de ionización Electroafinidad Electronegatividad Radio atómico (r): es la distancia desde el núcleo al último electrón del átomo Sabemos que r n Al aumentar
Propiedades Periódicas Radio atómico Potencial de ionización Electroafinidad Electronegatividad Radio atómico (r): es la distancia desde el núcleo al último electrón del átomo Sabemos que r n Al aumentar
Apuntes de Electrostática Prof. J. Martín ETSEIT ELECTROESTÁTICA I CAMPO ELECTRICO EN EL ESPACIO LIBRE
 LCTROSTÁTICA I CAMPO LCTRICO N L SPACIO LIBR. Le de Coulomb. Cagas puntuales 3. Distibuciones de caga 4. Campo eléctico 5. cuaciones de campo 6. Le de Gauss 7. Potencial eléctico 8. negía potencial 9.
LCTROSTÁTICA I CAMPO LCTRICO N L SPACIO LIBR. Le de Coulomb. Cagas puntuales 3. Distibuciones de caga 4. Campo eléctico 5. cuaciones de campo 6. Le de Gauss 7. Potencial eléctico 8. negía potencial 9.
Tema 8. Sólidos iónicos
 Tema 8. Sólidos iónicos Definiciones Estructuras iónicas Derivadas de CCP Derivadas de HCP Derivadas de empaquetamientos no compactos Racionalización de las estructuras iónicas Principios de Laves Reglas
Tema 8. Sólidos iónicos Definiciones Estructuras iónicas Derivadas de CCP Derivadas de HCP Derivadas de empaquetamientos no compactos Racionalización de las estructuras iónicas Principios de Laves Reglas
NUEVAS PRÁCTICAS MOTIVADORAS PARA LOS ALUMNOS DE ESO. BINGO
 NUEVAS PRÁCTICAS MOTIVADORAS PARA LOS ALUMNOS DE ESO. BINGO Teresa Ruano Culla COLEGIO SAN ANTONIO DE PADUA II Catarroja Introducción: La motivación de este proyecto es realizar nuevas actividades en los
NUEVAS PRÁCTICAS MOTIVADORAS PARA LOS ALUMNOS DE ESO. BINGO Teresa Ruano Culla COLEGIO SAN ANTONIO DE PADUA II Catarroja Introducción: La motivación de este proyecto es realizar nuevas actividades en los
TEMA 6. SOLIDIFICACIÓN ESTRUCTURA DEL TEMA CTM SOLIDIFICACIÓN
 CM SOLIDIFICACIÓN EMA 6. SOLIDIFICACIÓN En pácticamente todos los metales, y en muchos semiconductoes, ceámicos, polímeos y compuestos, el pocesado implica la tansfomación de estado a, al educi la tempeatua
CM SOLIDIFICACIÓN EMA 6. SOLIDIFICACIÓN En pácticamente todos los metales, y en muchos semiconductoes, ceámicos, polímeos y compuestos, el pocesado implica la tansfomación de estado a, al educi la tempeatua
2x = x = M. 100 = α = % NOCl eq K C =
 1 Universidad de Castilla la Mancha Selectividad Septiembre.013 Opción A SEPTIEMBRE 013 1.- El cloruro de nitrosilo es un gas utilizado en la síntesis de productos farmacéuticos. Se descompone a altas
1 Universidad de Castilla la Mancha Selectividad Septiembre.013 Opción A SEPTIEMBRE 013 1.- El cloruro de nitrosilo es un gas utilizado en la síntesis de productos farmacéuticos. Se descompone a altas
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
Capítulo 5. Propiedades periódicas de los elementos
 Capítulo 5. Propiedades periódicas de los elementos Objetivos: Justificación de las propiedades periódicas de los elementos Radio atómico: Potenciales de ionización. Carácter metálico y no metálico de
Capítulo 5. Propiedades periódicas de los elementos Objetivos: Justificación de las propiedades periódicas de los elementos Radio atómico: Potenciales de ionización. Carácter metálico y no metálico de
b) Para el último electrón del átomo de magnesio, los números cuánticos posibles son: n = 3; l = 1 ±.
 PRUEBA GENERAL OPCIÓN A CUESTIÓN 1.- Considerando el elemento alcalinotérreo del tercer período y el segundo elemento del grupo de los halógenos: a) Escribe sus configuraciones electrónicas. b) Escribe
PRUEBA GENERAL OPCIÓN A CUESTIÓN 1.- Considerando el elemento alcalinotérreo del tercer período y el segundo elemento del grupo de los halógenos: a) Escribe sus configuraciones electrónicas. b) Escribe
El campo electrostático
 1 Fenómenos de electización. Caga eléctica Cuando un cuepo adquiee po fotamiento la popiedad de atae pequeños objetos, se dice que el cuepo se ha electizado También pueden electizase po contacto con otos
1 Fenómenos de electización. Caga eléctica Cuando un cuepo adquiee po fotamiento la popiedad de atae pequeños objetos, se dice que el cuepo se ha electizado También pueden electizase po contacto con otos
Ejercicios y respuestas del apartado: Tabla periódica. Grupos y períodos. Metales, no metales y gases nobles
 Ejercicios y respuestas del apartado: Tabla periódica. Grupos y períodos. Metales, no metales y gases nobles Elementos de la tabla periódica (1) 1. Grupo de los halógenos: ---------> Símbolos: (1), (2),
Ejercicios y respuestas del apartado: Tabla periódica. Grupos y períodos. Metales, no metales y gases nobles Elementos de la tabla periódica (1) 1. Grupo de los halógenos: ---------> Símbolos: (1), (2),
Tema 4. Tema 4: Clasificación Periódica de los elementos químicos. 4.1 Introducción
 Tema 4: Clasificación Periódica de los elementos químicos 4.1 Introducción 4. Descripción de la Tabla Periódica 4.3 Base electrónica de la clasificación periódica 4.4 Propiedades periódicas AJ1.13-1, PHH10,
Tema 4: Clasificación Periódica de los elementos químicos 4.1 Introducción 4. Descripción de la Tabla Periódica 4.3 Base electrónica de la clasificación periódica 4.4 Propiedades periódicas AJ1.13-1, PHH10,
ACADEMIA DE QUÍMICA TURNO VESPERTINO
 INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
EJERCICIOS RESUELTOS DE ENLACE QUIMICO
 EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
PRIMERAS CLASIFICACIONES PERIÓDICAS
 LA TABLA PERIÓDICA PRIMERAS CLASIFICACIONES PERIÓDICAS Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades variaban periódicamente
LA TABLA PERIÓDICA PRIMERAS CLASIFICACIONES PERIÓDICAS Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades variaban periódicamente
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS DE ELECTROMAGNETISMO
 º de Bachilleato. Electomagnetismo POBLEMAS DE ELECTOMAGNETISMO 1- Un ion de litio Li +, que tiene una masa de 1,16 Α 1-6 kg, se acelea mediante una difeencia de potencial de V y enta pependiculamente
º de Bachilleato. Electomagnetismo POBLEMAS DE ELECTOMAGNETISMO 1- Un ion de litio Li +, que tiene una masa de 1,16 Α 1-6 kg, se acelea mediante una difeencia de potencial de V y enta pependiculamente
EL BINGO DE LOS ELEMENTOS. Aprenda la Tabla Periódica de los Elementos mientras juega este bingo.
 EL BINGO DE LOS ELEMENTOS Aprenda la Tabla Periódica de los Elementos mientras juega este bingo. 1 Cómo jugar este bingo Se juega como cualquier otro bingo. Imprima una o varias copias de los cartones
EL BINGO DE LOS ELEMENTOS Aprenda la Tabla Periódica de los Elementos mientras juega este bingo. 1 Cómo jugar este bingo Se juega como cualquier otro bingo. Imprima una o varias copias de los cartones
VII.- EQUILIBRIO DE LAS TRANSFORMACIONES REALES pfernandezdiez.es
 VII.- EQUILIBRIO DE LAS RANSFORMACIONES REALES VII..- SISEMAS ERMODINÁMICOS La masa de los sistemas que evolucionan puede veni en moles, kg, etc., y po eso indicamos los potenciales temodinámicos con mayúsculas.
VII.- EQUILIBRIO DE LAS RANSFORMACIONES REALES VII..- SISEMAS ERMODINÁMICOS La masa de los sistemas que evolucionan puede veni en moles, kg, etc., y po eso indicamos los potenciales temodinámicos con mayúsculas.
Facultad de Ciencias Curso Grado de Óptica y Optometría SOLUCIONES PROBLEMAS FÍSICA. TEMA 3: CAMPO ELÉCTRICO
 Facultad de iencias uso - SOLUIOS ROLMAS FÍSIA. TMA : AMO LÉTRIO. n los puntos (; ) y (-; ) de un sistema de coodenadas donde las distancias se miden en cm, se sitúan dos cagas puntuales de valoes, y -,
Facultad de iencias uso - SOLUIOS ROLMAS FÍSIA. TMA : AMO LÉTRIO. n los puntos (; ) y (-; ) de un sistema de coodenadas donde las distancias se miden en cm, se sitúan dos cagas puntuales de valoes, y -,
Contenidos. 1.- Primeras clasificaciones periódicas.
 LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
CURSO DE AGUAS SUBTERRANEAS TEMA 13: LA CALIDAD DEL AGUA SUBTERRÁNEA
 CURSO DE AGUAS SUBTERRANEAS 2010 TEMA 13: LA CALIDAD DEL AGUA SUBTERRÁNEA Mario Valencia Cuesta Geólogo AGUAS SUBTERRÁNEAS LTDA. aguassubterraneas@gmail.com INTRODUCCION A LAS AGUAS SUBTERRANEAS 2010 TEMA
CURSO DE AGUAS SUBTERRANEAS 2010 TEMA 13: LA CALIDAD DEL AGUA SUBTERRÁNEA Mario Valencia Cuesta Geólogo AGUAS SUBTERRÁNEAS LTDA. aguassubterraneas@gmail.com INTRODUCCION A LAS AGUAS SUBTERRANEAS 2010 TEMA
TEMA 4 (I) ESTRUCTURA ATÓMICA.
 Estructura Atómica, Sistema Periódico y Enlace Químico. 1 TEMA 4 (I) ESTRUCTURA ATÓMICA. 1. DESCUBRIMIENTO DE LA ESTRUCTURA ATÓMICA. 1.- Qué experimentos condujeron a la idea del núcleo atómico? (3.12)
Estructura Atómica, Sistema Periódico y Enlace Químico. 1 TEMA 4 (I) ESTRUCTURA ATÓMICA. 1. DESCUBRIMIENTO DE LA ESTRUCTURA ATÓMICA. 1.- Qué experimentos condujeron a la idea del núcleo atómico? (3.12)
Consideraciones sobre estructuras representativas
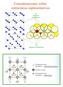 Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Química en solución acuosa. Reacciones en Qca. Inorgánica. El agua. Química Inorgánica 2006. Reacciones iónicas en solución. Reacciones moleculares
 Química en solución acuosa Química Inorgánica 2006 Reacciones en Qca. Inorgánica Reacciones iónicas en solución Reacciones moleculares Reacciones en estado fundido Reacciones en estado sólido El agua Momento
Química en solución acuosa Química Inorgánica 2006 Reacciones en Qca. Inorgánica Reacciones iónicas en solución Reacciones moleculares Reacciones en estado fundido Reacciones en estado sólido El agua Momento
LECCIÓN Nº 03 TABLA PERIÓDICA
 LECCIÓN Nº 03 TABLA PERIÓDICA OBJETIVO ESPECÍFICO: Conocer las características estructurales y propiedades de las partículas subatómicas(electrón, protón y neutrón), modelos Reconocer Número atómico y
LECCIÓN Nº 03 TABLA PERIÓDICA OBJETIVO ESPECÍFICO: Conocer las características estructurales y propiedades de las partículas subatómicas(electrón, protón y neutrón), modelos Reconocer Número atómico y
Departamento de Física y Química. I. E. S. Atenea (S. S. Reyes, Madrid) Examen de Selectividad de Física. Junio Soluciones
 Examen de Selectividad de Física. Junio 2008. Soluciones imea pate Cuestión.- Un cuepo de masa m está suspendido de un muelle de constante elástica k. Se tia veticalmente del cuepo desplazando éste una
Examen de Selectividad de Física. Junio 2008. Soluciones imea pate Cuestión.- Un cuepo de masa m está suspendido de un muelle de constante elástica k. Se tia veticalmente del cuepo desplazando éste una
INSTITUCION EDUCATIVA DIVERSIFICADO DE CHIA CIENCIAS NATURALES: QUIMICA ESTUDIO TABLA PERIODICA. GRADO DECIMO
 1 INSTITUCION EDUCATIVA DIVERSIFICADO DE CHIA CIENCIAS NATURALES: QUIMICA ESTUDIO TABLA PERIODICA. GRADO DECIMO CONTENIDOS 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev.
1 INSTITUCION EDUCATIVA DIVERSIFICADO DE CHIA CIENCIAS NATURALES: QUIMICA ESTUDIO TABLA PERIODICA. GRADO DECIMO CONTENIDOS 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev.
TEMA 3: ENLACE QUÍMICO
 I.E.S. Al-Ándalus. Dpto. de Física y Química. Curso 2004-05 FQ 1º Bach. Tema 3. Enlace Químico - 1 - TEMA 3: ENLACE QUÍMICO 3.1 Estabilidad atómica. Regla del Octete de Lewis 3.2 Enlace iónico. Propiedades
I.E.S. Al-Ándalus. Dpto. de Física y Química. Curso 2004-05 FQ 1º Bach. Tema 3. Enlace Químico - 1 - TEMA 3: ENLACE QUÍMICO 3.1 Estabilidad atómica. Regla del Octete de Lewis 3.2 Enlace iónico. Propiedades
GALICIA / JUNIO 03. LOGSE / FÍSICA / EXAMEN COMPLETO
 GALICIA / JUNIO 3. LOGSE / FÍSICA / EXAMEN COMPLEO El examen de física de las P.A.U. pesenta dos opciones de semejante nivel de dificultad. Cada opción consta de tes pates difeentes(poblemas, cuestiones
GALICIA / JUNIO 3. LOGSE / FÍSICA / EXAMEN COMPLEO El examen de física de las P.A.U. pesenta dos opciones de semejante nivel de dificultad. Cada opción consta de tes pates difeentes(poblemas, cuestiones
REACCIONES QUÍMICAS. Ocurren en la naturaleza. Se expresan por ECUACIONES QUÍMICAS
 REACCIONES QUÍMICAS Ocurren en la naturaleza Se expresan por ECUACIONES QUÍMICAS NaCl + AgNO 3 AgCl + NaNO 3 REACTIVOS PRODUCTOS ECUACIÓN QUÍMICA Estequiométrica (ecuación balanceada) Representar una reacción
REACCIONES QUÍMICAS Ocurren en la naturaleza Se expresan por ECUACIONES QUÍMICAS NaCl + AgNO 3 AgCl + NaNO 3 REACTIVOS PRODUCTOS ECUACIÓN QUÍMICA Estequiométrica (ecuación balanceada) Representar una reacción
PROBLEMAS DE QUIMICA GENERAL III (QM-1123) PRIMERA GUIA
 PROBLEMAS DE QUIMICA GENERAL III (QM-1123) PRIMERA GUIA 1.- Indique el número máximo de electrones que pueden ocupar cada una de las siguientes subcapas: (a) 3d, (b) 4s, (c) 2p, (d) 5f 2.- Determine el
PROBLEMAS DE QUIMICA GENERAL III (QM-1123) PRIMERA GUIA 1.- Indique el número máximo de electrones que pueden ocupar cada una de las siguientes subcapas: (a) 3d, (b) 4s, (c) 2p, (d) 5f 2.- Determine el
Compuestos Químicos. Capítulo 3 Sec. 3.1-3.6 Rosamil Rey, PhD CHEM 2115
 Compuestos Químicos Capítulo 3 Sec. 3.1-3.6 Rosamil Rey, PhD CHEM 2115 Tipos de enlaces Enlaces covalentes comparten electrones entre átomos y forman compuestos moleculares. Estos compuestos son representados
Compuestos Químicos Capítulo 3 Sec. 3.1-3.6 Rosamil Rey, PhD CHEM 2115 Tipos de enlaces Enlaces covalentes comparten electrones entre átomos y forman compuestos moleculares. Estos compuestos son representados
Problemas de Química (1ero Grado de Química). Tema 2. ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS
 Problemas de Química (1ero Grado de Química). Tema 2. ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1. Para el isótopo del elemento con Z = 36 y número másico 84 indique: (a) su número de protones; (b) su
Problemas de Química (1ero Grado de Química). Tema 2. ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1. Para el isótopo del elemento con Z = 36 y número másico 84 indique: (a) su número de protones; (b) su
Adaptación de impedancias
 .- El tansfomado ideal Adaptación de impedancias I +V +V TI Tansfomado ideal V elaciones V-I: V = I = a. I, válidas paa cualquie fecuencia. a Si se conecta una esistencia al secundaio, ente el nodo +V
.- El tansfomado ideal Adaptación de impedancias I +V +V TI Tansfomado ideal V elaciones V-I: V = I = a. I, válidas paa cualquie fecuencia. a Si se conecta una esistencia al secundaio, ente el nodo +V
Física General 1 Proyecto PMME - Curso 2007 Instituto de Física Facultad de Ingeniería UdelaR
 Física Geneal 1 Poyecto PMME - Cuso 007 Instituto de Física Facultad de Ingenieía UdelaR TITULO MÁQUINA DE ATWOOD AUTORES Calos Anza Claudia Gacía Matín Rodiguez INTRODUCCIÓN: Se nos fue planteado un ejecicio
Física Geneal 1 Poyecto PMME - Cuso 007 Instituto de Física Facultad de Ingenieía UdelaR TITULO MÁQUINA DE ATWOOD AUTORES Calos Anza Claudia Gacía Matín Rodiguez INTRODUCCIÓN: Se nos fue planteado un ejecicio
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE Junio 2011
 PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE Junio 2011 Opción A: QUÍMICA. CÓDIGO 160 1. Escribir las configuraciones electrónicas e indicar el símbolo de los siguientes elementos:
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE Junio 2011 Opción A: QUÍMICA. CÓDIGO 160 1. Escribir las configuraciones electrónicas e indicar el símbolo de los siguientes elementos:
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2011/12 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2011/12 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
ULA MSc. Trino Suárez B. Prof. Titular QUÍMICA INORGÁNICA I
 ULA MSc. Trino Suárez B. Prof. Titular QUÍMICA INORGÁNICA I TEMA 2 EJERCICIOS 2.1 1.- Identifique el tipo de sólido (molecular, ionico, covalente o metálico) en el que se presentan cada uno de los siguientes
ULA MSc. Trino Suárez B. Prof. Titular QUÍMICA INORGÁNICA I TEMA 2 EJERCICIOS 2.1 1.- Identifique el tipo de sólido (molecular, ionico, covalente o metálico) en el que se presentan cada uno de los siguientes
Capacidad de combinación. Capacidad de combinación La última capa de electrones de un átomo, se le conoce como capa de electrones de valencia
 Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
1ª EVALUACIÓN EJERCICIOS PARA EXÁMENES Química 2º Bachiller
 2010 1ª EVALUACIÓN EJERCICIOS PARA EXÁMENES Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores 0 [Escribir texto] Mª Teresa Gómez Ruiz Dpto Física Química IES
2010 1ª EVALUACIÓN EJERCICIOS PARA EXÁMENES Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores 0 [Escribir texto] Mª Teresa Gómez Ruiz Dpto Física Química IES
Parámetros de enlace. Jesús Gracia Mora
 Parámetros de enlace Jesús Gracia Mora La presentación, material adicional, ejercicios y bibliografía se encuentran a su disposición en: http://depa.pquim.unam.mx/qi/ Que es un enlace químico? Diferentes
Parámetros de enlace Jesús Gracia Mora La presentación, material adicional, ejercicios y bibliografía se encuentran a su disposición en: http://depa.pquim.unam.mx/qi/ Que es un enlace químico? Diferentes
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
VÍDEOS DE EJERCICIOS DE ENLACE QUÍMICO: ENUNCIADOS
 VÍDEOS DE EJERCICIOS DE ENLACE QUÍMICO: ENUNCIADOS Todos los ejercicios cuyos enunciados indicamos a continuación se pueden encontrar resueltos íntegramente en vídeo, paso a paso, en la página web. Asimismo,
VÍDEOS DE EJERCICIOS DE ENLACE QUÍMICO: ENUNCIADOS Todos los ejercicios cuyos enunciados indicamos a continuación se pueden encontrar resueltos íntegramente en vídeo, paso a paso, en la página web. Asimismo,
CANARIAS / SEPTIEMBRE 02. LOGSE / FÍSICA / EXAMEN COMPLETO
 CANAIAS / SEPTIEMBE 0. LOGSE / FÍSICA / EXAMEN COMPLETO De las dos opciones popuestas, sólo hay que desaolla una opción completa. Cada poblema coecto vale po tes puntos. Cada cuestión coecta vale po un
CANAIAS / SEPTIEMBE 0. LOGSE / FÍSICA / EXAMEN COMPLETO De las dos opciones popuestas, sólo hay que desaolla una opción completa. Cada poblema coecto vale po tes puntos. Cada cuestión coecta vale po un
Fuerzas inter e intramoleculares que determinan las estructuras de las Macromoléculas Biológicas (M.B.).
 Estuctua de Macomoléculas. Dpto. de Química Física. Facultad de Ciencias. Univesidad de Ganada. Fuezas inte e intamoleculaes que deteminan las estuctuas de las Macomoléculas Biológicas (M.B.)..- Intoducción.
Estuctua de Macomoléculas. Dpto. de Química Física. Facultad de Ciencias. Univesidad de Ganada. Fuezas inte e intamoleculaes que deteminan las estuctuas de las Macomoléculas Biológicas (M.B.)..- Intoducción.
UNIVERSIDADES DE ANDALUCÍA: PRUEBA DE SELECTIVIDAD. FÍSICA. JUNIO 2007
 I.E.S. Al-Ándalus. Aahal. Sevilla. Dpto. Física y Química. Selectividad Andalucía. Física. Junio 007-1 UNIVERSIDADES DE ANDALUCÍA: PRUEBA DE SELECTIVIDAD. FÍSICA. JUNIO 007 OPCIÓN A: 1. Po dos conductoes
I.E.S. Al-Ándalus. Aahal. Sevilla. Dpto. Física y Química. Selectividad Andalucía. Física. Junio 007-1 UNIVERSIDADES DE ANDALUCÍA: PRUEBA DE SELECTIVIDAD. FÍSICA. JUNIO 007 OPCIÓN A: 1. Po dos conductoes
Introducción a circuitos de corriente continua
 Univesidad de Chile Facultad de Ciencias Físicas y Matemáticas Depatamento de Física FI2003 - Métodos Expeimentales Semeste Pimavea 2010 Pofesoes: R. Espinoza, C. Falcón, R. Muñoz & R. Pujada GUIA DE LABORATORIO
Univesidad de Chile Facultad de Ciencias Físicas y Matemáticas Depatamento de Física FI2003 - Métodos Expeimentales Semeste Pimavea 2010 Pofesoes: R. Espinoza, C. Falcón, R. Muñoz & R. Pujada GUIA DE LABORATORIO
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. LA TABLA PERIÓDICA.
 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. LA TABLA PERIÓDICA. A partir de la posición de los elementos en la tabla periódica formando grupos y períodos podemos deducir la evolución de algunas propiedades
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. LA TABLA PERIÓDICA. A partir de la posición de los elementos en la tabla periódica formando grupos y períodos podemos deducir la evolución de algunas propiedades
EL SISTEMA PERIODICO HISTORIA DEL SISTEMA PERIÓDICO
 HISTORIA DEL SISTEMA PERIÓDICO Durante el siglo XIX, y a medida que avanzaba el conocimiento sobre los elementos químicos, se observó que algunos de ellos tenían propiedades semejantes. Los científicos
HISTORIA DEL SISTEMA PERIÓDICO Durante el siglo XIX, y a medida que avanzaba el conocimiento sobre los elementos químicos, se observó que algunos de ellos tenían propiedades semejantes. Los científicos
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Modelo 2005/2006 PRIMERA PARTE
 1 PAU Química. Modelo 2005/2006 PRIMERA PARTE Cuestión 1. Para el elemento alcalino del tercer periodo y para el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones electrónicas.
1 PAU Química. Modelo 2005/2006 PRIMERA PARTE Cuestión 1. Para el elemento alcalino del tercer periodo y para el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones electrónicas.
CARACTERÍSTICAS DE LOS GENERADORES DE CORRIENTE CONTINUA (C.C.)
 CARACERÍSCAS DE LOS GENERADORES DE CORRENE CONNUA (C.C.) Fueza electomotiz (f.e.m.) Es la causa que mantiene una tensión en bones del geneado. La fueza electomotiz (f.e.m.) es la tensión eléctica oiginada
CARACERÍSCAS DE LOS GENERADORES DE CORRENE CONNUA (C.C.) Fueza electomotiz (f.e.m.) Es la causa que mantiene una tensión en bones del geneado. La fueza electomotiz (f.e.m.) es la tensión eléctica oiginada
