Anexo II. Conclusiones científicas
|
|
|
- María Nieves Blázquez Campos
- hace 6 años
- Vistas:
Transcripción
1 Anexo II Conclusiones científicas 35
2 Conclusiones científicas La enoxaparina sódica es una heparina de bajo peso molecular comercializada con los nombres de Lovenox y denominaciones asociadas. Este anticoagulante se utiliza en el tratamiento y la profilaxis de trastornos tromboembólicos. Se administra mediante una inyección subcutánea o intravenosa. Lovenox y denominaciones asociadas está autorizado en todos los Estados miembros (EM) de la UE, así como en Islandia y Noruega. Las principales propiedades farmacológicas de la enoxaparina son su actividad antifactor Xa y antifactor IIa (antitrombina), que dependen de su afinidad de unión por la antitrombina. Lovenox y denominaciones asociadas solución inyectable está autorizado actualmente en más de 140 países de todo el mundo, entre ellos todos los Estados miembros de la Unión Europea (UE), así como Noruega e Islandia. La primera autorización de comercialización en la UE se concedió en Francia el 3 de abril de El producto está registrado actualmente en la UE con concentraciones de 100 mg/ml (equivalente a UI anti Xa/ml) en jeringas precargadas, viales multidosis, ampollas y 150 mg/ml (equivalente a UI anti Xa/ml) en jeringas precargadas. También está autorizado en viales de 100 mg/10 ml y en una pluma de 10 x 40 mg (equivalente a 10 x UI de anti Xa). Debido a las decisiones nacionales divergentes tomadas por los Estados miembros (EM) con respecto a la autorización del producto arriba mencionado y sus denominaciones asociadas, Francia notificó al CHMP/Agencia Europea de Medicamentos el inicio de un procedimiento de arbitraje conforme al artículo 30 de la Directiva 2001/83/CE para el producto arriba mencionado con el fin de solucionar las diferencias en la información sobre el producto (IP) autorizada por procedimientos nacionales y, así, armonizar las distintas IP en la UE. Resumen general de la evaluación científica del CHMP La información sobre el producto se dividió como sigue en función de las indicaciones para las que están aprobados los distintos productos: La ficha técnica o resumen de las características del producto (RCP) y el prospecto para viales, ampollas y jeringas precargadas, que abarca todas las indicaciones aprobadas. La presentación de UI (100 mg)/10 ml solución inyectable, que se utiliza únicamente para diálisis extracorpórea, por lo que en la sección 4.1 solo se considera esta indicación. La presentación en pluma (10 x UI (10 x 40 mg)) que contiene todas las indicaciones aprobadas, excepto el uso en diálisis extracorpórea. Sección 1 Nombre del medicamento y Sección 2 Composición cualitativa y cuantitativa La concentración del producto se expresa de manera distinta en los diferentes EM, bien en mg o bien en UI de actividad anti-factor Xa. Por una parte, la expresión y la posología en mg coincide con las aprobaciones en la mayor parte de la UE y permite tanto la identificación como la distinción entre diferentes presentaciones, al tiempo que favorece y facilita la prescripción, la posología, la dispensación y la administración. Por otra parte, otras heparinas de bajo peso molecular (HBPM) en la mayoría de los EM europeos se expresan principalmente en UI de actividad anti-xa y no en mg, como se hace en la Farmacopea Europea (versión 8.1, 2014), donde la concentración de heparinas, incluidas las HBPM, se expresa en UI de actividad anti-xa. Como la armonización de la expresión de la concentración utilizando solo una de esas opciones habría obligado a realizar cambios en la práctica establecida en algunos países, con lo que podría aumentar el riesgo de errores de medicación asociados a un riesgo más alto de trombosis o hemorragia intensa, se 36
3 ha modificado el texto para expresar la concentración en las dos unidades (en UI de actividad anti- Xa/ml y su equivalencia en mg/ml) en el embalaje exterior y en el acondicionamiento primario (jeringa), así como en las secciones 1, 2 y 4.2). Sección Indicaciones terapéuticas Esta sección se armonizó para eliminar las discrepancias en el texto exacto de las indicaciones de profilaxis y tratamiento. Además, las indicaciones no eran las mismas dependiendo de la concentración del producto, lo que se planteó como parte del procedimiento de arbitraje. Profilaxis del tromboembolismo venoso (TEV) en pacientes quirúrgicos Para la profilaxis del tromboembolismo venoso (TEV) en pacientes quirúrgicos, el CHMP consideró que sería oportuno basar la indicación en el nivel de riesgo trombótico del paciente conforme a las directrices de la American College of Clinical Pharmacy (ACCP). La indicación armonizada establece, por tanto, la profilaxis de la enfermedad tromboembólica venosa en pacientes quirúrgicos de riesgo moderado y alto, sobre todo los sometidos a cirugía ortopédica o general, incluida la cardiocirugía. Profilaxis de TEV en pacientes tratados médicamente La terminología utilizada para la indicación de profilaxis del tromboembolismo venoso en pacientes tratados médicamente variaba de un Estado miembro a otro. El CHMP se remitió también para esta indicación a las directrices actuales del ACCP y, además, prefirió un texto más en línea con las recomendaciones actuales publicadas en la literatura médica para la tromboprofilaxis en pacientes tratados médicamente con enfermedades agudas. El texto para la indicación en esta población incluye ahora, por tanto, a los pacientes tratados médicamente con una enfermedad aguda (como insuficiencia cardíaca aguda, insuficiencia respiratoria, infecciones graves o enfermedades reumáticas) y movilidad reducida que tienen un riesgo más alto de tromboembolismo venoso. Tratamiento del tromboembolismo venoso profundo Para el tratamiento del tromboembolismo venoso profundo, el texto exacto variaba de un Estado miembro a otro y el CHMP consideró la armonización de la indicación para incluir el tratamiento de la trombosis venosa profunda (TVP) y el embolismo pulmonar (EP), excluido el EP que probablemente vaya a precisar tratamiento trombolítico o cirugía. La indicación armonizada se basa en las directrices terapéuticas (Sociedad Europea de Cardiología (ESC) y ACCP), así como en datos de estudios clínicos y de la literatura médica presentados por el TAC. Tratamiento de la angina inestable (AI) e infarto de miocardio sin elevación del segmento ST (IMSEST). El tratamiento de la AI y el IMSEST no estaba autorizado en todos los Estados miembros antes de la finalización de este arbitraje. En lo que respecta a esta indicación, el CHMP consideró el documento de consenso del Comité Conjunto de la ESC y el American College of Cardiology para la redefinición del infarto de miocardio (IM), lo que llevó a la revisión de la definición de los síndromes coronarios agudos (SCA) para incluir la AI y el IMSEST. El CHMP acordó utilizar esta definición en el prospecto de la enoxaparina, y la indicación se armonizó para incluir el tratamiento de la angina inestable y el IMSEST administrado conjuntamente con ácido acetilsalicílico por vía oral. Tratamiento del infarto de miocardio agudo con elevación del segmento ST (IMEST). Con respecto al tratamiento del infarto de miocardio agudo con elevación del segmento ST, el CHMP señaló que el estudio fundamental (ExTRACT-TIMI 25) se había realizado en pacientes con IMEST que cumplían los criterios siguientes: 37
4 - Pacientes tratados médicamente (no sometidos a un procedimiento principalmente invasivo, como una intervención coronaria percutánea (ICP) o un injerto de derivación aortocoronaria (IDAC); Pacientes en los que se pudo realizar una ICP en cualquier momento por fracaso de la fibrinolisis o con urgencia en caso de isquemia o infarto de miocardio recurrente, pero que tuvo que aplazarse en otras situaciones durante al menos 48 horas. El CHMP adoptó un texto, que está conforme con los datos clínicos y las directrices terapéuticas (grado IIbB en las directrices de la ESC de 2012 y directrices de la American Heart Association (AHA) de 2011). Prevención de trombos extracorpóreos durante la hemodiálisis. En cuanto a la prevención de trombos extracórporeos durante la hemodiálisis, todos los Estados miembros incluyeron esta indicación en la IP, excepto los Países Bajos que no consideraron suficientes los datos obtenidos con el régimen posológico propuesto en el momento de la autorización de comercialización inicial. Ahora bien, no existen otras diferencias importantes para la indicación de hemodiálisis en los RCP nacionales aprobados en los EM de la UE. El CHMP consideró que debía mantenerse la indicación en línea con el texto más común aceptado en los países. Sección 4.2. Posología y forma de administración En general, las subsecciones sobre la posología y forma de administración reflejaron las indicaciones armonizadas para la enoxaparina. Profilaxis de la enfermedad tromboembólica venosa Para esta indicación en pacientes quirúrgicos de riesgo moderado y alto, el CHMP consideró que el RCP debía reflejar que el riesgo tromboembólico individual de los pacientes se puede estimar utilizando un modelo validado de estratificación del riesgo. Se armonizó la posología para la profilaxis del tromboembolismo venoso en pacientes tratados médicamente con el fin de reflejar las directrices del ACCP. Tratamiento de la TVP y el embolismo pulmonar (EP) Para el tratamiento de la TVP y el EP, el CHMP consideró, en base a los datos facilitados y las directrices de tratamiento disponibles, que el texto armonizado debía incluir una única inyección diaria de 150 UI/kg (1,5 mg/kg) o dos inyecciones diarias de 100 UI/kg (1 mg/kg) en pacientes con TVP y EP. El CHMP consideró también que el médico era quien debía elegir el régimen tras una evaluación individual que incluyera la valoración del riesgo tromboembólico y el riesgo hemorrágico. Prevención de la formación de trombos durante la hemodiálisis. En cuanto a la posología para esta indicación, la mayor parte de los países indicaron una dosis de enoxaparina de 1 mg/kg y unos pocos países indicaron una dosis más baja para esta indicación. Las dosis estudiadas en los estudios clínicos varían de 0,5 mg/kg a 1,25 mg/kg. El RCP se unificó para indicar que la dosis recomendada aceptada en la mayoría de los países es de 1 mg/kg, lo que está en línea con los datos clínicos y con las recomendaciones de las directrices terapéuticas. Indicaciones de angina inestable e indicaciones de IMSEST No existen diferencias entre países en cuanto al régimen posológico de la enoxaparina (1 mg/kg cada 12 horas mediante inyección subcutánea) en estas indicaciones. No obstante, el CHMP consideró que debía recomendarse el uso de ácido acetilsalicílico (AAS) en dosis de 75 mg a 325 mg en el RCP para reflejar los datos clínicos y la práctica clínica. Tratamiento del IMEST agudo 38
5 Se observaron además algunas discrepancias en cuanto a los momentos de administración de la enoxaparina en esta indicación, que se unificaron como parte del procedimiento. El CHMP observó que en la directriz actual de la ESC, se recomienda el uso de AAS en todos los pacientes sin contraindicaciones con una dosis de carga inicial por vía oral de mg (en pacientes no tratados anteriormente con aspirina) y una dosis de mantenimiento de mg/día a largo plazo con independencia de la estrategia de tratamiento. En cuanto al IMEST, debe mencionarse la dosis más alta administrada el primer día como se utilizó en el estudio ExTRACT-TIMI 25. Otras poblaciones Debido a la información divergente entre los Estados miembros, se hicieron también cambios en otras subsecciones, como la población pediátrica, las personas de edad avanzada y la insuficiencia hepática y renal para reflejar las indicaciones aprobadas y sobre la base de los datos disponibles en esas poblaciones. Se añadieron otras subsecciones para facilitar información sobre el cambio entre enoxaparina sódica y anticoagulantes orales, así como recomendaciones de administración con anestesia medular/epidural o punción lumbar. Sección 4.3: Contraindicaciones Esta sección se armonizó para reflejar de una manera uniforme las contraindicaciones siguientes, no todas las cuales se mencionaban en todos los países de la UE o se mencionaban con terminologías diferentes: Hipersensibilidad a la enoxaparina sódica, a la heparina o a sus derivados, incluidas otras heparinas de bajo peso molecular (HBPM), o a alguno de los excipientes. Úlcera gastrointestinal, presencia de neoplasia maligna con un alto riesgo de hemorragia, cirugía cerebral, medular u oftálmica reciente, confirmación o sospecha de varices esofágicas, malformaciones arteriovenosas, aneurismas vasculares o anomalías vasculares intramedulares o intracerebrales importantes. Antecedentes de trombocitopenia inducida por heparina (TIH) de mediación inmunitaria en los últimos 100 días o en presencia de anticuerpos circulantes (véase también la sección 4.4). Anestesia medular o epidural o anestesia locorregional cuando se utiliza enoxaparina sódica para el tratamiento en las 24 horas previas (con referencia a la sección 4.4). Uso de viales de dosis múltiples que contienen alcohol bencílico en recién nacidos o en neonatos prematuros debido al riesgo de síndrome de jadeo en esta población. Algunos Estados miembros incluían como contraindicación la insuficiencia renal grave (aclaramiento < 30 ml/min) en las indicaciones terapéuticas, que ahora se ha eliminado como parte del arbitraje basado en los datos disponibles que justifican el uso en esta población. Se ha eliminado también la contraindicación existente anteriormente para la utilización en pacientes con nefropatía terminal (aclaramiento de la creatinina < 15 ml/min) debido a la ausencia de datos de seguridad en esta población que justifique una contraindicación; ahora bien, no se recomienda el uso en esta población, como se explica más abajo. Sección 4.4 Advertencias y precauciones especiales de empleo Se han realizado cambios en esta sección para añadir el riesgo de endocarditis infecciosa aguda. Se ha aprobado un texto uniforme sobre la vigilancia del recuento de plaquetas para tener en cuenta las directrices internacionales actuales, con el fin de evitar una vigilancia innecesaria en pacientes con un riesgo bajo de TIH. Se han realizado otros cambios para complementar la información ya contenida en otras partes de la información del producto: 39
6 Disminución de la posología en pacientes con más de 75 años tratados con enoxaparina por infarto de miocardio con elevación del segmento ST (IMEST). Aumento del riesgo de insuficiencia hepática. Vigilancia biológica cuidadosa con medición de la actividad anti-xa en pacientes con insuficiencia renal. No se recomienda el uso de enoxaparina en pacientes con nefropatía terminal al no disponerse de datos en esta población aparte de la prevención de la formación de trombos en pacientes con diálisis. En pacientes con insuficiencia renal grave (aclaramiento de creatinina ml/min), al estar significativamente aumentada la exposición a enoxaparina sódica, se recomienda un ajuste de la dosis en los intervalos posológicos terapéuticos y profilácticos; Aumento de la posibilidad de hemorragias. Se recomienda extrema precaución cuando se utilice en pacientes con antecedentes (>100 días) de trombocitopenia inducida por heparina sin anticuerpos circulantes. No debe utilizarse para anestesia medular/epidural o punción lumbar durante el tratamiento con enoxaparina. Interrupción del tratamiento en caso de necrosis cutánea y vasculitis cutánea. Finalmente, se ha añadido texto para facilitar la trazabilidad de los medicamentos biológicos. Se han incluido otras secciones como «hiperpotasemia» al no ser un texto uniforme en todos los Estados miembros. Otras secciones del RCP Se han armonizado las secciones 4.5 a 6 basándose en la información disponible pertinente, o se ha modificado el texto según la última plantilla del QRD. Estos cambios fueron en su mayor parte de naturaleza técnica y, en consecuencia no se comentan aquí con detalle. Etiquetado Las modificaciones realizadas en el RCP se han reflejado en el etiquetado según corresponda; sin embargo, algunas secciones se han dejado en blanco para que sean cumplimentadas en cada país. Prospecto Se ha armonizado el prospecto teniendo en cuenta todas las revisiones del RCP relevantes para el prospecto. Comunicación directa a los profesionales sanitarios (CDPS) Teniendo en cuenta el riesgo de errores de medicación y la aclaración sobre las indicaciones y contraindicaciones, el CHMP acordó utilizar los siguientes mensajes clave en una comunicación directa a los profesionales sanitarios (CDPS) dirigida a médicos generales, ortopédicos, internistas, cardiólogos, hematólogos, cirujanos, farmacéuticos o enfermeros (u otros profesionales dependiendo del sistema nacional de asistencia sanitaria): La concentración de enoxaparina se expresará ahora tanto en unidades internacionales (UI) de actividad anti-xa como en miligramos (mg): Un mg de enoxaparina sódica equivale a 100 UI de actividad anti-xa. 40
7 Por ejemplo, para las jeringas precargadas de 0,4 ml, la concentración se indicará así: <Nombre comercial local> UI (40 mg)/0,4 ml > solución inyectable. La posología para la trombosis venosa profunda (TVP) y la embolia pulmonar (EP) se ha aclarado como sigue: La enoxaparina sódica se puede administrar por vía subcutánea: o o tanto en forma de una inyección diaria única de 150 UI/kg (1,5 mg/kg): utilizada en pacientes sin complicaciones con bajo riesgo de recidiva de ETV, o con dos inyecciones diarias de 100 UI/kg (1 mg/kg): utilizadas en todos los demás pacientes como los pacientes con obesidad, EP sintomática, cáncer, ETV recidivante o trombosis proximal (vena ilíaca). El régimen deberá ser seleccionado por el médico en base a una evaluación individual que incluirá la valoración del riesgo tromboembólico y el riesgo hemorrágico. Se ha eliminado de la información sobre el producto una contraindicación en pacientes con insuficiencia renal grave (aclaramiento de la creatinina < 30 ml/min) que existía en algunos Estados miembros de la UE; ahora bien, no se recomienda su uso en pacientes con nefropatía terminal (aclaramiento de creatinina < 15 ml/min), aparte de la prevención de la formación de trombos en pacientes con diálisis. Motivos para el dictamen del CHMP Considerando que: El alcance del procedimiento de arbitraje fue la armonización de la información sobre el producto. Se ha evaluado la información sobre el producto propuesta por los titulares de la autorización de comercialización a partir de la documentación presentada y el debate científico mantenido en el seno del Comité. El Comité ha examinado el procedimiento de arbitraje conforme al artículo 30 de la Directiva 2001/83/CE. El Comité ha examinado las divergencias identificadas en la notificación para Lovenox y denominaciones asociadas, así como en las secciones restantes de la información sobre el producto. El Comité ha revisado la totalidad de los datos presentados por el TAC en apoyo de la armonización propuesta de la información sobre el producto. El Comité ha aceptado la información armonizada sobre el producto para Lovenox y denominaciones asociadas. El CHMP ha recomendado la modificación de los términos de las autorizaciones de comercialización, a cuyo efecto se incluye en el anexo III la información sobre el producto para Lovenox y denominaciones asociadas (ver anexo I). El CHMP, en consecuencia, concluyó que la relación beneficio/riesgo de Lovenox y denominaciones asociadas continúa siendo favorable, sujeta a los cambios aprobados en la información sobre el producto y a las condiciones de la autorización de comercialización. 41
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
INFORME DE LA COMISIÓN DE USO RACIONAL DE LOS MEDICAMENTOS Y PRODUCTOS SANITARIOS (CURMP) SOBRE POSICIONAMIENTO TERAPÉUTICO DE PRASUGREL Y TICAGRELOR
 DIRECCION DE SERVICIOS SANITARIOS PRODUCTOS SANITARIOS Página 1 de 8 Introducción El síndrome coronario agudo (SCA) es un término general utilizado para describir la aparición aguda de la isquemia del
DIRECCION DE SERVICIOS SANITARIOS PRODUCTOS SANITARIOS Página 1 de 8 Introducción El síndrome coronario agudo (SCA) es un término general utilizado para describir la aparición aguda de la isquemia del
ANTICOAGULACION Y REVERSION. Maria Carballude Prieto R2 MFyC OCT/11
 ANTICOAGULACION Y REVERSION Maria Carballude Prieto R2 MFyC OCT/11 DEFINICION El tto con Anticoagulantes orales (ACO) ) se ha usado desde hace años a con demostrada eficacia en la profilaxis primaria y
ANTICOAGULACION Y REVERSION Maria Carballude Prieto R2 MFyC OCT/11 DEFINICION El tto con Anticoagulantes orales (ACO) ) se ha usado desde hace años a con demostrada eficacia en la profilaxis primaria y
ENFERMEDAD TROMBOEMBÓLICA VENOSA EN EL EMBARAZO Y EL PUERPERIO
 ENFERMEDAD TROMBOEMBÓLICA VENOSA EN EL EMBARAZO Y EL PUERPERIO Milagros Cruz Martínez UGC Obstetricia y Ginecología. Hospital Universitario San Cecilio. Granada INTRODUCCIÓN La enfermedad tromboembólica
ENFERMEDAD TROMBOEMBÓLICA VENOSA EN EL EMBARAZO Y EL PUERPERIO Milagros Cruz Martínez UGC Obstetricia y Ginecología. Hospital Universitario San Cecilio. Granada INTRODUCCIÓN La enfermedad tromboembólica
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO innohep 2.500 UI anti-xa/0,25 ml solución inyectable en jeringas precargadas innohep 3.500 UI anti-xa/0,35 ml solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO innohep 2.500 UI anti-xa/0,25 ml solución inyectable en jeringas precargadas innohep 3.500 UI anti-xa/0,35 ml solución
Lección 32. Antiagregantes, Anticoagulantes y Fibrinolíticos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS
 Ricardo Brage e Isabel Trapero - Lección 32 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 32 Antiagregantes, Anticoagulantes y Fibrinolíticos 1. FUNDAMENTOS 2. CLASIFICACIÓN Guión Ricardo
Ricardo Brage e Isabel Trapero - Lección 32 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 32 Antiagregantes, Anticoagulantes y Fibrinolíticos 1. FUNDAMENTOS 2. CLASIFICACIÓN Guión Ricardo
HBPM en la insuficiencia renal
 HBPM en la insuficiencia renal Conxita Falgà Tirado S. Medicina Interna. Hospital de Mataró. Barcelona. III Jornada Novedades en Tratamiento Anticoagulante Madrid 30 de Noviembre 2012 HBPM en la I.Renal
HBPM en la insuficiencia renal Conxita Falgà Tirado S. Medicina Interna. Hospital de Mataró. Barcelona. III Jornada Novedades en Tratamiento Anticoagulante Madrid 30 de Noviembre 2012 HBPM en la I.Renal
PROFILAXIS DE LA ENFERMEDAD TROMBOEMBÓLICA VENOSA ASOCIADA CON CIRUGÍA GENERAL Y CIRUGÍA ORTOPÉDICA
 INDICACIONES Las heparinas de bajo peso molecular (HBPM) administradas por vía subcutánea, han demostrado ser un tratamiento tan seguro y eficaz como la heparina no fraccionada intravenosa en el tratamiento
INDICACIONES Las heparinas de bajo peso molecular (HBPM) administradas por vía subcutánea, han demostrado ser un tratamiento tan seguro y eficaz como la heparina no fraccionada intravenosa en el tratamiento
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clexane 120 mg (12.000 UI) solución inyectable en jeringa precargada Clexane 150 mg (15.000 UI) solución inyectable
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clexane 120 mg (12.000 UI) solución inyectable en jeringa precargada Clexane 150 mg (15.000 UI) solución inyectable
Prospecto: Información para el usuario. FRAGMIN UI/0,2 ml solución inyectable en jeringas precargadas Dalteparina sódica
 Prospecto: Información para el usuario FRAGMIN 5.000 UI/0,2 ml solución inyectable en jeringas precargadas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento
Prospecto: Información para el usuario FRAGMIN 5.000 UI/0,2 ml solución inyectable en jeringas precargadas Dalteparina sódica Lea todo el prospecto detenidamente antes de empezar a utilizar el medicamento
Historia. Fisiopatología. Sistema venoso profundo. JOHN JAIRO BERRêO C. - ADELMA SOFêA HOYOS
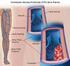 35 JOHN JAIRO BERRêO C. - ADELMA SOFêA HOYOS Historia La terapia anticoagulante ingresó en el arsenal clínico a partir del aislamiento de un glucosaminoglicano del hígado de un canino, que fue denominado
35 JOHN JAIRO BERRêO C. - ADELMA SOFêA HOYOS Historia La terapia anticoagulante ingresó en el arsenal clínico a partir del aislamiento de un glucosaminoglicano del hígado de un canino, que fue denominado
PROSPECTO: INFORMACION PARA EL USUARIO. Clexane 80 mg (8.000 UI) solución inyectable en jeringa precargada Enoxaparina sódica
 PROSPECTO: INFORMACION PARA EL USUARIO Clexane 80 mg (8.000 UI) solución inyectable en jeringa precargada Enoxaparina sódica Lea todo el prospecto detenidamente antes de empezar a usar el medicamento -
PROSPECTO: INFORMACION PARA EL USUARIO Clexane 80 mg (8.000 UI) solución inyectable en jeringa precargada Enoxaparina sódica Lea todo el prospecto detenidamente antes de empezar a usar el medicamento -
100 mg/ml. Xa de UI. 24 meses
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: ENOXAPARINA SÓDICA 60 Forma farmacéutica: Solución para inyección SC, intravascular Fortaleza: Presentación: Titular del Registro Sanitario,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: ENOXAPARINA SÓDICA 60 Forma farmacéutica: Solución para inyección SC, intravascular Fortaleza: Presentación: Titular del Registro Sanitario,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
PROTOCOLO DE ACTUACIÓN EN URGENCIAS ANTE LA SOSPECHA DE TROMBOEMBOLISMO PULMONAR (TEP)
 Página 1 de 7 PROTOCOLO DE ACTUACIÓN EN URGENCIAS ANTE LA SOSPECHA DE Página 2 de 7 El tromboembolismo pulmonar es el resultado de la obstrucción de la circulación arterial pulmonar por un émbolo procedente,
Página 1 de 7 PROTOCOLO DE ACTUACIÓN EN URGENCIAS ANTE LA SOSPECHA DE Página 2 de 7 El tromboembolismo pulmonar es el resultado de la obstrucción de la circulación arterial pulmonar por un émbolo procedente,
PROTOCOLO : PROFILAXIS DE TROMBOEMBOLISMO
 PROTOCOLO : PROFILAXIS DE TROMBOEMBOLISMO Dr. Oscar Diaz Cambronero Servicio de Anestesia Reanimacion y Tratamiento del Dolor Consorcio Hospital General Universitario de Valencia INTRODUCCION La enfermedad
PROTOCOLO : PROFILAXIS DE TROMBOEMBOLISMO Dr. Oscar Diaz Cambronero Servicio de Anestesia Reanimacion y Tratamiento del Dolor Consorcio Hospital General Universitario de Valencia INTRODUCCION La enfermedad
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ARTICULOS PUBLICADOS 4. ARTÍCULOS PUBLICADOS
 4. ARTÍCULOS PUBLICADOS 53 4.1. Clinical study and follow-up of 100 patients with the antiphospholipid syndrome. Semin Arthritis Rheum 1999; 29: 182-190. 54 55 56 57 58 59 60 61 62 63 RESUMEN Objetivo:
4. ARTÍCULOS PUBLICADOS 53 4.1. Clinical study and follow-up of 100 patients with the antiphospholipid syndrome. Semin Arthritis Rheum 1999; 29: 182-190. 54 55 56 57 58 59 60 61 62 63 RESUMEN Objetivo:
Protocolo de Actuación para pacientes con Síndrome Coronario Agudo
 Protocolo de Actuación para pacientes con Síndrome Coronario Agudo Dra Melisa Santás Álvarez Departamentos de Cardiología y Medicina Intensiva Hospital Universitario Lucus Augusti Objetivos/necesidad de
Protocolo de Actuación para pacientes con Síndrome Coronario Agudo Dra Melisa Santás Álvarez Departamentos de Cardiología y Medicina Intensiva Hospital Universitario Lucus Augusti Objetivos/necesidad de
COMISIÓN REVISORA SALA ESPECIALIZADA DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS. ACTA No. 10 SESIÓN ORDINARIA - PRESENCIAL
 1 COMISIÓN REVISORA SALA ESPECIALIZADA DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS ACTA No. 10 SESIÓN ORDINARIA - PRESENCIAL 19, 19, 20 Y 21 DE ABRIL DE 2016 ORDEN DEL DÍA 1. VERIFICACIÓN DEL QUÓRUM 2. REVISIÓN
1 COMISIÓN REVISORA SALA ESPECIALIZADA DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS ACTA No. 10 SESIÓN ORDINARIA - PRESENCIAL 19, 19, 20 Y 21 DE ABRIL DE 2016 ORDEN DEL DÍA 1. VERIFICACIÓN DEL QUÓRUM 2. REVISIÓN
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
Anticoagulación oral en atención primaria
 El efecto anticoagulante comienza a las 48-72 h de iniciar el tratamiento, se debe ajustar la dosis según la patología, mediante determinaciones seriadas del tiempo de protrombina (TP) expresado en INR
El efecto anticoagulante comienza a las 48-72 h de iniciar el tratamiento, se debe ajustar la dosis según la patología, mediante determinaciones seriadas del tiempo de protrombina (TP) expresado en INR
TRATAMIENTO INVASIVO DEL SINDROME CORONARIO AGUDO SIN ELEVACION ST / ANGINA INESTABLE ROSA OLMOS TUFIÑO R3 PG MEDICINA INTERNA UCE
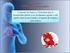 TRATAMIENTO INVASIVO DEL SINDROME CORONARIO AGUDO SIN ELEVACION ST / ANGINA INESTABLE ROSA OLMOS TUFIÑO R3 PG MEDICINA INTERNA UCE BAJO RIESGO MODERADO NSTEMI ALTO RIESGO ASA BB ANTICOAGULANTES INHIBIDOR
TRATAMIENTO INVASIVO DEL SINDROME CORONARIO AGUDO SIN ELEVACION ST / ANGINA INESTABLE ROSA OLMOS TUFIÑO R3 PG MEDICINA INTERNA UCE BAJO RIESGO MODERADO NSTEMI ALTO RIESGO ASA BB ANTICOAGULANTES INHIBIDOR
La tromboembolia venosa es un grave problema de salud pública
 La tromboembolia venosa es un grave problema de salud pública Resumen del contenidoun diagnóstico y tratamiento tempranos de la trombosis venosa profunda (TVP) es esencial para disminuir tanto el riesgo
La tromboembolia venosa es un grave problema de salud pública Resumen del contenidoun diagnóstico y tratamiento tempranos de la trombosis venosa profunda (TVP) es esencial para disminuir tanto el riesgo
Anexo IV. Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
ESTRATEGIA DE REPERFUSIÓN PRECOZ EN EL SÍNDROME CORONARIO AGUDO CON ELEVACIÓN DEL ST EN EL PRINCIPADO DE ASTURIAS PROYECTO IAMASTUR CÓDIGO CORAZÓN
 ESTRATEGIA DE REPERFUSIÓN PRECOZ EN EL SÍNDROME CORONARIO AGUDO CON ELEVACIÓN DEL ST EN EL PRINCIPADO DE ASTURIAS PROYECTO IAMASTUR CÓDIGO CORAZÓN UNIDAD DE ATENCIÓN A URGENCIAS Y EMERGENCIAS SANITARIAS
ESTRATEGIA DE REPERFUSIÓN PRECOZ EN EL SÍNDROME CORONARIO AGUDO CON ELEVACIÓN DEL ST EN EL PRINCIPADO DE ASTURIAS PROYECTO IAMASTUR CÓDIGO CORAZÓN UNIDAD DE ATENCIÓN A URGENCIAS Y EMERGENCIAS SANITARIAS
PROSPECTO: INFORMACIÓN PARA EL USUARIO. HEPARINA SÓDICA CHIESI UI/ml
 PROSPECTO: INFORMACIÓN PARA EL USUARIO HEPARINA SÓDICA CHIESI 5.000 UI/ml Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto ya que puede tener que volver
PROSPECTO: INFORMACIÓN PARA EL USUARIO HEPARINA SÓDICA CHIESI 5.000 UI/ml Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto ya que puede tener que volver
HBPM, son todas iguales? M. Lorena Castro Arias Médico Adjunto Servicio de Urgencias Hospital 12 de octubre 23 /05/2014
 HBPM, son todas iguales? M. Lorena Castro Arias Médico Adjunto Servicio de Urgencias Hospital 12 de octubre 23 /05/2014 HBPM! Proceden de la despolimerización de la molécula original de HNF HBPM PESO (daltons)
HBPM, son todas iguales? M. Lorena Castro Arias Médico Adjunto Servicio de Urgencias Hospital 12 de octubre 23 /05/2014 HBPM! Proceden de la despolimerización de la molécula original de HNF HBPM PESO (daltons)
INFORMACION PARA PRESCRIBIR REDUCIDA
 INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: NABRATIN 2. Nombre Genérico: CLOPIDOGREL 3. Forma Farmacéutica y Formulación: Tabletas. Cada tableta contiene: Bisulfato de Clopidogrel equivalente
INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: NABRATIN 2. Nombre Genérico: CLOPIDOGREL 3. Forma Farmacéutica y Formulación: Tabletas. Cada tableta contiene: Bisulfato de Clopidogrel equivalente
Rivaroxaban vs. Enoxaparina
 Rivaroxaban vs. Enoxaparina Se demostró que una dosis oral diaria de 10 mg de rivaroxaban fue significativamente más eficaz que la administración subcutánea diaria de 40 mg de enoxaparina para prevenir
Rivaroxaban vs. Enoxaparina Se demostró que una dosis oral diaria de 10 mg de rivaroxaban fue significativamente más eficaz que la administración subcutánea diaria de 40 mg de enoxaparina para prevenir
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clexane 20 mg (2.000 UI) solución inyectable en jeringa precargada Clexane 40 mg (4.000 UI) solución inyectable en
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Clexane 20 mg (2.000 UI) solución inyectable en jeringa precargada Clexane 40 mg (4.000 UI) solución inyectable en
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
Lourdes Betegon 1 ; Cristina Canal 1 ; Marina De Salas-Cansado 2
 Análisis de Costes No Farmacológicos y Eventos Evitados en el Tratamiento de la Fibrilación Auricular en España: Apixaban Frente a Otros Fármacos Anticoagulantes Lourdes Betegon 1 ; Cristina Canal 1 ;
Análisis de Costes No Farmacológicos y Eventos Evitados en el Tratamiento de la Fibrilación Auricular en España: Apixaban Frente a Otros Fármacos Anticoagulantes Lourdes Betegon 1 ; Cristina Canal 1 ;
Jorge Castillo Pilar Sierra. SCARTD Junio 2013
 Jorge Castillo Pilar Sierra SCARTD Junio 2013 Pilar Sierra Fundació Puigvert- Barcelona Índice: Porqué son necesarios nuevos antiagregantes? Fármacos en fase de investigación Nuevos antiagregantesplaquetarios
Jorge Castillo Pilar Sierra SCARTD Junio 2013 Pilar Sierra Fundació Puigvert- Barcelona Índice: Porqué son necesarios nuevos antiagregantes? Fármacos en fase de investigación Nuevos antiagregantesplaquetarios
INFARTO DE MIOCARDIO / DEPRESION DEL SEGMENTO ST Y ANGINA INESTABLE (NSTEMI).
 Título: INFARTO DE MIOCARDIO (IAM) Codificación CIE10 I22.9 infarto subsecuente del miocardio de parte no especificada Z03.4 observación por sospecha de infarto de miocardio I21 infarto de miocardio depresión
Título: INFARTO DE MIOCARDIO (IAM) Codificación CIE10 I22.9 infarto subsecuente del miocardio de parte no especificada Z03.4 observación por sospecha de infarto de miocardio I21 infarto de miocardio depresión
TROMBOEMBOLISMO PULMONAR
 TROMBOEMBOLISMO PULMONAR AHOGAMIENTO INCOMPLETO Concepto: El troemboembolismo pulmonar se puede conceptuar como la expresión clínica del enclavamiento de un trombo hemático en el árbol pulmonar. Es la
TROMBOEMBOLISMO PULMONAR AHOGAMIENTO INCOMPLETO Concepto: El troemboembolismo pulmonar se puede conceptuar como la expresión clínica del enclavamiento de un trombo hemático en el árbol pulmonar. Es la
18/04/2007 Código: PC Versión1
 Elaborado por: Jaime Elízaga Corrales Fernando Sarnago Cebada Ana María Pello Lázaro Aprobado por: Dr. Francisco Fernández-Avilés Modificaciones Fecha de presentación: 18/04/2007 Aprobación: Francisco
Elaborado por: Jaime Elízaga Corrales Fernando Sarnago Cebada Ana María Pello Lázaro Aprobado por: Dr. Francisco Fernández-Avilés Modificaciones Fecha de presentación: 18/04/2007 Aprobación: Francisco
PROTOCOLO PARA PREVENCIÓN DE TROMBOEMBOLIA VENOSA
 PROTOCOLO PARA PREVENCIÓN DE CUENCA ECUADOR 2015 Página: 2 de 10 INDICE OBJETIVO... 3 ALCANCE... 3 RESPONSABILIDADES... 3 GENERALIDADES... 3 FUNDAMENTO TEORICO... 3 ESCALA DE PUNTUACIÓN DE WELLS... 4 ESCALA
PROTOCOLO PARA PREVENCIÓN DE CUENCA ECUADOR 2015 Página: 2 de 10 INDICE OBJETIVO... 3 ALCANCE... 3 RESPONSABILIDADES... 3 GENERALIDADES... 3 FUNDAMENTO TEORICO... 3 ESCALA DE PUNTUACIÓN DE WELLS... 4 ESCALA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
Manejo Antitrombótico Post Stent Coronario en Pacientes con Anticoagulación Oral
 Manejo Antitrombótico Post Stent Coronario en Pacientes con Anticoagulación Oral Dilucidando un Problema Real Dr. Mario A. Benavides Gzz. Jefe del Servicio de Cardiología Hospital Universitario U.A.N.L.
Manejo Antitrombótico Post Stent Coronario en Pacientes con Anticoagulación Oral Dilucidando un Problema Real Dr. Mario A. Benavides Gzz. Jefe del Servicio de Cardiología Hospital Universitario U.A.N.L.
Guía de prescripción
 Guía de prescripción Tarjeta de alerta para el paciente Debe entregarse una tarjeta de alerta a cada paciente al que se le receta Xarelto 15 mg ó 20 mg y explicarle lo que supone el tratamiento anticoagulante.
Guía de prescripción Tarjeta de alerta para el paciente Debe entregarse una tarjeta de alerta a cada paciente al que se le receta Xarelto 15 mg ó 20 mg y explicarle lo que supone el tratamiento anticoagulante.
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO. URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
Para la lista completa de excipientes, véase la sección Indicaciones de uso, especificando las especies de destino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
Mujeres - De I00 a I99
 . Defunciones según causas a 3 caracteres y edad. Mujeres. 203 - Mujeres - De I00 a I99 I00. Fiebre reumática sin mención de complicación cardíaca I0. Fiebre reumática con complicación cardíaca I02. Corea
. Defunciones según causas a 3 caracteres y edad. Mujeres. 203 - Mujeres - De I00 a I99 I00. Fiebre reumática sin mención de complicación cardíaca I0. Fiebre reumática con complicación cardíaca I02. Corea
RESUMEN enfermedades cardiológicas y tratamientos dentales
 RESUMEN enfermedades cardiológicas y tratamientos dentales 1. Hacer una buena anamnesis en la ficha de la historia clínica para conocer la situación clínica del paciente: diagnóstico, tratamiento, riesgo
RESUMEN enfermedades cardiológicas y tratamientos dentales 1. Hacer una buena anamnesis en la ficha de la historia clínica para conocer la situación clínica del paciente: diagnóstico, tratamiento, riesgo
n el patrocinio de MARIA JOSE RUIZ OLGADO
 n el patrocinio de MARIA JOSE RUIZ OLGADO CASO CLINICO Varón de 75 años NAMC SIN FRCV CONOCIDOS SIN TRATAMIENTOS CRÓNICOS ACUDE A URGENCIAS (20H.) POR DOLOR TORÁCICO CASO CLINICO 1. INICIO SINTOMAS: INTERMITENTE
n el patrocinio de MARIA JOSE RUIZ OLGADO CASO CLINICO Varón de 75 años NAMC SIN FRCV CONOCIDOS SIN TRATAMIENTOS CRÓNICOS ACUDE A URGENCIAS (20H.) POR DOLOR TORÁCICO CASO CLINICO 1. INICIO SINTOMAS: INTERMITENTE
Profilaxis de la Enfermedad Tromboembólica en el Embarazo. Marta Pastor Extremiana Hospital Universitario Cruces Bilbao, 16 de Enero de 2015
 Profilaxis de la Enfermedad Tromboembólica en el Embarazo Marta Pastor Extremiana Hospital Universitario Cruces Bilbao, 16 de Enero de 2015 Enfermedad Tromboembólica Venosa (ETEV) Incluye la Trombosis
Profilaxis de la Enfermedad Tromboembólica en el Embarazo Marta Pastor Extremiana Hospital Universitario Cruces Bilbao, 16 de Enero de 2015 Enfermedad Tromboembólica Venosa (ETEV) Incluye la Trombosis
FICHA TÉCNICA -FRAGMIN-
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA -FRAGMIN- FRAGMIN 2.500 UI/0,2 ml, solución inyectable en jeringas precargadas. FRAGMIN 5.000 UI/0,2 ml, solución inyectable en jeringas precargadas. FRAGMIN 7.500
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA -FRAGMIN- FRAGMIN 2.500 UI/0,2 ml, solución inyectable en jeringas precargadas. FRAGMIN 5.000 UI/0,2 ml, solución inyectable en jeringas precargadas. FRAGMIN 7.500
Dabigatrán y Rivaroxaban: qué pueden aportar?
 Dabigatrán y Rivaroxaban: qué pueden aportar? Forum Multidisciplinar de la Enfermedad Tromboembólica Elche, 8-10 de mayo, 2008 Prof. Vicente Vicente García Servicio de Hematología y Oncología Médica Hospital
Dabigatrán y Rivaroxaban: qué pueden aportar? Forum Multidisciplinar de la Enfermedad Tromboembólica Elche, 8-10 de mayo, 2008 Prof. Vicente Vicente García Servicio de Hematología y Oncología Médica Hospital
0.5-2 ETV por cada 1000 embarazos 2/3 TVP durante el embarazo: M. Inf Izdo=80% 40-60% EP en el puerperio Incidencia similar en los 3 trimestres
 Tratamiento anticoagulante en la embarazada con ETV Dr. Javier Trujillo Santos Servicio de Medicina Interna Hospital Universitario Sª Mª del Rosell (Cartagena) 0.5-2 ETV por cada 1000 embarazos 2/3 TVP
Tratamiento anticoagulante en la embarazada con ETV Dr. Javier Trujillo Santos Servicio de Medicina Interna Hospital Universitario Sª Mª del Rosell (Cartagena) 0.5-2 ETV por cada 1000 embarazos 2/3 TVP
ELABORACIÓN DE SOLUCION DE FUROSEMIDA 2 mg/ml
 ELABORACIÓN DE SOLUCION DE FUROSEMIDA 2 mg/ml Fórmula materia prima cantidad/ml cantidad/100 ml Furosemida Ph.Eur. 2 mg 200 mg Sodio metil paraben (Nipagín ) 0,68 mg 68 mg Sodio propil paraben (Nipasol
ELABORACIÓN DE SOLUCION DE FUROSEMIDA 2 mg/ml Fórmula materia prima cantidad/ml cantidad/100 ml Furosemida Ph.Eur. 2 mg 200 mg Sodio metil paraben (Nipagín ) 0,68 mg 68 mg Sodio propil paraben (Nipasol
1. NOMBRE DEL MEDICAMENTO INNOHEP 20.000 UI anti-xa/ml, solución inyectable en jeringas
 1. NOMBRE DEL MEDICAMENTO INNOHEP 20.000 UI anti-xa/ml, solución inyectable en jeringas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una jeringa contiene 20.000 UI anti-xa/ml de tinzaparina sódica. Para excipientes,
1. NOMBRE DEL MEDICAMENTO INNOHEP 20.000 UI anti-xa/ml, solución inyectable en jeringas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una jeringa contiene 20.000 UI anti-xa/ml de tinzaparina sódica. Para excipientes,
Modificaciones respecto a la anterior edición. Elaborado: Revisado Aprobado: Dirección Médica Dirección Enfermería
 Protocolo de nueva elaboración Modificaciones respecto a la anterior edición Elaborado: Revisado Aprobado: Comisión Infección, profilaxis y política antibiótica Dirección Médica Dirección Enfermería Dirección
Protocolo de nueva elaboración Modificaciones respecto a la anterior edición Elaborado: Revisado Aprobado: Comisión Infección, profilaxis y política antibiótica Dirección Médica Dirección Enfermería Dirección
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR. Vacuna antigripal pandémica (antígenos de superficie, inactivada, adyuvada)
 A. ETIQUETADO 28 INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTÓN PARA JERINGA 1. NOMBRE DEL MEDICAMENTO Focetria suspensión inyectable en jeringa precargada Vacuna antigripal pandémica
A. ETIQUETADO 28 INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTÓN PARA JERINGA 1. NOMBRE DEL MEDICAMENTO Focetria suspensión inyectable en jeringa precargada Vacuna antigripal pandémica
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
GPC PREVENCIÓN PRIMARIA Y SECUNDARIA DEL ICTUS Prevención secundaria del ictus
 GP PREVENIÓN PRIMRI Y SEUNDRI DEL ITUS Prevención secundaria del ictus Riesgo de un nuevo episodio de ictus isquémico transitorio o ataque isquémico transitorio uál es el riesgo de sufrir un ictus en personas
GP PREVENIÓN PRIMRI Y SEUNDRI DEL ITUS Prevención secundaria del ictus Riesgo de un nuevo episodio de ictus isquémico transitorio o ataque isquémico transitorio uál es el riesgo de sufrir un ictus en personas
TERAPIA ANTITROMBÓTICA EN PACIENTES CON FA CRÓNICA TOMANDO ACO QUE CURSAN UN SCA. Dr. Elìas Bornicen Dr. Ivàn Vilar
 TERAPIA ANTITROMBÓTICA EN PACIENTES CON FA CRÓNICA TOMANDO ACO QUE CURSAN UN SCA Dr. Elìas Bornicen Dr. Ivàn Vilar FIBRILACIÓN AURICULAR La FA es la arritmia sostenida más común y afecta entre el 1% y
TERAPIA ANTITROMBÓTICA EN PACIENTES CON FA CRÓNICA TOMANDO ACO QUE CURSAN UN SCA Dr. Elìas Bornicen Dr. Ivàn Vilar FIBRILACIÓN AURICULAR La FA es la arritmia sostenida más común y afecta entre el 1% y
Guía de prescripción para el profesional sanitario
 Guía de prescripción para el profesional sanitario El primer inhibidor directo ORAL del Factor Xa Simplificando la Protección de Sus Pacientes Este medicamento está sujeto a seguimiento adicional, es prioritaria
Guía de prescripción para el profesional sanitario El primer inhibidor directo ORAL del Factor Xa Simplificando la Protección de Sus Pacientes Este medicamento está sujeto a seguimiento adicional, es prioritaria
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
A continuación se exponen los criterios de inclusión de cada uno de los fármacos en los estudios correspondientes para mayor información del clínico:
 TRATAMIENTO ANTITROMBÓTICO EN LAS DIFERENTES CARDIOPATÍAS Febrero 2013 FIBRILACION AURICULAR AISLADA El tratamiento de elección en pacientes con fibrilación auricular aislada e indicación de anticoagulación
TRATAMIENTO ANTITROMBÓTICO EN LAS DIFERENTES CARDIOPATÍAS Febrero 2013 FIBRILACION AURICULAR AISLADA El tratamiento de elección en pacientes con fibrilación auricular aislada e indicación de anticoagulación
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
ESTANDARIZACIÓN DE ABREVIATURAS,SÍMBOLOS Y EXPRESIONES UTILIZADOS EN LA PRESCRIPCIÓN Y LA ADMINISTRACIÓN DE MEDICAMENTOS EN UNA COMUNIDAD AUTÓNOMA
 ESTANDARIZACIÓN DE ABREVIATURAS,SÍMBOLOS Y EXPRESIONES UTILIZADOS EN LA PRESCRIPCIÓN Y LA ADMINISTRACIÓN DE MEDICAMENTOS EN UNA COMUNIDAD AUTÓNOMA Autores: de la Corte García M., Calvo Alcántara MJ. y
ESTANDARIZACIÓN DE ABREVIATURAS,SÍMBOLOS Y EXPRESIONES UTILIZADOS EN LA PRESCRIPCIÓN Y LA ADMINISTRACIÓN DE MEDICAMENTOS EN UNA COMUNIDAD AUTÓNOMA Autores: de la Corte García M., Calvo Alcántara MJ. y
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Flexicam 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Flexicam 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
SCASEST Tratamiento antiplaquetario y antitrombótico. Siempre y a todos?
 SCASEST Tratamiento antiplaquetario y antitrombótico. Siempre y a todos? Alfredo Bardají Servicio de Cardiología Hospital Universitario de Tarragona Joan XXIII ACMCB. 28 de Febrero 2008. Casi siempre y
SCASEST Tratamiento antiplaquetario y antitrombótico. Siempre y a todos? Alfredo Bardají Servicio de Cardiología Hospital Universitario de Tarragona Joan XXIII ACMCB. 28 de Febrero 2008. Casi siempre y
Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención
 Guía de Referencia Rápida Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención Guía de Referencia Rápida
Guía de Referencia Rápida Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención Guía de Referencia Rápida
Garantías de Oportunidad en el AUGE
 Garantías de Oportunidad en el AUGE PLAN AUGE GARANTÍA DE OPORTUNIDAD: El Auge define un tiempo máximo de atención para el diagnóstico y/o tratamiento de las 69 enfermedades incluidas en el plan de salud,
Garantías de Oportunidad en el AUGE PLAN AUGE GARANTÍA DE OPORTUNIDAD: El Auge define un tiempo máximo de atención para el diagnóstico y/o tratamiento de las 69 enfermedades incluidas en el plan de salud,
Prospecto: información para el usuario. Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
 Prospecto: información para el usuario FRAXIPARINA FORTE 0,6 ml solución inyectable Nadroparina cálcica Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. Conserve este prospecto,
Prospecto: información para el usuario FRAXIPARINA FORTE 0,6 ml solución inyectable Nadroparina cálcica Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. Conserve este prospecto,
MANEJO PERIOPERATORIO DE LOS ANTIPLAQUETARIOS. DAVID VIVAS, MD, PhD
 MANEJO PERIOPERATORIO DE LOS ANTIPLAQUETARIOS DAVID VIVAS, MD, PhD GRUPO TROMBOSIS SEC MURCIA 2011 ANTIPLAQUETARIOS Y CIRUGÍA Hasta el 5% pacientes tras intervencionismo precisan cirugía en los siguientes
MANEJO PERIOPERATORIO DE LOS ANTIPLAQUETARIOS DAVID VIVAS, MD, PhD GRUPO TROMBOSIS SEC MURCIA 2011 ANTIPLAQUETARIOS Y CIRUGÍA Hasta el 5% pacientes tras intervencionismo precisan cirugía en los siguientes
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
 INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
CONTENIDO DEL CURSO TROMBOSIS Y EMBOLIA
 Módulo I 1. Objetivo 1.1.1. HistologÍa y estructura de la pared vascular 1.1.2. EL Endotelio 1.1.3. Plaquetas 1.1.4 Fisiología de la coagulación 1.1.5 Proceso de la coagulación 1.1.6 Generalidades de la
Módulo I 1. Objetivo 1.1.1. HistologÍa y estructura de la pared vascular 1.1.2. EL Endotelio 1.1.3. Plaquetas 1.1.4 Fisiología de la coagulación 1.1.5 Proceso de la coagulación 1.1.6 Generalidades de la
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
REVISIÓN DE DUPLICIDADES DE NUEVOS ANTICOAGULANTES ORALES MEDIANTE UN PROGRAMA INFORMÁTICO DE DETECCIÓN DE PROBLEMAS RELACIONADOS CON LOS MEDICAMENTOS
 REVISIÓN DE DUPLICIDADES DE NUEVOS ANTICOAGULANTES ORALES MEDIANTE UN PROGRAMA INFORMÁTICO DE DETECCIÓN DE PROBLEMAS RELACIONADOS CON LOS MEDICAMENTOS BCN 14/11/14 Tarazona Casany MV, Vallés Martínez MT,
REVISIÓN DE DUPLICIDADES DE NUEVOS ANTICOAGULANTES ORALES MEDIANTE UN PROGRAMA INFORMÁTICO DE DETECCIÓN DE PROBLEMAS RELACIONADOS CON LOS MEDICAMENTOS BCN 14/11/14 Tarazona Casany MV, Vallés Martínez MT,
HOSPITAL UNIVERSITARIO REINA SOFÍA Informe de la Comisión de Farmacia y Terapéutica Fondaparinux en el síndrome coronario agudo
 1.- Identificación del fármaco: Nombre Comercial: Arixtra Presentaciones: Jeringa precarg 2.5mg/0.5ml Laboratorio: Glaxo Smithkline Precio adquisición: PVL+IVA: 8.67 (precio por jeringa) Grupo Terapéutico:
1.- Identificación del fármaco: Nombre Comercial: Arixtra Presentaciones: Jeringa precarg 2.5mg/0.5ml Laboratorio: Glaxo Smithkline Precio adquisición: PVL+IVA: 8.67 (precio por jeringa) Grupo Terapéutico:
PRM, RNM, Seguimiento Farmacoterapéutico y sus características
 PRM, RNM, Seguimiento Farmacoterapéutico y sus características Daniel Sabater Hernández Grupo de Investigación en Atención Farmacéutica. Universidad de Granada. Resultados Negativos asociados a la Medicación
PRM, RNM, Seguimiento Farmacoterapéutico y sus características Daniel Sabater Hernández Grupo de Investigación en Atención Farmacéutica. Universidad de Granada. Resultados Negativos asociados a la Medicación
INN Nombre inventado Concentración Forma farmacéutica. Caustinerf Arsenical
 Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
AZITROMICINA PHARMAGENUS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 AZITROMICINA PHARMAGENUS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Azitromicina Pharmagenus EFG se ha realizado siguiendo las Directrices que la Agencia Europea
AZITROMICINA PHARMAGENUS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Azitromicina Pharmagenus EFG se ha realizado siguiendo las Directrices que la Agencia Europea
MEDICAMENTOS GENERICOS
 MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
ESTATINAS EN PERSONAS MAYORES
 ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
TRATAMIENTO ANTITROMBÓTICO, ANTICOAGULANTE E HIPOLIPEMIANTE
 DPT UNIDAD DE ICTUS Fecha: 08/05/2014 Versión1 Revisión: anual Área de Gestión Clínica de Neurociencias TRATAMIENTO ANTITROMBÓTICO, ANTICOAGULANTE E HIPOLIPEMIANTE AUTORES -Isabel Prieto Méndez (Supervisora
DPT UNIDAD DE ICTUS Fecha: 08/05/2014 Versión1 Revisión: anual Área de Gestión Clínica de Neurociencias TRATAMIENTO ANTITROMBÓTICO, ANTICOAGULANTE E HIPOLIPEMIANTE AUTORES -Isabel Prieto Méndez (Supervisora
Eni* Tabletas e Inyectable. Ciprofloxacino
 Tabletas e Inyectable Ciprofloxacino Descripción Es ciprofloxacino, la fluoroquinolona bactericida potente, con amplio espectro antibacteriano que incluye grampositivos y gramnegativos. Tiene alta eficacia
Tabletas e Inyectable Ciprofloxacino Descripción Es ciprofloxacino, la fluoroquinolona bactericida potente, con amplio espectro antibacteriano que incluye grampositivos y gramnegativos. Tiene alta eficacia
Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias A.N.M.A.T.
 BUENOS AIRES, 17 Sep 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-015925-07-2 del registro de esta Administración
BUENOS AIRES, 17 Sep 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-015925-07-2 del registro de esta Administración
Etiologia. La trombosis venosa se define como la presencia de un trombo o coágulo de sangre en una vena, sea cual sea su localización.
 TROMBOSIS VENOSA Universidad Abierta Interamericana Facultad de Medicina Carrera Licenciatura en Enfermería Materia: Ciencias Biológicas IV Prof.: Alejandro Vázquez Alumno: Miranda Lino Etiologia La trombosis
TROMBOSIS VENOSA Universidad Abierta Interamericana Facultad de Medicina Carrera Licenciatura en Enfermería Materia: Ciencias Biológicas IV Prof.: Alejandro Vázquez Alumno: Miranda Lino Etiologia La trombosis
Cómo funciona una Unidad de Insuficiencia Cardiaca?
 2 Curso de Aspectos Prácticos en Cardiología Clínica Cómo funciona una Unidad de Insuficiencia Cardiaca? Dr. Ramón Bover Unidad de Insuficiencia Cardiaca Servicio de Cardiología Insuficiencia Cardiaca
2 Curso de Aspectos Prácticos en Cardiología Clínica Cómo funciona una Unidad de Insuficiencia Cardiaca? Dr. Ramón Bover Unidad de Insuficiencia Cardiaca Servicio de Cardiología Insuficiencia Cardiaca
PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
en el Paciente Quirúrgico
 Trombo profilaxis en el Paciente Quirúrgico CLINICA MEDICA C PROFESOR DR JUAN ALONSO Dra Lila Borràs Asistente Clinica Medica C BENEFICIO CLINICO NETO SANGRADO TROMBOSIS Que situaciones aumentan el riesgo
Trombo profilaxis en el Paciente Quirúrgico CLINICA MEDICA C PROFESOR DR JUAN ALONSO Dra Lila Borràs Asistente Clinica Medica C BENEFICIO CLINICO NETO SANGRADO TROMBOSIS Que situaciones aumentan el riesgo
Anexo II. Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto
 Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
VARIABILIDAD EN LOS NIVELES DE DÍMERO-D EN PACIENTES CON ENFERMEDAD TROMBOEMBÓLICA VENOSA
 VARIABILIA EN LOS NIVELES E ÍMERO- EN PACIENTES CON ENFERMEA TROMBOEMBÓLICA VENOSA María José Soto Cárdenas S. Medicina Interna H. U. Puerta del Mar (Cádiz) ENFERMEA TROMBOEMBÓLICA VENOSA: algunas consideraciones.
VARIABILIA EN LOS NIVELES E ÍMERO- EN PACIENTES CON ENFERMEA TROMBOEMBÓLICA VENOSA María José Soto Cárdenas S. Medicina Interna H. U. Puerta del Mar (Cádiz) ENFERMEA TROMBOEMBÓLICA VENOSA: algunas consideraciones.
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
Restricciones de uso de los medicamentos que contienen domperidona
 1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
