ALTERACIONES DEL ESTADO ACIDO-BASE. Prof. Dra. María Cecilia Carreras Química Clínica General Dpto. Bioquímica Clínica. FFyB. UBA
|
|
|
- María Luz Franco Villanueva
- hace 6 años
- Vistas:
Transcripción
1 ALTERACIONES DEL ESTADO ACIDO-BASE Prof. Dra. María Cecilia Carreras Química Clínica General Dpto. Bioquímica Clínica. FFyB. UBA
2 OBJETIVOS -Integrar los conceptos básicos de la fisiopatología con las manifestaciones clínicas de las alteraciones del equilibrio ácido-base. -Reconocer los mecanismos de regulación y los trastornos del equilibrio ácido-base.
3
4 6,8
5 REGULACION DEL EAB
6 Respuesta fisiológica a las alteraciones del EAB BUFFERS LIC (60%), LEC (40%) RESPIRATORIO EXCRECION O RETENCION DE CO 2 ph COMP. METABOLICO COMP. RESPIRATORIO RENAL EXCRECION DE H+, REABSORCION Y FORMACION de HCO 3 - Intervalos de referencia: ph 7,35-7,45 (35-45 nm H + ) pco mmhg HCO meq/l
7 Sistemas amortiguadores o buffer Primera línea de defensa contra las alteraciones ácido-base (minutos) LEC Células Hueso Orina H 2 CO 3 /HCO 3 - HPr/Pr - CaCO 3 H 2 CO 3 /HCO 3 - H 2 PO 4- /HPO 4 2- H 2 PO 4- /HPO 4 2- H 2 PO 4- /HPO 4 2- HPr/Pr - HHb/Hb - NH 3 /NH 4 +
8 Respuesta respiratoria Los pulmones son la segunda línea de defensa contra las alteraciones ácido-base SENSORES: quimiorreceptores del cerebro, carótida y aorta. MECANISMO: ph frecuencia respiratoria (Respiración de Kussmaul) ventilación alveolar pco 2 H 2 CO 3 H + ph frecuencia respiratoria ventilación alveolar pco 2 H 2 CO 3 H + TIEMPO DE RESPUESTA: minutos COMPENSACION COMPLETA: horas
9 Respuesta renal Los riñones son la tercer y última línea de defensa frente a las alteraciones ácido-base. MECANISMO: ajuste de: excreción de H + HCO 3 - EC HCO 3 - filtrado reabsorción y regeneración de HCO 3 - eliminación de HCO 3- generado en exceso HCO 3 - reabs formación de nuevo HCO 3 - DURACION: 3-5 días excreción de acidez titulable NH 4 +
10 PROXIMAL DISTAL LA ACIDIFICACION PROXIMAL RECUPERA EL BICARBONATO FILTRADO LA ACIDIFICACION DISTAL PRODUCE BICARBONATO DE NOVO
11 El efecto neto de la excreción de 1 H + es el retorno de 1 HCO 3- y 1 Na + a la circulación
12 Excreción renal de ácidos Acidos no volátiles filtrados = meq/día Buffers urinarios: acidez titulable (fosfatos)~ 10-40mEq/día Síntesis y excreción de NH 4+ ~ meq/día Excreción neta ácida = [(NH 4 + u x V) + (AT u x V)] (HCO 3 - u x V) excreción diaria de amonio y AT HCO 3- perdido en orina phu mínimo ~ 4,5
13 Alteraciones ácido-base primarias Alteración ph Alteración primaria Mecanismos de defensa Acidosis Metabólica ph [HCO 3- ] pl Alcalosis Metabólica ph [HCO 3- ] pl Buffers Hiperventilación ENA renal Buffers Hipoventilación ENA renal Acidosis Buffers respiratoria ph pco 2 ENA renal Alcalosis Buffers Respiratoria ph pco 2 ENA renal ENA = excreción neta de ácidos
14 TRASTORNOS METABOLICOS Y RESPIRATORIOS MECANISMOS DE COMPENSACION Compensación respiratoria rápida Compensación metabólica más lenta Acidosis metabólica Acidosis respiratoria Compensación respiratoria: HIPERVENTILACION Compensación metabólica: RETENCION DE HCO 3 - Alcalosis metabólica Alcalosis respiratoria Compensación respiratoria: HIPOVENTILACION Compensación metabólica: SECRECION DE HCO 3 -
15 La alteración de la [HCO 3- ] produce una variación de ph en el mismo sentido. La alteración de la pco 2 produce una variación de ph en sentido opuesto. Las respuestas compensatorias a nivel renal y respiratorio se producen en el mismo sentido que el trastorno primario. La compensación es completa cuando el ph vuelve al rango normal y parcial cuando está fuera del intervalo de referencia. NO existe sobrecompensación.
16 Mecanismos compensatorios Ecuaciones de predicción Alteración ácido-base Cálculo de la compensación LIMITES Acidosis metabólica pco 2 = 1,5 x [HCO 3- ] = 1,2 x [HCO 3- ] Alcalosis metabólica pco 2 = 0,6 x [HCO 3- ] Acidosis respiratoria aguda [HCO 3- ] = 0,1 x Pco 2 30 Acidosis respiratoria crónica [HCO 3- ] = 0,35 x pco 2 45 Alcalosis respiratoria aguda [HCO 3- ] = 0,2 x pco 2 18 Alcalosis respiratoria crónica [HCO 3- ] = 0,5 x pco 2 12 VALORES DE REFERENCIA: HCO 3- = 24 meq/l, pco 2 = 40 mm Hg
17 ECUACION DE HENDERSON HASSELBALCH ACIDOSIS METABOLICA
18 ACIDOSIS METABOLICA ph < 7,35 HCO 3- < 22 meq/l pco 2 N- Etiología CO 2 + H 2 O H 2 CO 3 H + + HCO 3-1. Inhabilidad del riñón para excretar la carga dietaria de H + - I Renal, hipoaldosteronismo (ATR tipo IV), secreción H + (ATR tipo I) 2. carga H + - Cetoacidosis, acidosis láctica, intoxicaciones 3. Pérdida de jugos digestivos ricos en HCO Diarrea, fístulas 4. Pérdida renal de HCO ATR tipo II, acetazolamida Características clínicas HIPERVENTILACIÓN CO 2 + H 2 O H 2 CO 3 H + + HCO 3 -
19 Clasificación de las acidosis metabólicas por el Anión Gap AG =ANM- CNM= [Na + ] - ([Cl - ]+ [HCO 3- ]) = 10 ± 4 meq/l K + AG HCO 3 - K + AG HCO - 3 K + AG HCO - 3 HCO 3 - Na + Cl - Na + Cl - Na + Cl - EAB Normal Acidosis AG alto Acidosis hiperclorémica AG N UTILIDAD CLINICA= diagnóstico diferencial de las acidosis metabólicas La utilidad diagnóstica es mayor cuando AG> 25
20 ¾ partes del valor del AG corresponden a la albúmina sérica
21 ANIÓN GAP BAJO NORMAL AUMENTADO - Error de laboratorio Cl - sobreestimado - Hipoalbuminemia - Hipermagnesemia - Hipercalcemia - Intoxicación con Li Aumento de cationes no medidos o disminución de aniones no medidos ACIDOSIS HIPERCLORÉMICA Pérdida gastrointestinal de HCO Diarrea severa - Pancreatitis - Fístula intestinal Pérdida renal de HCO Acidosis tubular renal proximal - Inhibidores de la AC (acetazolamida) Secreción renal reducida de H + - Insuficiencia renal temprana - Inhibidores o déficit de aldosterona - Acidosis tubular distal y tipo IV Administración de soluciones con Cl - Cetoacidosis Acidosis Láctica Intoxicaciones Insuficiencia renal Rabdomiólisis
22 CETOACIDOSIS Las cetonas son ácidos orgánicos (acetato y ácido β-hidroxibutírico que se disocian completamente, producen H+, consumen HCO 3- y provocan acidosis metabólica. DIABETICA POR AYUNO ALCOHOLICA Para que se desarrolle cetoacidosis diabética se requieren niveles anormales de insulina y glucagon. En el ayuno, la menor secreción de insulina conduce a la liberación de AG libres, una fracción de los mismos es captado por los hepatocitos que los transforman en cetonas ( 80% en ácido β-hidroxibutírico) que son liberados a la circulación. La patogenia de la cetoacidosis alcohólica involucra al etanol, inanición, déficit de Insulina, exceso de glucagon y catecolaminas y vómitos. En la cetoacidosis diabética, se agrega el déficit de volumen circulante, la coexistencia de acidosis láctica y el déficit de potasio, que depende de la duración y magnitud de la poliuria secundaria almal control glucémico y del grado de reposición de las pérdidas.
23 ACIDOSIS LÁCTICA LDH Piruvato + NADH Lactato + NAD + + H + Hiperlactatemia: lactato plasmático 2-5 mm Acidosis láctica: ph < 7,25 y lactato pl > 5 mm HCO 3 - EB<0 pco 2 y po 2 N ó SO 2 AG K + Tipo A : Lactato:piruvato > 10 acidosis láctica hipóxica: perfusión tisular u oxigenación insuficiente (anemia, ejercicio intenso o infecciones sistémicas, deshidratación, shock, falla cardíaca) Tipo B: Lactato:piruvato = 10 acidosis láctica glucolítica: disminución del metabolismo hepático d ácido láctico sin evidencias clínicas de pobre perfusión tisular u oxigenación. (asociada con otras enfemedades subyacentes -disfunción mitocondrial-, drogas (metformina) o toxinas, errores metabólicos congénitos) D-LACTATO: Infeccion bacteriana intestinal
24 ACIDOSIS EN LA INSUFICIENCIA RENAL Disminución de la excreción renal de NH 4+ a menos del 50 % Disminución de la conservación renal de HCO 3- filtrado. Capacidad restringida para aumentar la excreción de ácido en respuesta a una carga ácida. El ph urinario y la acidez titulable no se alteran. La hiperpotasemia y el hipoaldosteronismo presentes en la IR no parecen ser necesarios para el deterioro de la excreción renal de ácido.
25 Acidosis metabólica con AG aumentado + Gap Osmolar aumentado Intoxicaciones con alcoholes Ingestión de alcohol + ayuno Ingestión de etilenglicol (anticongelante, solventes) Ingestión de metanol (barnices, líquidos del automóvil) + Gap Osmolar normal Cetoacidosis diabética Acidosis Láctica Insuficiencia renal severa (VFG < 10 ml/min/1,73 m 2 ) Ingestión de salicilatos Intoxicación con hierro Exposición a tolueno
26 DETERMINACIÓN DEL GAP OSMOLAR UTILIDAD CLINICA: detección de sustancias tóxicas en acidosis metabólica con AG alto 1. MEDICIÓN DE LA OSMOLALIDAD, SODIO SÉRICO, GLUCOSA Y UREA 2. CALCULO DE LA OSMOLALIDAD PLASMÁTICA mosmol/kg H 2 O = 2 [Na + ] + glucosa/18 + urea/6 3. GAP OSMOLAR= osmolalidad (medida calculada) ~ 10 mosmol/kg H 2 O > 25 mosmol/kg H2O INTOXICACION? i. MANITOL, GLICINA ii. MEDIO DE CONTRASTE iii. METANOL iv. ETANOL V. ETILENGLICOL
27 Anión gap/ HCO 3 - Por cada unidad de en AG (sobre el normal) HCO 3- debe una unidad (por debajo del normal) Trastorno puro ~ 1-1,6 Valores de referencia: AG = 10 HCO 3- = 24 Ejemplo: AG HCO 3 - Diagnóstico 18 ( 8) 16 ( 8) Acidosis metabólica AG pura 18 ( 8) 22 ( 2) HCO 3- > que el esperado proceso mixto (acidosis + alcalosis metabólica) 18 ( 8) 12 ( 12) HCO 3- < que el esperado proceso mixto (acidosis AG y N)
28 ACIDOSIS METABOLICA CON ANION GAP NORMAL ACIDOSIS METABOLICA HIPERCLOREMICA Pérdida de bicarbonato: digestiva o renal Disminución de la excreción renal de ácidos (H + ) Retención de Cloro para mantener la electroneutralidad La causa más frecuente en el medio intrahospitalario es la infusión de grandes volúmenes de solución salina 0,9%.
29 ACIDOSIS HIPERCLOREMICA
30 Anión gap urinario AG urinario: Diferencia entre los aniones no medidos y los cationes no medidos aniones no medidos: sulfato, fosfato y aniones orgánicos cationes no medidos: NH 4 +, Ca 2+ y Mg 2+ Anión gap urinario = [Na + ] + [K + ] - [Cl - ] si phu < 6.5 = [Na + ] + [K + ] - ([Cl - ] + [CO 3 H - ]) si phu > 6.5 Utilidad clínica: Estimación de la producción y excreción de amonio diferenciación entre pérdidas GI y urinarias en la acidosis metabólica hiperclorémica Acidosis metabólica HCO 3- urinario 0 NH 4 + urinario Cl - urinario AG U < 0 AG U > 0 producción y excreción renal de NH 4 + normal (pérdida GI, ATR prox) defecto en la producción y excreción renal de NH 4 + (ATR tipo I y IV)
31 Gap osmolar urinario Osm u = [2 (Na + + K + ) + urea/60] Gap osmolar u = Osm u (medida-calculada) ~ NH 4 + En pacientes con acidosis metabólica: NH 4 + u > 20 Gap osmolar u > 40 mosm/kg Gap osmolar u < 40 mosm/kg acidificación alterada (ATR distal)
32 ACIDOSIS METABOLICA HIPERCLOREMICA Acidosis tubular renal disminución de la secreción tubular neta de H + o de la reabsorción de HCO 3 - ATR Tipo I (distal): disminución de la secreción de H + en c. intercaladas TC - ph u > 5,5 K + - disminución de la excreción de NH 4+ y de la acidez titulable, AG u >0 - [HCO 3- ] pl <10 meq/l ATR Tipo II (proximal): reducción de la reabsorción proximal de HCO ph u <5,5-variable K + N ó - aumento de la excreción de NH 4+, AG u <0 - [HCO 3- ] pl= >15 meq/l ATR Tipo IV: deficiencia o resistencia a la aldosterona (+ común) - ph u < 5,5 K + - baja producción de NH 4 +, AG u >0 - [HCO 3- ] pl > 15 meq/l
33
34 ESTUDIOS DE LABORATORIO EN LA ACIDOSIS METABOLICA Gases en sangre arterial ph y pco 2 ( ) po 2 HCO 3 - ( ) EB: ( )(cantidad de ácido o base que es requerida para titular la sangre del paciente hasta un ph de 7,40, dada una pco 2 de 40 mm Hg a 37 C) SO 2 : ( ) (cantidad de O 2 transportada por la Hb) Ionograma Na + K + (N ó ) Cl - HCO 3 - ( ) Cálculo del AG (N ó ) Cálculo del AG/ HCO 3 - Glucemia (DBT) Urea y creatinina (I renal) Hematocrito (anemia) y recuento de glóbulos blancos (sepsis)
35 Gap osmolar (IR:10-15) Gap osmolar >25 intoxicación con metanol, alcohol etílico o etilenglicol Cetonas (test de nitroprusiato) positivo para acetoacetato y acetona positivo cetoacidosis diabética, alcohólica o por ayuno prolongado negativo: en cetoacidosis que no convierten -hidroxibutirato a acetocacetato (shock severo o falla hepática) Lactato (IR: 0.5-1,5 meq/l) Lactato > 5 meq/l y ph <7,25 acidosis láctica Salicilatos (Nivel terapeútico: mg/dl) Salicilatos >40-50 mg/dl intoxicación (alcalosis respiratoria) Hierro Fe > 300 mg/dl toxicidad acidosis láctica Análisis de orina ph u - ph u > 5,5 en acidemia ATR tipo I - ph alcalino intoxicación con salicilatos - cristales de oxalato de calcio (forma de aguja) intoxicación con etilenglicol Anión Gap urinario >0 (ATR tipo I y IV)
36 Compensación de la acidosis metabólica 1- Buffers extracelulares e intracelulares HCO 3- /H 2 CO 3, Pr - /PrH, HPO 4 2- /H 2 PO 4- y carbonato óseo H + Na + /K + 2- Compensación respiratoria estimulación del centro respiratorio hiperventilación ( pco 2 ) pco 2e = 1,5 [HCO 3- ] + 8 ± 2 Por cada meq/l de descenso del [HCO 3- ] por debajo de 24 meq/l, la pco 2 debe descender 1 mm Hg. 3- Compensación renal aumento del intercambio Na + /H +, de la formación de NH 4+ y de la regeneración de HCO 3 -
37 ALGORITMO PARA ACIDOSIS METABOLICA GAP OSMOLAR ALTO ANION GAP NORMAL PERDIDA DE FLUIDOS? SI NO NORMAL Uremia Lactato Cetoácidos Salicilato AUMENTADO Etilenglicol Metanol Diarrea Ileostomía Fístula entérica <5,5 [K + ]s phu >5,5 ATR I ATR II ATR IV
38 ALCALOSIS METABÓLICA ph > 7,45 HCO 3- > 26 meq/l pco 2 N- CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - Etiología: generación y mantenimiento de la alcalosis metabólica Causas Pérdida de H + Administración excesiva de HCO 3 - Agotamiento de K + Factores de mantenimiento depleción de volumen de la reabsorción de HCO 3 - Características clínicas Hipoventilación Disminución del Ca iónico sérico (aumenta la fracción unida a proteínas) Aumento de la actividad neuromuscular Tetania, convulsiones y arritmias Tendencia a la hipokalemia e hipofosfatemia
39 ALCALOSIS POR CONTRACCION DE VOLUMEN VOLUMEN LEC VOLUMEN CIRCULANTE EFECTIVO RENINA ANGIOTENSINA II ALDOSTERONA SECRECION DE H + REGENERACION DE HCO 3 - MANTENIMIENTO DE LA ALCALOSIS
40 ALCALOSIS POR DEPLECION DE CLORURO VOMITOS [HCO 3- ] LEC [Cl - ] LEC VOLUMEN LEC [Cl - ] FILTRADO CARGA FILTRADA [HCO 3- ] CARGA FILTRADA [Cl - ] SECRECION H + REABSORCION [HCO 3- ] [Cl - ] REABSORBIDO REGENERACION [HCO 3- ] MANTENIMIENTO DE LA ALCALOSIS METABOLICA
41 ALCALOSIS POR DEPLECION DE POTASIO HIPOKALEMIA [K + ] IC EC [H + ] EC IC SECRECION RENAL H + REABSORCION [HCO 3- ] REGENERACION [HCO 3- ] MANTENIMIENTO DE LA ALCALOSIS METABOLICA
42 CLASIFICACIÓN DE LAS ALCALOSIS METABOLICAS RESPONDEDORA A CLORUROS (Cl - u < 10 meq/l) - Depleción de volumen - Vómitos - Aspiración gástrica - Fibrosis quística - Adenoma velloso de colon - Post-abuso de diuréticos de asa - Post-hipercapnia RESISTENTE A CLORUROS (Cl - u > 20 meq/l) - Exceso de mineralocorticoides a) Síndrome de Cushing b) Síndrome de Conn c) Esteroides exógenos d) Estados hiperreninémicos - Síndrome de Liddle - Depleción crónica de K + - Síndrome de Bartter, S. Gitelman - Uso/abuso de diuréticos - Abuso de laxantes - Depleción de Mg 2+, anfotericina - Exceso de alcalinos - Ingestión crónica de bicarbonato - Administración en paro cardio-respiratorio - Transfusión de sangre
43 Compensación de la Alcalosis Metabólica Sistemas Buffer H + Na + /K + Compensación respiratoria: Depresión del centro respiratorio hipoventilación ( pco 2 ) Por cada meq/l de aumento de [HCO 3- ] sobre 24 meq/l, la pco 2 debe subir 0,7 mm Hg (hasta pco 2 = 55 mmhg) Compensación renal: aumenta la excreción del exceso de HCO 3 - (salvo en deshidratación, hipokalemia o hipocloremia) Orina alcalina HCO 3- titulable en orina
44 ALGORITMO PARA ALCALOSIS METABOLICA Cl - u < 10 meq/l Vómitos Succión NG Post-diurético Adenoma velloso Post-álcalis > 20 meq/l K + u < 20 meq/l Abuso de laxantes Depleción severa K + > 40 meq/l Tratamiento diurético, Síndrome Bartter, Gitelman o Liddle Aldosteronismo primario o secundario, Sme. Cushing
45 ACIDOSIS RESPIRATORIA ph < 7,35 pco 2 > 45 mm Hg HCO 3- N- CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - CAUSAS: Desórdenes que interfieren en la capacidad normal de los pulmones para eliminar CO 2 Inhibición del centro respiratorio (sobredosis de barbitúricos, anestésicos, morfina) Desórdenes que afectan el intercambio de gases en los capilares pulmonares (edema pulmonar, EPOC, asma severo, neumonía, ARDS) Enfermedad de los músculos respiratorios y la pared torácica (hipok, miastenia) Obstrucción de las vías aéreas altas (broncoespasmo, apnea) Ventilación mecánica inadecuada
46 Compensación de la Acidosis Respiratoria Sistemas buffer IC: Hb y proteínas (buffering de CO 2 en GR) Plasma Tejido periférico Na + KHbO 2 O 2 O 2 O 2 K KHb + HHb Respiración Cl - H + HbCO 2 interna Cl - HCO - AC 3 CO 2 CO 2 CO 2 H 2 O HCO - 3 metabolismo Compensación renal: aumento en la excreción de ácidos renales, retención de Na + y HCO 3 - (No es efectiva antes de las 6-12 hs y no es óptima hasta las hs) Por cada 10 mm Hg de aumento de pco 2 sobre 40 mm Hg, el [HCO 3 -], se eleva 1 meq/l (sobre 24 meq/l) si la AR es aguda y 3 meq/l si es crónica
47 ALCALOSIS RESPIRATORIA ph > 7,45 pco 2 < 35 mm Hg HCO 3- N- CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - Causa: hiperventilación Ansiedad, histeria, llanto excesivo, embarazo (progesterona) Hipoxemia (altitud, anemia severa) Sepsis Acidosis Metabólica Enfermedad pulmonar Drogas que estimulan el centro respiratorio (salicilatos, catecolaminas, nicotina) Ventilación mecánica excesiva
48 Compensación de la alcalosis respiratoria Sistemas buffer H + Na + /K + Compensación renal: disminuye la reabsorción en TP, aumenta la eliminación de HCO 3- en TC Por cada 10 mm Hg de descenso de pco 2 por debajo de 40 mm Hg, el [HCO 3- ], disminuye 2,5 meq/l (por debajo de 24 meq/l) si la AR es aguda y 5 meq/l si es crónica
49
50 Alteraciones ácido-base mixtas Alcalosis respiratoria y acidosis metabólica (intoxicación por salicilatos o shock séptico) Acidosis metabólica y alcalosis metabólica (IR o cetoacidosis y vómitos copiosos) Alcalosis respiratoria, acidosis metabólica y alcalosis metabólica (sepsis y sonda nasogástrica) Acidosis respiratoria y alcalosis metabólica (EPOC y diarrea profusa) Acidosis respiratoria y acidosis metabólica (paro cardiorrespiratorio) Acidosis metabólica con anión gap aumentado y normal (IR y diarrea o fístula digestiva) Alcalosis respiratoria y alcalosis metabólica (embarazo y vómitos)
51 Estudio de las alteraciones del estado ácido-base De qué trastorno se trata? ph, pco 2, HCO 3- y AG Es adecuada la respuesta secundaria? Fórmulas de compensación Cuál es la causa del trastorno?
52 Alteraciones del estado ácido-base 1. Considerar la situación clínica del paciente 2. El paciente está acidémico o alcalémico? (ph<7,35 ó >7,45) 3. El proceso primario es metabólico o respiratorio? (? HCO 3-,?pCO 2 ) 4. Si es una acidosis metabólica, el anión restante está aumentado? 5. La compensación es apropiada? 6. Hay más de un desorden presente?
53 Estados clínicos y alteraciones ácido-base asociadas Estado clínico Embolia pulmonar Hipotensión Vómitos Diarrea severa Cirrosis Insuficiencia renal Sepsis Embarazo Uso de diuréticos EPOC Alteración ácido-base Alcalosis respiratoria Acidosis metabólica Alcalosis metabólica Acidosis metabólica Alcalosis respiratoria Acidosis metabólica Alcalosis respiratoria- Acidosis metabólica Alcalosis respiratoria Alcalosis metabólica Acidosis respiratoria
54 Caso ejemplo: Un hombre de 42 años fue encontrado en la calle con una botella de licor cerca y llevado a la Sala de Emergencias. La examinación clínica reveló una presión sanguínea de 120/80, pulsaciones 110/min, 37 C de temperatura corporal. El paciente no respondía. Reflejos normales. Su historia sugería la ingestíon de alguna toxina. Se tomó una muestra de sangre y se obtuvieron los siguientes resultados: ph= 7,1 pco 2 = 35 mm Hg po 2 = 90 mm Hg Na + = 145 meq/l K + = 5 meq/l Cl - = 97 meq/l HCO 3- = 12 meq/l Urea= 30 mg/dl Creatinina= 1.5 mg/dl Glucosa= 110 mg/dl
55 1. El paciente está acidémico o alcalémico? Intervalo de referencia: ph 7,35-7,45 ph = 7,10 PACIENTE ACIDEMICO
56 2. El proceso primario es metabólico o respiratorio? El proceso es iniciado por cambios en el HCO 3- o en la pco 2? HCO 3- = 12 meq/l Intervalo de referencia meq/l pco 2 = 35 mm Hg Intervalo de referencia: mm Hg ACIDOSIS METABOLICA 3. La compensación es adecuada?
57 Mecanismos compensatorios Alteración ácido-base Cálculo de la compensación LIMITES Acidosis metabólica pco 2 = 1,2 x [HCO 3- ] pco 2e = 1,5 x [HCO 3- ] +8 ± 2 Alcalosis metabólica pco 2 = 0,6 x [HCO 3- ] Acidosis respiratoria aguda [HCO 3- ] = 0,1 x Pco 2 30 Acidosis respiratoria crónica [HCO 3- ] = 0,35 x pco 2 45 Alcalosis respiratoria aguda [HCO 3- ] = 0,2 x pco 2 18 Alcalosis respiratoria crónica [HCO 3- ] = 0,5 x pco 2 12 VALORES DE REFERENCIA: HCO 3- = 24 meq/l, pco 2 = 40 mm Hg
58 pco 2 e = 1,5 x HCO ± 2 pco 2 e = (1,5 x 12) + 8 = 26 pco 2 esperada = 26 ± 2 pco 2 medida= 35 (> 26) ACIDOSIS RESPIRATORIA
59 4. El anión gap está aumentado? AG = Na + (HCO 3- + Cl - ) AG = 145 ( ) = 36 meq/l ACIDOSIS METABOLICA con AG aumentado
60 Otros datos de laboratorio: Lactato: 1 meq/l Cetonas: negativo Osmolaridad sérica: 350 mosm/kg H 2 O Osmolaridad calculada: (2x145) +(110/18) + (30/6) = 301 mosm/kg H 2 O Gap osmolar: = 49 mosm/kg H2O ACIDOSIS METABOLICA con AG y gap osmolar aumentados por intoxicación
61 Intoxicaciones que causan acidosis metabólica con AG aumentado aspirina (aumento de salicilatos (>30 mg%), alcalosis respiratoria primaria y orina alcalina) metanol (ácido fórmico, gap osmolar ) etilenglicol (cristales de oxalato de calcio e hipurato, gap osmolar ) alcohol etílico (gap osmolar ) isoniazida o hierro (tóxicos mitocondriales ácido láctico)
62 Otros datos de laboratorio: Salicilatos: negativo Metanol y etilenglicol: no se recibieron Análisis de orina: cristales de oxalato de calcio probable intoxicación con etilenglicol
63 5. Hay más de un desorden metabólico presente? AG/ HCO 3- = (AG - 10)/(24 - HCO 3- ) = (36-10)/(24-12) = 2,2 Por cada unidad de en AG (sobre el normal), HCO 3- debe una unidad (por debajo del normal). Trastorno puro = 1 Alteración mixta= < 1 ó > 1,6 anión gap > 1,6 = acidosis metabólica AG + alcalosis metabólica ACIDOSIS Y ALCALOSIS METABOLICA + ACIDOSIS RESPIRATORIA
64 El paciente tiene una alteración ácido-base triple: acidosis metabólica con alto AG secundaria a la intoxicación con etilenglicol, acidosis respiratoria y alcalosis metabólica probablemente por vómitos.
65 PROBLEMA 1 Un hombre de 30 años de edad con diabetes mellitus se presenta con una semana de poliuria, polidipsia, fiebre, náusea y dolor abdominal. Está ortostático en la admisión. Datos de laboratorio: Sodio: 130 meq/l Potasio: 6,1 meq/l Cloruro: 94 meq/l Urea: 75 mg/dl Glucosa: 906 mg/dl Creatinina: 2,3 mg/dl ph: 7,14 po 2 : 102 mm Hg pco 2 : 18 mm Hg Bicarbonato: 6 meq/l
66 1. Considerar la situación clínica 130 / 6,1 / 94 / 6 7,14 / 18 / 102 Cetoacidosis diabética 2. El paciente está acidémico o alcalémico? acidémico 3. El proceso primario es metabólico o respiratorio? ph pco 2 HCO 3- metabólico 4. Si es una acidosis metabólica, el anión gap es normal o está aumentado? AG= 130 (94 + 6)= La compensación es apropiada? pco 2 e= (1,5 x HCO 3- ) + 8 ± 2 = Hay más de un desorden presente? AG= 30 ( 20) HCO 3- = 6 ( 18) acidosis metabólica AG simple
67 PROBLEMA 2 Un hombre de 30 años de edad con diabetes mellitus se presenta con una semana de poliuria, polidipsia, fiebre y vómitos por 4 días. Datos de laboratorio: Sodio: 135 meq/l Potasio: 6,1 meq/l Cloruro: 89 meq/l Urea: 50 mg/dl Glucosa: 1181 mg/dl Creatinina: 2,3 mg/dl ph: 7,26 po 2 : 88 mm Hg pco 2 : 23 mm Hg Bicarbonato: 10 meq/l
68 1. Considerar la situación clínica 135 / 6,1 / 89 / 10 7,26 / 23 / 88 Cetoacidosis diabética y alcalosis metabólica por vómitos 2. El paciente está acidémico o alcalémico? acidémico 3. El proceso primario es metabólico o respiratorio? ph pco 2 HCO 3- metabólico 4. Si es una acidosis metabólica, el anión gap es normal o está aumentado? AG= 135 ( )= La compensación es apropiada? pco 2 e= (1,5 x HCO 3- ) + 8 ± 2 = Hay más de un desorden presente? AG= 36 ( 26) HCO 3- = 10 ( 14) acidosis metabólica AG + ALC MET
69 PROBLEMA 3 Un hombre de 30 años de edad con diabetes mellitus se presenta con una semana de poliuria, polidipsia, fiebre y diarrea. Datos de laboratorio: Sodio: 138 meq/l Potasio: 5,5 meq/l Cloruro: 111 meq/l Urea: 49 mg/dl Glucosa: 650 mg/dl Creatinina: 1,4 mg/dl ph: 7,26 po 2 : 88 mm Hg pco 2 : 23 mm Hg Bicarbonato: 8 meq/l 1- Considerar situación clínica Poliuria y polidipsia en paciente diabético: diuresis osmótica, pérdida de electrolitos y agua? Deshidratación: Cálculo del Na corregido por glucemia Na correg= (1,6 x 5,5) = 147 meq/l
70 1. Considerar la situación clínica 138 / 5,5 / 111 / 8 7,26 / 23 / 88 Cetoacidosis diabética (acidosis AG) y AC MET no AG por diarrea 2. El paciente está acidémico o alcalémico? acidémico 3. El proceso primario es metabólico o respiratorio? ph pco 2 HCO 3- metabólico 4. Si es una acidosis metabólica, el anión gap es normal o está aumentado? AG= 138 ( )= La compensación es apropiada? pco 2 e= (1,5 x HCO 3- ) + 8 ± 2 = Hay más de un desorden presente? AG= 19 ( 9) HCO 3- = 8 ( 16) acidosis metabólica AG + hiperclorémica
71 PROBLEMA 4 Un hombre de 30 años de edad con diabetes mellitus se presenta con una semana de poliuria, polidipsia, fiebre, tos y esputo purulento Datos de laboratorio: Sodio: 140 meq/l Potasio: 7 meq/l Cloruro: 104 meq/l Urea: 75 mg/dl Glucosa: 1008 mg/dl Creatinina: 2,6 mg/dl ph: 6,95 po 2 : 60 mm Hg pco 2 : 33 mm Hg Bicarbonato: 7 meq/l
72 1. Considerar la situación clínica 140 / 7 / 104 / 7 6,95 / 33 / 60 Cetoacidosis diabética ACID AG y ALC RESP por fiebre O AC RESP -neum 2. El paciente está acidémico o alcalémico? acidémico 3. El proceso primario es metabólico o respiratorio? ph pco 2 HCO 3- metabólico 4. Si es una acidosis metabólica, el anión gap es normal o está aumentado? AG= 140 ( )= La compensación es apropiada? pco 2 e= (1,5 x HCO 3- ) + 8 ± 2 = 18 ACID RESP 6. Hay más de un desorden presente? AG= 29 ( 17) HCO 3- = 7 ( 17) acidosis metabólica AG - ACID RESP
73 PROBLEMA 5 Una mujer de 31 años de edad que está embarazada de 33 semanas presenta Vómitos en los últimos 2 días. Datos de laboratorio: Sodio: 140 meq/l Potasio: 3 meq/l Cloruro: 104 meq/l Urea: 26 mg/dl Glucosa: 85 mg/dl Creatinina: 0,6 mg/dl ph: 7,64 po 2 : 93 mm Hg pco 2 : 25 mm Hg Bicarbonato: 26 meq/l
74 1. Considerar la situación clínica 140 / 3 / 104 / 26 7,64 / 25 / 93 Embarazo: alcalosis respiratoria; Vómitos: alcalosis metabólica 2. El paciente está acidémico o alcalémico? alcalémico 3. El proceso primario es metabólico o respiratorio? Si fuera respiratorio el bicarbonato tendría que ser <22; si fuera metabólico la pco2 debería ser >45; deben ser ambas 4. Si es una acidosis metabólica, el anión gap es normal o está aumentado? no corresponde 5. La compensación es apropiada? no 6. Hay más de un desorden presente? alcalosis respiratoria + alcalosis metabólica
75 PROBLEMA 6 Un hombre de 66 años de edad con enfermedad pulmonar obstructiva crónica (EPOC) de 70 kg con pco 2 basal de 52 mm Hg, hernia encarcelada de 3 días, Vómitos x 3 días, Volumen urinario reducido, pulso de 135, presión arterial 90/60, Frecuencia respiratoria de 30 y Sat O 2 : 88%. PREDICCIONES CLINICAS VOLEMIA: Na + : K + : Cl - : Acido-base: EPOC Vómitos Hipoxia aguda Hipovolemia Hiponatremia/normal bajo Hipokalemia Hipocloremia Acidosis respiratoria crónica Alcalosis metabólica Alcalosis respiratoria aguda
76 DATOS DE LABORATORIO Na K + 2,5 Cl - 62 HCO 3-45 BUN 45 Cr 1,5 EAB: ph 7,65 pco 2 48 ALCALEMIA METABOLICO ALCALOSIS METABOLICA pco 2 e= 52 ALCALOSIS RESPIRATORIA AGUDA SUPERPUESTA A ACIDOSIS RESPIRATORIA CRONICA AG: = 21 ACIDOSIS METABOLICA C/ AG AUMENTADO (acidosis láctica por hipoxemia)
77 BIBLIOGRAFIA - GUIA TP Campus: Bibliografía Ampliatoria (Alteraciones del EAB)
EDUCATIVO. Alteraciones del. - Departamento de Fisiopatología - Facultad de Medicina 2011MATERIAL. Dr MSc José Boggia
 - Departamento de Fisiopatología - Facultad de Medicina Alteraciones del equilibrio i ácido-base 2011 Dr MSc José Boggia PANORAMICA GLOBAL I. Recordatorio de la fisiología ácido-base II. Diagnóstico de
- Departamento de Fisiopatología - Facultad de Medicina Alteraciones del equilibrio i ácido-base 2011 Dr MSc José Boggia PANORAMICA GLOBAL I. Recordatorio de la fisiología ácido-base II. Diagnóstico de
Fisiopatología del Equilibrio Ácido-Base ACIDOSIS
 Fisiopatología del Equilibrio Ácido-Base ACIDOSIS Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile ALTERACIONES DEL EQUILIBRIO ACIDO BASE: I. ACIDOSIS:
Fisiopatología del Equilibrio Ácido-Base ACIDOSIS Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile ALTERACIONES DEL EQUILIBRIO ACIDO BASE: I. ACIDOSIS:
GASES ARTERIALES. Interpretación
 GASES ARTERIALES Interpretación GASES ARTERIALES Técnica básica para valoración del intercambio pulmonar de gases. Técnica de punción Punción de arteria radial no dominante. Utilizar anestesia local (opcional)
GASES ARTERIALES Interpretación GASES ARTERIALES Técnica básica para valoración del intercambio pulmonar de gases. Técnica de punción Punción de arteria radial no dominante. Utilizar anestesia local (opcional)
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA CICLO ACADÉMICO 2,009
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 Equilibrio AcidoAcido-Base Dr. Mynor A. Leiva Enríquez Las moléculas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 Equilibrio AcidoAcido-Base Dr. Mynor A. Leiva Enríquez Las moléculas
Equilibrio Acido-Base
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,008 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Las moléculas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,008 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Las moléculas
TRASTORNOS METABOLICOS DEL ESTADO ACIDO-BASE
 TRASTORNOS METABOLICOS DEL ESTADO ACIDO-BASE ALTERACIONES ACIDO-BASE Los ácidos son producidos en forma continua, durante el metabolismo normal La concentración de hidrógeno en el LEC se mantiene en un
TRASTORNOS METABOLICOS DEL ESTADO ACIDO-BASE ALTERACIONES ACIDO-BASE Los ácidos son producidos en forma continua, durante el metabolismo normal La concentración de hidrógeno en el LEC se mantiene en un
Equilibrio Acido-Base
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Conceptos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Conceptos
ALTERACIONES DEL EQUILIBRIO ÁCIDO BASE. Prof. Dra. Liliana G. Bianciotti
 ALTERACIONES DEL EQUILIBRIO ÁCIDO BASE Prof. Dra. Liliana G. Bianciotti lbianc@ffyb.uba.ar 2016 ALTERACIONES DEL EQUILIBIO ACIDO-BASE ph 7.35-7.45 Metabolismo de Ca 2+ y K + Solubilidad de sales óseas
ALTERACIONES DEL EQUILIBRIO ÁCIDO BASE Prof. Dra. Liliana G. Bianciotti lbianc@ffyb.uba.ar 2016 ALTERACIONES DEL EQUILIBIO ACIDO-BASE ph 7.35-7.45 Metabolismo de Ca 2+ y K + Solubilidad de sales óseas
lunes 27 de febrero de 12 Desequilibrio Acido-Base
 Desequilibrio Acido-Base Equilibrio Ácido-Base H + es un anión con muy baja concentración en el cuerpo humano. Na + 3.5 millones de veces mas que H + Escala de ph: mide el grado de acidez de una solución.
Desequilibrio Acido-Base Equilibrio Ácido-Base H + es un anión con muy baja concentración en el cuerpo humano. Na + 3.5 millones de veces mas que H + Escala de ph: mide el grado de acidez de una solución.
Equilibrio Ácido - Base
 Equilibrio Ácido - Base OBJETIVOS Comprender la importancia de mantener los valores de ph dentro del rango normal Analizar los diferentes mecanismos de regulación que permiten mantener el equilibrio ácido-base
Equilibrio Ácido - Base OBJETIVOS Comprender la importancia de mantener los valores de ph dentro del rango normal Analizar los diferentes mecanismos de regulación que permiten mantener el equilibrio ácido-base
ESTADO ACIDO-BASE CONCEPTOS TEORICO-PRACTICOS FUNDAMENTALES
 ESTADO ACIDOBASE CONCEPTOS TEORICOPRACTICOS FUNDAMENTALES Estado ácidobase: (EAB) Los trastornos del EAB se observan frecuentemente en la práctica diaria, sobre todo en pacientes agudos, algunos son simples
ESTADO ACIDOBASE CONCEPTOS TEORICOPRACTICOS FUNDAMENTALES Estado ácidobase: (EAB) Los trastornos del EAB se observan frecuentemente en la práctica diaria, sobre todo en pacientes agudos, algunos son simples
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO - BASE Carrera de Médicos Especialistas Universitarios en Medicina Crítica y Terapia Intensiva. Universidad de Buenos Aires CONCEPTOS GENERALES EQUILIBRIO ACIDO-BASE EN FORMA ESTEQUIOMÉTRICA
EQUILIBRIO ACIDO - BASE Carrera de Médicos Especialistas Universitarios en Medicina Crítica y Terapia Intensiva. Universidad de Buenos Aires CONCEPTOS GENERALES EQUILIBRIO ACIDO-BASE EN FORMA ESTEQUIOMÉTRICA
H + A - + Na + HCO3 - A - Na + + H2O + CO2 ( EXTRACELULAR ) H + A - + BUFFER - Na + A - Na + + BUFFERH ( INTRACELULAR )
 BIOQ. ALEXIS MURYAN H + A - + Na + HCO3 - A - Na + + H2O + CO2 ( EXTRACELULAR ) H + A - + BUFFER - Na + A - Na + + BUFFERH ( INTRACELULAR ) FASE DE GENERACION CAUSAS QUE LA ORIGINAN FASE DE MANTENIMIENTO
BIOQ. ALEXIS MURYAN H + A - + Na + HCO3 - A - Na + + H2O + CO2 ( EXTRACELULAR ) H + A - + BUFFER - Na + A - Na + + BUFFERH ( INTRACELULAR ) FASE DE GENERACION CAUSAS QUE LA ORIGINAN FASE DE MANTENIMIENTO
Fisiopatología Del Equilibrio Ácido-Base Alcalosis
 Fisiopatología Del Equilibrio Ácido-Base Alcalosis Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile ALTERACIONES DEL EQUILIBRIO ACIDO BASE: II. ALCALOSIS
Fisiopatología Del Equilibrio Ácido-Base Alcalosis Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile ALTERACIONES DEL EQUILIBRIO ACIDO BASE: II. ALCALOSIS
HOSPITAL NACIONAL PROF. A. POSADAS SERVICIO DE PEDIATRÍA
 HOSPITAL NACIONAL PROF. A. POSADAS SERVICIO DE PEDIATRÍA EQUILIBRIO ÁCIDO-BASE DESDE LA FISIOLOGÍA SERVICIO DE PEDIATRÍA HOSP. NAC. PROF. A. POSADAS Dept. Pediatría Fac. Medicina - UBA Horacio A. Repetto
HOSPITAL NACIONAL PROF. A. POSADAS SERVICIO DE PEDIATRÍA EQUILIBRIO ÁCIDO-BASE DESDE LA FISIOLOGÍA SERVICIO DE PEDIATRÍA HOSP. NAC. PROF. A. POSADAS Dept. Pediatría Fac. Medicina - UBA Horacio A. Repetto
GASES EN SANGRE. modifican el ph sanguineo.
 GASES EN SANGRE ESTADO ACIDO-BASE ESTADO DE OXIGENACION Detectar o confirmar alteraciones metabolicas y/o respiratorias que modifican el ph sanguineo. Determinar si la oxigenacion tisular es la adecuada.
GASES EN SANGRE ESTADO ACIDO-BASE ESTADO DE OXIGENACION Detectar o confirmar alteraciones metabolicas y/o respiratorias que modifican el ph sanguineo. Determinar si la oxigenacion tisular es la adecuada.
TALLER DE MEDIO INTERNO. Fernando Tortosa - Luis Aramayo
 TALLER DE MEDIO INTERNO Fernando Tortosa Luis Aramayo Interpretación del EAB La interpretación del EAB se inicia con el conocimiento de los antecedentes del paciente y su estado clínico actual Datos necesarios
TALLER DE MEDIO INTERNO Fernando Tortosa Luis Aramayo Interpretación del EAB La interpretación del EAB se inicia con el conocimiento de los antecedentes del paciente y su estado clínico actual Datos necesarios
ESTADO ACIDO BASE ACIDOSIS METABOLICA. ETIOLOGÍA DE LA ACIDOSIS METABÓLICA Inhabilidad Para Secretar La Carga Acida De La Dieta +
 ESTADO ACIDO BASE Los siguientes pasos son usados para evaluar los desordenes acidobase: 1.Determinar la anormalidad de base acidosis metabólica y/o alcalosis metabólica. 2.Determinar los factores contribuyentes
ESTADO ACIDO BASE Los siguientes pasos son usados para evaluar los desordenes acidobase: 1.Determinar la anormalidad de base acidosis metabólica y/o alcalosis metabólica. 2.Determinar los factores contribuyentes
Interpretación Rápida de los Gases Arteriales
 Artículo de Revisión Concisa Interpretación Rápida de los Gases Arteriales Dr. Juan Ignacio Padilla Cuadra (Decano, Facultad de Medicina, Universidad de Iberoamérica) Introducción: Los gases arteriales
Artículo de Revisión Concisa Interpretación Rápida de los Gases Arteriales Dr. Juan Ignacio Padilla Cuadra (Decano, Facultad de Medicina, Universidad de Iberoamérica) Introducción: Los gases arteriales
EQUILIBRIO ÁCIDO-BASE
 EQUILIBRIO ÁCIDO-BASE - Departamento de Fisiopatología - Facultad de Medicina Br. Inés Lujambio CONCEPTOS BÁSICOS. Ácido: toda sustancias capaz de ceder protones de hidrógeno (H + ). HCl H + + Cl - Base:
EQUILIBRIO ÁCIDO-BASE - Departamento de Fisiopatología - Facultad de Medicina Br. Inés Lujambio CONCEPTOS BÁSICOS. Ácido: toda sustancias capaz de ceder protones de hidrógeno (H + ). HCl H + + Cl - Base:
BALANCE ÁCIDO-BASE Y REGULACIÓN DEL ph
 BALANCE ÁCIDO-BASE Y REGULACIÓN DEL ph INTRODUCCION Importancia del mantenimiento del ph [H + ] afecta: Conformación de proteínas Reacciones donde el H + es producto o reactivo Liberación de O 2 de la
BALANCE ÁCIDO-BASE Y REGULACIÓN DEL ph INTRODUCCION Importancia del mantenimiento del ph [H + ] afecta: Conformación de proteínas Reacciones donde el H + es producto o reactivo Liberación de O 2 de la
Lic. Cintia Mendez Vedia Lic. en Nutrición Univesidad de Buenos Aires
 ÁCIDOS Y BASES Lic. Cintia Mendez Vedia Lic. en Nutrición Univesidad de Buenos Aires OBJETIVOS: - Reconocer ácidos, bases y sales, determinar sus disociaciones en agua, según sean electrolitos fuertes
ÁCIDOS Y BASES Lic. Cintia Mendez Vedia Lic. en Nutrición Univesidad de Buenos Aires OBJETIVOS: - Reconocer ácidos, bases y sales, determinar sus disociaciones en agua, según sean electrolitos fuertes
REGULACIÓN DEL EQUILIBRIO ÁCIDO-BASE. Bqca. Sofía Langton Fisiología Humana Junio 2014
 REGULACIÓN DEL EQUILIBRIO ÁCIDOBASE Bqca. Sofía Langton Fisiología Humana Junio 2014 Objetivos 1. Estudiar la importancia del balance ácidobase en el organismo. 2. Comprender los tres sistemas (amortiguadores,
REGULACIÓN DEL EQUILIBRIO ÁCIDOBASE Bqca. Sofía Langton Fisiología Humana Junio 2014 Objetivos 1. Estudiar la importancia del balance ácidobase en el organismo. 2. Comprender los tres sistemas (amortiguadores,
Amortiguadores o Buffer. SEMANA 13 Licda. Lilian Judith Guzman melgar
 Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
ENFERMERIA DE ALTO RIESGO HCO3 GASOMETRIA ARTERIAL. PaCO2. PaO2
 ENFERMERIA DE ALTO RIESGO HCO3 ph GASOMETRIA ARTERIAL PaO2 PaCO2 DEFINICION La gasometría arterial es una de las técnicas más frecuentes realizadas a pacientes en estado crítico. Para realizar una correcta
ENFERMERIA DE ALTO RIESGO HCO3 ph GASOMETRIA ARTERIAL PaO2 PaCO2 DEFINICION La gasometría arterial es una de las técnicas más frecuentes realizadas a pacientes en estado crítico. Para realizar una correcta
Alteraciones del Estado Acido-Base (traducido de Raoul Nelson) ASPECTOS GENERALES DE LAS ALTERACIONES ACIDO-BASE
 Alteraciones del Estado Acido-Base (traducido de Raoul Nelson) TERMINOLOGIA BASICA Acidemia: está presente cuando el ph en sangre es < 7,35. Alcalemia: está presente cuando el ph en sangre es > 7,45. Acidosis:
Alteraciones del Estado Acido-Base (traducido de Raoul Nelson) TERMINOLOGIA BASICA Acidemia: está presente cuando el ph en sangre es < 7,35. Alcalemia: está presente cuando el ph en sangre es > 7,45. Acidosis:
Actualización en Medio Interno Conceptos básicos
 Actualización en Medio Interno Conceptos básicos Bioquímica Lucrecia Drago Bioquímica M. Fernanda Pontoriero Ácidos Moléculas capaces de liberar H + HCl H + + Cl H 2 CO 3 H + + HCO 3 Bases Moléculas capaces
Actualización en Medio Interno Conceptos básicos Bioquímica Lucrecia Drago Bioquímica M. Fernanda Pontoriero Ácidos Moléculas capaces de liberar H + HCl H + + Cl H 2 CO 3 H + + HCO 3 Bases Moléculas capaces
ALTERACIONES DEL EQUILIBRIO ACIDOBÁSICO
 ALTERACIONES DEL EQUILIBRIO ACIDOBÁSICO RAQUEL YAGÜE ZAPICO R1 MEDICINA INTENSIVA Servicio de Medicina Interna 2012 GENERALIDADES DIARIAMENTE: -Hidrogeniones ( ácidos no volátiles): 70 a 100 mmol en dieta
ALTERACIONES DEL EQUILIBRIO ACIDOBÁSICO RAQUEL YAGÜE ZAPICO R1 MEDICINA INTENSIVA Servicio de Medicina Interna 2012 GENERALIDADES DIARIAMENTE: -Hidrogeniones ( ácidos no volátiles): 70 a 100 mmol en dieta
PROPÓSITO DE MEDIR LOS GASES ARTERIALES
 FISIOLOGÍA DE GASES ARTERIALES La primera parte de este módulo comprende elementos básicos sobre la fisiología de los gases arteriales. Este módulo ayudará a los profesionales de la enfermería y cardiorrespiratorios
FISIOLOGÍA DE GASES ARTERIALES La primera parte de este módulo comprende elementos básicos sobre la fisiología de los gases arteriales. Este módulo ayudará a los profesionales de la enfermería y cardiorrespiratorios
Control del Equilibrio ácido-base
 Control del Equilibrio ácido-base Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia
Control del Equilibrio ácido-base Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia
Programa 3º Curso. Curso (Prof. M García-Caballero)
 Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
Día 1 ANANMESIS Paciente masculino de 57 años llega a la guardia con fatiga y es internado para su evaluación.
 CASO CLINICO 8 Día 1 ANANMESIS Paciente masculino de 57 años llega a la guardia con fatiga y es internado para su evaluación. ANTECEDENTES Trabajador de la construcción, fumador desde su juventud. Refiere
CASO CLINICO 8 Día 1 ANANMESIS Paciente masculino de 57 años llega a la guardia con fatiga y es internado para su evaluación. ANTECEDENTES Trabajador de la construcción, fumador desde su juventud. Refiere
Escala de ph. Concentración de H + en Eq/L
 Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia capaz de aceptar un H + ÁCIDO: sustancia
Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia capaz de aceptar un H + ÁCIDO: sustancia
Fisiopatología Equilibrio Hidrosalino. Potasio
 Fisiopatología Equilibrio Hidrosalino Potasio Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile Valdivia- Chile FISIOPATOLOGIA DEL EQUILIBRIO DEL K+:
Fisiopatología Equilibrio Hidrosalino Potasio Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile Valdivia- Chile FISIOPATOLOGIA DEL EQUILIBRIO DEL K+:
Equilibrio Acido-Base. Dr Jorge Brenes Dittel. Nefrología.
 Equilibrio Acido-Base Dr Jorge Brenes Dittel. Nefrología. Equilibrio Acido-base. Fisiología ph es el logaritmo de la concentracíon del ión hidrogenion expresada en milimoles por litro. [H+] en sangre es
Equilibrio Acido-Base Dr Jorge Brenes Dittel. Nefrología. Equilibrio Acido-base. Fisiología ph es el logaritmo de la concentracíon del ión hidrogenion expresada en milimoles por litro. [H+] en sangre es
Tema 9: Interpretación de una gasometría
 Tema 9: Interpretación de una gasometría Concepto de gasometría Gasometría en muestras de sangre (arterial, capilar, venosa) Valores normales Hipoxemia Hipercapnia e hipocapnia Acidosis y alcalosis: Introducción
Tema 9: Interpretación de una gasometría Concepto de gasometría Gasometría en muestras de sangre (arterial, capilar, venosa) Valores normales Hipoxemia Hipercapnia e hipocapnia Acidosis y alcalosis: Introducción
MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ
 MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ 1-Historia clínica G D Varón de 1 año y 5 meses MOTIVO DE CONSULTA retraso del crecimiento ANTECEDENTES RNTPAEG
MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ 1-Historia clínica G D Varón de 1 año y 5 meses MOTIVO DE CONSULTA retraso del crecimiento ANTECEDENTES RNTPAEG
Conclusiones. Siempre antes del análisis, esta la Clínica o que espero yo en mi paciente
 Gases en Sepsis Conclusiones Siempre antes del análisis, esta la Clínica o que espero yo en mi paciente El análisis de los gases no debe retrasar tomar el Lactato e iniciar EGDT No tratamos solo números
Gases en Sepsis Conclusiones Siempre antes del análisis, esta la Clínica o que espero yo en mi paciente El análisis de los gases no debe retrasar tomar el Lactato e iniciar EGDT No tratamos solo números
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS
 EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
Índice. Sección I. 1. Química y amortiguamiento acidobásicos Homeostasis acidobásica intracelular... 35
 Índice Prefacio... V Prólogo... VII Indice... IX Colaboradores... XVII Sección I 1. Química y amortiguamiento acidobásicos... 21 - John H. Galla Introducción... 21 Amortiguamiento... 24 El papel de los
Índice Prefacio... V Prólogo... VII Indice... IX Colaboradores... XVII Sección I 1. Química y amortiguamiento acidobásicos... 21 - John H. Galla Introducción... 21 Amortiguamiento... 24 El papel de los
Revista de Actualización Clínica Volumen
 ACIDOSIS METABOLICA Vargas Flores Tatiana 1 Colaboración: Condori Canaza Claudia 2 RESUMEN El ph responsable del equilibrio ácidobase a nivel del líquido extracelular tiene un valor de 7,35 a 7,40; el
ACIDOSIS METABOLICA Vargas Flores Tatiana 1 Colaboración: Condori Canaza Claudia 2 RESUMEN El ph responsable del equilibrio ácidobase a nivel del líquido extracelular tiene un valor de 7,35 a 7,40; el
Trastornos Del Potasio. Hipopotasemia
 Trastornos Del Potasio Hipopotasemia Hipopotasemia Es uno de los trastornos hidroelectrolíticos más frecuentes en la UTI. Se considera hipopotasemia cuando la concentración plasmática de potasio cae por
Trastornos Del Potasio Hipopotasemia Hipopotasemia Es uno de los trastornos hidroelectrolíticos más frecuentes en la UTI. Se considera hipopotasemia cuando la concentración plasmática de potasio cae por
REGULACIÓN DEL BALANCE ÁCIDO-BÁSICO:
 REGULACIÓN DEL BALANCE ÁCIDO-BÁSICO: - FISIOLOGÍA DE ÁCIDOS Y BASES - EXCRECIÓN RENAL DE H + Miryam Romero R. MSc. PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas Universidad del Valle
REGULACIÓN DEL BALANCE ÁCIDO-BÁSICO: - FISIOLOGÍA DE ÁCIDOS Y BASES - EXCRECIÓN RENAL DE H + Miryam Romero R. MSc. PhD. Profesora de Fisiología Departamento de Ciencias Fisiológicas Universidad del Valle
Acidosis y Alcalosis Metabolica.
 Acidosis y Alcalosis Metabolica. Acidosis metabólica Se caracteriza por: ph arterial bajo (concentración alta de hidrogeniones) Reducción en la concentración plasmática de HCO3. Hiperventilación compensatoria.
Acidosis y Alcalosis Metabolica. Acidosis metabólica Se caracteriza por: ph arterial bajo (concentración alta de hidrogeniones) Reducción en la concentración plasmática de HCO3. Hiperventilación compensatoria.
FISIOPATOLOGIA. Concentración normal H+: 40 nmoles/l. -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3
 FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
Clase II Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile
 Fisiopatología Del Equilibrio Hidrosalino Clase II Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile BALANCE POSITIVO DE H2O y Na+: FISIOPATOLOGÍA DEL
Fisiopatología Del Equilibrio Hidrosalino Clase II Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiologia Universidad Austral de Chile BALANCE POSITIVO DE H2O y Na+: FISIOPATOLOGÍA DEL
Fisiología y Fisiopatología Del Equilibrio Hidrosalino
 Fisiología y Fisiopatología Del Equilibrio Hidrosalino Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile FISIOLOGÍA DEL EQUILIBRIO HIDROSALINO: 1. IMPORTANCIA
Fisiología y Fisiopatología Del Equilibrio Hidrosalino Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile FISIOLOGÍA DEL EQUILIBRIO HIDROSALINO: 1. IMPORTANCIA
K + Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia. (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium)
![K + Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia. (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium) K + Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia. (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium)](/thumbs/55/36263077.jpg) Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium) Generalidades Hiperpotasemia Manifestaciones clínicas Hipopotasemia Manifestaciones
Tema 29: Alteraciones del potasio: hiperpotasemia e hipopotasemia (sinónimos: hiper- e hipokalemia [o kaliemia]; Lat. kalium) Generalidades Hiperpotasemia Manifestaciones clínicas Hipopotasemia Manifestaciones
METABOLISMO ACIDO / BASE
 METABOLISMO ACIDO / BASE Dr Sergio Octavio GRANADOS TINAJERO Hospital Angeles de Villahermosa, Villahermosa, Tabasco, México. Course : 3 Year : 2003 Language : Spanish Country : Mexico City : Baja California
METABOLISMO ACIDO / BASE Dr Sergio Octavio GRANADOS TINAJERO Hospital Angeles de Villahermosa, Villahermosa, Tabasco, México. Course : 3 Year : 2003 Language : Spanish Country : Mexico City : Baja California
EQUILIBRIO ACIDO BASE
 EQUILIBRIO ACIDO BASE ASPECTO FISIOLÓGICO CONCENTRACIÒN NORMAL DE HIDROGENIONES 35 A 45 NM / L HAY MECANISMOS QUE ACTÚAN PERMANENTEMENTE PARA MANTENER ESTE RANGO FUERA DE ESTE HAY ALTERACIÓN DEL FUNCIONAMIENTO
EQUILIBRIO ACIDO BASE ASPECTO FISIOLÓGICO CONCENTRACIÒN NORMAL DE HIDROGENIONES 35 A 45 NM / L HAY MECANISMOS QUE ACTÚAN PERMANENTEMENTE PARA MANTENER ESTE RANGO FUERA DE ESTE HAY ALTERACIÓN DEL FUNCIONAMIENTO
Metabolismo de Na + y K + Dr. Gustavo Ramos Jiménez
 Metabolismo de Na + y K + Dr. Gustavo Ramos Jiménez Soluto : Solvente [NA] Tonicidad / Osmolalidad Hiponatremia Hipernatremia Causas de hiponatremia LEC contraído LEC aumentado LEC normal Causas de hiponatremia
Metabolismo de Na + y K + Dr. Gustavo Ramos Jiménez Soluto : Solvente [NA] Tonicidad / Osmolalidad Hiponatremia Hipernatremia Causas de hiponatremia LEC contraído LEC aumentado LEC normal Causas de hiponatremia
Agua, electrolitos, balance acido-base. Dra. Luz E. Cuevas-Molina NURS 1231
 Agua, electrolitos, balance acido-base Dra. Luz E. Cuevas-Molina NURS 1231 1 Introducción Para mantener la homoestasis debe haber un balance entre las cantidades de fluido y electrolitos Los electrolitos
Agua, electrolitos, balance acido-base Dra. Luz E. Cuevas-Molina NURS 1231 1 Introducción Para mantener la homoestasis debe haber un balance entre las cantidades de fluido y electrolitos Los electrolitos
1. Líquidos corporales. 2. Anatomía y función renal. 3. Hormonas ADH y aldosterona
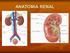 1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
Farmacoterapia en Descompensaciones agudas de Diabetes Mellitus
 Farmacoterapia en Descompensaciones agudas de Diabetes Mellitus Descompensaciones agudas Crisis hiperglicémicas Hipoglicemia Estado hiperosmolar no cetósico Cetoacidosis diabética Fisiopatología Cetoacidosis
Farmacoterapia en Descompensaciones agudas de Diabetes Mellitus Descompensaciones agudas Crisis hiperglicémicas Hipoglicemia Estado hiperosmolar no cetósico Cetoacidosis diabética Fisiopatología Cetoacidosis
e n o i l e b a d s l l
 e d s e n o i c a c i l p m s Co e t e b a i d la s u t i l l me t i p s Ho generalidades La cetoacidosis diabética y el estado hiperosmolar hiperglucémico son complicaciones agudas de la diabetes. Ambos
e d s e n o i c a c i l p m s Co e t e b a i d la s u t i l l me t i p s Ho generalidades La cetoacidosis diabética y el estado hiperosmolar hiperglucémico son complicaciones agudas de la diabetes. Ambos
8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
INTERPRETACION DE LOS GASES ARTERIALES
 INTERPRETACION DE LOS GASES ARTERIALES ph PaO2 PaCO2 HCO3 BE Hb SaO2 Bloque 6 Modulo 2 Dr Erick Valencia Anestesiologo Intensivista. Que son los Gases Arteriales? Una muestra de sangre anticoagulada que
INTERPRETACION DE LOS GASES ARTERIALES ph PaO2 PaCO2 HCO3 BE Hb SaO2 Bloque 6 Modulo 2 Dr Erick Valencia Anestesiologo Intensivista. Que son los Gases Arteriales? Una muestra de sangre anticoagulada que
TALLER ALTERACIONES DEL EQUILIBRIO ACIDO - BASE
 TALLER ALTERACIONES DEL EQUILIBRIO ACIDO - BASE 1. GENERALIDADES EQUILIBRIO ÁCIDO - BASE 1.1 Valor Normal Gasometría Arterial: PaCO 2 PaO 2 HCO - 3 Sat 35-45 mm Hg > 85 mm Hg 22-26 meq/lt > 95% 1.2 Mecanismos
TALLER ALTERACIONES DEL EQUILIBRIO ACIDO - BASE 1. GENERALIDADES EQUILIBRIO ÁCIDO - BASE 1.1 Valor Normal Gasometría Arterial: PaCO 2 PaO 2 HCO - 3 Sat 35-45 mm Hg > 85 mm Hg 22-26 meq/lt > 95% 1.2 Mecanismos
Trabajo Práctico N o 2 BUFFERS BIOLÓGICOS
 1 Trabajo Práctico N o 2 BUFFERS BIOLÓGICOS OBJETIVOS A partir de la ecuación de HendersonHasselbach calcular la concentración de (H + ),(Aceptor de H + ) o (Dador de H + ). Conocer cómo se mantiene el
1 Trabajo Práctico N o 2 BUFFERS BIOLÓGICOS OBJETIVOS A partir de la ecuación de HendersonHasselbach calcular la concentración de (H + ),(Aceptor de H + ) o (Dador de H + ). Conocer cómo se mantiene el
PAGINA FUNCION BASICA DEL RIÑON
 PAGINA 1 www.clases83.jimdo.com 096437814 FUNCION BASICA DEL RIÑON PAGINA 2 www.clases83.jimdo.com 096437814 PAGINA 3 www.clases83.jimdo.com 096437814 FILTRACION PAGINA 4 www.clases83.jimdo.com 096437814
PAGINA 1 www.clases83.jimdo.com 096437814 FUNCION BASICA DEL RIÑON PAGINA 2 www.clases83.jimdo.com 096437814 PAGINA 3 www.clases83.jimdo.com 096437814 FILTRACION PAGINA 4 www.clases83.jimdo.com 096437814
TRASTORNOS DEL MEDIO INTERNO: EQUILIBRIO ACIDO-BASE
 TRASTORNOS DEL MEDIO INTERNO: EQUILIBRIO ACIDO-BASE Fisiopatología: ACIDOSIS: trastorno del medio interno que tiende a disminuir el ph corporal (aumentando la concentración de H+) ALCALOSIS: trastorno
TRASTORNOS DEL MEDIO INTERNO: EQUILIBRIO ACIDO-BASE Fisiopatología: ACIDOSIS: trastorno del medio interno que tiende a disminuir el ph corporal (aumentando la concentración de H+) ALCALOSIS: trastorno
POLIURIA. La homeostasis del sodio es más compleja, su excreción está regulada por el riñón mediante mecanismos neuro-hormonales e intrarrenales.
 POLIURIA DEFINICION: Etimológicamente poliuria significa mucha diuresis. No hay un consenso sobre su definición, sin embargo, se tiende a definir como un volumen urinario inapropiadamente alto para el
POLIURIA DEFINICION: Etimológicamente poliuria significa mucha diuresis. No hay un consenso sobre su definición, sin embargo, se tiende a definir como un volumen urinario inapropiadamente alto para el
Diuréticos 19/11/2011. Mecanismos de acción, farmacocinética y reacciones adversas
 UNIVERSIDAD DE CHILE FACULTAD DE MEDICINA Diuréticos Mecanismos de acción, farmacocinética y reacciones adversas DIURÉTICOS Clasificación Diuréticos de Asa: Furosemida Tiazidas: Hidroclorotiazida Ahorradores
UNIVERSIDAD DE CHILE FACULTAD DE MEDICINA Diuréticos Mecanismos de acción, farmacocinética y reacciones adversas DIURÉTICOS Clasificación Diuréticos de Asa: Furosemida Tiazidas: Hidroclorotiazida Ahorradores
Líquidos y Electrolitos en Cirugía. R o d o l f o A. C a b r a l e s MD D o c e n t e A r e a d e C i r u g í a
 Líquidos y Electrolitos en Cirugía R o d o l f o A. C a b r a l e s MD D o c e n t e A r e a d e C i r u g í a OBJETIVOS Reconocer las bases teóricas de la homeostasis de líquidos y electrolitos en condiciones
Líquidos y Electrolitos en Cirugía R o d o l f o A. C a b r a l e s MD D o c e n t e A r e a d e C i r u g í a OBJETIVOS Reconocer las bases teóricas de la homeostasis de líquidos y electrolitos en condiciones
Regulación de (H+) Equilibrio ácido-básico
 Regulación de (H+) Equilibrio ácido-básico Introducción v CO2 es generado dentro de las células à Forma H2CO3 (ácido carbónico) al disolverse en agua Introducción ácidos no volátiles v Ácidos no volátiles:
Regulación de (H+) Equilibrio ácido-básico Introducción v CO2 es generado dentro de las células à Forma H2CO3 (ácido carbónico) al disolverse en agua Introducción ácidos no volátiles v Ácidos no volátiles:
TALLER DE GASES ARTERIALES
 TALLER DE GASES ARTERIALES MOP 24 de Agosto 2010 Objetivos Aprender a reconocer los trastornos del equilibrio ácido-base: Acidosis metabólica y respiratoria, alcalosis metabólica y respiratoria. Familiarizarse
TALLER DE GASES ARTERIALES MOP 24 de Agosto 2010 Objetivos Aprender a reconocer los trastornos del equilibrio ácido-base: Acidosis metabólica y respiratoria, alcalosis metabólica y respiratoria. Familiarizarse
FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL CRÓNICA
 UNIVERSIDAD DE CHILE Facultad de Medicina Escuela de Tecnología Médica FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL CRÓNICA Dr. Ramón Rodrigo 2007 Insuficiencia renal crónica Trastorno que involucra un deterioro
UNIVERSIDAD DE CHILE Facultad de Medicina Escuela de Tecnología Médica FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL CRÓNICA Dr. Ramón Rodrigo 2007 Insuficiencia renal crónica Trastorno que involucra un deterioro
En general es un parámetro que indica la función renal, aunque puede estar alterado en otras enfermedades o en casos de deshidratación.
 UREA La urea es el resultado final del metabolismo de las proteínas y se elimina por la orina. Si el riñón no funciona bien la urea se acumula en la sangre y se eleva su concentración. En general es un
UREA La urea es el resultado final del metabolismo de las proteínas y se elimina por la orina. Si el riñón no funciona bien la urea se acumula en la sangre y se eleva su concentración. En general es un
[A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x
![[A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x [A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x](/thumbs/55/35730009.jpg) Una reacción enzimática transcurre en 10 ml de una disolución cuya concentración total de citrato es 120 mm y su ph inicial es de 7. Durante la reacción se producen 0.2 miliequivalentes de un ácido. Calcular
Una reacción enzimática transcurre en 10 ml de una disolución cuya concentración total de citrato es 120 mm y su ph inicial es de 7. Durante la reacción se producen 0.2 miliequivalentes de un ácido. Calcular
Alteraciones de los Fluidos Corporales, Electrolitos
 Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
DESORDEN ACIDO BASICO
 DESORDEN ACIDO BASICO Cuando se habla de regulacion del equilibrio acido base, se habla en realidad de la Regulacion de la concentracion de iones hidrogenos en los liquidos corporales 1 Como la concentracion
DESORDEN ACIDO BASICO Cuando se habla de regulacion del equilibrio acido base, se habla en realidad de la Regulacion de la concentracion de iones hidrogenos en los liquidos corporales 1 Como la concentracion
b. Base es la sustancia que en disolución acuosa se disocia, liberando aniones de hidroxilo (OH ) según la ecuación general:
 ACIDOS y BASES Teorías ácido - base Los ácidos y las bases fueron definidos por primera vez por el científico sueco Svante Arrhenius en 1887 en su teoría disociación iónica, en la que establecía que hay
ACIDOS y BASES Teorías ácido - base Los ácidos y las bases fueron definidos por primera vez por el científico sueco Svante Arrhenius en 1887 en su teoría disociación iónica, en la que establecía que hay
JORNADA CIENTÍFICA COMENTARIOS INTERPRETATIVOS EN EL INFORME ANALÍTICO Y SEGURIDAD DEL PACIENTE
 JORNADA CIENTÍFICA COMENTARIOS INTERPRETATIVOS EN EL INFORME ANALÍTICO Y SEGURIDAD DEL PACIENTE SOCIEDAD ANDALUZA DE ANÁLISIS CLÍNICOS (SANAC) Antequera, 27 de Enero de 2011 COMENTARIOS INTERPRETATIVOS
JORNADA CIENTÍFICA COMENTARIOS INTERPRETATIVOS EN EL INFORME ANALÍTICO Y SEGURIDAD DEL PACIENTE SOCIEDAD ANDALUZA DE ANÁLISIS CLÍNICOS (SANAC) Antequera, 27 de Enero de 2011 COMENTARIOS INTERPRETATIVOS
2.- Sistema renal: Instauración tardía (24-48 horas) y de acción más duradera. Los riñones regulan el bicarbonato plasmático mediante tres procesos:
 Santos Nores, Juan*; Borrajo Prol, María Paz*; Camba Caride, María Jesús* *Servicio de Nefrología INTRODUCCIÓN Y CONCEPTOS: El metabolismo normal produce constantemente radicales ácidos. Sin embargo, el
Santos Nores, Juan*; Borrajo Prol, María Paz*; Camba Caride, María Jesús* *Servicio de Nefrología INTRODUCCIÓN Y CONCEPTOS: El metabolismo normal produce constantemente radicales ácidos. Sin embargo, el
EMERGENCIA HIPERGLUCEMICA
 EMERGENCIA HIPERGLUCEMICA Emergencias hiperglicémicas en diabéticos Cetoacidosis diabética. Coma hiperosmolar. Hiperglicemia de stress. Clínica de Cetoacidosis Sintonas Signos Laboratorio Poli-oliguria
EMERGENCIA HIPERGLUCEMICA Emergencias hiperglicémicas en diabéticos Cetoacidosis diabética. Coma hiperosmolar. Hiperglicemia de stress. Clínica de Cetoacidosis Sintonas Signos Laboratorio Poli-oliguria
La acidosis metabólica es un trastorno ácido-base que tiende a producir acidemia (descenso en el ph) por cambios primarios en la
 Fecha actualización: 27/09/16 Algoritmos diagnósticos: Equilibrio ácido base Use CTRL+F para buscar en este artículo Roberto Alcazar Arroyo Elena Corchete Prats Servicio de Nefrología Hospital Infanta
Fecha actualización: 27/09/16 Algoritmos diagnósticos: Equilibrio ácido base Use CTRL+F para buscar en este artículo Roberto Alcazar Arroyo Elena Corchete Prats Servicio de Nefrología Hospital Infanta
CETOACIDOSIS DIABÉTICA Y SÍNDROME HIPERGLICÉMICO HIPEROSMOLAR DRA. M. ISABEL GONZÁLEZ G.
 CETOACIDOSIS DIABÉTICA Y SÍNDROME HIPERGLICÉMICO HIPEROSMOLAR DRA. M. ISABEL GONZÁLEZ G. CURSO URGENCIAS MEDICAS FACULTAD DE MEDICINA UNIVERSIDAD DE CONCEPCION Junio 2008 CETOACIDOSIS DIABETICA Complicacion
CETOACIDOSIS DIABÉTICA Y SÍNDROME HIPERGLICÉMICO HIPEROSMOLAR DRA. M. ISABEL GONZÁLEZ G. CURSO URGENCIAS MEDICAS FACULTAD DE MEDICINA UNIVERSIDAD DE CONCEPCION Junio 2008 CETOACIDOSIS DIABETICA Complicacion
Líquidos corporales Compartimiento Equilibrio de líquidos. Q.F. Adriana Cordero
 Líquidos corporales Compartimiento Equilibrio de líquidos Q.F. Adriana Cordero INTRODUCCIÒN El agua y los solutos disueltos en cada uno de los compartimentos corporales de fluidos constituyen los líquidos
Líquidos corporales Compartimiento Equilibrio de líquidos Q.F. Adriana Cordero INTRODUCCIÒN El agua y los solutos disueltos en cada uno de los compartimentos corporales de fluidos constituyen los líquidos
Síndrome de Insuficiencia Respiratoria Aguda. Autora: MsC. Dra. María del Carmen Pino González
 Síndrome de Insuficiencia Respiratoria Aguda Autora: MsC. Dra. María del Carmen Pino González INSUFICIENCIA RESPIRATORIA AGUDA Se conoce como síndrome de insuficiencia respiratoria (SIR) al conjunto de
Síndrome de Insuficiencia Respiratoria Aguda Autora: MsC. Dra. María del Carmen Pino González INSUFICIENCIA RESPIRATORIA AGUDA Se conoce como síndrome de insuficiencia respiratoria (SIR) al conjunto de
VARIACIONES SANGUÍNEAS: - pco2 - EL ph ESTIMULO C.R.B., NO COMPENSA DISNEA - po2 - NaHCO3 5 mmol/l
 Fisiopatología Del Equilibrio Ácido-Base: Acidosis PH debe ser menor a 7.35. a) Acidosis Respiratorias b) Acidosis Metabólicas También se habla de acidosis compensadas y no compensadas. Una acidosis puede
Fisiopatología Del Equilibrio Ácido-Base: Acidosis PH debe ser menor a 7.35. a) Acidosis Respiratorias b) Acidosis Metabólicas También se habla de acidosis compensadas y no compensadas. Una acidosis puede
Sangre: Composición celular y plasmática Principales electrolitos Macro y microelementos. Proteínas, glúcidos, lípidos y lipoproteínas.
 Sangre: Composición celular y plasmática Principales electrolitos Macro y microelementos. Proteínas, glúcidos, lípidos y lipoproteínas. Nitrógeno no proteico, cetonas, enzimas plasmáticas. Respuestas fisiológicas
Sangre: Composición celular y plasmática Principales electrolitos Macro y microelementos. Proteínas, glúcidos, lípidos y lipoproteínas. Nitrógeno no proteico, cetonas, enzimas plasmáticas. Respuestas fisiológicas
Sistema renal. Odontología 2008
 Sistema renal Odontología 2008 Sistema renal Los riñones Si están bien perfundidos Mediante los mecanismos básicos: Filtración Reabsorción Secreción Regulan el medio interno Eliminan sustancias de deshecho
Sistema renal Odontología 2008 Sistema renal Los riñones Si están bien perfundidos Mediante los mecanismos básicos: Filtración Reabsorción Secreción Regulan el medio interno Eliminan sustancias de deshecho
Fundación H.A. Barceló Facultad de Medicina
 Fundación H.A. Barceló Facultad de Medicina LICENCIATURA EN NUTRICION PRIMER AÑO FISIOLOGIA MODULO 16 LECCIONES 1 Y 2 1 MODULO 16: Equilibrio Electrolítico y Control de ph OBJETIVOS - Conocer las vías
Fundación H.A. Barceló Facultad de Medicina LICENCIATURA EN NUTRICION PRIMER AÑO FISIOLOGIA MODULO 16 LECCIONES 1 Y 2 1 MODULO 16: Equilibrio Electrolítico y Control de ph OBJETIVOS - Conocer las vías
SOLUCIONES BUFFERS. pk = valor de ph en el cual las concentraciones del ácido y la sal son iguales
 SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
Trascripción clase de acidosis
 Trascripción clase de acidosis En las clases hemos visto como se produce el equilibrio ácido base y como el organismo trata de mantener el equilibrio ácido base. Al salirse del equilibrio acido_base se
Trascripción clase de acidosis En las clases hemos visto como se produce el equilibrio ácido base y como el organismo trata de mantener el equilibrio ácido base. Al salirse del equilibrio acido_base se
Actualización en diabetes: control de la glucosa y prevención de la cetoacidosis diabética
 Actualización en diabetes: control de la glucosa y prevención de la cetoacidosis diabética RAQUEL GARCÍA MARTÍNEZ ENFERMERA EDUCADORA EN DIABETES H.U. VIRGEN DEL ROCIO Índice Qué es la diabetes? Tipos
Actualización en diabetes: control de la glucosa y prevención de la cetoacidosis diabética RAQUEL GARCÍA MARTÍNEZ ENFERMERA EDUCADORA EN DIABETES H.U. VIRGEN DEL ROCIO Índice Qué es la diabetes? Tipos
ALTERACIONES DEL EQUILIBRIO ACIDO-BASE
 ALTERACIONES DEL EQUILIBRIO ACIDO-BASE El equilibrio ácido-base puede alterarse por dos tipos de mecanismos fundamentales. a) Cambios en la función respiratoria, con aumento o disminución de la P a CO
ALTERACIONES DEL EQUILIBRIO ACIDO-BASE El equilibrio ácido-base puede alterarse por dos tipos de mecanismos fundamentales. a) Cambios en la función respiratoria, con aumento o disminución de la P a CO
 Minino de Cheshire, podrías decirme, por favor, qué camino debo seguir para salir de aquí? Esto depende en gran parte del si>o al que quieras llegar - dijo el Gato. - - No me importa mucho el si>o... -
Minino de Cheshire, podrías decirme, por favor, qué camino debo seguir para salir de aquí? Esto depende en gran parte del si>o al que quieras llegar - dijo el Gato. - - No me importa mucho el si>o... -
MATERIA DE HEMATOLOGIA UNIDAD 3: VOLUMEN DE LA SANGRE
 MATERIA DE HEMATOLOGIA UNIDAD 3: VOLUMEN DE LA SANGRE TITULAR DE LA MATERIA: DRA EN C. CONSUELO CHANG RUEDA CICLO: ENERO - DICIEMBRE 2015 DRA EN C. CONSUELO CHANG RUEDA 8 UNIDAD III.- VOLUMEN SANGUÍNEO
MATERIA DE HEMATOLOGIA UNIDAD 3: VOLUMEN DE LA SANGRE TITULAR DE LA MATERIA: DRA EN C. CONSUELO CHANG RUEDA CICLO: ENERO - DICIEMBRE 2015 DRA EN C. CONSUELO CHANG RUEDA 8 UNIDAD III.- VOLUMEN SANGUÍNEO
Trastornos del equilibrio ácido-base
 NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
BIOQUIMICA CLINICA II
 Universidad Autónoma de Chiapas Facultad de Ciencias Químicas Campus IV BIOQUIMICA CLINICA II UNIDAD 5 EQUILIBRIO ACIDO-BASE TITULAR DEL CURSO : M.C. CONSUELO CHANG RUEDA CICLO ENERO - DICIEMBRE - 2015
Universidad Autónoma de Chiapas Facultad de Ciencias Químicas Campus IV BIOQUIMICA CLINICA II UNIDAD 5 EQUILIBRIO ACIDO-BASE TITULAR DEL CURSO : M.C. CONSUELO CHANG RUEDA CICLO ENERO - DICIEMBRE - 2015
Objetivos
 CONTENIDO CAPITULO I Transporte a travbs de membranas y epitelios... 1-1 Objetivos... 1-1.. Introduccion... 1-3 Movimientos de solutos... 1-4 Flujo de disolvente... 1-7 Intercambio ionicos a través de
CONTENIDO CAPITULO I Transporte a travbs de membranas y epitelios... 1-1 Objetivos... 1-1.. Introduccion... 1-3 Movimientos de solutos... 1-4 Flujo de disolvente... 1-7 Intercambio ionicos a través de
Fisiología. Principal catión extrecelular. Impermeable para membrana plasmática. Concentración plasmática regulada por ingesta y excreción de AGUA!
 Sodio?? Fisiología Principal catión extrecelular. Impermeable para membrana plasmática. Concentración plasmática regulada por ingesta y excreción de AGUA! Fisiología Hiponatremia: Dificultad para excretar
Sodio?? Fisiología Principal catión extrecelular. Impermeable para membrana plasmática. Concentración plasmática regulada por ingesta y excreción de AGUA! Fisiología Hiponatremia: Dificultad para excretar
FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL AGUDA
 UNIVERSIDAD DE CHILE Facultad de Medicina Escuela de Tecnología Médica FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL AGUDA Dr. Ramón Rodrigo 2008 ESTUDIO DE LAS ENFERMEDADES RENALES 1. Antecedentes de la historia
UNIVERSIDAD DE CHILE Facultad de Medicina Escuela de Tecnología Médica FISIOPATOLOGÍA DE LA INSUFICIENCIA RENAL AGUDA Dr. Ramón Rodrigo 2008 ESTUDIO DE LAS ENFERMEDADES RENALES 1. Antecedentes de la historia
Hipernatremias Natremia > 145 meq/l OSMOLARIDAD EFECTIVA = 2 Na+(mmol/L) + glicemia(mg/dl) 18 Estado de hiperosmolaridad efectiva o hipertonicidad
 Hipernatremia Hipernatremias Natremia > 145 meq/l OSMOLARIDAD EFECTIVA = 2 Na + (mmol/l) + glicemia(mg/dl) 18 Estado de hiperosmolaridad efectiva o hipertonicidad Hipernatremia Población hospitalaria general
Hipernatremia Hipernatremias Natremia > 145 meq/l OSMOLARIDAD EFECTIVA = 2 Na + (mmol/l) + glicemia(mg/dl) 18 Estado de hiperosmolaridad efectiva o hipertonicidad Hipernatremia Población hospitalaria general
Cátedra de Fisiología Humana CAPÍTULO I CAPITULO III. Equilibrio Acido Base PH. Carrera de Enfermería. Universidad Nacional del Nordeste
 CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
CETOACIDOSIS DIABÉTICA: CONTROVERSIAS EN EL MANEJO INICIAL COMPLICACIONES EN EMERGENCIAS Y CUIDADOS CRÍTICOS
 8 CONGRESO ARGENTINO de Emergencias y Cuidados Críticos en Pediatría. 26 al 28 de Abril de 2017. Ciudad Autónoma de Buenos Aires. CETOACIDOSIS DIABÉTICA: CONTROVERSIAS EN EL MANEJO INICIAL COMPLICACIONES
8 CONGRESO ARGENTINO de Emergencias y Cuidados Críticos en Pediatría. 26 al 28 de Abril de 2017. Ciudad Autónoma de Buenos Aires. CETOACIDOSIS DIABÉTICA: CONTROVERSIAS EN EL MANEJO INICIAL COMPLICACIONES
