Nota mensual. Medicamentos. Mayo. sobre. de Uso Humano y Productos Sanitarios. Medicamentos
|
|
|
- Manuel Olivares Escobar
- hace 5 años
- Vistas:
Transcripción
1 Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal.
2 Medicamentos Nuevos medicamentos aprobados En esta sección se reseñan aquellos que la Agencia considera que pueden ser de mayor interés para el profesional sanitario. La lista exhaustiva de los medicamentos que se autorizan mensualmente se encuentra en: Tras la autorización de los medicamentos por la Agencia, es necesario que la Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad y Consumo establezca las condiciones de financiación y, en caso de financiarse por el Sistema Nacional de Salud, su precio, antes de su comercialización. Nuevos principios activos con dictamen positivo para su autorización Principio activo: sugammadex Medicamento: Bridion Indicación: reversión del bloqueo neuromuscular inducido por rocuronio o vecuronio. El principio activo, sugammadex, es una gamma ciclodextrina modificada que forma un complejo con los agentes bloqueantes neuromusculares rocuronium o vecuronium en el plasma, y por lo tanto reduce la cantidad de agente bloqueante disponible para unirse a los receptores nicotínicos en la unión neuromuscular. La reacción adversa más común identificada durante el desarrollo clínico del medicamento fue disgeusia (sabor metálico o amargo). Principio activo: monohidrato de doripenem Medicamento: Doribax Indicación: tratamiento de la neumonía nocosomial en adultos, infecciones complicadas intraabdominales e infecciones complicadas del tracto urinario. El principio activo, monohidrato de doripenem, es un agente antibacteriano β-lactámico de amplio espectro, sintético, estéril e inyectable. Doribax ejerce su actividad bactericida inhibiendo la biosíntesis de la pared celular bacteriana. Doribax inactiva múltiples proteínas de unión a penicilinas, dando lugar a la inhibición de la síntesis de la pared celular con la subsiguiente muerte celular. El dictamen positivo para su autorización se ha basado en los resultados de estudios de no inferioridad en las poblaciones estudiadas, los cuales han comparado con levofloxacino en infecciones complicadas del tracto urinario, con meropenem en infecciones intra-abdominales complicadas y con penicilina/tazobactam e imipenem en neumonía nosocomial. Las reacciones adversas más comunes identificadas a lo largo del desarrollo clínico fueron cefalea, diarrea y náuseas. 1
3 Cambios de especial interés sanitario en medicamentos ya autorizados Nuevas indicaciones de medicamentos ya autorizados con dictamen positivo para su autorización El texto oficial y completo de las indicaciones terapéuticas ya autorizadas, puede consultarse en las fichas técnicas, disponibles en (búsqueda de medicamentos autorizados). Principio activo: cetuximab Medicamento: Erbitux Nueva indicación: se amplía la indicación para el tratamiento de pacientes con cáncer colorrectal metastásico tipo salvaje KRAS, que expresen el receptor del factor de crecimiento epidérmico (EGFR), en combinación con quimioterapia y también se añade la indicación para el uso como agente único en pacientes con cáncer colorrectal metastásico tipo salvaje KRAS que no hayan respondido a la terapia combinada con oxaliplatino e irinotecán o aquellos que son intolerantes a irinotecán. Indicación ya autorizada: en combinación con irinotecán para el tratamiento de pacientes con cáncer colorrectal metastásico que exprese el receptor del factor de crecimiento epidérmico (EGFR) después del fracaso de un tratamiento citotóxico que haya incluido irinotecán. Erbitux en combinación con radioterapia está indicado para el tratamiento de pacientes con cáncer de células escamosas de cabeza y cuello localmente avanzado. Principio activo: Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] Medicamento: Gardasil/Silgard Nueva Indicación: Se incluye la prevención de lesiones displásicas vaginales de alto grado Indicación ya autorizada: Prevención de la displasia cervical de alto grado (CIN 2/3), carcinoma cervical, lesiones displásicas vulvares de alto grado (VIN 2/3) y verrugas genitales externas (condiloma acuminata) relacionadas causalmente con los tipos 6, 11, 16 y 18 del Virus del Papiloma Humano (VPH). La indicación está basada en la demostración de la eficacia en mujeres adultas de 16 a 26 años de edad y en la demostración de inmunogenicidad en niños y adolescentes de 9 a 15 años de edad. La eficacia protectora no ha sido evaluada en hombres. Ambos medicamentos deben usarse de acuerdo con las recomendaciones oficiales. Cambio en las condiciones de conservación Medicamento: Neupro Principio activo: rotigotina Con el fin de evitar la cristalización del principio activo detectada en los parches de algunos lotes de este medicamento, a partir de ahora es necesaria su conservación entre los 2ºC y los 8ºC. En este sentido, deberá advertirse a los pacientes que conserven el medicamento en el frigorífico, ya que los nuevos lotes con la advertencia de conservación en frío en el envase no estarán disponibles en el mercado hasta finales de junio. Más información en 2
4 Otra información de interés Actualización de la información sobre presencia de contaminante en heparinas La Agencia ha emitido una nota actualizando la información sobre la presencia del contaminante condroitin sulfato hipersulfatado en heparinas. En ella se indica que no se han identificado nuevos lotes de heparina contaminada ni se han recibido en el Sistema Español de Farmacovigilancia nuevas notificaciones de reacciones alérgicas en pacientes tratados con heparinas. Hasta la fecha, no existen problemas de suministro de lotes libres de contaminante. Más información en: Solicitudes de ensayos clínicos electrónicas a la Agencia Ya es posible presentar cualquier solicitud de ensayo clínico a la Agencia de forma electrónica. Para ello, se han estandarizado todos los tipos de solicitudes de EC en 22 tipos, clasificados en solicitud inicial de un EC, solicitudes referentes a un ensayo clínico en trámite y solicitudes referentes a un EC autorizado (ver apartado 8 del documento Aclaraciones ) Existen dos formas de envío de una solicitud electrónica de EC a la AEMPS: 1. A través del portal de EC con medicamentos que permite a los promotores o solicitantes enviar solicitudes del tipo Inicial o En trámite: 2. Como alternativa a la solicitud a través del portal de ensayos clínicos con medicamentos es posible presentar la solicitud en soporte digital (CD/DVD con una estructura estándar de carpetas disponible en Las instrucciones para el envío de una solicitud pueden consultarse en: En caso de dificultades o para cualquier sugerencia referente a solicitudes electrónicas pueden contactar con la Agencia en el correo incidensayos@agemed.es o en el teléfono Nuevo servicio de suscripción a las listas de distribución de la Agencia La Agencia Española de Medicamentos y Productos Sanitarios ha incorporado a su Servicio de Suscripción de Contenidos 6 nuevas listas de distribución, segmentadas por áreas, de interés para informar sobre la aparición de nuevos contenidos relacionados con estas áreas en su Web. Las notificaciones enviadas a través de estas listas pueden recibirse por correo electrónico y/o por mensaje sms a la dirección de correo o número de teléfono móvil facilitados al realizar la suscripción. El siguiente cuadro muestra las nuevas listas que se suman a la lista Nota Informativa Mensual disponible actualmente. 3
5 Nombre de la lista Medicamentos de Uso Humano MUH: Alertas farmacéuticas de calidad y medicamentos ilegales MUH: Alertas y comunicaciones de seguridad de medicamentos Descripción Lista principal, si se suscribe a esta lista, recibirá toda la información distribuida a través en los tres apartados siguientes Alertas de Calidad y medicamentos ilegales Alertas y Notas de Seguridad MUH: Nota Informativa Mensual Nota Informativa Mensual de la AEMPS (Resumen mensual de novedades: Nuevos medicamentos, cambios relevantes en las condiciones de autorización ) Medicamentos de Uso Veterinario Información de Interés sobre Medicamentos de Uso Veterinario Productos Sanitarios Cosméticos y Productos de Higiene Personal Legislación y normativa Información de interés relativa a Productos Sanitarios Información de interés relativa a Cosméticos y Productos de Higiene Personal Legislación y normativa (nueva legislación, circulares y notas de interés sobre aplicación de la normativa) SI DESEA RECIBIR ESTA NOTA EN SU BUZÓN ELECTRÓNICO, PUEDE SUSCRIBIRSE EN: 4
Nota mensual. Medicamentos. Productos Sanitarios. Diciembre. sobre. de Uso Humano y. Medicamentos
 Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Nota mensual. Medicamentos. Marzo. sobre. de Uso Humano y Productos Sanitarios. Medicamentos
 Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
DIRECCIÓN DE ACCESO Y USO DE MEDICAMENTOS EQUIPO DE USO RACIONAL DE MEDICAMENTOS
 DIRECCIÓN DE ACCESO Y USO DE MEDICAMENTOS EQUIPO DE USO RACIONAL DE MEDICAMENTOS I. DATOS DE LA SOLICITUD Medicamento Solicitado Meropenem 1g inyectable Institución: Hospital María Auxiliadora Condición(es)
DIRECCIÓN DE ACCESO Y USO DE MEDICAMENTOS EQUIPO DE USO RACIONAL DE MEDICAMENTOS I. DATOS DE LA SOLICITUD Medicamento Solicitado Meropenem 1g inyectable Institución: Hospital María Auxiliadora Condición(es)
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Medicamentos Nuevos medicamentos aprobados Febrero En esta sección se reseñan aquellos que la Agencia considera que pueden ser de mayor interés para e
 Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
CONVOCATORIA 2008 DE AYUDAS PARA PROYECTOS DE INVESTIGACIÓN CLÍNICA DE CARÁCTER NO COMERCIAL CON MEDICAMENTOS
 CONVOCATORIA 2008 DE AYUDAS PARA PROYECTOS DE INVESTIGACIÓN CLÍNICA DE CARÁCTER NO COMERCIAL CON MEDICAMENTOS Aclaraciones sobre los trámites necesarios para su autorización por la Agencia Española de
CONVOCATORIA 2008 DE AYUDAS PARA PROYECTOS DE INVESTIGACIÓN CLÍNICA DE CARÁCTER NO COMERCIAL CON MEDICAMENTOS Aclaraciones sobre los trámites necesarios para su autorización por la Agencia Española de
sobre Alertas de productos sanitarios, cosméticos y productos de higiene personal. Información dirigida a profesionales sanitarios
 Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Información dirigida a profesionales sanitarios
Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Información dirigida a profesionales sanitarios
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Productos Sanitarios AEMPS LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS PRESENTA SU MEMORIA ANUAL DE ACTIVIDADES DEL AÑO 2010 Fecha de publicación: 25 de abril de 2011 Categoría:
Nota informativa Productos Sanitarios AEMPS LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS PRESENTA SU MEMORIA ANUAL DE ACTIVIDADES DEL AÑO 2010 Fecha de publicación: 25 de abril de 2011 Categoría:
Datos del solicitante
 Instructivo para el correcto llenado del Formato de solicitud de reunión con el SEPB 1 Datos del solicitante Razón social R.F.C. Representante Legal Domicilio Contactos Calle, número exterior y número
Instructivo para el correcto llenado del Formato de solicitud de reunión con el SEPB 1 Datos del solicitante Razón social R.F.C. Representante Legal Domicilio Contactos Calle, número exterior y número
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Productos Sanitarios AEMPS ESPAÑA ALCANZA EL QUINTO LUGAR EN LA RED DE AGENCIAS EUROPEAS DE MEDICAMENTOS POR VOLUMEN DE ACTIVIDAD Fecha de publicación: 26 de junio de 2013 Categoría: La
Nota informativa Productos Sanitarios AEMPS ESPAÑA ALCANZA EL QUINTO LUGAR EN LA RED DE AGENCIAS EUROPEAS DE MEDICAMENTOS POR VOLUMEN DE ACTIVIDAD Fecha de publicación: 26 de junio de 2013 Categoría: La
Informe mensual. Medicamentos. Diciembre. sobre. de Uso Humano y Productos Sanitarios. Medicamentos. Información dirigida a profesionales sanitarios
 Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Información dirigida a profesionales sanitarios ÍNDICE Medicamentos 1. Nuevos medicamentos 2. Cambios de especial interés
Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Información dirigida a profesionales sanitarios ÍNDICE Medicamentos 1. Nuevos medicamentos 2. Cambios de especial interés
Dra. Nayrin A. Súnico B.
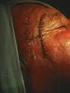 Dra. Nayrin A. Súnico B. Caracas, 14 de marzo de 2012 Introducción Cáncer de cuello uterino: 2da causa de cáncer en la mujer 2da causa de muerte en mujeres entre 14-44 años VPH con carcinoma de cuello
Dra. Nayrin A. Súnico B. Caracas, 14 de marzo de 2012 Introducción Cáncer de cuello uterino: 2da causa de cáncer en la mujer 2da causa de muerte en mujeres entre 14-44 años VPH con carcinoma de cuello
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Sanitarios AEMPS ESPAÑA SE SITUÓ EN 2014 COMO EL CUARTO ESTADO MIEMBRO DE LA UE POR ACTIVIDAD EN AUTORIZACIÓN DE NUEVOS MEDICAMENTOS Fecha de publicación: 3 de julio de 2015 Categoría:
Nota informativa Sanitarios AEMPS ESPAÑA SE SITUÓ EN 2014 COMO EL CUARTO ESTADO MIEMBRO DE LA UE POR ACTIVIDAD EN AUTORIZACIÓN DE NUEVOS MEDICAMENTOS Fecha de publicación: 3 de julio de 2015 Categoría:
Información dirigida a profesionales sanitarios
 Información dirigida a profesionales sanitarios Dolores Montero AEMPS VII eami,, Cancún, n, 15-17 17 octubre 2008 Información a profesionales sanitarios Esencial para garantizar que la actividad reguladora
Información dirigida a profesionales sanitarios Dolores Montero AEMPS VII eami,, Cancún, n, 15-17 17 octubre 2008 Información a profesionales sanitarios Esencial para garantizar que la actividad reguladora
Dirección General de Farmacia y Productos Sanitarios
 INSTRUCCIONES DEL DIRECTOR GENERAL DE FARMACIA Y PRODUCTOS SANITARIOS DE LA AGENCIA VALENCIANA DE SALUD EN RELACIÓN AL DESARROLLO DEL REAL DECRETO 1015/2009, DE 19 DE JUNIO, POR EL QUE SE REGULA LA DISPONIBILIDAD
INSTRUCCIONES DEL DIRECTOR GENERAL DE FARMACIA Y PRODUCTOS SANITARIOS DE LA AGENCIA VALENCIANA DE SALUD EN RELACIÓN AL DESARROLLO DEL REAL DECRETO 1015/2009, DE 19 DE JUNIO, POR EL QUE SE REGULA LA DISPONIBILIDAD
VARIACIONES RELATIVAS A LA FARMACOVIGILANCIA VETERINARIA
 VARIACIONES RELATIVAS A LA FARMACOVIGILANCIA VETERINARIA FRANCISCO DE ASÍS ORTEGA HUEDO Jefe de Sección SGMV 1 - Normativa en vigor - Estructura RD Artículo 2 -> Modificación RD 1246/2008 -> Centrándonos
VARIACIONES RELATIVAS A LA FARMACOVIGILANCIA VETERINARIA FRANCISCO DE ASÍS ORTEGA HUEDO Jefe de Sección SGMV 1 - Normativa en vigor - Estructura RD Artículo 2 -> Modificación RD 1246/2008 -> Centrándonos
MEDICAMENTOS BIOSIMILARES
 Murcia, 30 de Noviembre de 2016 MEDICAMENTOS BIOSIMILARES Mª del Rocío Gutiérrez Cívicos Farmacia Hospitalaria Hospital Universitario Santa Lucía INTRODUCCIÓN Las terapias biológicas están en constante
Murcia, 30 de Noviembre de 2016 MEDICAMENTOS BIOSIMILARES Mª del Rocío Gutiérrez Cívicos Farmacia Hospitalaria Hospital Universitario Santa Lucía INTRODUCCIÓN Las terapias biológicas están en constante
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
FICHA TÉCNICA. 1) NOMBRE DEL MEDICAMENTO ARKOCAPSULAS RAÍZ DE ORTIGA 290 mg cápsulas duras
 ARKOCAPSULAS RAÍZ DE ORTIGA FICHA TÉCNICA 1) NOMBRE DEL MEDICAMENTO ARKOCAPSULAS RAÍZ DE ORTIGA 290 mg cápsulas duras 2) COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Cápsula dura de hipromelosa
ARKOCAPSULAS RAÍZ DE ORTIGA FICHA TÉCNICA 1) NOMBRE DEL MEDICAMENTO ARKOCAPSULAS RAÍZ DE ORTIGA 290 mg cápsulas duras 2) COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Cápsula dura de hipromelosa
Biosimilares: Tratar a más pacientes con el mismo presupuesto o Facilitar el acceso de la población a nuevos tratamientos
 Biosimilares: Tratar a más pacientes con el mismo presupuesto o Facilitar el acceso de la población a nuevos tratamientos La biotecnología ha permitido el avance en los tratamientos para diversas enfermedades
Biosimilares: Tratar a más pacientes con el mismo presupuesto o Facilitar el acceso de la población a nuevos tratamientos La biotecnología ha permitido el avance en los tratamientos para diversas enfermedades
Agencia Española de Medicamentos y Productos Sanitarios AEMPS LA AEMPS PRESENTA LA MEMORIA ANUAL DE ACTIVIDADES DE 2015
 Nota informativa Sanitarios AEMPS LA AEMPS PRESENTA LA MEMORIA ANUAL DE ACTIVIDADES DE 2015 Fecha de publicación: 30 de junio de 2016 Categoría: La AEMPS Referencia: AEMPS, 7/2016 La Sanitarios (AEMPS)
Nota informativa Sanitarios AEMPS LA AEMPS PRESENTA LA MEMORIA ANUAL DE ACTIVIDADES DE 2015 Fecha de publicación: 30 de junio de 2016 Categoría: La AEMPS Referencia: AEMPS, 7/2016 La Sanitarios (AEMPS)
1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME. Presentaciones y precio Nombre comercial Composición Presentación Unidades PVL/unidad (+4% IVA)
 SUGAMMADEX Para la reversión del bloqueo neuromuscular por rocuronio o vecuronio (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario de Guadalajara) 21/07/2009 1.- IDENTIFICACIÓN
SUGAMMADEX Para la reversión del bloqueo neuromuscular por rocuronio o vecuronio (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario de Guadalajara) 21/07/2009 1.- IDENTIFICACIÓN
INFORMACIÓN RELATIVA AL PLASMA RICO EN PLAQUETAS, FRACCIONES, DERIVADOS, SUERO AUTÓLOGO
 INFORMACIÓN RELATIVA AL PLASMA RICO EN PLAQUETAS, FRACCIONES, DERIVADOS, SUERO AUTÓLOGO ARGUMENTOS Tras la publicación del INFORME/V1/23052013 de la Agencia Española de Medicamentos y Productos Sanitarios
INFORMACIÓN RELATIVA AL PLASMA RICO EN PLAQUETAS, FRACCIONES, DERIVADOS, SUERO AUTÓLOGO ARGUMENTOS Tras la publicación del INFORME/V1/23052013 de la Agencia Española de Medicamentos y Productos Sanitarios
Estudios Post-Autorización: experiencia en Canarias.
 Comunicación a la mesa: La seguridad de los Medicamentos en situaciones especiales (II) Estudios Post-Autorización: experiencia en Canarias. A Aldea, M García, E Fernández, M García-S, E Gómez, D Garrido,
Comunicación a la mesa: La seguridad de los Medicamentos en situaciones especiales (II) Estudios Post-Autorización: experiencia en Canarias. A Aldea, M García, E Fernández, M García-S, E Gómez, D Garrido,
XX SIMPOSIO REVISIONES EN CÁNCER TRATAMIENTO MÉDICO DEL CÁNCER EN EL AÑO 2018 SIMPOSIOS EDUCACIONALES. Madrid 7, 8 y 9 febrero 2018
 XX SIMPOSIO REVISIONES EN CÁNCER TRATAMIENTO MÉDICO DEL CÁNCER EN EL AÑO 2018 SIMPOSIOS EDUCACIONALES Madrid 7, 8 y 9 febrero 2018 PROGRAMA PRELIMINAR MIÉRCOLES 7 febrero 2018 09.00-09.15 INAUGURACIÓN
XX SIMPOSIO REVISIONES EN CÁNCER TRATAMIENTO MÉDICO DEL CÁNCER EN EL AÑO 2018 SIMPOSIOS EDUCACIONALES Madrid 7, 8 y 9 febrero 2018 PROGRAMA PRELIMINAR MIÉRCOLES 7 febrero 2018 09.00-09.15 INAUGURACIÓN
Modelos de Gestión Sanitaria
 esanidad 2012 Tecnologías y Servicios al Ciudadano martes, 16 y miércoles, 17 de octubre de 2012 Modelos de Gestión Sanitaria Normalización terminológica de la información asociada a los Medicamentos Ciclo
esanidad 2012 Tecnologías y Servicios al Ciudadano martes, 16 y miércoles, 17 de octubre de 2012 Modelos de Gestión Sanitaria Normalización terminológica de la información asociada a los Medicamentos Ciclo
Agencia Española de Medicamentos y Productos Sanitarios AEMPS REGULACIÓN DE LOS SILENCIOS ADMINISTRATIVOS EN PROCEDIMIENTOS DE LA AEMPS
 Nota informativa Agencia Española Medicamentos y Productos Sanitarios AEMPS REGULACIÓN DE LOS SILENCIOS ADMINISTRATIVOS EN PROCEDIMIENTOS DE LA AEMPS Fecha publicación: 26 septiembre 2011 Categoría: La
Nota informativa Agencia Española Medicamentos y Productos Sanitarios AEMPS REGULACIÓN DE LOS SILENCIOS ADMINISTRATIVOS EN PROCEDIMIENTOS DE LA AEMPS Fecha publicación: 26 septiembre 2011 Categoría: La
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL
 MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS.
 POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS. Los fármacos biosimilares son fármacos biológicos aprobados por la Agencia Europea del Medicamento (EMA)
POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS. Los fármacos biosimilares son fármacos biológicos aprobados por la Agencia Europea del Medicamento (EMA)
Paula Cerezo Álvarez Técnico Gestión de Investigación Fundación Biomédica del CHUVI 14 de julio de 2011
 Paula Cerezo Álvarez Técnico Gestión de Investigación Fundación Biomédica del CHUVI 14 de julio de 2011 Ensayos Clínicos y Estudios Observacionales Definición y requisitos documentales Índice 1. Introducción
Paula Cerezo Álvarez Técnico Gestión de Investigación Fundación Biomédica del CHUVI 14 de julio de 2011 Ensayos Clínicos y Estudios Observacionales Definición y requisitos documentales Índice 1. Introducción
Nuevas directrices sobre EPA: Tipos de estudios y Procedimientos administrativos
 Nuevas directrices sobre EPA: Tipos de estudios y Procedimientos administrativos César de la Fuente Honrubia División de Farmacoepidemiología y Farmacovigilancia AEMPS Jornada Informativa MSPS - 9 de julio
Nuevas directrices sobre EPA: Tipos de estudios y Procedimientos administrativos César de la Fuente Honrubia División de Farmacoepidemiología y Farmacovigilancia AEMPS Jornada Informativa MSPS - 9 de julio
NUEVO REAL DECRETO POR EL QUE SE REGULAN LOS ENSAYOS CLÍNICOS CON MEDICAMENTOS
 Hospital de Sagunto y C.E. BOLETÍN INFORMATIVO Febrero 2016 Nº 6 NUEVO REAL DECRETO POR EL QUE SE REGULAN LOS ENSAYOS CLÍNICOS CON MEDICAMENTOS Introducción Definiciones Objetivos Evaluación y Autorización
Hospital de Sagunto y C.E. BOLETÍN INFORMATIVO Febrero 2016 Nº 6 NUEVO REAL DECRETO POR EL QUE SE REGULAN LOS ENSAYOS CLÍNICOS CON MEDICAMENTOS Introducción Definiciones Objetivos Evaluación y Autorización
Oficina de Apoyo a la investigación clínica independiente de la AEMPS
 Oficina de Apoyo a la investigación clínica independiente de la AEMPS Antonio Blázquez. 9 de Julio de 2009, Madrid PLAN ESTRATÉGICO GENERAL DE LA AEMPS 2009-2012 La Oficina de Apoyo a la Investigación
Oficina de Apoyo a la investigación clínica independiente de la AEMPS Antonio Blázquez. 9 de Julio de 2009, Madrid PLAN ESTRATÉGICO GENERAL DE LA AEMPS 2009-2012 La Oficina de Apoyo a la Investigación
Asunto/assumpte: Criterios para el uso de doxorrubicina liposomal pegilada (Caelyx) durante la situación de desabastecimiento del mercado
 Asunto/assumpte: Criterios para el uso de doxorrubicina liposomal pegilada (Caelyx) durante la situación de desabastecimiento del mercado Ref.: NI04/12 Us tramet, adjunta, la Nota Informativa de la Agencia
Asunto/assumpte: Criterios para el uso de doxorrubicina liposomal pegilada (Caelyx) durante la situación de desabastecimiento del mercado Ref.: NI04/12 Us tramet, adjunta, la Nota Informativa de la Agencia
Bot PLUS 2.0 App Toda la información del medicamento en tu móvil
 Bot PLUS 2.0 App Toda la información del medicamento en tu móvil Antonio Blanes Jiménez Coordinador Base de Datos. Dpto Productos y Servicios Consejo General de Colegios Oficiales de Farmacéuticos #esalud16
Bot PLUS 2.0 App Toda la información del medicamento en tu móvil Antonio Blanes Jiménez Coordinador Base de Datos. Dpto Productos y Servicios Consejo General de Colegios Oficiales de Farmacéuticos #esalud16
BUSQUEDA Y GESTION DE INFORMACIÓN SOBRE MEDICAMENTOS Y PRODUCTOS SANITARIOS
 BUSQUEDA Y GESTION DE INFORMACIÓN SOBRE MEDICAMENTOS Y PRODUCTOS SANITARIOS Mª Victoria Rojo Manteca Centro de Información del Medicamento. Colegio Oficial de Farmacéuticos de Ávila. mavirm@usal.es Palabras
BUSQUEDA Y GESTION DE INFORMACIÓN SOBRE MEDICAMENTOS Y PRODUCTOS SANITARIOS Mª Victoria Rojo Manteca Centro de Información del Medicamento. Colegio Oficial de Farmacéuticos de Ávila. mavirm@usal.es Palabras
NUEVAS TASAS DE LA AEMPS (vigentes desde el 26 de julio de 2013)
 Modificación de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, por la Ley 10/2013, de 24 de julio, por la que se incorporan al ordenamiento (B.O.E.
Modificación de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, por la Ley 10/2013, de 24 de julio, por la que se incorporan al ordenamiento (B.O.E.
Servei de Control de Medicaments i Productes Sanitaris
 Assumpte/Asunto: JEXT 300 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,3 ml y JEXT 150 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,15 m
Assumpte/Asunto: JEXT 300 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,3 ml y JEXT 150 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,15 m
sobre Alertas de productos sanitarios, cosméticos y productos de higiene personal. Información dirigida a profesionales sanitarios
 Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Información dirigida a profesionales sanitarios
Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Información dirigida a profesionales sanitarios
III CURSO PARA INVESTIGADORES SOBRE NORMAS DE BPC PROCEDIMIENTO DE AUTORIZACIÓN DE UN ENSAYO CLÍNICO
 III CURSO PARA INVESTIGADORES SOBRE NORMAS DE BPC PROCEDIMIENTO DE AUTORIZACIÓN DE UN ENSAYO CLÍNICO Antes de realizar un EC con medicamentos se debe contar con: Dictamen favorable del CEIC Conformidad
III CURSO PARA INVESTIGADORES SOBRE NORMAS DE BPC PROCEDIMIENTO DE AUTORIZACIÓN DE UN ENSAYO CLÍNICO Antes de realizar un EC con medicamentos se debe contar con: Dictamen favorable del CEIC Conformidad
Oficina de Apoyo a la investigación clínica independiente y Terapias Avanzadas de la AEMPS Antonio Blázquez Pérez
 Oficina de Apoyo a la investigación clínica independiente y Terapias Avanzadas de la AEMPS Antonio Blázquez Pérez PLAN ESTRATÉGICO GENERAL DE LA AEMPS 2009-2012 La Oficina de Apoyo a la Investigación Clínica
Oficina de Apoyo a la investigación clínica independiente y Terapias Avanzadas de la AEMPS Antonio Blázquez Pérez PLAN ESTRATÉGICO GENERAL DE LA AEMPS 2009-2012 La Oficina de Apoyo a la Investigación Clínica
El Proceso es el Producto Los Productos Biológicos derivados de un proceso de producción completamente diferente no son idénticos.
 INDICE Diferencias entre Medicamento Biológico y Medicamento Genérico Marco Regulatorio Marco Regulatorio EMA (Agencia Europea del Medicamento) Aspectos científicos y de fabricación Aspectos Científicos:
INDICE Diferencias entre Medicamento Biológico y Medicamento Genérico Marco Regulatorio Marco Regulatorio EMA (Agencia Europea del Medicamento) Aspectos científicos y de fabricación Aspectos Científicos:
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Merck Departamento de Comunicación Clara Castaño, Telf ; ;
 División Merck Serono Merck Departamento de Comunicación Clara Castaño, Telf. +34 917453175; +34 690928786; clara.castano@merck.es Nota de prensa 25 de noviembre de 2009 Erbitux, reconocido por ASCO como
División Merck Serono Merck Departamento de Comunicación Clara Castaño, Telf. +34 917453175; +34 690928786; clara.castano@merck.es Nota de prensa 25 de noviembre de 2009 Erbitux, reconocido por ASCO como
Cartera de servicios y catálogo de productos del Servicio de Farmacia Hospitalaria
 Cartera de servicios y catálogo de productos del Servicio de Farmacia Hospitalaria Adaptación del documento Servicio de Farmacia Hospitalaria, catálogo de Productos y Facturación elaborado por la Subdirección
Cartera de servicios y catálogo de productos del Servicio de Farmacia Hospitalaria Adaptación del documento Servicio de Farmacia Hospitalaria, catálogo de Productos y Facturación elaborado por la Subdirección
Introducción y principios generales. Garantías de abastecimiento.
 Introducción y principios generales. Garantías de abastecimiento. Belén Escribano Jefe de Departamento de Inspección y Control de Medicamentos 1 Índice Antecedentes Objeto y ámbito de aplicación Principios
Introducción y principios generales. Garantías de abastecimiento. Belén Escribano Jefe de Departamento de Inspección y Control de Medicamentos 1 Índice Antecedentes Objeto y ámbito de aplicación Principios
Sistema de Información de Comités de Etica en España*
 Sistema de Información de Comités de Etica en España* * Información del Centro Coordinador de CEIC Mariantonia Serrano Castro Departamento de Medicamentos de Uso Humano Agencia Española de Medicamentos
Sistema de Información de Comités de Etica en España* * Información del Centro Coordinador de CEIC Mariantonia Serrano Castro Departamento de Medicamentos de Uso Humano Agencia Española de Medicamentos
Comparación de las vacunas profilácticas aprobadas contra el virus del papiloma humano
 Comparación de las vacunas profilácticas aprobadas contra el virus del papiloma humano La infección por serotipos oncogénicos del virus del papiloma humano (VPH) puede progresar hacia cáncer de cuello
Comparación de las vacunas profilácticas aprobadas contra el virus del papiloma humano La infección por serotipos oncogénicos del virus del papiloma humano (VPH) puede progresar hacia cáncer de cuello
CARBEPENEMES HAY DIFERENCIAS ENTRE ELLOS?
 CARBEPENEMES HAY DIFERENCIAS ENTRE ELLOS? PRO Dr José Garnacho Montero Unidad Clínica de Cuidados Críticos y Urgencias. Unidad de Cuidados Intensivos Hospital Virgen del Rocío. Sevilla. EVOLUCION DEL CONSUMO
CARBEPENEMES HAY DIFERENCIAS ENTRE ELLOS? PRO Dr José Garnacho Montero Unidad Clínica de Cuidados Críticos y Urgencias. Unidad de Cuidados Intensivos Hospital Virgen del Rocío. Sevilla. EVOLUCION DEL CONSUMO
Modificaciones que afectan a los medicamentos de Uso Humano
 JORNADA INFORMATIVA SOBRE LAS MODIFICACIONES, EN EL ÁMBITO DE LA AEMPS, DE LA LEY DE GARANTIAS SANITARIAS Y USO RACIONAL DE LOS MEDICAMENTOS Y PRODUCTOS SANITARIOS Modificaciones que afectan a los medicamentos
JORNADA INFORMATIVA SOBRE LAS MODIFICACIONES, EN EL ÁMBITO DE LA AEMPS, DE LA LEY DE GARANTIAS SANITARIAS Y USO RACIONAL DE LOS MEDICAMENTOS Y PRODUCTOS SANITARIOS Modificaciones que afectan a los medicamentos
Tema 17. Registro de medicamentos. Legislación y deontología farmacéutica
 Tema 17. Registro de medicamentos Legislación y deontología farmacéutica 1 ESTATAL DISPOSICIONES LEGALES REAL DECRETO 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización,
Tema 17. Registro de medicamentos Legislación y deontología farmacéutica 1 ESTATAL DISPOSICIONES LEGALES REAL DECRETO 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización,
EVALUACIÓN DE RESULTADOS DE CRIZOTINIB EN CÁNCER DE PULMÓN NO MICROCÍTICO. Mª José Moreno Fernández
 EVALUACIÓN DE RESULTADOS DE CRIZOTINIB EN CÁNCER DE PULMÓN NO MICROCÍTICO Mª José Moreno Fernández Introducción. Situación actual de Crizotinib. Objetivos. Material y métodos. Resultados. Limitaciones
EVALUACIÓN DE RESULTADOS DE CRIZOTINIB EN CÁNCER DE PULMÓN NO MICROCÍTICO Mª José Moreno Fernández Introducción. Situación actual de Crizotinib. Objetivos. Material y métodos. Resultados. Limitaciones
Interpretación de la legislación desde el punto de vista de un CEIC
 Experiencia en España en la realización de estudios post-autorización. Actualización tras la implementación de la Orden SAS/3470/2009 Mesa redonda: Interpretación de la legislación desde el punto de vista
Experiencia en España en la realización de estudios post-autorización. Actualización tras la implementación de la Orden SAS/3470/2009 Mesa redonda: Interpretación de la legislación desde el punto de vista
REQUISITOS DE CALIDAD EN EL MEDICAMENTO EN INVESTIGACIÓN (Junio 2008)
 agencia española de SUBDIRECCIÓN GENERAL DE MEDICAMENTOS DE USO HUMANO Área de Ensayos Clínicos REQUISITOS DE CALIDAD EN EL MEDICAMENTO EN INVESTIGACIÓN (Junio 2008) Medicamento: toda sustancia o combinación
agencia española de SUBDIRECCIÓN GENERAL DE MEDICAMENTOS DE USO HUMANO Área de Ensayos Clínicos REQUISITOS DE CALIDAD EN EL MEDICAMENTO EN INVESTIGACIÓN (Junio 2008) Medicamento: toda sustancia o combinación
PROSPECTO. GOBEMICINA 250 Inyectable GOBEMICINA 500 Inyectable GOBEMICINA 1 g Inyectable
 PROSPECTO GOBEMICINA 250 Inyectable GOBEMICINA 500 Inyectable GOBEMICINA 1 g Inyectable GOBEMICINA 250 (Ampicilina) INYECTABLE VIA INTRAVENOSA E INTRAMUSCULAR COMPOSICION Cada vial contiene: «250» AMPICILINA
PROSPECTO GOBEMICINA 250 Inyectable GOBEMICINA 500 Inyectable GOBEMICINA 1 g Inyectable GOBEMICINA 250 (Ampicilina) INYECTABLE VIA INTRAVENOSA E INTRAMUSCULAR COMPOSICION Cada vial contiene: «250» AMPICILINA
ANÁLISIS DE LAS NOTIFICACIONES ATENCIÓN PRIMARIA ERRORES DE MEDICACIÓN AGOSTO DE 2017
 ANÁLISIS DE LAS NOTIFICACIONES ATENCIÓN PRIMARIA ERRORES DE MEDICACIÓN AGOSTO DE 17 Durante el mes de agosto de 17 se han recibido en el Portal de Uso Seguro de Medicamentos 168 notificaciones relacionadas
ANÁLISIS DE LAS NOTIFICACIONES ATENCIÓN PRIMARIA ERRORES DE MEDICACIÓN AGOSTO DE 17 Durante el mes de agosto de 17 se han recibido en el Portal de Uso Seguro de Medicamentos 168 notificaciones relacionadas
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Productos Sanitarios AEMPS CRITERIOS PARA EL USO DE DOXORRUBICINA LIPOSOMAL PEGILADA (CAELYX) DURANTE LA SITUACIÓN DE DESABASTECIMIENTO DEL MERCADO Fecha de publicación: 14 de febrero
Nota informativa Productos Sanitarios AEMPS CRITERIOS PARA EL USO DE DOXORRUBICINA LIPOSOMAL PEGILADA (CAELYX) DURANTE LA SITUACIÓN DE DESABASTECIMIENTO DEL MERCADO Fecha de publicación: 14 de febrero
La infección persistente por VPH es necesaria para que aparezca el cáncer cervical, pero no es suficiente, por sí sola, para causar la enfermedad:
 VACUNA CONTRA EL PAPILOMAVIRUS La infección por el papilomavirus humano (VPH) El virus del papiloma humano infecta y se replica en los tejidos epiteliales cutáneos o mucosos, afectando principalmente la
VACUNA CONTRA EL PAPILOMAVIRUS La infección por el papilomavirus humano (VPH) El virus del papiloma humano infecta y se replica en los tejidos epiteliales cutáneos o mucosos, afectando principalmente la
Instrucciones para las oicinas de farmacia sobre la venta directa a profesionales sanitarios de medicamentos de uso humano, 2017, AEMPS
 Instrucciones para las oicinas de farmacia sobre la venta directa a profesionales sanitarios de medicamentos de uso humano, 2017, AEMPS Guía para la aplicación en la Comunidad Autónoma de Euskadi Vitoria-Gasteiz,
Instrucciones para las oicinas de farmacia sobre la venta directa a profesionales sanitarios de medicamentos de uso humano, 2017, AEMPS Guía para la aplicación en la Comunidad Autónoma de Euskadi Vitoria-Gasteiz,
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS. Esther Salgueiro 10, 17 de Marzo de 2015
 FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia. Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional
 Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España
 Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
VOL. 23 Nº datos de estabilidad en la ficha técnica (5) y/o directamente al laboratorio fabricante.
 VOL. 23 Nº 3 2014 ACTUALIZACIÓN DE LA ESTABILIDAD DE MEDICAMENTOS TERMOLÁBILES FUERA DE NEVERA (I)* Ana Conchillo Armendáriz, Marta Irujo Lizaur. Centro de Información de Medicamentos. Colegio Oficial
VOL. 23 Nº 3 2014 ACTUALIZACIÓN DE LA ESTABILIDAD DE MEDICAMENTOS TERMOLÁBILES FUERA DE NEVERA (I)* Ana Conchillo Armendáriz, Marta Irujo Lizaur. Centro de Información de Medicamentos. Colegio Oficial
Agencia Española de Medicamentos y P.S. (AEMPS) Madrid, 1 de junio 2009
 ENSAYO CLÍNICO EN TRÁMITE Agencia Española de Medicamentos y P.S. (AEMPS) Madrid, 1 de junio 2009 ENSAYO CLÍNICO EN TRÁMITE Carta de acompañamiento: ENSAYO CLÍNICO EN TRÁMITE Datos importantes que hay
ENSAYO CLÍNICO EN TRÁMITE Agencia Española de Medicamentos y P.S. (AEMPS) Madrid, 1 de junio 2009 ENSAYO CLÍNICO EN TRÁMITE Carta de acompañamiento: ENSAYO CLÍNICO EN TRÁMITE Datos importantes que hay
FICHA TÉCNICA. Polisacárido Vi de Salmonella typhi (cepa Ty2)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA EP
 Virus del Papiloma Humano Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA EP VPH: Agente ADN Virus de doble cadena Flia: Papillomaviridae Producen infección en tejidos estratificados de piel y mucosas de
Virus del Papiloma Humano Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA EP VPH: Agente ADN Virus de doble cadena Flia: Papillomaviridae Producen infección en tejidos estratificados de piel y mucosas de
Informe Público de Evaluación
 REF. PTE. AUTORIZACIÓN Informe Público de Evaluación SULFATO DE MAGNESIO GENFARMA 150 mg/ml Solución inyectable y para perfusión Este documento resume cómo ha evaluado la Productos Sanitarios (AEMPS) los
REF. PTE. AUTORIZACIÓN Informe Público de Evaluación SULFATO DE MAGNESIO GENFARMA 150 mg/ml Solución inyectable y para perfusión Este documento resume cómo ha evaluado la Productos Sanitarios (AEMPS) los
REQUISITOS DEL CEIC-E PARA LA AUTORIZACIÓN DE ENSAYOS CLÍNICOS
 REQUISITOS DEL CEIC-E PARA LA AUTORIZACIÓN DE ENSAYOS CLÍNICOS NO EXISTEN PLAZOS DE ENVÍO PARA PARA LOS ENSAYOS CLÍNICOS CON MEDICAMENTOS Y PRODUCTOS SANITARIOS Evaluación por el CEIC E cuando actúa como
REQUISITOS DEL CEIC-E PARA LA AUTORIZACIÓN DE ENSAYOS CLÍNICOS NO EXISTEN PLAZOS DE ENVÍO PARA PARA LOS ENSAYOS CLÍNICOS CON MEDICAMENTOS Y PRODUCTOS SANITARIOS Evaluación por el CEIC E cuando actúa como
BOLETÍN OFICIAL DEL ESTADO
 Núm. 258 Lunes 26 de octubre de 2009 Sec. III. Pág. 89676 III. OTRAS DISPOSICIONES 16996 Resolución de 16 de octubre de 2009, de la Subsecretaría, por la que se autoriza la presentación a través del registro
Núm. 258 Lunes 26 de octubre de 2009 Sec. III. Pág. 89676 III. OTRAS DISPOSICIONES 16996 Resolución de 16 de octubre de 2009, de la Subsecretaría, por la que se autoriza la presentación a través del registro
INSTRUCCIÓN 1/2003. Dirección General de Recursos Sanitarios Departamento de Sanidad y Seguridad Social
 INSTRUCCIÓN 1/2003 Dirección General de Recursos Sanitarios Departamento de Sanidad y Seguridad Social Asunto Requisitos para la realización de estudios post-autorización de medicamentos en los centros
INSTRUCCIÓN 1/2003 Dirección General de Recursos Sanitarios Departamento de Sanidad y Seguridad Social Asunto Requisitos para la realización de estudios post-autorización de medicamentos en los centros
Experiencia de la Administración
 Congreso AMIFE Madrid, 28 al 30 de Noviembre de 2018 MESA: INFORMACIÓN Y PROMOCIÓN FARMACÉUTICA EN EL MUNDO DIGITAL, CÓMO LLEVARSE BIEN Experiencia de la Administración Mª Carmen Puerta Fernández Jefa
Congreso AMIFE Madrid, 28 al 30 de Noviembre de 2018 MESA: INFORMACIÓN Y PROMOCIÓN FARMACÉUTICA EN EL MUNDO DIGITAL, CÓMO LLEVARSE BIEN Experiencia de la Administración Mª Carmen Puerta Fernández Jefa
CERTIFICADO DE INSCRIPCIÓN EN EL REGISTRO DE ESPECIALIDADES MEDICINALES (REM)
 ANEXO CERTIFICADO DE INSCRIPCIÓN EN EL REGISTRO DE ESPECIALIDADES MEDICINALES (REM) El Administrador Nacional de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) certifica
ANEXO CERTIFICADO DE INSCRIPCIÓN EN EL REGISTRO DE ESPECIALIDADES MEDICINALES (REM) El Administrador Nacional de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) certifica
Plasma autólogo, fracciones, componentes y derivados: Normativa e inspección
 TALLER SEFH Plasma autólogo, fracciones, componentes y derivados: Normativa e inspección Dr. Julio Muelas Tirado Jefe de Servicio de Ordenación, Control y Vigilancia de Productos Farmacéuticos Dirección
TALLER SEFH Plasma autólogo, fracciones, componentes y derivados: Normativa e inspección Dr. Julio Muelas Tirado Jefe de Servicio de Ordenación, Control y Vigilancia de Productos Farmacéuticos Dirección
I. Comunidad Autónoma
 Página 6018 I. Comunidad Autónoma 2. Autoridades y Personal Consejería de Economía y Hacienda 1857 Orden de 7 de febrero 2014, de la Consejería de Economía y Hacienda, por la que se aprueba el programa
Página 6018 I. Comunidad Autónoma 2. Autoridades y Personal Consejería de Economía y Hacienda 1857 Orden de 7 de febrero 2014, de la Consejería de Economía y Hacienda, por la que se aprueba el programa
Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico.
 Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico. Dr. Eduardo Fernández Quintana Centro de Farmacovigilancia e Información Terapéutica de Canarias de Canarias.
Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico. Dr. Eduardo Fernández Quintana Centro de Farmacovigilancia e Información Terapéutica de Canarias de Canarias.
Bot PLUS 2.0 La base de datos del conocimiento sanitario
 Bot PLUS 2.0 La base de datos del conocimiento sanitario TALLER COF SEVILLA 4 junio 2013 1 El Consejo General como proveedor de información Hace 30 AÑOS, el Consejo General creó una Base de Datos del Medicamento
Bot PLUS 2.0 La base de datos del conocimiento sanitario TALLER COF SEVILLA 4 junio 2013 1 El Consejo General como proveedor de información Hace 30 AÑOS, el Consejo General creó una Base de Datos del Medicamento
ANÁLISIS DE LAS NOTIFICACIONES ATENCIÓN HOSPITALARIA ERRORES DE MEDICACIÓN NOVIEMBRE 2017
 ANÁLISIS DE LAS NOTIFICACIONES ATENCIÓN HOSPITALARIA ERRORES DE MEDICACIÓN NOVIEMBRE 17 Durante el mes de noviembre de 17 los Hospitales de la Comunidad de Madrid han comunicado en el Portal de Uso Seguro
ANÁLISIS DE LAS NOTIFICACIONES ATENCIÓN HOSPITALARIA ERRORES DE MEDICACIÓN NOVIEMBRE 17 Durante el mes de noviembre de 17 los Hospitales de la Comunidad de Madrid han comunicado en el Portal de Uso Seguro
Vacunación frete al virus del papiloma humano
 Vacunación frete al virus del papiloma humano Dra. Sonia Tamames Jefe de Servicio de Epidemiología y Promoción de la Salud. Dirección General de Salud Pública de Castilla y León. Virus del Papiloma Humano
Vacunación frete al virus del papiloma humano Dra. Sonia Tamames Jefe de Servicio de Epidemiología y Promoción de la Salud. Dirección General de Salud Pública de Castilla y León. Virus del Papiloma Humano
Comunicación dirigida a Profesionales Sanitarios
 Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
ENROKARIZOO 20% Reg. SAGARPA: Q
 FICHA TECNICA DE PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENROKARIZOO 20% Reg. SAGARPA: Q-0265-008 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por 1 ml: Enrofloxacina... 200 mg Vehículo
FICHA TECNICA DE PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENROKARIZOO 20% Reg. SAGARPA: Q-0265-008 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por 1 ml: Enrofloxacina... 200 mg Vehículo
NOTIFICACIONES ATENCIÓN PRIMARIA DE MEDICACIÓN JUNIO DE 2017
 ANÁLISIS DE LAS NOTIFICACIONES ATENCIÓN PRIMARIA ERRORES DE MEDICACIÓN JUNIO DE 2017 Durante el mes de junio de 2017 se han recibido en el Portal de Uso Seguro de Medicamentos 222 notificaciones relacionadas
ANÁLISIS DE LAS NOTIFICACIONES ATENCIÓN PRIMARIA ERRORES DE MEDICACIÓN JUNIO DE 2017 Durante el mes de junio de 2017 se han recibido en el Portal de Uso Seguro de Medicamentos 222 notificaciones relacionadas
Agencia Española de Medicamentos y P.S. (AEMPS) Madrid, 1 Junio 2009
 RELLENAR UN FORMULARIO DE SOLICITUD INICIAL Agencia Española de Medicamentos y P.S. (AEMPS) Madrid, 1 Junio 2009 www.agemed.es Acceso al Portal de EC Nuevo ensayo clínico Nuevo ensayo clínico Nuevo EC:
RELLENAR UN FORMULARIO DE SOLICITUD INICIAL Agencia Española de Medicamentos y P.S. (AEMPS) Madrid, 1 Junio 2009 www.agemed.es Acceso al Portal de EC Nuevo ensayo clínico Nuevo ensayo clínico Nuevo EC:
CIRCULAR Nº 3/2011. C/ CAMPEZO, 1 EDIFICIO MADRID Página 1 de 7.
 CIRCULAR Nº 3/2011 Dependencia Agencia estatal «Productos Sanitarios» Contenido Ámbito de aplicación Información que deberán aportar las notificaciones de suspensión temporal o cese de comercialización
CIRCULAR Nº 3/2011 Dependencia Agencia estatal «Productos Sanitarios» Contenido Ámbito de aplicación Información que deberán aportar las notificaciones de suspensión temporal o cese de comercialización
CANCER DE CUELLO UTERINO. Dra. Silvia Fraga Campo Unidad de Tracto genital Inferior
 CANCER DE CUELLO UTERINO Dra. Silvia Fraga Campo Unidad de Tracto genital Inferior IMPORTANCIA Tras el cáncer de mama, el cáncer de cérvix es el cáncer femenino mundial más frecuente tanto en incidencia
CANCER DE CUELLO UTERINO Dra. Silvia Fraga Campo Unidad de Tracto genital Inferior IMPORTANCIA Tras el cáncer de mama, el cáncer de cérvix es el cáncer femenino mundial más frecuente tanto en incidencia
Dirección General de Medicamentos, Alimentos y Productos Sanitarios, República Dominicana
 Dirección General de Medicamentos, Alimentos y Productos Sanitarios, República Dominicana Dialogo con las Agencias Regulatorias Extranjeras Bio Latin America Mercedes Soriano 26 de octubre 2016 São Paulo,
Dirección General de Medicamentos, Alimentos y Productos Sanitarios, República Dominicana Dialogo con las Agencias Regulatorias Extranjeras Bio Latin America Mercedes Soriano 26 de octubre 2016 São Paulo,
DIRECCION GENERAL DE MEDICAMENTOS, INSUMOS Y DROGAS ( DIGEMID -PERU) PRODUCTOS BIOLOGICOS SITUACION ACTUAL
 DIGEMID DIRECCION GENERAL DE MEDICAMENTOS, INSUMOS Y DROGAS ( DIGEMID -PERU) PRODUCTOS BIOLOGICOS SITUACION ACTUAL DRA. AMANDA MARTINEZ ROJO EQUIPO DE REGISTRO DE PRODUCTOS FARMACEUTICOS JUNIO - 2008 SITUACION
DIGEMID DIRECCION GENERAL DE MEDICAMENTOS, INSUMOS Y DROGAS ( DIGEMID -PERU) PRODUCTOS BIOLOGICOS SITUACION ACTUAL DRA. AMANDA MARTINEZ ROJO EQUIPO DE REGISTRO DE PRODUCTOS FARMACEUTICOS JUNIO - 2008 SITUACION
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker inac, suspensión inyectable
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker inac, suspensión inyectable
GUÍA DE PRÁCTICA CLÍNICA. Vacunas contra HPV. Dra. Laura Fleider
 Dra. Laura Fleider Año 2011 - Revisión: 0 Página 1 de 6 Introducción Entre las afecciones atribuidas al virus del papiloma humano (HPV) que pueden prevenirse por medio de la vacunación se destacan: cáncer
Dra. Laura Fleider Año 2011 - Revisión: 0 Página 1 de 6 Introducción Entre las afecciones atribuidas al virus del papiloma humano (HPV) que pueden prevenirse por medio de la vacunación se destacan: cáncer
Cáncer colorrectal. Actualización y tendencias futuras
 Cáncer. Actualización y tendencias futuras MODALIDAD 100% ONLINE ÁREA MEDICINA DURACIÓN 90 HORAS Programas de Formación y Especialización MEDICINA Y SALUD DESCRIPCIÓN El cáncer es unas de las primeras
Cáncer. Actualización y tendencias futuras MODALIDAD 100% ONLINE ÁREA MEDICINA DURACIÓN 90 HORAS Programas de Formación y Especialización MEDICINA Y SALUD DESCRIPCIÓN El cáncer es unas de las primeras
Recomendaciones para la no utilización de hormona del crecimiento en la recuperación de enfermedades neurológicas cerebrales y periféricas.
 Pág. 1 de 6 Recomendaciones para la no utilización de hormona del crecimiento en la recuperación de enfermedades neurológicas cerebrales y periféricas. El objetivo de esta alerta internacional es difundir
Pág. 1 de 6 Recomendaciones para la no utilización de hormona del crecimiento en la recuperación de enfermedades neurológicas cerebrales y periféricas. El objetivo de esta alerta internacional es difundir
SINCERUM BIOTIC NEOMICINA - DEXAMETASONA. Gotas óticas. Neomicina Sulfato 0,500 g. Dexametasona 0,025 g.
 SINCERUM BIOTIC NEOMICINA - DEXAMETASONA Gotas óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen : Neomicina Sulfato 0,500 g. Dexametasona 0,025 g. Excipientes : Glicerina - Agua
SINCERUM BIOTIC NEOMICINA - DEXAMETASONA Gotas óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen : Neomicina Sulfato 0,500 g. Dexametasona 0,025 g. Excipientes : Glicerina - Agua
VACUNACIÓN FRENTE VPH EN MUJERES HASTA 45 AÑOS
 VACUNACIÓN FRENTE VPH EN MUJERES HASTA 45 AÑOS POR: ESPERANZA VICENTE MELLADO PALOMA RODRIGUEZ DE LA CRUZ CONSULTAS HOSPITAL ONCOLOGICO MD ANDERSON INTERNACIONAL ESPAÑA VPH? El virus del papiloma humano
VACUNACIÓN FRENTE VPH EN MUJERES HASTA 45 AÑOS POR: ESPERANZA VICENTE MELLADO PALOMA RODRIGUEZ DE LA CRUZ CONSULTAS HOSPITAL ONCOLOGICO MD ANDERSON INTERNACIONAL ESPAÑA VPH? El virus del papiloma humano
neumonía asociada a ventilación mecánica).
 FARMACOVIGILANCIA Doripenem (Doribax ): nuevas recomendaciones de uso en pacientes con neumonía nosocomial (Nota informativa de la AEMPS publicada con fecha 25 de junio de 2012. Ref: MUH (FV), 10/2012
FARMACOVIGILANCIA Doripenem (Doribax ): nuevas recomendaciones de uso en pacientes con neumonía nosocomial (Nota informativa de la AEMPS publicada con fecha 25 de junio de 2012. Ref: MUH (FV), 10/2012
Aspectos generales del nuevo real decreto
 Aspectos generales del nuevo real decreto Belén Escribano Romero Subdirectora General de Inspección y Control de Medicamentos Real Decreto 824/2010, de 25 de junio, por el que se regulan los laboratorios
Aspectos generales del nuevo real decreto Belén Escribano Romero Subdirectora General de Inspección y Control de Medicamentos Real Decreto 824/2010, de 25 de junio, por el que se regulan los laboratorios
CIRCULAR 4/2005 ORGANISMO: AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS.
 agencia española de CIRCULAR 4/2005 ORGANISMO: AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS. CONTENIDO: ÁMBITO: SEGUNDA ETAPA PARA EL USO DEL CERTIFICADO DE ARCHIVO PRINCIPAL DE PLASMA Dirección
agencia española de CIRCULAR 4/2005 ORGANISMO: AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS. CONTENIDO: ÁMBITO: SEGUNDA ETAPA PARA EL USO DEL CERTIFICADO DE ARCHIVO PRINCIPAL DE PLASMA Dirección
