-0,36-0,44 Zn 2+ +2e Zn -0,76 Mn 2+ +2e Mn -1,19 Al 3+ +3e Al -1,66 Mg 2+ +2e Mg -2,37 Na + +e Na -2,71 K + +e K -2,92 Li + +e Li -3,05
|
|
|
- Juan Soriano Miguélez
- hace 5 años
- Vistas:
Transcripción
1 Redox 2 21*. El número de oxidación, índice de oxidación o estado de oxidación fue definido por primera vez en 1880, por el inglés Otis Coe Johnson, como el número de cargas que un elemento aporta a la formación eléctrica de un compuesto, por eso podrás comprender fácilmente que el oxidante disminuirá su número de oxidación y el reductor lo aumentará. Así, dado el esquema de la pila Daniell, podrás asegurar que: a) El Cu 2+ actúa como oxidante b) El cinc al disolverse reduce al cobre c) En la hemicelda del Zn ocurre una oxidación d) En la hemicelda del Cu ocurre una reducción Si el Cu 2+, se deposita como Cu, su número de oxidación disminuye, y por lo tanto será el oxidante, que se reduce, en su hemicelda ocurre una reducción o sea ganancia de electrones, y por lo tanto será el cátodo, mientras que en la hemicelda del Zn 2+ /Zn, tiene lugar la oxidación del Zn, por lo que será el ánodo. Son correctas las propuestas a, c y d. 22*.Faraday, descubridor del butileno (después buteno), y del benzol (posteriormente benceno), fue inicialmente y debido a sus medios económicos un autodidacta, aunque después fuera discípulo de Davy, por eso tuvo que recurrir a la ayuda de un amigo filósofo e historiador, William Whewell, para crear los nombres, tan usados en electroquímica, derivados del griego, como ión (caminante), ánodo (camino hacia arriba), cátodo (camino hacia abajo), basándose en la migración de las cargas, electrodo (camino de la electricidad), electrolito y electrolisis (disolución por la electricidad). Sin embargo el sentido real del ánodo y del cátodo implica que: a) El ánodo es la hemicelda donde se produce la oxidación b) El cátodo es la hemicelda donde se produce la reducción c) El ánodo es el electrodo negativo d) El cátodo es el electrodo positivo e) El ánodo es el electrodo que toma electrones Por lo ya dicho, en el ánodo se produce la oxidación mientras que en el cátodo una reducción (regla nemotécnica vocal-vocal, consonante-consonante). El ánodo es el electrodo positivo, mientras que el cátodo, el negativo. Son correctas las propuestas a y b. 23*.Basándose en lo dicho anteriormente, y sabiendo que una lámina de plomo se disuelve en nitrato de plata, en el esquema de la pila dada, los errores que en él se aprecian serán: a) La denominación de ánodo b) La caracterización del cátodo c) El sentido del movimiento electrónico d) Los polos de la pila Por lo dicho anteriormente, el ánodo es el electrodo en el que el Pb pasa a Pb2+, por lo tanto las denominaciones de ánodo y cátodo son al revés, lo mismo que el sentido del movimiento de electrones. Son correctos los polos de la pila.
2 24. La IUPAC, distingue entre el número de carga de un elemento químico y el estado de oxidación, aunque conceptualmente sean similares, el primero lleva el signo de la carga, positiva o negativa, delante, mientras que el segundo lo lleva detrás, así el nitrógeno en el amoniaco tiene un estado de oxidación de: a) 3 b) -3 c) 3- d) 3+ mientras que el número de carga del nitrógeno en el compuesto será: a) 3 b) -3 c) 3- d) 3+ En el H 3 N, dado que la carga del H es +1, y la molécula es neutra, quiere decir que la carga del N deberá ser -3, mientras que su estado de oxidación será 3-. Por lo tanto en la primera pregunta es correcta la propuesta b, mientras que en la segunda lo es la c. 25. El mejor diagnóstico para identificar si una reacción es redox, es apreciar si existe variación en los números de oxidación de los protagonistas de dicha reacción, concepto que ya parece surgir a partir del trabajo de Abegg, en 1904, sobre valencias positivas y negativas, complementándose con los de Kossel en 1916, y culminando con los de Latimer en el 38. Actualmente se entiende como el número de cargas positivas o negativas que un elemento aporta a la formación de la especie química neutra o con carga en la que está integrado. Por eso, teniendo en cuenta que el O combinado, salvo en los peróxidos actúa dando dos cargas negativas y que el H combinado actúa con una positiva, podrás decir que los números de oxidación de los elementos X,Y y Z, integrados en las sustancias: HXO 4,H 2 Y 2 O 7 2-, y NaHZO 4 -, son respectivamente : a) 4+,+5,+5 b) 7+,6+,5+ c) +7,+5,+5 d) 8+,5+,6+ Se resolverán las siguientes ecuaciones: HXO4 +1+X+4(-2)=0 ; X=+7, luego su estado de oxidación es 7+ 2Y+7(-2)=-2; Y=+6 ; estado de oxidación Y Z+4(-2==-1; Z=+5, por lo tanto Z 5+. Es correcta la b. 26. Por lo general suele adscribirse al H el número de carga de 1+ y el oxígeno de 2-, no siempre ocurre así ya que depende de la electronegatividad de los otros elementos con los que se encuentra combinado así el primero cuando se combina con elementos del grupo 1, actúa siempre como: a) -1 b) 1+ c) +1 d) 1- mientras que el oxígeno cuando se junta al hidrógeno en el peróxido de hidrógeno, actúa como: a) 2- b) 1+ c) +1 d) -1 Como los elementos X del grupo 1 son mucho mas positivos que el H, éste en la combinación HX, actuará como -1,, mientras que en el H 2 O 2, como 2 O tienen que neutralizar la carga de 2H, también actuarán como -1. Son correctas por este orden la a y la d. 27.En un mismo compuesto un elemento puede existir en diferentes estados de oxidación, así el N, en el nitrito amónico (NH 4 )NO 2 los dos N, por el orden escrito tienen números de oxidación o estados de oxidación: a) -3 y +3 b) +3 y -3 c) 3+ y 3- d) 3+ y 5- El nitrito amónico es la sal formada por el ion nitrito NO 2 - y el ion amonio NH 4 +. Teniendo en cuenta la carga de los respectivos iones, el número de carga del N en el nitrito será +3, mientras que en el amonio será -3, por lo que los números de oxidación respectivamente serán 3+ y 3-, como se propone en c.
3 28. En los compuestos orgánicos el C puede presentar múltiples estados de oxidación, así en la serie: metano, metanol, metanal y metanoico, el número de carga del carbono será sucesivamente: a) -4, -2, 0, +2 b) 4+, 2+, 0, 2- c) 3-, 0, 2+,2- d) 3+,2+, 0,2- Teniendo en cuenta las formulas moleculares metano CH 4 ;X+4(+1)=0; X=-4 metanol H 4 CO; 4(+1)+X-2=0; X=-2; metanal H 2 CO 2(+1)+X-2=0, X=0, metanoico H 2 CO 2 ; 2(+1)+X+2(-2)=0 ; X=+2. Es correcta la propuesta a. V F2 +2e 2F - 2,87 PbO2+2e Pb 2+ 1,68 MnO 4 -+5e Mn 2+ 1,52 Cl 2 +2e 2Cl - 1,36 Cr 2 O e 2Cr 3+ 1,33 O 2 +4e 2H 2 O 1,23 Br 2 +2e 2Br - 1,06 NO e NO 0,96 Ag + +e Ag 0,80 I2+2e 2I - 0,53 Cu 2+ +2e Cu 0,34 2H + +2e H2 0,00 Pb 2+ +2e Pb -0,13 Sn 2+ +2e Sn -0,14 Ni 2+ +2e Ni -0,24 PbSO4+2e Pb Fe 2+ +2e Fe -0,36-0,44 Zn 2+ +2e Zn -0,76 Mn 2+ +2e Mn -1,19 Al 3+ +3e Al -1,66 Mg 2+ +2e Mg -2,37 Na + +e Na -2,71 K + +e K -2,92 Li + +e Li -3,05 29*. Las medidas de los potenciales normales de reducción, permiten determinar la capacidad oxidante o reductora de las diferentes especies químicas, tomando al electrodo de hidrógeno como patrón, en condiciones estándar, tal como se ha realizado anteriormente. Por eso, si tenemos en cuenta que los potenciales normales más positivos representan a las especies más oxidantes mientras que los más negativos son los más reductores, y refiriéndonos a la tabla adjunta, podremos decir que : a) El flúor es la especie más oxidante, mientras que el litio será la más reductora b) Los elementos situados a la derecha del sistema periódico (excluidos los gases nobles), son mas oxidantes, pues son mas electronegativos c) Los metales más reductores son los alcalinotérreos d) La mayor diferencia de potencial generada por una pila electroquímica, en condiciones normales, sería de 6V Son correctas las propuestas a y b. Los elementos más electropositivos serán los más reductores, y estarán situados a la izquierda del sistema periódico (grupo 1), que son los alcalinos. La mayor diferencia de potencial teórica sería de 5,92V. 30*.Una de las reacciones químicas de desplazamiento más estudiada en química elemental es aquella en la que un ácido fuerte con un metal producía una sal y desprendía hidrógeno, por ejemplo ácido sulfúrico y cinc. Sin embargo realmente esta reacción es redox, y teniendo en cuenta la tabla anterior, podremos decir de ella que: a) El H + del ácido sulfúrico debería ganar electrones, y eso solo puede ocurrir si el metal es más reductor que él b) No debería producirse hidrógeno si empleamos limaduras de cobre en la reacción c) El hidrogeno no se liberaría si el sulfúrico actúa como reductor, en lugar del H + d) Si el sulfúrico actuara como oxidante lo que se desprendería sería ácido sulfuroso o mejor dióxido de azufre Según la tabla anterior, el potencial normal de reducción del H +, está por encima del Zn 2+, y por debajo del Cu 2+, eso quiere decir que mientras que el ácido sulfúrico con Zn desprende H 2 (g), porque el H + es capaz de oxidarlo, es incapaz de hacerlo con el cobre, por eso en este caso se desprendería SO 2 (g). Son correctas las propuestas a.b y d.
4 31. En el esquema de la pila de al figura y sabiendo que las disoluciones tienen igual concentración, y teniendo en cuenta la tabla de potenciales normales: a) La reacción química Sn + Ni 2+ -> Sn 2+ + Ni transcurrirá espontáneamente en el sentido indicado b) Los electrones circularán del Sn al Ni c) A será el ánodo d) En C se produce una reducción Según la tabla el Sn 2+, es capaz de robar electrones al Ni, oxidándolo y formando Ni 2+, mientras él se reduce hasta Sn. Por lo cual se depositará Sn sobre su electrodo en C, mientras se disolverá el Ni en A, transcurriendo espontáneamente el proceso Sn 2+ + Ni -> Sn + Ni 2+. Por lo tanto sólo son correctas c y d. 32. En la foto de la pila, disponemos de las hemiceldas Cu 2+ /Cu (obsérvese la disolución de color azul del sulfato de cobreii) y Pb 2+ /Pb, unidas por un puente salino, y conectadas a un voltímetro, teniendo en cuenta los potenciales normales podrás asegurar que: a) La reacción química Cu 2+ + Pb -> Pb 2+ + Cu transcurrirá espontáneamente en el sentido indicado b) A, será el ánodo de la pila c) D, será el polo positivo de la pila d) Los electrones irán de C a D E 0 del par Cu 2+ /Cu =0,34V> E 0 Pb 2+ /Pb=-0,13V, por lo tanto el proceso espontáneo será Cu 2+ + Pb -> Pb 2+ + Cu, esto quiere decir que en B se produce la oxidación del Pb hasta Pb 2+, aumentando la concentración de la disolución, y será el ánodo mientras que en A se producirá la reducción del Cu 2+ a Cu, disminuyendo la concentración de aquél, y por lo tanto haciéndose el azul menos intenso. Por lo dicho, serán correctas las propuestas a, c y d. 33*.Realmente aunque se le atribuye a Volta el invento de la pila, los documentos históricos y arqueológicos no están de acuerdo con ello, pues en 1936, König, arqueólogo alemán, encontró en las excavaciones de Khujut Rabuat, cerca de Bagdad, una especie de pila datada sobre el 300aC formada por elementos de hierro y cobre. Este hecho explicaría algunos procesos químicos, conocidos desde el año 2500 AC, como el dorado de los metales, sólo posible por métodos electroquímicos. Conociendo la escala de potenciales, podrías decir de esta primera pila que: a) Posiblemente empleará el hierro como reductor b) El oxidante sería un compuesto de cobre(ii) c) La diferencia de potencial conseguida, seria superior a la de la pila Daniell, en condiciones normales d) Los electrones circularían del hierro al cobre e) El hierro podría dorarse con el cobre, que lo llegaría a recubrir al depositarse sobre él E 0 del par Cu 2+ /Cu =0,34V> E 0 Fe 2+ /Fe=-0,44V, por lo tanto el proceso espontáneo será Cu 2+ + Fe -> Fe 2+ + Cu Por lo tanto todas las propuestas son correctas menor la c, dado que la pila Daniell genera como se ha visto 1,1V,mientras que ésta produciría en las mismas condiciones 0,34V-(-0,44V)=0,78V.
5 34*.En esta fotografía de la pila Daniell se ha sustituido la hemicelda que contenía cinc, en una disolución de nitrato de cinc, por cobre sumergido en una disolución de sulfato de cobre 0,01M. Al ser el mismo metal podrás asegurar que: a) No se producirá corriente b) A, será el ánodo c) Se generará una diferencia de potencial pequeña d) Se formará una pila de concentración Realmente se produce una pequeña corriente, por el factor de la concentración (se debe fijar en el color de las disoluciones de sulfato de cobre(ii)) que aumenta o disminuye el potencial normal de reducción de los elementos. El menor potencial de reducción lo tendrá la hemicelda B, por eso será el ánodo. Este tipo de pilas en las que la diferencia de potencial se genera a partir de la diferencia de concentraciones, se denomina pilas de concentración. Son correctas las propuestas c y d. 35. El simbolismo de la pila anterior será: 2 2 a) Cu + (1 M ) / Cu Cu (0, 01 M ) / Cu b) Cu (0,01 M ) / Cu Cu / Cu (1 M ) 2 2 c) Cu / Cu + (0,01 M ) Cu (1 M ) / Cu d) Cu (1 M ) / Cu Cu / Cu (0,01 M ) La propuesta correcta es la b, puesto que se simboliza en el orden en que se produce primero el proceso del ánodo y después el del cátodo. 36*.En el esquema de la figura se muestran 2 pilas electroquímicas referidas al electrodo patrón conectadas a voltímetros con la aguja calibrada al medio de la escala en condiciones estándar. Si V 1 marca -0,76V y V 2-0,13V, podrás decir que la pila formada por las dos hemiceldas de la izquierda conectadas entre sí : a) El voltímetro marcaría 0,89v b) El sentido de la corriente por el circuito externo iría del Pb al Zn c) La reacción redox transcurriría espontáneamente en el sentido Zn ²+ + Pb = Zn + Pb ²+ d) El electrodo del plomo sería el cátodo E 0 del par Pb 2+ /Pb =-0,13V> E 0 Zn 2+ /Zn=-0,76V, por lo tanto el proceso espontáneo será Pb 2+ + Zn -> Zn 2+ + Pb, por lo tanto el Pb 2+ oxida al Zn hasta Zn 2+, reduciéndose él a Pb. El flujo electrónico iría de Zn a Pb, y la corriente tendría sentido contrario. El voltímetro marcaría -0,13V-(- 0,76V)=0,63V. Por lo tanto sólo es incorrecta la propuesta a
6 37*. Sabiendo que la pila Daniell genera 1,1V y considerando el test anterior, en la pila galvánica dada, podrás decir que: a) Se produciría una diferencia de potencial de 0,46V b) El Cu²+ actuaría como reductor c) Los electrones irían del Pb al Cu por el circuito exterior d) El cátodo sería la hemicelda del plomo Se sabe que E 0 del par Pb 2+ /Pb =-0,13V> E 0 Zn 2+ /Zn=-0,76V,mientras que la diferencia de potencial en la pila Daniell (E 0 del par Cu 2+ /Cu) (E 0 Zn 2+ /Zn=-0,76V) =1,1V, de lo que E 0 del par Cu 2+ /Cu=1,1V-0,76V=0,34V. Con estos datos en la pila dada (E 0 del par Cu 2+ /Cu) (E 0 Pb 2+ /Pb=) =0,34V-(-0,13V)=0,46V. por lo tanto el proceso espontáneo será Cu 2+ + Pb -> Pb 2+ + Cu, por lo tanto el Cu 2+ oxida al Pb hasta Pb 2+, reduciéndose él a Cu. El flujo electrónico iría de Pb al Cu. Son correctas las propuestas a y d. 38. Con el esquema de la pila Ag/Pb que te dan, cuyo voltímetro indica 0,93V.y aplicando tus conocimientos anteriores, podrás asegurar que : a) Los electrones irían del plomo a la plata b) El Ag + sería capaz de oxidar al hidrógeno c) La lámina de plata tendería a disolverse d) El potencial normal de reducción o potencial normal redox de la plata para la reacción Ag + + e- = Ag, sería de 0,80V Se sabe que E 0 del par Pb 2+ /Pb =-0,13V, como la pila marca 0,93V, el E 0 del par Ag + /Ag, será 0,93V-0,13V=0,80V, por lo que sería capaz de oxidar al H 2, hasta 2H +, y disolver la lámina de plomo. Son correctas a, b y d. 39. En la pila de concentración de la figura, basada en los electrodos de cobre, el voltímetro marca 81,4mV, y la disolución A de sulfato de cobre(ii), es 1M, por lo tanto dirás que la concentración de la disolución B, será aproximadamente en mol.l -1 : a) 0,001 b) 0,002 c) 0,0001 d) 0,00001 Se sabe que E 0 del par Cu 2+ /Cu = 0,44V. Al aplicar la fórmula de Nernst, que modifica los potenciales en función de la concentración de los reaccionantes 0 0,059 E = E log Q, siendo n los electrones transferidos y Q el cociente n 2 0,059 Cu + de la reacción. En este caso 0, 0814 = log , Despejando Cu + = 10 = 0, 0017 mol. L La propuesta correcta es la b.
7 40*. Si en la pila Daniell, sustituyéramos el electrodo de cinc, por una moneda de plata, en una disolución de nitrato de plata, tal como muestra la figura, dirás que: a) Están mal conectados los bornes al voltímetro, por lo que marcará una diferencia de potencial negativa b) Los electrones pasan por el circuito externo de la lámina de cobre a la moneda de plata c) La hemicelda donde está la lámina de cobre es el cátodo d) La moneda de plata es el polo positivo de la pila Se sabe que E 0 del par Cu 2+ /Cu = 0,44V, mientras que E 0 del par Ag + /Ag =0,80V, lo cual quiere decir que el proceso espontáneo será 2Ag + + Cu -> Cu 2+ + Ag. Los electrones pasarán del Cu al Ag, siendo esta hemicelda, donde se produce la reducción de la Ag+, el cátodo, y polo positivo de la pila. Por lo tanto son correctas las propuestas b y d. El polo positivo de la pila está conectado al borne positivo(rojo) del voltímetro.
8
-0,36-0,44 Zn 2+ +2e Zn -0,76 Mn 2+ +2e Mn -1,19 Al 3+ +3e Al -1,66 Mg 2+ +2e Mg -2,37 Na + +e Na -2,71 K + +e K -2,92 Li + +e Li -3,05
 Redox 2 21*. El número de oxidación, índice de oxidación o estado de oxidación fue definido por primera vez en 1880, por el inglés Otis Coe Johnson, como el número de cargas que un elemento aporta a la
Redox 2 21*. El número de oxidación, índice de oxidación o estado de oxidación fue definido por primera vez en 1880, por el inglés Otis Coe Johnson, como el número de cargas que un elemento aporta a la
de todos los dados el correcto será el: a) A b) B c) C d) D
 Redox 3 41*. Uno de los experimentos que puedes hacer perfectamente en el laboratorio y que te permitiría recordar el proceso de la pila Daniell, sería sumergir una lámina o chapa de cinc en un vaso de
Redox 3 41*. Uno de los experimentos que puedes hacer perfectamente en el laboratorio y que te permitiría recordar el proceso de la pila Daniell, sería sumergir una lámina o chapa de cinc en un vaso de
Redox 7. la única correcta, sería la: a) A b)b c)c d)d
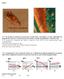 Redox 7 121*. En las fotos se muestra la reacción entre el ácido nítrico concentrado y el cobre, indicándose los productos de la reacción. La observación de las mismas y el ajuste correspondiente, te hará
Redox 7 121*. En las fotos se muestra la reacción entre el ácido nítrico concentrado y el cobre, indicándose los productos de la reacción. La observación de las mismas y el ajuste correspondiente, te hará
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA
 QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
Unidad 6: ELECTROQUIMICA
 Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
OBJETIVOS ESPECÍFICOS. Al finalizar el Tema el estudiante:
 OBJETIVOS ESPECÍFICOS TEMA IV: ELECTROQUÍMICA: Al finalizar el Tema el estudiante: 1.1 Establecerá qué tipo de proceso es el que ocurre en una celda galvánica o pila. 1.2 Identificará los diferentes tipos
OBJETIVOS ESPECÍFICOS TEMA IV: ELECTROQUÍMICA: Al finalizar el Tema el estudiante: 1.1 Establecerá qué tipo de proceso es el que ocurre en una celda galvánica o pila. 1.2 Identificará los diferentes tipos
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
4. Un agente oxidante (2 correctas) A) Toma electrones de otra sustancia B) Da electrones a otra sustancia C) Se oxida D) Se reduce
 CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca
 1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
REACCIONES REDOX (SOLUCIONES)
 Cuestiones y problemas de QuímicaReacciones redox REACCIONES REDOX (SOLUCIONES) 1) SO : S (+); O (). CaH : Ca (+); H (1). K Cr O 7 : K (+1); Cr (+6); O (). H CO : H (+1); C (+); O (). CH O: C (0); H (+1);
Cuestiones y problemas de QuímicaReacciones redox REACCIONES REDOX (SOLUCIONES) 1) SO : S (+); O (). CaH : Ca (+); H (1). K Cr O 7 : K (+1); Cr (+6); O (). H CO : H (+1); C (+); O (). CH O: C (0); H (+1);
Celdas Galvánicas y Electrolíticas
 Celdas Galvánicas y Electrolíticas Reacciones de óxido-reducción Reacciones en las cuales una o más de las sustancias intervinientes modifica su estado de oxidación. Znº (s) + Cu +2 (ac) Zn 2+ (ac) + Cuº
Celdas Galvánicas y Electrolíticas Reacciones de óxido-reducción Reacciones en las cuales una o más de las sustancias intervinientes modifica su estado de oxidación. Znº (s) + Cu +2 (ac) Zn 2+ (ac) + Cuº
Tema 5. Oxidación Reducción. Prof(a). María Angélica Sánchez Palacios
 Tema 5. Oxidación Reducción Prof(a). María Angélica Sánchez Palacios Los procesos electroquímicos consisten en reacciones de oxido-reducción en las cuales: - La energía liberada por una reacción espontánea
Tema 5. Oxidación Reducción Prof(a). María Angélica Sánchez Palacios Los procesos electroquímicos consisten en reacciones de oxido-reducción en las cuales: - La energía liberada por una reacción espontánea
OXIDACIÓN-REDUCCIÓN. PAU-tipos de problemas
 OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
Pilas electroquímicas
 Pilas electroquímicas El nombre de pila procede del apilamiento de monedas de cobre y cinc, que hizo Volta, en 1800. Después del descubrimiento de los reflejos eléctricos de la rana muerta de Galvani,
Pilas electroquímicas El nombre de pila procede del apilamiento de monedas de cobre y cinc, que hizo Volta, en 1800. Después del descubrimiento de los reflejos eléctricos de la rana muerta de Galvani,
Prof(a). María Angélica Sánchez Palacios
 Tema 5. Oxidación Reducción Prof(a). María Angélica Sánchez Palacios Los procesos electroquímicos consisten en reacciones de oxido-reducción en las cuales: - La energía liberada por una reacción espontánea,
Tema 5. Oxidación Reducción Prof(a). María Angélica Sánchez Palacios Los procesos electroquímicos consisten en reacciones de oxido-reducción en las cuales: - La energía liberada por una reacción espontánea,
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX
 TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS REACCIONES DE TRANSFERENCIA DE ELECTRONES
 CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS 2001-2012 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. El KMnO 4, en medio ácido sulfúrico, reacciona con el H 2 O 2 para dar MnSO
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS 2001-2012 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. El KMnO 4, en medio ácido sulfúrico, reacciona con el H 2 O 2 para dar MnSO
Reacciones Redox. Química General e Inorgánica Ingeniería Ambiental
 Reacciones Redox Hasta esta guía hemos aprendido a balancear ecuaciones químicas sencillas por tanteo, pero muchas ecuaciones son demasiado complejas para que este procedimiento de balanceo por tanteo
Reacciones Redox Hasta esta guía hemos aprendido a balancear ecuaciones químicas sencillas por tanteo, pero muchas ecuaciones son demasiado complejas para que este procedimiento de balanceo por tanteo
Tema 9: Reacciones de oxidación-reducción
 Tema 9: Reacciones de oxidación-reducción Proceso de oxidación-reducción. Ajuste de reacciones red-ox. Potencial de electrodo. Celda electroquímica. Esquema de la celda. Potenciales estandar de los electrodos.
Tema 9: Reacciones de oxidación-reducción Proceso de oxidación-reducción. Ajuste de reacciones red-ox. Potencial de electrodo. Celda electroquímica. Esquema de la celda. Potenciales estandar de los electrodos.
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A
Estado de oxidación (E.O.)
 Reacciones Redox Estado de oxidación (E.O.) Es la carga que tendría un átomo si todos sus enlaces fueran iónicos. En el caso de enlaces covalentes polares habría que suponer que la pareja de electrones
Reacciones Redox Estado de oxidación (E.O.) Es la carga que tendría un átomo si todos sus enlaces fueran iónicos. En el caso de enlaces covalentes polares habría que suponer que la pareja de electrones
 REDOX 1. Dada la ecuación redox KMnO 4 + K 2 SO 3 + HCl > MnO 2 + K 2 SO 4 + KCl + H 2 O 1. a) Deduce razonadamente la sustancia oxidante y la reductora, la que oxida y la que se reduce. b) Escribe y ajusta
REDOX 1. Dada la ecuación redox KMnO 4 + K 2 SO 3 + HCl > MnO 2 + K 2 SO 4 + KCl + H 2 O 1. a) Deduce razonadamente la sustancia oxidante y la reductora, la que oxida y la que se reduce. b) Escribe y ajusta
Electroquímica. Cátedra de Geoquímica
 Electroquímica Cátedra de Geoquímica 1 ELECTROQUÍMICA: Parte de la Química que estudia las reacciones en las que hay transferencia de electrones, conocidas como REDOX Dada una reacción: Identificar el
Electroquímica Cátedra de Geoquímica 1 ELECTROQUÍMICA: Parte de la Química que estudia las reacciones en las que hay transferencia de electrones, conocidas como REDOX Dada una reacción: Identificar el
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 008 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 008 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2001 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 001 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 001 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A
PILAS Y ELECTRÓLISIS. Foto: Gabriel Acquistapace
 PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 transparent www.profesorjrc.es REACCIONES DE TRANSFERENCIA DE ELECTRONES 29 de junio de 2016 Números de oxidación Oxidación: Reducción: Átomo o grupo de átomos que pierden e, n.o. Átomo o grupo de átomos
transparent www.profesorjrc.es REACCIONES DE TRANSFERENCIA DE ELECTRONES 29 de junio de 2016 Números de oxidación Oxidación: Reducción: Átomo o grupo de átomos que pierden e, n.o. Átomo o grupo de átomos
OXIDACIÓN-REDUCCIÓN. PAU-tipos de problemas
 OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
QUÍMICA 2º Bachillerato Ejercicios: Electroquímica
 1(8) Ejercicio nº 1 Considera la reacción: Cu(s) + 2Ag + (aq) Cu +2 (aq) + 2Ag(s) a) Escribe las semirreacciones de oxidación y de reducción c) Escribe el esquema de la pila que se puede formar con dicha
1(8) Ejercicio nº 1 Considera la reacción: Cu(s) + 2Ag + (aq) Cu +2 (aq) + 2Ag(s) a) Escribe las semirreacciones de oxidación y de reducción c) Escribe el esquema de la pila que se puede formar con dicha
Reacciones de transferencia de electrones
 DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO Actividades tema 8 Reacciones de transferencia de electrones Reacciones de oxidación-reducción 1.-Asigna el número
DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO Actividades tema 8 Reacciones de transferencia de electrones Reacciones de oxidación-reducción 1.-Asigna el número
REACCIONES DE OXIDACIÓN-REDUCCIÓN
 10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES DE FINAL DE UNIDAD Generales sobre oxidación-reducción 1. Determina los estados de oxidación del azufre en las siguientes sustancias: H 2 S;
10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES DE FINAL DE UNIDAD Generales sobre oxidación-reducción 1. Determina los estados de oxidación del azufre en las siguientes sustancias: H 2 S;
Teoría Redox. Química III medio
 Teoría Redox Química III medio Las reacciones de oxido-reducción son aquellas en las que existe una transferencia de electrones o un cambio en los estados de oxidación de las sustancias que forman parte
Teoría Redox Química III medio Las reacciones de oxido-reducción son aquellas en las que existe una transferencia de electrones o un cambio en los estados de oxidación de las sustancias que forman parte
1. CONCEPTOS DE OXIDACIÓN Y REDUCCIÓN.
 UD. 7 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. CONCEPTOS DE OXIDACIÓN Y REDUCCIÓN. Oxidación: proceso en el que un átomo cede electrones. Reducción: proceso en el que un átomo gana electrones. Oxidante:
UD. 7 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. CONCEPTOS DE OXIDACIÓN Y REDUCCIÓN. Oxidación: proceso en el que un átomo cede electrones. Reducción: proceso en el que un átomo gana electrones. Oxidante:
ELECTROQUÍMICA. 1- Concepto de potencial normal. Electrodo de referencia
 ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
ELECTROQUÌMICA. Zn Zn 2+ (aq) Cu 2+ (aq) Cu
 ELECTROQUÌMICA - Pilas químicas ó voltaicas, producen una corriente continua mediante la utilización de una reacción redox. - Electrólisis, produce una reacción redox por medio de una corriente eléctrica
ELECTROQUÌMICA - Pilas químicas ó voltaicas, producen una corriente continua mediante la utilización de una reacción redox. - Electrólisis, produce una reacción redox por medio de una corriente eléctrica
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA 1 REACIONES DE OXIDACIÓNREDUCCIÓN Son aquellas en las que se produce una transferencia de electrones entre dos sustancias.
REACCIONES DE TRANSFERENCIA DE ELECTRONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA 1 REACIONES DE OXIDACIÓNREDUCCIÓN Son aquellas en las que se produce una transferencia de electrones entre dos sustancias.
RESUMEN DE ELECTROQUÍMICA 2ºBACH
 Toda reacción redox consiste en una transferencia de electrones desde la sustancia que se oxida (reductor)a la que se reduce (oxidante.) Una reacción redox espontánea permite obtener una corriente eléctrica.
Toda reacción redox consiste en una transferencia de electrones desde la sustancia que se oxida (reductor)a la que se reduce (oxidante.) Una reacción redox espontánea permite obtener una corriente eléctrica.
REACCIONES DE OXIDACIÓN-REDUCCIÓN
 10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
TEMA-11 Electroquímica
 QUÍMICA I TEMA-11 Electroquímica Tecnólogo en Minería 1 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos químicos 2 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos
QUÍMICA I TEMA-11 Electroquímica Tecnólogo en Minería 1 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos químicos 2 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos
ELECTROQUÍMICA. Se discutirán en la clase práctica algunos de los siguientes ejercicios de Brown: Capítulo 20: 5, 7, 13, 21, 23, 33, 39, 47, 51
 REPARTIDO 8 ELECTROQUÍMICA 2007 Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Capítulo 20, 723-761 APENDICE E Ejercicios
REPARTIDO 8 ELECTROQUÍMICA 2007 Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Capítulo 20, 723-761 APENDICE E Ejercicios
Cátedra de Geoquímica - Problemas anexos 2012
 ph 1) Calcular el ph de los siguientes sistemas sabiendo que la concentración promedio de iones hidronio en cada caso es: a. Agua de manantial: 1,5 x 10-9 mol/l (Rta.: 8,82) b. Agua geotermal: 8,12 x 10-8
ph 1) Calcular el ph de los siguientes sistemas sabiendo que la concentración promedio de iones hidronio en cada caso es: a. Agua de manantial: 1,5 x 10-9 mol/l (Rta.: 8,82) b. Agua geotermal: 8,12 x 10-8
Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química
 1 Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química 1. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado
1 Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química 1. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado
ELECTROQUÍMICA. 1. Conceptos de oxidación-reducción
 ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno.
 PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
Problemas de electrolisis. Resueltos
 Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
PILAS ELECTROQUIMICAS
 PILAS ELECTROQUIMICAS En las reacciones de redox existe una transferencia de electrones entre en dador (especie que se oxida) y un aceptor (especie que se reduce).esta transferencia de electrones desde
PILAS ELECTROQUIMICAS En las reacciones de redox existe una transferencia de electrones entre en dador (especie que se oxida) y un aceptor (especie que se reduce).esta transferencia de electrones desde
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
Examen de recuperación de la 3ª evaluación de Química de 2º de Bachillerato
 Examen de recuperación de la 3ª evaluación de Química de 2º de Bachillerato Nombre: Fecha: 1. En medio ácido, el ion permanganato (MnO - 4 ) se utiliza como agente oxidante fuerte. Conteste razonadamente
Examen de recuperación de la 3ª evaluación de Química de 2º de Bachillerato Nombre: Fecha: 1. En medio ácido, el ion permanganato (MnO - 4 ) se utiliza como agente oxidante fuerte. Conteste razonadamente
Oxidación y Reducción
 Oxidación y Reducción Un poco de Historia En 1718 Georg Stahl propuso la existencia del Flogisto. Cuando un oxido se calienta en presencia de carbono absorben de la atmosfera al flogisto y al hacer combustión
Oxidación y Reducción Un poco de Historia En 1718 Georg Stahl propuso la existencia del Flogisto. Cuando un oxido se calienta en presencia de carbono absorben de la atmosfera al flogisto y al hacer combustión
CUESTIONES Y PROBLEMAS DEL TEMA 8 (ELECTROQUÍMICA)
 CUESTIONES Y PROBLEMAS DEL TEMA 8 (ELECTROQUÍMICA) 1.- Teniendo en cuenta los potenciales de reducción estándar de los pares E 0 (Cl 2 /Cl - ) = 1 36 V y E 0 (Cu 2+ /Cu) = 0 34 V: a) Escriba la reacción
CUESTIONES Y PROBLEMAS DEL TEMA 8 (ELECTROQUÍMICA) 1.- Teniendo en cuenta los potenciales de reducción estándar de los pares E 0 (Cl 2 /Cl - ) = 1 36 V y E 0 (Cu 2+ /Cu) = 0 34 V: a) Escriba la reacción
GUÍA DE REFUERZO PRUEBA DE SÍSTESIS II SEMESTRE
 Firma Apoderado GUÍA DE REFUERZO PRUEBA DE SÍSTESIS II SEMESTRE Nombre: Curso:11 th Grade Subsector: Química Fecha: Entrega 19 de noviembre Objetivos: Evaluar los contenidos y habilidades desarrollados
Firma Apoderado GUÍA DE REFUERZO PRUEBA DE SÍSTESIS II SEMESTRE Nombre: Curso:11 th Grade Subsector: Química Fecha: Entrega 19 de noviembre Objetivos: Evaluar los contenidos y habilidades desarrollados
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA. 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué?
 REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción A Reserva 3, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción A Reserva 3, Ejercicio 3, Opción
16. El esquema simbólico de la pila anterior de todos los dados : Será el a) A b)b c) C d) D
 Redox 1 1.Un profesor de anatomía de la Universidad de Bolonia, va a realizar entre 1780 y 1786, las experiencias que serán el punto de partida para poder crear lo que sería el primer generador de corriente
Redox 1 1.Un profesor de anatomía de la Universidad de Bolonia, va a realizar entre 1780 y 1786, las experiencias que serán el punto de partida para poder crear lo que sería el primer generador de corriente
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 6, Opción B Reserva 3, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 6, Opción B Reserva 3, Ejercicio 3, Opción
EJERCICIOS RESUELTOS DE REDOX
 EJERCICIOS RESUELTOS DE REDOX 1. Al hacer reaccionar cobre metálico con ácido nítrico diluido se obtiene monóxido de nitrógeno y nitrato de cobre (II). Plantee, iguale y complete la ecuación redox correspondiente,
EJERCICIOS RESUELTOS DE REDOX 1. Al hacer reaccionar cobre metálico con ácido nítrico diluido se obtiene monóxido de nitrógeno y nitrato de cobre (II). Plantee, iguale y complete la ecuación redox correspondiente,
OXIDACIÓN REDUCCIÓN QCA 09 ANDALUCÍA
 OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
Unidad 8 Reacciones de oxidaciónreducción
 Unidad 8 Reacciones de oxidaciónreducción 1. Reacciones de Oxidación: proceso por el cual un reductor pierde electrones. Reducción: proceso por el cual un oxidante gana electrones. 2 2. Número de oxidación
Unidad 8 Reacciones de oxidaciónreducción 1. Reacciones de Oxidación: proceso por el cual un reductor pierde electrones. Reducción: proceso por el cual un oxidante gana electrones. 2 2. Número de oxidación
REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015
 REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015 1- El permanganato de potasio actúa como oxidante en medio ácido, dando como producto Mn 2+. Por el contrario, como oxidante en medio básico el
REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015 1- El permanganato de potasio actúa como oxidante en medio ácido, dando como producto Mn 2+. Por el contrario, como oxidante en medio básico el
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio 6, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio 6, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2016 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 016 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 016 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio, Opción B
QUÍMICA. Tema 8. Reacciones Redox. Electroquímica
 Tema 8. Reacciones Redox. Electroquímica Índice - Concepto de oxidación-reducción - Número de oxidación - Oxidantes y reductores - Potencial normal de reducción - Predicción de reacciones redox Objetivos
Tema 8. Reacciones Redox. Electroquímica Índice - Concepto de oxidación-reducción - Número de oxidación - Oxidantes y reductores - Potencial normal de reducción - Predicción de reacciones redox Objetivos
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. PAU-16M A. Se lleva a cabo la electrolisis de una disolución acuosa de bromuro de sodio 1 M, haciendo pasar una corriente
QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. PAU-16M A. Se lleva a cabo la electrolisis de una disolución acuosa de bromuro de sodio 1 M, haciendo pasar una corriente
Reacciones de Oxidación y reducción
 Reacciones de Oxidación y reducción Introducción Las reacciones de oxidoreducción son aquellas en las que existe una transferencia de electrones o un cambio en los estados de oxidación de las sustancias
Reacciones de Oxidación y reducción Introducción Las reacciones de oxidoreducción son aquellas en las que existe una transferencia de electrones o un cambio en los estados de oxidación de las sustancias
Paso 2: Escribir las correspondientes semireacciones sin ajustar y. Paso 3: Ajustar en cada semireacción todos los elementos a
 Tema 21 21.1. Reacciones de oxidación-reducción Química y electricidad 21.2. Celdas electroquímicas 21.3. Potencial de electrodo 1 2 21.1. Reacciones de oxidación-reducción (redox) Son reacciones de transferencia
Tema 21 21.1. Reacciones de oxidación-reducción Química y electricidad 21.2. Celdas electroquímicas 21.3. Potencial de electrodo 1 2 21.1. Reacciones de oxidación-reducción (redox) Son reacciones de transferencia
Introducción. Concepto de oxidación y reducción Reacciones Ácido base v/s reacciones REDOX. Reacciones de Oxidación y reducción. Oxidación: básica.
 Reacciones de Oxidación y reducción Introducción Las reacciones de oxidoreducción son aquellas en las que existe una transferencia de electrones o un cambio en los estados de oxidación de las sustancias
Reacciones de Oxidación y reducción Introducción Las reacciones de oxidoreducción son aquellas en las que existe una transferencia de electrones o un cambio en los estados de oxidación de las sustancias
7º) En la tabla siguiente se indican los potenciales estándar de distintos pares en disolución acuosa: Fe2+/Fe = - 0,44 V Cu2+/Cu = 0,34 V
 EJERCICIOS DE OXIDACIÓN Y REDUCCIÓN 1º) Ajuste las siguientes ecuaciones iónicas, en medio ácido, por el método del ión-electrón: a) MnO4 + I Mn2+ + I2 b) VO43 + Fe2+ VO2+ + Fe3+ c) Cl2 + I Cl + I2 2º)
EJERCICIOS DE OXIDACIÓN Y REDUCCIÓN 1º) Ajuste las siguientes ecuaciones iónicas, en medio ácido, por el método del ión-electrón: a) MnO4 + I Mn2+ + I2 b) VO43 + Fe2+ VO2+ + Fe3+ c) Cl2 + I Cl + I2 2º)
Tema 9: Electroquímica
 1.Dado el siguiente diagrama de una celda electroquímica: Pt(s) H 2 (g) H + (ac) Ag + (ac) Ag(s) Cual es la reacción global balanceada de la celda? A) 2H + (ac) + 2Ag + (ac) H 2 (g) + 2Ag(s) B) H 2 (g)
1.Dado el siguiente diagrama de una celda electroquímica: Pt(s) H 2 (g) H + (ac) Ag + (ac) Ag(s) Cual es la reacción global balanceada de la celda? A) 2H + (ac) + 2Ag + (ac) H 2 (g) + 2Ag(s) B) H 2 (g)
2 + H2O2 + H2SO4 + 2 H2O
 REDOX. Julio 2017; Opción A; Problema 2.- En presencia de ácido sulfúrico, H 2 SO 4, el sulfato de hierro (II), FeSO 4, reacciona con peróxido de hidrógeno, H 2 O 2, de acuerdo con la siguiente reacción
REDOX. Julio 2017; Opción A; Problema 2.- En presencia de ácido sulfúrico, H 2 SO 4, el sulfato de hierro (II), FeSO 4, reacciona con peróxido de hidrógeno, H 2 O 2, de acuerdo con la siguiente reacción
REACCIONES RED-OX QCA 05
 1.- Se dispone de una pila con dos electrodos de Cu y Ag sumergidos en una disolución 1 M de sus respectivos iones, Cu + y Ag +. Conteste sobre la veracidad o falsedad de las afirmaciones siguientes: a)
1.- Se dispone de una pila con dos electrodos de Cu y Ag sumergidos en una disolución 1 M de sus respectivos iones, Cu + y Ag +. Conteste sobre la veracidad o falsedad de las afirmaciones siguientes: a)
Ejercicios de acceso a la Universidad Problemas de Electroquímica
 Ejercicios de acceso a la Universidad Problemas de Electroquímica 57 Dada la reacción en la que el ión permanganato [tetraoxomanganato(vii)] oxida, en medio ácido, al dióxido de azufre, obteniéndose ión
Ejercicios de acceso a la Universidad Problemas de Electroquímica 57 Dada la reacción en la que el ión permanganato [tetraoxomanganato(vii)] oxida, en medio ácido, al dióxido de azufre, obteniéndose ión
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 15 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 15 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. Indique, razonadamente, si cada una de las siguientes transformaciones es una reacción de oxidación-reducción, identificando, en su caso, el agente oxidante
REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. Indique, razonadamente, si cada una de las siguientes transformaciones es una reacción de oxidación-reducción, identificando, en su caso, el agente oxidante
REACCIONES DE INTERCAMBIO DE ELECTRONES EJERCICIOS PARA RESOLVER
 2010 REACCIONES DE INTERCAMBIO DE ELECTRONES EJERCICIOS PARA RESOLVER Mª Teresa Gómez Ruiz IES Politécnico Cartagena Dpto Física Química 15/09/2010 ÍNDICE Página EJERCICIOS DE ELECTROQUÍMICA (Nª 1 Nª6)
2010 REACCIONES DE INTERCAMBIO DE ELECTRONES EJERCICIOS PARA RESOLVER Mª Teresa Gómez Ruiz IES Politécnico Cartagena Dpto Física Química 15/09/2010 ÍNDICE Página EJERCICIOS DE ELECTROQUÍMICA (Nª 1 Nª6)
6.3.- Electroquímica
 360 Reacciones de transferencia de electrones 6.3.- Electroquímica Aspectos teóricos: Procesos electroquímicos 6.3.1. Procesos electroquímicos. Potenciales de reducción estándar. Celdas galvánicas y electrolíticas.
360 Reacciones de transferencia de electrones 6.3.- Electroquímica Aspectos teóricos: Procesos electroquímicos 6.3.1. Procesos electroquímicos. Potenciales de reducción estándar. Celdas galvánicas y electrolíticas.
Electroquímica UNIDAD XII-B QUIMICA- CPAM. 2017
 Electroquímica UNIDAD XII-B QUIMICA- CPAM. 2017 Electroquímica La electroquímica es la rama de la química que estudia la transformación entre la energía eléctrica y la energía química. Los procesos electroquímicos
Electroquímica UNIDAD XII-B QUIMICA- CPAM. 2017 Electroquímica La electroquímica es la rama de la química que estudia la transformación entre la energía eléctrica y la energía química. Los procesos electroquímicos
Capítulo 7: Reacciones de oxidación-reducción
 Capítulo 7: Reacciones de oxidación-reducción ACTIVIDADES DE RECAPITULACIÓN 1*. Indica, razonadamente, si cada una de las siguientes transformaciones es una reacción redox, identificando, en su caso, el
Capítulo 7: Reacciones de oxidación-reducción ACTIVIDADES DE RECAPITULACIÓN 1*. Indica, razonadamente, si cada una de las siguientes transformaciones es una reacción redox, identificando, en su caso, el
ELECTROQUÍMICA. CELDAS GALVÁNICAS Y CELDAS ELECTROLÍTICAS. Reacciones de óxido reducción. Cambios de la energía libre y criterios de espontaneidad
 ELECTROQUÍMICA. CELDAS GALVÁNICAS Y CELDAS ELECTROLÍTICAS Temas previos: Reacciones de óxido reducción Cambios de la energía libre y criterios de espontaneidad REACCIONES DE OXIDO-REDUCCIÓN Oxidación:
ELECTROQUÍMICA. CELDAS GALVÁNICAS Y CELDAS ELECTROLÍTICAS Temas previos: Reacciones de óxido reducción Cambios de la energía libre y criterios de espontaneidad REACCIONES DE OXIDO-REDUCCIÓN Oxidación:
Oxidación-Reducción. Oxidantes y reductores
 OxidaciónReducción Inicialmente estos conceptos se relacionaban con la cantidad de oxígeno, así la oxidación comenzó a usarse para indicar que un compuesto incrementaba la proporción de átomos de este,
OxidaciónReducción Inicialmente estos conceptos se relacionaban con la cantidad de oxígeno, así la oxidación comenzó a usarse para indicar que un compuesto incrementaba la proporción de átomos de este,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA QUÍMICA TEMA 7: REACCIONES REDOX.
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 7: REACCIONES REDOX http://emestrada.wordpress.com Dada la siguiente reacción redox en disolución acuosa: KMnO + KI + HSO I + MnSO + K SO + HO
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 7: REACCIONES REDOX http://emestrada.wordpress.com Dada la siguiente reacción redox en disolución acuosa: KMnO + KI + HSO I + MnSO + K SO + HO
Unidad II: Eje : Electroquímica y almacenamiento de energía
 Unidad II: Eje : Electroquímica y almacenamiento de energía En tu netbook, en Escritorio del Alumno Actividades Física y Química Clases de reacciones químicas. Realiza una lectura comprensiva. Y luego,
Unidad II: Eje : Electroquímica y almacenamiento de energía En tu netbook, en Escritorio del Alumno Actividades Física y Química Clases de reacciones químicas. Realiza una lectura comprensiva. Y luego,
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA
 QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
PILAS ELECTROQUÍMICAS
 PILAS ELECTROQUÍMICAS Las pilas electroquímicas se llaman también células galvánicas, células electroquímicas, pilas galvánicas, pilas voltaicas, pilas eléctricas o, simplemente, pilas. Como ya hemos visto,
PILAS ELECTROQUÍMICAS Las pilas electroquímicas se llaman también células galvánicas, células electroquímicas, pilas galvánicas, pilas voltaicas, pilas eléctricas o, simplemente, pilas. Como ya hemos visto,
TEMA - 9. DATOS: R = 0,082 atm L K. (Sol: b) 0.05 M;; c) V = 28 ml)
 TEMA - 9 1.- El análisis químico del agua oxigenada (peróxido de hidrógeno), se realiza disolviendo la muestra en ácido sulfúrico diluido y valorando con una disolución de permanganato potásico, según
TEMA - 9 1.- El análisis químico del agua oxigenada (peróxido de hidrógeno), se realiza disolviendo la muestra en ácido sulfúrico diluido y valorando con una disolución de permanganato potásico, según
QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS
 1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
Unidad 7 Redox. La ecuación iónica sin ajustar con los números de oxidación:
 OPCIÓN A Unidad 7 Redox 1. Indique cual es el oxidante y cual es el reductor en los siguientes procesos de oxidación-reducción, sin ajustar: (2 p) El oxidante será aquel elemento que gane electrones (se
OPCIÓN A Unidad 7 Redox 1. Indique cual es el oxidante y cual es el reductor en los siguientes procesos de oxidación-reducción, sin ajustar: (2 p) El oxidante será aquel elemento que gane electrones (se
Tema 3. Termodinámica de Procesos Electroquímicos
 Tema 3. Termodinámica de Procesos Electroquímicos 1.- Iones en disolución 2.- Reacciones Redox 3.- Celdas Electroquímicas 4.- Potencial de una celda. Ecuación de Nerst 5.- Ejemplos de Procesos Electroquímicos
Tema 3. Termodinámica de Procesos Electroquímicos 1.- Iones en disolución 2.- Reacciones Redox 3.- Celdas Electroquímicas 4.- Potencial de una celda. Ecuación de Nerst 5.- Ejemplos de Procesos Electroquímicos
Zn 2e Zn +2 proceso de oxidación Ánodo Polo negativo. Cu e Cu proceso de reducción Cátodo Polo positivo. Zn + Cu +2 Zn+2 + Cu
 Tema 4(II).PILAS Y CELDAS ELECTROLÍTICAS PILAS GALVÁNICAS Los procesos redox son procesos de transferencia de electrones. Podemos aprovechar tales procesos para producir corriente eléctrica si conseguimos
Tema 4(II).PILAS Y CELDAS ELECTROLÍTICAS PILAS GALVÁNICAS Los procesos redox son procesos de transferencia de electrones. Podemos aprovechar tales procesos para producir corriente eléctrica si conseguimos
47. El esquema simbólico de la pila anterior de todos los dados:
 Redox 3 41*. Uno de los experimentos que puedes hacer perfectamente en el laboratorio y que te permitiría recordar el proceso de la pila Daniell, sería sumergir una lámina o chapa de cinc en un vaso de
Redox 3 41*. Uno de los experimentos que puedes hacer perfectamente en el laboratorio y que te permitiría recordar el proceso de la pila Daniell, sería sumergir una lámina o chapa de cinc en un vaso de
MODELO DE EXAMEN DE QUIMICA (25 AÑOS) INSTRUCCIONES PREGUNTAS
 MODELO DE EXAMEN DE QUIMICA (25 AÑOS) INSTRUCCIONES a. El examen de química consistirá en 30 preguntas de tipo test b. La duración del examen será de 1,5 horas. c. Sólo hay que elegir una respuesta por
MODELO DE EXAMEN DE QUIMICA (25 AÑOS) INSTRUCCIONES a. El examen de química consistirá en 30 preguntas de tipo test b. La duración del examen será de 1,5 horas. c. Sólo hay que elegir una respuesta por
