Resumen. Teratogenicidad. Trastornos neuropsiquiátricos. 19 de septiembre de Estimado Profesional Sanitario:
|
|
|
- Nieves Bustos Crespo
- hace 5 años
- Vistas:
Transcripción
1 19 de septiembre de 2018 Retinoides ( Acitretina, Adapaleno, Alitretinoína, Bexaroteno, Isotretinoína, Tazaroteno y Tretinoína): Actualización de los efectos teratogénicos y trastornos neuropsiquiátricos Estimado Profesional Sanitario: Los laboratorios abajo firmantes, según lo acordado con la Agencia Europea de Medicamentos (EMA) y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), desean poner en su conocimiento la siguiente información: Resumen Teratogenicidad Los retinoides orales son altamente teratogénicos y no deben utilizarse durante el embarazo. Los retinoides orales, acitretina, alitretinoína e isotretinoína deben utilizarse según las condiciones de un Plan de Prevención de Embarazos (PPE) en toda mujer con capacidad de gestación. Antes de prescribir acitretina, alitretinoína o isotretinoína informe a la paciente de los riesgos que conllevan los medicamentos que contienen retinoides orales, utilizando los materiales informativos sobre seguridad que han sido revisados y optimizados. Como medida de precaución, los retinoides tópicos también están contraindicados, tanto en mujeres embarazadas como en mujeres que estén planificando un embarazo. Trastornos neuropsiquiátricos Se han notificado, en raras ocasiones, casos de depresión, empeoramiento de la depresión-ansiedad y alteraciones del estado de ánimo en pacientes tratados con retinoides orales. Informe a los pacientes en tratamiento con retinoides orales de que pueden experimentar cambios en su estado de ánimo y/o comportamiento, y que tanto ellos como sus familiares deben de estar atentos a ello e informar a su médico si esto ocurriera. Vigile la aparición de signos y síntomas de depresión en todos los pacientes tratados con retinoides orales y, en caso necesario, derívelos al especialista correspondiente para que reciban el tratamiento apropiado. Preste especial atención cuando se trate de pacientes con antecedentes de depresión. Antecedentes de seguridad Los medicamentos que contienen retinoides están disponibles en formas farmacéuticas orales y tópicas y se utilizan para tratar diversas formas de acné, eccema crónico grave de las manos que no responde al tratamiento con corticosteroides, formas graves de psoriasis y trastornos de la queratinización. Tretinoína también puede utilizarse para tratar la leucemia promielocítica, y el bexaroteno se utiliza para el tratamiento de las manifestaciones cutáneas de linfoma cutáneo de
2 células T en estados avanzados. Tras una reciente y exhaustiva revisión de toda la información relevante, el Comité para la Evaluación de Riesgos en Europeo (PRAC) ha recomendado reforzar la información relativa a teratogenicidad y trastornos neuropsiquiátricos que se ha de proporcionar a pacientes y profesionales sanitarios (ficha técnica, prospecto y materiales informativos sobre seguridad). Riesgo teratogénico Los retinoides orales (acitretina, alitretinoína, bexaroteno, isotretinoína y tretinoína) son altamente teratógenos. El uso de acitretina, alitretinoína e isotretinoína en mujeres con capacidad de gestación, está sujeto a las condiciones del Plan de Prevención de Embarazos (PPE). En relación al bexaroteno y tretinoína oral, se considera que, debido tanto por sus indicaciones oncológicas que requieren atención hospitalaria especializada como al perfil de los pacientes en tratamiento, las medidas existentes en la actualidad son adecuadas y no es necesaria la implementación de un PPE. Esta revisión también evaluó la información disponible sobre la seguridad de la utilización de los retinoides tópicos durante el embarazo (adapaleno, alitretinoína, isotretinoína, tazaroteno y tretinoína). Los datos disponibles muestran que la exposición sistémica tras la aplicación tópica es mínima, por lo tanto es improbable que se produzcan efectos adversos en el feto. No obstante, también se señala que el ser humano es de las especies más sensibles a la toxicidad por retinoides. Se concluye por lo tanto, que el uso de retinoides tópicos debe contraindicarse durante el embarazo y en mujeres que estén planificando un embarazo como medida de precaución. Trastornos neuropsiquiátricos Se han notificado casos de depresión, empeoramiento de la depresión-ansiedad y alteraciones del estado de ánimo en pacientes tratados con retinoides orales. La evidencia de la que disponemos a través de la bibliografía publicada y de las notificaciones de casos individuales de sospechas de reacciones adversas, indica que los resultados de los estudios son inconsistentes entre ellos y que los estudios publicados tienen limitaciones. Por tanto, no ha sido posible identificar un aumento de riesgo claro en lo referido a trastornos neuropsiquiátricos en personas tratadas con retinoides orales en comparación con las que no están en tratamiento. Asimismo, se sabe que los pacientes con trastornos cutáneos graves tienen de por si un mayor riesgo de padecer trastornos psiquiátricos. Se recomienda informar a los pacientes tratados con retinoides orales sobre la posibilidad de experimentar cambios en su estado de ánimo y en su comportamiento, y que deben informar a su médico si esto sucede. Cualquier paciente que muestre signos de depresión debe derivarse al especialista pertinente para que reciba tratamiento si fuera necesario. Debe prestarse especial atención a los pacientes con antecedentes de depresión tratados con retinoides orales. Es necesario vigilar la aparición de signos de depresión en todos los pacientes. Esta revisión también evaluó la información disponible sobre retinoides tópicos, concluyéndose que tras la aplicación tópica la exposición sistémica es mínima haciendo improbable que se produzca riesgo de trastornos psiquiátricos (adapaleno, alitretinoína, isotretinoína, tazaroteno y tretinoína). Las fichas técnicas y los prospectos se actualizarán para incluir los resultados de esta revisión. Los materiales informativos sobre seguridad de los retinoides orales (acitretina, alitretinoína e isotretinoína) van a actualizarse y a distribuirse a los profesionales sanitarios.
3 En el anexo a esta comunicación encontrará información más detallada sobre el Programa de Prevención de Embarazos para estos medicamentos. Notificación de sospechas de reacciones adversas Se recuerda la importancia de notificar las sospechas de reacciones adversas asociadas a los medicamentos tras su autorización; ello permite realizar una supervisión continuada de la relación beneficio/riesgo del producto. Puede notificar las sospechas de reacciones adversas al Centro Autonómico de correspondiente mediante el sistema de tarjeta amarilla ( _serfv.pdf) o a través del formulario electrónico disponible en Adicionalmente, las sospechas de reacciones adversas relacionadas con un principio activo del grupo de los retinoides podrán comunicarse a través del Departamento de del laboratorio titular de la autorización de comercialización correspondiente en cada caso concreto. En cuanto a los retinoides orales: Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Los medicamentos que contienen retinoides tópicos no están sujetos a seguimiento adicional. Puntos de contacto de las compañías farmacéuticas Si desea realizar alguna pregunta o requiere información adicional, puede ponerse en contacto con las unidades de de los Laboratorios detallados en la siguiente tabla: # Empresa Persona de contacto Nombre del medicamento Correo electrónico Teléfono 1 Aurovitas Spain, U. Mercedes Cerezo Capilla Responsable Local de Neotigason (acitretina) Mercedes.cerezo@aurobindo.com Tlfn (+34) Mylan IRE Healthcare Limited Mariona Lería Gelabert Persona de Contacto de Local y l Departamento Médico Treclinac (clindamicina y tretinoína) phvg.spain@mylan.com Tel.:
4 3 Isdin Daniel Edo Isdiben (isotretinoina) Tel.: Alfasigma España, S.L. Mireia Iglesias Responsable Local de Mayesta (isotretinoína).es@alfasigma.com Tel.: Ferrer internacional, Albert Garcia Retirides (tretinoína) pharmacovigilance@ferrer.com Tel.: Laboratorios Viñas, Maria Cleofé Zaragozá Jiménez Suplente de Acnemin (isotretinoína) stecnica@vinas.es Tel.: Laboratorios Ranbaxy, S.L. Rosa Orihuela Responsable local de Isotretinoína SUN rosa.orihuela@sunpharma.com Tel.: Pierre Fabre Ibérica, Antonio Conesa Isoacne (isotretinoína) farmacovigilancia@pierre-fabre.es Tel.: Especialidades Farmacéuticas Centrum Marina Pórcel Quiles Flexresan (isotretinoína) farmacovigilancia@asac.net Tel:
5 Differine (adapaleno) 10 Laboratorios Galderma Victoria Bonne Director Médico y Responsable local de Epiduo (adapaleno y peróxido de benzoilo) Tactuoben (adapaleno y peróxido de benzoilo) medicalspain@galderma.com Tel: Industrial Farmacéutica Cantabria, Marta Domínguez Dercutane (isotretinoína) Acitretina IFC Neocare (tretinoína) marta.dominguez@cantabrialabs.es Telf: Stiefel Pilar Diego Saiz Toctino (alitretinoína) unidad.farmacovigilancia@gsk.com Tel: Anexo- Condiciones del PPE para los retinoides orales acitretina, alitretinoína e isotretinoína. El Plan de Prevención de Embarazos para retinoides orales se ha armonizado y optimizado para proporcionar información clara y concisa tanto para los profesionales sanitarios como para las pacientes. El uso de acitretina, alitretinoína e isotretinoína en mujeres con capacidad de gestación, ha de hacerse siguiendo las indicaciones del Plan de Prevención de Embarazos. Las condiciones del Plan de Prevención de Embarazos exigen a los médicos que garanticen que cada mujer tratada con retinoides orales entienda que estos suponen un riesgo para el feto y que no deben tomarse durante el embarazo. Toda mujer con capacidad de gestación en tratamiento debe utilizar métodos anticonceptivos eficaces ininterrumpidamente durante al menos un mes antes de iniciar la terapia, durante la duración de la misma y hasta 1 mes después de la interrupción de esta para alitretionína e isotretinoína (hasta 3 años para acitretina). La mujer entiende y acepta la necesidad de realizar seguimiento/pruebas de embarazo periódicas, antes, durante el tratamiento (idealmente cada mes) y hasta 1 mes después de la interrupción del mismo para alitretinoína e isotretinoína (para acitretina cada 1-3 meses durante los 3 años siguientes a la interrupción del tratamiento). La mujer debe interrumpir inmediatamente el tratamiento con acitretina, alitretinoína o isotretinoína e informar urgentemente a su médico si se queda embarazada o piensa que pudiera estarlo.
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Anexo III Enmiendas a las secciones relevantes de la información del producto
 Anexo III Enmiendas a las secciones relevantes de la información del producto Nota: Estas enmiendas a las secciones relevantes de la información del producto son el resultado de un procedimiento de arbitraje.
Anexo III Enmiendas a las secciones relevantes de la información del producto Nota: Estas enmiendas a las secciones relevantes de la información del producto son el resultado de un procedimiento de arbitraje.
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Toctino (alitretinoína)
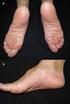 1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
 ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 [ D] Guía del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
[ D] Guía del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), junio 2015 Disponible en
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), junio 2015 Disponible en
Comunicación dirigida a Profesionales Sanitarios
 Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
Anexo III. Modificaciones en las secciones relevantes de la información del producto
 Anexo III Modificaciones en las secciones relevantes de la información del producto Nota: Estas modificaciones de las secciones relevantes de la Ficha Técnica y Prospecto son el resultado del proceso de
Anexo III Modificaciones en las secciones relevantes de la información del producto Nota: Estas modificaciones de las secciones relevantes de la Ficha Técnica y Prospecto son el resultado del proceso de
Toctino (alitretinoína)
 1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS. Esther Salgueiro 10, 17 de Marzo de 2015
 FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
Comunicación dirigida a profesionales sanitarios
 Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS
 Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Entero-Silicona 9 mg/ml emulsión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de emulsión oral contiene:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Entero-Silicona 9 mg/ml emulsión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de emulsión oral contiene:
Anexo III. Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto
 Anexo III Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto Nota: Esta Ficha Técnica, Etiquetado y Prospecto son el resultado del proceso de arbitraje.
Anexo III Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto Nota: Esta Ficha Técnica, Etiquetado y Prospecto son el resultado del proceso de arbitraje.
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO
 ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII)
 Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII) Puede consultar esta información en formato PDF COMUNICACIÓN SOBRE RIESGOS DE MEDICAMENTOS
Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII) Puede consultar esta información en formato PDF COMUNICACIÓN SOBRE RIESGOS DE MEDICAMENTOS
Valdoxan /Thymanax (agomelatina)
 Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto
 ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto Nota: Si procede, la ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados
ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto Nota: Si procede, la ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
FICHA TÉCNICA. Excipientes con efecto conocido: Cada comprimido contiene: 200 mg de sacarosa y 240 mg de sorbitol (E-420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Simeticona Normon 40 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona... 40 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Simeticona Normon 40 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona... 40 mg Excipientes con efecto conocido:
FORMULARIO DE CONSENTIMIENTO INFORMADO PARA MUJERES CON POSIBILIDAD DE QUEDAR EMBARAZADAS
 FORMULARIO DE CONSENTIMIENTO INFORMADO PARA MUJERES CON POSIBILIDAD DE QUEDAR EMBARAZADAS Lenalinova (Lenalidomida) puede ser perjudicial para el feto. nacimiento graves que pueden poner en peligro la
FORMULARIO DE CONSENTIMIENTO INFORMADO PARA MUJERES CON POSIBILIDAD DE QUEDAR EMBARAZADAS Lenalinova (Lenalidomida) puede ser perjudicial para el feto. nacimiento graves que pueden poner en peligro la
RELACION DE MEDICAMENTOS DE ESPECIAL CONTROL MEDICO CON SUS INDICACIONES
 ACITRETINA 74727 IFC 10 mg CA Nº REG: 74727 CN: 684171 ACITRETINA IFC 10MG 30 CAPSULAS DURAS EFG Formas graves y generalizadas de psoriasis refractarias; Psoriasis pustulosa de las manos y pies; Ictiosis
ACITRETINA 74727 IFC 10 mg CA Nº REG: 74727 CN: 684171 ACITRETINA IFC 10MG 30 CAPSULAS DURAS EFG Formas graves y generalizadas de psoriasis refractarias; Psoriasis pustulosa de las manos y pies; Ictiosis
Comunicación dirigida a profesionales sanitarios
 Comunicación dirigida a profesionales sanitarios Bendamustina (Levact, Bendamustina Accord, Bendamustina Dr. Reddys, Bendamustina Intas): aumento de la mortalidad observado en estudios clínicos recientes
Comunicación dirigida a profesionales sanitarios Bendamustina (Levact, Bendamustina Accord, Bendamustina Dr. Reddys, Bendamustina Intas): aumento de la mortalidad observado en estudios clínicos recientes
Restricciones de dispensación para isotretinoína
 Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
Comunicación dirigida a profesionales sanitarios
 Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS MICOFENOLATO*: NUEVAS RECOMENDACIONES SOBRE LA PREVENCIÓN DE EMBARAZOS.
 COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS MICOFENOLATO*: NUEVAS RECOMENDACIONES SOBRE LA PREVENCIÓN DE EMBARAZOS. Estimado profesional sanitario, 22 de enero de 2018 Los laboratorios farmacéuticos
COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS MICOFENOLATO*: NUEVAS RECOMENDACIONES SOBRE LA PREVENCIÓN DE EMBARAZOS. Estimado profesional sanitario, 22 de enero de 2018 Los laboratorios farmacéuticos
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL
 MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
BREAKYL PELÍCULA BUCAL (CITRATO DE FENTANILO)
 BREAKYL PELÍCULA BUCAL (CITRATO DE FENTANILO) Información importante sobre seguridad dirigida a profesionales sanitarios Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
BREAKYL PELÍCULA BUCAL (CITRATO DE FENTANILO) Información importante sobre seguridad dirigida a profesionales sanitarios Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
ALERTA RÁPIDA EUROPEA DEL MEDICAMENTO VETERINARIO VELACTIS
 Sanitarios AEMPS ALERTA RÁPIDA EUROPEA DEL MEDICAMENTO VETERINARIO VELACTIS Fecha de publicación: 1 de julio de 2016 Categoría: MEDICAMENTOS VETERINARIOS, SEGURIDAD. Referencia: MVET, 5/2016 Suspensión
Sanitarios AEMPS ALERTA RÁPIDA EUROPEA DEL MEDICAMENTO VETERINARIO VELACTIS Fecha de publicación: 1 de julio de 2016 Categoría: MEDICAMENTOS VETERINARIOS, SEGURIDAD. Referencia: MVET, 5/2016 Suspensión
farmacéutico Instanyl (Fentanilo) Informacion sobre seguridad para el INSTANYL SOLUCIÓN PARA PULVERIZACIÓN NASAL
 Instanyl (Fentanilo) Informacion sobre seguridad para el farmacéutico EN ENVASE UNIDOSIS Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
Instanyl (Fentanilo) Informacion sobre seguridad para el farmacéutico EN ENVASE UNIDOSIS Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO
 TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización.
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización. Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización. Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Algoritmos Terapéuticos en Acné. Dra. Minerva Gómez Flores
 Algoritmos Terapéuticos en Acné Dra. Minerva Gómez Flores Conjunto de pasos sistematizados destinados a resolver una situación Algoritmo Niveles de Evidencia 1: Fuerte evidencia, obtenida de revisiones
Algoritmos Terapéuticos en Acné Dra. Minerva Gómez Flores Conjunto de pasos sistematizados destinados a resolver una situación Algoritmo Niveles de Evidencia 1: Fuerte evidencia, obtenida de revisiones
LEFLUNOMIDA. Información sobre seguridad para los profesionales sanitarios
 LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
Farmacovigilancia. Curso de Diplomado en Sanidad
 Farmacovigilancia Curso de Diplomado en Sanidad 2010 FARMACOVIGILANCIA Conjunto de procedimientos de detección, registro y evaluación de las reacciones adversas, para la determinación de su incidencia,
Farmacovigilancia Curso de Diplomado en Sanidad 2010 FARMACOVIGILANCIA Conjunto de procedimientos de detección, registro y evaluación de las reacciones adversas, para la determinación de su incidencia,
FICHA TÉCNICA. Cada gramo contiene 40 mg de peróxido de benzoílo como peróxido de benzoílo acuoso.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Solucel 40 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo contiene 40 mg de peróxido de benzoílo como peróxido de benzoílo acuoso. Excipientes con
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Solucel 40 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo contiene 40 mg de peróxido de benzoílo como peróxido de benzoílo acuoso. Excipientes con
Traducción no oficial del prospecto en alemán
 Traducción no oficial del prospecto en alemán Prospecto: información para el paciente Información para usuarios Medivitan iv Jeringa Precargada 5 mg, 1 mg, 1,05 mg solución inyectable Principios activos:
Traducción no oficial del prospecto en alemán Prospecto: información para el paciente Información para usuarios Medivitan iv Jeringa Precargada 5 mg, 1 mg, 1,05 mg solución inyectable Principios activos:
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA
 Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
FICHA TÉCNICA. Alivio de los síntomas del dolor agudo de garganta en adultos y niños mayores de 6 años.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor menta amilmetacresol / alcohol dichlorobencílico Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor miel y limón
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor menta amilmetacresol / alcohol dichlorobencílico Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor miel y limón
1. Qué es Ultra Levura y para qué se utiliza.
 Introducción Prospecto: información para el paciente Ultra Levura 250 mg cápsulas duras Saccharomyces boulardii Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Introducción Prospecto: información para el paciente Ultra Levura 250 mg cápsulas duras Saccharomyces boulardii Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
JORNADA INFORMATIVA RD FARMACOVIGILANCIA 577/213
 JORNADA INFORMATIVA RD FARMACOVIGILANCIA 577/213 INFORMACIÓN Y COMUNICACIÓN DE LA AEMPS SOBRE SEGURIDAD DE MEDICAMENTOS 30 de septiembre de 2013 Alfonso Rodríguez Pascual División de Farmacoepidemiología
JORNADA INFORMATIVA RD FARMACOVIGILANCIA 577/213 INFORMACIÓN Y COMUNICACIÓN DE LA AEMPS SOBRE SEGURIDAD DE MEDICAMENTOS 30 de septiembre de 2013 Alfonso Rodríguez Pascual División de Farmacoepidemiología
Prospecto: información para el usuario. ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico
 Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España
 Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
Prospecto: información para el usuario. ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico
 Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Lea todo el prospecto detenidamente antes de que se le administre este medicamento porque contiene información importante para usted.
 PROSPECTO: INFORMACION PARA EL USUARIO Indio ( 111 In) oxina Mallinckrodt 37 MBq/ml precursor radiofarmacéutico en solución Oxinato de indio ( 111 In) Lea todo el prospecto detenidamente antes de que se
PROSPECTO: INFORMACION PARA EL USUARIO Indio ( 111 In) oxina Mallinckrodt 37 MBq/ml precursor radiofarmacéutico en solución Oxinato de indio ( 111 In) Lea todo el prospecto detenidamente antes de que se
FICHA TÉCNICA. 1 ml de solución contiene 3 mg de hipromelosa y 5,5 mg de cloruro de sodio.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO COLIRCUSÍ HUMECTANTE 3 mg/ml + 5,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 3 mg de hipromelosa y 5,5 mg de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO COLIRCUSÍ HUMECTANTE 3 mg/ml + 5,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 3 mg de hipromelosa y 5,5 mg de
FICHA TÉCNICA. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
Toctino (alitretinoína)
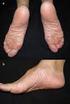 1 PROGRAMA DE PREVENCIÓN DEL EMBARAZO Información sobre la anticoncepción PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
1 PROGRAMA DE PREVENCIÓN DEL EMBARAZO Información sobre la anticoncepción PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
Ficha técnica Página 1
 1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
Prospecto: información para el usuario. Zovirax 30 mg/g pomada oftálmica Aciclovir
 Prospecto: información para el usuario Zovirax 30 mg/g pomada oftálmica Aciclovir Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Zovirax 30 mg/g pomada oftálmica Aciclovir Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACFOL 5MG COMPRIMIDOS ÁCIDO FÓLICO
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ACFOL 5MG COMPRIMIDOS ÁCIDO FÓLICO Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto ya que puede tener que volver
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACFOL 5MG COMPRIMIDOS ÁCIDO FÓLICO Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto ya que puede tener que volver
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
EchinaMed gotas orales en solución
 EchinaMed gotas orales en solución PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para
EchinaMed gotas orales en solución PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para
Anexo III. Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto
 Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
FICHA TÉCNICA. Posología Administrar cuando sea necesario, o según criterio médico. Como norma general administrar:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Citrato/Lauril sulfoacetato 450 mg/ 45 mg solución rectal Citrato de sodio / Lauril sulfoacetato de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Citrato/Lauril sulfoacetato 450 mg/ 45 mg solución rectal Citrato de sodio / Lauril sulfoacetato de sodio 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por
Prospecto: información para el usuario. Prospantus Jarabe en sobres Extracto seco de Hedera helix L. (hiedra)
 Prospecto: información para el usuario Prospantus Jarabe en sobres Extracto seco de Hedera helix L. (hiedra) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento porque contiene
Prospecto: información para el usuario Prospantus Jarabe en sobres Extracto seco de Hedera helix L. (hiedra) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento porque contiene
INSTRUCCIONES PARA EL USO DE LA GUÍA
 INSTRUCCIONES PARA EL USO DE LA GUÍA La presente Guía pretende ser una herramienta de consulta rápida para el médico prescriptor y otros profesionales sanitarios. Para su correcta interpretación deben
INSTRUCCIONES PARA EL USO DE LA GUÍA La presente Guía pretende ser una herramienta de consulta rápida para el médico prescriptor y otros profesionales sanitarios. Para su correcta interpretación deben
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Prospecto: información para el usuario. Tactuoben 1 mg/g + 25 mg/g gel Adapaleno /Peróxido de Benzoilo
 Prospecto: información para el usuario Tactuoben 1 mg/g + 25 mg/g gel Adapaleno /Peróxido de Benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el usuario Tactuoben 1 mg/g + 25 mg/g gel Adapaleno /Peróxido de Benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el paciente. Ultra Levura 250 mg granulado para suspensión oral. Saccharomyces boulardii
 Prospecto: información para el paciente Ultra Levura 250 mg granulado para suspensión oral Saccharomyces boulardii Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
Prospecto: información para el paciente Ultra Levura 250 mg granulado para suspensión oral Saccharomyces boulardii Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Maria Teresa Herdeiro Adolfo Figueiras
 Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Adolfo Figueiras Reacción Adversa a Medicamento cualquier respuesta a un medicamento que sea nociva y no intencionada
Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Adolfo Figueiras Reacción Adversa a Medicamento cualquier respuesta a un medicamento que sea nociva y no intencionada
Notificación de acontecimientos adversos en Ensayos clínicos. 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica.
 Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
INSTRUCTIVO EXTERNO PLAN DE FARMACOVIGILANCIA PARA PRODUCTOS NATURALES PROCESADOS DE USO MEDICINAL.
 INSTRUCTIVO EXTERNO PLAN DE FARMACOVIGILANCIA PARA PRODUCTOS NATURALES PROCESADOS DE USO MEDICINAL. Versión [1.0] Coordinación General Técnica de Certificaciones Dirección Técnica de Registro Sanitario,
INSTRUCTIVO EXTERNO PLAN DE FARMACOVIGILANCIA PARA PRODUCTOS NATURALES PROCESADOS DE USO MEDICINAL. Versión [1.0] Coordinación General Técnica de Certificaciones Dirección Técnica de Registro Sanitario,
Capítulo 10 SEGURIDAD VACUNAL Y VIGILANCIA DE EFECTOS ADVERSOS DE LA VACUNACIÓN
 Capítulo 10 SEGURIDAD VACUNAL Y VIGILANCIA DE EFECTOS ADVERSOS DE LA VACUNACIÓN 10.1. EFECTOS ADVERSOS ASOCIADOS A LAS VACUNAS Las vacunas son productos biológicos compuestos por antígeno/s (único o múltiples)
Capítulo 10 SEGURIDAD VACUNAL Y VIGILANCIA DE EFECTOS ADVERSOS DE LA VACUNACIÓN 10.1. EFECTOS ADVERSOS ASOCIADOS A LAS VACUNAS Las vacunas son productos biológicos compuestos por antígeno/s (único o múltiples)
FICHA TECNICA. HIDROCORTISONA PENSA Crema Hidrocortisona
 FICHA TECNICA HIDROCORTISONA PENSA Crema Hidrocortisona 1. NOMBRE DEL MEDICAMENTO HIDROCORTISONA PENSA Crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 100 g contienen: Hidrocortisona (DCI)...0,5 g.
FICHA TECNICA HIDROCORTISONA PENSA Crema Hidrocortisona 1. NOMBRE DEL MEDICAMENTO HIDROCORTISONA PENSA Crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 100 g contienen: Hidrocortisona (DCI)...0,5 g.
Prospecto: información para el usuario. Sal de fruta ENO polvo efervescente sabor naranja
 PROSPECTO 1 Prospecto: información para el usuario Sal de fruta ENO polvo efervescente sabor naranja Hidrogenocarbonato de sodio, ácido cítrico anhidro, carbonato de sodio anhidro. Lea todo el prospecto
PROSPECTO 1 Prospecto: información para el usuario Sal de fruta ENO polvo efervescente sabor naranja Hidrogenocarbonato de sodio, ácido cítrico anhidro, carbonato de sodio anhidro. Lea todo el prospecto
Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO bucomax pastillas para chupar sabor menta bucomax pastillas para chupar sabor fresa bucomax pastillas para chupar sabor miel y limón 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
1. NOMBRE DEL MEDICAMENTO bucomax pastillas para chupar sabor menta bucomax pastillas para chupar sabor fresa bucomax pastillas para chupar sabor miel y limón 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
CINFAMUCOL ACETILCISTEÍNA 200mg
 CINFAMUCOL ACETILCISTEÍNA 200mg PROSPECTO Acetilcisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. - Conserve este
CINFAMUCOL ACETILCISTEÍNA 200mg PROSPECTO Acetilcisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. - Conserve este
FICHA TÉCNICA. Población pediátrica No se ha establecido la seguridad y eficacia de Sebiprox en niños menores de 12 años. No hay datos disponibles.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Sebiprox 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 100 g de champú contienen 1,5 g de ciclopirox olamina (15 mg/g). Contiene 0,01 mg/g de dipropilenglicol.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Sebiprox 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 100 g de champú contienen 1,5 g de ciclopirox olamina (15 mg/g). Contiene 0,01 mg/g de dipropilenglicol.
FICHA TÉCNICA. Adultos y adolescentes mayores de 12 años: de 250 a 500 mg al día distribuidos en dos tomas (mañana y noche)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
Farmacovigilancia. Tipos de RAM. Morbilidad y mortalidad asociada al consumo de medicamentos.
 Notificación Espontánea de Reacciones Adversas a Medicamentos () Reacción Medicamento Adversa a Tipos de Cualquier respuesta a un medicamento que sea nociva y no intencionada Se produce a dosis utilizadas
Notificación Espontánea de Reacciones Adversas a Medicamentos () Reacción Medicamento Adversa a Tipos de Cualquier respuesta a un medicamento que sea nociva y no intencionada Se produce a dosis utilizadas
Anexo III. Modificaciones a las secciones relevantes de ficha técnica y prospecto
 Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Lea todo el prospecto antes de empezar a usar el medicamento.
 Lea todo el prospecto antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este medicamento
Lea todo el prospecto antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este medicamento
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 2.1 Descripción general
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib)
 Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Nota mensual. Medicamentos. Productos Sanitarios. Diciembre. sobre. de Uso Humano y. Medicamentos
 Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
FICHA TÉCNICA. Alivio a corto plazo (durante dos tres meses) del edema y síntomas relacionados con la insuficiencia venosa crónica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FABROVEN 150 mg/150 mg/100 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una cápsula dura contiene: Extracto seco de Ruscus valorado en heterósidos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FABROVEN 150 mg/150 mg/100 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una cápsula dura contiene: Extracto seco de Ruscus valorado en heterósidos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
