OISPOSICION N o 7 9 5
|
|
|
- Gabriel Paz Carrasco
- hace 8 años
- Vistas:
Transcripción
1 ~ús«lmé S~ de P0titúa4. íl?~dóhe1~ A.n.??t.A. 7 OISPOSICION N o BUENOS AIRES, Oir.B20 11 Visto el Expediente N del Registro de esta Administración Nacionall de Medicamentos, Alimentos y Tecnología Médica(ANMAT), y CONSIDERANDO: Que por las presentes actuaciones GLAXOSMITHKLINE ARGENTINA S.A. solicita se autorice la inscripción en el Registro de Especialidades Medicinales (REM) de esta Administración Nacional, de una vacuna CONTRA SARAMPION, RUBEOLA, PAPERAS y VARICELA VIRUS VIVOS ATENUADOS DE SARAMPION, RUBEOLA, PAPERAS y VARICELA, la que será importada a la República Argentina. Que lo solicitado se encuadra en la Disposición N 705/05 la cual se aplica a las tramitaciones de solicitudes de inscripción de vacunas. Que dicha norma Fija los requisitos científicos y técnicos requeridos para acreditar en forma fehaciente la calidad, eficacia y seguridad de las vacunas sometidas al trámite de autorización de comercialización a través de su inscripción en el Registro de Especialidades Medicinales. Que como antecedente el mencionado producto cuenta con la aprobación de la autoridad sanitaria de ALEMANIA. Que las actividades de elaboración y comercialización de
2 , ~~ ~ús4ttut de P~. íli?~e1~ A.n.?itA.7 Swzeta1Ú especialidades medicinales se encuentran contempladas por la Ley y los Decretos 9763/64, 1890/92 Y 150/92 (T.O. Decreto 177/93), y normas complementarias. Que consta la evaluación técnica producida por el Departamento de Registro. Que consta la evaluación técnica producida por el Instituto Nacional de Medicamentos (INAME), en la que informa que: a) El producto estudiado encuadra en la definición de especialidad medicinal, contemplada por la norma legal vigente, según consta en su informe del 2/5/08; b) El producto estudiado reúne los requisitos técnicos que contempla la norma legal vigente; c) Los establecimientos declarados demuestran aptitud para la elaboración y el control de calidad del producto cuya inscripción en el Registro se solicita. Que respecto de la información preclínica dicho Instituto ha emitido el informe de fecha 19/8/2009, considerada aceptable. Que consta la evaluación técnica producida por la Dirección de Evaluación de Medicamentos (DEM), la que informa que el producto a registrar es una vacuna que combina los componentes de la vacuna PRIORIX (sarampión, parotiditis, rubéola) y de la vacuna VARILRIX (varicela), ambas indicadas en la infancia, pudiéndose administrar en forma concomitante. Que señala que en el caso de que las recomendaciones oficiales dosis adicionales de vacuna de sarampión, paperas, rubéola y/o aricela, puede ser utilizada para esta dosis.
3 ~úsa1m4 S~ depotltúm. íl?~ e 1HJtit«t04 A.?t.m.A. 7 DISPOSICION N O Que la DEM informa que la vacuna está indicada para la inmunización activa contra el sarampión, rubéola, paperas y varicela a partir de los 9 meses hasta los 12 años inclusive. Que la DEM considera que se realizaron estudios de seguridad en monos Rhesus con dosis sencilla y dosis repetida que indicaron que la vacuna es bien tolerada y no produce efectos tóxicos locales o sistémicos (ESTUDIOS 007, 038,044). Que, los estudios clínicos desarrollados son los siguientes: 006 (Alemania, Estonia, Bélgica); 007 (Australia, Canadá, Colombia, Italia, México); 013 (Alemania); 018 (Singapur), 022 (Brasil); 038 ( Alemania, Austria); 043 (Alemania, Polonia, Finlandia, l:3recia); 044 (Alemania), los cuales demostraron la no inferioridad de la vacuna respecto de PRIORIX y VARILRIX, así como su perfil de seguridad y reactogenicidad. Que asimismo la firma GLAXOSMITHKLINE ARGENTINA S.A. se compromete ante esta ANMAT, mediante los planes de vigilancia post comercialización de fs. 1217/1250, a notificar los efectos adversos que pudieran presentarse, según lo establecido en la Normas Nacionales de vacunación, cumpliendo con el formulario de notificación ESAVI. Que de la evaluación técnica producida por la DEM, se concluye que: a) La indicación, posolo!~ía, vía de administración, condición de venta, y los proyectos de rótulos y prospectos se consideran aceptables, proyectos de fs. 408, que se aprueban atento cumplir con los criterios de seguridad
4 ~túsa1m4 SwzdaJÚa, de PotltiM.4, 'R :9edadÓ# e 1~ r!.'7t, '/1t,,,4, 7 D1SPOSICION N y eficacia. Que los datos identificatorios característicos a ser transcriptos en los proyectos de la Disposición Autorizante y del Certificado correspondiente, han sido convalidados por las áreas técnicas precedentemente citadas. Que la Dirección de Asuntos Jurídicos de esta Administración Nacional, dictamina que se ha dado cumplimiento a los requisitos legales y formales que contempla la normativa vigente en la materia. Que corresponde autorizar la inscripción en el REM de la especialidad medicinal objeto de la solicitud. Nros. 1490/92 Y 425/10. Que se actúa en virtud de las facultades conferidas por los Decretos Por ello; EL INTERVENTOR DE LA ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA DISPONE: ARTICULO Autorízase la inscripción en el Registro Nacional de Especialidades Medicinales (REM) de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica de la especialidad medicinal de nombre comercial VAMMRIX y nombre/s genérico/s VACUN,ll, CONTRA SARAMPION, RUBEOLA, PAPERAS y VARICELA VIRUS VIVOS ATENUADOS DE SARAMPION, RUBEOLA, PAPERAS y r RICELA, la que será importada a la República Argentina, de acuerdo a lo
5 ~úsabt4 SwzetaJtia de Pota0u. ~e1~ A.n.m.A.? DISPOSICION N O solicitado, en el tipo de Trámite NO , por GLAXOSMITHKLINE ARGENTINA S.A., con los Datos Identificatorios Característicos que figuran como Anexo I de la presente Disposición y que forma parte integrante de la misma. ARTICULO 2 - Autorízanse los textos de los proyectos de rótulo/s y de prospecto/s figurando como Anexo 11 de la presente Disposición y que forma parte integrante de la misma. ARTICULO 3 - Extiéndese, sobre la base de lo dispuesto en los Artículos precedentes, el Certificado de Inscripción en el REM, figurando como Anexo III de la presente Disposición y que forma parte integrante de la misma. ARTICULO 40 - En los rótulos y prospectos autorizados deberá figurar la leyenda: ESPECIALIDAD MEDICINAL AUTORIZADA POR EL MINISTERIO DE SALUD, CERTIFICADO N, con exclusión de toda otra leyenda no contemplada en la norma legal vigente. ARTICULO 50 - Con carácter previo a la comercialización del producto cuya inscripción se autoriza por la presente disposición, el titular del mismo deberá notificar a esta Administración Nacional la fecha de inicio de la elaboración o importación del primer lote a comercializar a los fines de realizar la verificación técnica del cumplimiento de las Buenas Practicas de Fabricación, consistente en la constatación de la capacidad de producción y de control correspondiente según Disposición ANMAT N 2819/04, de la o las plantas en la que se realicen, a riterio de esta Administración los procesos de elaboración críticos. TICULO 60 - La vigencia del Certificado mencionado en el Artículo 3 será por
6 ~4eSabut SW/da!Ú4 de PotittcM, íli?~,,4,n,?1ta, 7 e 1H4tit«tc4 D1SPOSICION N 079E cinco (5) años, a partir de la fecha impresa en el mismo. ARTICULO 70 - Establécese que la firma GLAXOSMITHKLINE ARGENTINA S.A., deberá dar cumplimiento a las obligaciones asumidas ante esta ANMAT en los planes de vigilancia post comercialización de fs. 1217/1250, y realizar todas los estudios y las actividades de farmacovigilancia adicionales contenidas en el Plan de Farmacovigilancia, de acuerdo al plan de administración de riesgos de la compañía, cuyos resultados deberán ser presentados ante el Departamento de Farmacovigilancia de la Dirección de Evaluación de Medicamentos. ARTICULO 80 - Regístrese. Inscríbase en el Registro Nacional de Especialidades Medicinales al nuevo producto. Por Mesa de Entradas notifiquese al interesado, haciéndole entrega de la copia autenticada de la presente Disposición, conjuntamente con sus Anexos 1, 1I, Y III. Gírese al Departamento de Registro a los fines de confeccionar el legajo correspondiente; cumplido, archivese. EXPEDIENTE NO: DISPOSICIÓN NO: n W(I~íL Dr. OTTO A. ORSINGHER SUB-INTERVENTOR...N.M.A.T.
7 ~ús4fm4 SwzeúvÚ4 de PotitkM, ~e'7~ A,n,m,A, 7 ANEXO 1 DATOS IDENTIFICATORIOS CARACTERÍSTICOS Nombre comercial: VAMMRIX Nombre/s genérico/s: VACUNA CONTRA SARAMPION, RUBEOLA, PAPERAS y VARICELA VIRUS VIVOS ATENUADOS DE SARAMPION, RUBEOLA, PAPERAS y VARICELA Nombre o razón social de los establecimientos elaboradores: GlaxoSmithKline Biologicals SA y SACHSISCHES SERUMWERK DRESDEN - DIVISIÓN DE SmithKline Beecham Pharma GmbH and CO, KG, Domicilio de los establecimientos elaboradores: 89 Rue de L'Institut, 1330 Rixensart Bélgica Y Zirkusstrasse 40, Dresden, ALEMANIA (ELABORACIÓN DE LAS AMPOLLAS CONTENIENDO EL DILUYENTE), Domicilio de los laboratorios de control de calidad propio: CARLOS CASARES 3690 VICTORIA, PROV, DE BUENOS AIRES. Los siguientes datos identificatorios autorizados por la presente disposición se detallan a continuación: Forma farmacéutica: POLVO LIOFILIZADO PARA INYECTABLE. Nombre Comercial: VAMMRIX, Clasificación ATC: J07BD54. ndicación/es autorizada/s: está indicada para la inmunización activa contra el
8 l& ~ús4!«4 swzetajúa de?ofitúm. 'R~~ e 1H4tiM04 A.n.?1t. A sarampión, rubéola, paperas y varicela a partir de la edad de 9 meses hasta los 12 años inclusive. CADA DOSIS DE LA VACUNA RECONSTITUIDA (0.5 mi) CONTIENE: Concentración/es: VIRUS VIVO ATENUADO DEL SARAMPIÓN (CEPA SCHWARZ) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA RUBÉOLA (CEPA WISTAR RA 27/3) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA PAROTIDITIS (CEPA RIT 4385, DERIVADA DE LA CEPA JERYL LYNN) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA VARICELA (CEPA OKA) NO MENOS DE PFU. Fórmula completa por unidad de forma farmacéutica ó porcentual: Genérico/s: VIRUS VIVO ATENUADO DEL SARAMPIÓN (CEPA SCHWARZ) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA RUBÉOLA (CEPA WISTAR RA 27/3) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA PAROTIDITIS (CEPA RIT 4385, DERIVADA DE LA CEPA JERYL LYNN) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA VARICELA (CEPA OKA) NO MENOS DE PFU. Excipientes: SORBITOL 14 MG, AGUA PARA INYECTABLE 0.5 ML, LACTOSA ANHIDRA 56 MG, AMINOACIDOS P/ INYECCION 15 MG, MANITOL 14 MG. Origen del producto: Biológico Fuente de obtención de la/s materia/s prima/s utilizada/s, para productos de origen biológico ó biotecnológico: LA PRODUCCIÓN DEL VIRUS DEL SARAMPIÓN BASA EN LA SIEMBRA DE UN LOTE PRINCIPAL USANDO
9 ~,(es41m4 Swzetalúa de P~. :~dó# e 1H4tiM04 A.n.?1t. A EMBRIOFIBROBLASTOS DE POLLO COMO SUSTRATO Y LA CEPA SCHWARTZ DEL VIRUS VIVO ATENUADO DEL SARAMPIÓN COMO INÓCULO. LA PRODUCCIÓN DEL VIRUS DE LA PAPERA SE BAS,ll, EN UN SISTEMA DE SIEMBRA DE LOTE USANDO EMBRIOFIBROBLASTOS DE POLLO COMO SUSTRATO Y LA SIEMBRA DE VIRAL RIT438S, LA CUAL ES 100% JL1 PURA AISLADA DE LA CEPA JERYL LYNN COMO INÓCULO. LA PRODUCCIÓN DE:L VIRUS LA RUBÉOLA SE BASA EN LA SIEMBRA DE UN LOTE PRINCIPAL USANDO UNA LÍNEA DE CÉLULA DIPLOIDE HUMANA MRCS COMO SUSUTRATO y LA CEPA RA27/3 DEL VIRUS VIVO ATENUADO DE LA RUBÉOLA COMO INÓCULO. LA PRODUCCIÓN DEL VIRUS LA VARICELA SE BASA EN LA SIEMBRA DE UN LOTE PRINCIPAL USANDO UNA LINEA DE CÉLULA DIPLOIDE HUMANA MRCS Cm10 SUSTRATO y LA CEPA OKA DEL VIRUS VIVO ATENUADO DE LA VARICELA COMO INÓCULO. Vía/s de administración: SUBCUTANEA. Envase/s Primario/s: FRASCO AMPOLLA DE VIDRIO TIPO 1 INCOLORO CON TAPÓN ELASTOMERICO + AMPOLLA DE VIDRIO TIPO 1 CON DILUYENTE, FRASCO AMPOLLA DE VIDRIO TIPO 1 INlCOLORO CON TAPÓN ELASTOMERICO + JERINGA DE VIDRIO TIPO 1 PRELLENADA CON DILUYENTE CON 2 AGUJAS SEPARADAS, FRASCO AMPOLLA DE VIDRIO TIPO 1 INCOLORO CON TAPÓN ELASTOMERICO + JERINGA DE VIDRIO TIPO 1 PRELLENADA CON DILUYENTE SIN AGUJAS. Presentación: Frasco ampolla conteniendo el liofilizado + ampolla conteniendo el diluyente por 1, 10 Y 100. Frasco ampolla conteniendo el liofilizado + Jeringa rellenada conteniendo el diluyente con 2 agujas separadas por 1 y 10. Frasco
10 ~tiesabut SwzeúvÚ4 de P~. 'R~edadó.ee 1H4t<'M44 A.n.m. A ampolla conteniendo el liofilizado + Jeringa prellenada conteniendo diluyente sin agujas por 1, 10, 20 Y 50. Contenido por unidad de venta: Frasco ampolla conteniendo el liofilizado + ampolla conteniendo el diluyente por 1, 10 Y 100. Frasco ampolla conteniendo el liofilizado + Jeringa prellenada conteniendo el diluyente con 2 agujas separadas por 1 Y 10. Frasco ampolla conteniendo el liofilizado + Jeringa prellenada conteniendo diluyente sin agujas por 1, 10, 20 Y 50. Período de vida Útil: 18 meses. Forma de conservación: Condición de expendio: NO CONGELAR; desde: 2 oc. hasta: 8 oc. BAJO RECETA. DISPOSICIÓN NO: W/1~lL I or./otto A. ORSINGHER SUB-1NTE RV E N TU" A..N.IY.I.A.'l'.
11 ~túsaltut SW/da1Ú4 de 'P0t<tica4, 'RC9rdadk e 1H4tit«t04.A, n,?it,a, 7 ANEXO Ir TEXTO DEL/LOS RÓTULO/S y PROSPECTO/S AUTORIZADO/S De la ESPECIALIDAD MEDICINAL inscripta en el REM mediante DISPOSICIÓN J\NMAT NO: O Dr, J OII~W.t~~I~G~ SUB-INTERVEN\rOR... N.M.A.T.
12 079 5 PROYECTO DE RÓ VAMMRI~ VACUNA CONTRA SARAMPiÓN, RUBÉOLA, PAPERAS Y VARICELA VIRUS VIVOS ATENUADOS DE SARAMPiÓN, RUBÉOLA, PAPERAS Y VARICELA Polvo liofilizado para inyectable Venta bajo receta Elaborado en Bélgica FÓRMULA CUALI-CUANTITATIVA: Cada dosis de la vacuna reconstituida (0,5 mi) contiene: Virus vivo atenuado del sarampión 1 (cepa Schwarz) no menos de 10 3,0 0lCC 3 s0, Virus vivo atenuado de la rubéola 2 (cepa Wistar RA 2"i'13) no menos de 10 3,0 0lCCso 3, Virus vivo atenuado de la parotíditis 1 (cepa RIT 4385, derivada de la cepa Jeryl Lynn) no menos de 10 4,4 01CC 3 s0, Virus vivo atenuado de la varicela 2 (cepa OKA) no menos de 10 3,3PFU 4, Lactosa anhidra 56 mg, Sorbítol14 mg, Manitol14 mg, Aminoácidos 15 mg, Agua para inyección 0,5 mi. lproducido en células de embrión de pollo 2Producido en células diploides humanas (MIRC-5) 300sis infecciosa en cultivo celular 50% 4Unídades formadoras de placas Posologla: Según indicación médica. MANTENER FUERA DEL ALCANCE DE LOS NIÑOS. CONSERVACiÓN: Conservar en heladera (2 C - 8 C). No congelar. Conservar en el envase original protegido de la luz. Elaborado por: GlaxoSmithKline Biologicals S.A., Bélgica. Importado por: GlaxoSmithKline Argentinal S.A. - Carlos Casares 3690, (B1644BCO) Victoria, Buenos Aires, Argentina. Director Técnico: Eduardo D. Camino - Farmacéutico, Especialidad Medicinal Autorizada por el Ministerio de Salud. Certificado N... (*) Envases conteniendo: Frasco ampolla conteniendo el liofilizad() + ampolla conteniendo el diluyente por 1,10 y 100. Frasco ampolla conteniendo el Iiofllizadl) + jeringa prellenada conteniendo el diluyente con 2 agujas separadas por 1 y 10. Frasco ampolla conteniendo el liofilizado + jeringa prellenada conteniendo el diluyente sin agujas por 1,10,20 Y 50. G\aUSmit Ei D. CimlOQ A IOderildo ntina S"A. Gl., "~'h')ntit'.a S)\. 1'"\1 \1 J,.a rlílue r3 "TéCnica
13 079 5 PROYECTO DE PROSPECTO S:.., VAMMRI~ VACUNA CONTRA SARAMPiÓN, RUBÉOLA, PAPERAS Y VARICELA VIRUS VIVOS ATENUADOS DE SARJlMPIÓN, RUBÉOLA, PAPERAS Y VARICELA Polvo liofilizado para inyectable Venta Bajo Receta Elaborado en Bélgica FÓRMULA CUAU-CUANTITATIVA: Cada dosis de la vacuna reconstituida (O,5 mi) contiene: Virus vivo atenuado del sarampión' (cepa Schwarz) no menos de 10 3,0 DICCso 3, Virus vivo atenuado de la rubéola 2 (cepa Wistar RA 27'/3) no menos de 103,0OlCCso 3, Virus vivo atenuado de la parotiditis' (cepa RIT 4385, derivada de la cepa Jeryl Lynn) no menos de 10 4,4DICCso 3, Virus vivo atenuado de la varicela 2 (cepa OI<:A)no menos de 10 3,3PFU 4, Lactosa anhidra 56 mg, Sorbitol14 mg, Manitol14 mg, Aminoácidos 15 mg, Agua para inyección 0,5 mi. 1Producido en células de embrión de pollo 2Producido en células diploides humanas (MRC-5) 300sis infecciosa en cultivo celular 50% 4Unidades formadoras de placas ACCiÓN TERAPÉUTICA: Vacuna combinada de virus vivos atenuados contra sarampión, rubéola, paperas y varicela. (Código ATC: J07BD54). INDICACIONES: VAMMRI~ está indicado para la inmunizal;i6n activa contra el sarampión, rubéola, paperas y varicela a partir de la edad de 9 meses hélsta los 12 anos inclusive (Ver ADVERTENCIAS Y PRECAUCIONES). PROPIEDADES FARMACOLÓGICAS: Propiedades farmacodinámicas: Las tasas de seroconversión inducidas por dos dosis de VAMMRIX IlD administradas con un intervalo de seis semanas en aproximadameinte nillos no vacunados previamente, de 11 a 23 meses de edad, se resumen en la siguiente tabla: Anticuerpo Después de la 1 8 dosis Después de la 2 8 dosis Prueba (umbral) Antisarampión ELISA (150 mullmll 964% 991% Antlparotldltls EUSA (231 mul/ml) 91,3% 98,8% Neutralizaciones (1:28) 95,4% 99,4% Antirubéola EUSA (4 Ul/mll 99,7% 99,9% Antlvaricela IFA (1:4) 97,2% 99,8% ELISA (50 mul/ml) 89,4% 992% En ensayos cunicos, se ha demostrado que la gran mayoría de los pacientes que recibieron vacunas antivaricela y que están expuestos al virus salvaje fueron protegidos completamente de la varicela o presentaron una forma más leve de la enfermedad (varicela modificada). Los datos sugieren una eficacia más alta y una disminución de la varicela modificada después de dos dosis de vacuna en relaci6n con un is.
14 o 19 5 Propiedades farmacocinétlcas: No se requiere la evaluación de las propiedades farmacocinéticas de las vacunas. Datos preclínicos sobre seguridad: Un estudio de toxicidad de dosis repetidal> en animales no reveló ninguna toxicidad local o sistémica de la vacuna. POSO LOGIA y MODO DE ADMINISTRACiÓN: Pacientes entre 9 meses hasta 12 anos de edad inclusive deben recibir 2 dosis de VAMMRI~ para asegurar una protección óptima contra sarampión, rubéola, paperas y varicela (Ver PROPIEDADES FARMACOLÓGICAS - Propiedades farmacodinámicas). Es preferible respetar un intervalo de al menos seis semanas entre las dosis. En ningún caso este intervalo deberá ser inferior a cuatro semanas. Alternativamente, y de acuerdo con las recomendaciones oficiales aplicables.: Una única dosis de VAMMRI~ puede ser administrada a ninos los cuales ya han recibido una única dosis de otra vacuna contra sarampión, rubéola y paperas y/o varicela. Una única dosis de VAMMRI~ puede ser administrada seguida de una dosis única de otra vacuna contra sarampión, rubéola y paperas y/o varicela. "Las recomendaciones oficiales aplicables pueden variar respecto del intervalo entre dosis y la necesidad de una o dos dosis de vacuna contra sarampión, rubéola y paperas y de vacuna contra varicela. Modo de administración: VAMMRI~ de,be ser administrado por inyección subcutánea, preferiblemente en la cara externa del brazo. CONTRAINDICACIONES: VAMMRI~ está contraindicada en personas con hipersensibilidad conocida a la neomicina o a cualquier otro componente de la vacuna (alergia al huevo - Ver ADVERTENCIAS Y PRECAUCIONES). Antecedentes de dermatitis de contacto a la neomicina no es una contraindicación. VAMMRI~ está contraindicada en las personas que presenten signos de hipersensibilidad luego de la administración previa de las vacunas contra el sarampión, la rubéola, la paperas ylo la varicela. Está contraindicada la administración de VAMMRI~ en embarazadas. Además, deberá evitarse el embarazo durante los tres meses posteriores a la vacunación (Ver ADVERTENCIAS Y PRECAUCIONES - Embarazo, lactancia). VAMMRIX@lno debe administrarse a pacientes inmunocomprometidos, incluyendo pacientes con inmunodeficiencia primaria o secundaria. ADVERTENCIAS Y PRECAUCIONES: Al igual que con todas las vacunas inyecta.bles, siempre se debe tener disponible tratamiento médico apropiado en caso que se presente una ocasional reacción anafiláctica, después de la administración de la vacuna. Al igual que con otras vacunas, la administr.3ción de VAMMRI~ debe posponerse en pacientes que padezcan una afección febril aguda Sl3vera. Sin embargo, la presencia de una infección menor, por ejemplo un resfrlo, no debe resultar en la postergación de la vacunación. Antes de inyectar la vacuna, debe dejarse que el alcohol y otros desinfectantes se evaporen de la piel, ya que pueden inactivar los virus atenuados de la vacuna. Es posible que los lactantes en el primer ano de vida no respondan de manera suficiente al componente antisarampión de la vacuna, debido a la posible persistencia de los anticuerpos antisarampión maternos. Deberán administrarse dosis adicionales de vacuna con contenido antisarampión, de acuerdo a las recomendac:iones oficiales. Antecedentes de convulsiones febriles nt,ecedentes familiares de convulsiones no constituyen una contraindicación para el em e VAMMRI~. Se deberá vigilar estrechamente a los
15 0795 vacunados con antecedentes de convulsiones febriles, ya que puede presentarse relacionada con la vacuna durante el periodo comprendido entre 4 y 12 dias después d vacunación. Los componentes antisarampión y antiparotiditis de la vacuna se producen en cultivo de células de embrión de pollo y, por lo tanto, pueden contener trazas de proterna de huevo. En las personas con antecedentes de reacciones anafilácticas, anafilactoides u otras reacciones inmediatas (por ejemplo, urticaria generalizada, inflamación de la boca y la garganta, dificultad para respirar, hipotensión o shock) después de la ngesta de huevo se puede incrementar el riesgo de reacciones de hipersensibilidad die tipo inmediato después de la vacunación, aunque se ha comprobado que estos tipos de reac(;iones son muy infrecuentes. Las personas que han sufrido anafilaxis después de la ingesta de huevo, deberán ser vacunados con suma precaución, y disponer de un tratamiento adecuado, en caso de producirse una reacción de este tipo. No se ha documentado la transmisión de los virus del sarampión, rubéola y paperas desde los pacientes vacunados a los contactos sensibles, aunque se sabe que se produce la excreción farfngea del virus de la rubéola aproximadamente de 7 a 28 dlas después de la vacunación, con una excreción máxima alrededor del 11 dla. La experiencia post-comercialización sugiere que puede producirse la transmisión del virus de la varicela en casos muy infrecuentes entre pacientes vacunados sanos que presentan un exantema de tipo varicela y contactos susceptibles. VAMMRIX e no debe ser administrada por vía Intravenosa o Intradérmlca bajo ninguna circunstancia. Al igual que con cualquier vacuna, es posibl,e que no se desencadene una respuesta inmunitaria protectora en todos los vacunados. Luego de la vacunación con vacunas conteniendo virus vivos contra sarampión, rubéola y paperas, se han reportado casos de empeoramiento y recurrencia de trombocitopenia en pacientes que la sufrieron luego de la primera dosis. En estos casos, debe evaluarse cuidadosamente el riesgo-beneficio de la inmunización con VAMMRIX e. No se ha estudiado el empleo de VAMMRIX'1l en pacientes con infección asintomática por el VIH. Puede plantearse la administración de VAMIMRlxe con precaución en esta población cuando, en opinión del médico, la no administración de I;a vacuna acarrea un riesgo mayor. INTERACCIONES: VAMMRIXti> puede administrarse simultáneamente (pero en lugares diferentes de inyección) con cualquiera de las siguientes vacunas mclnovalentes o combinadas [incluidas las vacunas hexavalentes (DTPa-VHB-IPV/Hib)]: VaCUllC1contra difteria, tétanos y pertusis acelular (DTPa), vacuna contra Haemophilus influenzae tipo b (Hib), vacuna polio inactivada (IPV), vacuna contra hepatitis B (VHB). Si es preciso realizar la prueba de la tube!rculina, deberá hacerse antes de la vacunación o simultáneamente a la misma, puesto que so ha descripto que las vacunas contra el sarampión, rubéola y paperas combinadas pueden c:ausar una depresión transitoria de la sensibilidad cutánea a la prueba de la tuberculina. Dado que esta anergia puede durar hasta seis semanas como máximo, no deberá realizarse la pruel~a de la tuberculina dentro de este periodo después de la vacunación, a fin de evitar resultados falsamente negativos. En los pacientes que han recibido gammaglobulinas humanas o una transfusión de sangre, deberá retrasarse la vacunación durante trels meses como minimo, debido a la probabilidad de fracaso de la vacunación a causa de la presllncia de anticuerpos adquiridos de manera pasiva. Deberán evitarse los salicilatos durante seis semanas después de cada vacunación, ya que se ha descripto el slndrome de Reye después del uso de salicilatos durante la infección natural por varicela. Embarazo: Está contraindicada la administración de VAMMRlx'I' en embarazadas. Además, el embarazo deberá evitarse durante tres meses después de la vacunación. No se dispone de datos suficientes en seres humanos sobre el empleo de VAMMRlx'I' durante el embarazo, y no se han realizado estudios en animales sobre la toxicidad en el sistema reproductivo.
16 I Lactancia: No se dispone de datos suficientes en seres humanos sobre el empleo de VAMMRlxe durante e ~ periodo de lactancia. 'f REACCIONES ADVERSAS: El perfil de seguridad presentado a continuación se basa en los datos de más de dosis administradas a niflos de 9 a 27 meses de edad. Las reacciones se registraron hasta 42 días después de la vacunación. Las frecuencias notificadas son las siguiente:.: Muy comunes (~1/10) Comunes (~1/100 a <1/10) Poco comunes (~1/1.000 a <1/100) Raramente (~1/ a <1/1.000) Infecciones e infestaciones: Poco comunes: Infección de las vlas respiratorias altas. Raramente: Otitis media. Trastornos de la sangre y del sistema linfático: Poco comunes: Linfadenopatía. Trastornos endocrinos: Poco comunes: Inflamación de las parótidas. Trastornos del metabolismo y la nutrición: Poco comunes: Anorexia. Trastornos psiquiátricos: Comunes: Irritabilidad. Poco comunes: Llanto, nerviosismo, insomníi:). Trastornos del sistema nervioso: Raramente: Convulsiones febriles. Trastornos respiratorios, torácicos y del mediastino: Poco comunes: Rinitis. Raramente: Tos, bronquitis. Trastornos digestivos: Poco comunes: Diarrea, vómitos. Trastornos de la piel y del tejido subcutáneo: Comunes: Erupción cutánea. Trastornos generales y alteraciones en el lugar de administración: Muy comunes: Dolor y enrojecimiento en el lugar de inyección, fiebre (rectal ~38 C - :S:39,5 C; axilar I oral: ~37 5 C - :s:39.c)*. Comunes: Inflamación en el lugar de inyección, fiebre (rectal >39,5 C; axilar 1 oral >39.C)*. *Luego de la administración de la primera dosis de la vacuna combinada contra sarampión, rubéola, paperas y varicela, se observó un aljmento en la incidencia de fiebre (aproximadamente 1,5 veces) cuando se comparó a la administración concomitante de vacuna contra sarampión, rubéola y paperas y vacuna contra varicela en lugares de inyección separados. Poco comunes: L go, malestar, fatiga. ntina S.A-. Camino -'lloderad O 4
17 019 5 Durante la vigilancia post-comercializacim, se han descripto las siguientes reaccion adicionales luego de la vacunación contra el sarampión, la parotiditis, la rutéola y la varicela: Infecciones e infestaciones: Meningitis. Trastornos de la sangre y del sistema linfático: Trombocitopenia, púrpura tmmbocitopénica. Trastornos del sistema inmunitario: Reacciones alérgicas (incluidas las reacciones anafilácticas y anafilactoides). Trastornos del sistema nervioso: Mielitis transversa, slndrome de Guillain Barré, neuritis periférica, encefalitis. Trastomos de la piel y del tejido subcutáneo: Eritema multiforme. Trastornos musculoesqueléticos y del tejido (;onectivo: Artralgia, artritis. Trastornos generales y alteraciones en el lugar de administración: Srndrom.~ de Kawasaki. En algunos casos poco frecuentes, no puede descartarse una afección de tipo paperas, con un perrodo de incubación abreviado. En casos aislados, después de la vacun ~ combinada contra el sarampión, rubéola y paperas, se ha descripto una inflamación transitoria y dolorosa de los testrculos. SOBRE DOSIFICACiÓN: Los datos disponibles son insuficientes. Ante la eventualidad de una sobredosificación, concurrir al Hospital más CI!rCanOo comunicarse con los centros de Toxicologla: Hospital de Pediatrla Ricardo Gutiérrez (011) /2247. Hospital A. Posadas (011) / Optativamente a otros centros de Intoxicaciones. Incompatibilidades: Debido a la falta de estudios de compatibilidad, medicamentos. este medicamento no deb(! mezclarse con otros PRESENTACiÓN: VAMMRIXIll> se presenta en un frasco ampolla conteniendo un Iiofilizaclo de color blanco a ligeramente rosado, acompanado por una ampolla o jeringa prellenada de vidrio con o sin aguja conteniendo 0,5 mi de la solución diluyente estéril transparente e incolora. Se presenta en: Frasco ampolla conteniendo el liofilizado + ampolla conteniendo el culuyente por 1, 10 Y 100. Frasco ampolla conteniendo el liofilizad() + Jeringa prellenada contflniendo el diluyente con 2 agujas separadas por 1 y 10. Frasco ampolla conteniendo el liofilizado + jeringa prellenada contenlondo el diluyente sin agujas por 1, 10,20 y 50. CONSERVACiÓN: Conservar en heladera (2.C - 8.C). No congl~lar. Conservar en el envase original protegido de la luz. Instrucciones de uso, manipulación y eliminación: Deberá inspeccionarse visualmente la presencia de cualquier partfcula e>:trana ylo un aspecto f1sico anormal de la vacuna reconstituida. En caso de observar alguno de éstos, la vacuna deberá desecharse. VAMMRI~ debe ser reconstituida agregando al frasco que contiene la vac:una liofilizada todo el diluyente contenido en el contenedor suministrado. Después de la adición del diluyente al polvo, la mezcla deberá agitarse bien hasta que el polvo se disuelva completamente. El color de la vacuna reconstituida puede variar desde un color durazno claro a rosado fucsia debido a variac' ne nores de su ph. Esto es normal y no afecta al rendimiento de la vacuna. En caso de ob se tra variación, la vacuna debe desecharse. 5
18 079 5 Toda vacuna no utilizada o material de desecho deben ser descartados siguiendo las norma bioseguridad. Después de la reconstitución: se recomiendi3 el uso inmediato. Sin embargo, se ha demostrado estabilidad durante 8 horas luego de la reconstitución cuando es almacenada entre 2 C y 8 C. MANTENER FUERA DEL ALCANCE DE LOS NIÑOS Especialidad Medicinal Autorizada por el Ministerio de Salud. Certificado N"... Director Técnico: Eduardo D. Camino - Farmacéutico. Elaborado por: GlaxoSmithKline Biologicals S.A., Bélgica. Importado por: GlaxoSmlthKline Argentlnal S.A., Carlos Casares 3690, (B1644BCD) Victoria, Buenos Aires, Argentina. INFORMACiÓN ADICIONAL PODRA SOLICITARSE A LA DIRECCiÓN M(;DICA DE GlaxoSmithKline Argentina S. A. - (011) GDS06-IPI04 Fecha de la última actualización: / Disp. N. S ~'" S.A.!:~InQ Apoderad; 6
19 0' eglaxo GlaxoSmithKline Argentina S.A. Carlos Casares 3690 B1644BCD. Victoria Buenos Aires ~Argentín Tel Buenos Aires,,Junio de 2010 Al Sr. Interventor de A.N.M.A.T. Dr. Carlos A Chiale S I O Ref.: VAMMRIX lll Vacuna contra sarampión, rubéola, paperas y varicela. Expediente N 1-4' De nuestra mayor consideración: GlaxoSmlthKllne Argentina S.A., tiene el agrado de dirigirse a USlted a fin de cumplimentar lo solicitado por la Dirección de Evaluación de Medicamentos de AN.M.A.T. Asimismo, es nuestra intención informar que la modificación que solicita lu Dirección de Evaluación de Medicamentos respecto de las presentaciones, sostenemos la pmsentación del diluyente en ampollas ya que se dispone de especificaciones de liberación las cuales constan a foja 634, asl como también se dispone de un resumen de estabilidad el cual consta a foja 685. Es nuestra intención informar que, junto con la modificación solicitada por II~Dirección de Evaluación de Medicamentos, se ha realizado Unll actualización del texto del prospecto la cual incluye modificaciones en los Items: Propiedades Farmacológicas, posologral y Modo de Administración, Advertencias y Precauciones, Rllacciones Adversas e Instrucciones de uso, manipulación y eliminación. A tal efecto adjuntamos: Formulario REM con los cambios solicitado!; respecto de la vida útil a 113 meses y el contenido por unidad de venta. Proyecto rótulo (triplicado) con los cambios solicitados. Proye o d prospecto (triplicado) con los cambios solicitados. ión suministrada por nuestra Casa Matriz sustentando la modificación,, I---..., -f..' '... cem s propicia la oca.sión para saludarlo con nuestra consideración I ~'flf"l:. T. r". -"'.... I, tl \ 9 JUN 2010 j I.A~~"'.gu.. ME A DIE: ENrPlA 45 ~.. 1'"h: C::~;T"~~~--~.""~~.'.../. t:;l", i'~aba~~ida Apoderado ~.~ _. -,-..C""~:.SA
20 ~úsa1m4 SW1d4/Ú4 de PotltúM, ~dóit e 1~,4, ']t,'jit,,4, 7 ANEXO III CERTIFICADO Expediente NO: El Interventor de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica O (ANMAT) certifica que, mediante la Disposición NO, y de acuerdo a lo solicitado en el tipo de Trámite N , por GLAXOSMITHKLINE ARGENTINA S.A., se autorizó la inscripción en el Registro de Especialidades Medicinales (REM), de un nuevo producto importado con los siguientes datos identificatorios característicos: Nombre comercial: VAMMRIX Nombre/s genérico/s: VACUNA CONTRA SARAMPION, RUBEOLA, PAPERAS y VARICELA VIRUS VIVOS ATENUADOS DE SARAMPION, RUBEOLA, PAPERAS y VARICELA Nombre o razón social de los establecimientos elaboradores: GlaxoSmithKline Biologicals SA y SACHSISCHES SERUMWERK DRESDEN - DIVISIÓN DE 0! SmithKline Beecham Pharma Gl11bHand CO, KG. Domicilio de los establecimientos elaboradores: 89 Rue de L'Institut, 1330 Rixensart Bélgica Y Zirkusstrasse 40, Dresden, ALEMANIA (ELABORACIÓN DE LAS AMPOLLAS CONTENIENDO EL DILUYENTE). Domicilio de los laboratorios de control de calidad propio: CARLOS CASARES r 3690 VICTORIA, PROV, DE BUENOS AIRES.
21 ~ús4bmt Swzet<vzl4 de PotitieM, 'R~dÓ# e 1H4t<'t«tod A.n.mA. 7 Los siguientes datos identificatorios autorizados por la presente disposición se detallan a continuación: Forma farmacéutica: POLVO LIOFILIZADO PARA INYECTABLE. Nombre Comercial: VAMMRIX. Clasificación ATC: J07BD54. Indicación/es autorizada/s: está indicada para la inmunización activa contra el sarampión, rubéola, paperas y varicela a partir de la edad de 9 meses hasta los 12 años inclusive. CADA DOSIS DE LA VACUNA RECONSTITUIDA (0.5 mi) CONTIENE: Concentración/es: VIRUS VIVO ATENUADO DEL SARAMPIÓN (CEPA SCHWARZ) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA RUBÉOLA (CEPA WISTAR RA 27/3) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA PAROTIDITIS (CEPA RIT 4385, DERIVADA DE LA CEPA JERYL LYNN) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA VARICELA (CEPA OKA) NO MENOS DE PFU. Fórmula completa por unidad de forma farmacéutica ó porcentual: Genérico/s: VIRUS VIVO ATENUADO DEL SARAMPIÓN (CEPA SCHWARZ) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA RUBÉOLA (CEPA WISTAR RA 27/3) NO MENOS DE DICCso, VIRUS VIVO ATENUADO DE LA PAROTIDITIS (CEPA RIT 4385, DERIVADA DE LA CEPA JERYL LYNN) NO MENOS r DE DICCso, VIRUS VIVO ATENUADO DE LA VARICELA (CEPA OKA) NO
22 ~ties41m4 SwzetaJUa de Politiu4. 'R~uf4dÓ1t e 1H4tiM44 A.11.m.A. 7 MENOS DE PFU. Excipientes: SORBITOL 14 MG, AGUA PARA INYECTABLE 0.5 ML, LACTOSA ANHIDRA 56 MG, AMINOACIDOS P/ INYECCION 15 MG, MANITOL 14 MG. Origen del producto: Biológico Fuente de obtención de la/s rnateria/s prima/s utilizada/s, para productos de origen biológico ó biotecnológico: LA PRODUCCIÓN DEL VIRUS DEL SARAMPIÓN SE BASA EN LA SIEMBRA DE UN LOTE PRINCIPAL USANDO EMBRIOFIBROBLASTOS DE POLLO COMO SUSTRATO Y LA CEPA SCHWARTZ DEL VIRUS VIVO ATENUADO DEL SARAMPIÓN COMO INÓCULO. LA PRODUCCIÓN DEL VIRUS DE LA PAPERA SE BASA EN UN SISTEMA DE SIEMBRA DE LOTE USANDO EMBRIOFIBROBLASTOS DE POLLO COMO SUSTRATO Y LA SIEMBRA DE VIRAL RIT4385, LA CUAL ES 100% JL1 PURA AISLADA DE LA CEPA JERYL LYNN COMO INÓCULO. LA PRODUCCIÓN DEL VIRUS LA RUBÉOLA SE BASA EN LA SIEMBRA DE UN LOTE PRINCIPAL USANDO UNA LÍNEA DE CÉLULA DIPLOIDE HUMANA MRC5 COMO SUSUTRATO Y LA CEPA RA27/3 DEL VIRUS VIVO ATENUADO DE LA RUBÉOLA COMO INÓCULO. LA F>RODUCCIÓN DEL VIRUS LA VARICELA SE BASA EN LA SIEMBRA DE UN LOTE: PRINCIPAL USANDO UNA LINEA DE CÉLULA DIPLOIDE HUMANA MRC5 COMO SUSTRATO Y LA CEPA OKA DEL VIRUS VIVO ATENUADO DE LA VARICELA COMO INÓCULO. Vía/s de administración: SUBCUTANEA. Envase/s Primario/s: FRASCO AMPOLLA DE VIDRIO TIPO 1 INCOLORO CON rtapón ELASTOMERICO + AMPOLLA DE VIDRIO TIPO 1 CON DILUYENTE, FRASCO
23 ~úsdbut S~ de Pofitiuu, 'R~~e1~ A, 1t m,a, 7 AMPOLLA DE VIDRIO TIPO I INCOLORO CON TAPÓN ELASTOMERICO + JERINGA DE VIDRIO TIPO I PRELLENADA CON DILUYENTE CON 2 AGUJAS SEPARADAS, FRASCO AMPOLLA DE VIDRIO TIPO I INCOLORO CON TAPÓN ELASTOMERICO + JERINGA DE VIDRIO TIPO I PRI::LLENADACON DILUYENTE SIN AGUJAS, Presentación: Frasco ampolla conteniendo el liofilizado + ampolla conteniendo el diluyente por 1, 10 Y 100, Frasco ampolla conteniendo el liofilizado + Jeringa prellenada conteniendo el diluyente con 2 agujas separadas por 1 y 10, Frasco ampolla conteniendo el liofilizado + Jeringa prellenada conteniendo diluyente sin agujas por 1, 10, 20 Y 50, Contenido por unidad de venta: Frasco ampolla conteniendo el liofilizado + ampolla conteniendo el diluyente por 1, 10 Y 100, Frasco ampolla conteniendo el liofilizado + Jeringa prellenada conteniendo el diluyente con 2 agujas separadas por 1 Y 10, Frasco ampolla conteniendo el liofilizado + Jeringa prellenada conteniendo diluyente sin agujas por 1, 10, 20 Y 50, Período de vida Útil: 18 meses, Forma de conservación: NO CONGELAR; desde: 2 oc. hasta: 8 oc.,-<7 J. Condición de expendio: BAJO RECETA, Se extiende a GLAXOSMITHKLINE ARGENTINA SA el Certificado NO, en la Ciudad de Buenos Aires, a los días del..5. O 7 4 mes de O 1 F EB 2 O11 de,' siendo su vigencia por cinco (5) años a rpartir de la fecha impresa en el mismo. DISPOSICIÓN (ANMAT) NO: 0795 I W,(,, L, Dr. ono A. ORSINGHER SUB-INTERVENTOR.,N.M.A.T.
FICHA TÉCNICA. Nota: La utilización de Priorix debe realizarse de acuerdo a las recomendaciones oficiales.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
Vacuna triple vírica (sarampión, rubeola, parotiditis)
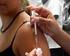 Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
Vacunación Infantil. www.madrid.org
 Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
B~,ENOSAIRES, 2 6 ABO 2013. Nacional de Medicamentos, Alimentos y Tecnología Medica;
 ~desakt S~ de'p0táica4, ~ 1H4tiM44 4,1t,?It, 4, 7. B~,ENOSAIRES, 2 6 ABO 2013 VISTO el Expediente NO 1-0047-0000-003502-13-1 del Registro de la Administración Nacional de Medicamentos, Alimentos y Tecnología
~desakt S~ de'p0táica4, ~ 1H4tiM44 4,1t,?It, 4, 7. B~,ENOSAIRES, 2 6 ABO 2013 VISTO el Expediente NO 1-0047-0000-003502-13-1 del Registro de la Administración Nacional de Medicamentos, Alimentos y Tecnología
el cambio de categoría del producto odontológico aprobado por Disposición ANMAT N 7221/98 del 30 de Noviembre de 1998 y se
 0348 BUENOS AIRES, 1 4 ENE 2011 VISTO el Expediente no 1-47-804-09-4 el Registro de la esta Administración Nacional; y CONSIDERANDO: Que por las presentes actuaciones la firma DEFUEN S.A. solicita el cambio
0348 BUENOS AIRES, 1 4 ENE 2011 VISTO el Expediente no 1-47-804-09-4 el Registro de la esta Administración Nacional; y CONSIDERANDO: Que por las presentes actuaciones la firma DEFUEN S.A. solicita el cambio
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
FICHA TECNICA. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
de la Administración Nacional de Medicamentos, Alimentos y Tecnología CABUCHI S.A., solicita la aprobación de nuevos proyectos de prospectos
 ~desatad Swr.etalÚ4 de p~, ;;ef)cd4~ e 1H4ti~ /1,n,'/1t,/1, 7, DISPOS1CIÚN N0 BUENOS AIRES, 18 Ole 2014 VISTO el Expediente N 1-0047-0000-002528-14-8 del Registro de la Administración Nacional de Medicamentos,
~desatad Swr.etalÚ4 de p~, ;;ef)cd4~ e 1H4ti~ /1,n,'/1t,/1, 7, DISPOS1CIÚN N0 BUENOS AIRES, 18 Ole 2014 VISTO el Expediente N 1-0047-0000-002528-14-8 del Registro de la Administración Nacional de Medicamentos,
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos
 GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
Prospecto: información para el usuario. DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral)
 Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
Vacunas Varicela- Herpes Zoster. Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC
 Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
Vacunaciones en grupos de riesgo
 Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
Medicamentos de venta Libre: información que deben contener rótulos, prospectos y etiquetas
 13 de febrero de 2012 Medicamentos de venta Libre: información que deben contener rótulos, prospectos y etiquetas La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica ( ANMAT) organismo
13 de febrero de 2012 Medicamentos de venta Libre: información que deben contener rótulos, prospectos y etiquetas La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica ( ANMAT) organismo
Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
BUENOS AIRES, lal Administración Nacional de Medicamentos, Alimentos y Tecnología Medica;
 ~desalad S~ de Polétie4d..
~desalad S~ de Polétie4d..
REGISTRO SANITARIO DE PRODUCTOS BIOLÓGICOS/ BIOTECNOLÓGICOS
 REGISTRO SANITARIO DE PRODUCTOS BIOLÓGICOS/ BIOTECNOLÓGICOS REPÚBLICA DE PANAMÁ PRESENTADO POR: LICDA. KYRHIAM CASTILLO CHIAL MINISTERIO DE SALUD DIRECCIÓN N NACIONAL DE FARMACIAS Y DROGAS Registro Sanitario
REGISTRO SANITARIO DE PRODUCTOS BIOLÓGICOS/ BIOTECNOLÓGICOS REPÚBLICA DE PANAMÁ PRESENTADO POR: LICDA. KYRHIAM CASTILLO CHIAL MINISTERIO DE SALUD DIRECCIÓN N NACIONAL DE FARMACIAS Y DROGAS Registro Sanitario
D1SPOSICION N" 4 2 4 lj BUENOSAIRES,
 D1SPOSICION N" 4 2 4 lj BUENOSAIRES, o Z JUl 2013 VISTO el Expediente NO 1-47-23051-12-5 del Registro de esta Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), 1 y CONSIDERANDO:.Que
D1SPOSICION N" 4 2 4 lj BUENOSAIRES, o Z JUl 2013 VISTO el Expediente NO 1-47-23051-12-5 del Registro de esta Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), 1 y CONSIDERANDO:.Que
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
BUENOS AIRES, 05 ole 2012
 .L ''6,.!7..;!7~,,aIg~ ~.J~.s:Y "2012 - Año de Homenaje al doctor D. MANUEL BELGRANO",AJltWY. DISPOSICION Ne 7 1 3 9 BUENOS AIRES, 05 ole 2012 VISTO el Expediente NO 1-47-11547-12-5 del Registro de esta
.L ''6,.!7..;!7~,,aIg~ ~.J~.s:Y "2012 - Año de Homenaje al doctor D. MANUEL BELGRANO",AJltWY. DISPOSICION Ne 7 1 3 9 BUENOS AIRES, 05 ole 2012 VISTO el Expediente NO 1-47-11547-12-5 del Registro de esta
~desat«d SecutaJÚ4de 'P~, íl!?e9<daed.t e 1~,,4,1t,m,A. 7,
 ~desat«d SecutaJÚ4de 'P~, íl!?e9
~desat«d SecutaJÚ4de 'P~, íl!?e9
Ó MEJORAL PARA NIÑOS Y MEJORAL PARA NIÑOS JUNIOR / PARACETAMOL,
 ~desat«l-. Swzeta/Úa. de 'P0t/tua4, ;e~e1~ A.n.?1t. A. 7.... 2014- A.t4
~desat«l-. Swzeta/Úa. de 'P0t/tua4, ;e~e1~ A.n.?1t. A. 7.... 2014- A.t4
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
Expediente N 1-47-4282/10-2 del Registro de esta. Nacional de Medicamentos, Alimentos y Tecnología Médica
 " ~ahyad:d Y~ahY~ c~ej~ "2010 - Año del bicentenario de la Revolución de Mayo" A.N.M.A.T BUENOS AIRES,Q 4 AGO 2010 VISTO el Expediente N 1-47-4282/10-2 del Registro de esta Administración Nacional de Medicamentos,
" ~ahyad:d Y~ahY~ c~ej~ "2010 - Año del bicentenario de la Revolución de Mayo" A.N.M.A.T BUENOS AIRES,Q 4 AGO 2010 VISTO el Expediente N 1-47-4282/10-2 del Registro de esta Administración Nacional de Medicamentos,
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA. * cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014.
 PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014. A quiénes está dirigida la campaña? A todas aquellas personas nacidas entre 1967 y 1986 que no puedan comprobar
PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014. A quiénes está dirigida la campaña? A todas aquellas personas nacidas entre 1967 y 1986 que no puedan comprobar
CHARLA DE VACUNACIÓN INFANTIL PARA MADRES Y PADRES
 CHARLA DE VACUNACIÓN INFANTIL PARA MADRES Y PADRES José Tomás Rojas Centro de Salud Zaidín Sur INFECCIONES Enfermedades producidas por microbios (microscópicos), muy frecuente en la infancia, la mayoría
CHARLA DE VACUNACIÓN INFANTIL PARA MADRES Y PADRES José Tomás Rojas Centro de Salud Zaidín Sur INFECCIONES Enfermedades producidas por microbios (microscópicos), muy frecuente en la infancia, la mayoría
. Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje.
 . Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje. GMSI C/09 Las vacunaciones recomendadas para destinos
. Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje. GMSI C/09 Las vacunaciones recomendadas para destinos
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA INGREDIENTES ACTIVOS Cada dosis de 0,5 ml de vacuna reconstituida contiene:
 1. NOMBRE DEL MEDICAMENTO PENTAVAC Vacuna de difteria, tétanos, tosferina acelular y poliomielitis inactivada, adsorbida y Vacuna de Haemophilus influenzae tipo b conjugada. 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO PENTAVAC Vacuna de difteria, tétanos, tosferina acelular y poliomielitis inactivada, adsorbida y Vacuna de Haemophilus influenzae tipo b conjugada. 2. COMPOSICIÓN CUALITATIVA
Transfusión de sangre
 Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS
 VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
County of Santa Cruz. Preguntas Generales Acerca del Sarampión HEALTH SERVICES AGENCY COMMUNICABLE DISEASE UNIT. Qué es el sarampión?
 County of Santa Cruz HEALTH SERVICES AGENCY COMMUNICABLE DISEASE UNIT POST OFFICE BOX 962, 1060 EMELINE AVENUE SANTA CRUZ, CA 95061-0962 (831) 454-4114 FAX: (831) 454-5049 TDD: (831) 454-4123 Preguntas
County of Santa Cruz HEALTH SERVICES AGENCY COMMUNICABLE DISEASE UNIT POST OFFICE BOX 962, 1060 EMELINE AVENUE SANTA CRUZ, CA 95061-0962 (831) 454-4114 FAX: (831) 454-5049 TDD: (831) 454-4123 Preguntas
1 6,JUl 2013 DISPOSICION N BUENOSAIRES,
 Regulacíón e Institutos A.N.M.A.T. DISPOSICION N BUENOSAIRES, 1 6,JUl 2013 VISTO el Expediente N 1-47-525-13-2 del Registro de esta Administración Nacional de Medicamentos, Alimentos y Tecnología Médica
Regulacíón e Institutos A.N.M.A.T. DISPOSICION N BUENOSAIRES, 1 6,JUl 2013 VISTO el Expediente N 1-47-525-13-2 del Registro de esta Administración Nacional de Medicamentos, Alimentos y Tecnología Médica
VISTO el Expediente No 1-47-1110-4309-04-8 del Registro de la. Administración Nacional de Medicamentos, Alimentos y Tecnología Médica, y
 BUENOS AIRES, 09 Abr 2007 VISTO el Expediente No 1-47-1110-4309-04-8 del Registro de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica, y CONSIDERANDO: Que el Decreto n 150/92 define
BUENOS AIRES, 09 Abr 2007 VISTO el Expediente No 1-47-1110-4309-04-8 del Registro de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica, y CONSIDERANDO: Que el Decreto n 150/92 define
POLIOMIELITIS INTRODUCCIÓN INDICACIONES
 POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
PROSPECTO: INFORMACIÓN PARA EL USUARIO. PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos
 PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
Prospecto: información para el usuario
 Prospecto: información para el usuario Boostrix, Suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
Prospecto: información para el usuario Boostrix, Suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
"2013 - AiW de! 2i'~ de ea AJ4H&a tje-zat ~ de lf13 " DISPOSIC,ON BUENOS AIRES, 25 OCT 2013
 ~desat«d SwzetaJú4de p~, ~e'l~ r1.1t.?1t.r1. 7, "2013 - AiW de! 2i'~ de ea AJ4H&a tje-zat ~ de lf13 " DISPOSIC,ON No65t4 BUENOS AIRES, 25 OCT 2013 VISTO el Expediente N0 1-0047-0000-007804-13-0 del Registro
~desat«d SwzetaJú4de p~, ~e'l~ r1.1t.?1t.r1. 7, "2013 - AiW de! 2i'~ de ea AJ4H&a tje-zat ~ de lf13 " DISPOSIC,ON No65t4 BUENOS AIRES, 25 OCT 2013 VISTO el Expediente N0 1-0047-0000-007804-13-0 del Registro
FICHA TÉCNICA. Cantidad: Los ingredientes activos en 1 ml de VITALIPID INFANTIL corresponden a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Kytril 1 mg/1 ml solución inyectable Granisetrón
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Kytril 1 mg/1 ml solución inyectable Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO Kytril 1 mg/1 ml solución inyectable Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
Que es la rubéola? Todas las personas que se contagian con el virus de la rubéola tienen los síntomas de la enfermedad?
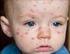 Que es la rubéola? Es una enfermedad causad por un virus. Se caracteriza por fiebre, ganglios agrandados (principalmente en el cuello y detrás de las orejas) y erupción en la piel que dura de 3 a 5 días,
Que es la rubéola? Es una enfermedad causad por un virus. Se caracteriza por fiebre, ganglios agrandados (principalmente en el cuello y detrás de las orejas) y erupción en la piel que dura de 3 a 5 días,
Qué son las vacunas y cómo actúan?
 Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
MINISTERIO DE SALUD DIRECCIÓN NACIONAL DE FARMACIA Y DROGAS DEPARTAMENTO DE REGISTRO SANITARIO DE MEDICAMENTOS Y OTROS PRODUCTOS PARA LA SALUD HUMANA
 MINISTERIO DE SALUD DIRECCIÓN NACIONAL DE FARMACIA Y DROGAS DEPARTAMENTO DE REGISTRO SANITARIO DE MEDICAMENTOS Y OTROS PRODUCTOS PARA LA SALUD HUMANA GUÍA SOBRE EL PROCEDIMIENTO PARA EL REGISTRO SANITARIO
MINISTERIO DE SALUD DIRECCIÓN NACIONAL DE FARMACIA Y DROGAS DEPARTAMENTO DE REGISTRO SANITARIO DE MEDICAMENTOS Y OTROS PRODUCTOS PARA LA SALUD HUMANA GUÍA SOBRE EL PROCEDIMIENTO PARA EL REGISTRO SANITARIO
Esquema nacional de vacunación 2015
 Esquema nacional de vacunación 2015 Definiciones en el PAI Susceptible Cualquier persona o animal que supuestamente no posee suficiente resistencia contra un agente patógeno determinado, que le proteja
Esquema nacional de vacunación 2015 Definiciones en el PAI Susceptible Cualquier persona o animal que supuestamente no posee suficiente resistencia contra un agente patógeno determinado, que le proteja
PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado)
 1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
VACUNACIÓN EN HUESPEDES ESPECIALES
 VACUNACIÓN EN HUESPEDES ESPECIALES E N F E R M E R A V A N E S A A R G Ü E L L O INMUNIDAD BACTERIANAS VIRALES VIVAS ATENUADAS BCG Sarampión Paperas Rubéola Varicela OPV Fiebre Amarilla Rotavirus INACTIVADAS
VACUNACIÓN EN HUESPEDES ESPECIALES E N F E R M E R A V A N E S A A R G Ü E L L O INMUNIDAD BACTERIANAS VIRALES VIVAS ATENUADAS BCG Sarampión Paperas Rubéola Varicela OPV Fiebre Amarilla Rotavirus INACTIVADAS
BUENOS AIRES, O 6 FES 2012. VISTO el Expediente NO 1-0047-0000-014526-11-1 el. Registro de la Administración Nacional de Medicamentos Alimentos y
 ~desat«d "2012 - Aii6 de ~0Hte«4je al dodm 'D. 1KA7tU&.t 'l1&.téj;j;mw" Swzeta1Ú4 de 'P~4, íii?~d.óh e 1~ A.n.?1t. A, 7, OISPOSICIÓN (fl BUENOS AIRES, O 6 FES 2012 VISTO el Expediente NO 1-0047-0000-014526-11-1
~desat«d "2012 - Aii6 de ~0Hte«4je al dodm 'D. 1KA7tU&.t 'l1&.téj;j;mw" Swzeta1Ú4 de 'P~4, íii?~d.óh e 1~ A.n.?1t. A, 7, OISPOSICIÓN (fl BUENOS AIRES, O 6 FES 2012 VISTO el Expediente NO 1-0047-0000-014526-11-1
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH)
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
LACTEOL POLVO PARA SUSPENSIÓN ORAL Lactobacillus acidophilus
 LACTEOL POLVO PARA SUSPENSIÓN ORAL Lactobacillus acidophilus Lea todo el prospecto detenidamente porque contiene información importante para Usted. Este medicamento puede obtenerse sin receta para el tratamiento
LACTEOL POLVO PARA SUSPENSIÓN ORAL Lactobacillus acidophilus Lea todo el prospecto detenidamente porque contiene información importante para Usted. Este medicamento puede obtenerse sin receta para el tratamiento
BUENOS AIRES, 2 1 FEB 2013
 ~desa6td S~deP~, ~~e'l~ A.1t.??t. A. 7. "201S - Ai4 dd g'~ de f4 A~ ~ ~ de 111S" BUENOS AIRES, 2 1 FEB 2013 VISTO el Expediente NO 1-0047-0000-013887-12-2 del Registro de la Administración Nacional de
~desa6td S~deP~, ~~e'l~ A.1t.??t. A. 7. "201S - Ai4 dd g'~ de f4 A~ ~ ~ de 111S" BUENOS AIRES, 2 1 FEB 2013 VISTO el Expediente NO 1-0047-0000-013887-12-2 del Registro de la Administración Nacional de
FICHA TÉCNICA. STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Temporada de Influenza 2015-2016
 Temporada de Influenza 2015-2016 22 de octubre, 2015 Dr. Eduardo Azziz-Baumgartner Objetivos Conceptos básicos sobre la influenza Impacto de la enfermedad Recomendaciones de vacunación para este año Porque
Temporada de Influenza 2015-2016 22 de octubre, 2015 Dr. Eduardo Azziz-Baumgartner Objetivos Conceptos básicos sobre la influenza Impacto de la enfermedad Recomendaciones de vacunación para este año Porque
BUENOS AIRES, Z 4 JUN 2013. Administración Nacional de Medicamentos, Alimentos y Tecnología Medica; y
 ~desat«d S~de?~. íl!?'9«tadóu e 1~ A. n.?1t.a. 7. DISPOSICION N" 3 8 9 O BUENOS AIRES, Z 4 JUN 2013 VISTO el Expediente NO 1-0047-0000-00369-13-4 del Registro de la Administración Nacional de Medicamentos,
~desat«d S~de?~. íl!?'9«tadóu e 1~ A. n.?1t.a. 7. DISPOSICION N" 3 8 9 O BUENOS AIRES, Z 4 JUN 2013 VISTO el Expediente NO 1-0047-0000-00369-13-4 del Registro de la Administración Nacional de Medicamentos,
EchinaMed Junior, comprimidos
 EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
Administración Nacional de Medicamentos Alimentos y Tecnología Medica. S.A.Le. solicita autorización para la venta a laboratorios de análisis
 A.N.M.A. T. DI8f.lOSlmem N' 856 9 BUENOS AIRES, 20 Die 2011 VISTO el expediente NO 1-47-21992/10-1 del Registro de la Administración Nacional de Medicamentos Alimentos y Tecnología Medica y, CONSIDERANDO:
A.N.M.A. T. DI8f.lOSlmem N' 856 9 BUENOS AIRES, 20 Die 2011 VISTO el expediente NO 1-47-21992/10-1 del Registro de la Administración Nacional de Medicamentos Alimentos y Tecnología Medica y, CONSIDERANDO:
R~e1~,,4.1/.?It, A. 7,
 ~desat«d S~ de'1'otiticm, R~e1~,,4.1/.?t, A. 7, "2015 - AÑO DEL BCENTENARO DEL CONGRESO DE LOS PUEBLOS LBRES" OSPOSCON N 9 5 91 BUENOSARES, 12 140'1 ~01~ VSTO el Expediente N 1-0047-0000-015301-14-3 del
~desat«d S~ de'1'otiticm, R~e1~,,4.1/.?t, A. 7, "2015 - AÑO DEL BCENTENARO DEL CONGRESO DE LOS PUEBLOS LBRES" OSPOSCON N 9 5 91 BUENOSARES, 12 140'1 ~01~ VSTO el Expediente N 1-0047-0000-015301-14-3 del
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DURAMUNE CACHORROS DP + C Liofilizado y disolvente para suspensión inyectable para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
REEMBOLSO DE GASTOS DE FARMACIA 2016
 REEMBOLSO DE GASTOS DE FARMACIA 2016 Garantía prestada desde 1 de enero de 2014 exclusivamente para clientes particulares de los productos Caser Salud Prestigio, Caser Salud Integral y Caser Salud Activa.
REEMBOLSO DE GASTOS DE FARMACIA 2016 Garantía prestada desde 1 de enero de 2014 exclusivamente para clientes particulares de los productos Caser Salud Prestigio, Caser Salud Integral y Caser Salud Activa.
Información general sobre Gripe
 Información general sobre Gripe Fuentes Facultad de Ciencias Médicas UCA Ministerio de Salud del Gobierno de la Ciudad de Buenos Aires Ministerio de Salud del Gobierno Nacional Qué es la gripe o influenza?
Información general sobre Gripe Fuentes Facultad de Ciencias Médicas UCA Ministerio de Salud del Gobierno de la Ciudad de Buenos Aires Ministerio de Salud del Gobierno Nacional Qué es la gripe o influenza?
LISTA DE CHEQUEO REQUISITOS REGISTRO SANITARIO MEDICAMENTOS
 LISTA DE CHEQUEO REQUISITOS REGISTRO SANITARIO MEDICAMENTOS Los requisitos para registro sanitario son los siguientes: 7.1. Solicitud firmada y sellada por el Profesional Responsable conteniendo la información
LISTA DE CHEQUEO REQUISITOS REGISTRO SANITARIO MEDICAMENTOS Los requisitos para registro sanitario son los siguientes: 7.1. Solicitud firmada y sellada por el Profesional Responsable conteniendo la información
RECOMENDACIONES PARA EVITAR PREVENCIONES
 RECOMENDACIONES PARA EVITAR PREVENCIONES COFEPRIS 04-022 SOLICITUD DE PRÓRROGA DEL REGISTRO SANITARIO DE MEDICAMENTOS, HERBOLARIOS, VITAMÍNICOS Y HOMEOPÁTICOS MODALIDAD A PRÓRROGA DEL REGISTRO SANITARIO
RECOMENDACIONES PARA EVITAR PREVENCIONES COFEPRIS 04-022 SOLICITUD DE PRÓRROGA DEL REGISTRO SANITARIO DE MEDICAMENTOS, HERBOLARIOS, VITAMÍNICOS Y HOMEOPÁTICOS MODALIDAD A PRÓRROGA DEL REGISTRO SANITARIO
~ de Registro. DtSPOSitiÓ(l! W 2 o 2 1 BUENOS AIRES, 1 L ABR 2013
 "2013- Afio del Bicentenario de la Asamblea General Constituyente de 1813" DtSPOSitiÓ(l! W 2 o 2 1 BUENOS AIRES, 1 L ABR 2013 VISTO el Expediente NO 1-47-23225-10-3 del Registro de esta Administración
"2013- Afio del Bicentenario de la Asamblea General Constituyente de 1813" DtSPOSitiÓ(l! W 2 o 2 1 BUENOS AIRES, 1 L ABR 2013 VISTO el Expediente NO 1-47-23225-10-3 del Registro de esta Administración
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
VIH. Conozca los Factores. Respuestas a 10 Preguntas Importantes Sobre VIH/SIDA. Departmento de Salud Pública de Illinois
 VIH Conozca los Factores Respuestas a 10 Preguntas Importantes Sobre VIH/SIDA Departmento de Salud Pública de Illinois 1 2 3 4 Qué es el VIH? El VIH se refiere al virus de inmunodeficiencia humano. El
VIH Conozca los Factores Respuestas a 10 Preguntas Importantes Sobre VIH/SIDA Departmento de Salud Pública de Illinois 1 2 3 4 Qué es el VIH? El VIH se refiere al virus de inmunodeficiencia humano. El
BUENOSAIRES'1 7 JUN 2013. VISTO el Expediente NO 1-0047-0000-005887-13-5 Y. VARIFARMA SA, solicita la corrección de errores materiales que se
 8 "20/S ~eúsat«d Se
8 "20/S ~eúsat«d Se
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
1. DOCUMENTO DE INFORMACIÓN PARA (*) CIRUGÍA DE LA INCURVACION DE PENE
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Sustancias activas: Virus RSB, cepa EV908, inactivado mínimo 10 5,5 *
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BOVIPAST RSP, suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BOVIPAST RSP, suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
BUENOS AIRES, Nacional de Medicamentos, Alimentos y Tecnología Médica; y
 150/92. ~~ ~ Ministerio de Salud A,NMA.T DISPOSICION N- 7 6 O 2 BUENOS AIRES, D 1 ole 2010 VISTO el Expediente N 1-47-0000-6140-10-4 del Registro de la Administración Nacional de Medicamentos, Alimentos
150/92. ~~ ~ Ministerio de Salud A,NMA.T DISPOSICION N- 7 6 O 2 BUENOS AIRES, D 1 ole 2010 VISTO el Expediente N 1-47-0000-6140-10-4 del Registro de la Administración Nacional de Medicamentos, Alimentos
DiS?OSICIÚN N BUENOS AIRES, 2 2 FEB. 2016. Registro de la Administración Nacional de Medicamentos, Alimentos y
 ~desat«d S~de'P~, 'R~e1_ 1'11t?/t.,,4. 7. DiS?OSICIÚN N 16 8 Q BUENOS AIRES, 2 2 FEB. 2016 VISTO el Expediente NO 1-0047-0000-001115-15-6 del Registro de la Administración Nacional de Medicamentos, Alimentos
~desat«d S~de'P~, 'R~e1_ 1'11t?/t.,,4. 7. DiS?OSICIÚN N 16 8 Q BUENOS AIRES, 2 2 FEB. 2016 VISTO el Expediente NO 1-0047-0000-001115-15-6 del Registro de la Administración Nacional de Medicamentos, Alimentos
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
CONTRATACIÓN DE SERVICIOS DE TERCERIZACIÓN DE PRODUCTOS DOMISANITARIOS FABRICADOS EN EL ÁMBITO DEL MERCOSUR
 MERCOSUR/GMC/RES. N 24/06 CONTRATACIÓN DE SERVICIOS DE TERCERIZACIÓN DE PRODUCTOS DOMISANITARIOS FABRICADOS EN EL ÁMBITO DEL MERCOSUR VISTO: El Tratado de Asunción, el Protocolo de Ouro Preto, la Decisión
MERCOSUR/GMC/RES. N 24/06 CONTRATACIÓN DE SERVICIOS DE TERCERIZACIÓN DE PRODUCTOS DOMISANITARIOS FABRICADOS EN EL ÁMBITO DEL MERCOSUR VISTO: El Tratado de Asunción, el Protocolo de Ouro Preto, la Decisión
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
1. DOCUMENTO DE INFORMACIÓN PARA (*) ACUPUNTURA, MOXIBUSTIÓN Y AURICULOTERAPIA
 FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
FORMULARIO DE INFORMACIÓN Y CONSENTIMIENTO INFORMADO ESCRITO Orden de 8 de julio de 2009 (BOJA nº 152 de fecha 6 de agosto) por la que se dictan instrucciones a los Centros del Sistema Sanitario Público
DI8P08t010N ft 4 1 4 O
 "2011 Año del Trabajo Decente, la Salud y Seguridad de los Trabajadores" DI8P08t010N ft 4 1 4 O BUENOS AIRES, 1 5 JUN 20" VISTO el Expediente N 1-47-4226-11-1 del Registro de esta Administración Nacional
"2011 Año del Trabajo Decente, la Salud y Seguridad de los Trabajadores" DI8P08t010N ft 4 1 4 O BUENOS AIRES, 1 5 JUN 20" VISTO el Expediente N 1-47-4226-11-1 del Registro de esta Administración Nacional
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
Cáncer. de ovario. Diario del tratamiento
 Cáncer de ovario Diario del tratamiento Recuerde que si no se encuentra bien después del tratamiento o le preocupa cómo estará entre las visitas a la consulta del médico, puede ponerse en contacto con
Cáncer de ovario Diario del tratamiento Recuerde que si no se encuentra bien después del tratamiento o le preocupa cómo estará entre las visitas a la consulta del médico, puede ponerse en contacto con
COMPOSICIÓN ANGILEPTOL. Sabor Menta Comprimidos
 COMPOSICIÓN ANGILEPTOL Sabor Menta Comprimidos Cada comprimido contiene: Principios activos: Clorhexidina (D.C.I) HCl... 5 mg Benzocaína (D.C.I.)... 4 mg Enoxolona (D.C.I.)... 3 mg Excipientes: Sorbitol
COMPOSICIÓN ANGILEPTOL Sabor Menta Comprimidos Cada comprimido contiene: Principios activos: Clorhexidina (D.C.I) HCl... 5 mg Benzocaína (D.C.I.)... 4 mg Enoxolona (D.C.I.)... 3 mg Excipientes: Sorbitol
Alérgenos y reacciones alérgicas
 UNIDAD DIDÁCTICA 6 Alérgenos y reacciones alérgicas Se producen reacciones anormales del organismo en aquellas personas sensibles a determinadas sustancias. Según los causantes de la reacción, existen
UNIDAD DIDÁCTICA 6 Alérgenos y reacciones alérgicas Se producen reacciones anormales del organismo en aquellas personas sensibles a determinadas sustancias. Según los causantes de la reacción, existen
VITRIFICACIÓN DE ÓVULOS (OVOCITOS)
 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 1 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 2 Es una técnica que se considera un procedimiento experimental, destinada a conservar gametos femeninos con fines reproductivos,
VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 1 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 2 Es una técnica que se considera un procedimiento experimental, destinada a conservar gametos femeninos con fines reproductivos,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Por dosis de 0,4 ml de vacuna reconstituida con el diluyente (agua para preparaciones inyectables):
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac KC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 0,4 ml de vacuna reconstituida con el diluyente
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac KC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 0,4 ml de vacuna reconstituida con el diluyente
Documentos Técnicos n.º 2
 Documentos Técnicos n.º 2 1 PAUTAS HABITUALES DE VACUNACIÓN Y ACTUALIZACIÓN DE CALENDARIO DE VACUNACIONES. AÑO 2006. Lo deseable es incorporar al niño que comienza o completa su vacunación al calendario
Documentos Técnicos n.º 2 1 PAUTAS HABITUALES DE VACUNACIÓN Y ACTUALIZACIÓN DE CALENDARIO DE VACUNACIONES. AÑO 2006. Lo deseable es incorporar al niño que comienza o completa su vacunación al calendario
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
La vacuna pentavalente oral contra rotavirus puede ser tolerable
 La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de
La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de

 ~nisterio de Sa~ud S~ de PotttieM, í(!et}cd4~ e 1H4t
~nisterio de Sa~ud S~ de PotttieM, í(!et}cd4~ e 1H4t