Sólidos Iónicos El enlace Iónico (1)
|
|
|
- Alberto Olivares Benítez
- hace 6 años
- Vistas:
Transcripción
1 1 Sólidos Iónicos El enlace Iónico (1)
2 2 * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, Capítulo 4. * Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, Capítulo 5. * Douglas, B.; McDaniel, D.; Alexander. J., Problems for Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, Capítulo 5. * Casabó i Gispert, J, Estructura Atómica y Enlace Químico, Reverté, Capítulo 14. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, Capítulo 3. * Moeller, T., Inorganic Chemistry. A Modern Introduction, John Wiley & Sons, Traducción española:, Reverté, Capítulo 4. * Housecroft, C. E.; Sharpe, A. G., Inorganic Chemistry, 3ª Ed., Pearson Prentice Hall, Capítulo 6. Traducción española de la 2ª Ed., Pearson Prentice Hall, Capítulo 5. * Atkins, P.; Overton, T.; Rourke, J.; Weller, M.; Armstrong, F., (Shriver-Atkins) Inorganic Chemistry, 4ª Ed., Oxford University Press, Traducción española de la 4ª Ed., McGraw-Hill Interamericana, Capítulo 3. * Rodgers, G. E., Introduction to Coordination, Solid-state and Descriptive Inorganic Chemistry, McGraw- Hill, Traducción española:, Introducción a la Química de Coordinación, del Estado Sólido y Descriptiva, McGraw-Hill, Capítulo 7 y 8.
3 3 Compuestos iónicos Propiedades diferentes de los covalentes. Propiedades relacionadas con la estructura cristalina, la presencia de dos tipos de partículas, y las interacciones existentes entre ellas. 1) Muy baja o nula conductividad en estado sólido. Abribuida a la presencia de partículas con carga eléctrica, pero ocupando posiciones fijas y con una movilidad muy restringida. Conductores en disolución o fundidos. Forma iones con total libertad de movimiento. No implica su existencia en sólido. 2) Puntos de fusión y ebullición elevados. Interacciones iónicas fuertes y omnidireccionales. * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993, pp 92. * Casabó i Gispert, J, Estructura Atómica y Enlace Químico, Reverté, 1999, pp 298.
4 4 Compuestos iónicos Propiedades diferentes de los covalentes. Propiedades relacionadas con la estructura cristalina, la presencia de dos tipos de partículas, y las interacciones existentes entre ellas. 3) Compuestos muy duros, pero muy frágiles Interacciones iónicas fuertes y omnidireccionales. Interacciones atractivas y repulsivas. Kotz, J. C.; Treichel, P. M., Química y Reactividad Química, 5ª Ed., Thomson Paraninfo, 2003, pp 95. 4) Solubles en disolventes polares. E = q + q 4 r Polaridad disolvente,, 1/, E, atracción Efecto de la solvatación (Ión Dipolo) Vacío o = 8, C 2 m 1 J 1 H 2 O = 7, C 2 m 1 J 1 = 82 o MeCN = 2, C 2 m 1 J 1 = 33 o NH 3 = 2, C 2 m 1 J 1 = 25 o * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993, pp 92. * Casabó i Gispert, J, Estructura Atómica y Enlace Químico, Reverté, 1999, pp 298.
5 5 Compuestos iónicos: Elementos con gran diferencia de electronegatividad. Elementos metálicos muy activos (M + ) P.I. Favorables Elementos no metálicos muy activos (X ) A.E. * Atomos capaces de perder 1-2 electrones (raramente 3) Li, Na, K, Be, Mg, Ca, Sr, * Atomos capaces de ganar 1-2 electrones (casi nunca 3) F, Cl, Br, O, S, Se, * Cationes de los metales más activos: Grupo 1 (Li, Na, ) 2 (Be, Mg, ) y parte del 13 (Ga, In) Algunos metales de transición en estados de oxidación bajos Sn 2+, Pb 2+ (n s 2 ) Cu 2 2+, Ag +, Au +, Zn 2+, Cd 2+, Hg 2+ (n-1 d 10 ), Fe 3+, Mn 2+ (n-1 d 5 ) P.I. Endotérmicos, pequeños en valor absoluto. * Aniones de los no metales más activos: Grupo 17 (F, Cl, ) 16 (O, S, ) y el N Oxidación / Reducción * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993, pp 92. * Casabó i Gispert, J, Estructura Atómica y Enlace Químico, Reverté, 1999, pp 298.
6 6 Iónico puro, Electrones localizados enteramente en los aniones Sin delocalización electrónica (metálico) Sin compartición electrónica (covalente) Nº Coord max. 8 menos compactos que los metales menos densos que los metales Menos elásticos No mecanizables Sólidos Iónicos: NO existen moléculas discretas Químicamente Iones y átomos de procedencia son cosas radicalmente distintas Na: 1s 2 2s 2 2p 6 3s 1 Metal reacciona violentamente con el agua dando NaOH Reductor color metálico Na + : 1s 2 2s 2 2p 6 Catión soluble en agua poco reactivo incoloro Na + F Mg 2+ O 2 Na + Mg 2+ 1s 2 2s 2 2p 6 F O 2 1s 2 2s 2 2p 6 Isomórficos * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993, pp 92. * Casabó i Gispert, J, Estructura Atómica y Enlace Químico, Reverté, 1999, pp 298.
7 Estructuras Cristalinas 7 Estructura cristalina iónica, inherente al estado sólido. Se trata de acomodar dos tipos de partícula en una estructura cristalina siguiendo ciertas reglas: 1) Cada catión debe rodearse del máximo número posible de aniones (número de coordinación del catión) y cada anión debe rodearse del máximo número posible de cationes (número de coordinación del anión). 2) La separación entre iones de igual signo debe ser la máxima posible (minimizar repulsiones) al tiempo que la separación entre iones de distinto signo deber ser la mínima posible (maximizar atracciones). 3) Debe respetarse la neutralidad eléctrica de la estructura, la proporción de aniones y cationes debe ser la correspondiente a la estequiometría del compuesto. Sólidos Iónicos: Su fórmula química nos indica la proporción en que participan aniones y cationes en la estructura cristalina resultante Unidades fórmula SI Moléculas discretas NO Modelo de empaquetamiento de aniones Radio del anión r Radio hueco Td 0,225 r Radio hueco Oh 0,414 r * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
8 8 Tipos de Redes Cationes en huecos Octaédricos Red Tipo NaCl Empaquetamiento Cúbico Compacto de Aniones Cationes ocupando todos los huecos Oh Nº coordinación anión 6 Nº coordinación catión 6 Coordinación 6:6 Gillespie, R. J.; Popelier, P. L. A., Chemical Bonding and Molecular Geometry, Oxford University Press, 2001, pp 9. 4 Unidades fórmula en la celda unidad Fig - 84 Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 56. Housecroft, C. E.; Sharpe, A. G., Inorganic Chemistry, 3ª Ed., Pearson Prentice Hall, pp 165. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
9 9 Tipos de Redes Cationes en huecos Octaédricos Red Tipo NaCl Empaquetamiento Cúbico Compacto de Aniones NaN 3 Cationes ocupando todos los huecos Oh Nº coordinación anión 6 Fig - 87 Nº coordinación catión 6 Coordinación 6:6 Fig - 86 Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, 1994, pp 213. Atkins, P.; Overton, T.; Rourke, J.; Weller, M.; Armstrong, F., Traducción española de la 4ª Ed., McGraw-Hill Interamericana, 2008, pp 85. Fig - 85 * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
10 10 Tipos de Redes Cationes en huecos Octaédricos Red Tipo NaCl Empaquetamiento Cúbico Compacto de Aniones Cationes ocupando todos los huecos Oh Nº coordinación anión 6 Nº coordinación catión 6 Coordinación 6:6 Fig - 88 Fig - 89 Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, 1994, pp 213. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
11 11 Tipos de Redes Cationes en huecos Octaédricos Red Tipo NiAs Empaquetamiento Hexagonal Compacto de Aniones Cationes ocupando todos los huecos Oh Nº coordinación anión 6 Nº coordinación catión 6 Coordinación 6:6 4 Unidades fórmula en la celda unidad Fig - 90 Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, 1994, pp 207. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
12 12 Tipos de Redes Cationes en huecos Octaédricos Red Tipo Rutilo, TiO 2 Empaquetamiento Hexagonal Compacto de Aniones Cationes ocupando la mitad de los huecos Oh Nº coordinación anión 3 Nº coordinación catión Ti 4+ 6 Coordinación 3:6 2 Unidades fórmula en la celda unidad Fig - 91 Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 56. Housecroft, C. E.; Sharpe, A. G., Inorganic Chemistry, 3ª Ed., Pearson Prentice Hall, pp 170. Atkins, P.; Overton, T.; Rourke, J.; Weller, M.; Armstrong, F., Traducción española de la 4ª Ed., McGraw-Hill Interamericana, 2008, pp 88. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
13 13 Tipos de Redes Cationes en huecos Octaédricos Red Tipo Perovskita, CaTiO 3 Empaquetamiento Cúbico Compacto de O 2 (caras) y Ca 2+ Vértices Catión Ti 4+ ocupando 1/4 de los huecos Oh Nº coordinación catión Ti 4+ : 6 O 2, 8 Ca 2+ Nº coordinación catión Ca 2+ : 6 Ca 2+, 12 O 2, 8 Ti 4+ 1 Unidad fórmula en la celda unidad Fig - 92 Fig - 93 Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, 1994, pp 209. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
14 14 Tipos de Redes Cationes en huecos Tetraédricos Red Tipo Blenda, ZnS Empaquetamiento Cúbico Compacto de Aniones Cationes ocupando la mitad de los huecos Td Nº coordinación anión 4 Nº coordinación catión 4 Coordinación 4:4 Atkins, P.; Overton, T.; Rourke, J.; Weller, M.; Armstrong, F., Traducción española de la 4ª Ed., McGraw-Hill Interamericana, 2008, pp Unidades fórmula en la celda unidad Fig - 95 Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 56. Housecroft, C. E.; Sharpe, A. G., Inorganic Chemistry, 3ª Ed., Pearson Prentice Hall, pp 168. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
15 15 Tipos de Redes Cationes en huecos Tetraédricos Red Tipo Wurtzita, ZnS Empaquetamiento Hexagonal Compacto de Aniones Cationes ocupando la mitad de los huecos Td Nº coordinación anión 4 Nº coordinación catión 4 Coordinación 4:4 8 Unidades fórmula en la celda unidad Fig - 94 Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 56. Housecroft, C. E.; Sharpe, A. G., Inorganic Chemistry, 3ª Ed., Pearson Prentice Hall, pp 170. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
16 16 Tipos de Redes Cationes en huecos Tetraédricos Red Tipo Fluorita, CaF 2 Empaquetamiento Cúbico Compacto de Cationes Aniones ocupando todos los huecos Td Nº coordinación anión 4 Nº coordinación catión 8 Coordinación 4:8 Atkins, P.; Overton, T.; Rourke, J.; Weller, M.; Armstrong, F., Traducción española de la 4ª Ed., McGraw-Hill Interamericana, 2008, pp Unidades fórmula en la celda unidad Fig - 96 Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 56. Housecroft, C. E.; Sharpe, A. G., Inorganic Chemistry, 3ª Ed., Pearson Prentice Hall, pp 168. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
17 17 Tipos de Redes Cationes en huecos Tetraédricos Red Tipo anti-fluorita, M 2 X Empaquetamiento Cúbico Compacto de Aniones Cationes ocupando todos los huecos Td Nº coordinación catión 4 Nº coordinación anión 8 Coordinación 8:4 4 Unidades fórmula en la celda unidad Fig - 97 Fig - 98 Casabó i Gispert, J, Estructura Atómica y Enlace Químico, Reverté, 1999, pp 315. Fig - 99 Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, 1994, pp 210. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
18 18 Tipos de Redes Cationes en huecos Tetraédricos Red Tipo PtS Empaquetamiento Cúbico Compacto de Pt 2+ S 2 ocupando la mitad de los huecos Td Nº coordinación catión Pt 2+ 4 plano cuadrado Nº coordinación anión S 2 4 tetraédrico Coordinación 4:4 Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, 1994, pp 210. Fig Unidades fórmula en la celda unidad * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
19 19 Tipos de Redes Cationes en huecos Red Tipo BiF 3 Empaquetamiento Cúbico Compacto de Bi 3+ /C 3 60 F /K + ocupando todos los huecos Td y Oh 4 Unidades fórmula en la celda unidad Fig Atkins, P.; Overton, T.; Rourke, J.; Weller, M.; Armstrong, F., Traducción española de la 4ª Ed., McGraw-Hill Interamericana, 2008, pp 322 y 637. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
20 20 Tipos de Redes Cationes en huecos Red Tipo CsCl Empaquetamiento Cúbico Simple de aniones Cl Cationes Cs + ocupando el centro del cubo Nº coordinación catión 8 Nº coordinación anión 8 Coordinación 8:8 1 Unidad fórmula en la celda unidad Housecroft, C. E.; Sharpe, A. G., Inorganic Chemistry, 3ª Ed., Pearson Prentice Hall, pp 168. Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 56. Fig * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
21 21 Tipos de Redes Cationes en huecos Red Tipo CdI 2 Empaquetamiento Hexagonal Compacto de aniones I Fig Cationes Cd 2+ ocupando la mitad de los huecos Oh por capas alternas Atkins, P.; Overton, T.; Rourke, J.; Weller, M.; Armstrong, F., Traducción española de la 4ª Ed., McGraw-Hill Interamericana, 2008, pp 450. Red Tipo PdCl 2 Housecroft, C. E.; Sharpe, A. G., Inorganic Chemistry, 3ª Ed., Pearson Prentice Hall, pp 170. Cationes Pd 2+ ocupando la mitad de los huecos Td por capas alternas Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, 1994, pp 219. Fig * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
22 22 Tipos de Redes Cationes en huecos Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3ª Ed., John Wiley & Sons, 1994, pp 222. Fig * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
23 23 Tipos de Redes Cationes en huecos Fig Casabó i Gispert, J, Estructura Atómica y Enlace Químico, Reverté, 1999, pp 315. * Gutiérrez Ríos, E,, 2ª Ed. Reverté, 1984, pp 55.
Sólidos Covalentes. Tema 4: Estado Sólido. QUIMICA GENERAL Química Inorgánica Sólidos Covalentes
 Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
Tema 5: Fuerzas Intermoleculares. QUIMICA GENERAL Química Inorgánica Sólidos Moleculares. Profesor: Rafael Aguado Bernal. Sólidos Moleculares
 1 Sólidos Moleculares 2 * uheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., arper Collins, 1993. Capítulo 8. * Douglas, B.; McDaniel, D.;
1 Sólidos Moleculares 2 * uheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., arper Collins, 1993. Capítulo 8. * Douglas, B.; McDaniel, D.;
Estructura de sólidos
 Estructura de sólidos Química Inorgánica - 2006 Tipos de estructuras cristalinas cristal enlace características molecular covalente-baja energía cristales blandos, bajo p.f. red covalente covalente cristales
Estructura de sólidos Química Inorgánica - 2006 Tipos de estructuras cristalinas cristal enlace características molecular covalente-baja energía cristales blandos, bajo p.f. red covalente covalente cristales
EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA
 EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA Las 6 preguntas siguientes se refieren a la tabla periódica que se presenta. Los símbolos han sido asignados arbitrariamente. D H B A E M G J L R X Y N P Q Z T
EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA Las 6 preguntas siguientes se refieren a la tabla periódica que se presenta. Los símbolos han sido asignados arbitrariamente. D H B A E M G J L R X Y N P Q Z T
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
Consideraciones sobre estructuras representativas
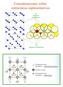 Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
SÓLIDOS INORGÁNICOS. Tema 6. FUNDAMENTOS
 SÓLIDOS INORGÁNICOS Tema 6. Fundamentos Tema 7. Sólidos metálicos Tema 8. Sólidos iónicos Tema 9. Sólidos covalentes Tema 10. Sólidos moleculares Tema 11. Defectos y no-estequiometría Tema 12. Propiedades
SÓLIDOS INORGÁNICOS Tema 6. Fundamentos Tema 7. Sólidos metálicos Tema 8. Sólidos iónicos Tema 9. Sólidos covalentes Tema 10. Sólidos moleculares Tema 11. Defectos y no-estequiometría Tema 12. Propiedades
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
Tema 9: Estabilidad de compuestos de coordinación. Aspectos termodinámicos
 1.-Estabilidad de compuestos termodinámicos -La estabilidad en compuestos suele definirse por la constante de equilibrio: M m+ (aq) + L n- ML (m-n)+ (aq) K = [ML (m-n)+ ] [M m+ ][L n- ] -Por ejemplo: [Cu(H
1.-Estabilidad de compuestos termodinámicos -La estabilidad en compuestos suele definirse por la constante de equilibrio: M m+ (aq) + L n- ML (m-n)+ (aq) K = [ML (m-n)+ ] [M m+ ][L n- ] -Por ejemplo: [Cu(H
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13
 CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
Química Inorgánica-63.13- Dra.Silvia E. Jacobo. Sólidos. Estructuras Cristalinas
 Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
Tema 8. Sólidos iónicos
 Tema 8. Sólidos iónicos Definiciones Estructuras iónicas Derivadas de CCP Derivadas de HCP Derivadas de empaquetamientos no compactos Racionalización de las estructuras iónicas Principios de Laves Reglas
Tema 8. Sólidos iónicos Definiciones Estructuras iónicas Derivadas de CCP Derivadas de HCP Derivadas de empaquetamientos no compactos Racionalización de las estructuras iónicas Principios de Laves Reglas
Tipos de estructuras. Introducción a la Ciencia de Materiales. M. Bizarro F. M. Sánchez
 Tipos de estructuras Empaquetamiento compacto Son estructuras formadas por átomos de igual tamaño que se unen mediante enlace metálico (esferas duras) A B A : A B C : FCC vs HCP El factor de empaquetamiento
Tipos de estructuras Empaquetamiento compacto Son estructuras formadas por átomos de igual tamaño que se unen mediante enlace metálico (esferas duras) A B A : A B C : FCC vs HCP El factor de empaquetamiento
TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES
 PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
ENLACE QUIMICO Y ESTRUCTURA DE LA MATERIA
 Licenciatura en Química 1-5 CÓDIGO: B053/99/7424 CURSO 2002-2003 Carga docente: 7 créditos (5 teóricos + 2 prácticos) Curso: 1º, Troncal Primer cuatrimestre Departamento: Química Inorgánica Profesor/es:
Licenciatura en Química 1-5 CÓDIGO: B053/99/7424 CURSO 2002-2003 Carga docente: 7 créditos (5 teóricos + 2 prácticos) Curso: 1º, Troncal Primer cuatrimestre Departamento: Química Inorgánica Profesor/es:
CAPITULO 2 LA TABLA PERIODICA
 1.0079 1 H HIDROGENO 6.941 3 Li LITIO 22.989 11 Na SODIO 30.098 19 K POTASIO CAPITULO 2 LA TABLA PERIODICA ORDENAMIENTO ACTUAL GRUPOS Y PERIODOS PROPIEDADES PERIODICAS TAMAÑO POTENCIAL DE IONIZACION AFINIDAD
1.0079 1 H HIDROGENO 6.941 3 Li LITIO 22.989 11 Na SODIO 30.098 19 K POTASIO CAPITULO 2 LA TABLA PERIODICA ORDENAMIENTO ACTUAL GRUPOS Y PERIODOS PROPIEDADES PERIODICAS TAMAÑO POTENCIAL DE IONIZACION AFINIDAD
Contenido. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades periódicas:
 LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
La tabla periódica. Julius Lothar Meyer. Dimitri Ivanovich Mendeleev
 La tabla periódica Julius Lothar Meyer Dimitri Ivanovich Mendeleev Silvia Ponce López ITESM, Julio 2007 Contenidos Organización de los elementos en la tabla periódica Propiedades periódicas: radio atómico,
La tabla periódica Julius Lothar Meyer Dimitri Ivanovich Mendeleev Silvia Ponce López ITESM, Julio 2007 Contenidos Organización de los elementos en la tabla periódica Propiedades periódicas: radio atómico,
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
Capítulo 5. Propiedades periódicas de los elementos
 Capítulo 5. Propiedades periódicas de los elementos Objetivos: Justificación de las propiedades periódicas de los elementos Radio atómico: Potenciales de ionización. Carácter metálico y no metálico de
Capítulo 5. Propiedades periódicas de los elementos Objetivos: Justificación de las propiedades periódicas de los elementos Radio atómico: Potenciales de ionización. Carácter metálico y no metálico de
PRIMERAS CLASIFICACIONES PERIÓDICAS
 LA TABLA PERIÓDICA PRIMERAS CLASIFICACIONES PERIÓDICAS Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades variaban periódicamente
LA TABLA PERIÓDICA PRIMERAS CLASIFICACIONES PERIÓDICAS Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades variaban periódicamente
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES
 UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
1. Los elementos químicos
 RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
Ilustración 15.1. El número de coordinación en el NaCl es 6:6. Cada ion esta rodeado por seis iones que tienen carga opuesta a él.
 ENLACE IÓNICO Tú sabes que existen sustancias que forman sólidos cristalinos con altos puntos de fusión, que no conducen la corriente en estado sóliso pero se vuelven buenos conductores al fundirlos o
ENLACE IÓNICO Tú sabes que existen sustancias que forman sólidos cristalinos con altos puntos de fusión, que no conducen la corriente en estado sóliso pero se vuelven buenos conductores al fundirlos o
64 4 4 0 8 Teórica ( x ) Presencial (x ) Teórica-práctica ( ) Híbrida ( )
 PROGRAMA DE ESTUDIO Nombre de la asignatura: QUIMICA DEL ESTADO SÓLIDO Clave: QMT02 Ciclo Formativo: Básico ( ) Profesional ( ) Especializado ( x ) Fecha de elaboración: Marzo 2015 Horas Horas Horas de
PROGRAMA DE ESTUDIO Nombre de la asignatura: QUIMICA DEL ESTADO SÓLIDO Clave: QMT02 Ciclo Formativo: Básico ( ) Profesional ( ) Especializado ( x ) Fecha de elaboración: Marzo 2015 Horas Horas Horas de
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Tema 4. Cristaloquímica. Descripción estructural y
 Tema 4. Cristaloquímica. Descripción estructural y estructuras tipos Qué objetivos tiene la Cristaloquímica? Las fases cristalinas son componentes esenciales de los materiales, y especificamente de los
Tema 4. Cristaloquímica. Descripción estructural y estructuras tipos Qué objetivos tiene la Cristaloquímica? Las fases cristalinas son componentes esenciales de los materiales, y especificamente de los
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
ÁTOMO Y ENLACE QUÍMICO
 ÁTM Y ENLACE QUÍMIC EJERCICIS DE ENTRENAMIENT PARA LA XIV LIMPÍADA NACINAL DE QUÍMICA Bibliografía recomendada Química, La Ciencia Central, T. L. Brown, H. E. LeMay, Jr., B. Burnsten. Editorial PrenticeHall
ÁTM Y ENLACE QUÍMIC EJERCICIS DE ENTRENAMIENT PARA LA XIV LIMPÍADA NACINAL DE QUÍMICA Bibliografía recomendada Química, La Ciencia Central, T. L. Brown, H. E. LeMay, Jr., B. Burnsten. Editorial PrenticeHall
SOLUCIONES EJERCICIOS DE ENLACE QUÍMICO. 1º BCT
 SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
El H solo necesita 2 electrones en su capa de valencia como el He.
 Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
INTRODUCCIÓN AL ENLACE IÓNICO
 INTRODUCCIÓN AL ENLACE IÓNICO AUTORIA SILVIA GARCÍA SEPÚLVEDA TEMÁTICA FÍSICA Y QUÍMICA ETAPA BACHILLERATO Resumen A continuación voy a pasar a describir como se lleva a cabo el estudio del enlace químico,
INTRODUCCIÓN AL ENLACE IÓNICO AUTORIA SILVIA GARCÍA SEPÚLVEDA TEMÁTICA FÍSICA Y QUÍMICA ETAPA BACHILLERATO Resumen A continuación voy a pasar a describir como se lleva a cabo el estudio del enlace químico,
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato
 Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos
 3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
LA TABLA PERIÓDICA. 1
 LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
Longitud y energía de enlace
 Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
INTRODUCCIÓN A LOS METALES DE TRANSICIÓN QUÍMICA INORGÁNICA AVANZADA
 INTRODUCCIÓN A LOS METALES DE TRANSICIÓN QUÍMICA INORGÁNICA AVANZADA Los elementos de transición. Bloque d: elementos situados entre los bloque s y p. Tienen ocupados, en su estado fundamental, los niveles
INTRODUCCIÓN A LOS METALES DE TRANSICIÓN QUÍMICA INORGÁNICA AVANZADA Los elementos de transición. Bloque d: elementos situados entre los bloque s y p. Tienen ocupados, en su estado fundamental, los niveles
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Sólidos Arreglos y celdas unitarias. Ramón L. Hernández Castillo Enero 2012
 Sólidos Arreglos y celdas unitarias Ramón L. Hernández Castillo Enero 2012 Importancia de estudiar los sólidos cristalinos La mayoría de los compuestos inorgánicos son sólidos Casi todos los elementos
Sólidos Arreglos y celdas unitarias Ramón L. Hernández Castillo Enero 2012 Importancia de estudiar los sólidos cristalinos La mayoría de los compuestos inorgánicos son sólidos Casi todos los elementos
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
Unidad 7 LA TABLA PERIÓDICA.
 Unidad 7 LA TABLA PERIÓDICA. Primeras clasificaciones REPASO periódicas. Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades
Unidad 7 LA TABLA PERIÓDICA. Primeras clasificaciones REPASO periódicas. Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Química Inorgánica Bloque d 1. BLOQUE d
 Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
Tema 4: Propiedades periódicas de los elementos - 1 -
 Tema 4: Propiedades periódicas de los elementos - - BIBLIOGRAFÍA: * Estructura atómica y enlace químico J. Casabó i Gispert * Química. Curso Universitario B.M. Mahan y R.J. Myers * Química General R.H.
Tema 4: Propiedades periódicas de los elementos - - BIBLIOGRAFÍA: * Estructura atómica y enlace químico J. Casabó i Gispert * Química. Curso Universitario B.M. Mahan y R.J. Myers * Química General R.H.
Estructura Cristalina de Sólidos
 Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
ALEACIONES 1. INTRODUCCION 2. CLASIFICACION 3. SOLUCIONES SÓLIDAS 4. FASES INTERMEDIAS 5. SOLUCIONES SÓLIDAS ORDENADAS M.V.M.G ALEACIONES 1
 ALEACIONES 1. INTRODUCCION 2. CLASIFICACION 3. SOLUCIONES SÓLIDAS 4. FASES INTERMEDIAS 5. SOLUCIONES SÓLIDAS ORDENADAS 2007-08 ALEACIONES 1 INTRODUCCIÓN Una aleación es la combinación de dos o más metales,
ALEACIONES 1. INTRODUCCION 2. CLASIFICACION 3. SOLUCIONES SÓLIDAS 4. FASES INTERMEDIAS 5. SOLUCIONES SÓLIDAS ORDENADAS 2007-08 ALEACIONES 1 INTRODUCCIÓN Una aleación es la combinación de dos o más metales,
Muchos elementos, al unirse a otros, manifiestan la tendencia a adquirir la estructura electrónica externa propia de los gases nobles.
 ENLACE QUÍMICO I 1. INTRODUCCIÓN. 2. ENLACE IÓNICO. 3. ENLACE COVALENTE. 4. ACTIVIDADES. 1. INTRODUCCIÓN. Se denomina enlace químico a las fuerzas que mantienen unidos los átomos, iones y moléculas cuando
ENLACE QUÍMICO I 1. INTRODUCCIÓN. 2. ENLACE IÓNICO. 3. ENLACE COVALENTE. 4. ACTIVIDADES. 1. INTRODUCCIÓN. Se denomina enlace químico a las fuerzas que mantienen unidos los átomos, iones y moléculas cuando
Trabajo Práctico de Laboratorio. Análisis Cualitativo de Cationes. Marcha Sistemática. Identificación de algunos Cationes de Interés Bromatológico.
 Trabajo Práctico de Laboratorio Análisis Cualitativo de Cationes. Marcha Sistemática. Identificación de algunos Cationes de Interés Bromatológico. Objetivo: Desarrollar en el estudiante las habilidades
Trabajo Práctico de Laboratorio Análisis Cualitativo de Cationes. Marcha Sistemática. Identificación de algunos Cationes de Interés Bromatológico. Objetivo: Desarrollar en el estudiante las habilidades
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
Contenidos LA TABLA PERIÓDICA. Primeras clasificaciones periódicas. Primeras clasificaciones periódicas. Triadas de Döbereiner (1829) (Enlace Web):
 Contenidos 2 LA TABLA PERIÓDICA. Unidad 7 1 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad.
Contenidos 2 LA TABLA PERIÓDICA. Unidad 7 1 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad.
ACADEMIA DE QUÍMICA TURNO VESPERTINO
 INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos.
 Evolución histórica de la Tabla Periódica 1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos. 1869: Mendeleev y Meyer: las propiedades
Evolución histórica de la Tabla Periódica 1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos. 1869: Mendeleev y Meyer: las propiedades
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
Líquidos Tensión superficial, viscosidad, presión de vapor. Sólidos Sólidos covalentes, iónicos, moleculares y metálicos
 Fuerzas intermoleculares Estados de agregación de la materia Gases Gases ideales y reales Líquidos Tensión superficial, viscosidad, presión de vapor Sólidos Sólidos covalentes, iónicos, moleculares y metálicos
Fuerzas intermoleculares Estados de agregación de la materia Gases Gases ideales y reales Líquidos Tensión superficial, viscosidad, presión de vapor Sólidos Sólidos covalentes, iónicos, moleculares y metálicos
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
Las propiedades características de las sustancias están relacionadas con la forma en que están unidas sus partículas y las fuerzas entre ellas, es
 EL ENLACE QUÍMICO Las propiedades características de las sustancias están relacionadas con la forma en que están unidas sus partículas y las fuerzas entre ellas, es decir, con el tipo de ENLACE que existe
EL ENLACE QUÍMICO Las propiedades características de las sustancias están relacionadas con la forma en que están unidas sus partículas y las fuerzas entre ellas, es decir, con el tipo de ENLACE que existe
0,225. 0, ,15 0,92
 1.- El ácido clorhídrico reacciona con el mármol (carbonato de calcio) formando cloruro de calcio, dióxido de carbono gas y agua. a) Escribe y ajusta la reacción química. (0,5 p) b) Halla el volumen de
1.- El ácido clorhídrico reacciona con el mármol (carbonato de calcio) formando cloruro de calcio, dióxido de carbono gas y agua. a) Escribe y ajusta la reacción química. (0,5 p) b) Halla el volumen de
Introducción: La importancia del enlace. químicos. Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen
 Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
PROBLEMAS DE QUIMICA GENERAL III (QM-1123) PRIMERA GUIA
 PROBLEMAS DE QUIMICA GENERAL III (QM-1123) PRIMERA GUIA 1.- Indique el número máximo de electrones que pueden ocupar cada una de las siguientes subcapas: (a) 3d, (b) 4s, (c) 2p, (d) 5f 2.- Determine el
PROBLEMAS DE QUIMICA GENERAL III (QM-1123) PRIMERA GUIA 1.- Indique el número máximo de electrones que pueden ocupar cada una de las siguientes subcapas: (a) 3d, (b) 4s, (c) 2p, (d) 5f 2.- Determine el
Enlaces Primarios o fuertes Secundarios o débiles
 Capítulo III MET 2217 Tipos de enlaces atómicos y moleculares Enlaces Primarios o fuertes Secundarios o débiles Enlaces primarios Iónico Actúan fuerzas intermoleculares relativamente grandes, electrostáticas.
Capítulo III MET 2217 Tipos de enlaces atómicos y moleculares Enlaces Primarios o fuertes Secundarios o débiles Enlaces primarios Iónico Actúan fuerzas intermoleculares relativamente grandes, electrostáticas.
TRABAJO PRÁCTICO: MODELOS EXTREMOS DE SUSTANCIA
 1 Complemento TRABAJO PRÁCTICO: S EXTREMOS DE SUSTANCIA FUNDAMENTOS TEÓRICOS BÁSICOS Todas las sustancias pueden considerarse formadas por un conjunto de unidades estructurales o fundamentales. La clase
1 Complemento TRABAJO PRÁCTICO: S EXTREMOS DE SUSTANCIA FUNDAMENTOS TEÓRICOS BÁSICOS Todas las sustancias pueden considerarse formadas por un conjunto de unidades estructurales o fundamentales. La clase
Enlace químico. 5. Dadas las siguientes sustancias: CS 2 (lineal), HCN (lineal), NH 3 (piramidal) y H 2 O (angular):
 Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
TEMA 3 LA TABLA PERIÓDICA
 TEMA 3 LA TABLA PERIÓDICA Mª PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Antecedentes de la Tabla Periódica 2. La TP y las configuraciones electrónicas 3. Radio atómico. Radio iónico 4. Energía de
TEMA 3 LA TABLA PERIÓDICA Mª PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Antecedentes de la Tabla Periódica 2. La TP y las configuraciones electrónicas 3. Radio atómico. Radio iónico 4. Energía de
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO
 ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
ORGANIZACIÓN DE LOS ELEMENTOS EN LA TABLA PERIÓICA PROPIEDADES PERIÓDICAS
 Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
TEMA 8 ESTRUCTURA CRISTALINA
 Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
1. Identificación. Identificación de la Asignatura. Equipo docente
 GUÍA DE LA ASIGNATURA DEL MÁSTER EN QUÍMICA FINA Y MOLECULAR 2010/2011 REACTIVIDAD Y MECANISMOS DE REACCIÓN EN COMPUESTOS DE COORDINACIÓN 1. Identificación Identificación de la Asignatura Asignatura: Reactividad
GUÍA DE LA ASIGNATURA DEL MÁSTER EN QUÍMICA FINA Y MOLECULAR 2010/2011 REACTIVIDAD Y MECANISMOS DE REACCIÓN EN COMPUESTOS DE COORDINACIÓN 1. Identificación Identificación de la Asignatura Asignatura: Reactividad
Colegio Superior de Señoritas Tema: Formación de Compuestos Químicos Septiembre 2010 Prof.: NVM 8vo Nivel Departamento de Ciencias
 COMPUESTOS QUÍMICOS Y SU CLASIFICACIÓN El número de oxidación: representa la cantidad de electrones que puede ganar o perder un elemento. El hidrógeno tiene número de oxidación +1 y puede perder un electrón;
COMPUESTOS QUÍMICOS Y SU CLASIFICACIÓN El número de oxidación: representa la cantidad de electrones que puede ganar o perder un elemento. El hidrógeno tiene número de oxidación +1 y puede perder un electrón;
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015)
 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
EJERCICIOS RESUELTOS DE REDOX
 EJERCICIOS RESUELTOS DE REDOX 1. Al hacer reaccionar cobre metálico con ácido nítrico diluido se obtiene monóxido de nitrógeno y nitrato de cobre (II). Plantee, iguale y complete la ecuación redox correspondiente,
EJERCICIOS RESUELTOS DE REDOX 1. Al hacer reaccionar cobre metálico con ácido nítrico diluido se obtiene monóxido de nitrógeno y nitrato de cobre (II). Plantee, iguale y complete la ecuación redox correspondiente,
FORMULACIÓN Y NOMENCLATURA
 FORMULACIÓN Y NOMENCLATURA.- Formulación: Es la representación escrita de una molécula que se rige por unas normas universales establecidas por acuerdo de la comunidad científica..- Nomenclatura: Es el
FORMULACIÓN Y NOMENCLATURA.- Formulación: Es la representación escrita de una molécula que se rige por unas normas universales establecidas por acuerdo de la comunidad científica..- Nomenclatura: Es el
EJERCICIOS RESUELTOS DE ENLACE QUIMICO
 EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
ENLACE IÓNICO. Este enlace tendrá lugar entre átomos de electronegatividad muy distinta: entre metales y no metales.
 ENLACE IÓNICO Si enfrentamos un átomo al que le falten pocos electrones en su capa de valencia para adquirir la configuración de gas noble (muy electronegativo, tendencia a coger electrones), tal como
ENLACE IÓNICO Si enfrentamos un átomo al que le falten pocos electrones en su capa de valencia para adquirir la configuración de gas noble (muy electronegativo, tendencia a coger electrones), tal como
*TABLA PERIODICA. Esp. Harrison Meléndez Tarazona
 *TABLA PERIODICA Esp. Harrison Meléndez Tarazona *Surgimiento En 1869 Lothar Meyer publicó un esquema de clasificación basado en orden creciente de peso atómico En marzo de 1869 Dimitri Mendeléiev entregaba
*TABLA PERIODICA Esp. Harrison Meléndez Tarazona *Surgimiento En 1869 Lothar Meyer publicó un esquema de clasificación basado en orden creciente de peso atómico En marzo de 1869 Dimitri Mendeléiev entregaba
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
GUÍA DE EJERCICIOS ENLACE
 GUÍA DE EJERCICIOS ENLACE Área Química Resultados de aprendizaje Aplicar y analizar características de moléculas, para predecir solubilidad, tipo de enlace que la forman y estructura más estable, potenciando
GUÍA DE EJERCICIOS ENLACE Área Química Resultados de aprendizaje Aplicar y analizar características de moléculas, para predecir solubilidad, tipo de enlace que la forman y estructura más estable, potenciando
Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Cristales metálicos
 Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta, de manera
Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta, de manera
ENLACE QUÍMICO II. 5.- De los compuestos iónicos KBr y NaBr, cuál será el más duro y cuál el de mayor temperatura de fusión?. Por qué?.
 ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
Guía para el docente
 Guía para el docente Descripción curricular: - Nivel: 2.º Medio - Subsector: Ciencias químicas - Unidad temática: - Palabras claves: enlace químico, enlace iónico, enlace covalente, enlace metálico - Contenidos
Guía para el docente Descripción curricular: - Nivel: 2.º Medio - Subsector: Ciencias químicas - Unidad temática: - Palabras claves: enlace químico, enlace iónico, enlace covalente, enlace metálico - Contenidos
Introducción a la Formulación y Nomenclatura de las Sustancias Inorgánicas
 D EPA R T A M ENTO D E FÍSICA Y Q UÍM ICA Introducción a la Formulación y Nomenclatura de las Sustancias Inorgánicas José Manuel Ramírez Fernández Valencias y estados, grados o números de oxidación Con
D EPA R T A M ENTO D E FÍSICA Y Q UÍM ICA Introducción a la Formulación y Nomenclatura de las Sustancias Inorgánicas José Manuel Ramírez Fernández Valencias y estados, grados o números de oxidación Con
PROPIEDADES QUÍMICAS DEL SUELO
 PROPIEDADES QUÍMICAS DEL SUELO DEFINICIONES Ión: Átomos o moléculas que pierden o ganan electrones por lo cual adquieren una determinada carga; si ganan adquieren carga negativa: aniones (Cl -, NO 3- );
PROPIEDADES QUÍMICAS DEL SUELO DEFINICIONES Ión: Átomos o moléculas que pierden o ganan electrones por lo cual adquieren una determinada carga; si ganan adquieren carga negativa: aniones (Cl -, NO 3- );
INSTITUTO POLITECNICO NACIONAL
 INSTITUTO POLITECNICO NACIONAL CECYT NO. 1 GONZALO VÁZQUEZ VELA GUÍA DE QUÍMICA I PERIÓDO ESCOLAR 2015-2016 ACADEMIA DE QUÍMICA TURNO VESPERTINO 1 Materia y Energía 1.- Calcula la energía, en Joules y
INSTITUTO POLITECNICO NACIONAL CECYT NO. 1 GONZALO VÁZQUEZ VELA GUÍA DE QUÍMICA I PERIÓDO ESCOLAR 2015-2016 ACADEMIA DE QUÍMICA TURNO VESPERTINO 1 Materia y Energía 1.- Calcula la energía, en Joules y
EL SISTEMA PERIODICO HISTORIA DEL SISTEMA PERIÓDICO
 HISTORIA DEL SISTEMA PERIÓDICO Durante el siglo XIX, y a medida que avanzaba el conocimiento sobre los elementos químicos, se observó que algunos de ellos tenían propiedades semejantes. Los científicos
HISTORIA DEL SISTEMA PERIÓDICO Durante el siglo XIX, y a medida que avanzaba el conocimiento sobre los elementos químicos, se observó que algunos de ellos tenían propiedades semejantes. Los científicos
LAS PROPIEDADES CARACTERÍSTICAS DE LAS SUSTANCIAS ESTÁN RELACIONADAS CON LA FORMA EN QUE ESTÁN UNIDAS SUS PARTÍCULAS Y LAS FUERZAS ENTRE ELLAS, ES
 EL ENLACE QUÍMICO LAS PROPIEDADES CARACTERÍSTICAS DE LAS SUSTANCIAS ESTÁN RELACIONADAS CON LA FORMA EN QUE ESTÁN UNIDAS SUS PARTÍCULAS Y LAS FUERZAS ENTRE ELLAS, ES DECIR, CON EL TIPO DE ENLACE QUE EXISTE
EL ENLACE QUÍMICO LAS PROPIEDADES CARACTERÍSTICAS DE LAS SUSTANCIAS ESTÁN RELACIONADAS CON LA FORMA EN QUE ESTÁN UNIDAS SUS PARTÍCULAS Y LAS FUERZAS ENTRE ELLAS, ES DECIR, CON EL TIPO DE ENLACE QUE EXISTE
Colección de problemas Unidad 2
 Facultad de Química, UNAM Curso: Química General I Colección de problemas Unidad 2 1. Describe una contribución importante a la ciencia hecha por cada uno de los científicos siguientes: Dalton, Thomson,
Facultad de Química, UNAM Curso: Química General I Colección de problemas Unidad 2 1. Describe una contribución importante a la ciencia hecha por cada uno de los científicos siguientes: Dalton, Thomson,
Reacciones de transferencia de electrones
 Reacciones de transferencia de electrones Las reacciones de transferencia de electrones o reacciones de oxidación-reducción son aquellas en las que dos o más elementos cambian su número de oxidación. Número
Reacciones de transferencia de electrones Las reacciones de transferencia de electrones o reacciones de oxidación-reducción son aquellas en las que dos o más elementos cambian su número de oxidación. Número
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
