ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
|
|
|
- Natalia Nieto López
- hace 5 años
- Vistas:
Transcripción
1 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1
2 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de la reconstitución, 1 dosis (0,65 ml) contiene: Virus varicela-zóster 1, cepa Oka/Merck (vivos, atenuados) > UFP 2 1 Producidos en células diploides humanas (MRC-5) 2 UFP = Unidades formadoras de placa Esta vacuna puede contener trazas de neomicina. Ver secciones 4.3 y 4.4. Excipientes con efecto conocido: Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Polvo y disolvente para suspensión inyectable. El polvo es una masa compacta cristalina de color blanco o blanquecino. El disolvente es un líquido transparente incoloro. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas ZOSTAVAX está indicado para la prevención del herpes zóster ( zóster o culebrilla) y la neuralgia post-herpética (NPH) relacionada con herpes zóster. ZOSTAVAX está indicado para la inmunización de individuos de 50 años de edad o mayores. 4.2 Posología y forma de administración Posología Los individuos deben recibir una dosis única (0,65 ml) administrada subcutáneamente. Se desconoce actualmente la necesidad de una segunda dosis. Ver sección 5.1. Población pediátrica ZOSTAVAX no está indicado para la prevención de la infección primaria por el virus de la varicela (varicela) y no debe ser utilizado en niños y adolescentes. Forma de administración La vacuna ha de ser administrada por VIA SUBCUTÁNEA, preferiblemente en la región deltoidea. No inyectar intravascularmente. 2
3 Precauciones que deben tomarse antes de manipular o administrar este medicamento: ver sección 6.6. Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección Contraindicaciones Antecedentes de hipersensibilidad al principio activo o a alguno de los excipientes o a residuos en cantidades de trazas (ej. neomicina) (ver secciones 4.4 y 6.1). Estados de inmunodeficiencia primaria o adquirida debidos a afecciones tales como: leucemias agudas y crónicas; linfoma; otras enfermedades que afectan a la médula ósea o al sistema linfático; inmunosupresión debida a VIH/SIDA (ver secciones 4.8 y 5.1); deficiencias de la inmunidad celular. Terapia inmunosupresora (incluyendo altas dosis de corticosteroides). Sin embargo, ZOSTAVAX no está contraindicado en sujetos que estén recibiendo corticosteroides tópicos/inhalados o dosis bajas de corticosteroides sistémicos o en pacientes que estén recibiendo corticoides como terapia de sustitución, por ejemplo, para la insuficiencia adrenal (ver secciones 4.8 y 5.1). Tuberculosis activa no tratada. Embarazo. Además, se debe evitar un embarazo durante 1 mes después de la vacunación (ver sección 4.6). 4.4 Advertencias y precauciones especiales de empleo Debe estar siempre disponible un tratamiento médico adecuado y supervisión para el caso de que sucediera una reacción anafiláctica/anafilactoide rara después de la administración de la vacuna, ya que existe la posibilidad de reacciones de hipersensibilidad, no sólo al principio activo, sino también a los excipientes y residuos en cantidades de trazas (por ejemplo, neomicina) presentes en la vacuna (ver secciones 4.3, 4.8 y 6.1). La alergia a neomicina generalmente se manifiesta como una dermatitis de contacto. Sin embargo, un antecedente de dermatitis de contacto debida a neomicina no es una contraindicación para recibir vacunas de virus vivos. ZOSTAVAX no está indicado para el tratamiento de zóster o de NPH. En presencia de fiebre debe considerarse un aplazamiento de la vacunación. Como con cualquier otra vacuna, la vacunación con ZOSTAVAX puede no proteger a todos los vacunados. Ver sección 5.1. No se ha establecido la seguridad y eficacia de ZOSTAVAX en adultos que se sabe que están infectados con VIH, con o sin evidencia de inmunodepresión (ver sección 4.3) sin embargo, ha finalizado un estudio de fase II de seguridad e inmunogenicidad en adultos infectados por VIH con la función inmune inalterada (Recuento de células T CD células/µl), ver secciones 4.8 y 5.1. Transmisión En los ensayos clínicos con ZOSTAVAX no se ha notificado la transmisión del virus de la vacuna. Sin embargo, la experiencia tras la comercialización de las vacunas de varicela sugiere que puede ocurrir raramente la transmisión del virus de la vacuna entre vacunados que desarrollan una erupción varicelosa y contactos susceptibles (por ejemplo, nietos pequeños susceptibles al virus varicela-zóster, VVZ). También se ha notificado la transmisión del virus de la vacuna desde vacunados frente a varicela que no desarrollan una erupción varicelosa. Éste es un riesgo teórico de la vacunación con ZOSTAVAX. El riesgo de transmisión de virus atenuados de la vacuna desde un vacunado a un 3
4 contacto susceptible debe ser sopesado frente al riesgo de desarrollar zóster natural y la potencial transmisión del VVZ salvaje a un contacto susceptible. 4.5 Interacción con otros medicamentos y otras formas de interacción ZOSTAVAX puede ser administrado de forma concomitante con vacuna antigripal inactivada mediante inyecciones separadas y en diferentes sitios del cuerpo (ver sección 5.1). ZOSTAVAX no debe administrarse de forma concomitante con la vacuna antineumocócica de polisacáridos de 23 serotipos, ya que en un ensayo clínico se observó una reducción de la inmunogenicidad de ZOSTAVAX como resultado del uso concomitante (ver sección 5.1). Actualmente no se dispone de datos relativos al uso concomitante con otras vacunas. No se ha evaluado la administración concurrente de ZOSTAVAX y medicaciones anti-virales de eficacia conocida frente al VVZ. 4.6 Fertilidad, embarazo y lactancia Embarazo No se han realizado estudios en mujeres embarazadas. Se desconoce también si ZOSTAVAX puede causar daño en el feto cuando se administra a mujeres embarazadas, o si puede afectar a la capacidad de reproducción. Sin embargo, se sabe que la infección por el virus varicela-zóster que ocurre de forma natural puede causar daño fetal. Como ZOSTAVAX no está indicado en individuos menores de 50 años, ZOSTAVAX no está destinado a mujeres embarazadas. En cualquier caso, se debe evitar un embarazo durante 1 mes después de la vacunación (ver sección 4.3). Lactancia No se conoce si VVZ se secreta en la leche humana. Sin embargo, como algunos virus son secretados en la leche humana, debe tenerse precaución si se administra ZOSTAVAX a mujeres en período de lactancia. Fertilidad No se ha evaluado ZOSTAVAX en estudios de fertilidad. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se espera una nula o insignificante influencia de ZOSTAVAX sobre la capacidad para conducir y utilizar máquinas. 4.8 Reacciones adversas a. Resumen del perfil de seguridad Se ha evaluado la seguridad general en ensayos clínicos con más de adultos vacunados con ZOSTAVAX. Estudio de Prevención de Herpes zóster (Estudio SPS Shingles Prevention Study) en individuos de 60 años de edad y mayores En el mayor de estos ensayos, el Estudio de Prevención de Herpes zóster (SPS), individuos recibieron una dosis única de la formulación congelada de ZOSTAVAX (n=19.270) o placebo (n=19.276) y se monitorizó la seguridad a lo largo del ensayo. Durante el ensayo, se notificaron reacciones adversas graves relacionadas con la vacuna en 2 sujetos vacunados con ZOSTAVAX (exacerbación de asma y polimialgia reumática) y en 3 sujetos que recibieron placebo (Síndrome de Goodpasture, reacción anafiláctica y polimialgia reumática). 4
5 En el Subestudio de Monitorización de Acontecimientos Adversos, se le proporcionó a un subgrupo de individuos del SPS (n=3.345 recibieron ZOSTAVAX y n=3.271 recibieron placebo) tarjetas de vacunación para registrar los acontecimientos adversos que tuvieron lugar desde el Día 0 al Día 42 después de la vacunación, además del control rutinario de seguridad que se llevó a cabo durante todo el ensayo. Las reacciones adversas en el lugar de inyección y sistémicas relacionadas con la vacuna que fueron notificadas con una incidencia significativamente mayor en el grupo de la vacuna frente al grupo del placebo en el Subestudio de Monitorización de Acontecimientos Adversos figuran en la Tabla 1. La mayoría de estas reacciones adversas fueron notificadas como de intensidad leve. La Tabla 1 también incluye acontecimientos adversos adicionales que han sido notificados espontáneamente durante el seguimiento post-comercialización. La incidencia general de las reacciones adversas en el lugar de inyección relacionadas con la vacuna fue significativamente mayor en los sujetos vacunados con ZOSTAVAX frente a los sujetos que recibieron placebo (48% en ZOSTAVAX y 17% en placebo). En el resto de sujetos del SPS se realizó una monitorización rutinaria de la seguridad, pero no se les proporcionó tarjetas de vacunación. Los tipos de acontecimientos adversos notificados en estos pacientes fueron generalmente similares a los del subgrupo de pacientes del Subestudio de Monitorización de Acontecimientos Adversos. Dentro de los 42 días del periodo de notificación post-vacunación en el SPS, el número de erupciones tipo herpes zóster notificadas entre todos los sujetos fue pequeño (17 para ZOSTAVAX, 36 para placebo; p=0,009). De estas 53 erupciones tipo herpes zóster, en 41 se obtuvieron muestras adecuadas para la prueba de PCR. Se detectó el VVZ salvaje en 25 de ellas (5 para ZOSTAVAX, 20 para placebo). La cepa Oka/Merck del VVZ no se detectó en ninguna de estas muestras. Dentro de esos mismos 42 días del periodo de notificación post-vacunación en el estudio SPS, el número (n=59) de notificaciones de erupción varicelosa también fue pequeño. De éstas, en 10 se obtuvieron muestras adecuadas para PCR. No se detectó VVZ en ninguna de estas muestras. Estudio de Eficacia y Seguridad de ZOSTAVAX (Estudio ZEST) in individuos de 50 a 59 años de edad En el estudio ZEST, los individuos recibieron una dosis única de ZOSTAVAX (n=11.184) o de placebo (n=11.212) y se hizo un seguimiento de la seguridad a lo largo del estudio. Durante el estudio se notificó un acontecimiento adverso grave relacionado con la vacuna en 1 sujeto vacunado con ZOSTAVAX (reacción anafiláctica). Todos los sujetos recibieron una tarjeta de vacunación con la finalidad de registrar los acontecimientos adversos ocurridos entre los días 1 a 42 posteriores a la vacunación, adicionalmente al seguimiento rutinario de la seguridad llevado a cabo a lo largo del estudio. En la Tabla 1 se recogen los acontecimientos adversos sistémicos y en el lugar de inyección relacionados con la vacuna que fueron notificados en el estudio ZEST. La Tabla 1 también incluye acontecimientos adversos adicionales que habían sido notificados espontáneamente durante el seguimiento post-comercialización. La incidencia global de acontecimientos adversos en el lugar de inyección relacionados con la vacuna fue significativamente mayor para los sujetos vacunados con ZOSTAVAX frente a los sujetos que recibieron placebo (63,9% para ZOSTAVAX y 14,4% para el placebo). La mayoría de estas reacciones adversas se notificaron como de intensidad leve. Dentro del periodo de notificación de 42 días tras la vacunación en el estudio ZEST, se notificaron erupciones tipo herpes zóster fuera del lugar de inyección en 34 sujetos (19 para ZOSTAVAX y 15 5
6 para el placebo). De las 24 muestras que fueron adecuadas para la prueba de la Reacción en Cadena de la Polimerasa (PCR) se detectó VVZ salvaje en 10 de estas muestras (3 para ZOSTAVAX, 7 para el placebo). No se detectó la cepa Oka/Merck del VVZ en ninguna de estas muestras. Dentro del mismo periodo de notificación de 42 días tras la vacunación en el estudio ZEST, se notificaron erupciones varicelosas en 124 sujetos (69 para ZOSTAVAX y 55 para el placebo). De 23 muestras disponibles y adecuadas para la prueba PCR, el VVZ se detectó en una de esas muestras procedente del grupo de sujetos que habían recibido ZOSTAVAX; sin embargo, la cepa del virus (salvaje o cepa Oka/Merck) no pudo ser determinada. Otros estudios Adultos sanos En los demás ensayos clínicos que respaldan la autorización inicial de la formulación congelada de ZOSTAVAX, las tasas de notificación de las erupciones tipo herpes zóster y varicelosas fuera del lugar de inyección durante los 42 días posteriores a la vacunación también fueron bajas, tanto en los vacunados como en los que recibieron placebo. De las 17 erupciones tipo herpes zóster y varicelosas fuera del lugar de inyección notificadas, en 10 casos se obtuvieron muestras adecuadas para PCR. La cepa Oka/Merck se identificó mediante análisis de PCR a partir de muestras de lesiones en sólo dos sujetos que notificaron erupción varicelosa (comienzo en Día 8 y Día 17). En otros ensayos clínicos que evaluaron ZOSTAVAX en sujetos de 50 años o mayores, incluyendo un estudio de la vacuna antigripal inactivada administrada concomitantemente, el perfil de seguridad fue generalmente similar al que se vio en el Subestudio de Monitorización de Acontecimientos Adversos del SPS. Sin embargo, en estos ensayos se notificó una tasa mayor de acontecimientos adversos en el lugar de inyección, de intensidad leve a moderada, entre los sujetos de años en comparación con sujetos > 60 años (ver sección 5.1). Los datos obtenidos de un ensayo clínico (n=368) demostraron que la actual formulación refrigerada es generalmente bien tolerada con un perfil de seguridad comparable al de la formulación congelada. En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, en el que ZOSTAVAX se administró a 100 individuos de 50 años o mayores con antecedentes de herpes zóster (HZ) antes de la vacunación, el perfil de seguridad fue generalmente similar al observado en el Subestudio de Monitorización de Acontecimientos Adversos del SPS. En base a los datos limitados obtenidos de dos ensayos clínicos que incluyeron a individuos seronegativos o con bajos títulos de anticuerpos para el VVZ (27 individuos de al menos 30 años recibieron la vacuna frente a zóster de virus vivos atenuados), las reacciones adversas sistémicas y en el lugar de inyección fueron en general similares a las notificadas por otros individuos que recibieron ZOSTAVAX en los ensayos clínicos, notificándose fiebre en 2 de los 27 individuos. Ningún individuo notificó erupciones similares a las de la varicela o a las producidas por el virus herpes zóster. No se notificaron reacciones adversas graves relacionadas con la vacuna. Adultos con tratamiento crónico/de mantenimiento con corticosteroides sistémicos En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a 206 individuos de 60 años o mayores que estuvieron recibiendo tratamiento crónico/de mantenimiento con corticosteroides sistémicos a una dosis diaria equivalente de 5 a 20 mg de prednisona desde al menos 2 semanas antes del reclutamiento y hasta 6 semanas o más después de la vacunación, con el fin de evaluar la inmunogenicidad y el perfil de seguridad de ZOSTAVAX. Los acontecimientos adversos se monitorizaron hasta el día 42 post-vacunación y los acontecimientos adversos graves durante el periodo que dura el estudio (180 días). En este ensayo clínico el perfil de seguridad fue comparable en general al observado en el Subestudio de Monitorización de Acontecimientos Adversos del SPS (ver sección 4.3 Contraindicaciones en lo relativo a corticosteroides). Adultos infectados por VIH con la función inmune inalterada 6
7 En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a adultos infectados por VIH (18 años de edad o mayores) (ver sección 5.1). 286 sujetos recibieron 2 dosis y 9 sujetos recibieron una sola dosis. Los acontecimientos adversos se monitorizaron hasta el día 42 post vacunación y los acontecimientos adversos graves durante el periodo que dura el estudio (180 días). Se notificó un caso grave de erupción maculo-papular relacionado con la vacuna en el día 4 después de la primera dosis de ZOSTAVAX. El perfil de seguridad fue, por lo general, similar al observado en el sub-estudio de monitorización de acontecimientos adversos del SPS (ver sección 4.3 relacionado con la inmunosupresión debida a VIH/SIDA). b. Resumen tabulado de acontecimientos adversos La Tabla 1 incluye las reacciones adversas en el lugar de inyección y sistémicas relacionadas con la vacuna que fueron notificadas con una incidencia significativamente mayor en el grupo de la vacuna frente al grupo del placebo en el Subestudio de Monitorización de Acontecimientos Adversos. Las reacciones adversas se clasifican en función de su frecuencia utilizando la siguiente convención: [Muy frecuentes (>1/10); Frecuentes (>1/100 a <1/10); Poco frecuentes (>1/1.000 a <1/100); Raras (>1/ a <1/1.000); Muy raras (<1/10.000)] La Tabla 1 también incluye acontecimientos adversos adicionales que han sido notificados espontáneamente durante el seguimiento post-comercialización. Debido a que estos acontecimientos se notificaron de forma voluntaria a partir de una población de tamaño indeterminado, no siempre es posible valorar de forma fiable su frecuencia ni establecer una relación causal con la exposición a la vacuna. Por lo tanto, se asigna la categoría de frecuencia No conocida a estos acontecimientos adversos. Tabla 1 Clasificación de órganos del sistema MedDRA Reacciones adversas Frecuencia Infecciones e infestaciones Varicela Herpes zóster (cepa vacunal) Muy raras Muy raras 1 Trastornos de la sangre y del Linfoadenopatía (cervical, axilar) No conocida** sistema linfático Trastornos del sistema Reacciones de hipersensibilidad incluyendo No conocida** inmunológico reacciones anafilácticas Trastornos del sistema nervioso Dolor de cabeza Frecuentes Trastornos gastrointestinales Náuseas No conocida** Trastornos de la piel y del Erupción No conocida** tejido subcutáneo Trastornos musculoesqueléticos y del tejido conjuntivo Artralgia, Mialgia No conocida** Dolor en una extremidad Frecuentes Trastornos generales y alteraciones en el lugar de administración Eritema *, Dolor/dolor al tacto *, Hinchazón *, Prurito Muy frecuentes Hematoma, Calor, Induración Frecuentes Erupción, Urticaria, Pirexia No conocida** 7
8 * Reacciones adversas de notificación solicitada en el protocolo del ensayo (en los 5 días postvacunación). ** Acontecimientos adversos post-comercialización (no se puede estimar la frecuencia a partir de los datos disponibles). Reacciones adversas en el lugar de inyección. 1 Esta reacción adversa se identificó mediante vigilancia post-comercialización pero no se observó en el programa de desarrollo clínico. La categoría de frecuencia se estimó a partir de un cálculo estadístico basado en cero casos de un número total de pacientes expuestos a Zostavax en el programa de desarrollo clínico (n > ). Notificación de sospechas de reacciones adversas: Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación, incluido en el Anexo V. 4.9 Sobredosis Se ha notificado raramente la administración de una dosis de ZOSTAVAX más alta de la recomendada y el perfil de acontecimientos adversos fue comparable al observado con la dosis recomendada de ZOSTAVAX. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Vacunas, Vacuna vírica. Código ATC: J07BK02 Mecanismo de acción Cualquiera que haya sido infectado con VVZ, incluyendo a aquéllos sin historial clínico de varicela, está en riesgo de desarrollar zóster. Este riesgo parece estar relacionado causalmente con un declive en la inmunidad específica frente a VVZ. ZOSTAVAX ha demostrado reforzar la inmunidad específica frente a VVZ, lo que se presume como mecanismo por el que protege frente a zóster y sus complicaciones (Ver Inmunogenicidad). Evaluación de la eficacia clínica proporcionada por ZOSTAVAX Estudio de Prevención de Herpes zóster (Estudio SPS Shingles Prevention Study) en individuos de 60 años de edad y mayores: ZOSTAVAX redujo significativamente el riesgo de desarrollar zóster y NPH en comparación con placebo. Además, ZOSTAVAX redujo significativamente el dolor asociado a zóster medido mediante la escala de carga de enfermedad (BOI) del dolor asociado a HZ (ver resultados y definición en la Tabla 2). Tabla 2 Eficacia de ZOSTAVAX comparada con placebo en el Estudio de Prevención de Herpes zóster (SPS) Variable Eficacia de la IC 95% vacuna* Incidencia de Zóster 51% 44 a 58% Incidencia de NPH** 67% 48 a 79% BOI del dolor asociado a HZ*** 61% 51 a 69% *Eficacia de la vacuna: reducción relativa en la medición de la variable en el grupo de vacunados 8
9 comparada con el grupo placebo. **Dolor asociado a zóster clínicamente relevante que persiste o aparece al menos 90 días después de la aparición de la erupción. ***La escala de BOI del dolor asociado a zóster es una escala combinada que incorpora la incidencia, intensidad y duración del dolor agudo y crónico asociado a zóster durante un periodo de seguimiento de 6 meses. En el Estudio de Prevención de Herpes zóster (SPS), ensayo clínico de ZOSTAVAX, doble ciego y controlado con placebo, se aleatorizaron sujetos de 60 años o mayores para recibir una dosis única de ZOSTAVAX (n= ) o placebo (n= ). ZOSTAVAX disminuyó significativamente la incidencia de zóster comparado con placebo (315 casos [5,4/1.000 personas-año] frente a 642 casos [11,1/1.000 personas-año], respectivamente; p<0,001). La eficacia protectora de ZOSTAVAX frente a zóster fue del 51% (IC 95%: [de 44 a 58%]). ZOSTAVAX redujo la incidencia de zóster en un 64% (IC 95%: [de 56 a 71%]) en individuos de años y en un 38% (IC 95%: [de 25 a 48%]) en individuos de 70 años. En el SPS, la reducción de zóster se vio en casi todos los dermatomas. Se produjo zóster oftálmico en 35 sujetos vacunados con ZOSTAVAX frente a 69 sujetos que recibieron placebo. Aparecieron problemas de visión en 2 sujetos vacunados con ZOSTAVAX frente a 9 sujetos que recibieron placebo. ZOSTAVAX redujo la incidencia de NPH comparado con placebo (27 casos [0,5/1.000 personas-año] frente a 80 casos [1,4/1.000 personas-año], respectivamente; p<0,001). En este ensayo, la definición de NPH fue dolor clínicamente significativo asociado a zóster que persiste o aparece al menos 90 días después de la aparición de la erupción. La eficacia protectora de ZOSTAVAX frente a NPH fue del 67% (IC 95%: [de 48 a 79%]). Con referencia sólo a los sujetos que desarrollaron zóster, hubo una reducción en el riesgo de desarrollar posteriormente NPH. En el grupo de la vacuna, el riesgo de desarrollar NPH después de zóster fue del 9% (27/315), mientras que en el grupo del placebo fue del 13% (80/642). Este efecto fue más destacado en el grupo de sujetos de más edad ( 70 años), donde el riesgo de desarrollar NPH después de zóster se redujo al 10% en el grupo de la vacuna frente al 19% en el grupo del placebo. ZOSTAVAX redujo la escala de BOI del dolor asociado a zóster en aproximadamente un 61% (IC 95%: [de 51 a 69%]), comparado con placebo. El efecto fue más pronunciado en el grupo de edad más joven (60 a 69 años), donde la eficacia de ZOSTAVAX en BOI del dolor asociado a zóster fue del 66% comparado con el 55% en pacientes 70 años; sin embargo, esta diferencia no fue estadísticamente significativa (p=0,266). Prevención de los casos de HZ con dolor intenso en toda la población del estudio ZOSTAVAX redujo la incidencia de zóster con dolor intenso y de larga duración (puntuación de intensidad-duración > 600) en un 73% (IC 95%: [de 46 a 87%]) comparado con placebo (11 frente a 40 casos, respectivamente). Reducción de la intensidad por duración del dolor asociado a zóster en individuos vacunados que desarrollaron zóster Con respecto al dolor agudo (dolor entre 0-30 días) no hubo diferencias estadísticamente significativas entre el grupo de la vacuna y el grupo del placebo. La escala de intensidad por duración del dolor asociado a zóster fue de 89 (IC 95%: [de 82 a 97%]) para el grupo de la vacuna frente a 92 (IC 95%: [de 87 a 97%]) para el grupo del placebo. El uso global de medicación analgésica fue similar en ambos grupos de estudio. Entre los individuos vacunados que desarrollaron NPH, ZOSTAVAX redujo significativamente el dolor (crónico) asociado a NPH comparado con placebo. En el periodo a partir de los 90 días después de la aparición de la erupción hasta el final del seguimiento, hubo una reducción del 57% en la escala de intensidad por duración (puntuación media de 347 para ZOSTAVAX y 805 para placebo; 9
10 p=0,016). Entre los individuos vacunados que desarrollaron zóster, ZOSTAVAX redujo significativamente el dolor global agudo y crónico asociado a zóster comparado con placebo. A lo largo de un periodo de 6 meses de seguimiento (agudo y crónico), hubo una reducción del 22% (p=0,008) en la puntuación de intensidad por duración y un 52% (IC 95%: [de 7 a 74%]) de reducción (desde el 6,2% al 3,5%) del riesgo de padecer HZ con dolor intenso y de larga duración (puntuación de intensidad por duración >600). Subestudio de Persistencia a Corto Plazo (Subestudio STPS - Short-term Persistence Substudy): El subestudio STPS se inició para obtener información adicional sobre la persistencia de la eficacia de la vacuna y para preservar un subgrupo de sujetos del estudio SPS para el subestudio de Persistencia a Largo Plazo (LTPS). El STPS incluyó sujetos que habían sido previamente vacunados con ZOSTAVAX y sujetos que previamente habían recibido placebo en el SPS. La edad media en el momento del reclutamiento en el STPS fue de 73,3 años. Durante el desarrollo del STPS se ofreció ZOSTAVAX a los sujetos que habían recibido placebo, momento en el que se consideró que habían completado el STPS. Los análisis de eficacia de la vacuna en el STPS se basan fundamentalmente en los datos recogidos 4 a 7 años después de la vacunación en el SPS. El seguimiento medio en el STPS fue de aproximadamente 1,2 años (rango de 1 día a 2,2 años). En el STPS hubo 84 casos de HZ evaluables [8,4/1.000 persona-año] en el grupo de ZOSTAVAX y 95 casos evaluables [14,0/1.000 persona-año] en el grupo placebo. La eficacia estimada de la vacuna durante el periodo de seguimiento del STPS fue del 40% (IC 95%: [18 a 56%]) para la incidencia de HZ, del 60% (IC 95%: [-10 a 87%]) para la incidencia de NPH y del 50% (IC 95%: [14 a 71%]) en BOI de dolor asociado a HZ. Subestudio de Persistencia a Largo Plazo (Subestudio LTPS - Long-term Persistence Substudy): Después de finalizar el STPS, el LTPS evaluó la duración de la protección frente a HZ, NPH y BOI de dolor asociado a HZ en un total de sujetos que habían sido vacunados previamente con ZOSTAVAX en el SPS. La edad media en el momento del reclutamiento para el LTPS fue de 74,5 años. En el LTPS no estuvo disponible un control con placebo simultáneo; se utilizaron datos de anteriores receptores de placebo para estimar la eficacia de la vacuna. Los análisis de eficacia de la vacuna en el LTPS se basan fundamentalmente en los datos recogidos desde el año 7 al año 10 después de la vacunación en el SPS. El seguimiento medio durante el LTPS fue de aproximadamente 3,9 años (rango de 1 semana a 4,75 años). Durante el LTPS se notificaron 263 casos de HZ evaluables en 261 pacientes [10,3/1.000 persona-año]. La eficacia estimada de la vacuna durante el periodo de seguimiento del LTPS fue del 21% (IC 95%: [11 a 30%]) para la incidencia de HZ, del 35% (IC 95%: 9 a 56%]) para la incidencia de NPH y del 37% (IC 95%: [27 a 46%]) en BOI de dolor asociado a HZ. Estudio de Eficacia y Seguridad de ZOSTAVAX (Estudio ZEST) en individuos de 50 a 59 años de edad: El Estudio de Eficacia y Seguridad de ZOSTAVAX (ZEST) fue un ensayo clínico doble ciego, controlado con placebo, en el que se aleatorizaron sujetos de 50 a 59 años para recibir una dosis única de ZOSTAVAX (n=11.211) o de placebo (n= ) y se les hizo un seguimiento en cuanto al desarrollo de zóster durante una media de 1,3 años (rango de 0 a 2 años). Todos los casos sospechosos de zóster fueron evaluados por un comité de evaluación clínica. La determinación final de los casos de zóster se realizó mediante la Reacción en Cadena de la Polimerasa (PCR) [86%], o en ausencia de detección del virus, según lo determinado por un comité de evaluación clínica [14%]. ZOSTAVAX redujo significativamente la incidencia de zóster comparado con el placebo (30 casos [2,0/1.000 persona-años] frente a 99 casos [6,6/1.000 persona-años], respectivamente; p<0,001). La eficacia protectora de ZOSTAVAX frente a zóster fue del 70% (IC 95%: [54 a 81%]. Inmunogenicidad de ZOSTAVAX 10
11 En el Estudio de Prevención de Herpes zóster (SPS), se evaluó la respuesta inmune a la vacunación en un subgrupo de los sujetos reclutados (N=1.395). ZOSTAVAX logró obtener una mayor respuesta inmune específica frente a VVZ a las 6 semanas post-vacunación comparada con placebo. Se ha demostrado un incremento, tanto en los niveles de anticuerpos frente a VVZ, medidos mediante ensayo inmunoenzimático de adsorción de glicoproteína (gpelisa) (diferencia de 1,7 veces, media geométrica de los títulos [GMT] de 479 frente a 288 unidades gpelisa/ml, p<0,001), como en la actividad de células T, medida mediante el inmunoensayo enzimático de interferón gamma (IFN-γ ELISPOT) (diferencia de 2,2 veces, media geométrica del recuento [GMC] de 70 frente a 32 células formadoras de manchas por millón de células mononucleares de sangre periférica [SFC/10 6 PBMCs], p<0,001). Al evaluarse a las 4 semanas post-vacunación, la inmunogenicidad de la actual formulación refrigerada estable ha demostrado ser similar a la inmunogenicidad de la anterior formulación congelada de ZOSTAVAX. Dentro del Ensayo de Eficacia y Seguridad de ZOSTAVAX (ZEST), se evaluaron las respuestas inmunes a la vacunación en una subcohorte aleatoria del 10% (n= para ZOSTAVAX y n= para el placebo) de los sujetos reclutados en el estudio ZEST. ZOSTAVAX obtuvo mayores respuestas inmunes específicas de VVZ a las 6 semanas tras la vacunación en comparación con el placebo. Se demostraron los incrementos en el nivel de anticuerpos VVZ, medidos mediante el ensayo inmunoenzimático de adsorción de glicoproteína (gpelisa) (diferencia de 2,3 veces (IC 95% [2,2; 2,4], media geométrica del título [GMT] de 664 frente a 288 unidades gpelisa/ml, p< 0,001). Inmunogenicidad después de la administración concomitante En un ensayo clínico controlado, doble ciego, 762 adultos de 50 años o mayores fueron randomizados para recibir una dosis única de ZOSTAVAX administrado bien de forma concomitante con vacuna antigripal de virus fraccionados inactivados (N=382) o no concomitante (N= 380). La respuesta de anticuerpos frente a ambas vacunas a las 4 semanas después de la vacunación fue similar, ya fueran administradas de forma concomitante o no. En un ensayo clínico controlado, doble ciego, 473 adultos a partir de 60 años fueron aleatorizados para recibir una dosis única de ZOSTAVAX administrado bien de forma concomitante con vacuna antineumocócica de polisacáridos de 23 serotipos (N=237) o no concomitante (N=236). A las 4 semanas de la administración concomitante, los niveles de anticuerpos frente a VVZ no fueron similares a los obtenidos después de la administración no concomitante (GMT de 338 frente a 484 unidades gpelisa/ml respectivamente; ratio GMT = 0,70 (IC 95%: [0,61; 0,80])). Los niveles de anticuerpos frente a VVZ a las 4 semanas de la vacunación aumentaron 1,9 veces (IC 95%: [1,7; 2,1]; cumpliendo con el criterio de aceptación preestablecido) en el grupo con administración concomitante frente a 3,1 veces (IC 95%: [2,8; 3,5]) en el grupo con administración no concomitante. Las GMT para los antígenos de la vacuna antineumocócica de polisacáridos de 23 serotipos fueron similares en los dos grupos. No hubo diferencia significativa en el perfil de seguridad entre la administración concomitante de ZOSTAVAX y la vacuna antineumocócica de polisacáridos de 23 serotipos y su administración no concomitante, salvo que el dolor de cabeza, el eritema y la hinchazón en el lugar de inyección de la vacuna antineumocócica fueron más frecuentes en el grupo con administración concomitante. Inmunogenicidad en individuos con antecedentes de herpes zóster (HZ) antes de la vacunación En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, ZOSTAVAX se administró a 100 individuos de 50 años o mayores con antecedentes de herpes zóster (HZ) antes de la vacunación para evaluar la inmunogenicidad y seguridad (ver sección 4.8) de ZOSTAVAX. ZOSTAVAX indujo una respuesta inmune específica frente a VVZ significativamente mayor, medida mediante gpelisa a las 4 semanas después de la vacunación, comparada con placebo (diferencia de 2,1 veces (IC 95%: [1,5 a 2,9]), p<0,001, GMT de 812 frente a 393 unidades gpelisa/ml). Las respuestas de anticuerpos frente a VVZ fueron generalmente similares en individuos de 50 a 59 años comparado con individuos de 60 años o mayores. Inmunogenicidad en individuos en tratamiento sistémico crónico/de mantenimiento con corticosteroides 11
12 En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a 206 individuos de 60 años o mayores que estaban recibiendo tratamiento sistémico crónico/de mantenimiento con corticosteroides a una dosis diaria equivalente de 5 a 20 mg de prednisona desde al menos 2 semanas antes del reclutamiento y hasta 6 semanas o más después de la vacunación, con el fin de evaluar la inmunogenicidad y el perfil de seguridad de ZOSTAVAX. Comparado con el placebo, ZOSTAVAX indujo una GMT de anticuerpos específicos frente a VVZ medidos por gpelisa más alta a las 6 semanas tras la vacunación (GMT de 531,1 frente a 224,3 unidades gpelisa/ml, respectivamente). El incremento de la media geométrica de la respuesta inmune después de la vacunación medida por gpelisa fue de 2,3 veces (IC 95%: [2,0 a 2,7]) comparado con 1,1 veces (IC 95%: [1,0 a 1,2]) en el grupo placebo. Inmunogenicidad en adultos infectados por VIH con la función inmune inalterada En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a adultos infectados por VIH (18 años de edad o mayores; mediana de edad 49 años) en tratamiento antirretroviral adecuado con la función inmune inalterada (Recuento de células T CD células/µl). A pesar de que ZOSTAVAX está indicado en un régimen de una única dosis, se utilizó un régimen de 2 dosis (ver sección 4.2). 286 sujetos recibieron 2 dosis y 9 sujetos recibieron una sola dosis. La respuesta de anticuerpos después de la primera y la segunda dosis fueron similares (GMT de 534,4 y 530,3 gpelisa unidades/ml, respectivamente). El incremento, en número de veces, de la media geométrica de los anticuerpos VZV, medidos por gpelisa, desde el inicio hasta la semana 6 y 12 fue de 1,78 (IC 95%: [1,64 a 1,92]) y 1,80 veces (IC 95%: [1,66 a 1,95]), respectivamente, en receptores de la vacuna (ver sección 4.3 relacionado con la inmunosupresión debida a VIH/SIDA). Revacunación La necesidad o el momento de revacunación con ZOSTAVAX no se ha determinado todavía. En un ensayo doble ciego, controlado con placebo, 98 adultos de 60 años o mayores recibieron una segunda dosis de ZOSTAVAX 42 días después de la dosis inicial; la vacuna fue generalmente bien tolerada. La frecuencia de acontecimientos adversos relacionados con la vacuna después de la segunda dosis de ZOSTAVAX fue generalmente similar a la que se vio con la primera dosis. Sujetos inmunocomprometidos La vacuna no ha sido evaluada en individuos con alteraciones de la inmunidad. 5.2 Propiedades farmacocinéticas No aplicable. 5.3 Datos preclínicos sobre seguridad No se han realizado estudios no-clínicos convencionales, pero no existen motivos de preocupación a partir de los datos no-clínicos que se consideren relevantes para la seguridad clínica, aparte de los datos incluidos en otras secciones de la Ficha Técnica. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Polvo: Sacarosa Gelatina hidrolizada Cloruro sódico Dihidrógeno fosfato potásico Cloruro potásico L-Glutamato monosódico 12
13 Fosfato disódico anhidro Hidróxido sódico (para ajustar el ph) Urea Disolvente: Agua para preparaciones inyectables 6.2 Incompatibilidades En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros en la misma jeringa. 6.3 Periodo de validez 18 meses. Después de la reconstitución, la vacuna debe utilizarse inmediatamente. Sin embargo, se ha demostrado una estabilidad de 30 minutos hasta su utilización, si se conserva entre 20º y 25ºC. 6.4 Precauciones especiales de conservación Conservar y transportar refrigerado (entre 2ºC y 8ºC). No congelar. Conservar en el embalaje original para protegerlo de la luz. Para las condiciones de conservación tras la reconstitución del medicamento, ver sección Naturaleza y contenido del envase Polvo en un vial (vidrio) con un tapón (goma de butilo) y tapa flip-off (aluminio) y disolvente en un vial (vidrio) con un tapón (goma de clorobutilo) y tapa flip-off (aluminio) en envases de 1 ó 10. Puede que solamente estén comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación y otras manipulaciones Evitar el contacto con desinfectantes. Para la reconstitución de la vacuna utilizar el disolvente suministrado. Cuando está reconstituido, ZOSTAVAX es un líquido de semi-turbio a traslúcido, de casi blanco a amarillo pálido. Es importante la utilización de una nueva jeringa y nueva aguja estériles para cada paciente con el fin de prevenir la transmisión de agentes infecciosos de un individuo a otro. Instrucciones para la reconstitución Extraer el contenido completo del vial de disolvente en una jeringa. Inyectar todo el disolvente en el vial de la vacuna liofilizada. Agitar suavemente para disolver completamente. Extraer el contenido completo de la vacuna reconstituida utilizando la misma jeringa. Inyectar la vacuna. Se recomienda que la vacuna sea administrada inmediatamente después de la reconstitución, para minimizar la pérdida de potencia. Deseche la vacuna reconstituida si no es utilizada en 30 minutos. No utilice la vacuna reconstituida si advierte cualquier partícula extraña o si el aspecto del disolvente 13
14 o de la vacuna reconstituida difiere de lo descrito anteriormente. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN SANOFI PASTEUR MSD SNC 162, avenue Jean Jaurès Lyon Francia 8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN EU/1/06/341/001 EU/1/06/341/ FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Fecha de la primera autorización: 23 de Mayo de 2006 Fecha de la última renovación: 23 de Mayo de FECHA DE LA REVISIÓN DEL TEXTO La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos 14
15 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de la reconstitución, 1 dosis (0,65 ml) contiene: Virus varicela-zóster 1, cepa Oka/Merck (vivos, atenuados) > UFP 2 1 Producidos en células diploides humanas (MRC-5) 2 UFP = Unidades formadoras de placa Esta vacuna puede contener trazas de neomicina. Ver secciones 4.3 y 4.4. Excipientes con efecto conocido: Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Polvo y disolvente para suspensión inyectable en jeringa precargada. El polvo es una masa compacta cristalina de color blanco o blanquecino. El disolvente es un líquido transparente incoloro. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas ZOSTAVAX está indicado para la prevención del herpes zóster ( zóster o culebrilla) y la neuralgia post-herpética (NPH) relacionada con herpes zóster. ZOSTAVAX está indicado para la inmunización de individuos de 50 años de edad o mayores. 4.2 Posología y forma de administración Posología Los individuos deben recibir una dosis única (0,65 ml) administrada subcutáneamente. Se desconoce actualmente la necesidad de una segunda dosis. Ver sección 5.1. Población pediátrica ZOSTAVAX no está indicado para la prevención de la infección primaria por el virus de la varicela (varicela) y no debe ser utilizado en niños y adolescentes. Forma de administración La vacuna ha de ser administrada por VIA SUBCUTÁNEA, preferiblemente en la región deltoidea. 15
16 No inyectar intravascularmente. Precauciones que deben tomarse antes de manipular o administrar este medicamento: ver sección 6.6. Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección Contraindicaciones Antecedentes de hipersensibilidad al principio activo o a alguno de los excipientes o a residuos en cantidades de trazas (ej. neomicina) (ver secciones 4.4 y 6.1). Estados de inmunodeficiencia primaria o adquirida debidos a afecciones tales como: leucemias agudas y crónicas; linfoma; otras enfermedades que afectan a la médula ósea o al sistema linfático; inmunosupresión debida a VIH/SIDA (ver secciones 4.8 y 5.1); deficiencias de la inmunidad celular. Terapia inmunosupresora (incluyendo altas dosis de corticosteroides). Sin embargo, ZOSTAVAX no está contraindicado en sujetos que estén recibiendo corticosteroides tópicos/inhalados o dosis bajas de corticosteroides sistémicos, o en pacientes que estén recibiendo corticoides como terapia de sustitución, por ejemplo, para la insuficiencia adrenal (ver secciones 4.8 y 5.1). Tuberculosis activa no tratada. Embarazo. Además, se debe evitar un embarazo durante 1 mes después de la vacunación (ver sección 4.6). 4.4 Advertencias y precauciones especiales de empleo Debe estar siempre disponible un tratamiento médico adecuado y supervisión para el caso de que sucediera una reacción anafiláctica/anafilactoide rara después de la administración de la vacuna, ya que existe la posibilidad de reacciones de hipersensibilidad, no sólo al principio activo, sino también a los excipientes y residuos en cantidades de trazas (por ejemplo, neomicina) presentes en la vacuna (ver secciones 4.3, 4.8 y 6.1). La alergia a neomicina generalmente se manifiesta como una dermatitis de contacto. Sin embargo, un antecedente de dermatitis de contacto debida a neomicina no es una contraindicación para recibir vacunas de virus vivos. ZOSTAVAX no está indicado para el tratamiento de zóster o de NPH. En presencia de fiebre debe considerarse un aplazamiento de la vacunación. Como con cualquier otra vacuna, la vacunación con ZOSTAVAX puede no proteger a todos los vacunados. Ver sección 5.1. No se ha establecido la seguridad y eficacia de ZOSTAVAX en adultos que se sabe que están infectados con VIH, con o sin evidencia de inmunodepresión (ver sección 4.3) sin embargo, ha finalizado un estudio de fase II de seguridad e inmunogenicidad en adultos infectados por VIH con la función inmune inalterada (Recuento de células T CD células/µl), ver secciones 4.8 y 5.1. Transmisión En los ensayos clínicos con ZOSTAVAX no se ha notificado la transmisión del virus de la vacuna. Sin embargo, la experiencia tras la comercialización de las vacunas de varicela sugiere que puede ocurrir raramente la transmisión del virus de la vacuna entre vacunados que desarrollan una erupción varicelosa y contactos susceptibles (por ejemplo, nietos pequeños susceptibles al virus varicela-zóster, VVZ). También se ha notificado la transmisión del virus de la vacuna desde vacunados frente a 16
17 varicela que no desarrollan una erupción varicelosa. Éste es un riesgo teórico de la vacunación con ZOSTAVAX. El riesgo de transmisión de virus atenuados de la vacuna desde un vacunado a un contacto susceptible debe ser sopesado frente al riesgo de desarrollar zóster natural y la potencial transmisión del VVZ salvaje a un contacto susceptible. 4.5 Interacción con otros medicamentos y otras formas de interacción ZOSTAVAX puede ser administrado de forma concomitante con vacuna antigripal inactivada mediante inyecciones separadas y en diferentes sitios del cuerpo (ver sección 5.1). ZOSTAVAX no debe administrarse de forma concomitante con la vacuna antineumocócica de polisacáridos de 23 serotipos, ya que en un ensayo clínico se observó una reducción de la inmunogenicidad de ZOSTAVAX como resultado del uso concomitante (ver sección 5.1). Actualmente no se dispone de datos relativos al uso concomitante con otras vacunas. No se ha evaluado la administración concurrente de ZOSTAVAX y medicaciones anti-virales de eficacia conocida frente al VVZ. 4.6 Fertilidad, embarazo y lactancia Embarazo No se han realizado estudios en mujeres embarazadas. Se desconoce también si ZOSTAVAX puede causar daño en el feto cuando se administra a mujeres embarazadas, o si puede afectar a la capacidad de reproducción. Sin embargo, se sabe que la infección por el virus varicela-zóster que ocurre de forma natural puede causar daño fetal. Como ZOSTAVAX no está indicado en individuos menores de 50 años, ZOSTAVAX no está destinado a mujeres embarazadas. En cualquier caso, se debe evitar un embarazo durante 1 mes después de la vacunación (ver secciones 4.3). Lactancia No se conoce si VVZ se secreta en la leche humana. Sin embargo, como algunos virus son secretados en la leche humana, debe tenerse precaución si se administra ZOSTAVAX a mujeres en período de lactancia. Fertilidad No se ha evaluado ZOSTAVAX en estudios de fertilidad. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se espera una nula o insignificante influencia de ZOSTAVAX sobre la capacidad para conducir y utilizar máquinas. 4.8 Reacciones adversas a. Resumen del perfil de seguridad Se ha evaluado la seguridad general en ensayos clínicos con más de adultos vacunados con ZOSTAVAX. Estudio de Prevención de Herpes zóster (Estudio SPS Shingles Prevention Study) en individuos de 60 años de edad y mayores En el mayor de estos ensayos, el Estudio de Prevención de Herpes zóster (SPS), individuos recibieron una dosis única de la formulación congelada de ZOSTAVAX (n=19.270) o placebo (n=19.276) y se monitorizó la seguridad a lo largo del ensayo. Durante el ensayo, se notificaron reacciones adversas graves relacionadas con la vacuna en 2 sujetos vacunados con ZOSTAVAX 17
18 (exacerbación de asma y polimialgia reumática) y en 3 sujetos que recibieron placebo (Síndrome de Goodpasture, reacción anafiláctica y polimialgia reumática). En el Subestudio de Monitorización de Acontecimientos Adversos, se le proporcionó a un subgrupo de individuos del SPS (n=3.345 recibieron ZOSTAVAX y n=3.271 recibieron placebo) tarjetas de vacunación para registrar los acontecimientos adversos que tuvieron lugar desde el Día 0 al Día 42 después de la vacunación, además del control rutinario de seguridad que se llevó a cabo durante todo el ensayo. Las reacciones adversas en el lugar de inyección y sistémicas relacionadas con la vacuna que fueron notificadas con una incidencia significativamente mayor en el grupo de la vacuna frente al grupo del placebo en el Subestudio de Monitorización de Acontecimientos Adversos figuran en la Tabla 1. La mayoría de estas reacciones adversas fueron notificadas como de intensidad leve. La Tabla 1 también incluye los acontecimientos adversos adicionales que han sido notificados espontáneamente durante el seguimiento post-comercialización. La incidencia general de las reacciones adversas en el lugar de inyección relacionadas con la vacuna fue significativamente mayor en los sujetos vacunados con ZOSTAVAX frente a los sujetos que recibieron placebo (48% en ZOSTAVAX y 17% en placebo). En el resto de sujetos del SPS se realizó una monitorización rutinaria de la seguridad, pero no se les proporcionó tarjetas de vacunación. Los tipos de acontecimientos adversos notificados en estos pacientes fueron generalmente similares a los del subgrupo de pacientes del Subestudio de Monitorización de Acontecimientos Adversos. Dentro de los 42 días del periodo de notificación post-vacunación en el SPS, el número de erupciones tipo herpes zóster notificadas entre todos los sujetos fue pequeño (17 para ZOSTAVAX, 36 para placebo; p=0,009). De estas 53 erupciones tipo herpes zóster, en 41 se obtuvieron muestras adecuadas para la prueba de PCR. Se detectó el VVZ salvaje en 25 de ellas (5 para ZOSTAVAX, 20 para placebo). La cepa Oka/Merck del VVZ no se detectó en ninguna de estas muestras. Dentro de esos mismos 42 días del periodo de notificación post-vacunación en el estudio SPS, el número (n=59) de notificaciones de erupción varicelosa también fue pequeño. De éstas, en 10 se obtuvieron muestras adecuadas para PCR. No se detectó VVZ en ninguna de estas muestras. Estudio de Eficacia y Seguridad de ZOSTAVAX (Estudio ZEST) in individuos de 50 a 59 años de edad En el estudio ZEST, los individuos recibieron una dosis única de ZOSTAVAX (n=11.184) o de placebo (n=11.212) y se hizo un seguimiento de la seguridad a lo largo del estudio. Durante el estudio se notificó un acontecimiento adverso grave relacionado con la vacuna en 1 sujeto vacunado con ZOSTAVAX (reacción anafiláctica). Todos los sujetos recibieron una tarjeta de vacunación con la finalidad de registrar los acontecimientos adversos ocurridos entre los días 1 a 42 posteriores a la vacunación, adicionalmente al seguimiento rutinario de la seguridad llevado a cabo a lo largo del estudio. En la Tabla 1 se recogen los acontecimientos adversos sistémicos y en el lugar de inyección relacionados con la vacuna que fueron notificados en el estudio ZEST. La Tabla 1 también incluye acontecimientos adversos adicionales que habían sido notificados espontáneamente durante el seguimiento post-comercialización. La incidencia global de acontecimientos adversos en el lugar de inyección relacionados con la vacuna fue significativamente mayor para los sujetos vacunados con ZOSTAVAX frente a los sujetos que recibieron placebo (63,9% para ZOSTAVAX y 14,4% para el placebo). La mayoría de estas reacciones adversas se notificaron como de intensidad leve. 18
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable
FICHA TÉCNICA. Polisacárido Vi de Salmonella typhi (cepa Ty2)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Anatoxal Tedi, suspensión inyectable, jeringa precargada Vacuna contra la difteria y el tétanos (adsorbida, contenido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Anatoxal Tedi, suspensión inyectable, jeringa precargada Vacuna contra la difteria y el tétanos (adsorbida, contenido
FICHA TÉCNICA ZOSTAVAX. prevenir el herpes zóster prevenir la neuralgia posherpética disminuir el dolor asociado con el herpes zóster agudo o crónico.
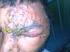 1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna antivaricela atenuada 3. Composición cualitativa y cuantitativa Cuando se reconstituye como se indica, es un preparado estéril para
1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna antivaricela atenuada 3. Composición cualitativa y cuantitativa Cuando se reconstituye como se indica, es un preparado estéril para
Comentarios sobre la vacuna contra el herpes zóster
 Comentarios sobre la vacuna contra el herpes zóster Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid El Advisory Committee
Comentarios sobre la vacuna contra el herpes zóster Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid El Advisory Committee
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
* cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
 1. NOMBRE DEL MEDICAMENTO LEVRISON, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe fraccionados*,
1. NOMBRE DEL MEDICAMENTO LEVRISON, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe fraccionados*,
FICHA TÉCNICA. Suspensión inyectable en jeringa precargada. La vacuna antihepatitis A (inactivada, adsorbida) es una suspensión blanca y turbia.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Avaxim, suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de 0,5 mililitros
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Avaxim, suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de 0,5 mililitros
ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable en jeringa precargada
 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos)
1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos)
ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable en jeringa precargada
 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos)
1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable ZOSTAVAX polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos)
FICHA TÉCNICA. * La vacuna cumple con la recomendación de la OMS (hemisferio Norte) y con la decisión de la Unión Europea para la campaña 2000/2001.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL PASTEUR Vacuna antigripal inactivada (virus fraccionados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe cultivados en huevos, fraccionados
FICHA TÉCNICA. Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO Respi 3 suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO Respi 3 suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
FICHA TÉCNICA. MENCEVAX AC es una preparación liofilizada de polisacáridos purificados de Neisseria meningitidis (meningococo) de los grupos A y C.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral. Agua para preparaciones inyectables 1 g por 1 ml. ph entre 4,5 y 7,0.
 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por 1 ml. ph entre
1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por 1 ml. ph entre
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZULVAC 1 Bovis suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZULVAC 1 Bovis suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO EURICAN P Liofilizado y disolvente para suspensión inyectable
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO EURICAN P Liofilizado y disolvente para suspensión inyectable
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1.- DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SYVAYESKY-ACUOSO Liofilizado y disolvente para suspensión inyectable 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1.- DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SYVAYESKY-ACUOSO Liofilizado y disolvente para suspensión inyectable 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker inac, suspensión inyectable
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker inac, suspensión inyectable
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 2.1 Descripción general
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Las cápsulas son ovales, con el cuerpo y la tapa de color blanco.
Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna reconstituida
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna reconstituida
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL BRSV PI3 BVD Liofilizado y suspensión
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL BRSV PI3 BVD Liofilizado y suspensión
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO RESPI INTRANASAL, liofilizado y disolvente para suspensión para
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO RESPI INTRANASAL, liofilizado y disolvente para suspensión para
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS-4 Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS-4 Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
1. NOMBRE DEL MEDICAMENTO CHIROFLU Vacuna antigripal (antígeno de superficie, inactivado) (campaña )
 1. NOMBRE DEL MEDICAMENTO CHIROFLU Vacuna antigripal (antígeno de superficie, inactivado) (campaña 1999-2000) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos de la superficie de virus de la gripe propagados
1. NOMBRE DEL MEDICAMENTO CHIROFLU Vacuna antigripal (antígeno de superficie, inactivado) (campaña 1999-2000) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos de la superficie de virus de la gripe propagados
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO AUSKIPRA-GN Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancia
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO AUSKIPRA-GN Liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancia
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SUVAXYN M. HYO-PARASUIS, suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancias activas:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SUVAXYN M. HYO-PARASUIS, suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancias activas:
FICHA TÉCNICA. 1 ml de solución contiene 3 mg de hipromelosa y 5,5 mg de cloruro de sodio.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO COLIRCUSÍ HUMECTANTE 3 mg/ml + 5,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 3 mg de hipromelosa y 5,5 mg de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO COLIRCUSÍ HUMECTANTE 3 mg/ml + 5,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 3 mg de hipromelosa y 5,5 mg de
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO. LETIFEND liofilizado y disolvente para solución inyectable para perros
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LETIFEND liofilizado y disolvente para solución inyectable para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de vacuna contiene: Liofilizado
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LETIFEND liofilizado y disolvente para solución inyectable para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de vacuna contiene: Liofilizado
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ingelvac MycoFLEX suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Mycoplasma
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ingelvac MycoFLEX suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Mycoplasma
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis BVD Suspensión inyectable para bovino. DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis BVD Suspensión inyectable para bovino. DIRECCIÓN DE LA AGENCIA ESPAÑOLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. HAVRIX, cumple con los requisitos de la Organización Mundial de la Salud para la fabricación de productos biológicos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO - HAVRIX 1440 - HAVRIX 720 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA HAVRIX es una suspensión estéril que contiene el virus de la hepatitis A (VHA) (cepa HM 175)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO - HAVRIX 1440 - HAVRIX 720 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA HAVRIX es una suspensión estéril que contiene el virus de la hepatitis A (VHA) (cepa HM 175)
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican Lmulti Suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de suspensión
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican Lmulti Suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis de suspensión
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. COLOMBOVAC PMV/POX Liofilizado y suspensión para suspensión inyectable para palomas
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO COLOMBOVAC PMV/POX Liofilizado y suspensión para suspensión inyectable
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO COLOMBOVAC PMV/POX Liofilizado y suspensión para suspensión inyectable
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Influvac suspensión inyectable jeringa precargada (vacuna antigripal inactivada de antígenos de superficie). Campaña 2014/2015. 2.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Influvac suspensión inyectable jeringa precargada (vacuna antigripal inactivada de antígenos de superficie). Campaña 2014/2015. 2.
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TÉCNICA. Alivio de los síntomas del dolor agudo de garganta en adultos y niños mayores de 6 años.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor menta amilmetacresol / alcohol dichlorobencílico Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor miel y limón
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor menta amilmetacresol / alcohol dichlorobencílico Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor miel y limón
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS BALANCE liofilizado y suspensión para preparación de suspensión inyectable para bovino
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRABOVIS BALANCE liofilizado y suspensión para preparación de suspensión inyectable para bovino
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. CANIGEN DHPPi liofilizado y solvente para suspensión inyectable para perros
 DEPARTAMENTO MEDICAMENTOS VETERINARIOS DE FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CANIGEN DHPPi liofilizado y solvente para suspensión inyectable
DEPARTAMENTO MEDICAMENTOS VETERINARIOS DE FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CANIGEN DHPPi liofilizado y solvente para suspensión inyectable
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Saccharomyces boulardii 250 mg Excipientes con efecto conocido:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSCTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Cellufresh 5 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA. Toxoide diftérico purificado... una dosis inmunizante* Toxoide tetánico purificado...una dosis inmunizante**
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO D.T.VAX Vacuna antidiftero-tetánica adsorbida. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Toxoide diftérico purificado... una dosis inmunizante* Toxoide tetánico
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO D.T.VAX Vacuna antidiftero-tetánica adsorbida. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Toxoide diftérico purificado... una dosis inmunizante* Toxoide tetánico
4.2. Indicaciones de uso, especificando las especies de destino
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO FILAVAC VHD K C+V suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO FILAVAC VHD K C+V suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Antígenos de superficie de virus de la gripe (hemaglutinina y neuraminidasa), de las siguientes cepas*:
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2013/2014)
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2013/2014)
FICHA TÉCNICA. Adultos y adolescentes mayores de 12 años: de 250 a 500 mg al día distribuidos en dos tomas (mañana y noche)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Virus de la Laringotraqueítis Infecciosa Aviar, vivo atenuado, cepa Serva 2,5 log 10 DIE 50 *
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS ILT 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (0,03 ml):
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS ILT 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (0,03 ml):
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Leptospira interrogans inactivada, serogrupo canicola, cepa Ca : 40 PD 80 **
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBIVAC RL Suspensión inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBIVAC RL Suspensión inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER INACTIVATUM Suspensión inyectable para bovino 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER INACTIVATUM Suspensión inyectable para bovino 2. COMPOSICIÓN
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-181) 15 microgramos HA** Cepa derivada de A/Victoria/361/2011 (H3N2): (IVR-165)
 1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
1. RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 1. RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DERCUNIMIX Liofilizado y suspensión para suspensión inyectable para conejos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
1. RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DERCUNIMIX Liofilizado y suspensión para suspensión inyectable para conejos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
Información para Prescribir Amplia ZOSTAVAX
 I. Denominación distintiva ZOSTAVAX II. Denominación genérica Vacuna antivaricela atenuada. III. Forma Farmacéutica y Formulación Forma Farmacéutica: Suspensión. Consideración de uso: Inyectable. ZOSTAVAX
I. Denominación distintiva ZOSTAVAX II. Denominación genérica Vacuna antivaricela atenuada. III. Forma Farmacéutica y Formulación Forma Farmacéutica: Suspensión. Consideración de uso: Inyectable. ZOSTAVAX
Excipientes con efecto conocido: Lactosa monohidrato 6,5 mg Sacarosa 92,30 mg Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Saccharomyces boulardii 50 mg. Excipientes con efecto conocido: Lactosa
1. NOMBRE DEL MEDICAMENTO Ultra-Levura 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Saccharomyces boulardii 50 mg. Excipientes con efecto conocido: Lactosa
Brucella melitensis, viva atenuada, cepa Rev-1 (fase lisa) x 10 9 ufc* *ufc: Unidades formadoras de colonias
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CZV Rev-1 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis (1 ml) de
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CZV Rev-1 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis (1 ml) de
FICHA TÉCNICA. Polisacárido capsular Vi purificado de Salmonella typhi (cepa Ty2) microgramos
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV Suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 1 ml contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV Suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 1 ml contiene:
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
FICHA TÉCNICA. Excipientes con efecto conocido: Cada comprimido contiene: 200 mg de sacarosa y 240 mg de sorbitol (E-420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Simeticona Normon 40 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona... 40 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Simeticona Normon 40 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona... 40 mg Excipientes con efecto conocido:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DILPHES 4 suspensión inyectable para bovino, ovino y caprino 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DILPHES 4 suspensión inyectable para bovino, ovino y caprino 2. COMPOSICIÓN
FICHA TÉCNICA. Excipientes con efecto conocido: 0,458 g de maltitol líquido (E965) y 1,830 g de isomalta (E953).
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol.
 1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna reconstituida
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac Myxo-RHD liofilizado y disolvente para suspensión inyectable para conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna reconstituida
Inmunización activa de residentes en áreas endémicas de fiebre amarilla. Las áreas endémicas se limitan a Africa y América Central y del sur.
 1. NOMBRE DEL MEDICAMENTO: ARILVAX, Vacuna de la fiebre amarilla, viva (BP) 2. COMPOSICION CUALI Y CUANTITATIVA: Por dosis (0,5 ml): Principios Activos: Virus de la fiebre amarilla... 10 3,7 ufp (equivalente
1. NOMBRE DEL MEDICAMENTO: ARILVAX, Vacuna de la fiebre amarilla, viva (BP) 2. COMPOSICION CUALI Y CUANTITATIVA: Por dosis (0,5 ml): Principios Activos: Virus de la fiebre amarilla... 10 3,7 ufp (equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Tusheel películas bucodispersables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada película bucodispersable contiene 16 mg de extracto (como extracto seco) de hoja
FICHA TÉCNICA. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por cada unidad de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Por cada unidad de vacuna
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Entero-Silicona 9 mg/ml emulsión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de emulsión oral contiene:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Entero-Silicona 9 mg/ml emulsión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de emulsión oral contiene:
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
Purevax RCPFeLV liofilizado y disolvente para suspensión inyectable
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPFeLV liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Liofilizado: Sustancias activas:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPFeLV liofilizado y disolvente para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Liofilizado: Sustancias activas:
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Ultra Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA. Sorbitol líquido (no cristalizante); 1 ml de jarabe contiene 495,6 mg de sorbitol (E 420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
