Nombre de fantasía Dosis Forma farmacéutica
|
|
|
- Veronica Ortiz de Zárate Núñez
- hace 6 años
- Vistas:
Transcripción
1 Anexo I Relación de los nombres, forma farmacéutica y dosis de los medicamentos veterinarios, y de las especies de destino y titulares de la autorización de comercialización en los Estados miembros 1/10
2 Estado miembro de la UE/EEE Titular de la autorización de comercialización Nombre de fantasía Dosis Forma farmacéutica Especie de destino Austria - Emulsion zur Injektion für Rinder Bélgica República Checa Injekční emulze pro skot Dinamarca Francia EMULSION INJECTABLE POUR BOVINS 2/10
3 Estado miembro de la UE/EEE Titular de la autorización de comercialización Nombre de fantasía Dosis Forma farmacéutica Especie de destino Alemania Grecia Hungría vakcina A.U.V. Irlanda Emulsion for injection for cattle Italia Emulsion for injection for cattle 3/10
4 Estado miembro de la UE/EEE Titular de la autorización de comercialización Nombre de fantasía Dosis Forma farmacéutica Especie de destino Polonia Portugal emulsja do wstrzykiwań dla bydła Emulsão para injecção para bovinos República Eslovaca injekčná emulzia pre dobytok España Países Bajos 4/10
5 Estado miembro de la UE/EEE Titular de la autorización de comercialización Nombre de fantasía Dosis Forma farmacéutica Especie de destino Reino Unido Emulsion for Injection for Cattle 5/10
6 Anexo II Conclusiones científicas y motivos de la suspensión de las autorizaciones de comercialización 6/10
7 RESUMEN GENERAL DE LA EVALUACIÓN CIENTÍFICA DE EMULSIÓN INYECTABLE PARA BOVINO Y DENOMINACIONES ASOCIADAS 1. Introducción emulsión para bovino es una vacuna que reduce los signos clínicos y las lesiones pulmonares producidas por serotipo A1 e Histophilus somni en terneros a partir de los. Desde octubre de 2010, el número de informes recibidos sobre acontecimientos de tipo anafiláctico, algunos de ellos mortales, ha aumentado de 12 a 24, principalmente en cuatro de los 16 Estados miembros de la Unión Europea (UE) en donde está autorizado el producto. Estas notificaciones alertaron de una posible relación con el uso de emulsión para bovino. Aunque no estaba claro si esos acontecimientos representaban reacciones anafilácticas «reales» o eran el resultado de signos clínicos similares producidos por acontecimientos anafilactoides o relacionados con endotoxinas, en adelante se utiliza el término «de tipo anafiláctico» para hacer referencia a los acontecimientos adversos notificados. El mayor número de acontecimientos adversos se notificó en Francia. Tras la comercialización inicial del medicamento en Francia en 2009, se estimó que la frecuencia de acontecimientos adversos notificados en relación con la cantidad de producto comercializado era de aproximadamente un animal afectado por cada 860 animales tratados (nueve informes de acontecimientos adversos en 69 animales afectados, 18 de los cuales murieron). Tras la evaluación de los acontecimientos adversos, la autoridad competente francesa consideró que la relación riesgo/beneficio del producto era desfavorable y suspendió la autorización de comercialización en Francia como medida de precaución hasta que pudiera identificarse la causa de dichos acontecimientos adversos y se adoptaran medidas correctoras. El titular de la autorización de comercialización suspendió voluntariamente la comercialización del producto en marzo de 2011, inicialmente en Francia y posteriormente en todos los demás Estados miembros afectados. Las autoridades nacionales competentes suspendieron las autorizaciones de comercialización en España e Italia el 11 y el 20 de abril de 2011, respectivamente. 2. Datos presentados En cuatro Estados miembros de la UE se han notificado acontecimientos adversos relacionados con reacciones de tipo anafiláctico, algunos de ellos mortales. Hasta la fecha no se han notificado acontecimientos adversos en los otros 12 Estados miembros afectados. La frecuencia de acontecimientos notificados varía entre los Estados miembros y no parece ser un reflejo directo de la cantidad de producto comercializado. Los acontecimientos adversos de tipo anafiláctico se han notificado con mayor frecuencia en tres de los 16 Estados miembros que han autorizado el producto, Bélgica, Francia e Italia. Además, en España, donde se han registrado aproximadamente la mitad de las ventas totales del producto en la UE, se han comunicado dos acontecimientos adversos hasta la fecha. En Francia, se estimó que la incidencia de acontecimientos de tipo anafiláctico notificados era del 0,177 % o de un animal afectado por cada 560 animales tratados. Entre el 1 de abril de 2010 y el 28 de febrero de 2011, se estimó que la incidencia global de acontecimientos adversos en la UE era de aproximadamente el 0,048 % (o «rara») y la mortalidad en torno al 0,0087 % (o «muy rara»). El Comité de Medicamentos de Uso Veterinario (CVMP) señaló que los datos de farmacovigilancia (informes de acontecimientos adversos) indicaban una frecuencia variable de notificación de acontecimientos de tipo anafiláctico en la Unión Europea. El Comité consideró el posible papel de otros 7/10
8 factores contribuyentes en relación con los acontecimientos adversos notificados, como efectos relacionados con la calidad (de los lotes), efectos relacionados con los animales (por ejemplo, raza, sensibilidad según la edad); interacciones o factores geográficos. Se consideró la posible relación entre los acontecimientos adversos notificados y los posibles efectos relacionados con endotoxinas del producto. Sin embargo, la evaluación de los datos no permitió llegar a una conclusión definitiva sobre estas hipótesis. Tras la evaluación de los datos presentados por el titular de la autorización de comercialización, se consideró que la información no era suficiente para conocer el mecanismo responsable de los acontecimientos de tipo anafiláctico tras la administración de emulsión para bovino, ni los posibles factores que pueden contribuir a esos acontecimientos. El Comité examinó los estudios que se están realizando y se realizarán en el futuro con el apoyo del titular de la autorización de comercialización para investigar la posible relación entre emulsión para bovino y los acontecimientos adversos de tipo anafiláctico. En un ensayo clínico se investigaron los posibles efectos de las vacunas contra el virus respiratorio sincitial bovino como un posible factor de predisposición a los acontecimientos adversos observados tras el empleo de emulsión para bovino. No obstante, el CVMP consideró que las circunstancias en las que se había realizado ese estudio y el limitado número de animales incluidos en él no permitían extraer conclusiones definitivas que explicaran el aumento de los acontecimientos de tipo anafiláctico observado en el campo, ni para recomendar medidas orientadas a la reducción del riesgo de tales acontecimientos. Un segundo estudio, en el que también se investiga la posible relación de las vacunas contra el virus respiratorio sincitial bovino como un factor de predisposición, no ha acabado aún y se espera conocer sus resultados a finales de julio de El CVMP consideró asimismo que el hincapié que hacía el titular de la autorización de comercialización en la investigación del papel de la infección por el virus sincitial respiratorio bovino o la vacunación contra este virus perseguía la exclusión de otros factores de riesgo que pueden contribuir a la aparición de acontecimientos adversos. Se recomendó que el titular de la autorización de comercialización siguiera investigando más a fondo todos esos posibles factores contribuyentes. El Comité examinó las medidas propuestas por el titular de la autorización de comercialización para reducir al mínimo el riesgo de acontecimientos de tipo anafiláctico después de la administración del producto. Al no haberse identificado ninguna causa subyacente que explicara los acontecimientos adversos observados en ese momento, consideró que los cambios propuestos en el resumen de las características del producto (RCP) y el prospecto eran insuficientes para reducir al mínimo el riesgo de acontecimientos de tipo anafiláctico tras la administración de emulsión para bovino en las condiciones de uso autorizadas. Aunque barajó la posible necesidad de una revisión del texto del RCP en el futuro para reflejar con mayor exactitud la frecuencia y la intensidad de los acontecimientos adversos notificados, no consideró que ese cambio fuera una medida adecuada para abordar la cuestión relativa a los acontecimientos de tipo anafiláctico. El Comité recordó que, desde marzo de 2011, el titular de la autorización de comercialización había suspendido voluntariamente la comercialización del producto en todos los Estados miembros de la UE afectados donde está autorizado el producto. Aun reconociendo las limitaciones intrínsecas de los datos de farmacovigilancia y el reducido tamaño del estudio clínico realizado por el titular de la autorización de comercialización, tras examinar los datos disponibles el CVMP concluyó que los resultados antes mencionados proporcionan indicios de una asociación entre los acontecimientos de tipo anafiláctico observados y la administración de emulsión para bovino. No se conoce todavía el mecanismo responsable, ni los factores que pueden contribuir a esos acontecimientos. En la actualidad se está realizando un estudio de laboratorio, pero, no obstante, harán falta más investigaciones para determinar las causas subyacentes de los acontecimientos de tipo anafiláctico notificados. 8/10
9 3. Evaluación de la relación riesgo/beneficio emulsión para bovino es la única vacuna actualmente aprobada en la Unión Europea que combina los componentes activos e Histophilus somni. Con ella se amplía el abanico de posibles opciones de vacunación. Se espera que tenga un efecto positivo en la salud y el bienestar de los rebaños al reducir los signos clínicos y las lesiones pulmonares causados por serotipo A1 e Histophilus somni en bovino. Aunque se reconocen los beneficios de la vacuna contra la enfermedad respiratoria bovina para la salud y el bienestar de los animales, así como sus beneficios económicos, emulsión para bovino no es una vacuna esencial para este tipo de ganado. En el mercado de la Unión Europea ya existen otros instrumentos de tratamiento y manejo que son válidos para controlar las enfermedades causadas por e Histophilus somni. Los principales riesgos asociados al producto están relacionados con los posibles acontecimientos de tipo anafiláctico que puedan aparecer en los animales tratados, algunos de los cuales han sido fatales. En Francia se calculó que la incidencia de acontecimientos de tipo anafiláctico notificados era del 0,177 %, o de 1 animal afectado por cada 560 animales tratados. Entre el 1 de abril de 2010 y el 28 de febrero de 2011, se estimó que la incidencia en toda la UE de acontecimientos adversos notificados desde que empezara a usarse el producto había sido del 0,048 % (o «rara») entre el 1 de abril de 2010 y el 28 de febrero de 2011 y la mortalidad, del 0,0087 % (o «muy rara»). La frecuencia de acontecimientos de tipo anafiláctico notificados desde que se inició la comercialización del producto aumentó notablemente a partir de octubre de 2010 en Bélgica, Francia e Italia, en comparación con otros Estados miembros afectados. Tras examinar los datos de seguridad posteriores a la autorización, no se aprecian indicios de que el producto entrañe un riesgo para el usuario, el consumidor o el medio ambiente. Los datos evaluados indican una asociación entre la vacunación de bovinos con emulsión para bovino y la aparición de acontecimientos de tipo anafiláctico, que ha aumentado recientemente en algunos Estados miembros de la UE. Hasta la fecha, se desconoce el mecanismo responsable de los acontecimientos observados, así como los factores que pueden contribuir a los mismos y que siguen siendo objeto de investigación. Como todavía no se han determinado las causas subyacentes, tampoco se han podido proponer medidas correctoras adecuadas para reducir al mínimo el riesgo de este tipo de acontecimientos adversos. El titular de la autorización de comercialización ha adoptado medidas cautelares y ha suspendido la comercialización del producto en la UE. Puesto que de momento no se pueden adoptar medidas correctoras, tampoco se puede descartar que los acontecimientos adversos graves notificados en algunos Estados miembros puedan ocurrir en otros países que hasta la fecha no se han visto afectados. Se considera que el riesgo potencial de estos acontecimientos después de usar el producto es inaceptable en comparación con las ventajas que ofrece. El CVMP ha concluido que globalmente, en las condiciones de uso autorizadas, la relación riesgo/beneficio es desfavorable. 9/10
10 Motivos de la suspensión de las autorizaciones de comercialización Considerando que los acontecimientos adversos de tipo anafiláctico, algunos de ellos mortales, notificados desde que se inició la comercialización de emulsión para bovino indican una relación con el producto; que aún no se conoce la causa de los acontecimientos adversos observados y que, por tanto, no se ha podido proponer ninguna medida específica para asegurar que el producto se asocie a un riesgo inaceptable de acontecimientos de tipo anafiláctico, en ocasiones mortales, en las condiciones de uso autorizadas; que el CVMP ha llegado a la conclusión de que la relación riesgo/beneficio de emulsión para bovino es desfavorable en las condiciones de uso autorizadas; el CVMP, con arreglo al artículo 83, apartado 1, letra a, de la Directiva 2001/82/CE, ha recomendado la suspensión de las autorizaciones de comercialización para los medicamentos veterinarios que figuran en el Anexo I del dictamen del CVMP. Condiciones para el levantamiento de la suspensión Las autoridades nacionales competentes, coordinadas por el Estado miembro de referencia, deberán asegurarse de que el titular de la autorización de comercialización cumpla las siguientes condiciones: El titular de la autorización de comercialización debe investigar la naturaleza cualitativa de los acontecimientos adversos observados; investigar los posibles factores que puedan explicar las diferencias regionales observadas en los acontecimientos adversos; y proponer medidas adecuadas que reduzcan el riesgo de aparición de tales acontecimientos con el fin de demostrar una relación riesgo/beneficio favorable del producto cuando se utiliza siguiendo las recomendaciones del resumen de las características del producto. 10/10
Dosis. Virus vivos de la enfermedad bursal infecciosa, cepa V877. Virus vivos de la enfermedad bursal infecciosa, cepa V877
 ANEXO I RELACIÓN DE LOS NOMBRES, FORMAS FARMACÉUTICAS Y DOSIS DE LOS MEDICAMENTOS VETERINARIOS, Y DE LAS ESPECIES ANIMALES, VÍAS DE ADMINISTRACIÓN, DOSIS RECOMENDADA, PERÍODO DE ESPERA Y SOLICITANTES O
ANEXO I RELACIÓN DE LOS NOMBRES, FORMAS FARMACÉUTICAS Y DOSIS DE LOS MEDICAMENTOS VETERINARIOS, Y DE LAS ESPECIES ANIMALES, VÍAS DE ADMINISTRACIÓN, DOSIS RECOMENDADA, PERÍODO DE ESPERA Y SOLICITANTES O
L 282/52 Diario Oficial de la Unión Europea
 L 282/52 Diario Oficial de la Unión Europea 13.10.2006 DECISIÓN DE LA COMISIÓN de 12 de octubre de 2006 sobre los programas de erradicación y vigilancia de determinadas enfermedades animales, prevención
L 282/52 Diario Oficial de la Unión Europea 13.10.2006 DECISIÓN DE LA COMISIÓN de 12 de octubre de 2006 sobre los programas de erradicación y vigilancia de determinadas enfermedades animales, prevención
L 90/106 Diario Oficial de la Unión Europea
 L 90/106 Diario Oficial de la Unión Europea 28.3.2013 DECISIÓN DE LA COMISIÓN de 26 de marzo de 2013 por la que se determinan las asignaciones anuales de emisiones de los Estados miembros para el período
L 90/106 Diario Oficial de la Unión Europea 28.3.2013 DECISIÓN DE LA COMISIÓN de 26 de marzo de 2013 por la que se determinan las asignaciones anuales de emisiones de los Estados miembros para el período
L 192/4 Diario Oficial de la Unión Europea
 L 192/4 Diario Oficial de la Unión Europea 24.7.2007 REGLAMENTO (CE) N o 866/2007 DEL CONSEJO de 23 de julio de 2007 por el que se modifica el Reglamento (CE) n o 234/2004 relativo a determinadas medidas
L 192/4 Diario Oficial de la Unión Europea 24.7.2007 REGLAMENTO (CE) N o 866/2007 DEL CONSEJO de 23 de julio de 2007 por el que se modifica el Reglamento (CE) n o 234/2004 relativo a determinadas medidas
Resumen general de la evaluación científica de los medicamentos que contienen nimesulida para uso sistémico (Ver Anexo I)
 Anexo II Conclusiones científicas y motivos de la modificación de los resúmenes de las características del producto y los prospectos presentados por la EMA 41 Conclusiones científicas Resumen general de
Anexo II Conclusiones científicas y motivos de la modificación de los resúmenes de las características del producto y los prospectos presentados por la EMA 41 Conclusiones científicas Resumen general de
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Forma farmacéutica. Estado miembro. Vía de administración. Concentra ción. Especie de destino. Solicitante Nombre Sustancia activa
 Anexo I Relación de los nombres, formas farmacéuticas y dosis de los medicamentos veterinarios, y de las especies animales, vías de y solicitantes en los estados miembros 1/9 Estado miembro Solicitante
Anexo I Relación de los nombres, formas farmacéuticas y dosis de los medicamentos veterinarios, y de las especies animales, vías de y solicitantes en los estados miembros 1/9 Estado miembro Solicitante
COMISIÓN EUROPEA COMUNICADO DE PRENSA. Principales correcciones financieras
 COMISIÓN EUROPEA COMUNICADO DE PRENSA La Comisión recuperará de los Estados miembros 54,3 millones de euros de gastos de la PAC Bruselas, 16 de febrero de 2012 La Comisión Europea ha reclamado hoy, en
COMISIÓN EUROPEA COMUNICADO DE PRENSA La Comisión recuperará de los Estados miembros 54,3 millones de euros de gastos de la PAC Bruselas, 16 de febrero de 2012 La Comisión Europea ha reclamado hoy, en
Forma farmacéutica Vía de administración. Contenido (Concentración) Estado miembro. Nombre. Dinamarca. Vantas 50 mg Implante Subcutánea 50 mg
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, SOLICITANTE, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado miembro Dinamarca
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, SOLICITANTE, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado miembro Dinamarca
POBLACIÓN EN JEREZ DE LA FRONTERA, SEGÚN PROCEDENCIA Nacidos en España Nacidos en la misma Comunidad Nacidos en la misma
 POBLACIÓN EN JEREZ DE LA FRONTERA, SEGÚN PROCEDENCIA Nacidos en España 2011 203.431 Nacidos en la misma Comunidad 2011 191.725 Nacidos en la misma Comunidad y en la misma provincia 2011 179.709 Nacidos
POBLACIÓN EN JEREZ DE LA FRONTERA, SEGÚN PROCEDENCIA Nacidos en España 2011 203.431 Nacidos en la misma Comunidad 2011 191.725 Nacidos en la misma Comunidad y en la misma provincia 2011 179.709 Nacidos
NOTA INFORMATIVA SOBRE LAS CONDICIONES DE EXPORTACIÓN DE BOVINOS VIVOS DE ESPAÑA A TURQUÍA. 04 de julio de 2017
 MINISTERIO DE AGRICULTURA Y PESCA, ALIMENTACIÓN Y MEDIO AMBIENTE DIIRECCION GENERAL DE SANIDAD DE LA PRODUCCIÓN AGRARIA SUBDIRECCION GENERAL DE ACUERDOS SANITARIOS Y CONTROL EN FRONTERA NOTA INFORMATIVA
MINISTERIO DE AGRICULTURA Y PESCA, ALIMENTACIÓN Y MEDIO AMBIENTE DIIRECCION GENERAL DE SANIDAD DE LA PRODUCCIÓN AGRARIA SUBDIRECCION GENERAL DE ACUERDOS SANITARIOS Y CONTROL EN FRONTERA NOTA INFORMATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACION DEL MEDICAMENTO VETERINARIO DERCUNIMIX 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACION DEL MEDICAMENTO VETERINARIO DERCUNIMIX 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACION DEL MEDICAMENTO VETERINARIO DERCUNIMIX 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis
DECISIÓN DEL CONSEJO EUROPEO
 26.6.2010 Diario Oficial de la Unión Europea L 160/5 DECISIONES DECISIÓN DEL CONSEJO EUROPEO de 17 de junio de 2010 relativa al examen, por una Conferencia de representantes de los Gobiernos de los Estados
26.6.2010 Diario Oficial de la Unión Europea L 160/5 DECISIONES DECISIÓN DEL CONSEJO EUROPEO de 17 de junio de 2010 relativa al examen, por una Conferencia de representantes de los Gobiernos de los Estados
Anexo IV. Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
Resumen general de la evaluación científica de los supositorios que contienen derivados terpénicos (ver Anexo I)
 ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS DE LA REVOCACIÓN O MODIFICACIÓN DE LAS SECCIONES PERTINENTES DE LOS RESÚMENES DE LAS CARACTERÍSTICAS DEL PRODUCTO, ETIQUETADOS Y PROSPECTOS PRESENTADOS POR LA
ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS DE LA REVOCACIÓN O MODIFICACIÓN DE LAS SECCIONES PERTINENTES DE LOS RESÚMENES DE LAS CARACTERÍSTICAS DEL PRODUCTO, ETIQUETADOS Y PROSPECTOS PRESENTADOS POR LA
L 337/46 Diario Oficial de la Unión Europea COMISIÓN
 L 337/46 Diario Oficial de la Unión Europea 5.12.2006 COMISIÓN DECISIÓN DE LA COMISIÓN de 30 de noviembre de 2006 por la que se aprueban los programas de erradicación y vigilancia de las enfermedades animales
L 337/46 Diario Oficial de la Unión Europea 5.12.2006 COMISIÓN DECISIÓN DE LA COMISIÓN de 30 de noviembre de 2006 por la que se aprueban los programas de erradicación y vigilancia de las enfermedades animales
Frecuencia y vía de administración. 500 mg Equinos Una vez (el tratamiento puede repetirse si lo recomienda el veterinario) Vía intravenosa
 Anexo I Relación de los nombres, formas farmacéuticas y dosis de los medicamentos veterinarios, y de las especies animales, vías de administración y titulares de la autorización de comercialización en
Anexo I Relación de los nombres, formas farmacéuticas y dosis de los medicamentos veterinarios, y de las especies animales, vías de administración y titulares de la autorización de comercialización en
Diario Oficial de la Unión Europea L 314/39
 15.11.2006 Diario Oficial de la Unión Europea L 314/39 DECISIÓN DE LA COMISIÓN de 14 de noviembre de 2006 por la que se establecen requisitos mínimos para la recogida de información durante la inspección
15.11.2006 Diario Oficial de la Unión Europea L 314/39 DECISIÓN DE LA COMISIÓN de 14 de noviembre de 2006 por la que se establecen requisitos mínimos para la recogida de información durante la inspección
(Texto pertinente a efectos del EEE)
 21.3.2017 L 75/27 DECISIÓN DE EJECUCIÓN (UE) 2017/486 DE LA COMISIÓN de 17 de marzo de 2017 por la que se modifican los anexos I y II de la Decisión 2004/558/CE en lo que respecta al reconocimiento como
21.3.2017 L 75/27 DECISIÓN DE EJECUCIÓN (UE) 2017/486 DE LA COMISIÓN de 17 de marzo de 2017 por la que se modifican los anexos I y II de la Decisión 2004/558/CE en lo que respecta al reconocimiento como
COMISIÓN DE LAS COMUNIDADES EUROPEAS INFORME DE LA COMISIÓN AVANCE HACIA LOS OBJETIVOS DE LA COMUNIDAD CON ARREGLO AL PROTOCOLO DE KIOTO
 COMISIÓN DE LAS COMUNIDADES EUROPEAS Bruselas, 20.12.2004 COM(2004) 818 final INFORME DE LA COMISIÓN AVANCE HACIA LOS OBJETIVOS DE LA COMUNIDAD CON ARREGLO AL PROTOCOLO DE KIOTO (de conformidad con la
COMISIÓN DE LAS COMUNIDADES EUROPEAS Bruselas, 20.12.2004 COM(2004) 818 final INFORME DE LA COMISIÓN AVANCE HACIA LOS OBJETIVOS DE LA COMUNIDAD CON ARREGLO AL PROTOCOLO DE KIOTO (de conformidad con la
Capítulo 6 Mercado europeo de tomate
 Capítulo 6 Mercado europeo de tomate El mayor porcentaje de comercio mundial de tomate fresco se produce en Europa con aproximadamente el 48% del tonelaje intercambiado. En el año 21, España fue el primer
Capítulo 6 Mercado europeo de tomate El mayor porcentaje de comercio mundial de tomate fresco se produce en Europa con aproximadamente el 48% del tonelaje intercambiado. En el año 21, España fue el primer
MANEJO DE LA ENFERMEDAD MENINGOCÓCICA INVASIVA (EMI) PARA FARMACÉUTICOS COMUNITARIOS
 MANEJO DE LA ENFERMEDAD MENINGOCÓCICA INVASIVA (EMI) PARA FARMACÉUTICOS COMUNITARIOS COORDINADOR DEL CURSO Dr. Juan Ruiz-Canela. Médico especialista en Pediatría. Centro de Salud Virgen de África. Sevilla.
MANEJO DE LA ENFERMEDAD MENINGOCÓCICA INVASIVA (EMI) PARA FARMACÉUTICOS COMUNITARIOS COORDINADOR DEL CURSO Dr. Juan Ruiz-Canela. Médico especialista en Pediatría. Centro de Salud Virgen de África. Sevilla.
RECOMENDACIÓN DE LA COMISIÓN. de
 COMISIÓN EUROPEA Bruselas, 9.3.2016 C(2016) 5200 final RECOMENDACIÓN DE LA COMISIÓN de 9.3.2016 relativa a las medidas que debe adoptar España para garantizar una corrección oportuna de su déficit excesivo
COMISIÓN EUROPEA Bruselas, 9.3.2016 C(2016) 5200 final RECOMENDACIÓN DE LA COMISIÓN de 9.3.2016 relativa a las medidas que debe adoptar España para garantizar una corrección oportuna de su déficit excesivo
Anexo II. Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 12 Conclusiones científicas y motivos para la modificación de los términos de
Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 12 Conclusiones científicas y motivos para la modificación de los términos de
Propuesta de DECISIÓN DEL CONSEJO
 COMISIÓN EUROPEA Bruselas, 10.10.2016 COM(2016) 651 final 2016/0318 (NLE) Propuesta de DECISIÓN DEL CONSEJO relativa a las contribuciones financieras que deberán pagar los Estados miembros para financiar
COMISIÓN EUROPEA Bruselas, 10.10.2016 COM(2016) 651 final 2016/0318 (NLE) Propuesta de DECISIÓN DEL CONSEJO relativa a las contribuciones financieras que deberán pagar los Estados miembros para financiar
PONENCIAS INmuNIzACIóN ACtIvA. vacunas j.m. SáNChEz-vIzCAíNO
 PONENCIAS inmunización activa. vacunas j.m. sánchez-vizcaíno 2 3 4 enfermedad de Glässer, La una amenaza creciente. NUEVA Ahora, protección estratégica 2 en 1. > > > > > Primera vacuna combinada frente
PONENCIAS inmunización activa. vacunas j.m. sánchez-vizcaíno 2 3 4 enfermedad de Glässer, La una amenaza creciente. NUEVA Ahora, protección estratégica 2 en 1. > > > > > Primera vacuna combinada frente
Evolución de los indicadores del estado de salud en España y su magnitud en el contexto de la Unión Europea
 Indicadores de Salud 2013 Evolución de los indicadores del estado de salud en España y su magnitud en el contexto de la Unión Europea -Documento Resumen- INFORMACIÓN Y ESTADÍSTICAS SANITARIAS 2013 MINISTERIO
Indicadores de Salud 2013 Evolución de los indicadores del estado de salud en España y su magnitud en el contexto de la Unión Europea -Documento Resumen- INFORMACIÓN Y ESTADÍSTICAS SANITARIAS 2013 MINISTERIO
DIRECTIVA 2012/2/UE DE LA COMISIÓN
 ES L 37/60 Diario Oficial de la Unión Europea 10.2.2012 DIRECTIVAS DIRECTIVA 2012/2/UE DE LA COMISIÓN de 9 de febrero de 2012 por la que se modifica la Directiva 98/8/CE del Parlamento Europeo y del Consejo
ES L 37/60 Diario Oficial de la Unión Europea 10.2.2012 DIRECTIVAS DIRECTIVA 2012/2/UE DE LA COMISIÓN de 9 de febrero de 2012 por la que se modifica la Directiva 98/8/CE del Parlamento Europeo y del Consejo
Tablas de mortalidad La esperanza de vida al nacimiento aumenta en más de dos años desde 1995 y se sitúa en 80,23 años
 29 de octubre de 2007 actualizada 30 de octubre de 2007 Tablas de mortalidad 1992-2005 La esperanza de vida al nacimiento aumenta en más de dos años desde 1995 y se sitúa en 80,23 años Navarra, Madrid,
29 de octubre de 2007 actualizada 30 de octubre de 2007 Tablas de mortalidad 1992-2005 La esperanza de vida al nacimiento aumenta en más de dos años desde 1995 y se sitúa en 80,23 años Navarra, Madrid,
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS. Esther Salgueiro 10, 17 de Marzo de 2015
 FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
DECLARACIONES CONJUNTAS DE LAS PRESENTES PARTES CONTRATANTES Y DE LAS NUEVAS PARTES CONTRATANTES EN EL ACUERDO
 DECLARACIONES CONJUNTAS DE LAS PRESENTES PARTES CONTRATANTES Y DE LAS NUEVAS PARTES CONTRATANTES EN EL ACUERDO AF/EEE/BG/RO/DC/es 1 SOBRE LA PRONTA RATIFICACIÓN DEL ACUERDO SOBRE LA PARTICIPACIÓN DE LA
DECLARACIONES CONJUNTAS DE LAS PRESENTES PARTES CONTRATANTES Y DE LAS NUEVAS PARTES CONTRATANTES EN EL ACUERDO AF/EEE/BG/RO/DC/es 1 SOBRE LA PRONTA RATIFICACIÓN DEL ACUERDO SOBRE LA PARTICIPACIÓN DE LA
PARLAMENTO EUROPEO. Comisión de Transportes y Turismo * PROYECTO DE INFORME
 PARLAMENTO EUROPEO 2004 2009 Comisión de Transportes y Turismo 2008/0068(CNS) 19.1.2009 * PROYECTO DE INFORME sobre la propuesta de Decisión del Consejo relativa a la celebración del Acuerdo entre la Comunidad
PARLAMENTO EUROPEO 2004 2009 Comisión de Transportes y Turismo 2008/0068(CNS) 19.1.2009 * PROYECTO DE INFORME sobre la propuesta de Decisión del Consejo relativa a la celebración del Acuerdo entre la Comunidad
PROSPECTO. Metrobactin 250 mg comprimidos para perros y gatos Metronidazol
 PROSPECTO Metrobactin 250 mg comprimidos para perros y gatos Metronidazol 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y DEL FABRICANTE RESPONSABLE
PROSPECTO Metrobactin 250 mg comprimidos para perros y gatos Metronidazol 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y DEL FABRICANTE RESPONSABLE
Diario Oficial de la Unión Europea L 8/29
 13.1.2007 Diario Oficial de la Unión Europea L 8/29 DECISIÓN DE LA COMISIÓN de 22 de diciembre de 2006 relativa a determinadas medidas de protección frente a la gripe aviar altamente patógena y a los desplazamientos
13.1.2007 Diario Oficial de la Unión Europea L 8/29 DECISIÓN DE LA COMISIÓN de 22 de diciembre de 2006 relativa a determinadas medidas de protección frente a la gripe aviar altamente patógena y a los desplazamientos
(Texto pertinente a efectos del EEE) (2011/874/UE)
 23.12.2011 Diario Oficial de la Unión Europea L 343/65 DECISIÓN DE EJECUCIÓN DE LA COMISIÓN de 15 de diciembre de 2011 por la que se establece la lista de terceros países y territorios de terceros países
23.12.2011 Diario Oficial de la Unión Europea L 343/65 DECISIÓN DE EJECUCIÓN DE LA COMISIÓN de 15 de diciembre de 2011 por la que se establece la lista de terceros países y territorios de terceros países
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Diario Oficial de la Unión Europea L 310/19
 9.11.2012 Diario Oficial de la Unión Europea L 310/19 REGLAMENTO (UE) N o 1042/2012 DE LA COMISIÓN de 7 de noviembre de 2012 por el que se modifica el Reglamento (UE) n o 1031/2010 para registrar una plataforma
9.11.2012 Diario Oficial de la Unión Europea L 310/19 REGLAMENTO (UE) N o 1042/2012 DE LA COMISIÓN de 7 de noviembre de 2012 por el que se modifica el Reglamento (UE) n o 1031/2010 para registrar una plataforma
INFORME DE LA COMISIÓN
 COMISIÓN EUROPEA Bruselas, 23.9.2016 COM(2016) 618 final INFORME DE LA COMISIÓN Informe para facilitar el cálculo de la cantidad atribuida a la Unión Europea e informe para facilitar el cálculo de la cantidad
COMISIÓN EUROPEA Bruselas, 23.9.2016 COM(2016) 618 final INFORME DE LA COMISIÓN Informe para facilitar el cálculo de la cantidad atribuida a la Unión Europea e informe para facilitar el cálculo de la cantidad
ESTADO T1 DATOS SOCIETARIOS Y PERSONAS DE CONTACTO
 ESTADO T1 DATOS SOCIETARIOS Y PERSONAS DE CONTACTO Dato Contacto 1 Contacto 2 Contacto 3 - Domicilio Social 01001 - - - - Domicilio Social del agente 01002 - Nº total empleados adscritos a la Función de
ESTADO T1 DATOS SOCIETARIOS Y PERSONAS DE CONTACTO Dato Contacto 1 Contacto 2 Contacto 3 - Domicilio Social 01001 - - - - Domicilio Social del agente 01002 - Nº total empleados adscritos a la Función de
Adjunto se remite a las Delegaciones el documento de la Comisión D013132/03.
 CONSEJO DE LA UNIÓN EUROPEA Bruselas, 11 de agosto de 2011 (OR. en) 13422/11 DENLEG 114 AGRI 558 NOTA DE TRANSMISIÓN Emisor: la Comisión Europea Fecha de recepción: 28 de julio de 2011 Destinatario: Secretaría
CONSEJO DE LA UNIÓN EUROPEA Bruselas, 11 de agosto de 2011 (OR. en) 13422/11 DENLEG 114 AGRI 558 NOTA DE TRANSMISIÓN Emisor: la Comisión Europea Fecha de recepción: 28 de julio de 2011 Destinatario: Secretaría
DIMENSIÓN LEGAL DEL PERMISO POR PUNTOS
 DIMENSIÓN LEGAL DEL PERMISO POR PUNTOS Madrid, 30 de Mayo de 2006 Ramón Ledesma Muñiz Subdirector General de Normativa y Recursos 1 LA REALIDAD ACTUAL La intervención de la Administración en la actividad
DIMENSIÓN LEGAL DEL PERMISO POR PUNTOS Madrid, 30 de Mayo de 2006 Ramón Ledesma Muñiz Subdirector General de Normativa y Recursos 1 LA REALIDAD ACTUAL La intervención de la Administración en la actividad
TRATADO DE ADHESION DE ESPAÑA Y PORTUGAL A LAS COMUNIDADES EUROPEAS ( )
 TRATADO DE ADHESION DE ESPAÑA Y PORTUGAL A LAS COMUNIDADES EUROPEAS (12-06-1085) Artículo 14. - El apartado 2 del artículo 148 del Tratado CEE y el apartado 2 del artículo 118 del Tratado CEEA serán sustituidos
TRATADO DE ADHESION DE ESPAÑA Y PORTUGAL A LAS COMUNIDADES EUROPEAS (12-06-1085) Artículo 14. - El apartado 2 del artículo 148 del Tratado CEE y el apartado 2 del artículo 118 del Tratado CEEA serán sustituidos
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
DECISIÓN DE EJECUCIÓN DE LA COMISIÓN
 20.12.2013 Diario Oficial de la Unión Europea L 346/75 DECISIÓN DE EJECUCIÓN DE LA COMISIÓN de 18 de diciembre de 2013 por la que se modifican los modelos de certificados sanitarios I, II y III para el
20.12.2013 Diario Oficial de la Unión Europea L 346/75 DECISIÓN DE EJECUCIÓN DE LA COMISIÓN de 18 de diciembre de 2013 por la que se modifican los modelos de certificados sanitarios I, II y III para el
Forma farmacéutica. Solución inyectable. Solución inyectable. Solución inyectable. Solución inyectable. Solución inyectable. Solución inyectable
 ANEXO I RELACIÓN DE LOS NOMBRES, FORMAS FARMACÉUTICAS Y DOSIS DE LOS MEDICAMENTOS VETERINARIOS, Y DE LAS ESPECIES ANIMALES, VÍAS DE ADMINISTRACIÓN Y SOLICITANTES O TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
ANEXO I RELACIÓN DE LOS NOMBRES, FORMAS FARMACÉUTICAS Y DOSIS DE LOS MEDICAMENTOS VETERINARIOS, Y DE LAS ESPECIES ANIMALES, VÍAS DE ADMINISTRACIÓN Y SOLICITANTES O TITULARES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
(Texto pertinente a efectos del EEE)
 11.12.2015 ES L 326/49 REGLAMENTO DE EJECUCIÓN (UE) 2015/2307 DE LA COMISIÓN de 10 de diciembre de 2015 relativo a la autorización bisulfito sódico de menadiona y bisulfito de menadiona nicotinamida como
11.12.2015 ES L 326/49 REGLAMENTO DE EJECUCIÓN (UE) 2015/2307 DE LA COMISIÓN de 10 de diciembre de 2015 relativo a la autorización bisulfito sódico de menadiona y bisulfito de menadiona nicotinamida como
REGLAMENTOS. (Texto pertinente a efectos del EEE)
 L 69/18 REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) 2017/447 DE LA COMISIÓN de 14 de marzo de 2017 relativo a la del preparado de Bacillus subtilis (DSM 5750) y Bacillus licheniformis (DSM 5749) como aditivo
L 69/18 REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) 2017/447 DE LA COMISIÓN de 14 de marzo de 2017 relativo a la del preparado de Bacillus subtilis (DSM 5750) y Bacillus licheniformis (DSM 5749) como aditivo
Diario Oficial de la Unión Europea. (Actos no legislativos) REGLAMENTOS
 L 146/1 II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) 2016/879 DE LA COMISIÓN de 2 de junio de 2016 por el que se establecen, de conformidad con el Reglamento (UE) n. o 517/2014 del
L 146/1 II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) 2016/879 DE LA COMISIÓN de 2 de junio de 2016 por el que se establecen, de conformidad con el Reglamento (UE) n. o 517/2014 del
(Texto pertinente a efectos del EEE)
 2.10.2015 ES L 257/19 REGLAMENTO DE EJECUCIÓN (UE) 2015/1759 DE LA COMISIÓN de 28 de septiembre de 2015 por el que se aprueba el uso del glutaraldehído como sustancia activa en biocidas de los tipos de
2.10.2015 ES L 257/19 REGLAMENTO DE EJECUCIÓN (UE) 2015/1759 DE LA COMISIÓN de 28 de septiembre de 2015 por el que se aprueba el uso del glutaraldehído como sustancia activa en biocidas de los tipos de
Diario Oficial de las Comunidades Europeas
 L 210/37 DECISIÓN DE LA COMISIÓN de 11 de julio de 2001 que modifica la Decisión 94/984/CE por la que se establecen las condiciones zoosanitarias y la certificación veterinaria para la importación de carne
L 210/37 DECISIÓN DE LA COMISIÓN de 11 de julio de 2001 que modifica la Decisión 94/984/CE por la que se establecen las condiciones zoosanitarias y la certificación veterinaria para la importación de carne
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Equilis West Nile suspensión inyectable para caballos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Equilis West Nile suspensión inyectable para caballos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Procedimiento Normalizado de Trabajo para la ejecución del Programa de Vacunación Lengua Azul
 Página 1 de 9 Procedimiento Normalizado de Trabajo para la ejecución del Programa de Vacunación Lengua Azul Realizado por: Revisado por: Aprobado por: SECCIÓN DE EPIDEMIOVIGILANCIA LA JEFA DE SERVICIO
Página 1 de 9 Procedimiento Normalizado de Trabajo para la ejecución del Programa de Vacunación Lengua Azul Realizado por: Revisado por: Aprobado por: SECCIÓN DE EPIDEMIOVIGILANCIA LA JEFA DE SERVICIO
Ante la entrada en vigor del nuevo Código de Buenas Prácticas de la Industria Farmacéutica (versión 2014)
 Ante la entrada en vigor del nuevo Código de Buenas Prácticas de la Industria Farmacéutica (versión 2014) La SEC informa a sus socios La Sociedad Española de Cardiología considera importante informar a
Ante la entrada en vigor del nuevo Código de Buenas Prácticas de la Industria Farmacéutica (versión 2014) La SEC informa a sus socios La Sociedad Española de Cardiología considera importante informar a
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
España, a la cola de Europa en número de sanciones y controles de tráfico
 España, a la cola de Europa en número de sanciones y controles de tráfico Según diversos estudios realizados en el ámbito europeo, nuestro país es el segundo con menos radares en relación a la población
España, a la cola de Europa en número de sanciones y controles de tráfico Según diversos estudios realizados en el ámbito europeo, nuestro país es el segundo con menos radares en relación a la población
Diario Oficial de las Comunidades Europeas COMISIÓN
 L 77/13 COMISIÓN DECISIÓN DE LA COMISIÓN de 2 de febrero de 2000 relativa al procedimiento de certificación de productos de construcción con arreglo al apartado 4 del artículo 20 de la Directiva 89/106/CEE
L 77/13 COMISIÓN DECISIÓN DE LA COMISIÓN de 2 de febrero de 2000 relativa al procedimiento de certificación de productos de construcción con arreglo al apartado 4 del artículo 20 de la Directiva 89/106/CEE
Anexo II. Conclusiones científicas y motivos de la suspensión de la comercialización y el uso de los medicamentos presentados por la EMA
 Anexo II Conclusiones científicas y motivos de la suspensión de la comercialización y el uso de los medicamentos presentados por la EMA 14 Conclusiones científicas Resumen general de la evaluación científica
Anexo II Conclusiones científicas y motivos de la suspensión de la comercialización y el uso de los medicamentos presentados por la EMA 14 Conclusiones científicas Resumen general de la evaluación científica
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO COVEXIN 10 SUSPENSIÓN INYECTABLE PARA OVINO Y BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principios
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO COVEXIN 10 SUSPENSIÓN INYECTABLE PARA OVINO Y BOVINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principios
Visto el Tratado de Funcionamiento de la Unión Europea y, en particular, su artículo 91,
 29.4.2014 Diario Oficial de la Unión Europea L 127/129 DIRECTIVA 2014/46/UE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 3 de abril de 2014 por la que se modifica la Directiva 1999/37/CE del Consejo, relativa
29.4.2014 Diario Oficial de la Unión Europea L 127/129 DIRECTIVA 2014/46/UE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 3 de abril de 2014 por la que se modifica la Directiva 1999/37/CE del Consejo, relativa
DECISIÓN DE LA COMISIÓN
 L 328/26 17.12.2003 II (Actos cuya publicación no es una condición para su aplicabilidad) COMISIÓN DECISIÓN DE LA COMISIÓN de 11 de diciembre de 2003 relativa a las condiciones de policía sanitaria y de
L 328/26 17.12.2003 II (Actos cuya publicación no es una condición para su aplicabilidad) COMISIÓN DECISIÓN DE LA COMISIÓN de 11 de diciembre de 2003 relativa a las condiciones de policía sanitaria y de
-2- Avda. Marcelo Celayeta, 75, NA3, 2º, Pamplona (Navarra) Tel.: , Fax:
 (Actos cuya publicación no es una condición para su aplicabilidad) CONSEJO DECISIÓN DEL CONSEJO de 1 de diciembre de 2000, relativa a la puesta en aplicación del acervo de Schengen en Dinamarca, Finlandia
(Actos cuya publicación no es una condición para su aplicabilidad) CONSEJO DECISIÓN DEL CONSEJO de 1 de diciembre de 2000, relativa a la puesta en aplicación del acervo de Schengen en Dinamarca, Finlandia
Sesión 13: Precalificación en el Contexto de las Adquisiciones del Fondo Mundial
 Sesión 13: Precalificación en el Contexto de las Adquisiciones del Fondo Mundial Creado el año 2002 Fondo Mundial Atrae y desembolsa recursos adicionales para prevenir y tratar el SIDA, tuberculosis (TB)
Sesión 13: Precalificación en el Contexto de las Adquisiciones del Fondo Mundial Creado el año 2002 Fondo Mundial Atrae y desembolsa recursos adicionales para prevenir y tratar el SIDA, tuberculosis (TB)
2.I. EL SECTOR PÚBLICO EN LOS PAISES DE LA UNIÓN EUROPEA.
 2.I. EL SECTOR PÚBLICO EN LOS PAISES DE LA UNIÓN EUROPEA. La situación presupuestaria en 2003 volvió a empeorar en la mayoría de los países de la zona euro debido, al igual que en los dos años anteriores,
2.I. EL SECTOR PÚBLICO EN LOS PAISES DE LA UNIÓN EUROPEA. La situación presupuestaria en 2003 volvió a empeorar en la mayoría de los países de la zona euro debido, al igual que en los dos años anteriores,
REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD. DECRETO EJECUTIVO No (De 27 de agosto de 2007 ) EL PRESIDENTE DE LA REPÚBLICA,
 1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
Nombre. Vertimen 8 mg Tabletten. Vertimen 16 mg Tabletten. Vertisan 16 mg Таблетка. Vertisan 8 mg Tableta 8 mg Comprimido Vía oral
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA(S) FARMACÉUTICA(S), DOSIS, VÍA(S) DE ADMINISTRACIÓN, SOLICITANTE(S), TITULAR(ES) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1
Dra. Nayrin A. Súnico B.
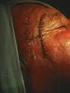 Dra. Nayrin A. Súnico B. Caracas, 14 de marzo de 2012 Introducción Cáncer de cuello uterino: 2da causa de cáncer en la mujer 2da causa de muerte en mujeres entre 14-44 años VPH con carcinoma de cuello
Dra. Nayrin A. Súnico B. Caracas, 14 de marzo de 2012 Introducción Cáncer de cuello uterino: 2da causa de cáncer en la mujer 2da causa de muerte en mujeres entre 14-44 años VPH con carcinoma de cuello
VALOR UMBRAL Y VALORES OBJETIVOS DINÁMICOS DE UN INDICADOR. APLICACIÓN AL INDICADOR DE SINIESTRALIDAD EN CARRETERAS
 VALOR UMBRAL Y VALORES OBJETIVOS DINÁMICOS DE UN INDICADOR. APLICACIÓN AL INDICADOR DE SINIESTRALIDAD EN CARRETERAS X. Lastra-Bravo, A. Tolón-Becerra, F. Bienvenido-Bárcena, M. Ramírez-Román Valores umbrales
VALOR UMBRAL Y VALORES OBJETIVOS DINÁMICOS DE UN INDICADOR. APLICACIÓN AL INDICADOR DE SINIESTRALIDAD EN CARRETERAS X. Lastra-Bravo, A. Tolón-Becerra, F. Bienvenido-Bárcena, M. Ramírez-Román Valores umbrales
Farmacovigilancia. César Alik Pedrajo Zenteno. Dictaminador Especializado COMISION DE EVIDENCIA Y MANEJO DE RIESGOS.
 Farmacovigilancia. César Alik Pedrajo Zenteno. Dictaminador Especializado COMISION DE EVIDENCIA Y MANEJO DE RIESGOS. DIRECCIÓN EJECUTIVA DE FARMACOPEA Y FARMACOVIGILANCIA. 14 Septiembre de 2012. FARMACOVIGILANCIA
Farmacovigilancia. César Alik Pedrajo Zenteno. Dictaminador Especializado COMISION DE EVIDENCIA Y MANEJO DE RIESGOS. DIRECCIÓN EJECUTIVA DE FARMACOPEA Y FARMACOVIGILANCIA. 14 Septiembre de 2012. FARMACOVIGILANCIA
Nota de prensa. El año pasado fallecieron personas en accidente de tráfico. Datos consolidados a 30 días
 Nota de prensa MINISTERIO Datos consolidados a 30 días El año pasado fallecieron 2.060 personas en accidente de tráfico Respecto de 2010 el número de víctimas mortales ha descendido un 13% Para la contabilización
Nota de prensa MINISTERIO Datos consolidados a 30 días El año pasado fallecieron 2.060 personas en accidente de tráfico Respecto de 2010 el número de víctimas mortales ha descendido un 13% Para la contabilización
Vacunas hexavalentes y muerte súbita
 Vacunas hexavalentes y muerte súbita Respuesta del Experto a Vacunas hexavalentes y muerte súbita Pregunta Quisiera saber qué hay de cierto sobre la vacuna hexavalente (DTPa+Hib+Hp B+VPI), si es segura
Vacunas hexavalentes y muerte súbita Respuesta del Experto a Vacunas hexavalentes y muerte súbita Pregunta Quisiera saber qué hay de cierto sobre la vacuna hexavalente (DTPa+Hib+Hp B+VPI), si es segura
L 172/14 Diario Oficial de la Unión Europea
 ES L 172/14 Diario Oficial de la Unión Europea 25.6.2013 REGLAMENTO DE EJECUCIÓN (UE) N o 601/2013 DE LA COMISIÓN de 24 de junio de 2013 relativo a la de acetato de cobalto(ii) tetrahidratado, carbonato
ES L 172/14 Diario Oficial de la Unión Europea 25.6.2013 REGLAMENTO DE EJECUCIÓN (UE) N o 601/2013 DE LA COMISIÓN de 24 de junio de 2013 relativo a la de acetato de cobalto(ii) tetrahidratado, carbonato
CORRECCIÓN DE ERRORES
 17.11.2015 L 300/49 CORRECCIÓN DE ERROR Corrección de errores del Reglamento (UE) n o 361/2014 de la Comisión, de 9 de abril de 2014, por el que se establecen disposiciones de aplicación del Reglamento
17.11.2015 L 300/49 CORRECCIÓN DE ERROR Corrección de errores del Reglamento (UE) n o 361/2014 de la Comisión, de 9 de abril de 2014, por el que se establecen disposiciones de aplicación del Reglamento
Servei de Control de Medicaments i Productes Sanitaris
 Assumpte/Asunto: JEXT 300 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,3 ml y JEXT 150 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,15 m
Assumpte/Asunto: JEXT 300 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,3 ml y JEXT 150 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,15 m
DIRECTIVA 92/27/CEE DEL CONSEJO, DE 31 DE MARZO DE 1992, RELATIVA AL ETIQUETADO Y AL PROSPECTO DE LOS MEDICAMENTOS DE USO HUMANO
 DIRECTIVA 92/27/CEE DEL CONSEJO, DE 31 DE MARZO DE 1992, RELATIVA AL ETIQUETADO Y AL PROSPECTO DE LOS MEDICAMENTOS DE USO HUMANO Artículo 1. Capítulo primero Definiciones y ámbito de aplicación 1. La presente
DIRECTIVA 92/27/CEE DEL CONSEJO, DE 31 DE MARZO DE 1992, RELATIVA AL ETIQUETADO Y AL PROSPECTO DE LOS MEDICAMENTOS DE USO HUMANO Artículo 1. Capítulo primero Definiciones y ámbito de aplicación 1. La presente
Manual de uso óptimo de la sangre: análisis del contenido
 Manual de uso óptimo de la sangre: análisis del contenido Dr. Miguel Lozano Molero Servicio de Hemoterapia y Hemostasia Hospital Clínico Universitario Barcelona Organizaciones Europeas Consejo de Europa
Manual de uso óptimo de la sangre: análisis del contenido Dr. Miguel Lozano Molero Servicio de Hemoterapia y Hemostasia Hospital Clínico Universitario Barcelona Organizaciones Europeas Consejo de Europa
(Texto pertinente a efectos del EEE)
 30.10.2014 L 309/23 REGLAMENTO (UE) N o 1154/2014 DE LA COMISIÓN de 29 de octubre de 2014 por el que se deniega la autorización de determinadas declaraciones de propiedades saludables en los alimentos
30.10.2014 L 309/23 REGLAMENTO (UE) N o 1154/2014 DE LA COMISIÓN de 29 de octubre de 2014 por el que se deniega la autorización de determinadas declaraciones de propiedades saludables en los alimentos
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO. Equilis Prequenza Te, suspensión inyectable, para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Equilis Prequenza Te, suspensión inyectable, para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias activas: Virus de la influenza
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Equilis Prequenza Te, suspensión inyectable, para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias activas: Virus de la influenza
Diario Oficial de la Unión Europea L 291/5
 5.11.2005 Diario Oficial de la Unión Europea L 291/5 REGLAMENTO (CE) N o 1810/2005 DE LA COMISIÓN de 4 de noviembre de 2005 relativo a una nueva autorización durante diez años de un aditivo en los piensos,
5.11.2005 Diario Oficial de la Unión Europea L 291/5 REGLAMENTO (CE) N o 1810/2005 DE LA COMISIÓN de 4 de noviembre de 2005 relativo a una nueva autorización durante diez años de un aditivo en los piensos,
(Texto pertinente a efectos del EEE)
 6.5.2015 ES L 115/25 REGLAMENTO DE EJECUCIÓN (UE) 2015/724 DE LA COMISIÓN de 5 de mayo de 2015 relativo a la del acetato de retinilo, del palmitato de retinilo y del propionato de retinilo como aditivos
6.5.2015 ES L 115/25 REGLAMENTO DE EJECUCIÓN (UE) 2015/724 DE LA COMISIÓN de 5 de mayo de 2015 relativo a la del acetato de retinilo, del palmitato de retinilo y del propionato de retinilo como aditivos
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB+ND+EDS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS IB+ND+EDS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias A.N.M.A.T.
 BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
Diario Oficial de la Unión Europea
 9.. L / REGLAMENTO DE EJECUCIÓN (UE) / DE LA COMISIÓN de de febrero de por el que se establece información técnica para el cálculo de las provisiones técnicas y los fondos propios básicos a efectos de
9.. L / REGLAMENTO DE EJECUCIÓN (UE) / DE LA COMISIÓN de de febrero de por el que se establece información técnica para el cálculo de las provisiones técnicas y los fondos propios básicos a efectos de
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
Programa Subregional de Farmacovigilancia de Centroamérica y República Dominicana
 Programa Subregional de Farmacovigilancia de Centroamérica y Alerta Informativa No. 05/2016 RIESGO DE CONTAMINACIÓN CRUZADA CON CEFALOSPORINAS DE VARIOS MEDICAMENTOS FABRICADOS POR LABORATORIOS NORMON,
Programa Subregional de Farmacovigilancia de Centroamérica y Alerta Informativa No. 05/2016 RIESGO DE CONTAMINACIÓN CRUZADA CON CEFALOSPORINAS DE VARIOS MEDICAMENTOS FABRICADOS POR LABORATORIOS NORMON,
(Actos no legislativos) REGLAMENTOS
 .. L 9/ II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) /97 DE LA COMISIÓN de de noviembre de por el que se establece información técnica para el cálculo de las provisiones técnicas
.. L 9/ II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) /97 DE LA COMISIÓN de de noviembre de por el que se establece información técnica para el cálculo de las provisiones técnicas
ANEXO. de la. Propuesta de DECISIÓN DEL CONSEJO
 COMISIÓN EUROPEA Bruselas, 23.5.2014 COM(2014) 291 final ANNEX 1 ANEXO Acuerdo sobre la participación de Islandia en el cumplimiento conjunto de los compromisos de la Unión Europea, sus Estados miembros
COMISIÓN EUROPEA Bruselas, 23.5.2014 COM(2014) 291 final ANNEX 1 ANEXO Acuerdo sobre la participación de Islandia en el cumplimiento conjunto de los compromisos de la Unión Europea, sus Estados miembros
(Texto pertinente a efectos del EEE)
 L 147/8 ES 12.6.2015 REGLAMENTO DE EJECUCIÓN (UE) 2015/897 DE LA COMISIÓN de 11 de junio de 2015 relativo a la clorhidrato de tiamina y el mononitrato de tiamina como s en piensos para todas las especies
L 147/8 ES 12.6.2015 REGLAMENTO DE EJECUCIÓN (UE) 2015/897 DE LA COMISIÓN de 11 de junio de 2015 relativo a la clorhidrato de tiamina y el mononitrato de tiamina como s en piensos para todas las especies
(Actos no legislativos) REGLAMENTOS
 8.8. L / II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) /7 DE LA COMISIÓN de 8 de agosto de por el que se establece información técnica para el cálculo de las provisiones técnicas
8.8. L / II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) /7 DE LA COMISIÓN de 8 de agosto de por el que se establece información técnica para el cálculo de las provisiones técnicas
Este documento es un instrumento de documentación y no compromete la responsabilidad de las instituciones
 1997R0258 ES 20.01.2009 003.001 1 Este documento es un instrumento de documentación y no compromete la responsabilidad de las instituciones B REGLAMENTO (CE) N o 258/97 DEL PARLAMENTO EUROPEO Y DEL CONSEJO
1997R0258 ES 20.01.2009 003.001 1 Este documento es un instrumento de documentación y no compromete la responsabilidad de las instituciones B REGLAMENTO (CE) N o 258/97 DEL PARLAMENTO EUROPEO Y DEL CONSEJO
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
La esperanza de vida al nacimiento roza los 81 años en 2007, con un incremento de casi cuatro años desde el año 1991
 22 de diciembre de 2009 Tablas de mortalidad de España. Año 2007 La esperanza de vida al nacimiento roza los 81 años en 2007, con un incremento de casi cuatro años desde el año 1991 Comunidad Foral de
22 de diciembre de 2009 Tablas de mortalidad de España. Año 2007 La esperanza de vida al nacimiento roza los 81 años en 2007, con un incremento de casi cuatro años desde el año 1991 Comunidad Foral de
(Texto pertinente a efectos del EEE) (2011/394/UE) (4) A raíz de una comunicación de Francia, deben añadirse,
 5.7.2011 Diario Oficial de la Unión Europea L 176/45 DECISIÓN DE EJECUCIÓN DE LA COMISIÓN de 1 de julio de 2011 por la que se modifica la Decisión 2009/821/CE en lo relativo a la lista de puestos de inspección
5.7.2011 Diario Oficial de la Unión Europea L 176/45 DECISIÓN DE EJECUCIÓN DE LA COMISIÓN de 1 de julio de 2011 por la que se modifica la Decisión 2009/821/CE en lo relativo a la lista de puestos de inspección
Setiembre. Incidencia de los mercados de E.E.U.U. y Unión Europea en el comercio exterior de Uruguay
 Setiembre 2011 Incidencia de los mercados de E.E.U.U. y Unión Europea en el comercio exterior de Uruguay 1. Comercio exterior Uruguay-E.E.U.U. Estados Unidos es un país muy relevante para Uruguay como
Setiembre 2011 Incidencia de los mercados de E.E.U.U. y Unión Europea en el comercio exterior de Uruguay 1. Comercio exterior Uruguay-E.E.U.U. Estados Unidos es un país muy relevante para Uruguay como
Indicadores. Económicos. Intercambio comercial entre Perú y principales países y zonas con acuerdo comercial
 Indicadores Económicos Boletín Estadístico 04 Setiembre 2013 Intercambio comercial entre Perú y principales países y zonas con acuerdo comercial El Perú ha suscrito un conjunto de acuerdos comerciales
Indicadores Económicos Boletín Estadístico 04 Setiembre 2013 Intercambio comercial entre Perú y principales países y zonas con acuerdo comercial El Perú ha suscrito un conjunto de acuerdos comerciales
PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
INTRODUCCIÓN LEGISLACIÓN DE LA UE. incluida la política de información al consumidor.
 COMUNICACIÓN DE LA COMISIÓN AL PARLAMENTO EUROPEO Y AL CONSEJO SOBRE LAS NECESIDADES FUTURAS Y LA UTILIZACIÓN EN LA UNIÓN EUROPEA DE CARNE SEPARADA MECÁNICAMENTE, INCLUIDA LA POLÍTICA DE INFORMACIÓN AL
COMUNICACIÓN DE LA COMISIÓN AL PARLAMENTO EUROPEO Y AL CONSEJO SOBRE LAS NECESIDADES FUTURAS Y LA UTILIZACIÓN EN LA UNIÓN EUROPEA DE CARNE SEPARADA MECÁNICAMENTE, INCLUIDA LA POLÍTICA DE INFORMACIÓN AL
Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico.
 Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico. Dr. Eduardo Fernández Quintana Centro de Farmacovigilancia e Información Terapéutica de Canarias de Canarias.
Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico. Dr. Eduardo Fernández Quintana Centro de Farmacovigilancia e Información Terapéutica de Canarias de Canarias.
