PRÁCTICA 7 CALOR DE NEUTRALIZACIÓN
|
|
|
- Ángeles Valdéz Barbero
- hace 8 años
- Vistas:
Transcripción
1 PRÁCTICA 7 CALOR DE NEUTRALIZACIÓN 1.- FUNDAMENTO TEÓRICO Todos los procesos que tienen lugar en la naturaleza evolucionan hacia estados de equilibrio. Si arrojamos una pelota en el aire, caerá al suelo y después de unos botes permanecerá inmóvil en su estado final de equilibrio. Las pilas que suministran energía eléctrica lo hacen mientras se encuentran en desequilibrio termodinámico y cuando alcanzan el equilibrio, dejan de funcionar. El sol brillará mientras exista combustible nuclear en su interior. Cuando lo consuma, alcanzará el equilibrio, se apagará y dejará de proporcionarnos energía. Al igual que la pelota cae y encuentra su estado de equilibrio en la posición más baja del suelo, de la misma manera los sistemas evolucionan hacia estados de mínima energía. El primer principio de la termodinámica dice que la energía no se crea ni se destruye, simplemente se transforma. Pero si un sistema evoluciona hacia un estado de mínima energía, qué ocurre con la energía sobrante?, cómo se manifiesta?. En esta práctica analizaremos el comportamiento de distintos sistemas formados por un ácido fuerte y una base fuerte. Cuando hablamos de especies fuertes, nos referimos a aquellas que están completamente disociadas. El ácido clorhídrico (HCl) y el hidróxido sódico (NaOH) son ejemplos de un ácido y una base fuerte respectivamente. En una disolución, el primero se encuentra completamente disociado en las especies iónicas H + y Cl -, y podemos afirmar que no existe prácticamente nada de la especie sin disociar (HCl). De igual forma, el hidróxido sódico está totalmente disociado en las especies Na + y OH - y podemos aseverar que en la disolución no encontraremos la especie molecular NaOH. Cada disolución constituye un sistema y mientras se encuentre a una temperatura constante y no ocurran reacciones químicas en su seno, podemos considerarlas como sistemas en estado de equilibrio. Cuando se mezclan, las especies iónicas de ambas disoluciones abandonan el equilibrio y evolucionan hacia uno nuevo. A esta transición se la denomina proceso. En éste, los iones de una especie se rodean de los de la otra resultando una situación termodinámicamente más favorable. Energéticamente esto quiere decir que si se suman las energías de los dos sistemas iniciales, el resultado es un valor mayor que el que corresponde a la disolución final. 7-1
2 Si usted mezclara ambas disoluciones en un matraz, comprobaría rápidamente qué ocurre con la energía sobrante: se invierte en aumentar la energía cinética de las partículas, lo que queda evidenciado macroscópicamente por un aumento brusco de temperatura. El nuevo sistema se encuentra desplazado del equilibrio termodinámico y su temperatura es ahora diferente de la del medio que lo rodea. Como consecuencia de este desequilibrio termodinámico tiene lugar una transferencia de energía, entre el sistema y el medio, que denominanos calor. Calor es una palabra que se emplea coloquialmente en diferentes contextos, sin embargo cuando se utiliza no suele incorporar su acepción científica. El calor es una forma de transferencia de energía que tiene lugar entre sistemas que se encuentran a diferentes temperaturas y es una magnitud que se puede medir fácilmente. En términos generales el calor depende del proceso y no de los estados inicial y final. Por ello se dice que esta magnitud no es función de estado. Para entender esta afirmación, suponga que se encuentra en la planta baja de un edificio. Usted se encuentra a una altura nula respecto al suelo y este dato es independiente de cómo haya llegado a ese estado. Si sube usted a la quinta planta, se encuentra a una altura determinada respecto al suelo y evidentemente, este dato es independiente de si lo ha hecho subiendo por las escaleras o usando el ascensor. La altura es una función que depende solamente del estado en el que se encuentra y es independiente de cómo lo haya alcanzado, por ello se dice que es función de estado. Imagínese de nuevo en la planta baja. Ahora planteamos dos formas de subir hasta la quinta, por las escaleras y en ascensor. Cuál será el nivel de cansancio una vez arriba?. Depende del camino. Evidentemente estaremos más cansados si subimos por las escaleras que si lo hacemos por ascensor. Es decir, podemos vernos en la quinta planta con niveles de cansancio diferentes. Por lo tanto si la única información de que disponemos es que nos situamos en una planta u otra, es imposible que podamos asignar un nivel de cansancio u otro. Como el cansancio depende del camino, se dice que no es función de estado. El calor, al igual que el nivel de cansancio no es una función de estado, es decir, depende del camino recorrido. Sin embargo existen condiciones determinadas en las que esta magnitud coincide con la variación de una propiedad que sí es función de estado: la entalpía (H). En este sentido podemos afirmar que cuando un proceso tiene lugar en condiciones de presión constante, la energía transferida en forma de calor (Q) a lo largo del proceso coincide con la variación de entalpía, esto es 1 : Q = H = H Estado final H Estado Inicial ; Como la práctica que vamos a realizar tiene lugar en un sistema abierto a presión atmosférica (constante), podemos afirmar que el calor medido coincidirá con la variación de entalpía del 1 Obsérvese que como Q no es función de estado no existe la posibilidad de definir Q(Estado Inicial) ni Q(Estado Final), de la misma manera que no podemos definir un nivel objetivo de cansancio por el hecho de situarnos en la planta baja o en la quinta planta. Asimismo, la terminología Q constituye un error y no debe emplearse. 7-2
3 sistema. Bajo estas condiciones específicas, el calor sí constituye una magnitud que depende únicamente de los estados inicial y final, a través de una función de sus temperaturas, Q = f(t Estado Final T Estado Inicial ); Cuando mezclamos las disoluciones de HCl y NaOH, tiene lugar la siguiente reacción, H + + Cl - + Na + + OH - Cl - + Na + + H 2 O Eliminando términos semejantes queda la reacción global, H + + OH - H 2 O Que significa que las propiedades ácidas quedan neutralizadas por las de la base, generando un producto neutro que es el agua. A este tipo de reacciones se las denomina reacciones de neutralización, y al calor generado en ellas, calor o entalpía de neutralización. Esta afirmación se extiende a todas las reacciones en las que un ácido fuerte (da lo mismo cual), reaccione con una base fuerte (da lo mismo cual). En todas ellas, el producto de la reacción es el agua, por lo tanto, en todas estas reacciones el calor o entalpía de neutralización es el mismo, es decir, el que corresponde a la reacción de formación del agua a partir de sus iones, o sea, julios (13 35 calorías), por mol de agua formada. El fenómeno es totalmente diferente en el caso de ácido fuerte - base débil o base fuerte - ácido débil, ya que parte del calor de neutralización se emplea en disociar la base o el ácido débil. Por ejemplo en el caso de un ácido fuerte - base débil, conforme se van neutralizando los iones hidrógeno (H + ) del ácido fuerte con los iones hidroxilo ( - OH) de la base débil, se ioniza más base débil a expensas del calor de formación del agua a partir de sus iones. Este proceso continúa hasta completar la neutralización. Por ello, los valores del calor de neutralización de ácidos o bases débiles frente a bases o ácidos fuertes, dan valores inferiores al de formación del agua a partir de sus iones. El calorímetro El calorímetro (o vaso Dewar), consiste en un recipiente con doble pared de vidrio entre las que se ha practicado un cierto grado de vacío que disminuye la pérdida de calor por conducción y convección. La pared interna se encuentra recubierta de una superficie reflectante que evita en parte la pérdida de calor por radiación. Las reacciones de neutralización que vamos a llevar a cabo tendrán lugar en este dispositivo. El calor que se desprenda cuando ocurra la reacción partirá de la disolución y se cederá al interior del recinto sin pérdidas energéticas al exterior, por lo que podrá ser medido. El cálculo de la energía desprendida se realizará posteriormente a partir de la medida de la variación de la temperatura de la disolución. 7-3
4 Cálculo del equivalente en agua del sistema calorimétrico Se tiene entonces que el calorímetro constituye un dispositivo que evita fugas de energía en forma de calor entre su contenido y el exterior. Si esto es así, cabría pensar que la variación de temperatura medida en la disolución correspondería específicamente al calor generado en la reacción?. No, aún existe una porción de energía que no estamos cuantificando ya que, las mismas paredes del calorímetro, así como todos aquellos elementos que se encuentren en contacto con el ácido y la base, absorben una cierta cantidad de calor, que invierten en elevar su temperatura. Imagine que pide un café en un bar. Está muy caliente y para enfriarlo usted pide un vaso vacío. Al verter café en el nuevo vaso, está haciendo que parte de la energía térmica del café sea absorbida por las paredes, lo que ocasiona la disminución de su temperatura. Lo mismo ocurre en el calorímetro. En la neutralización se desprende energía. Parte se invierte en aumentar la temperatura de la disolución (que es lo que se mide en el experimento), sin embargo otra porción sirve para aumentar la de la pared interna del calorímetro y la de cualquier otro dispositivo que esté en su interior. Para conocer la porción de energía absorbida por el mismo sistema calorimétrico, se calcula el equivalente en agua K. Para ello se añade agua al calorímetro a una temperatura moderada alta y se mide su disminución. Evidentemente, al igual que ocurría con el café, el agua se enfría porque cede parte de su energía a la pared interna. Con la medida de la variación de temperatura del agua, podemos calcular el calor que ésta cede (Q 1 ). Como el sistema está cerrado, el calor cedido por el agua coincide con el tomado por el sistema (Q 2 ). donde, El calor cedido por el agua es -Q 1 (el signo indica pérdida de energía): - Q 1 = - m c (t f - t i ); m = Masa de agua introducida en el calorímetro. c = Calor específico del agua. t i = Temperatura inicial del agua (instantes antes de verterla en el calorímetro). t f = Temperatura final del agua = temperatura final del sistema. El calor absorbido por el sistema calorimétrico es +Q 2, (el signo indica ganancia de energía): donde + Q 2 = + K (t f - t 0 ); K = Equivalente en agua del calorímetro. t 0 = Temperatura inicial del calorímetro. t f = Temperatura final del sistema calorimétrico = temperatura final del agua. Ahora bien, como el calor perdido por el agua lo toma el sistema calorimétrico, tendremos: Q 1 = + Q 2 - m c (t f - t i ) = + K (t f - t 0 )
5 de donde, aproximando c = 1 caloría/g ºC: mc(t f - ti ) m(ti - t f ) K = = ; ( t f - t0 ) ( t f - t0 ) Cálculo del calor de neutralización Entonces, el calor producido en la reacción de neutralización se invierte en, (a) elevar la temperatura de la solución, y (b) elevar la temperatura del sistema calorimétrico. El calor necesario para elevar la temperatura inicial de la solución (ácido más base) hasta la temperatura final del proceso será: donde, a b (a) Q s= ms c s(t f - t +t 2 ); Q s = Calor tomado por la solución. m s = Masa de la solución (disolución de ácido + disolución de base). c s = Calor específico de la solución. t a = Temperatura inicial del ácido. t b = Temperatura inicial de la base. t f = Temperatura final del proceso. El calor tomado por el sistema viene expresado por la ecuación: (b) Q 2 = K (t f - t 0 ); La suma de esta ecuación y la anterior nos dará el valor del calor desprendido en la reacción de neutralización (Q): Q = m c ( t - t a +t s s f 2 b )+ K(t - t ) f 0 ; Recuérdese que el valor del calor de neutralización viene expresado en unidades de energía desprendida por mol neutralizado, por lo que para calcular el calor de neutralicación (Q n ), bastará sustituir los valores en la ecuación anterior y dividir por el número de moles neutralizados, esto es, Q n = Q Número de Moles Neutraliza dos Téngase presente que el producto m s c s se puede tomar como m s. El error cometido al hacer esta aproximación es menor al uno por ciento. 7-5
6 2.- OBJETIVO DE LA PRÁCTICA Se calculará mediante método calorimétrico el calor de neutralización de los sistemas constituidos por, ácido clorhídrico e hidróxido sódico ácido sulfúrico e hidróxido sódico 3.- MATERIAL Y REACTIVOS Material Reactivos 1 Matraz aforado de 500 ml. 2 Matraz aforado de 250 ml. 2 Probetas de 250 ml. 1 Vaso de precipitado de 100 ml. 1 Vaso de precipitado de 250 ml. 1 Erlenmeyer 100 ml. 1 Bureta 50 ml. 1 Embudo 1 Calorímetro. 1 Pipeta de 10 ml. 1 Termómetro Fenolftaleína. Azul de bromotimol. Ftalato ácido de potasio (biftalato potásico). Ácido clorhídrico (HCl). Ácido sulfúrico (H 2 SO 4 ). Hidróxido sódico (NaOH). Agua destilada. 4.- PROCEDIMIENTO EXPERIMENTAL Sistema HCl - NaOH Prepare una disolución de 250 ml uno molar (1 M) de ácido clorhídrico. Prepare una disolución de 500 ml uno molar (1 M) de hidróxido sódico. Determine la molaridad exacta del hidróxido sódico preparado aproximadamente 1M, operando del siguiente modo: 7-6
7 Pese exactamente 2 gramos de ftalato ácido de potasio y disuelva en aproximadamente 50 ml de agua destilada. Añada 2 gotas de fenolftaleína. Valore con la disolución de sosa preparada. Anote el volumen consumido, V NaOH, y calcule la molaridad exacta de la disolución. Anote la molaridad hallada, M NaOH, en la tabla 5.1. Determine la molaridad del ácido clorhídrico preparado, aproximadamente 1M. Para ello opere del siguiente modo: Tome con la pipeta diez ml de la disolución del ácido, pasándolos a un matraz erlenmeyer. Añada dos gotas de azul de bromotimol. Valore la solución, con el hidróxido sódico preparado, hasta viraje del indicador de amarillo a azul. Anote el volumen empleado, V NaOH (1), en la tabla 5.2. Repita el ensayo una vez más y anote el volumen gastado V NaOH (2), en la tabla 5.2. Halle el volumen medio V NaOH (medio) empleado. Determine y anote en la tabla 5.2. la molaridad real del ácido (M HCl ) a partir de la igualdad, donde V NaOH (medio) M NaOH = V HCl M HCl V NaOH (medio) = Volumen medio de NaOH empleado en la neutralización M NaOH = Molaridad de la solución de hidróxido sódico utilizada M HCl = Molaridad del ácido clorhídrico preparado V HCl = Volumen de ácido tomado Sistema H 2 SO 4 - NaOH Prepare una disolución de 250 ml 0.5 molar (0.5 M) de ácido sulfúrico. Determine la normalidad exacta del ácido sulfúrico preparado, aproximadamente 0.5M, utilizando el mismo sistema empleado en el sistema HCl - NaOH y anote los resultados en la tabla 5.4. Calor de neutralización del ácido frente al hidróxido sódico HCl NaOH Lávese el calorímetro y séquese con papel filtro, dejándolo destapado con objeto de que tome la temperatura ambiente. Lave y seque las probetas. 7-7
8 Mídase en la probeta correspondiente al ácido, 200 ó 204 ml de esta solución, según que su normalidad sea menor o mayor respectivamente que la del hidróxido sódico. El objetivo es el de emplear más volumen de la disolución que tenga mayor normalidad. Anote el volumen en la tabla 5.3. Mídase en la probeta correspondiente al hidróxido sódico, 200 ó 204 ml de esta solución, según que su normalidad sea menor o mayor respectivamente que la del ácido. El objetivo es emplear más volumen de la disolución que tenga mayor concentración real. Anote el volumen en la tabla 5.3. Tome la temperatura media de las paredes del vaso Dewar dejando reposar el termómetro en el vaso durante unos dos minutos. Anote esta temperatura (T 0 ) en la tabla 5.3. Tome las temperaturas de las disoluciones de ácido y sosa. Anote estas temperaturas en la tabla 5.3. Para simplificar los cálculos se procurará que la temperatura de ambas soluciones sea superior a la temperatura media del vaso Dewar. Coloque el termómetro en la tapa del calorímetro de forma que al tapar éste con las soluciones reaccionantes en su interior, el bulbo quede dentro de la solución. En esta operación se invertirá el menor tiempo posible: vierta en el calorímetro las soluciones contenidas en las probetas, tápelo y al finalizar ponga en marcha el cronómetro. Tome la temperatura del sistema cada quince segundos, durante un minuto, agitando la solución suavemente de vez en cuando. Anote las temperaturas en la tabla 5.3. Finalmente debe comprobar el carácter ácido o básico de la disolución resultante. Para ello añada una gota de azul de bromotimol sobre el contenido del calorímetro. El carácter debe coincidir con el de la solución añadida en exceso. Este dato es necesario para calcular el calor de neutralización. Anótelo en la tabla 5.3. Si la solución tiene carácter ácido, los moles neutralizados son los de base que intervinieron en la reacción. Si por el contrario la solución tiene carácter básico, los moles neutralizados serán los correspondientes a los de ácido empleado. H 2 SO 4 NaOH Repetir el proceso utilizando la disolución de ácido sulfúrico en vez de la de HCl y anote los resultados en la tabla 5.5. Tenga presente que a diferencia con el sistema anterior, cada mol de ácido sulfúrico consume dos de hidróxido sódico. Equivalente en agua del sistema calorimétrico Tómese la temperatura de las paredes perfectamente secas del calorímetro. Caliente en el microondas aproximadamente 500 ml de agua hasta unos 40ºC (consulte al profesor). Anote la temperatura inicial del agua (T agua ) en la tabla
9 Viértanse en el calorímetro, activando simultáneamente el cronómetro, 404 ml del agua calentada (200 ml ml), tapando el calorímetro lo más rápidamente posible. Tómense las temperaturas del sistema de 15 en 15 segundos durante un minuto y anótelas en la tabla 5.6. Realice otros dos ensayos siguiendo las instrucciones dadas en los párrafos anteriores. Anótense los valores obtenidos en la tabla 5.6. CÁLCULOS: Calcule la constante de equivalente en agua del sistema calorimétrico (K Medio ), siguiendo las instrucciones dadas en este guión y anótelo en la tabla 5.6. Calcule el calor de neutralización correspondiente al sistema HCl NaOH. Anótelo en la tabla 5.7. Calcule el calor de neutralización correspondiente al sistema H 2 SO 4 NaOH. Anótelo en la tabla
10 5.- RESULTADOS EXPERIMENTALES Determinación de la molaridad exacta de la disolución de NaOH» 1M V NaOH = M NaOH = Determinación de la molaridad exacta de la disolución de HCl» 1M V NaOH (1) = V NaOH (2) = V NaOH (medio) = M HCl = Sistema HCl NaOH M HCl = V HCl ( 200 ó 204)= T HCl = M NaOH = V NaOH (200 ó 204)= T NaOH = T 0 (vaso Dewar) = Tiempo / s Temperatura / ºC Carácter de la solución (ácido o básico) : Determinación de la molaridad exacta de la disolución de H 2 SO 4» 0.5M V NaOH (1) = V NaOH (2) = V NaOH (medio) = M H2SO4 = Sistema H 2 SO 4 NaOH N H2SO4 = V H2SO4 ( 200 ó 204)= T H2SO4 = N NaOH = V NaOH (200 ó 204)= T NaOH = T 0 (vaso Dewar) = Tiempo / s Temperatura / ºC Carácter de la solución (ácido o básico) : Equivalente en agua del sistema calorimétrico Ensayo 1 K 1 = T 0 (vaso Dewar) = T agua = Tiempo / s Temperatura / ºC Ensayo 2 K 2 = T 0 (vaso Dewar) = T agua = Tiempo / s Temperatura / ºC Ensayo 3 K 3 = T 0 (vaso Dewar) = T agua = Tiempo / s Temperatura / ºC K Medio = (K 1 + K 2 + K 3 ) / 3 = Calores de neutralización Q n (HCl - NaOH)= Q n (H 2 SO 4 - NaOH)= 7-10
Calor de Reacción. Departamento de Química. Facultad de Ciencias. Universidad de Los Andes. Mérida. Venezuela
 Calor de Reacción Objetivos 1. Estudiar el calor de reacción de tres tipos de reacciones: Hidratación de un ácido. Disolución de una sal. Neutralización de un ácido 2. Determinar el calor involucrado en
Calor de Reacción Objetivos 1. Estudiar el calor de reacción de tres tipos de reacciones: Hidratación de un ácido. Disolución de una sal. Neutralización de un ácido 2. Determinar el calor involucrado en
VALORACIONES ÁCIDO-BASE
 Práctica Química 2º Bachillerato VALORACIONES ÁCIDO-BASE Nombre: Grupo: Fundamento La determinación del ph en una muestra es un proceso muy habitual en el laboratorio de análisis químico para cuantificar
Práctica Química 2º Bachillerato VALORACIONES ÁCIDO-BASE Nombre: Grupo: Fundamento La determinación del ph en una muestra es un proceso muy habitual en el laboratorio de análisis químico para cuantificar
TITULACIÓN ACIDO BASE.
 1. INTRODUCCION El análisis volumétrico es una técnica basadas en mediciones de volumen para calcular la cantidad de una sustancia en solución, y consiste en una valoración (titulación), que es el proceso
1. INTRODUCCION El análisis volumétrico es una técnica basadas en mediciones de volumen para calcular la cantidad de una sustancia en solución, y consiste en una valoración (titulación), que es el proceso
VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS
 VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS Ejercicio 1 Cálculo del ph de una disolución de ácido fuerte a partir de su concentración. Se dispone de una disolución 0,02M de ácido nítrico. Calcular
VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS Ejercicio 1 Cálculo del ph de una disolución de ácido fuerte a partir de su concentración. Se dispone de una disolución 0,02M de ácido nítrico. Calcular
ÁCIDO BASE QCA 07 ANDALUCÍA
 por ÁCIDO BASE QCA 07 ANDALUCÍA 1.- a) Calcule el ph de una disolución de HClO 4 0 0 M y de una disolución 0 05 M de NaOH. b) Calcule el ph de la disolución obtenida al mezclar 50 ml de cada una de las
por ÁCIDO BASE QCA 07 ANDALUCÍA 1.- a) Calcule el ph de una disolución de HClO 4 0 0 M y de una disolución 0 05 M de NaOH. b) Calcule el ph de la disolución obtenida al mezclar 50 ml de cada una de las
Química 2º Bacharelato
 Química 2º Bacharelato DEPARTAMENTO DE FÍSICA E QUÍMICA Termodinámica química 13/12/07 Nombre: Problemas 1. a) Calcula qué calor se desprende en la combustión de 20,0 cm 3 de etanol líquido a presión atmosférica
Química 2º Bacharelato DEPARTAMENTO DE FÍSICA E QUÍMICA Termodinámica química 13/12/07 Nombre: Problemas 1. a) Calcula qué calor se desprende en la combustión de 20,0 cm 3 de etanol líquido a presión atmosférica
M; ph =2,88; b. α = 1,33.10
 EJERCICIOS DE ÁCIDO BASE. 1º. Tenemos 100cc de agua destlada. Calcular: a. su ph b. si le añadimos una gota (0,05 cc) de HCl 0,1M, calcular el ph de la disolución resultante b. calcular el ph de la disolución
EJERCICIOS DE ÁCIDO BASE. 1º. Tenemos 100cc de agua destlada. Calcular: a. su ph b. si le añadimos una gota (0,05 cc) de HCl 0,1M, calcular el ph de la disolución resultante b. calcular el ph de la disolución
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS EQUILIBRIO ÁCIDO BASE
 PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PRÁCTICA 19 CINÉTICA DE REACCIÓN POR VOLUMETRÍA 1.- FUNDAMENTO TEÓRICO.
 PRÁCTICA 19 CINÉTICA DE REACCIÓN POR VOLUMETRÍA 1.- FUNDAMENTO TEÓRICO. La Termodinámica estudia en toda su profundidad el equilibrio de una reacción química, así como las posibilidades de que ésta pueda
PRÁCTICA 19 CINÉTICA DE REACCIÓN POR VOLUMETRÍA 1.- FUNDAMENTO TEÓRICO. La Termodinámica estudia en toda su profundidad el equilibrio de una reacción química, así como las posibilidades de que ésta pueda
UNIVERSIDAD DON BOSCO DEPARTAMENTO DE CIENCIAS BÁSICAS Asignatura: FÍSICA II
 UNIVERSIDAD DON BOSCO DEPARTAMENTO DE CIENCIAS BÁSICAS Asignatura: FÍSICA II LABORATORIO DE FÍSICA CICLO: AÑO: Laboratorio: 08 Laboratorio 08: CALOR ESPECÍFICO DE UN METAL I. OBJETIVOS General Aplicar
UNIVERSIDAD DON BOSCO DEPARTAMENTO DE CIENCIAS BÁSICAS Asignatura: FÍSICA II LABORATORIO DE FÍSICA CICLO: AÑO: Laboratorio: 08 Laboratorio 08: CALOR ESPECÍFICO DE UN METAL I. OBJETIVOS General Aplicar
PRÁCTICA 3 DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR
 PRÁCTICA 3 DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR Material Productos 2 matraces aforados de 250 ml Hidróxido de sodio en lentejas 2 matraces aforados de 25 ml Disolución de hidróxido
PRÁCTICA 3 DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR Material Productos 2 matraces aforados de 250 ml Hidróxido de sodio en lentejas 2 matraces aforados de 25 ml Disolución de hidróxido
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
Manual de Laboratorio de Química Analítica
 PRÁCTICA 4: DETERMINACIÓN DE LA CONCENTRACIÓN DE ÁCIDO ACÉTICO EN UNA MUESTRA DE VINAGRE BLANCO INTRODUCCIÓN El vinagre blanco es una solución de ácido acético obtenida por fermentación. El análisis se
PRÁCTICA 4: DETERMINACIÓN DE LA CONCENTRACIÓN DE ÁCIDO ACÉTICO EN UNA MUESTRA DE VINAGRE BLANCO INTRODUCCIÓN El vinagre blanco es una solución de ácido acético obtenida por fermentación. El análisis se
1010 DEPARTAMENTO DE FÍSICA Y QUÍMICA 2º Bachillerato QUÍMICA
 1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
Nombres de los integrantes: Práctica 4. Determinación de concentraciones y las diversas maneras de expresarla. Segunda parte: titulaciones rédox.
 Universidad Nacional Autónoma de México Facultad de Química Laboratorio de Química General II 1 Nombres de los integrantes: Grupo Equipo Práctica 4. Determinación de concentraciones y las diversas maneras
Universidad Nacional Autónoma de México Facultad de Química Laboratorio de Química General II 1 Nombres de los integrantes: Grupo Equipo Práctica 4. Determinación de concentraciones y las diversas maneras
ÁCIDOS-BASES. 1.-Calcule la concentración molar de una disolución de ácido sulfúrico que tenga el mismo ph que otra de ácido acético 0,374 M.
 ÁCIDOS-BASES 1.-Calcule la concentración molar de una disolución de ácido sulfúrico que tenga el mismo ph que otra de ácido acético 0,374 M. DATOS: Masas atómicas: H = 1; C = 12; 0 = 16; S = 32. Ka ác.
ÁCIDOS-BASES 1.-Calcule la concentración molar de una disolución de ácido sulfúrico que tenga el mismo ph que otra de ácido acético 0,374 M. DATOS: Masas atómicas: H = 1; C = 12; 0 = 16; S = 32. Ka ác.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
Calor específico de un metal
 Calor específico de un metal Objetivos Determinar el calor específico del Cobre (Cu). Comprobar experimentalmente la ley cero de la Termodinámica. Introducción Diferentes sustancias requieren diferentes
Calor específico de un metal Objetivos Determinar el calor específico del Cobre (Cu). Comprobar experimentalmente la ley cero de la Termodinámica. Introducción Diferentes sustancias requieren diferentes
HOJA Nº 6. REACCIONES QUÍMICAS (II)
 HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA
 TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
PROBLEMAS DE DISOLUCIONES 1º Bachillerato.-
 1 - Cuántos gramos de ácido nítrico son necesarios para preparar 1,5 litros de disolución acuosa de dicho ácido 0,6 M?. (Solución: 56,7 g) 2 - Una disolución 0,25 m de cloruro de sodio contiene 58,5 g
1 - Cuántos gramos de ácido nítrico son necesarios para preparar 1,5 litros de disolución acuosa de dicho ácido 0,6 M?. (Solución: 56,7 g) 2 - Una disolución 0,25 m de cloruro de sodio contiene 58,5 g
Cálculo del rendimiento de una reacción química
 COLEGIO INTERNACIONAL SEK-CATALUNYA Curso 2011/12 Práctica Química 1 4º ESO Cálculo del rendimiento de una reacción química Introducción Para interpretar una reacción de manera cuantitativa, es necesario
COLEGIO INTERNACIONAL SEK-CATALUNYA Curso 2011/12 Práctica Química 1 4º ESO Cálculo del rendimiento de una reacción química Introducción Para interpretar una reacción de manera cuantitativa, es necesario
ÁCIDO BASE. SELECTIVIDAD UCLM 2ºBACH
 1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
Cantidad de sustancia. Gases. Disoluciones.
 1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
GUÍA N 1 TERMOQUÍMICA 2018-I. Laboratorio N 1: Termoquímica LABORATORIO DE FISICOQUÍMICA - UNIVERSIDAD TECNOLÓGICA DEL PERÚ
 GUÍA N 1 TERMOQUÍMICA 2018-I Laboratorio N 1: Termoquímica LABORATORIO DE FISICOQUÍMICA - UNIVERSIDAD TECNOLÓGICA DEL PERÚ LABORATORIO N 1 I. OBJETIVOS TERMOQUÍMICA Conocer el funcionamiento de un calorímetro
GUÍA N 1 TERMOQUÍMICA 2018-I Laboratorio N 1: Termoquímica LABORATORIO DE FISICOQUÍMICA - UNIVERSIDAD TECNOLÓGICA DEL PERÚ LABORATORIO N 1 I. OBJETIVOS TERMOQUÍMICA Conocer el funcionamiento de un calorímetro
QUÍMICA 2º Bachillerato Ejercicios: Cálculos en Química
 1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
CINÉTICA DE HIDRÓLISIS DEL ACETATO DE METILO Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara
 CINÉTICA DE HIDRÓLISIS DEL ACETATO DE METILO Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara OBJETIVOS 1.- Estudiar la cinética de la reacción de hidrólisis ácida del acetato de metilo en disolución
CINÉTICA DE HIDRÓLISIS DEL ACETATO DE METILO Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara OBJETIVOS 1.- Estudiar la cinética de la reacción de hidrólisis ácida del acetato de metilo en disolución
REACCIONES ÁCIDO-BASE
 9 REACCINES ÁCID-BASE SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Escribe las reacciones de disociación de las siguientes sustancias, indicando cuál o cuáles de ellas son ácidos o
9 REACCINES ÁCID-BASE SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Escribe las reacciones de disociación de las siguientes sustancias, indicando cuál o cuáles de ellas son ácidos o
TERMOQUÍMICA A MICROESCALA
 TERMOQUÍMICA A MICROESCALA Agradecimientos: Estefanía Piles Selma Verónica Piles Selma I.E.S. Enric Soler i Godes Esta práctica la realizamos por primera vez en un curso del Cefire titulado: Química a
TERMOQUÍMICA A MICROESCALA Agradecimientos: Estefanía Piles Selma Verónica Piles Selma I.E.S. Enric Soler i Godes Esta práctica la realizamos por primera vez en un curso del Cefire titulado: Química a
PRÁCTICA 2 DETERMINACIÓN DE ÁCIDO ACETILSALICÍLICO EN COMPRIMIDOS MEDIANTE VOLUMETRÍA ÁCIDO-BASE
 PRÁCTICA DETERMINACIÓN DE ÁCID ACETILSALICÍLIC EN CMPRIMIDS MEDIANTE VLUMETRÍA ÁCID-BASE INTRDUCCIÓN El ácido acetilsalicílico (AAS, C 9 H 8 4 ), que es el ácido orto aceto benzóico o el éter acético de
PRÁCTICA DETERMINACIÓN DE ÁCID ACETILSALICÍLIC EN CMPRIMIDS MEDIANTE VLUMETRÍA ÁCID-BASE INTRDUCCIÓN El ácido acetilsalicílico (AAS, C 9 H 8 4 ), que es el ácido orto aceto benzóico o el éter acético de
ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N 4: DETERMINACION DE ph
 I. Presentación de la guía: ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N 4: DETERMINACION DE ph Competencia: El alumno será capaz de aplicar diferentes métodos instrumentales para la determinación
I. Presentación de la guía: ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N 4: DETERMINACION DE ph Competencia: El alumno será capaz de aplicar diferentes métodos instrumentales para la determinación
PRÁCTICA 16 ESTEQUIOMETRÍA DE LAS REACCIONES QUÍMICAS 1.- FUNDAMENTO TEÓRICO.
 PRÁCTICA 16 ESTEQUIOMETRÍA DE LAS REACCIONES QUÍMICAS 1.- FUNDAMENTO TEÓRICO. En esta práctica se dirigirá la atención hacia el concepto de reacción química. Toda reacción es una transformación de la materia
PRÁCTICA 16 ESTEQUIOMETRÍA DE LAS REACCIONES QUÍMICAS 1.- FUNDAMENTO TEÓRICO. En esta práctica se dirigirá la atención hacia el concepto de reacción química. Toda reacción es una transformación de la materia
REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97
 REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule los
REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule los
REACCIONES REVERSIBLES. ASPECTOS PRÁCTICOS DEL EQUILIBRIO QUÍMICO
 III 1 PRÁCTICA 3 REACCIONES REVERSIBLES. ASPECTOS PRÁCTICOS DEL EQUILIBRIO QUÍMICO En esta experiencia estudiaremos, cualitativamente, algunos aspectos prácticos del euilibrio uímico. Para ello: Experimentaremos
III 1 PRÁCTICA 3 REACCIONES REVERSIBLES. ASPECTOS PRÁCTICOS DEL EQUILIBRIO QUÍMICO En esta experiencia estudiaremos, cualitativamente, algunos aspectos prácticos del euilibrio uímico. Para ello: Experimentaremos
(g) CO 2. (g) + 2 H 2. Procediendo en la misma forma con la segunda ecuación, obtenemos: (g) 3 CO 2. (g) + 4 H 2
 Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas. Química General para Ingenieros: QUIM 2115
 UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Química General para Ingenieros: QUIM 115 Experimento No. : ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Química General para Ingenieros: QUIM 115 Experimento No. : ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO
7. Medida del ph: Disoluciones reguladoras. Precipitación isoeléctrica de la caseína
 7. Medida del ph: Disoluciones reguladoras. Precipitación isoeléctrica de la caseína José Peinado Peinado, Fermín Toribio Meléndez-Valdés Departamento de Bioquímica y Biología Molecular, Campus Universitario
7. Medida del ph: Disoluciones reguladoras. Precipitación isoeléctrica de la caseína José Peinado Peinado, Fermín Toribio Meléndez-Valdés Departamento de Bioquímica y Biología Molecular, Campus Universitario
REACCIONES REDOX. Tubos de ensayo, permanganato de potasio, peróxido de hidrógeno, ácido sulfúrico.
 REACCIONES REDOX PRÁCTICA 1 Cápsula de porcelana, mechero, limaduras de cobre Se coloca en una capsula de porcelana limaduras de cobre y se calienta. Al cabo de cierto tiempo se observa que las limaduras
REACCIONES REDOX PRÁCTICA 1 Cápsula de porcelana, mechero, limaduras de cobre Se coloca en una capsula de porcelana limaduras de cobre y se calienta. Al cabo de cierto tiempo se observa que las limaduras
SOLUCIONES. Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva Santiago (Concepción)
 SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
ÁCIDOS Y BASES. Una sustancia se considera ácido o base según su comportamiento frente al agua.
 ÁCIDOS Y BASES 1. Concepto Ácido-Base 1.1. Teoría de Arrhenius Una sustancia se considera ácido o base según su comportamiento frente al agua. ÁCIDO: es toda sustancia que en disolución acuosa libera protones
ÁCIDOS Y BASES 1. Concepto Ácido-Base 1.1. Teoría de Arrhenius Una sustancia se considera ácido o base según su comportamiento frente al agua. ÁCIDO: es toda sustancia que en disolución acuosa libera protones
Práctica 1. Preparación de disoluciones y determinación de la concentración de una disolución por medio de una valoración.
 1 Nombres Grupo Equipo Primera parte Práctica 1. Preparación de disoluciones y determinación de la concentración de una disolución por medio de una valoración. Problemas: - Preparar disoluciones aproximadamente
1 Nombres Grupo Equipo Primera parte Práctica 1. Preparación de disoluciones y determinación de la concentración de una disolución por medio de una valoración. Problemas: - Preparar disoluciones aproximadamente
Ejercicios 3 (Soluciones) 2) Determinar el peso de 400 ml de ácido clorhídrico cuya densidad es de 1,16 g/ml R: 464 g
 Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO PUEDAS, CON UNA ONG.
 SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
Tema 6 Reacciones de transferencia de protones. Ácidos y bases. Teoría de Brönsted-Lowry sobre ácidos y bases.
 Tema 6 Reacciones de transferencia de protones. Ácidos y bases. Teoría de Arrhenius sobre ácidos y bases. Teoría de Brönsted-Lowry sobre ácidos y bases. Fuerza relativa de ácidos y bases. Constante de
Tema 6 Reacciones de transferencia de protones. Ácidos y bases. Teoría de Arrhenius sobre ácidos y bases. Teoría de Brönsted-Lowry sobre ácidos y bases. Fuerza relativa de ácidos y bases. Constante de
H2SO4 (aq)+ NaOH (aq) Na2SO4 (aq)+ H2O (líq)
 1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
PROBLEMAS ÁCIDO-BASE PAU ASTURIAS
 PAU-ÁCIDO-BASE-1 PROBLEMAS ÁCIDO-BASE PAU ASTURIAS 1.- Se preparan 100 cm 3 de una disolución acuosa de NH 3 a partir de 10 cm 3 de otra disolución con un 25 por ciento en masa de NH 3 y densidad 0,90
PAU-ÁCIDO-BASE-1 PROBLEMAS ÁCIDO-BASE PAU ASTURIAS 1.- Se preparan 100 cm 3 de una disolución acuosa de NH 3 a partir de 10 cm 3 de otra disolución con un 25 por ciento en masa de NH 3 y densidad 0,90
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
Laboratorio 6. Calor diferencial de solución
 Laboratorio 6. Calor diferencial de solución Objetivo Determinar la solubilidad del ácido oxálico a diferentes temperaturas. Calcular el calor diferencial de la solución saturada. Teoría Uno de los casos
Laboratorio 6. Calor diferencial de solución Objetivo Determinar la solubilidad del ácido oxálico a diferentes temperaturas. Calcular el calor diferencial de la solución saturada. Teoría Uno de los casos
Formas de expresar la concentración de disoluciones. Química General II 2011
 Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción
ÁCIDO-BASE TEORÍA DE ARRHENIUS
 ÁCIDO-BASE TEORÍA DE ARRHENIUS Ácido es toda sustancia que en disolución acuosa se disocia con formación de iones de hidrógeno, H +, o protones. HA + H 2 O A -- + H + Base es toda sustancia que en disolución
ÁCIDO-BASE TEORÍA DE ARRHENIUS Ácido es toda sustancia que en disolución acuosa se disocia con formación de iones de hidrógeno, H +, o protones. HA + H 2 O A -- + H + Base es toda sustancia que en disolución
TERMOQUÍMICA: DETERMINACIÓN APROXIMADA DE ENTALPÍAS DE DISOLUCIÓN
 SEMINARIO DE FÍSICA Y QUÍMICA NIVEL: BACHILLERATO. FÍSICA Y QUÍMICA MATERIA: QUÍMICA CURSO 2013-2014. PRÁCTICA Nº: Nombre y apellidos:... Grupo:... Fecha:... TERMOQUÍMICA: DETERMINACIÓN APROXIMADA DE ENTALPÍAS
SEMINARIO DE FÍSICA Y QUÍMICA NIVEL: BACHILLERATO. FÍSICA Y QUÍMICA MATERIA: QUÍMICA CURSO 2013-2014. PRÁCTICA Nº: Nombre y apellidos:... Grupo:... Fecha:... TERMOQUÍMICA: DETERMINACIÓN APROXIMADA DE ENTALPÍAS
Práctica No 6. Calor de combustión (Hg)
 Práctica No 6 Calor de combustión (Hg) 1. Objetivo general: Determinación del calor de combustión del acido benzoico utilizando un calorímetro adiabático de volumen constante. 2. Objetivos específicos:
Práctica No 6 Calor de combustión (Hg) 1. Objetivo general: Determinación del calor de combustión del acido benzoico utilizando un calorímetro adiabático de volumen constante. 2. Objetivos específicos:
TEMA 6.- Reacciones de trans- ferencia de protones
 TEMA 6.- Reacciones de trans- ferencia de protones CUESTIONES 51.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más débil es un ácido menor es el ph de sus
TEMA 6.- Reacciones de trans- ferencia de protones CUESTIONES 51.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más débil es un ácido menor es el ph de sus
1) Medición del ph de soluciones mediante una escala de referencia
 OBJETIVO TRABAJO PRÁCTICO Nº 5 EQUILIBRIO ÁCIDO - BASE Familiarizarse con los conceptos de neutralización, ph, hidrólisis, soluciones reguladoras y empleo de indicadores. Adquirir destreza en técnicas
OBJETIVO TRABAJO PRÁCTICO Nº 5 EQUILIBRIO ÁCIDO - BASE Familiarizarse con los conceptos de neutralización, ph, hidrólisis, soluciones reguladoras y empleo de indicadores. Adquirir destreza en técnicas
Tarea previa. Responde las siguientes preguntas usando únicamente el espacio asignado para ello, en caso de excederlo, tu respuesta será inválida.
 1 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Nombre: Nombre: Nombre: Nombre: Nombre: Grupo: Equipo: Práctica 1. Preparación de disoluciones y determinación
1 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Nombre: Nombre: Nombre: Nombre: Nombre: Grupo: Equipo: Práctica 1. Preparación de disoluciones y determinación
PRACTICA No.2 REACCIONES QUÍMICAS II
 1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No.2 REACCIONES QUÍMICAS II INTRODUCCION:
1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No.2 REACCIONES QUÍMICAS II INTRODUCCION:
Las ecuaciones químicas
 Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
P3. Reacciones ácido-base; volumetría
 P3. Reacciones ácido-base; volumetría P3. Reacciones ácido-base; volumetría I. Preparación de una disolución de NaOH(ac) ) ~0.1M II. Uso de un patrón primario Valoración de la disolución de NaOH(ac) )
P3. Reacciones ácido-base; volumetría P3. Reacciones ácido-base; volumetría I. Preparación de una disolución de NaOH(ac) ) ~0.1M II. Uso de un patrón primario Valoración de la disolución de NaOH(ac) )
CONCENTRACIÓN MOLAR Y NORMAL
 PROBLEMAS INICIALES DE PRÁCTICA CONCENTRACIÓN MOLAR Y NORMAL Pregunta 1 Qué significa una disolución con una concentración 0.3 M? Respuesta: 0.3 moles de una sustancia en 1 litro de disolución. Pregunta
PROBLEMAS INICIALES DE PRÁCTICA CONCENTRACIÓN MOLAR Y NORMAL Pregunta 1 Qué significa una disolución con una concentración 0.3 M? Respuesta: 0.3 moles de una sustancia en 1 litro de disolución. Pregunta
Sistema Integrado de Gestión NEUTRALIZACION ACIDO-BASE TITULACION DE UN ACIDO CON UNA BASE PROGRAMA DE DEPORTE GUIA PRÁCTICA N 4
 Sistema Integrado de Gestión NEUTRALIZACION ACIDO-BASE TITULACION DE UN ACIDO CON UNA BASE PROGRAMA DE Versión 5 Proceso: Investigación IV Febrero de 2016 Página 2 de 11 1. OBJETIVOS Valorar (titular)
Sistema Integrado de Gestión NEUTRALIZACION ACIDO-BASE TITULACION DE UN ACIDO CON UNA BASE PROGRAMA DE Versión 5 Proceso: Investigación IV Febrero de 2016 Página 2 de 11 1. OBJETIVOS Valorar (titular)
Solución: Serie problemas para entregar ÁCIDO-BASE
 Solución: Serie problemas para entregar ÁCIDO-BASE 1.- El ácido metanoico, HCOOH, es un ácido débil porque en disolución acuosa no está totalmente disociado. Al disolver 4,6 g de ácido metanoico en 1 litro
Solución: Serie problemas para entregar ÁCIDO-BASE 1.- El ácido metanoico, HCOOH, es un ácido débil porque en disolución acuosa no está totalmente disociado. Al disolver 4,6 g de ácido metanoico en 1 litro
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría
 1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
Manual de Laboratorio de Química Analítica
 PRÁCTICA 6: DETERMINACIÓN DE LA CONCENTRACIÓN DE CLORURO DE SODIO EN UNA MUESTRA DE ALIMENTO: MÉTODOS DE MOHR Y VOLHARD INTRODUCCIÓN Para analizar el contenido de cloruro de sodio (NaCl) en una muestra
PRÁCTICA 6: DETERMINACIÓN DE LA CONCENTRACIÓN DE CLORURO DE SODIO EN UNA MUESTRA DE ALIMENTO: MÉTODOS DE MOHR Y VOLHARD INTRODUCCIÓN Para analizar el contenido de cloruro de sodio (NaCl) en una muestra
PRÁCTICA 5. CALORIMETRÍA
 PRÁCTICA 5. CALORIMETRÍA INTRODUCCIÓN Al mezclar dos cantidades de líquidos a distinta temperatura se genera una transferencia de energía en forma de calor desde el más caliente al más frío. Dicho tránsito
PRÁCTICA 5. CALORIMETRÍA INTRODUCCIÓN Al mezclar dos cantidades de líquidos a distinta temperatura se genera una transferencia de energía en forma de calor desde el más caliente al más frío. Dicho tránsito
CONCENTRACIÓN DE LAS DISOLUCIONES
 CONCENTRACIÓN DE LAS DISOLUCIONES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza
CONCENTRACIÓN DE LAS DISOLUCIONES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva, Ejercicio 4,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva, Ejercicio 4,
La riqueza en peso nos dice que en 100 gramos de disolución hay 37 gramos de soluto, de modo que en 1180 gramos de disolución habrá:
 40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
EXÁMENES SELECTIVIDAD DE ÁCIDO BASE EN LA COMUNIDAD VALENCIANA, ESPECIALIDAD: QUÍMICA
 EXÁMENES SELECTIVIDAD DE ÁCIDO BASE EN LA COMUNIDAD VALENCIANA, ESPECIALIDAD: QUÍMICA Septiembre 2012; Opción A; CUESTION 3 Aplicando la teoría ácido-base de Brönsted-Lowry, explique razonadamente, escribiendo
EXÁMENES SELECTIVIDAD DE ÁCIDO BASE EN LA COMUNIDAD VALENCIANA, ESPECIALIDAD: QUÍMICA Septiembre 2012; Opción A; CUESTION 3 Aplicando la teoría ácido-base de Brönsted-Lowry, explique razonadamente, escribiendo
DISOLUCIONES. Molécula de agua (disolvente) iones solvatados
 DISOLUCIONES Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la
DISOLUCIONES Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
VALORACIÓN ÁCIDO BASE
 PRÁCTICA 5 VALORACIÓN ÁCIDO BASE OBJETIVO Determinar concentraciones desconocidas de ácidos y bases. I. FUNDAMENTO TEÓRICO Las cantidades de reaccionantes y productos de una reacción, son investigados
PRÁCTICA 5 VALORACIÓN ÁCIDO BASE OBJETIVO Determinar concentraciones desconocidas de ácidos y bases. I. FUNDAMENTO TEÓRICO Las cantidades de reaccionantes y productos de una reacción, son investigados
Termoquímica Calor de Neutralización
 LABORATORIO DE FISICOQUÍMICA QMC-313 Termoquímica Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 23/05/2014 Página 2 de 6 Termoquímica Tabla de contenido 1. FUNDAMENTO... 3 2. INSTRUMENTOS
LABORATORIO DE FISICOQUÍMICA QMC-313 Termoquímica Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 23/05/2014 Página 2 de 6 Termoquímica Tabla de contenido 1. FUNDAMENTO... 3 2. INSTRUMENTOS
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II HOJAS DE TRABAJO UNIDAD IV DISOLUCIONES Libros a utilizar:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II HOJAS DE TRABAJO UNIDAD IV DISOLUCIONES Libros a utilizar:
PRÁCTICA 5 DETERMINACIÓN DEL CONTENIDO DE ÁCIDO ASCÓRBICO EN UN PREPARADO FARMACÉUTICO MEDIANTE VOLUMETRÍA REDOX
 PRÁCTICA 5 DETERMINACIÓN DEL CONTENIDO DE ÁCIDO ASCÓRBICO EN UN PREPARADO FARMACÉUTICO MEDIANTE VOLUMETRÍA REDOX INTRODUCCIÓN El ácido ascórbico (C 6 H 8 O 6 ) es un azúcar con propiedades antioxidantes
PRÁCTICA 5 DETERMINACIÓN DEL CONTENIDO DE ÁCIDO ASCÓRBICO EN UN PREPARADO FARMACÉUTICO MEDIANTE VOLUMETRÍA REDOX INTRODUCCIÓN El ácido ascórbico (C 6 H 8 O 6 ) es un azúcar con propiedades antioxidantes
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2010. Fase general OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
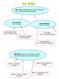 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
CONOCIMIENTO E IDENTIFICACIÓN DEL MATERIAL Y EQUIPO DE LABORATORIO. Nombre del Alumno: Profesor: Grupo:
 CONOCIMIENTO E IDENTIFICACIÓN DEL MATERIAL Y EQUIPO DE LABORATORIO. Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1.Obtiene, registra
CONOCIMIENTO E IDENTIFICACIÓN DEL MATERIAL Y EQUIPO DE LABORATORIO. Nombre del Alumno: Profesor: Grupo: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeños y habilidades. 1.Obtiene, registra
DETERMINACIÓN DE LA ACIDEZ DE UN ZUMO DE LIMÓN NATURAL
 DETERMINACIÓN DE LA ACIDEZ DE UN ZUMO DE LIMÓN NATURAL AUTORÍA JOAQUÍN RUIZ MOLINA TEMÁTICA CIENCIAS EXPERIMENTALES, QUÍMICA ETAPA BACHILLERATO, FORMACIÓN PROFESIONAL Resumen En las asignaturas como Física
DETERMINACIÓN DE LA ACIDEZ DE UN ZUMO DE LIMÓN NATURAL AUTORÍA JOAQUÍN RUIZ MOLINA TEMÁTICA CIENCIAS EXPERIMENTALES, QUÍMICA ETAPA BACHILLERATO, FORMACIÓN PROFESIONAL Resumen En las asignaturas como Física
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación.
 PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
JMLC - Chena IES Aguilar y Cano - Estepa
 Termodinámica es la parte de la física que estudia los intercambios de calor y trabajo que acompañan a los procesos fisicoquímicos. Si estos son reacciones químicas, la parte de ciencia que los estudia
Termodinámica es la parte de la física que estudia los intercambios de calor y trabajo que acompañan a los procesos fisicoquímicos. Si estos son reacciones químicas, la parte de ciencia que los estudia
PROBLEMA EXPERIMENTAL Nº 1
 PRBLEMA EXPERIMENTAL Nº 1 (30 puntos) DETERMINACIÓN DEL CNTENID DE VITAMINA C EN UN ZUM (JUG) DE NARANJA bjetivo Determinar la concentración de vitamina C en un zumo de naranja. Introducción La provincia
PRBLEMA EXPERIMENTAL Nº 1 (30 puntos) DETERMINACIÓN DEL CNTENID DE VITAMINA C EN UN ZUM (JUG) DE NARANJA bjetivo Determinar la concentración de vitamina C en un zumo de naranja. Introducción La provincia
2.3.4 Reacciones con ácidos y bases 11
 100 Parte (b). Hay que determinar la cantidad teórica requerida de HCl puro. Luego, se calcula el volumen de ácido comercial (disolución acuosa) que provee esa cantidad de moles de HCL puro: 2 kgmol HCl
100 Parte (b). Hay que determinar la cantidad teórica requerida de HCl puro. Luego, se calcula el volumen de ácido comercial (disolución acuosa) que provee esa cantidad de moles de HCL puro: 2 kgmol HCl
Resolución de Cuestiones
 La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
Concentraciones: Concentración molar (M) y concentración porcentual % (m/m)
 Elaborado por: Armando Marín B. Concentraciones: Concentración molar (M) y concentración porcentual % (m/m) A diferencia de lo que ocurre con las sustancias puras, la composición de una mezcla es variable.
Elaborado por: Armando Marín B. Concentraciones: Concentración molar (M) y concentración porcentual % (m/m) A diferencia de lo que ocurre con las sustancias puras, la composición de una mezcla es variable.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 3, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 2, Ejercicio 6,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 3, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 2, Ejercicio 6,
GUÍA Nº 1: Preparación de Soluciones I parte
 1 Produce una inmensa tristeza pensar que la naturaleza habla mientras el género humano no la escucha. Victor Hugo I parte Preparar soluciones porcentuales soluto y la cantidad de solvente. La concentración
1 Produce una inmensa tristeza pensar que la naturaleza habla mientras el género humano no la escucha. Victor Hugo I parte Preparar soluciones porcentuales soluto y la cantidad de solvente. La concentración
4. Cuál de las siguientes es una base de Brönsted? A) SO 4
 CUESTIONES ACIDO-BASE ---------------------------------------------------------------------------------------------------------- 1. El ácido conjugado del HSO - 4 es: A) HSO - 4 B) H 2 SO 4 C) H 3 O +
CUESTIONES ACIDO-BASE ---------------------------------------------------------------------------------------------------------- 1. El ácido conjugado del HSO - 4 es: A) HSO - 4 B) H 2 SO 4 C) H 3 O +
QUÍMICA 2º Bachillerato Ejercicios: Reacciones Ácido Base (II)
 1(13) Ejercicio nº 1 Completa las siguientes reacciones entre pares ácidos y bases de BrönstedLowry: a) NH 4 + + H 2 O _ b) H 2 O + CO 3 2 _ c) H 2 O + CH 3 COO _ Ejercicio nº 2 Complete los siguientes
1(13) Ejercicio nº 1 Completa las siguientes reacciones entre pares ácidos y bases de BrönstedLowry: a) NH 4 + + H 2 O _ b) H 2 O + CO 3 2 _ c) H 2 O + CH 3 COO _ Ejercicio nº 2 Complete los siguientes
EXPERIMENTO 3. CURVAS DE TITULACION DE AMINOACIDOS. DETERMINACION DE VALORES DE pk
 EXPERIMENTO 3 CURVAS DE TITULACION DE AMINOACIDOS. DETERMINACION DE VALORES DE pk REQUISITOS Repasar los conceptos sobre las propiedades de los aminoácidos (AA), reacciones ácido base, ph, pk, soluciones
EXPERIMENTO 3 CURVAS DE TITULACION DE AMINOACIDOS. DETERMINACION DE VALORES DE pk REQUISITOS Repasar los conceptos sobre las propiedades de los aminoácidos (AA), reacciones ácido base, ph, pk, soluciones
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
EJERCICIOS DE EQUILIBRIO QUÍMICO.
 EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
TRABAJO PRÁCTICO N 2 DETERMINACIÓN DE DENSIDADES
 0 TRABAJO PRÁCTICO N 2 DETERMINACIÓN DE DENSIDADES a) Determinación de la densidad de hidrógeno Objetivos Determinar la densidad de un gas Conceptos Gases ideales, presión de vapor, rendimiento, pureza,
0 TRABAJO PRÁCTICO N 2 DETERMINACIÓN DE DENSIDADES a) Determinación de la densidad de hidrógeno Objetivos Determinar la densidad de un gas Conceptos Gases ideales, presión de vapor, rendimiento, pureza,
9. MEDIDA DE LA DENSIDAD DE LÍQUIDOS
 9. MEDIDA DE LA DENSIDAD DE LÍQUIDOS OBJETIVO El objetivo de la practica es determinar la densidad de líquidos utilizando la balanza de Möhr y su aplicación a la determinación de la densidad de disoluciones
9. MEDIDA DE LA DENSIDAD DE LÍQUIDOS OBJETIVO El objetivo de la practica es determinar la densidad de líquidos utilizando la balanza de Möhr y su aplicación a la determinación de la densidad de disoluciones
Interacción aire - agua. Termómetro húmedo
 Interacción aire - agua. Termómetro húmedo Objetivos de la práctica! Obtener experimentalmente la denominada temperatura húmeda.! Estudiar las magnitudes psicrométricas de dos corrientes de aire húmedo,
Interacción aire - agua. Termómetro húmedo Objetivos de la práctica! Obtener experimentalmente la denominada temperatura húmeda.! Estudiar las magnitudes psicrométricas de dos corrientes de aire húmedo,
REACCIONES ÁCIDO-BASE O DE TRANSFERENCIA DE PROTONES
 REACCIONES ÁCIDOBASE O DE TRANSFERENCIA DE PROTONES Química de 2º Bachillerato Fernando Lozano Rosado INTRODUCCIÓN Desde hace mucho tiempo los químicos clasificaron todos los compuestos inorgánicos en
REACCIONES ÁCIDOBASE O DE TRANSFERENCIA DE PROTONES Química de 2º Bachillerato Fernando Lozano Rosado INTRODUCCIÓN Desde hace mucho tiempo los químicos clasificaron todos los compuestos inorgánicos en
