Química. Proves d accés a la universitat. Serie 3. Convocatòria El yoduro de plomo(ii) (PbI 2
|
|
|
- Carlos José Luis Calderón Moreno
- hace 7 años
- Vistas:
Transcripción
1 Proves d accés a la universitat Convocatòria 2016 Química Serie 3 Responda a las cuestiones 1, 2 y 3. A continuación, elija UNA cuestión entre la 4 y la 5 y UNA cuestión entre la 6 y la 7, y conteste las dos que haya escogido. 1. El yoduro de plomo(ii) (PbI 2 ) es una sal de color amarillo, bastante insoluble en agua fría, que se puede obtener mezclando disoluciones acuosas de nitrato de plomo(ii) (Pb(NO 3 ) 2 ) y de yoduro de potasio (KI). a) Escriba la reacción de precipitación del yoduro de plomo(ii) y razone, efectuando los cálculos pertinentes, si precipitará yoduro de plomo(ii) cuando se mezclan 0,25 L de disolución acuosa 0,15 m de yoduro de potasio con 0,25 L de disolución acuosa de nitrato de plomo(ii) 0,15 m, a 25 C. Puede suponerse que los volúmenes son aditivos. b) Explique qué procedimiento seguiría en el laboratorio, mencione qué materiales utilizaría y efectúe los cálculos necesarios para preparar la disolución acuosa, antes mencionada, de yoduro de potasio a partir del producto sólido. Datos: Masas atómicas relativas: K = 39; I = 127. Constante del producto de solubilidad del PbI 2 a 25 C: K ps = 7,
2 2. La siguiente figura representa el diagrama de fases del agua. a) Dé el nombre y la definición de los puntos B y C, y de las líneas AB, BC y BD. b) Cuál es el estado físico del agua a 10 C y 1 atm? Partiendo de estas condiciones de temperatura y presión, se calienta el agua a presión constante hasta 130 C. Explique qué le ocurre a medida que aumenta la temperatura. Nombre todos los cambios de fase que tienen lugar. Dibuje, en el cuaderno de respuestas, el diagrama de fases e indique los estados inicial y final, y la línea de calentamiento. 3. Por electrólisis de una disolución acuosa de cloruro de oro(iii) (AuCl 3 ), se obtiene cloro gaseoso y se deposita oro. a) Escriba las semirreacciones que tienen lugar en el ánodo y en el cátodo, y la reacción global. Dibuje un esquema de la celda electrolítica, indicando el electrodo positivo y el negativo, el ánodo y el cátodo, el movimiento de los iones en el interior de la celda y el de los electrones por el circuito exterior. b) Calcule el número de átomos de oro y el número de moléculas de cloro que se obtienen cuando ha pasado un mol de electrones por el circuito. Dato: Número de Avogadro: N A = 6,
3 4. El consumo de substancias estupefacientes supone un grave problema de salud pública. Estas substancias permanecen acumuladas en diferentes partes del cuerpo durante un cierto tiempo, que varía desde días hasta meses. Por ejemplo, la cocaína (C 17 H 21 NO 4 ) y la anfetamina (C 9 H 13 N) pueden detectarse en el cabello de una persona hasta noventa días después de su consumo, mediante la técnica de espectrometría de masas. En la siguiente figura se muestra el espectro de masas obtenido a partir del cabello de una persona de la que se sospecha que ha tomado una de estas drogas. a) Qué magnitud se representa en el eje horizontal del gráfico? A partir de los datos experimentales, deduzca si la persona ha consumido cocaína o anfetamina. b) A 250 C de temperatura y 1 atm de presión, la cocaína se encuentra en estado gaseoso. Calcule el volumen molar de la cocaína en estas condiciones de temperatura y presión, suponiendo que es un gas ideal. Qué diferencias hay entre un gas real y un gas ideal? Datos: Masas atómicas relativas: C = 12; H = 1; N = 14; O = 16. Constante universal de los gases ideales: R = 0,082 atm L mol 1 K Para calcular la energía reticular del cloruro de magnesio (MgCl 2 ) es preciso conocer los datos termodinámicos que figuran en la siguiente tabla: Magnitudes en condiciones estándar y a 25 C Valor (kj mol 1 ) Energía de sublimación del magnesio 146,3 Primera energía de ionización del magnesio 736,3 Segunda energía de ionización del magnesio 1 448,4 Energía de disociación del cloro gaseoso 242,6 Afinidad electrónica del cloro 364,5 Variación de entalpía de formación del cloruro de magnesio 641,2 a) Dibuje el diagrama de entalpías del cloruro de magnesio (ciclo de Born-Haber) y calcule la energía reticular de esta sal a 25 C. b) Explique justificadamente si el valor absoluto de la energía reticular del cloruro de magnesio es mayor o menor que el de la energía reticular del cloruro de calcio (CaCl 2 ). Datos: Números atómicos: Z(Cl) = 17; Z(Mg) = 12; Z(Ca) = 20. 3
4 6. La síntesis del amoniaco se produce por reacción entre el nitrógeno y el hidrógeno, según la siguiente ecuación química: N 2 (g) + 3 H 2 (g) 2 NH 3 (g) Se introducen 1,0 mol de nitrógeno y 3,0 mol de hidrógeno en un reactor cerrado de 1,3 L. Cuando se calienta la mezcla gaseosa a 528 K, se observa que la presión en el equilibrio es de 80,0 atm. Calcule, a 528 K: a) El porcentaje de nitrógeno que ha reaccionado una vez que se ha alcanzado el equilibrio. b) La constante de equilibrio en concentraciones K c. Dato: Constante universal de los gases ideales: R = 0,082 atm L mol 1 K La única forma de determinar la ecuación de velocidad de una reacción es efectuando experimentos para medir el efecto que produce la variación de concentración de los reactivos sobre la velocidad. A continuación, se muestra una reacción y los resultados obtenidos, a una temperatura determinada, cuando se estudia su cinética mediante el método de las velocidades iniciales: 2 H 2 (g) + 2 NO(g) 2 H 2 O(g) + N 2 (g) Experimento [H 2 ] (mol L 1 ) [NO] (mol L 1 ) Velocidad (mol L 1 s 1 ) 1 2, , , , , , , , , a) Calcule el orden de reacción respecto de cada reactivo y el orden total. b) Determine la constante de velocidad de la reacción. A partir de la teoría de las colisiones, explique dos formas de aumentar la velocidad de esta reacción química. L Institut d Estudis Catalans ha tingut cura de la correcció lingüística i de l edició d aquesta prova d accés
5 Proves d accés a la universitat Convocatòria 2016 Química Serie 5 Responda a las cuestiones 1, 2 y 3. A continuación, elija UNA cuestión entre la 4 y la 5 y UNA cuestión entre la 6 y la 7, y conteste las dos que haya escogido. 1. El ibuprofeno, que puede representarse como C 12 H 17 COOH, es un antiinflamatorio que se utiliza para combatir el dolor y los estados febriles. Es un ácido monoprótico débil que contiene un único grupo ácido carboxílico ( COOH) en su molécula. Se ha preparado en el laboratorio una disolución acuosa 0,200 m de este ácido y, al medir el ph, se obtiene un valor de 2,95 a 25 C. a) Calcule la constante de acidez, K a, del ibuprofeno a 25 C. b) Quiere valorarse la disolución acuosa de ibuprofeno 0,200 m con NaOH 0,100 m, pero en el laboratorio solo se dispone de una disolución de NaOH 0,400 m. Calcule qué volumen de esta disolución se necesita para preparar 100,0 ml de una disolución de NaOH 0,100 m y explique cómo la prepararía en el laboratorio, indicando el material que utilizaría. Justifique si puede emplearse el rojo de metilo como indicador para detectar el punto final de esta valoración ácido-base. Dato: Intervalo de viraje (ph) del rojo de metilo: 4,2-6,2. Estructura química del ibuprofeno 2. La electrólisis es un proceso en el que se aporta energía eléctrica para que se produzca una reacción redox no espontánea. Mediante la electrólisis de una disolución acuosa de cloruro de cobre(ii), empleando dos electrodos inertes de grafito, se obtiene Cl 2 (g) en el ánodo y se deposita Cu(s) en el cátodo. a) Escriba las semirreacciones que tienen lugar en el ánodo y el cátodo, indique la polaridad de los electrodos y diga si la semirreacción es de oxidación o de reducción. Escriba la ecuación química global que se produce en el proceso de electrólisis. b) En el laboratorio se lleva a cabo la electrólisis de una disolución acuosa de cloruro de cobre(ii) durante 60 minutos, utilizando una corriente continua de 1,30 A, y se obtienen 1,54 g de Cu(s). Calcule la masa atómica del cobre. Dato: Constante de Faraday: F = 9, C (mol e ) 1.
6 3. Muchos ésteres tienen un aroma característico y, por esta razón, se utilizan frecuentemente como aromatizantes artificiales y aditivos alimentarios. Uno de estos ésteres es el butanoato de etilo, llamado habitualmente butirato de Butirato de etilo etilo, que tiene un aroma parecido al de la piña tropical. Puede obtenerse por reacción entre el ácido butanoico y el etanol, de acuerdo con la siguiente ecuación química: CH 3 COOH(l) + CH 3 OH(l) CH 3 COO CH 3 (l) + H 2 O(l) La constante de equilibrio, K c, de esta reacción tiene un valor de 4,0 a la temperatura de 50 C. Un recipiente contiene una mezcla formada por 0,40 mol de ácido butanoico, 0,40 mol de etanol, 0,50 mol de butanoato de etilo y 0,50 mol de agua. a) Justifique, a partir de los cálculos necesarios, por qué esta mezcla no está en equilibrio a 50 C. Cuáles serán las cantidades (en moles) de cada compuesto cuando la mezcla alcance el equilibrio? b) Quiere mejorarse el rendimiento de la reacción de obtención del éster y se nos propone aplicar alguna de las tres estrategias siguientes: aumentar la presión, añadir una sustancia higroscópica o añadir más cantidad de alcohol. Explique razonadamente si con cada una de las estrategias se conseguirá o no el objetivo que se persigue. Nota: Las sustancias higroscópicas son sustancias que absorben agua, tanto en forma de vapor como en forma líquida, del ambiente que las rodea. 4. El óxido de calcio o cal viva es un compuesto inorgánico muy importante en el ámbito industrial. En el control de la contaminación se utiliza para eliminar el dióxido de azufre generado en algunas centrales eléctricas mediante la siguiente reacción: 2 CaO(s) + 2 SO 2 (g) + O 2 (g) 2 CaSO 4 (s) a) En una central eléctrica se eliminan, cada minuto, 447 g de dióxido de azufre. Calcule el calor que se liberará por minuto en el proceso de eliminación del dióxido de azufre con cal viva si se realiza a una presión constante de 1 atm y una temperatura de 298 K. b) En caso de que el proceso se realizara a volumen constante, justifique si se liberaría una cantidad de calor superior, inferior o igual. Datos: Masas atómicas relativas: O = 16; S = 32. Entalpías estándar de formación, a 298 K: DH f (CaO, s) = 635,1 kj mol 1 ; DH f (SO 2, g) = 296,4 kj mol 1 ; DH f (CaSO 4, s) = 1 432,7 kj mol 1. Constante universal de los gases ideales: R = 8,31 J mol 1 K 1. 2
7 5. El biogás es una mezcla de metano y dióxido de carbono que puede obtenerse a partir de las reacciones metabólicas de las bacterias metanógenas. Estas bacterias llevan a cabo diversas reacciones para descomponer la materia orgánica, la última de las cuales es la siguiente transformación del ácido acético: CH 3 COOH(l) CH 4 (g) + CO 2 (g) DH (a 298 K) = 18,10 kj a) Una granja se plantea instalar una planta de obtención de biogás a partir de ácido acético y duda de la espontaneidad de este proceso. A partir de los cálculos necesarios, indique si esta reacción de obtención de biogás es espontánea en condiciones estándar y a 298 K. b) Para controlar el proceso de obtención del biogás se ha registrado el espectro de masas de uno de los tres compuestos que intervienen en la reacción. Qué magnitud se representa en el eje de abscisas de un espectro de masas? Identifique el compuesto, indicando a qué pueden ser debidos los tres picos de mayor intensidad que aparecen en el espectro. Espectro de masas Datos: Entropías estándar, a 298 K: S (CH 3 COOH, l) = 159,8 J mol 1 K 1 ; S (CO 2, g) = 213,7 J mol 1 K 1 ; S (CH 4, g) = 187,9 J mol 1 K 1. Masas atómicas relativas: H = 1; C = 12; O = Conocer la velocidad de una reacción química y determinar de qué depende es muy útil cuando se diseña el proceso de fabricación de una nueva sustancia. Los ingenieros químicos tienen que buscar, en cada caso, cómo mejorar el rendimiento de una reacción, pero también cómo acelerarla. En un reactor, a volumen constante y a la temperatura de 60 C, se ha realizado un estudio de la cinética de la siguiente reacción: A(g) + 2 B(g) C(g) Los datos experimentales obtenidos demuestran que la reacción es de primer orden respecto de A y de orden cero respecto de B. a) Escriba la ecuación de velocidad de la reacción. Calcule la constante de velocidad de esta reacción a 60 C si, para una concentración inicial del reactivo A de 1, mol L 1 y del reactivo B de 4, mol L 1, la velocidad inicial de la reacción es 4, mol L 1 s 1. La velocidad de la reacción se mantendrá, disminuirá o aumentará cuando hayan transcurrido unos minutos después del inicio de la reacción? Justifique su respuesta. b) Qué es un catalizador? Explique cómo actúa un catalizador en una reacción química a partir del modelo del estado de transición. 3
8 7. Uno de los principales ríos que suministran agua a la ciudad de Barcelona es el río Llobregat. En una analítica rutinaria del agua de este río se han obtenido los siguientes datos: Parámetros Valores ph 7,45 iones cloruro, Cl (mg L 1 ) 298 iones sulfato, SO 4 2 (mg L 1 ) 207 iones calcio, Ca 2+ (mg L 1 ) 128 iones magnesio, Mg 2+ (mg L 1 ) 41,9 iones sodio, Na + (mg L 1 ) 87,4 a) Se llena un tubo de ensayo, hasta la mitad, con agua del río Llobregat a 298 K. A continuación, se añade, gota a gota, una disolución concentrada de Pb(NO 3 ) 2 hasta que empieza a aparecer un poco de precipitado. Justifique, numéricamente, si este precipitado es PbCl 2 o PbSO 4. b) Se llena otro tubo de ensayo, hasta la mitad, con agua del río Llobregat y se le añade, gota a gota, una disolución de NaOH para aumentar la basicidad y hacer precipitar los hidróxidos metálicos insolubles. Cuando el ph es 12,6 empieza a precipitar el hidróxido de calcio. Qué valor tiene la constante del producto de solubilidad de este hidróxido a 298 K? Datos: Masas atómicas relativas: O = 16; S = 32; Cl = 35,5; Ca = 40. Constantes del producto de solubilidad, a 298 K: K ps (PbCl 2 ) = 1, ; K ps (PbSO 4 ) = 1, Constante de ionización del agua, a 298 K: K w = 1, L Institut d Estudis Catalans ha tingut cura de la correcció lingüística i de l edició d aquesta prova d accés
Química. Proves d accés a la universitat. Serie 2. Convocatòria 2015
 Proves d accés a la universitat Convocatòria 2015 Química Serie 2 Responda a las cuestiones 1, 2 y 3. A continuación, elija UNA cuestión entre la 4 y la 5 y UNA cuestión entre la 6 y la 7 y conteste las
Proves d accés a la universitat Convocatòria 2015 Química Serie 2 Responda a las cuestiones 1, 2 y 3. A continuación, elija UNA cuestión entre la 4 y la 5 y UNA cuestión entre la 6 y la 7 y conteste las
1 Hd + H ionización + H afinidad = 437 89,24 122 418,9 + 349 =
 QUÍMICA GENERAL OPCIÓN A CUESTIÓN 1.- Construye el ciclo de Born-Haber y calcula la energía de red ( Hred) del KCl(s) a partir de los siguientes datos: entalpía estándar de formación del KCl(s), H f =
QUÍMICA GENERAL OPCIÓN A CUESTIÓN 1.- Construye el ciclo de Born-Haber y calcula la energía de red ( Hred) del KCl(s) a partir de los siguientes datos: entalpía estándar de formación del KCl(s), H f =
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2010. Fase general OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
1010 DEPARTAMENTO DE FÍSICA Y QUÍMICA 2º Bachillerato QUÍMICA
 1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO PUEDAS, CON UNA ONG.
 SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Modelo 2007/2008 PRIMERA PARTE
 1 PAU Química. Modelo 2007/2008 PRIMERA PARTE Cuestión 1. Para cada uno de los elementos con la siguiente configuración electrónica en los niveles de energía más externos: A=2s 2 2p 4 ; B=2s 2 ; C= 3s
1 PAU Química. Modelo 2007/2008 PRIMERA PARTE Cuestión 1. Para cada uno de los elementos con la siguiente configuración electrónica en los niveles de energía más externos: A=2s 2 2p 4 ; B=2s 2 ; C= 3s
QUÍMICA 2º Bachillerato Ejercicios: Cálculos en Química
 1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
PROBLEMAS EQUILIBRIO ÁCIDO BASE
 PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
UNA ONG ESPERA TU RESPUESTA, ATIÉNDELA PARA QUE PUEDA AYUDAR A OTROS OPCIÓN A
 UNA ONG ESPERA TU RESPUESTA, ATIÉNDELA PARA QUE PUEDA AYUDAR A OTROS OPCIÓN A CUESTIÓN.- Cuál de las siguientes reacciones nunca será espontánea independientemente del valor de la temperatura?, cuál será
UNA ONG ESPERA TU RESPUESTA, ATIÉNDELA PARA QUE PUEDA AYUDAR A OTROS OPCIÓN A CUESTIÓN.- Cuál de las siguientes reacciones nunca será espontánea independientemente del valor de la temperatura?, cuál será
PRUEBA DE ACCESO A LA UNIVERSIDAD
 PRUEBA DE ACCESO A LA UNIVERSIDAD CONVOCATORIA DE JUNIO DE 2014 EJERCICIO DE: QUÍMICA TIEMPO DISPONIBLE: 1 hora 30 minutos PUNTUACIÓN QUE SE OTORGARÁ A ESTE EJERCICIO: (véanse las distintas partes del
PRUEBA DE ACCESO A LA UNIVERSIDAD CONVOCATORIA DE JUNIO DE 2014 EJERCICIO DE: QUÍMICA TIEMPO DISPONIBLE: 1 hora 30 minutos PUNTUACIÓN QUE SE OTORGARÁ A ESTE EJERCICIO: (véanse las distintas partes del
Las entalpías que se dan corresponden a roturas y formación de enlaces entre átomos.
 OPCIÓN GENERAL. OPCIÓN A PROBLEMA.- A partir de los siguientes datos: Molécula Enlaces H enlace (KJ mol ) H H H 436 O O = O 496 H O O H 463 Estima la entalpía estándar de formación de la molécula de agua.
OPCIÓN GENERAL. OPCIÓN A PROBLEMA.- A partir de los siguientes datos: Molécula Enlaces H enlace (KJ mol ) H H H 436 O O = O 496 H O O H 463 Estima la entalpía estándar de formación de la molécula de agua.
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA
 ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
ÁCIDO BASE. SELECTIVIDAD UCLM 2ºBACH
 1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo 2008-2009 MATERIA: QUÍMICA MODELO INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo 2008-2009 MATERIA: QUÍMICA MODELO INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
OPCIÓN A. b) Falsa. Siendo S la solubilidad molar del compuesto poco soluble, su producto de solubilidad
 OPCIÓN A CUESTIÓN 3.- El hidróido de cadmio (II) es una sustancia cuyo producto de solubilidad es 7, 10 15 a 5 ºC, y aumenta al aumentar la temperatura. Justifica si son verdaderas o falsas las siguientes
OPCIÓN A CUESTIÓN 3.- El hidróido de cadmio (II) es una sustancia cuyo producto de solubilidad es 7, 10 15 a 5 ºC, y aumenta al aumentar la temperatura. Justifica si son verdaderas o falsas las siguientes
TEMA 1: Introducción a la Química. Reacción química: leyes. Mol y Número de Avogadro. Estequiometría y disoluciones.
 TEMA 1: Introducción a la Química. Reacción química: leyes. Mol y Número de Avogadro. Estequiometría y disoluciones. 1. Introducción: sustancias puras (elementos y compuestos); transformaciones de la materia
TEMA 1: Introducción a la Química. Reacción química: leyes. Mol y Número de Avogadro. Estequiometría y disoluciones. 1. Introducción: sustancias puras (elementos y compuestos); transformaciones de la materia
H2SO4 (aq)+ NaOH (aq) Na2SO4 (aq)+ H2O (líq)
 1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
EJERCICIOS DE EQUILIBRIO QUÍMICO.
 EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
Resolución de Cuestiones
 La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
En este curso abordamos la clasificación de las reacciones químicas tomando en cuenta los siguientes aspectos:
 IV. LA REACCIÓN QUÍMICA Ejemplos de Clasificación de la Reacción Química Aún cuando en la bibliografía más utilizada en los cursos de Química General se habla constantemente de la reacción química, en
IV. LA REACCIÓN QUÍMICA Ejemplos de Clasificación de la Reacción Química Aún cuando en la bibliografía más utilizada en los cursos de Química General se habla constantemente de la reacción química, en
COLEGIO CRISTO REY Ejercicios repaso Química 2º Bachillerato Cinética y Equilibrio químico
 OLEGIO RISTO REY Ejercicios repaso Química º Bachillerato inética y Equilibrio químico 1 En un recipiente de,0 L se hallan, en equilibrio a cierta temperatura, 4,0 de dióxido de azufre, 4,0 de oxíeno y
OLEGIO RISTO REY Ejercicios repaso Química º Bachillerato inética y Equilibrio químico 1 En un recipiente de,0 L se hallan, en equilibrio a cierta temperatura, 4,0 de dióxido de azufre, 4,0 de oxíeno y
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO PUEDAS, CON UNA ONG.
 SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO PUEDAS, CON UNA ONG. OPCIÓN A GENERAL PROBLEMA 1.- El denominado gas de agua tiene una composición en volumen de 55% de CO (g), 33% de H (g)
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO PUEDAS, CON UNA ONG. OPCIÓN A GENERAL PROBLEMA 1.- El denominado gas de agua tiene una composición en volumen de 55% de CO (g), 33% de H (g)
PROGRAMA DE QUÍMICA ESTRUCTURA ATÓMICA Y CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS
 PROGRAMA DE QUÍMICA La asignatura se ajustará al programa oficial (Decreto 115/2008, de 6 de junio, por el que se establece el currículo de Bachillerato en Extremadura- DOE, nº 117, de 18 de junio de 2008-).
PROGRAMA DE QUÍMICA La asignatura se ajustará al programa oficial (Decreto 115/2008, de 6 de junio, por el que se establece el currículo de Bachillerato en Extremadura- DOE, nº 117, de 18 de junio de 2008-).
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
Química 2º Bacharelato
 Química 2º Bacharelato DEPARTAMENTO DE FÍSICA E QUÍMICA Termodinámica química 13/12/07 Nombre: Problemas 1. a) Calcula qué calor se desprende en la combustión de 20,0 cm 3 de etanol líquido a presión atmosférica
Química 2º Bacharelato DEPARTAMENTO DE FÍSICA E QUÍMICA Termodinámica química 13/12/07 Nombre: Problemas 1. a) Calcula qué calor se desprende en la combustión de 20,0 cm 3 de etanol líquido a presión atmosférica
PROGRAMA QUÍMICA 2015-2016
 PROGRAMA QUÍMICA 2015-2016 1. Conceptos comunes. Transformaciones físicas y químicas. Leyes ponderales de la química. Masas atómicas y masas moleculares. Número de Avogadro. Mol. Fórmula empírica y fórmula
PROGRAMA QUÍMICA 2015-2016 1. Conceptos comunes. Transformaciones físicas y químicas. Leyes ponderales de la química. Masas atómicas y masas moleculares. Número de Avogadro. Mol. Fórmula empírica y fórmula
cromo depositado: % = 12,93/18,72 100 = 69,1 %. Resultado: b) 69,1 %.
 OPCIÓN GENERAL OPCIÓN A PROBLEMA 1.- Se analiza una muestra de 10 ml de una disolución acuosa que contiene ión cloruro, Cl, mediante la adición de una gota (0, ml) de disolución acuosa de nitrato de plata,
OPCIÓN GENERAL OPCIÓN A PROBLEMA 1.- Se analiza una muestra de 10 ml de una disolución acuosa que contiene ión cloruro, Cl, mediante la adición de una gota (0, ml) de disolución acuosa de nitrato de plata,
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar:
 1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
CONCEPTOS BÁSICOS EN QUÍMICA
 CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
Las ecuaciones químicas
 Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Página 1
 TEMA 5. CINÉTICA QUÍMICA Y EQUILIBRIO QUÍMICO 6.2) A una hipotética reacción química A + B C le corresponde la siguiente ecuación de velocidad: v = k [A] [B]. Indique: a) El orden de la reacción respecto
TEMA 5. CINÉTICA QUÍMICA Y EQUILIBRIO QUÍMICO 6.2) A una hipotética reacción química A + B C le corresponde la siguiente ecuación de velocidad: v = k [A] [B]. Indique: a) El orden de la reacción respecto
ÁCIDO BASE QCA 07 ANDALUCÍA
 por ÁCIDO BASE QCA 07 ANDALUCÍA 1.- a) Calcule el ph de una disolución de HClO 4 0 0 M y de una disolución 0 05 M de NaOH. b) Calcule el ph de la disolución obtenida al mezclar 50 ml de cada una de las
por ÁCIDO BASE QCA 07 ANDALUCÍA 1.- a) Calcule el ph de una disolución de HClO 4 0 0 M y de una disolución 0 05 M de NaOH. b) Calcule el ph de la disolución obtenida al mezclar 50 ml de cada una de las
HOJA Nº 6. REACCIONES QUÍMICAS (II)
 HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
EXÁMENES SELECTIVIDAD DE ÁCIDO BASE EN LA COMUNIDAD VALENCIANA, ESPECIALIDAD: QUÍMICA
 EXÁMENES SELECTIVIDAD DE ÁCIDO BASE EN LA COMUNIDAD VALENCIANA, ESPECIALIDAD: QUÍMICA Septiembre 2012; Opción A; CUESTION 3 Aplicando la teoría ácido-base de Brönsted-Lowry, explique razonadamente, escribiendo
EXÁMENES SELECTIVIDAD DE ÁCIDO BASE EN LA COMUNIDAD VALENCIANA, ESPECIALIDAD: QUÍMICA Septiembre 2012; Opción A; CUESTION 3 Aplicando la teoría ácido-base de Brönsted-Lowry, explique razonadamente, escribiendo
PROCESOS DE OXIDACIÓN-REDUCCIÓN. ELECTROQUÍMICA.
 PROCESOS DE OXIDACIÓN-REDUCCIÓN. ELECTROQUÍMICA. Ajustar las reacciones: MnO - 4 + Fe 2+ + H + Mn 2+ + Fe 3+ + H 2 O - MnO 4 + I - + H 2 O I 2 + MnO 2 + OH - ClO - 3 + Co 2+ + H + Cl - + Co 3+ + H 2 O
PROCESOS DE OXIDACIÓN-REDUCCIÓN. ELECTROQUÍMICA. Ajustar las reacciones: MnO - 4 + Fe 2+ + H + Mn 2+ + Fe 3+ + H 2 O - MnO 4 + I - + H 2 O I 2 + MnO 2 + OH - ClO - 3 + Co 2+ + H + Cl - + Co 3+ + H 2 O
de una reacción n en la cual, tanto reactivos como productos están n en condiciones estándar (p = 1 atm; ; T = 298 K = 25 ºC;
 Entalpía a estándar de la reacción Es el incremento entálpico de una reacción n en la cual, tanto reactivos como productos están n en condiciones estándar (p = 1 atm; ; T = 298 K = 25 ºC; conc.. = 1 M).
Entalpía a estándar de la reacción Es el incremento entálpico de una reacción n en la cual, tanto reactivos como productos están n en condiciones estándar (p = 1 atm; ; T = 298 K = 25 ºC; conc.. = 1 M).
CUADRO ESTADÍSTICO DE CALIFICACIONES DE QUÍMICA EN SELECTIVIDAD 2014. JUNIO (5,49±0.2) desviación de las medias, no de la población) ALMERÍA 5,41 3,39
 CUADRO ESTADÍSTICO DE CALIFICACIONES DE QUÍMICA EN SELECTIVIDAD 214 DISTRITO UNIVERSITARIO JUNIO (5,49±.2) desviación de las medias, no de la población) SEPTIEMBRE ( ALMERÍA 5,41 3,39 CÁDIZ 5,31 3,9 CÓRDOBA
CUADRO ESTADÍSTICO DE CALIFICACIONES DE QUÍMICA EN SELECTIVIDAD 214 DISTRITO UNIVERSITARIO JUNIO (5,49±.2) desviación de las medias, no de la población) SEPTIEMBRE ( ALMERÍA 5,41 3,39 CÁDIZ 5,31 3,9 CÓRDOBA
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 9 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 9 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva,
QUÍMICA 2º Bachillerato Ejercicios: Reacciones de Oxidación Reducción (II)
 1(10) Ejercicio nº 1 El KCl reacciona con KMnO 4, en medio ácido sulfúrico, para dar cloro gaseoso, sulfato de manganeso (II), agua y sulfato de potasio. a) Iguale la ecuación molecular por el método del
1(10) Ejercicio nº 1 El KCl reacciona con KMnO 4, en medio ácido sulfúrico, para dar cloro gaseoso, sulfato de manganeso (II), agua y sulfato de potasio. a) Iguale la ecuación molecular por el método del
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
] = s = 1'5 10-5 M. a) El equilibrio de ionización del compuesto es: Al(OH) 3 Al 3+ + 3 OH -
![] = s = 1'5 10-5 M. a) El equilibrio de ionización del compuesto es: Al(OH) 3 Al 3+ + 3 OH - ] = s = 1'5 10-5 M. a) El equilibrio de ionización del compuesto es: Al(OH) 3 Al 3+ + 3 OH -](/thumbs/40/21798534.jpg) 1. Se disuelve hidróxido de cobalto(ii) en agua hasta obtener una disolución saturada a una temperatura dada. Se conoce que la concentración de iones OH - es 3 10-5 M. Calcule: a) La concentración de iones
1. Se disuelve hidróxido de cobalto(ii) en agua hasta obtener una disolución saturada a una temperatura dada. Se conoce que la concentración de iones OH - es 3 10-5 M. Calcule: a) La concentración de iones
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
Química 2º Bachillerato. Dº de Física y Química. IES Atenea. S. S. Reyes 1. Equilibrio químico
 Química 2º Bachillerato. Dº de Física y Química. IES Atenea. S. S. Reyes 1 Equilibrio químico 1. En un matraz de 1 L se introducen 0,1 moles de PCl 5 y se calienta hasta 300 C, disociándose según: PCl
Química 2º Bachillerato. Dº de Física y Química. IES Atenea. S. S. Reyes 1 Equilibrio químico 1. En un matraz de 1 L se introducen 0,1 moles de PCl 5 y se calienta hasta 300 C, disociándose según: PCl
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva, Ejercicio 3, Opción A Reserva, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva, Ejercicio 3, Opción A Reserva, Ejercicio 6, Opción
VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS
 VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS Ejercicio 1 Cálculo del ph de una disolución de ácido fuerte a partir de su concentración. Se dispone de una disolución 0,02M de ácido nítrico. Calcular
VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS Ejercicio 1 Cálculo del ph de una disolución de ácido fuerte a partir de su concentración. Se dispone de una disolución 0,02M de ácido nítrico. Calcular
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
TEMA 6 EQUILIBRIO QUÍMICO
 TEMA 6 EQUILIBRIO QUÍMICO ÍNDICE 1. Equilibrio químico homogéneo y heterogéneo 2. Concentraciones en equilibrio 3. Constante de equilibrio K c 4. Constantes de equilibrio K p y K c 5. Cociente de reacción
TEMA 6 EQUILIBRIO QUÍMICO ÍNDICE 1. Equilibrio químico homogéneo y heterogéneo 2. Concentraciones en equilibrio 3. Constante de equilibrio K c 4. Constantes de equilibrio K p y K c 5. Cociente de reacción
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría
 1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
Cantidad de sustancia. Gases. Disoluciones.
 1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
4. TEORÍA ATÓMICO-MOLECULAR
 4. TEORÍA ATÓMICO-MOLECULAR Sustancias que reaccionan 1. Explica qué son los procesos o cambios físicos y pon ejemplos de ellos. Los procesos o cambios físicos no producen modificaciones en la naturaleza
4. TEORÍA ATÓMICO-MOLECULAR Sustancias que reaccionan 1. Explica qué son los procesos o cambios físicos y pon ejemplos de ellos. Los procesos o cambios físicos no producen modificaciones en la naturaleza
H 2 (g) 2 H(g) ΔH = +436 kj Indique, de forma cualitativa, las condiciones de temperatura en que la reacción anterior será espontánea.
 PAU-TERMOQUÍMICA ASTURIAS-1 PAU 010 P 1 La combustión completa de 40 g de acetona, C H 6 O(l), libera 14,5 kj. Si las entalpías estándar de formación del CO (g) y del H O(l) son -9,5 y -85,8 kj mol-1,
PAU-TERMOQUÍMICA ASTURIAS-1 PAU 010 P 1 La combustión completa de 40 g de acetona, C H 6 O(l), libera 14,5 kj. Si las entalpías estándar de formación del CO (g) y del H O(l) son -9,5 y -85,8 kj mol-1,
Reacciones en disolución acuosa
 Reacciones en disolución acuosa (no redox) Ramón L. Hernández-Castillo, Ph.D. Química 106 (laboratorio) Objetivos Reglas de Solubilidad en medio acuoso Reacciones típicas en medio acuoso (precipitación,
Reacciones en disolución acuosa (no redox) Ramón L. Hernández-Castillo, Ph.D. Química 106 (laboratorio) Objetivos Reglas de Solubilidad en medio acuoso Reacciones típicas en medio acuoso (precipitación,
EJERCICIOS RESUELTOS DE EQUILIBRIO QUIMICO
 EJERIIOS RESUELTOS DE EQUILIBRIO QUIMIO 1. uando el cloruro amónico se calienta a 75º en un recipiente cerrado de 1,0 litro, se descompone dando lugar a cloruro de hidrógeno gaseoso y amoniaco gaseoso
EJERIIOS RESUELTOS DE EQUILIBRIO QUIMIO 1. uando el cloruro amónico se calienta a 75º en un recipiente cerrado de 1,0 litro, se descompone dando lugar a cloruro de hidrógeno gaseoso y amoniaco gaseoso
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
EJERCICIOS DE TERMODINÁMICA
 EJERCICIOS DE TERMODINÁMICA. La descomposición del tetraóxido de nitrógeno ( N O 4 NO4( NO( ocurre espontáneamente a temperaturas altas. Los datos termodinámicos a 98ºK se incluyen en la tabla adjunta.
EJERCICIOS DE TERMODINÁMICA. La descomposición del tetraóxido de nitrógeno ( N O 4 NO4( NO( ocurre espontáneamente a temperaturas altas. Los datos termodinámicos a 98ºK se incluyen en la tabla adjunta.
a) La ecuación correspondiente a la descomposición de la nitroglicerina es la siguiente:
 FASE GENERAL OPCIÓN A PROBLEMA.- La nitroglicerina, C 3 H 5 N 3 O 9 (l), se descompone a atm y 5 ºC para formar N (g), CO (g), H O (l) y O (g), desprendiendo 54,4 kj mol de nitroglicerina: a) Escribe la
FASE GENERAL OPCIÓN A PROBLEMA.- La nitroglicerina, C 3 H 5 N 3 O 9 (l), se descompone a atm y 5 ºC para formar N (g), CO (g), H O (l) y O (g), desprendiendo 54,4 kj mol de nitroglicerina: a) Escribe la
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B
GUÍA DE PROBLEMAS. Cinética Química
 GUÍA DE PROBLEMAS 1) Deduzca las ecuaciones matemáticas que representan la cinética química para las reacciones de cero, primer y segundo orden. Asimismo, establezca la ecuación para cuando la concentración
GUÍA DE PROBLEMAS 1) Deduzca las ecuaciones matemáticas que representan la cinética química para las reacciones de cero, primer y segundo orden. Asimismo, establezca la ecuación para cuando la concentración
Ejercicios 3 (Soluciones) 2) Determinar el peso de 400 ml de ácido clorhídrico cuya densidad es de 1,16 g/ml R: 464 g
 Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS DE EQUILIBRIO QUÍMICO Exámenes de Selectividad de la Comunidad Valenciana.
 PROBLEMAS DE EQUILIBRIO QUÍMICO Exámenes de Selectividad de la Comunidad Valenciana. Septiembre 2012; Opción B; PROBLEMA 4.- A 375 K el SO 2 Cl 2 (g) se descompone parcialmente según el siguiente equilibrio:
PROBLEMAS DE EQUILIBRIO QUÍMICO Exámenes de Selectividad de la Comunidad Valenciana. Septiembre 2012; Opción B; PROBLEMA 4.- A 375 K el SO 2 Cl 2 (g) se descompone parcialmente según el siguiente equilibrio:
Butano(g) -124,7 Dióxido de carbono(g) -393 Agua(l) -286
 1.- Dada la reacción de combustión del butano: Butano(g) + oxígeno (g) ======== dióxido de carbono(gas) + agua (gas) Sabiendo que es una reacción exotérmica, indica si a la misma temperatura, el calor
1.- Dada la reacción de combustión del butano: Butano(g) + oxígeno (g) ======== dióxido de carbono(gas) + agua (gas) Sabiendo que es una reacción exotérmica, indica si a la misma temperatura, el calor
Química 2º Bachillerato Termoquímica
 I. E. S. Atenea. Departamento de Física y Química 1 Química 2º Bachillerato Termoquímica 1. Calcular la variación de energía interna para la reacción de combustión del benceno (C 6 H 6 ) si el proceso
I. E. S. Atenea. Departamento de Física y Química 1 Química 2º Bachillerato Termoquímica 1. Calcular la variación de energía interna para la reacción de combustión del benceno (C 6 H 6 ) si el proceso
QUÍMICA 2º Bachillerato Ejercicios: Reacciones Ácido Base (II)
 1(13) Ejercicio nº 1 Completa las siguientes reacciones entre pares ácidos y bases de BrönstedLowry: a) NH 4 + + H 2 O _ b) H 2 O + CO 3 2 _ c) H 2 O + CH 3 COO _ Ejercicio nº 2 Complete los siguientes
1(13) Ejercicio nº 1 Completa las siguientes reacciones entre pares ácidos y bases de BrönstedLowry: a) NH 4 + + H 2 O _ b) H 2 O + CO 3 2 _ c) H 2 O + CH 3 COO _ Ejercicio nº 2 Complete los siguientes
1. Analizar situaciones y obtener información sobre fenómenos químicos utilizando las estrategias básicas del trabajo científico.
 ASIGNATURA: QUIMICA Actualización: Mayo 2009 Validez desde el curso: 2009/2010 Autorización: COPAEU Castilla y León PROGRAMA Análisis del currículo y acuerdos para las Pruebas de Acceso a Estudios Universitarios
ASIGNATURA: QUIMICA Actualización: Mayo 2009 Validez desde el curso: 2009/2010 Autorización: COPAEU Castilla y León PROGRAMA Análisis del currículo y acuerdos para las Pruebas de Acceso a Estudios Universitarios
REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97
 REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule los
REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule los
Refuerzo Modelos atómicos
 Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
Equilibrio. Boletín repaso Química 2 º bachillerato(i) 1.Dado el equilibrio: H2O(g) + C(s) CO(g) + H2(g) ΔH > 0
 Equilibrio 1.Dado el equilibrio: H2O(g) + C(s) CO(g) + H2(g) ΔH > 0 Señala, razonadamente, cuál de las siguientes medidas produce un aumento de la concentración de monóxido de carbono: a) Elevar la temperatura.
Equilibrio 1.Dado el equilibrio: H2O(g) + C(s) CO(g) + H2(g) ΔH > 0 Señala, razonadamente, cuál de las siguientes medidas produce un aumento de la concentración de monóxido de carbono: a) Elevar la temperatura.
Cuestiones y Problemas del Tema 6: Equilibrio Químico
 Cuestiones y Problemas del Tema 6: Equilibrio Químico 1. Considere el siguiente sistema en equilibrio: Justifique el efecto que tendrá sobre los parámetros que se indican el cambio que se propone: Cambio
Cuestiones y Problemas del Tema 6: Equilibrio Químico 1. Considere el siguiente sistema en equilibrio: Justifique el efecto que tendrá sobre los parámetros que se indican el cambio que se propone: Cambio
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Sistemas Físicos y Químicos
 1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
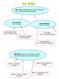 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2013 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B Reserva
TERMODINÁMICA DEL EQUILIBRIO CAPÍTULO II. SOLUCIONES QUÍMICAS
 Ing. Federico G. Salazar Termodinámica del Equilibrio TERMODINÁMICA DEL EQUILIBRIO CAPÍTULO II. SOLUCIONES QUÍMICAS Contenido 1. Propiedades Parciales Molares 2. Entalpía de Mezcla 3. Efectos caloríficos
Ing. Federico G. Salazar Termodinámica del Equilibrio TERMODINÁMICA DEL EQUILIBRIO CAPÍTULO II. SOLUCIONES QUÍMICAS Contenido 1. Propiedades Parciales Molares 2. Entalpía de Mezcla 3. Efectos caloríficos
Formas de expresar la concentración de disoluciones. Química General II 2011
 Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
( kj / mol) -1268 0-393,5-285,8
 Apellidos y Nombre Grupo 1. (1 punto) En un experimento se disuelve una barra de aluminio (sólido) en 100,00 ml de una disolución de HCl 1,50 M. 2 Al(s) + 6 HCl(ac) 2 AlCl 3 (ac) + 3 H 2 (g) Cuando termina
Apellidos y Nombre Grupo 1. (1 punto) En un experimento se disuelve una barra de aluminio (sólido) en 100,00 ml de una disolución de HCl 1,50 M. 2 Al(s) + 6 HCl(ac) 2 AlCl 3 (ac) + 3 H 2 (g) Cuando termina
Principios de Química General 1
 Principios de Química General 1 La unidad básica de longitud del sistema MKS es: Metro La ley que dice " Todo cuerpo conserva su estado de reposo y movimiento uniforme rectilíneo, a menos que fuerzas externas
Principios de Química General 1 La unidad básica de longitud del sistema MKS es: Metro La ley que dice " Todo cuerpo conserva su estado de reposo y movimiento uniforme rectilíneo, a menos que fuerzas externas
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 3, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 2, Ejercicio 6,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 3, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 2, Ejercicio 6,
b) Las constantes ácida y básica de un ácido y su base conjugada vienen relacionadas por la
 FASE GENERAL OPCIÓN A CUESTIÓN.- Considera los ácidos orgánicos monopróticos: úrico, benzoico, láctico y butanoico. a) Ordénalos en orden creciente de acidez en disolución acuosa. b) Justifica cuál de
FASE GENERAL OPCIÓN A CUESTIÓN.- Considera los ácidos orgánicos monopróticos: úrico, benzoico, láctico y butanoico. a) Ordénalos en orden creciente de acidez en disolución acuosa. b) Justifica cuál de
Electrólisis. Laboratorio de físico-química Universidad de La Serena. Rodrigo Araya Cortes. Pedagogía en Química y Ciencias naturales
 Electrólisis Laboratorio de físico-química Universidad de La Serena Rodrigo Araya Cortes Pedagogía en Química y Ciencias naturales Jueves 01 de octubre del 2009 Electrolisis Objetivos: o o o o Aprender
Electrólisis Laboratorio de físico-química Universidad de La Serena Rodrigo Araya Cortes Pedagogía en Química y Ciencias naturales Jueves 01 de octubre del 2009 Electrolisis Objetivos: o o o o Aprender
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 2009-2010 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 2009-2010 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN
GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA. 1. Igualar las siguientes ecuaciones mediante el método algebraico.
 1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
PAAU (LOXSE) Setembro 2007
 PAAU (LOXSE) Setembro 27 Código: 3 QUÍMICA CALIICACIÓN: CUESTIONES =2 PUNTOS CADA UNA; PROBLEMAS: 2 PUNTOS CADA UNO; PRÁCTICA: 2 PUNTOS CUESTIONES (Responda SOLAMENTE a DOS de las siguientes cuestiones).
PAAU (LOXSE) Setembro 27 Código: 3 QUÍMICA CALIICACIÓN: CUESTIONES =2 PUNTOS CADA UNA; PROBLEMAS: 2 PUNTOS CADA UNO; PRÁCTICA: 2 PUNTOS CUESTIONES (Responda SOLAMENTE a DOS de las siguientes cuestiones).
UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA GUÍA N 3: CINÉTICA QUÍMICA
 UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA CURSO: 4 TO AÑO PROFESOR: CARLOS M. LANDAETA H. GUÍA N 3: CINÉTICA QUÍMICA 1.- Escriba las expresiones de las velocidades de
UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA CURSO: 4 TO AÑO PROFESOR: CARLOS M. LANDAETA H. GUÍA N 3: CINÉTICA QUÍMICA 1.- Escriba las expresiones de las velocidades de
TIPOS DE REACCIONES QUIMICAS
 Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio Fase general OPCIÓN A
 1 PAU Química. Junio 2010. Fase general OPCIÓN A Cuestión 1A. El elemento de número atómico 12 se combina fácilmente con el elemento de número atómico 17. Indique: a) La configuración electrónica de los
1 PAU Química. Junio 2010. Fase general OPCIÓN A Cuestión 1A. El elemento de número atómico 12 se combina fácilmente con el elemento de número atómico 17. Indique: a) La configuración electrónica de los
M; ph =2,88; b. α = 1,33.10
 EJERCICIOS DE ÁCIDO BASE. 1º. Tenemos 100cc de agua destlada. Calcular: a. su ph b. si le añadimos una gota (0,05 cc) de HCl 0,1M, calcular el ph de la disolución resultante b. calcular el ph de la disolución
EJERCICIOS DE ÁCIDO BASE. 1º. Tenemos 100cc de agua destlada. Calcular: a. su ph b. si le añadimos una gota (0,05 cc) de HCl 0,1M, calcular el ph de la disolución resultante b. calcular el ph de la disolución
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA EL ALUMNADO DE BACHILLERATO 160 QUÍMICA. JUNIO 2015
 PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA EL ALUMNADO DE BACHILLERATO OPCIÓN A 1. Dadas las siguientes sustancias químicas: NH 3, Al, C(diamante) y MgCl 2. Indique de forma razonada cuál de ellas: a. Es
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA EL ALUMNADO DE BACHILLERATO OPCIÓN A 1. Dadas las siguientes sustancias químicas: NH 3, Al, C(diamante) y MgCl 2. Indique de forma razonada cuál de ellas: a. Es
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo 20072008 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos partes.
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo 20072008 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos partes.
T(K) 298 400 600 800 1000 Kp 2,82 10-25 1,78 10-16 1,98 10-8 1,29 10-3 2,642 10 1
 EQUILIBRIO QUÍMICO : ACTIVIDADES DE SELECTIVIDAD Curso 13-14 1.- En un matraz de 2 l se introducen 12 g de PCl 5 y se calienta hasta 300 º C. En el equilibrio de disociación; PCl 5 (g) PCl 3 (g) + Cl 2
EQUILIBRIO QUÍMICO : ACTIVIDADES DE SELECTIVIDAD Curso 13-14 1.- En un matraz de 2 l se introducen 12 g de PCl 5 y se calienta hasta 300 º C. En el equilibrio de disociación; PCl 5 (g) PCl 3 (g) + Cl 2
Unidad 5- Cinética Química
 La termodinámica nos permite conocer la espontaneidad ó no espontaneidad de las reacciones, pero no nos informa de la rapidez con que tendrá lugar el proceso de transformación de los reactivos en productos:
La termodinámica nos permite conocer la espontaneidad ó no espontaneidad de las reacciones, pero no nos informa de la rapidez con que tendrá lugar el proceso de transformación de los reactivos en productos:
TERMOQUÍMICA PAU ASTURIAS
 TERMOQUÍMICA PAU ASTURIAS 1. (PAU 08) La observación experimental de H con respecto al producto T S, para una reacción simple, A B, permite la representación gráfica de la figura: Observando, la misma,
TERMOQUÍMICA PAU ASTURIAS 1. (PAU 08) La observación experimental de H con respecto al producto T S, para una reacción simple, A B, permite la representación gráfica de la figura: Observando, la misma,
EJERCICIOS DE SELECTIVIDAD 99/00
 EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
