4. TEORÍA ATÓMICO-MOLECULAR
|
|
|
- Pablo Venegas Aguirre
- hace 9 años
- Vistas:
Transcripción
1 4. TEORÍA ATÓMICO-MOLECULAR Sustancias que reaccionan 1. Explica qué son los procesos o cambios físicos y pon ejemplos de ellos. Los procesos o cambios físicos no producen modificaciones en la naturaleza de las sustancias que intervienen. Los cambios de estado y la separación de las sustancias de una mezcla son ejemplos de cambios físicos. 2. Define procesos o transformaciones químicas y pon ejemplos de ellos. Una transformación química es un proceso mediante el cual una o más sustancias se transforman en otras diferentes. La electrolisis del agua o la descomposición térmica del azúcar son ejemplos de transformaciones químicas. 3. Describe las diferencias que existen entre una mezcla de azufre y limaduras de hierro y la reacción entre el azufre y el hierro para dar el compuesto sulfuro de hierro. La mezcla de azufre y limaduras de hierro tiene un aspecto heterogéneo y se puede separar en sus componentes por métodos físicos. La reacción entre el azufre y el hierro es un proceso químico que transforma estas sustancias en una nueva: sulfuro de hierro. 4. Indica en cuáles de los siguientes procesos se produce un cambio químico: a) Se rompe una botella de vidrio. b) Se mezclan mantequilla y azúcar. c) Se quema un trozo de carbón. d) Se oxida el hierro. e) Se evapora un perfume. f) Se quema petróleo. g) Se obtiene cobre a partir de óxido de cobre. h) Se baten frutas con leche. i) Se funde la cera de una vela. Se produce un cambio químico en c), d), f) y g). Las leyes de las reacciones químicas 5. Copia en tu cuaderno y completa los siguientes enunciados: a) La masa de un sistema permanece cualquiera que sea la transformación que ocurra dentro de él. b) Cuando dos o más elementos se combinan para dar un, lo hacen siempre en proporciones de masas definidas y. a) La masa de un sistema permanece constante cualquiera que sea la transformación que ocurra dentro de él. b) Cuando dos o más elementos se combinan para dar un mismo compuesto, lo hacen siempre en proporciones de masas definidas y constantes. Teoría atómico-ecular 1
2 6. Pesamos una vela antes y después de encenderla y observamos que ha perdido masa. a) Acaso no se cumple la ley de la conservación de la masa? b) Cómo explicarías este hecho? a) Se cumple la ley de la conservación de la masa. b) Porque no se ha considerado la masa de las sustancias gaseosas que se han desprendido. 7. Si se calienta un alambre de cobre, se forma óxido de cobre y la masa del alambre aumenta. a) Se cumple la ley de Lavoisier o ley de conservación de la masa? b) Cómo explicarías este hecho? a) Se cumple la ley de la conservación de la masa. b) Porque no se ha considerado la masa del oxígeno que se ha combinado con el cobre. 8. El calcio reacciona con el oxígeno del aire para dar óxido de calcio (cal viva): calcio + oxígeno óxido de calcio Copia en tu cuaderno y completa los datos que faltan en esta tabla, aplicando la ley de la conservación de la masa y la ley de las proporciones múltiples. Experiencia m calcio (g) m oxígeno (g) m óxido de calcio (g) Averigua la composición del óxido de calcio utilizando los datos de la actividad anterior. El porcentaje de oxígeno es % y el porcentaje de calcio %. 10. Justifica si es verdadera o falsa esta afirmación: Si se hacen reaccionar 2.8 g de hierro con 1.6 g de azufre, se obtienen 4.4 g de sulfuro de hierro, y si se desea obtener 6 g de sulfuro de hierro, habrá que hacer reaccionar 3.5 g de hierro con 2.5 g de azufre. Es falsa porque la proporción 2.8/1.6 es 1.75, pero la proporción 3.5/2.5 es g de magnesio reaccionan exactamente con 2.02 g de oxígeno para formar óxido de magnesio. Qué cantidad de óxido de magnesio se obtiene? Calcula el porcentaje de oxígeno y de magnesio en el compuesto. Se obtienen 5.09 g de óxido de magnesio. El porcentaje de magnesio es 60.3 % y el de oxígeno 39.7 %. Teoría atómico-ecular 2
3 La teoría atómica de Dalton 12. Pueden descomponerse los elementos en otras sustancias más sencillas? Y los compuestos? Distingue entre elemento y compuesto. Los elementos no pueden descomponerse en otras sustancias más sencillas. Los compuestos pueden descomponerse en los elementos que los componen. Un elemento es una sustancia formada por átomos iguales. Un compuesto es una sustancia formada por átomos distintos combinados en proporciones fijas. 13. Puede existir un compuesto formado por un átomo de una clase y 1.5 átomos de otra clase? No puede existir un compuesto formado por un átomo de una clase y 1.5 átomos de otra clase. 14. Cómo se explica la ley de Lavoisier a partir de la teoría de la teoría atómica de Dalton? Los átomos son indestructibles e indivisibles y en una reacción química solo cambia la organización de los átomos, por eso la masa inicial es igual a la masa final. 15. Cómo se justifica la ley de Proust a partir de la teoría atómica de Dalton? Cuando dos o más átomos de elementos diferentes se combinan para formar un mismo compuesto lo hacen en una relación de números enteros sencillos. 16. Estaba en lo cierto Dalton al suponer que la écula de agua era HO? Qué hipótesis se planteó Dalton para suponer que esa podía ser su fórmula? Dalton no estuvo afortunado al suponer que la écula de agua era HO. Según Dalton las fórmulas eran las más simples posibles. 17. Si los átomos de cierta sustancia son todos iguales, de qué sustancia se trata? De un elemento químico. Relación entre sustancias gaseosas 18. Indica si este enunciado es verdadero o falso y justifica tu respuesta: La suma de los volúmenes de las sustancias gaseosas que reaccionan es igual a la suma de los volúmenes de las sustancias que se obtienen en una reacción química entre gases El enunciado es falso. En una reacción entre sustancias gaseosas no se cumple la conservación de los volúmenes. 19. Un total de 2 L de hidrógeno reaccionan con 1 L de oxígeno para dar 2 L de agua, medidos todos en las mismas condiciones de presión y temperatura; contradice esta reacción el principio de conservación de la masa? No contradice el principio de conservación de la masa porque se trata de una relación entre los volúmenes de combinación de las sustancias gaseosas. Teoría atómico-ecular 3
4 20. Dibuja un recipiente que contenga en las mismas condiciones de presión y temperatura: a) Un volumen de cloro. b) Dos volúmenes de oxígeno. c) Un volumen de agua. d) Tres volúmenes de cloruro de hidrógeno. e) Dos volúmenes de amoniaco. 21. Se hace reaccionar 1 volumen de hidrógeno con otro volumen igual de gas flúor y se obtienen dos volúmenes de fluoruro de hidrógeno. Todos los gases están medidos en las mismas condiciones de presión y temperatura. a) Representa la reacción en forma de dibujo. b) Explica esta reacción con la ley de Avogadro. c) Por qué la teoría de Dalton no hubiera servido para explicar esta reacción? d) Qué diferencia hay entre el átomo de flúor (F), y la écula de flúor, (F2)? b) Una écula de hidrógeno reacciona con una écula de flúor para dar 2 éculas de fluoruro de hidrógeno. c) Porque para Dalton los gases están constituidos por átomos, no por agregados de átomos o éculas. d) El átomo de flúor, F, es la partícula más pe queña de flúor que puede entrar en juego en una reacción química, y la écula de flúor, F 2, es la forma en que se presenta el flúor en la naturaleza en estado libre. 22. Qué diferencia hay entre el átomo de oxígeno, (O), y la écula de oxígeno, (O2)? El átomo de oxígeno, O, es la partícula más pequeña de oxígeno que puede entrar en juego en una reacción química, y la écula de oxígeno, O 2, es la forma en que se presenta el oxígeno en la naturaleza en estado libre. 23. Escribe de nuevo la teoría cinética de los gases sustituyendo la palabra partícula por écula. a) Los gases están formados por un gran número e éculas (átomos en el caso de gases nobles) muy pequeñas si se comparan con la distancia que las separa. b) Entre écula y écula no hay nada, solo espacio vacío. c) Estas éculas se mueven continuamente y de forma desordenada. d) Las éculas en su movimiento, chocan entre si y contra las paredes del recipiente que contiene el gas. e) La velocidad de las éculas del gas aumenta al elevar la temperatura y disminuye cuando desciende. Teoría atómico-ecular 4
5 24. Escribe de nuevo la teoría cinética de la materia sustituyendo la palabra partícula por átomo o écula. a) La materia está formada por átomos que son tan pequeños que no podemos ver. b) Estos átomos o éculas están en continuo movimiento (dependiendo de su estado de agregación) de forma aleatoria. Cantidad de sustancia, y volumen ar 25. Copia en tu cuaderno y completa la siguiente frase: Un de átomos de plata contiene átomos de plata, y un de éculas de oxígeno contiene éculas de oxígeno. Un de átomos de plata contiene átomos de plata y un de éculas de oxígeno contiene éculas de oxígeno. 26. Dónde hay más éculas: en 1 de hidrógeno, H2, o en un de agua, H2O? Hay el mismo número de éculas. 27. Dónde hay más éculas: en 1 L de cloro, Cl2, o en 1 L de cloruro de hidrógeno, HCl, medidas ambas sustancias en las mismas condiciones de presión y temperatura? Hay el mismo número de éculas. 28. Justifica si el siguiente enunciado es verdadero o falso: 1 de cloro, Cl2, ocupa siempre el mismo volumen que 1 de dióxido de carbono, CO2. Es falso. Para que sea verdadero hay que indicar que ambas sustancias se encuentran en las mismas condiciones de presión y temperatura. 29. Por qué razón el volumen de un de un gas es el mismo para todos los gases? Un de cualquier gas contiene partículas y por lo tanto ocupan siempre el mismo volumen. 30. Calcula el volumen ocupado en condiciones normales de presión y temperatura por las siguientes cantidades de gases: a) 0.3 de hidrógeno. b) 2.5 de metano. c) éculas de dióxido de carbono. d) átomos de neón. a) El volumen es : L b) El volumen es : L 6.72 L 56 L Teoría atómico-ecular 5
6 c) El volumen es : éculas CH 4 23 eculas es CH L d) El volumen es : átomos Ne átomos 0.5 es Ne 22.4 L 0.01 es CH L 0.5 Ne 11.2 L Indica en tu cuaderno cuáles de estas respuestas son verdaderas: para disponer de 2 de gas oxígeno hay que tomar a) 20 L de este gas en condiciones normales de presión y temperatura. b) éculas de este gas. c) éculas de este gas. d) 44.8 L de éste gas en condiciones normales de presión y temperatura. a) Falso; b) Verdadero; c) Falso; d) Verdadero. Conservación de la materia y de la naturaleza 32. Describe todos los pasos y las transformaciones que tienen lugar en el ciclo del carbono. Qué sucedería con los residuos que las bacterias no pueden descomponer o que no pueden ser reciclados artificialmente? Los residuos que las bacterias no pueden descomponer, permanecen en la naturaleza. 33. Describe todos los pasos del ciclo del agua. Cómo vuelve al ciclo (es decir, cómo se recicla) el agua que utilizamos en nuestros hogares? El agua se recicla. Vuelve al ciclo mediante las depuradoras. Teoría atómico-ecular 6
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS
 UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la
 Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
si con 24 g de magnesio reaccionan 6 g de oxígeno pues con 6 g reaccionarán x
 Hoja número 1. 1) Si 24 g de magnesio se combinan exactamente con 16 g de oxígeno para formar óxido de magnesio, a) cuántos gramos de óxido se habrán formado?; b) a partir de 6 g de magnesio cuántos gramos
Hoja número 1. 1) Si 24 g de magnesio se combinan exactamente con 16 g de oxígeno para formar óxido de magnesio, a) cuántos gramos de óxido se habrán formado?; b) a partir de 6 g de magnesio cuántos gramos
La materia. Clasificación de la materia
 27 de marzo de 2005 Contenidos 1 Introducción La materia 2 La materia Qué es la materia? Materia es todo aquello que tiene masa y posee volumen. La materia Qué es la materia? Materia es todo aquello que
27 de marzo de 2005 Contenidos 1 Introducción La materia 2 La materia Qué es la materia? Materia es todo aquello que tiene masa y posee volumen. La materia Qué es la materia? Materia es todo aquello que
QUÍMICA 2º Bachillerato Ejercicios: Cálculos en Química
 1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
TRANSFORMACIONES QUÍMICAS 1.- SUSTANCIAS PURAS, ELEMENTOS Y COMPUESTOS
 TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
H2SO4 (aq)+ NaOH (aq) Na2SO4 (aq)+ H2O (líq)
 1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
TRANSFORMACIONES Y REACCIONES QUÍMICAS
 TRANSFORMACIONES Y REACCIONES QUÍMICAS 1. TRANSFORMACIONES FÍSICAS Y QUÍMICAS a. Transformaciones físicas: Cambios que sufre la materia y que no alteran su naturaleza. (Ej.: el agua al congelarse) b. Transformaciones
TRANSFORMACIONES Y REACCIONES QUÍMICAS 1. TRANSFORMACIONES FÍSICAS Y QUÍMICAS a. Transformaciones físicas: Cambios que sufre la materia y que no alteran su naturaleza. (Ej.: el agua al congelarse) b. Transformaciones
EVOLUCIÓN HISTÓRICA DE LOS MODELOS ATÓMICOS.
 Mapa conceptual. EVOLUCIÓN HISTÓRICA DE LOS MODELOS ATÓMICOS. AUTOR DALTON (1808) THOMSON (1900) RUTHERFORD (1911) HECHOS EN LOS QUE SE BASÓ. Ley de conservación de la masa en las reacciones químicas (Lavoisier,
Mapa conceptual. EVOLUCIÓN HISTÓRICA DE LOS MODELOS ATÓMICOS. AUTOR DALTON (1808) THOMSON (1900) RUTHERFORD (1911) HECHOS EN LOS QUE SE BASÓ. Ley de conservación de la masa en las reacciones químicas (Lavoisier,
todoesquimica.bligoo.cl
 todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
Estructura de los átomos.
 Estructura de los átomos. Teoría atomística de Demócrito: Átomo, del griego: que no se puede cortar. Demócrito, filósofo griego (s. IV a.c.): Si dividimos la materia de forma sucesiva llegará un momento
Estructura de los átomos. Teoría atomística de Demócrito: Átomo, del griego: que no se puede cortar. Demócrito, filósofo griego (s. IV a.c.): Si dividimos la materia de forma sucesiva llegará un momento
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
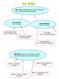 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA. 1. Igualar las siguientes ecuaciones mediante el método algebraico.
 1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
CONCEPTOS BÁSICOS EN QUÍMICA
 CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
Las ecuaciones químicas
 Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
UNIDAD: 7 ESTEQUIOMETRÍA
 UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
TIPOS DE REACCIONES QUIMICAS
 Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
De qué se Compone la Materia?
 8vo Básico> Ciencias Naturales Composición de la materia De qué se Compone la Materia? Observa la siguiente situación y responde las preguntas propuestas: La profesora comienza su clase y pregunta: Profesora:
8vo Básico> Ciencias Naturales Composición de la materia De qué se Compone la Materia? Observa la siguiente situación y responde las preguntas propuestas: La profesora comienza su clase y pregunta: Profesora:
OBJETIVOS Y METODOS DE LA QUIMICA. CLASIFICACIÓN DE LA MATERIA. OBJETIVOS Y METODOS DE LA QUIMICA.
 OBJETIVOS Y METODOS DE LA QUIMICA. CLASIFICACIÓN DE LA MATERIA. OBJETIVOS Y METODOS DE LA QUIMICA. Para reflexionar: la Química forma parte de las Ciencias Naturales, cuyo objetivo último es mejorar las
OBJETIVOS Y METODOS DE LA QUIMICA. CLASIFICACIÓN DE LA MATERIA. OBJETIVOS Y METODOS DE LA QUIMICA. Para reflexionar: la Química forma parte de las Ciencias Naturales, cuyo objetivo último es mejorar las
, que no está formado por moléculas, sino por una red cristalina en la que hay una proporción de dos átomos de flúor por cada átomo de calcio.
 7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
LEYES FUNDAMENTALES DE LA QUÍMICA
 CONTENIDOS LEYES FUNDAMENTALES DE LA QUÍMICA 1.- La Química en la antigüedad. La Alquimia. 2.- Sustancias homogéneas y heterogéneas. Elementos y compuestos. (Repaso)..- Leyes fundamentales de la Química..1.
CONTENIDOS LEYES FUNDAMENTALES DE LA QUÍMICA 1.- La Química en la antigüedad. La Alquimia. 2.- Sustancias homogéneas y heterogéneas. Elementos y compuestos. (Repaso)..- Leyes fundamentales de la Química..1.
Ley de conservación de la masa (Lavoisier)
 LEYES PONDERALES Leyes ponderales Las leyes ponderales son un conjunto de leyes que tienen como objetivo el estudio de las masas de las sustancias, en una reacción química, entre dos o más sustancias.
LEYES PONDERALES Leyes ponderales Las leyes ponderales son un conjunto de leyes que tienen como objetivo el estudio de las masas de las sustancias, en una reacción química, entre dos o más sustancias.
Estequiometría. En química, la estequiometría (del griego "στοιχειον"
 Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría
 1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]
![Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]](/thumbs/40/20756584.jpg) Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
Estructura Atómica y Tabla Periódica
 Estructura Atómica y Tabla Periódica Átomos y Elementos Estructura Atómica y Tabla Periódica Átomo Tabla Periódica Núcleo Electrones Grupos Períodos Protones Neutrones Arreglo de electrones Número atómico
Estructura Atómica y Tabla Periódica Átomos y Elementos Estructura Atómica y Tabla Periódica Átomo Tabla Periódica Núcleo Electrones Grupos Períodos Protones Neutrones Arreglo de electrones Número atómico
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
1.2 LA MATERIA Y LOS CAMBIOS
 1.2 LA MATERIA Y LOS CAMBIOS Por equipo definir que es átomo, molécula y de que están formados Equipo Átomo Molécula 1 2 3 4 5 6 7 8 ÁTOMO 1. Un átomo es eléctricamente neutro. tiene el mismo número
1.2 LA MATERIA Y LOS CAMBIOS Por equipo definir que es átomo, molécula y de que están formados Equipo Átomo Molécula 1 2 3 4 5 6 7 8 ÁTOMO 1. Un átomo es eléctricamente neutro. tiene el mismo número
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Sistemas Físicos y Químicos
 1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
QUÍMICA I. TEMA 1: Estado Físico de la materia
 QUÍMICA I TEMA 1: Estado Físico de la materia Tecnólogo Minero - 2014 E s q u e m a d e l a C l a s e Tema 1: Estado físico de la materia La materia Clasificación de la materia Estado Sólido, liquido y
QUÍMICA I TEMA 1: Estado Físico de la materia Tecnólogo Minero - 2014 E s q u e m a d e l a C l a s e Tema 1: Estado físico de la materia La materia Clasificación de la materia Estado Sólido, liquido y
Cuaderno de Repaso para Alumnos Pendientes con la asignatura de 3º ESO Física-Química
 Departamento de Física y Química Cuaderno de Repaso para Alumnos Pendientes con la asignatura de 3º ESO Física-Química CAMBIO DE UNIDADES Repaso Global 3ºESO FyQ 1. Cuáles son las magnitudes fundamentales
Departamento de Física y Química Cuaderno de Repaso para Alumnos Pendientes con la asignatura de 3º ESO Física-Química CAMBIO DE UNIDADES Repaso Global 3ºESO FyQ 1. Cuáles son las magnitudes fundamentales
Resolución de Cuestiones
 La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN
 PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN 1) Razona si los procesos siguientes son físicos o químicos: a. La fermentación del azúcar. b. Formación de hielo. c. Destrucción de la
PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN 1) Razona si los procesos siguientes son físicos o químicos: a. La fermentación del azúcar. b. Formación de hielo. c. Destrucción de la
CONCEPTOS BÁSICOS DE QUÍMICA
 CONCEPTOS BÁSICOS DE QUÍMICA IES La Magdalena. Avilés. Asturias Los átomos de distintos elementos pueden unirse mediante un enlace (iónico o covalente) formando un compuesto. Cuando se forma un compuesto
CONCEPTOS BÁSICOS DE QUÍMICA IES La Magdalena. Avilés. Asturias Los átomos de distintos elementos pueden unirse mediante un enlace (iónico o covalente) formando un compuesto. Cuando se forma un compuesto
Ley de conservación de la masa (Lavoisier)
 LEYES PONDERALES Leyes ponderales Las leyes ponderales son un conjunto de leyes que tienen como objetivo el estudio de las masas de las sustancias, en una reacción química, entre dos o más sustancias.
LEYES PONDERALES Leyes ponderales Las leyes ponderales son un conjunto de leyes que tienen como objetivo el estudio de las masas de las sustancias, en una reacción química, entre dos o más sustancias.
Tema 13: La materia Ciencias Naturales 1º ESO página 1. Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
 Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
Tema 0. Conceptos Básicos en Química. Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones
 Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
REACCIONES QUÍMICAS : TRANSFORMACIONES DE MATERIALES.
 REACCIONES QUÍMICAS : TRANSFORMACIONES DE MATERIALES. Para qué se estudian las reacciones químicas? El estudio de una reacción permite entender qué sucede con los átomos y sus uniones, cuales son las que
REACCIONES QUÍMICAS : TRANSFORMACIONES DE MATERIALES. Para qué se estudian las reacciones químicas? El estudio de una reacción permite entender qué sucede con los átomos y sus uniones, cuales son las que
Unidades de masa atómica
 Unidades de masa atómica La estructura química y las fórmulas químicas sirven para estudiar las relaciones de masa de átomos y moléculas. Estas relaciones ayudan a explicar la composición de los compuestos
Unidades de masa atómica La estructura química y las fórmulas químicas sirven para estudiar las relaciones de masa de átomos y moléculas. Estas relaciones ayudan a explicar la composición de los compuestos
EJERCICIOS DE EQUILIBRIO QUÍMICO.
 EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
El mol. Chema Martín, 3º ESO. 2016
 El mol Chema Martín, 3º ESO. 2016 El mol Es el concepto fundamental de la química. Todos los cálculos que haremos a partir de ahora se basarán en él, por eso es muy importante entenderlo correctamente
El mol Chema Martín, 3º ESO. 2016 El mol Es el concepto fundamental de la química. Todos los cálculos que haremos a partir de ahora se basarán en él, por eso es muy importante entenderlo correctamente
MASA ATÓMICA MASA MOLECULAR. Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1
 Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1 MASA ATÓMICA Al igual que ocurre en la materia ordinaria (piensa en las distintas variedades de panes en tamaño, composición y peso,
Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1 MASA ATÓMICA Al igual que ocurre en la materia ordinaria (piensa en las distintas variedades de panes en tamaño, composición y peso,
GASES - PREGUNTAS DE TEST
 GASES - PREGUNTAS DE TEST A - CONCEPTOS GENERALES B - LEYES GENERALES DE LOS GASES IDEALES: C- LEY DE GRAHAM DE LA DIFUSIÓN D- TEORÍA CINÉTICA A - CONCEPTO DE GAS-VAPOR A-1 - Un vapor es A - Cualquier
GASES - PREGUNTAS DE TEST A - CONCEPTOS GENERALES B - LEYES GENERALES DE LOS GASES IDEALES: C- LEY DE GRAHAM DE LA DIFUSIÓN D- TEORÍA CINÉTICA A - CONCEPTO DE GAS-VAPOR A-1 - Un vapor es A - Cualquier
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
2. Ordena las letras para obtener los nombres de los cambios de estado que se definen en cada casilla.
 1. Observa las figuras, lee los textos y responde: Un trozo de mármol no varía su forma si lo cambiamos de posición. Su volumen tampoco cambia aunque lo apretemos con la mano. Podemos cambiar la forma
1. Observa las figuras, lee los textos y responde: Un trozo de mármol no varía su forma si lo cambiamos de posición. Su volumen tampoco cambia aunque lo apretemos con la mano. Podemos cambiar la forma
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
Colegio Superior de Señoritas Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 -
 Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Complete el siguiente cuadro calculando en cada caso los valores faltantes. Características de algunas especies químicas Especie química
Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Complete el siguiente cuadro calculando en cada caso los valores faltantes. Características de algunas especies químicas Especie química
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia.
 TEMA 02 Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia. -.-.-.-.-.-.-.-.-..-..-..-..-..-..-.-..-..-..-..-..-.-..-.-..-.-.-.-..-.-...-..-.-..-.-..-.-..-.-..-.-..-.-..-.-..-.-
TEMA 02 Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia. -.-.-.-.-.-.-.-.-..-..-..-..-..-..-.-..-..-..-..-..-.-..-.-..-.-.-.-..-.-...-..-.-..-.-..-.-..-.-..-.-..-.-..-.-..-.-
CAMBIOS FÍSICOS Y QUÍMICOS
 CAMBIOS FÍSICOS Y QUÍMICOS En nuestro entorno las cosas cambian y se transforman constantemente. Constantemente se producen cambios físicos y cambios químicos. 1. LOS CAMBIOS FÍSICOS En los cambios Físicos:
CAMBIOS FÍSICOS Y QUÍMICOS En nuestro entorno las cosas cambian y se transforman constantemente. Constantemente se producen cambios físicos y cambios químicos. 1. LOS CAMBIOS FÍSICOS En los cambios Físicos:
Contenido de Física y Química Conceptos y ejercicios - 13-14
 Contenido de Física y Química Conceptos y ejercicios - 13-14 Concepto Teoría (Conceptos) Práctica (Ejercicios) Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Óxidos ácidos (NM+O) Nomenclatura.
Contenido de Física y Química Conceptos y ejercicios - 13-14 Concepto Teoría (Conceptos) Práctica (Ejercicios) Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Óxidos ácidos (NM+O) Nomenclatura.
TEÓRICO-PRÁCTICO N 2: ESTEQUIOMETRÍA DE LA MOLÉCULA
 TEÓRICO-PRÁCTICO N 2: ESTEQUIOMETRÍA DE LA MOLÉCULA FUNDAMENTO TEÓRICO La estequiometría es el área de la química que estudia las cantidades de reactivos y productos que intervienen en una reacción química,
TEÓRICO-PRÁCTICO N 2: ESTEQUIOMETRÍA DE LA MOLÉCULA FUNDAMENTO TEÓRICO La estequiometría es el área de la química que estudia las cantidades de reactivos y productos que intervienen en una reacción química,
La materia y sus propiedades
 SECCIÓN 1.2 La materia y sus propiedades Todo lo que te rodea está formado por materia. Los libros, los escritorios, las computadoras, los árboles y los edificios están formados por materia, al igual que
SECCIÓN 1.2 La materia y sus propiedades Todo lo que te rodea está formado por materia. Los libros, los escritorios, las computadoras, los árboles y los edificios están formados por materia, al igual que
Materia: Todo aquello que existe en el universo, que posee masa y está ocupando un lugar en el
 LA QUÍMICA La química estudia la naturaleza de la materia, su composición, propiedades, transformaciones que sufre y las leyes que gobiernan esos cambios. Materia: Todo aquello que existe en el universo,
LA QUÍMICA La química estudia la naturaleza de la materia, su composición, propiedades, transformaciones que sufre y las leyes que gobiernan esos cambios. Materia: Todo aquello que existe en el universo,
2,21 g de magnesio 7 g magnesio+ 4,59 g oxígeno=
 Compuesto Tetróxido de dinitrógeno Alcohol etílico Glucosa Propano Dióxido de carbono Fórmula molecular Fórmula empírica N O 4 C H 6 O C 6 H 1 O 6 C H 8 CO NO C H 6 O CH O C H 8 CO 1. Justifica si un compuesto
Compuesto Tetróxido de dinitrógeno Alcohol etílico Glucosa Propano Dióxido de carbono Fórmula molecular Fórmula empírica N O 4 C H 6 O C 6 H 1 O 6 C H 8 CO NO C H 6 O CH O C H 8 CO 1. Justifica si un compuesto
Refuerzo Modelos atómicos
 Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
Elemento Neutrones Protones Electrones
 PROBLEMAS DE ÁTOMOS 1. Argumenta cómo se explica la ley de conservación de la masa en las reacciones químicas mediante su teoría atómica de Dalton. Calcula cuánto carbono se necesita para reaccionar exactamente
PROBLEMAS DE ÁTOMOS 1. Argumenta cómo se explica la ley de conservación de la masa en las reacciones químicas mediante su teoría atómica de Dalton. Calcula cuánto carbono se necesita para reaccionar exactamente
Leyes clásicas de las reacciones químicas
 Leyes clásicas de las reacciones químicas Leyes ponderales Relativas a la masa de reactivos y productos en un reacción química. Instrumento de medida. La balanza - Ley de conservación de la masa. Lavoisier
Leyes clásicas de las reacciones químicas Leyes ponderales Relativas a la masa de reactivos y productos en un reacción química. Instrumento de medida. La balanza - Ley de conservación de la masa. Lavoisier
1. Las propiedades de los gases
 1. Las propiedades de los gases Para establecer por qué las diferentes sustancias tienen unas propiedades características de cada una de ellas (densidades, puntos de cambios de estado, solubilidad en agua,
1. Las propiedades de los gases Para establecer por qué las diferentes sustancias tienen unas propiedades características de cada una de ellas (densidades, puntos de cambios de estado, solubilidad en agua,
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar:
 1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p
 1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA
 UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos tienen un núcleo muy pequeño donde se concentra casi toda
UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos tienen un núcleo muy pequeño donde se concentra casi toda
Butano(g) -124,7 Dióxido de carbono(g) -393 Agua(l) -286
 1.- Dada la reacción de combustión del butano: Butano(g) + oxígeno (g) ======== dióxido de carbono(gas) + agua (gas) Sabiendo que es una reacción exotérmica, indica si a la misma temperatura, el calor
1.- Dada la reacción de combustión del butano: Butano(g) + oxígeno (g) ======== dióxido de carbono(gas) + agua (gas) Sabiendo que es una reacción exotérmica, indica si a la misma temperatura, el calor
FÍSICA Y QUÍMICA 3ºESO
 TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3ºESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. Por ejemplo siempre tienen
TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3ºESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. Por ejemplo siempre tienen
Sistemas materiales. Sustancias puras Mezclas. Dos o mas componentes. Homogénas
 Sistemas materiales Sustancias puras Mezclas Un solo componente Dos o mas componentes Simples Compuestas Homogénas Heterogénas Un solo tipo de átomo. Cl,Fe, O 2,Ca,Na Dos o mas tipos de átomos. H 2 O,
Sistemas materiales Sustancias puras Mezclas Un solo componente Dos o mas componentes Simples Compuestas Homogénas Heterogénas Un solo tipo de átomo. Cl,Fe, O 2,Ca,Na Dos o mas tipos de átomos. H 2 O,
QUÍMICA GENERAL II 23079 Grupo B1 Profesor: Claude A Ewert
 QUÍMICA GENERAL II 23079 Grupo B1 Profesor: Claude A Ewert Examen Parcial No 1 Solución del Profesor Materia Teoría Atómica Masas atómicas - Composición 29 de abril de 2015 NOMBRE CÓDIGO NOTA Presentación:
QUÍMICA GENERAL II 23079 Grupo B1 Profesor: Claude A Ewert Examen Parcial No 1 Solución del Profesor Materia Teoría Atómica Masas atómicas - Composición 29 de abril de 2015 NOMBRE CÓDIGO NOTA Presentación:
TEMA 3: La materia. Propiedades eléctricas y el átomo. 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos.
 Física y Química Curso 2012/13 3º E.S.O. TEMA 3: La materia. Propiedades eléctricas y el átomo. 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A
Física y Química Curso 2012/13 3º E.S.O. TEMA 3: La materia. Propiedades eléctricas y el átomo. 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A
PCPI Ámbito Científico-Tecnológico LA MATERIA
 LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
Física y Química 1º Bachillerato LOMCE
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 201 2016 Unidad Didáctica 1 Rev 01 Las Leyes Ponderales y Las Leyes de los Gases Ideales 1.1 Las
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 201 2016 Unidad Didáctica 1 Rev 01 Las Leyes Ponderales y Las Leyes de los Gases Ideales 1.1 Las
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS
 PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
Cambios en la Materia. Sra. Anlinés Sánchez Otero
 Cambios en la Materia Sra. Anlinés Sánchez Otero Cambios en la Materia Cambios Físicos Químicos Cambios Físicos Alteran la sustancia sin modificar su composición. Se utilizan para separar mezclas e identificar
Cambios en la Materia Sra. Anlinés Sánchez Otero Cambios en la Materia Cambios Físicos Químicos Cambios Físicos Alteran la sustancia sin modificar su composición. Se utilizan para separar mezclas e identificar
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES
 TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
TRANSFORMACIONES QUÍMICAS
 TRANSFORMACIONES QUÍMICAS CAMBIOS FÍSICOS Y CAMBIOS QUÍMICOS Todas las sustancias pueden transformarse y pasar de un estado inicial a otro final si se las somete a determinadas condiciones. Por ejemplo,
TRANSFORMACIONES QUÍMICAS CAMBIOS FÍSICOS Y CAMBIOS QUÍMICOS Todas las sustancias pueden transformarse y pasar de un estado inicial a otro final si se las somete a determinadas condiciones. Por ejemplo,
FÓRMULAS EMPÍRICA Y MOLECULAR
 FÓRMULAS EMPÍRICA Y MOLECULAR 1.- Un cierto compuesto X está formado por un 33,3% del elemento A y un 66,7% del elemento B. Cuántos gramos de X se formarán cuando se mezclan 3,98 gramos de A con 6,23 gramos
FÓRMULAS EMPÍRICA Y MOLECULAR 1.- Un cierto compuesto X está formado por un 33,3% del elemento A y un 66,7% del elemento B. Cuántos gramos de X se formarán cuando se mezclan 3,98 gramos de A con 6,23 gramos
1010 DEPARTAMENTO DE FÍSICA Y QUÍMICA 2º Bachillerato QUÍMICA
 1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
Departamento de Física y Química Adaptaciones 3º E.S.O.
 Los elementos químicos se ordenan en la Tabla de los elementos (Tabla periódica) siguiendo el criterio de número atómico creciente, es decir, según el número de protones que tienen en el núcleo. El primer
Los elementos químicos se ordenan en la Tabla de los elementos (Tabla periódica) siguiendo el criterio de número atómico creciente, es decir, según el número de protones que tienen en el núcleo. El primer
TEORÍA CINÉTICA. CAMBIOS DE ESTADO 3ºESO
 1. ESTADOS DE AGREGACIÓN DE LA MATERIA La materia se puede encontrar en la naturaleza en tres estados de agregación o estados físicos: sólido, líquido y gaseoso. Estos estados poseen unas propiedades que
1. ESTADOS DE AGREGACIÓN DE LA MATERIA La materia se puede encontrar en la naturaleza en tres estados de agregación o estados físicos: sólido, líquido y gaseoso. Estos estados poseen unas propiedades que
I. TEORÍA ATÓMICO-MOLECULAR
 Índice 1. La materia 2. Clasificación de la materia 3. Leyes ponderales 4. Teoría atómica de Dalton 5. Leyes volumétricas 6. La unidad de cantidad de materia: el mol 2 1 La materia Materia es todo aquello
Índice 1. La materia 2. Clasificación de la materia 3. Leyes ponderales 4. Teoría atómica de Dalton 5. Leyes volumétricas 6. La unidad de cantidad de materia: el mol 2 1 La materia Materia es todo aquello
Materia: FÍSICA Y QUÍMICA 3º E.S.O Curso
 ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
CONCEPTOS GENERALES (A)
 CONCEPTOS GENERALES DE QUÍMICA. PREGUNTAS DE TEST )))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))- A- CONCEPTOS GENERALES B- TIPOS DE SISTEMAS QUÍMICOS: C- TIPOS DE REACCIONES: D- ÁTOMOS,
CONCEPTOS GENERALES DE QUÍMICA. PREGUNTAS DE TEST )))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))- A- CONCEPTOS GENERALES B- TIPOS DE SISTEMAS QUÍMICOS: C- TIPOS DE REACCIONES: D- ÁTOMOS,
Los símbolos químicos son distintos signos abreviados que se utilizan para identificar los elementos y compuestos químicos en lugar de sus nombres
 Los símbolos químicos son distintos signos abreviados que se utilizan para identificar los elementos y compuestos químicos en lugar de sus nombres completos. La mayoría de los símbolos se derivan de las
Los símbolos químicos son distintos signos abreviados que se utilizan para identificar los elementos y compuestos químicos en lugar de sus nombres completos. La mayoría de los símbolos se derivan de las
TEMA 1: LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES
 Nombre Grupo TEMA 1: LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES 5. Realiza cálculos y expresa las siguientes cantidades en unidades del Sistema Internacional. a) 237 mm b) 50 horas 1. Cuándo una hipótesis
Nombre Grupo TEMA 1: LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES 5. Realiza cálculos y expresa las siguientes cantidades en unidades del Sistema Internacional. a) 237 mm b) 50 horas 1. Cuándo una hipótesis
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq
 qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq Actividades de recuperación de 2º trimestre 3º ESO wertyuiopasdfghjklzxcvbnmqwertyui
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq Actividades de recuperación de 2º trimestre 3º ESO wertyuiopasdfghjklzxcvbnmqwertyui
EL INTERIOR DE LA MATERIA. De qué está hecha la materia?
 EL INTERIOR DE LA MATERIA De qué está hecha la materia? Esta cuestión ha preocupado a los seres humanos desde los tiempos más remotos. Algunas de las ideas propuestas a lo largo de la historia, más o menos
EL INTERIOR DE LA MATERIA De qué está hecha la materia? Esta cuestión ha preocupado a los seres humanos desde los tiempos más remotos. Algunas de las ideas propuestas a lo largo de la historia, más o menos
GUIA DE ESTUDIO PARA EXAMEN EXTRAORDINARIO DE QUÍMICA TERCER GRADO DE SECUNDARIA 2013-2014
 GUIA DE ESTUDIO PARA EXAMEN EXTRAORDINARIO DE QUÍMICA TERCER GRADO DE SECUNDARIA 2013-2014 - Qué es química orgánica? - Escribe la formula y nombre de dos compuestos orgánicos. - Qué función realiza el
GUIA DE ESTUDIO PARA EXAMEN EXTRAORDINARIO DE QUÍMICA TERCER GRADO DE SECUNDARIA 2013-2014 - Qué es química orgánica? - Escribe la formula y nombre de dos compuestos orgánicos. - Qué función realiza el
8 Sistema periódico y enlace
 8 Sistema periódico y enlace 1. Qué queremos decir cuando afirmamos que la mayor parte del átomo está vacía? 2. Indica el número de protones, neutrones y electrones correspondiente a los siguientes isótopos:
8 Sistema periódico y enlace 1. Qué queremos decir cuando afirmamos que la mayor parte del átomo está vacía? 2. Indica el número de protones, neutrones y electrones correspondiente a los siguientes isótopos:
Descripción de los 3 estados de la materia. Química General II Estado Gaseoso
 Descripción de los 3 estados de la materia Química General II Estado Gaseoso Clasificación de los Estados de la Materia. Gases Líquidos Sólidos 1. Carecen de forma definida, llenan completamente el recipiente.
Descripción de los 3 estados de la materia Química General II Estado Gaseoso Clasificación de los Estados de la Materia. Gases Líquidos Sólidos 1. Carecen de forma definida, llenan completamente el recipiente.
6. ELEMENTOS Y COMPUESTOS
 6. ELEMENTOS Y COMPUESTOS 1. Cuáles son metales y cuáles no metales de los siguientes elementos: carbono, azufre, cobre y aluminio? Por qué? Son metales el cobre y el aluminio, y son no metales el carbono
6. ELEMENTOS Y COMPUESTOS 1. Cuáles son metales y cuáles no metales de los siguientes elementos: carbono, azufre, cobre y aluminio? Por qué? Son metales el cobre y el aluminio, y son no metales el carbono
TEMA 3. CLASIFICACIÓN DE LA MATERIA.
 TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
Cantidad de sustancia. Gases. Disoluciones.
 1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
3. MATERIA Y PARTÍCULAS
 . MAERIA Y ARÍCULAS El estado gaseoso 1. Quién utilizó por primera vez la palabra gas para designar uno de los estados de la materia? Qué significa esta palabra? Johann van Helmont fue el primero que utilizó
. MAERIA Y ARÍCULAS El estado gaseoso 1. Quién utilizó por primera vez la palabra gas para designar uno de los estados de la materia? Qué significa esta palabra? Johann van Helmont fue el primero que utilizó
Tema 2. Estequiometría
 Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
FÍSICA Y QUÍMICA 1º BACH. ALGUNOS EJERCICIOS RESUELTOS. TEMA 2:
 Física y Química 1º Bachillerato Tema. Naturaleza de la materia. ejercicios resueltos - 1 - FÍSICA Y QUÍMICA 1º BACH. ALGUNOS EJERCICIOS RESUELTOS. TEMA : LEY DE LA CONSERVACIÓN DE LA MASA (LAVOISIER)
Física y Química 1º Bachillerato Tema. Naturaleza de la materia. ejercicios resueltos - 1 - FÍSICA Y QUÍMICA 1º BACH. ALGUNOS EJERCICIOS RESUELTOS. TEMA : LEY DE LA CONSERVACIÓN DE LA MASA (LAVOISIER)
Física y Química - 3º ESO
 C O L L E G I S A N A N T O N I O D E P A D U A F R A N C I S C A N S L C A R C A I X E N T C U R S 2 0 1 1 / 2 0 1 2 Física y Química - 3º ESO Tema 1 La ciencia y su método. Medida de magnitudes. Anexo
C O L L E G I S A N A N T O N I O D E P A D U A F R A N C I S C A N S L C A R C A I X E N T C U R S 2 0 1 1 / 2 0 1 2 Física y Química - 3º ESO Tema 1 La ciencia y su método. Medida de magnitudes. Anexo
