Tema 1 ESTRUCTURA Y PROPIEDADES DE LAS
|
|
|
- Natalia Martín Peralta
- hace 7 años
- Vistas:
Transcripción
1 Tema 1 ESTRUCTURA Y PROPIEDADES DE LAS MOLÉCULAS ORGÁNICAS Miguel Carda y Eva Falomir Universidad Jaume I
2 TEMA 1 ESTRUCTURA Y PROPIEDADES DE LAS MOLÉCULAS ORGÁNICAS
3
4 BLOQUE TEMÁTICO I: ESTRUCTURA Y PROPIEDADES DE LAS MOLÉCULAS ORGÁNICAS Unidad temática I.1: Conceptos fundamentales en Química Orgánica I.1.1. La Química Orgánica como ciencia. I.1.2. El enlace en las moléculas orgánicas. I El enlace simple Carbono-Carbono I El doble enlace Carbono-Carbono I El triple enlace Carbono-Carbono I.1.3. Electronegatividad y polaridad I.1.4. Efecto inductivo Unidad temática I.2 I.2.1. Enlaces deslocalizados: Efecto resonante I Energía de resonancia I.2.2. Aromaticidad. Unidad temática I.3. Propiedades de los compuestos orgánicos I.3.1. Enlaces más débiles que el enlace covalente I Las fuerzas, o interacciones, de Van der Waals I a. Fuerzas dipolo permanente-dipolo permanente (fuerzas de Keesom) I b. Fuerzas dipolo permanente-dipolo inducido (fuerzas de Debye) I c. Fuerzas de dispersión de London I Interacciones intermoleculares por puente de hidrógeno I.3.2. Estructura y propiedades físicas de los compuestos orgánicos I Puntos de ebullición I Solubilidad I.3.3. Acidez en las moléculas orgánicas Factores internos que influencian la acidez de los compuestos orgánicos a. Electronegatividad del átomo que soporta la carga negativa b. Tamaño del átomo que soporta la carga negativa c. Efecto inductivo d. Efecto resonante e. ibridación del átomo que soporta la carga negativa f. Efectos estéricos I f. Influencia de otros efectos sobre la fuerza ácida I Factores externos que influencia la acidez de los compuestos orgánicos I.3.4. Basicidad en las moléculas orgánicas I Efecto inductivo y de solvatación en la fuerza básica I Efecto resonante y fuerza básica
5
6 Bloque Temático I. Estructura de las moléculas orgánicas ( 1 Unidad temática I.1: Conceptos fundamentales en Química Orgánica I.1.1. La Química Orgánica como ciencia La Química Orgánica se ocupa del estudio de las propiedades y transformaciones de los compuestos que contienen el elemento carbono. El elevado número y complejidad de estos compuestos se debe a las características de enlazamiento del carbono, que puede formar enlaces hasta con cuatro átomos más. Además, este elemento se puede unir a otros átomos de carbono para dar lugar a largas cadenas constituidas por cientos e incluso miles de átomos. El carbono puede formar enlaces estables con muchos átomos distintos de la tabla periódica y además, puede formar diferentes tipos de enlaces: simples, dobles o triples. La diversidad de la química que tiene como base el carbono no es sorprendente si se piensa en las diferencias que presentan las formas del carbono elemental: diamante y grafito. El diamante es duro e incoloro mientras que el grafito es suave y negro. Estas diferencias en las propiedades de las distintas formas del carbono son consecuencia de las diferencias estructurales que presentan dichas formas. La Química Orgánica, junto con la Bioquímica, es la ciencia básica que permite explicar los procesos químicos que tienen lugar en los organismos vivos. De hecho, el nombre Química Orgánica proviene de la antigua creencia de que ciertas sustancias sólo podían ser producidas por organismos vivos. Los pueblos prehistóricos hicieron uso de las propiedades de algunos compuestos orgánicos y realizaron algunas reacciones químico-orgánicas. Los antiguos egipcios, los romanos y los fenicios emplearon varios colorantes que eran verdaderos compuesto químicos puros: el índigo, la alizarina y la legendaria púrpura de Tiro. Los dos primeros colorantes se aislaron de las plantas y el último se obtuvo en pequeñas cantidades a partir de una especie rara de molusco. Desde muy antiguo se sabía que la grasa animal se podía convertir en jabón por tratamiento con lejía. asta época tan reciente como 1948, los químicos orgánicos no pudieron sintetizar productos que fueran capaces de competir con el jabón (detergentes). La fermentación del almidón y de los azúcares para obtener alcohol se conoce desde tiempos prehistóricos y el método que se aplica en la actualidad no difiere mucho del que se ideó hace cientos de años. La Química Orgánica, tal y como hoy la conocemos, arranca de finales del siglo XVIII cuando se inició el aislamiento de sustancias orgánicas de extractos de origen natural. En este orden de cosas son dignos de mención los estudios que el alemán Carl Scheele llevó a cabo entre los años 1769 a 1786 sobre aislamiento de diversos compuestos orgánicos de fuentes naturales. En 1784, Lavoisier ideó un método, basado en la combustión de la materia orgánica, que permitía determinar los porcentajes de carbono, hidrógeno, oxígeno y nitrógeno que constituían los compuestos orgánicos. En 1807, el químico sueco Berzelius denominó, con el nombre de compuestos orgánicos, a aquellos compuestos derivados de los seres vivos o de la materia viva. Durante todo el siglo XIX, Berzelius y otros químicos creyeron que tales compuestos poseían una fuerza vital y que, por tanto, sería imposible sintetizar un compuesto orgánico a partir de materiales inorgánicos. La teoría de la fuerza vital fue declinando a medida que la aportación creciente de datos analíticos evidenciaba que las leyes químicas que gobernaban el comportamiento de la materia inorgánica eran también válidas para los compuestos orgánicos.
7 2 Bloque Temático I. Estructura de las moléculas orgánicas ( La teoría de la fuerza vital sufrió un gran revés en 1828, año en el que Wöhler consiguió sintetizar la urea por descomposición térmica del isocianato amónico. Según la clasificación de Berzelius la urea era un compuesto orgánico, poseedor de fuerza vital y, por tanto, imposible de ser sintetizado a partir de compuestos clasificados como inorgánicos: N 4 NCO 2 N O N 2 Isocianato amónico Urea La síntesis de la urea obligó a un replanteamiento de la definición de compuesto orgánico, pasándose a denominar como tal todo compuesto que contuviese carbono en su estructura. Durante el primer tercio de siglo XIX investigadores como Gay-Lussac, Liebig y Berzelius descubrieron y perfeccionaron nuevos métodos analíticos que permitieron determinar la clase de elementos, así como su proporción, que constituían los compuestos orgánicos. acia mitad del siglo XIX, el desarrollo incipiente de la síntesis orgánica permitió la preparación de compuestos orgánicos a partir de materiales de partida relativamente simples. Uno de los aspectos de la Química que se resistía a los esfuerzos de las mentes más brillantes del siglo XIX era el relacionado con la estructura de los compuestos orgánicos. Se sabía, por ejemplo, que el alcohol etílico y el dimetiléter tenían la misma fórmula molecular, C 2 6O, pero mientras que el primero es un líquido con punto de ebullición 78 C, el segundo es un gas. Los químicos del siglo XIX pensaron que las diferentes propiedades químicas que presentaban compuestos con la misma fórmula molecular se tenían que deber a la forma en la que se ordenaban los átomos en la estructura molecular. I.1.2. El enlace en las moléculas orgánicas En 1858 Kekulé propuso una teoría estructural que permitía asignar la estructura de los compuestos orgánicos más simples. Esta teoría se basaba en la tetravalencia del átomo de carbono y en el concepto de enlace químico, y fue la base de partida para la asignación de las estructuras de moléculas orgánicas sencillas, tales como el metano, el etano o el propano. La teoría estructural de Kekulé permitió explicar el fenómeno de la isomería, es decir la presencia de diferentes propiedades físicas y/o químicas en compuestos con la misma fórmula molecular. En 1916, la introducción del concepto de enlace covalente por el químico estadounidense Lewis proporcionó la base que permitió relacionar las estructuras de las moléculas orgánicas y sus propiedades químicas. Según Lewis una capa llena de electrones es especialmente estable y los átomos transfieren o comparten electrones para tratar de alcanzar una capa llena de electrones y alcanzar, así, la estructura electrónica estable similar a la del gas noble más próximo, que normalmente contiene 8 electrones en su capa más externa. La tendencia de los átomos a adquirir la configuración electrónica externa de 8 electrones se la conoce como regla del octeto. Cuando dos átomos comparten dos electrones entre sí se forma entre ellos un enlace covalente. Los átomos, de acuerdo con su configuración electrónica, pueden cumplir la regla del octeto con pares de electrones compartidos (electrones enlazantes) y pares de electrones sin compartir (electrones no enlazantes).
8 Química Orgánica I- 3 Las estructuras de Lewis utilizan un punto para representar a un electrón de valencia, y un par de puntos o una línea para representar a pares de electrones. A continuación, se indica la representación de Lewis de algunas moléculas orgánicas, como el etano, la metilamina, el metanol y el clorometano. Nótese que estas tres últimas contienen átomos que consiguen su octeto electrónico mediante la suma de electrones enlazantes y no enlazantes, como el caso del átomo de nitrógeno de la metilamina, del átomo de oxígeno del metanol, o del átomo de cloro del clorometano. Representación de Lewis de algunos compuestos orgánicos C C C N C C O C Cl Etano Metilamina Etanol Clorometano I El enlace simple Carbono-Carbono El compuesto orgánico más simple es el metano C 4, que como es sabido tiene estructura tetraédrica. La justificación de esta estructura vino de la mano de la teoría mecanocuántica. Así, un átomo de carbono en su estado fundamental tiene dos electrones desapareados. energía creciente n=2 2p 2s n=1 1s estado electrónico fundamental del carbono Se debería esperar que en lugar de formar C 4, el carbono se uniera sólo a dos átomos de hidrógeno y formara C 2, dejando vacío un orbital 2p. El C 2 es una especie química conocida, llamada carbeno, pero es una sustancia muy reactiva y de tiempo de vida media muy corto. Por adición de 96 kcal/mol de energía a un átomo de carbono, uno de los electrones 2s puede promocionarse hasta alcanzar el orbital vacío 2p, dando lugar a la configuración electrónica indicada a continuación:
9 4 Bloque Temático I. Estructura de las moléculas orgánicas ( energía creciente n=2 2p 2s n=1 1s estado electrónico del átomo de carbono excitado Al promocionar un electrón desde el orbital 2s al 2p el átomo de carbono tiene disponibles cuatro electrones para formar cuatro enlaces covalentes y de esta forma puede conseguir la configuración electrónica de gas noble. La formación de un enlace covalente produce un descenso de energía en el sistema. Por ejemplo, la formación de un enlace C- produce un descenso de energía de 87 kcal/mol. Por tanto, la formación de dos enlaces covalentes más en el átomo de carbono provoca un descenso de 174 kcal/mol de energía, que compensa sobradamente los 96 kcal/mol que se requieren para promover al átomo de carbono desde el estado fundamental al estado excitado. Este razonamiento explica por qué el átomo de carbono tiende a ser tetravalente en lugar de divalente. Sin embargo, no explica la forma tetraédrica de la molécula de metano. Si admitimos que el átomo de carbono en la molécula de metano participa con el orbital 2s y los tres orbitales 2p, hay que concluir que se formarían tres enlaces covalentes por solapamiento C 2p- 1s, y el cuarto enlace covalente se formaría por solapamiento C 2s- 1s. Esto significaría que tres de los ángulos -C- serían de 90º, y los otros quedarían indeterminados. El sistema de un orbital 2s y tres orbitales 2p, mutuamente perpendiculares, es una solución satisfactoria aproximada para la ecuación de Schroedinger para la capa n=2, pero pueden formularse combinaciones lineales de estos cuatro orbitales que también sean soluciones satisfactorias para la ecuación de Schroedinger. Matemáticamente está permitido combinar los orbitales 2s y 2p de cualquier modo, con la condición de que en la formación de los cuatro
10 Química Orgánica I- 5 orbitales nuevos se empleen exactamente un orbital s y tres p. Una forma de llevar a cabo tal combinación consiste en formar cuatro orbitales nuevos, cada uno de los cuales tiene ¼ de carácter s y ¾ de carácter p. Los cuatro orbitales híbridos son entonces equivalentes entre sí y, teniendo en cuenta que contienen triple carácter p que s, se les denomina híbridos sp 3. El contorno de densidad electrónica de un orbital sp 3 presenta dos lóbulos, como un orbital p, pero en este caso los lóbulos son bastante desiguales en tamaño. Diagrama de contorno de densidad electrónica de un orbital híbrido sp 3 Para formar un enlace fuerte es necesario que los electrones estén situados entre los núcleos de los átomos. Un orbital sp 3 puede situar mucha más densidad electrónica, en una dirección determinada, que la que sitúa un orbital s o un orbital p. Por consiguiente, un enlace covalente que se forme con la participación de un orbital sp 3 del átomo de carbono será más fuerte que un enlace covalente en el que participe un orbital p o un orbital s. La energía de un enlace covalente que se forma mediante el solapamiento entre el orbital híbrido sp 3 del carbono y el orbital 1s del hidrógeno es de 103 kcal/mol, mientras que los enlaces covalentes correspondientes C 2p- 1s y C 2s- 1s tienen una energía de 60 kcal/mol y 80 kcal/mol. Los cuatro orbitales híbridos sp 3 del carbono se sitúan en direcciones tales que forman entre ellos ángulos de 109.5º, como si se dirigieran hacia los vértices de un tetraedro regular. Densidad electrónica alrededor de un átomo de carbono con hibridación sp 3. La densidad electrónica total es esférica Los orbitales híbridos sp 3 dan la mejor explicación para la formación de enlaces en los hidrocarburos saturados porque el átomo de carbono tiene la misma energía, tanto si está hibridizado como si no lo está, pero la configuración hibridizada puede formar enlaces más fuertes. La geometría tetraédrica tiene una ventaja adicional, puesto que permite que los núcleos de hidrógeno estén lo más alejados posible entre sí para una longitud de enlace C-. Y puesto que estos núcleos están todos cargados positivamente, cuanto más alejados estén, en igualdad de otras condiciones, menor será la energía del sistema. La molécula del metano es un tetraedro perfecto con ángulos de enlace de 109.5º. La distancia de enlace C- es de 1.09 Å. La hibridación sp 3 en el átomo de carbono explica la estructura del metano. Cada enlace C- se forma por solapamiento de un orbital sp 3 del carbono con un orbital 1s del hidrógeno.
11 6 Bloque Temático I. Estructura de las moléculas orgánicas ( El etano C 3-C 3 está compuesto por dos grupos metilo. Cada átomo de carbono presenta una hibridación sp 3 y se une a los átomos de hidrógeno mediante un enlace σ formado por solapamiento del orbital 1s del hidrógeno con un orbital sp 3 del carbono. Además, existe un enlace σ C-C formado por el solapamiento de un orbital sp 3 de un átomo de carbono con el otro orbital sp 3 del otro átomo de carbono. Los dos grupos metilo no están fijos en una posición determinada, sino que pueden girar con relativa libertad alrededor del enlace sigma que mantiene unidos a los dos átomos de carbono. El enlace σ mantiene el solapamiento lineal cuando giran los átomos de carbono (véase el bloque temático II para el concepto de isomería conformacional). I El doble enlace Carbono-Carbono conformaciones alternadas del etano Como se acaba de ver, cuando se comparte un par de electrones entre dos átomos se forma un enlace simple. Muchas moléculas orgánicas contienen átomos que comparten dos pares electrónicos, como la del etileno, y se dice que estos átomos están unidos mediante un enlace doble. También hay estructuras orgánicas con átomos que comparten tres pares de electrones, como los de la molécula de acetileno, y en este caso se dice que el enlace entre los átomos es un triple enlace.
12 Química Orgánica I- 7 Los alquenos son hidrocarburos con enlaces dobles carbono-carbono. Se les denomina también olefinas. El alqueno más simple es el etileno cuya fórmula molecular es C 2 4. El doble enlace se representa, en una estructura de Lewis, mediante dos pares de electrones entre los átomos de carbono. La longitud del enlace C=C en el etileno es de 1.33 Å, mucho más corto que el enlace simple C-C del etano que es de 1.54 Å. La longitud del enlace C- en el etileno es de 1.08 Å, ligeramente menor que el enlace C- en el etano que es de 1.09 Å. Los ángulos de enlace de C-C- y -C- son de y respectivamente. Estas distancias y ángulos de enlace se pueden explicar admitiendo que los dos átomos de carbono que forman el doble enlace presentan una hidridación sp 2 y que el doble enlace está constituido por un enlace σ y un enlace π. El enlace σ se forma por solapamiento de los orbitales sp 2 de cada átomo de carbono. Cada uno de los enlaces C- se forma por solapamiento de un orbital híbrido sp 2 del carbono con el orbital 1s del hidrógeno. 2p 2p C C C C sp 2 Enlace σ (Csp 2 -Csp 2 ) En la región de enlace carbono-carbono deben entrar dos electrones más. Cada átomo de carbono contiene todavía un orbital 2p no hibridizado. El orbital 2p consta de dos lóbulos y a cada uno se le da un signo que representa el signo algebraico de la función de onda en las diferentes regiones. Los signos de la función de onda no representan cargas. Indican que la función de onda de un orbital 2p tiene valor cero en el átomo de carbono. A esto se le denomina un nodo. Los nodos son puntos que marcan un cambio de signo de la función de onda (Nota= en
13 8 Bloque Temático I. Estructura de las moléculas orgánicas ( estos apuntes los dos signos de la función de onda, + y -, se representan mediante dos colores diferentes en cada uno de los lóbulos orbitálicos). Para que los dos orbitales p se recubran eficazmente, deben estar orientados paralelamente entre sí y perpendicularmente a la estructura del enlace σ, y además el signo de la función de onda tiene que coincidir. Para que esto ocurra, la estructura de los enlaces σ tiene que ser coplanar y los seis núcleos atómicos implicados en el doble enlace tienen que estar en el mismo plano. Si esto ocurre, los dos orbitales paralelos p están lo suficientemente cerca para solaparse en posición lateral y se pueden combinar de dos maneras: a) Cuando se recubren los lóbulos del mismo signo se forma un orbital molecular enlazante π. b) Si los signos de la función de onda no coinciden se genera un orbital molecular antienlazante π*. En el estado fundamental de un alqueno, los dos electrones que forman el enlace π entre los átomos de carbono están en el orbital molecular enlazante π. C C no hay solapamiento C C Energía Orbital π antienlazante C C solapamiento enlazante C C Orbital π enlazante El solapamiento de los orbitales p es menos eficaz que el solapamiento frontal por el que se forman los orbitales σ. Por consiguiente un enlace π es más débil que un enlace σ. La longitud del enlace C- es menor en el etileno que en el etano por dos razones: a) El enlace σ del etileno está formado por el solapamiento de dos orbitales sp 2 del carbono (33.3% de carácter s), mientras que el enlace σ en el etano está formado por el solapamiento de dos orbitales sp 3 (25% de carácter s). b) El solapamiento de los orbitales p que forman el enlace π aproxima a los dos átomos de carbono. Isomería cis-trans La energía de disociación del doble enlace C=C es aproximadamente de 146 kcal/mol y la energía de disociación de un enlace simple C-C es de 83 kcal/mol. Por tanto, la energía de
14 Química Orgánica I- 9 disociación del enlace π debe ser de 63 kcal/mol. Los extremos de la molécula de etileno no pueden torcerse entre sí, porque para ello se debería romper el enlace π. A diferencia de lo que ocurre en los enlaces simples, en los enlaces dobles C=C no hay libre rotación. Este es el origen de la isomería cis-trans. Por ejemplo, hay dos alquenos que responden al nombre de 2-buteno: el cis-2-buteno y el trans-2-buteno (véase el bloque temático II para el concepto de isomería configuracional de doble enlace). I El triple enlace Carbono-Carbono Los alquinos son hidrocarburos que contienen un triple enlace C-C. Se les denomina también hidrocarburos acetilénicos porque derivan del alquino más simple que se llama acetileno. La estructura de Lewis del acetileno muestra tres pares de electrones en la región entre los núcleos de carbono. El acetileno tiene una estructura lineal que se explica admitiendo una hidridación sp en cada uno de los átomos de carbono. El solapamiento de dos orbitales sp entre sí genera el enlace σ C- C. Por otra parte, el solapamiento del orbital sp con el orbital 1s del hidrógeno forma el enlace σ C-. Los dos enlaces π se originan por solapamiento de los dos orbitales p que quedan en cada uno de los dos átomos de carbono. El solapamiento de estos orbitales forma un cilindro de densidad electrónica que circunda al enlace σ C-C. Enlace σ C sp - 1s Enlace σ C sp -C sp C C C C Sistema de orbitales σ del acetileno Sistema de orbitales π del acetileno La longitud del enlace C-C en el acetileno es de 1.20 Å y cada uno de los enlaces C- tiene una distancia de 1.06 Å. Los dos enlaces, tanto el C-C como el C-, son más cortos que los enlaces correspondientes en el etano y en el etileno.
15 10 Bloque Temático I. Estructura de las moléculas orgánicas ( El triple enlace es relativamente corto debido al solapamiento de los tres pares de electrones y al elevado carácter s de los orbitales hidridos sp (50% de carácter s), lo que aproxima más a los átomos de carbono que forman el enlace σ del acetileno. I.1.3. Electronegatividad y polaridad Cuando dos átomos comparten por igual los dos electrones del enlace covalente se dice que el enlace es no polar, como ocurre en el enlace covalente de la molécula de hidrógeno, en el enlace covalente de la molécula de cloro, o en el enlace covalente carbono-carbono del etano. Sin embargo, la mayor parte de los enlaces covalentes están formados por dos átomos diferentes, de manera que los electrones del enlace son atraídos con mayor intensidad por uno de los dos átomos que forman el enlace. Cuando esto ocurre el enlace covalente se denomina enlace polar. Por ejemplo, cuando el carbono se enlaza al cloro el par de electrones del enlace se encuentra atraído con más intensidad por el átomo de cloro, de manera que sobre el átomo de carbono aparece una pequeña carga parcial positiva y sobre el átomo de cloro aparece una cantidad igual de carga negativa. En la siguiente figura se indica el enlace covalente polar C-Cl de la molécula de clorometano. La polaridad del enlace se indica con una flecha que dirige su punta hacia el extremo negativo del enlace polar y un signo mas (+) en el extremo positivo del enlace. La polaridad del enlace se mide mediante su momento dipolar (µ) que se define como la cantidad de diferencia de carga multiplicada por la longitud del enlace. El símbolo δ+ quiere decir una pequeña cantidad de carga positiva y el símbolo δ- quiere decir una pequeña cantidad de carga negativa. A fin de predecir si un enlace covalente va a ser polar se recurre a la comparación de las electronegatividades de los átomos que forman el enlace. La electronegatividad se define como la tendencia del núcleo atómico a la atracción de electrones. Pauling desarrolló una escala de electronegatividades relativas para la mayoría de los átomos. En el Sistema Periódico la electronegatividad aumenta de izquierda a derecha y disminuye al bajar en una columna, por lo que el flúor es el elemento más electronegativo. A continuación, se da una tabla de electronegatividades para los principales átomos de interés en Química Orgánica.
16 Química Orgánica I Li 1.0 Na 0.9 Be 1.6 Mg 1.3 B 1.8 Al 1.6 C 2.5 Si 1.9 N 3.0 P 2.2 O 3.4 S 2.6 F 4.0 Cl 3.2 Br 3.0 I 2.7 Como se deduce de la tabla anterior, un enlace C- debería estar muy poco polarizado, puesto que la electronegatividad del hidrógeno y del carbono es similar. Sin embargo, los halógenos, el oxígeno y el nitrógeno, que son heteroátomos que suelen aparecer en las estructuras orgánicas, son más electronegativos que el carbono y, por tanto, los enlaces C- halógeno, C-O y C-N son polares. A continuación, se representan las estructuras de Lewis de las moléculas de fluoruro de hidrógeno (F), agua ( 2O) y amoníaco (N 3) con indicación de la polaridad de los enlaces. La molécula de metano se puede considerar que está constituida por enlaces C- muy poco polarizados: En algunos de los temas de esta asignatura se dará una representación del contorno de densidad electrónica de determinadas moléculas. La asimetría en la distribución de carga se indicará con un sistema de colores que varía de tonalidad según el valor del potencial electrostático: el color rojo indica una zona de la estructura con elevada densidad de carga negativa, debido a presencia de átomos muy electronegativos, mientras que un color azul indica una zona de la estructura con déficit de carga debido a la presencia de átomos poco electronegativos. En la siguiente figura se muestra esta variación del color respecto al signo del potencial: rojo < naranja < amarillo < verde < azul potencial electrostático más negativo potencial electrostático más positivo En la siguiente figura se muestran los contornos de potencial electrostático que presentan las moléculas descritas anteriormente:
17 12 Bloque Temático I. Estructura de las moléculas orgánicas ( El enlace -F del fluoruro de hidrógeno está fuertemente polarizado y la densidad de carga a lo largo del enlace entre el flúor y el hidrógeno está desplazada hacia el átomo más electronegativo (flúor) creando un potencial electrostático negativo alrededor de dicho átomo (color rojo) y en consecuencia un potencial electrostático positivo alrededor del hidrógeno (color azul). Lo mismo ocurre en el caso de la molécula de agua, en el que la mayor electronegatividad del oxígeno provoca la polarización de los enlaces O-. El caso del amoníaco es similar al de la molécula de agua: el nitrógeno es más electronegativo que el hidrógeno y, por tanto, los tres enlaces N- son polares. La densidad de carga se halla desplazada hacia el nitrógeno, lo cual se aprecia perfectamente en el diagrama de contorno de potencial electrostático debido a la coloración rojiza en la parte superior de la figura (posición del nitrógeno), y a la aparición de una zona de color azul en la parte inferior, en la cual se ubican los tres átomos de hidrógeno. En el metano no existen enlaces polares debido a las electronegatividades similares de los átomos de carbono y de hidrógeno. La distribución simétrica de la densidad de carga conlleva la aparición de un potencial electrostático más bien neutro (verde) alrededor de todos los átomos de la molécula. I.1.4. Efecto inductivo La diferente electronegatividad de los átomos que constituyen las moléculas orgánicas, y las interacciones secundarias entre sus orbitales provocan, la aparición de ciertos efectos de polarización y deslocalización electrónica. Uno de ellos es el denominado efecto inductivo, que se puede definir como la polarización de enlaces provocada por un átomo o un grupo atómico a lo largo de una cadena carbonada σ. En la siguiente figura se indica el efecto inductivo provocado por el átomo de cloro en la molécula de cloroetano: El enlace C-Cl de la molécula de cloroetano está polarizado debido a la diferencia de electronegatividad entre el carbono y el cloro. Como consecuencia de ello, sobre el átomo de
18 Química Orgánica I- 13 cloro existe una fracción de carga negativa y sobre el átomo de carbono una fracción de carga positiva. Este átomo de carbono cargado positivamente atrae hacia sí los tres pares de electrones que le unen a los otros tres átomos y por tanto en el otro átomo de carbono de la molécula aparece una fracción de carga positiva, aunque menor que en el átomo de carbono unido directamente al cloro. El efecto inductivo es permanente y por tanto no es un fenómeno que ocurra en un momento dado en la molécula. ay que tener en cuenta que el efecto inductivo decrece rápidamente al aumentar la distancia con respecto al origen del desplazamiento electrónico, y en la práctica se puede despreciar a partir del segundo átomo de la cadena. El efecto inductivo puede ser electrón-atrayente, como el del átomo de cloro en el cloroetano, o electrón-dador como el del grupo alquilo en la molécula anterior. El efecto inductivo se representa transformando el enlace en una flecha y se indica como +I o I según el efecto sea electrón-dador o electrón-atrayente. Tomando como referencia el hidrógeno, cuyo efecto inductivo se considera 0, aquellos átomos, o grupos de átomos, cuya electronegatividad es mayor que la del C se considera que tienen efecto inductivo I. Este tipo de átomos, o grupos de átomos, se clasifican como electrónatrayentes, ya que atraen hacia sí el par de electrones del enlace, dejando sobre el átomo de carbono al que están unidos una densidad de carga positiva. Por otro lado, aquellos átomos, o grupos de átomos, que tienden a desplazar la densidad electrónica sobre el átomo de carbono al que están unidos se dice que tienen un efecto inductivo +I, y se clasifican como grupos electrón-dadores. En este grupo cabe clasificar a los radicales alquílicos, los metales, y los grupos cargados negativamente. En la tabla que se da a continuación se da una clasificación de los principales grupos orgánicos según sus efectos inductivos electrón-atrayentes o electrón-dadores. Los grupos alquilo, de los cuales se indican en la tabla solo los más usuales como el t-butilo, el isopropilo, el etilo o el metilo, presentan todos efecto inductivo electrón-dador (+I). Efectos inductivos Efecto electrón-atrayente (-I) Efecto electrón-dador (+I) -NO 2 (grupo nitro) -CN (grupo ciano) -O - (grupo alcóxido) -COO - (grupo carboxilato) -COO (grupo carboxilo) -C(C 3) 3 (grupo t-butilo) -X (halógenos) -C(C 3) 2 (grupo isopropilo -OC 3 (grupo metoxilo) -C 2C 3 (grupo etilo) -O (grupo hidroxilo) -C 3 (grupo metilo) En los enlaces polares las cargas parciales sobre los átomos son reales. Sin embargo, cuando se dibujan las estructuras de Lewis de determinadas especies químicas aparecen cargas eléctricas asociadas a algunos átomos. Estas cargas se denominan cargas formales y se calculan según la siguiente ecuación:
19 14 Bloque Temático I. Estructura de las moléculas orgánicas ( A continuación se dibujan las estructuras de Lewis del anión carbonato y del nitrometano. En dos de los átomos de oxígeno del anión carbonato aparece una carga formal negativa. Por otro lado, en la molécula de nitrometano aparece una carga formal positiva sobre el átomo de nitrógeno y una carga formal negativa sobre uno de los dos átomos de oxígeno. En la siguiente figura se indica el cálculo de la carga formal de cada uno de los átomos que integran el anión carbonato: El mismo cálculo se indica a continuación para los átomos de oxígeno y nitrógeno de la molécula de nitrometano: Dos átomos diferentes que poseen la misma configuración electrónica en la capa de valencia, aunque posean distinta carga formal, se denominan átomos isoelectrónicos. Por ejemplo, el átomo de fluor del fluorometano y el átomo de oxígeno del anión metóxido son átomos isoelectrónicos, al igual que el átomo de carbono del metano y el átomo de nitrógeno del catión amonio.
20 Química Orgánica I- 15 Unidad temática I.2 I.2.1. Enlaces deslocalizados: efecto resonante Se denominan enlaces conjugados a los enlaces múltiples, ya sean dobles o triples enlaces que están separados por un enlace simple. La presencia en una estructura de enlaces conjugados, o la presencia de enlaces múltiples contiguos a átomos con pares electrónicos libres, provoca la aparición del efecto resonante o mesómero, también conocido como efecto conjugativo (se describe como efecto K, por la inicial de Konjugativ en alemán). El efecto resonante, mesómero o conjugativo, es un efecto estabilizante y se define como la deslocalización de la densidad electrónica π de un átomo, o grupo de átomos, sobre otros átomos de la estructura. La molécula de butadieno se puede representar con la estructura de Lewis I, que contiene dos enlaces dobles C-C conjugados, por tanto separados por un enlace simple C-C: El efecto conjugativo, resonante o mesómero permite describir la estructura del butadieno con dos estructuras de Lewis adicionales, las numeradas como II y III en la figura anterior, las cuales contienen un enlace doble y dos cargas de signo opuesto en los extremos de la molécula. Las estructuras resonantes o mesómeras son aquellas que tienen la misma geometría pero difieren en su distribución electrónica. Este es el caso de las estructuras I, II y III de la figura anterior, cuya geometría (posición de los núcleos) es idéntica, pero se diferencian en la forma en la que se distribuye la densidad electrónica π. La molécula orgánica que se describe mediante la contribución de varias estructuras resonantes tiene características asociadas a cada una de aquéllas. En estos casos se dice que la molécula es un híbrido de resonancia de las estructuras resonantes. El método de la resonancia permite saber, de forma cualitativa, la estabilización que puede conseguir una molécula por deslocalización electrónica. Cuanto mayor sea el número de estructuras resonantes mediante las que se pueda describir una especie química mayor será su estabilidad. El concepto de estructuras resonantes se puede aplicar en la descripción del nitrometano, que se puede representar mediante las dos estructuras de Lewis que se indican a continuación:
21 16 Bloque Temático I. Estructura de las moléculas orgánicas ( En realidad, el nitrometano no es la estructura resonante I ni tampoco la estructura resonante II, sino la estructura que resultaría al mezclar las características asociadas a la estructura I y a la II, tal y como se indica a continuación: El problema de dibujar los compuestos orgánicos como híbridos de resonancia reside en la imposibilidad de contar el número de electrones sobre determinados átomos. Por ejemplo, en la estructura de híbrido de resonancia del nitrometano se hace difícil saber el número de electrones sobre el átomo de nitrógeno o sobre los átomos de oxígeno. Aunque los híbridos de resonancia dan una imagen más real del orden de enlace y de la distribución electrónica de la molécula no se suelen utilizar en los textos de Química Orgánica, debido al problema acabado de comentar. Una forma de escribir el híbrido de resonancia, que sí permite contar los electrones en cada átomo, consiste en encerrar entre corchetes a todas las estructuras resonantes conectándolas entre sí mediante una flecha de doble punta, tal y como se ha descrito más arriba. La mayor o menor contribución de las estructuras resonantes a la descripción de la molécula se puede relacionar con la mayor o menor estabilidad que teóricamente puede atribuirse a cada estructura. De forma cualitativa se puede evaluar esta mayor o menor estabilidad teniendo en cuenta los siguientes puntos: 1. Una estructura resonante será tanto más estable (contribuirá más al hibrido de resonancia) cuanto mayor sea el número de enlaces formales que posea. 2. Las estructuras iónicas con separación de cargas son más inestables (contribuyen menos al hibrido de resonancia) que las no cargadas. 3. Entre dos estructuras resonantes con separación de cargas, y en igualdad de otras condiciones, será más estable (contribuirá más al hibrido de resonancia) la estructura con la carga negativa en el átomo más electronegativo. 4. Las estructuras resonantes con octetos completos en todos los átomos de la segunda fila del Sistema Periódico son particularmente estables (contribuyen más al
22 Química Orgánica I- 17 hibrido de resonancia), aunque ello suponga la presencia de una carga positiva en un átomo electronegativo. Para dibujar correctamente las estructuras resonantes de un compuesto conviene seguir las siguientes reglas: 1. Dibujar una estructura de Lewis para el compuesto en cuestión. 2. Tomando como base la estructura de Lewis acabada de dibujar se dibuja otra estructura de Lewis de manera que: a) Todos los núcleos mantengan su posición original. b) Se mantenga el mismo número de electrones apareados. A continuación se aplican estas reglas para el dibujo de las estructuras resonantes de la acetamida: 1. Se dibuja la estructura de Lewis de la acetamida: 2. Tomando como base la estructura de Lewis acabada de dibujar, se dibuja otra estructura de Lewis que mantenga los núcleos en la misma posición y que contenga el mismo número de electrones apareados que la primera, tal y como se indica a continuación. El método de las estructuras resonantes permite describir a la acetamida como un híbrido de resonancia entre las estructuras resonantes I y II. De las dos estructuras resonantes la que contribuye en mayor proporción en el híbrido de resonancia es la I, porque tiene un mayor número de enlaces y porque no comporta separación de cargas. Sin embargo, la estructura resonante II, aunque contribuye poco a la hora de determinar las propiedades físicas y químicas de la acetamida, pone de manifiesto que el enlace C-N debe tener un cierto carácter de doble enlace, como así ocurre en realidad. I Energía de resonancia Como se ha indicado anteriormente, los dobles enlaces separados por tan sólo un enlace sencillo se denominan dobles enlaces conjugados, como en el 1,3-butadieno o en el 1,3- pentadieno. Cuando los enlaces dobles están separados por dos o más enlaces sencillos no
23 18 Bloque Temático I. Estructura de las moléculas orgánicas ( interaccionan entre sí, y se les denomina enlaces dobles aislados, como en el caso del 1,4- pentadieno. Debido a la interacción entre los dobles enlaces, los sistemas con dobles enlaces conjugados son más estables que los sistemas con dobles enlaces aislados. Una forma de comparar la estabilidad relativa de los alquenos es medir el calor desprendido en la reacción de hidrogenación. Por ejemplo, la diferencia entre los calores de hidrogenación del 1-penteno ( = -30 Kcal/mol) y del trans-2-penteno ( = Kcal/mol) indica que este último es 2.6 kcal/mol más estable que el alqueno monosustituido. Si una molécula tiene mas de un enlace doble y están aislados entre sí, el calor de hidrogenación se acerca a la suma de los calores de hidrogenación de los dobles enlaces individuales. Por ejemplo, el calor de hidrogenación del 1,4-pentadieno (dieno con enlaces dobles aislados) es de kcal/mol, que es aproximadamente el doble del calor de hidrogenación del 1-penteno. Para el caso de un dieno conjugado, como el trans-1,3-pentadieno se puede calcular un calor de hidrogenación teórico que sería el que correspondería a la suma de los dos enlaces dobles. A continuación, se efectúa este cálculo para el trans-1,3-pentadieno.
24 Química Orgánica I- 19 Según este cálculo, la hidrogenación del trans-1,3-pentadieno debería desprender, aproximadamente, 57.4 kcal/mol. Sin embargo, cuando se lleva a cabo la hidrogenación del trans-1,3-pentadieno, y se determina en un calorímetro el calor desprendido, se observa que son sólo 53.7 Kcal/mol, y por tanto existe una diferencia de 3.7 kcal/mol entre el valor teórico y el valor experimental. Este valor indica que el dieno conjugado tiene una estabilidad adicional de unas 3.7 kcal/mol, que se denomina energía de resonancia o energía de conjugación. En el siguiente diagrama se comparan gráficamente los calores de hidrogenación teórico y experimental del trans-1,3-pentadieno, apreciándose claramente la estabilización adicional, calculada en 3.7 kcal/mol, de este dieno conjugado con respecto a la hipotética situación no conjugada. Comparación entre el calor de hidrogenación teórico y experimental del (E)-penta-1,3-dieno (E)-penta-1,3-dieno teórico 3.7 Kcal/mol(energía de resonancia) Energia º=-57.4 Kcal/mol º=-53.7 Kcal/mol (E)-penta-1,3-dieno n-pentano Esta estabilización adicional de los dienos conjugados es una situación general. Por ejemplo, el 1,3-butadieno es un dieno conjugado y, teniendo en cuenta que el calor de hidrogenación experimental del 1-buteno es 30.2 kcal/mol, su calor de hidrogenación teórico sería de 60.4 kcal/mol, tal y como se calcula a continuación: Sin embargo el calor de hidrogenación experimental del 1,3-butadieno es de sólo kcal/mol. La diferencia entre el valor teórico y el experimental, que es de 3.6 kcal/mol, es la
25 20 Bloque Temático I. Estructura de las moléculas orgánicas ( energía de resonancia o de estabilización del 1,3-butadieno. Comparación entre el calor de hidrogenación teórico y experimental del buta-1,3-dieno Buta-1,3-dieno teórico 3.6 Kcal/mol(energía de resonancia) Buta-1,3-dieno Energia º=-60.4 Kcal/mol º=-56.8 Kcal/mol Butano I.2.2. Aromaticidad El compuesto orgánico que representa de forma paradigmática el concepto de aromaticidad es el benceno. La primera estructura para este compuesto fue propuesta por el químico alemán Friedrich August Kekulé von Stradonitz ( ) en 1865, y consistía en una mezcla en equilibrio de dos ciclohexatrienos, formados con enlaces sencillos y dobles alternados. En la estructura de Kekulé los enlaces sencillos serían más largos (1.47 Å) que los enlaces dobles (1.33 Å). Cuando se desarrollaron los métodos físicos de determinación estructural y se pudo medir la distancia de enlace C-C del benceno se encontró que todas las distancias eran iguales y median 1.39 Å, que es un promedio entre la distancia de un enlace doble (1.33 Å) y un enlace simple (1.47 Å). Aparte de las características físicas del benceno, que no resultan explicadas por las estructuras de 1,3,5-ciclohexatrieno, existen una serie de propiedades químicas del benceno que tampoco resultan explicadas por las estructuras de enlaces dobles alternados que propuso Kekulé. De hecho, la hidrogenación del benceno es mucho más lenta que la de los alquenos y requiere condiciones mucho más drásticas: alta presión de hidrógeno y empleo de catalizadores muy activos.
26 Química Orgánica I- 21 Antes se ha visto cómo la comparación de los calores de hidrogenación permite cuantificar la estabilidad relativa de los dienos conjugados con respecto a los dienos no conjugados. En el caso del benceno se puede recurrir al mismo método para determinar cuál es la estabilidad adicional asociada a este compuesto en comparación con otros alquenos cíclicos. En la siguiente gráfica se representan los calores de hidrogenación, determinados experimentalmente, del ciclohexeno, del 1,4-ciclohexadieno, del 1,3-ciclohexadieno y del benceno. También se representa, a modo de comparación, el calor de hidrogenación teórico del hipotético 1,3,5- ciclohexatrieno. 1,3,5-ciclohexatrieno kcal/mol de energía de resonancia energía 1.8 kcal/mol energía de resonancia kcal/mol kcal/mol kcal/mol kcal/mol kcal/mol energía del ciclohexano Cuando el ciclohexeno se hidrogena a ciclohexano se desprenden 28.6 kcal/mol. El 1,4- ciclohexadieno, un dieno no conjugado, libera en la hidrogenación 57.4 kcal/mol, aproximadamente el doble del calor de hidrogenación del ciclohexeno. La hidrogenación del 1,3-ciclohexadieno, un dieno conjugado libera 55.4 kcal/mol, 1.8 kcal/mol menos que el doble del valor del ciclohexeno. Una energía de resonancia de 1.8 kcal/mol es típica para un dieno conjugado. Para el hipotético 1,3,5-ciclohexatrieno se puede calcular un calor de hidrogenación de: 0 = - (3 x x 1.8) kcal/mol = kcal /mol Al contrario que los anteriores alquenos, que se hidrogenan a presión atmosférica, la hidrogenación del benceno necesita de elevadas presiones de hidrógeno y de catalizadores muy activos. Cuando se produce la hidrogenación sólo se liberan 49.8 kcal/mol, 32.9 kcal/mol menos que el hipotético calor de hidrogenación del 1,3,5-ciclohexatrieno. A esta diferencia de energía se le conoce como energía de resonancia del benceno.
27 22 Bloque Temático I. Estructura de las moléculas orgánicas ( Se dice que el benceno es un hidrocarburo aromático, que es un término que engloba a aquellos compuestos que posen una elevada estabilidad termodinámica y una reactividad química diferente de la de los alquenos y polienos conjugados. La remarcable estabilidad del benceno se puede explicar si se admite la deslocalización de la densidad electrónica asociada a los orbitales p. Las estructuras resonantes se diferencian en la distribución de la densidad electrónica pero no en la posición relativa de los átomos que las integran. En realidad el benceno es un híbrido de resonancia cuyos enlaces π están deslocalizados, con un orden de enlace de aproximadamente 1 ½ entre los átomos de carbono adyacentes. Esto explica que las longitudes de enlace C-C en el benceno sean más cortas que las de los enlaces simples, pero más largas que las de los dobles enlaces. Como los enlaces π están deslocalizados en el anillo a menudo se inscribe un círculo en el hexágono, en lugar de trazar los enlaces dobles localizados. Por tanto, el benceno consiste en un anillo formado por seis átomos de carbono con hibridación sp 2, enlazados entre sí mediante enlaces σ Csp 2 -Csp 2. Cada uno de los átomos de carbono se enlaza además a un átomo de hidrógeno mediante un enlace σ Csp 2-1s. Todos los enlaces C-C tienen la misma longitud y todos los ángulos de enlace son de 120º. Como los átomos de carbono presentan hibridación sp 2, cada átomo de carbono tiene un orbital p perpendicular al plano del anillo que se solapa con los orbitales p de los carbonos contiguos para formar un círculo de densidad electrónica π por encima y por debajo del plano molecular. La representación del benceno como un hexágono regular con un círculo en el centro evoca el solapamiento cíclico de los seis orbitales 2p. Orbitales moleculares del benceno El sistema de orbitales π del benceno se forma en realidad por combinación lineal de los seis orbitales 2p asociados a los átomos de carbono. Esta combinación genera seis orbitales moleculares π de los cuales tres son enlazantes y tres son antienlazantes y son los que se muestran a continuación:
28 Química Orgánica I- 23 La ocupación de los orbitales enlazantes en el benceno es óptima puesto que no se sitúa ningún electrón en los destructivos orbitales antienlazantes. Se puede afirmar, a la vista del diagrama anterior, que la estabilidad del benceno se debe a un grupo de orbitales moleculares de baja energía, que son capaces de acomodar de forma altamente eficiente toda la densidad electrónica asociada a los electrones π. El benceno se engloba dentro de la familia de los compuestos aromáticos. Los componentes de esta familia cumplen las siguientes condiciones: 1) Sus estructuras son cíclicas y contienen enlaces dobles conjugados. 2) Cada átomo de carbono del anillo presenta hidridación sp 2, u ocasionalmente sp, con al menos un orbital p no hidridizado. 3) Los orbitales p se solapan formando un anillo continuo de orbitales paralelos. La estructura debe ser plana o casi plana para que el solapamiento de los orbitales p sea efectivo. 4) Además, los compuestos aromáticos deben cumplir la regla de ückel cuyo enunciado es el siguiente: Un compuesto aromático contiene 4n+2 electrones π en el sistema cíclico, siendo n un número entero. Si el número de electrones π es 4n, siendo n un número entero, el compuesto es antiaromático.
29 24 Bloque Temático I. Estructura de las moléculas orgánicas ( Unidad temática I.3. Propiedades de los compuestos orgánicos I.3.1. Enlaces más débiles que el enlace covalente El enlace covalente es la unión que explica el mantenimiento de la unidad estructural de un compuesto orgánico. Además de este enlace intramolecular se pueden dar interacciones entre las moléculas, que son mucho más débiles que los enlaces covalentes, pero que a menudo son las responsables de las propiedades físicas de los compuestos orgánicos. Este tipo de interacciones intermoleculares son de especial importancia en el estado sólido y en el estado líquido, situaciones en las que las moléculas están en íntimo contacto. Los puntos de fusión, de ebullición y las solubilidades de los compuestos orgánicos muestran los efectos de estas fuerzas. Las principales fuerzas intermoleculares son: 1) Las fuerzas de Van der Waals, que se clasifican a su vez en: a) Fuerzas dipolo permanente-dipolo permanente (fuerzas de Keesom) b) Fuerzas dipolo permanente-dipolo inducido (fuerzas de Debye) c) Fuerzas dipolo inducido-dipolo inducido (fuerzas de dispersión de London) 2) Los enlaces por puentes de hidrógeno I Las fuerzas, o interacciones, de Van der Waals Las fuerzas, o interacciones, de van der Waals son las fuerzas atractivas o repulsivas que se establecen entre las moléculas, ya sean éstas polares o apolares. El valor de las atracciones intermoleculares de tipo van der Waals es bajo, oscilando entre 0.1 y 35 KJ/mol. Sin embargo, estas fuerzas juegan un papel fundamental en campos tan diversos como la química supramolecular, la biología estructural, la ciencia de polímeros, la nanotecnología, la ciencia de superficies, y la física de materia condensada. Existen básicamente tres tipos de interacciones de van der Waals, que se comentan a continuación. I a. Fuerzas dipolo permanente-dipolo permanente (fuerzas de Keesom) Las fuerzas de atracción que se establecen entre dipolos permanentes se denominan fuerzas de Keesom. El valor de este tipo de interacciones es proporcional a los valores de los momentos dipolares de las moléculas, y se debe a la atracción electrostática entre la zona cargada negativamente de una molécula y la zona cargada positivamente positiva de la otra. Esta atracción electrostática provoca que las moléculas se vayan orientando unas con respecto a otras (véase la figura que se representa a continuación):
30 Química Orgánica I- 25 Orientación de moléculas polares debido a las fuerzas de Keesom Las fuerzas de Keesom explican por qué los gases constituidos por moléculas polares, como el SO 2 o el Cl, son fácilmente licuables: al disminuir la temperatura, decrece la agitación térmica, los dipolos se orientan entre sí, las moléculas se asocian y se produce un estado más condensado (líquido). I b. Fuerzas dipolo permanente-dipolo inducido (fuerzas de Debye) Si se aplica un campo eléctrico a una molécula su densidad electrónica responde generando y distribuyendo pequeñas cargas eléctricas en los átomos de la molécula, que en su conjunto se anulan. Por ejemplo, la molécula de cloro carece de momento dipolar permanente, pero si se aplica un campo eléctrico en la dirección del eje molecular, el par de electrones del enlace covalente se polariza, y cada uno de los átomos de cloro que constituyen la molécula adquiere una pequeña carga eléctrica igual, pero de signo opuesto, apareciendo un momento dipolar inducido en la dirección del campo eléctrico. Esta polarización se mide en debyes, en honor a Peter Debye. Aplicación de un campo eléctrico δ δ Cl Cl Cl Cl Las moléculas polares, que contienen un dipolo permanente, actúan como pequeños campos eléctricos, provocando la polarización de las moléculas apolares cercanas. Este fenómeno de polarización inducida es una fuente de atracción entre moléculas y explica la disolución de algunos gases apolares, como el Cl 2, en disolventes polares. I c. Fuerzas de dispersión de London En las moléculas no polares la principal fuerza de atracción es la fuerza de dispersión de London, que surge de la interacción entre dipolos inducidos que se generan temporalmente en las moléculas. Así, la aproximación de las nubes electrónicas de dos moléculas apolares provoca un desplazamiento transitorio de la densidad electrónica de aquéllas, induciéndose un momento dipolar pequeño y temporal que provoca una atracción intermolecular. Estos dipolos temporales solo duran una fracción de segundo y cambian continuamente de orientación. La fuerza de
31 26 Bloque Temático I. Estructura de las moléculas orgánicas ( atracción entre dipolos inducidos depende del peso molecular y del contacto superficial entre las moléculas y, por tanto, es proporcional al área molecular. El incremento de las fuerzas de dispersión de London, debido al aumento del peso molecular y al de la superficie de contacto entre las moléculas, explica el aumento de la temperatura de ebullición al pasar de metano (temperatura de ebullición = -165ºC), a propano (temperatura de ebullición = -44.5ºC) y a butano (temperatura de ebullición = -0.5ºC). Metano(C 4 ) Peso molecular = 16.0 g/mol Temp. ebullición =-165ºC Propano(C 3 C 2 C 3 ) Peso molecular = 44.1 g/mol Temp. ebullición =-44.5ºC Butano(C 3 C 2 C 2 C 3 ) Peso molecular = 58.1 g/mol Temp. ebullición =-0.5ºC En la siguiente figura se representan los puntos de ebullición y las estructuras de los tres isómeros del pentano (el n-pentano, el iso-pentano (2-metilbutano) y el neo-pentano (2,2- dimetilpropano)). La diferencia de temperatura de ebullición entre el isómero lineal n-pentano y el ramificado neo-pentano (2,2-dimetilpropano) es de 27 C. Esta diferencia se explica por la forma lineal de las moléculas de n-pentano, que provoca un aumento de las fuerzas intermolecularas de dispersión de London. Por el contrario, las fuerzas de dispersión de London entre las moléculas cuasi-esféricas del neo-pentano son mucho más débiles, lo que se traduce en una disminución de su temperatura de ebullición.
TEMA 4. EFECTOS ELECTRÓNICOS. ENLACES DESLOCALIZADOS.
 TEMA 4. EFECTOS ELECTRÓNICOS. ENLACES DESLOCALIZADOS. 1. Estructuras de resonancia. 1.1. Contribución de las estructuras resonantes. 1.2. Cómo dibujar estructuras resonantes 2. Efecto inductivo. 3. Efecto
TEMA 4. EFECTOS ELECTRÓNICOS. ENLACES DESLOCALIZADOS. 1. Estructuras de resonancia. 1.1. Contribución de las estructuras resonantes. 1.2. Cómo dibujar estructuras resonantes 2. Efecto inductivo. 3. Efecto
Lección 1: GENERALIDADES
 Lección 1: GENERALIDADES 1.Concepto de Química Orgánica. Introducción histórica. 2. Estructuras de Lewis. Estructuras resonantes. 3. Geometría de las moléculas. 4. Representaciones de las moléculas orgánicas
Lección 1: GENERALIDADES 1.Concepto de Química Orgánica. Introducción histórica. 2. Estructuras de Lewis. Estructuras resonantes. 3. Geometría de las moléculas. 4. Representaciones de las moléculas orgánicas
TEMA 1 CONCEPTOS FUNDAMENTALES EN QUIMICA ORGANICA
 TEMA 1 EPTS FUDAMETALES E QUIMIA RGAIA 1. oncepto y origen de la Química rgánica. 2. Evolución histórica de la Química rgánica. 3. Representación de Lewis de las moléculas orgánicas. 4. Electronegatividad
TEMA 1 EPTS FUDAMETALES E QUIMIA RGAIA 1. oncepto y origen de la Química rgánica. 2. Evolución histórica de la Química rgánica. 3. Representación de Lewis de las moléculas orgánicas. 4. Electronegatividad
Enlace químico II: geometría molecular e hibridación de orbitales atómicos
 Enlace químico II: geometría e hibridación de orbitales atómicos Capítulo 10 Modelo de la repulsión de los pares de electrones de la capa de valencia (): Predice la geometría de la molécula a partir de
Enlace químico II: geometría e hibridación de orbitales atómicos Capítulo 10 Modelo de la repulsión de los pares de electrones de la capa de valencia (): Predice la geometría de la molécula a partir de
Enlace químico II: geometría molecular e hibridación de orbitales atómicos
 Enlace químico II: geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Teorías de cómo ocurren
Enlace químico II: geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Teorías de cómo ocurren
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS
 CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
Teoría estructural de Kekulé: fórmulas estructurales
 TEMA 1.- Enlaces en las moléculas orgánicas. Enlaces C-, metano. Enlaces C-C, etano. Enlaces C=C, etileno. Enlaces C C, acetileno. Enlaces sencillos carbono heteroátomo. Enlaces múltiles carbono heteroátomo.
TEMA 1.- Enlaces en las moléculas orgánicas. Enlaces C-, metano. Enlaces C-C, etano. Enlaces C=C, etileno. Enlaces C C, acetileno. Enlaces sencillos carbono heteroátomo. Enlaces múltiles carbono heteroátomo.
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
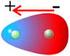 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
ESTRUCTURA DE LA MATERIA QCA 01 ANDALUCÍA. 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad.
 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
BIOQUÍMICA Y BIOLOGÍA MOLECULAR I CURSO 2003/04 ENLACE QUÍMICO
 BIQUÍMIA Y BILGÍA MLEULAR I URS 2003/04 Problemas 1º de Medicina UIVERSIDAD DE AVARRA DEPARTAMET DE BIQUÍMIA ELAE QUÍMI 1. rdenar por su estabilidad relativa (menor energía de ionización) los siguientes
BIQUÍMIA Y BILGÍA MLEULAR I URS 2003/04 Problemas 1º de Medicina UIVERSIDAD DE AVARRA DEPARTAMET DE BIQUÍMIA ELAE QUÍMI 1. rdenar por su estabilidad relativa (menor energía de ionización) los siguientes
Interacciones químicas de no enlace. Fuerzas de van der Waals
 Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
TEMA 3.2 El Enlace Covalente
 TEMA 3.2 El Enlace Covalente» Estructuras de Lewis: Regla del ctete Formas resonantes Carga formal Excepciones a la regla del octete» Geometría Molecular: Teoría RPENV (Repulsión de los pares de electrones
TEMA 3.2 El Enlace Covalente» Estructuras de Lewis: Regla del ctete Formas resonantes Carga formal Excepciones a la regla del octete» Geometría Molecular: Teoría RPENV (Repulsión de los pares de electrones
Efecto inductivo Desplazamiento parcial del par electrónico en enlace sencillo hacia el átomo más electronegativo provocando fracciones de carga.
 www.youtube.com Efecto inductivo Desplazamiento parcial del par electrónico en enlace sencillo hacia el átomo más electronegativo provocando fracciones de carga. Efecto mesómero o resonancia Desplazamiento
www.youtube.com Efecto inductivo Desplazamiento parcial del par electrónico en enlace sencillo hacia el átomo más electronegativo provocando fracciones de carga. Efecto mesómero o resonancia Desplazamiento
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica.
 SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
MÓDULO A: ácido-base y espectroscópicas de los compuestos orgánicos
 MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
I.- CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 1.- Concepto y origen de la Química Orgánica I.- CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA La Química Orgánica se ocupa del estudio de las propiedades y transformaciones de los compuestos que contienen
1.- Concepto y origen de la Química Orgánica I.- CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA La Química Orgánica se ocupa del estudio de las propiedades y transformaciones de los compuestos que contienen
DIENOS. Los dienos conjugados son aquellos donde los enlaces dobles se alternan con enlaces simples. Ej: 1,3-pentadieno CH 2 =CH-CH=CH-CH 3
 Teoría de Química Orgánica I DIENOS Un hidrocarburo que contiene dos dobles enlaces se denomina dieno y la relación entre los dobles enlaces puede clasificarse como aislados, conjugados o acumulados. Los
Teoría de Química Orgánica I DIENOS Un hidrocarburo que contiene dos dobles enlaces se denomina dieno y la relación entre los dobles enlaces puede clasificarse como aislados, conjugados o acumulados. Los
Puntos de ebullición.
 1.-Indica el tipo de enlace de los siguientes hidruros. Ayundándote de la siguiente tabla comenta la polaridad de los enlaces. Hidruro % carácter iónico HF 43 HCl 17 HBr 11 HI 6 Representa gráficamente
1.-Indica el tipo de enlace de los siguientes hidruros. Ayundándote de la siguiente tabla comenta la polaridad de los enlaces. Hidruro % carácter iónico HF 43 HCl 17 HBr 11 HI 6 Representa gráficamente
Enlaces químicos I: conceptos básicos. Capítulo 9
 Enlaces químicos I: conceptos básicos Capítulo 9 Los electrones de valencia son los últimos electrones de un orbital en un átomo, que son los causantes de los enlaces químicos. Grupo e - configuración
Enlaces químicos I: conceptos básicos Capítulo 9 Los electrones de valencia son los últimos electrones de un orbital en un átomo, que son los causantes de los enlaces químicos. Grupo e - configuración
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Actividad introductoria: Aplicación en la industria de las fuerzas intermoleculares.
 Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE QUÍMICA ORGÁNICA ESTRUCTURA DE COMPUESTOS ORGANICOS, ANALISIS ELEMENTAL, CARGA FORMAL TRABAJO PRÁCTICO
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE QUÍMICA ORGÁNICA ESTRUCTURA DE COMPUESTOS ORGANICOS, ANALISIS ELEMENTAL, CARGA FORMAL TRABAJO PRÁCTICO
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
EJERCICIOS DE ENLACE. a) Amoniaco. b) Tricloruro de boro. c) Metano.
 EJERCICIOS DE ENLACE 1. Deduzca, según la teoría de Repulsión de Pares de Electrones de la Capa de Valencia, la geometría de las siguientes moléculas e indique la polaridad de las mismas: a) Amoniaco.
EJERCICIOS DE ENLACE 1. Deduzca, según la teoría de Repulsión de Pares de Electrones de la Capa de Valencia, la geometría de las siguientes moléculas e indique la polaridad de las mismas: a) Amoniaco.
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
A. VIVENCIA Elabora la siguiente sopa de letras y define los conceptos:
 INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)
![QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g) QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)](/thumbs/49/25837773.jpg) OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN
 GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN 1. REVISIÓN DE TABLA PERIÓDICA 1.1 Completa el siguiente cuadro. Configuración electrónica externa Bloque
GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN 1. REVISIÓN DE TABLA PERIÓDICA 1.1 Completa el siguiente cuadro. Configuración electrónica externa Bloque
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
Unidad I: Propiedades Periódicas: Masa y Enlace
 Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
Según Lewis el enlace covalente consiste en la unión de dos átomos que comparten uno o más pares de electrones.
 En 1916, Lewis resaltó que los gases nobles eran muy poco reactivos debido a que su configuración electrónica era muy estable, y sugirió que los átomos pueden adquirir estabilidad compartiendo electrones
En 1916, Lewis resaltó que los gases nobles eran muy poco reactivos debido a que su configuración electrónica era muy estable, y sugirió que los átomos pueden adquirir estabilidad compartiendo electrones
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato
 Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
Hibridación y Momento Dipolar
 Hibridación y Momento Dipolar Conceptos Previos El orbital o capa de valencia es el orbital asociado al más alto nivel cuántico que contiene electrones. La forma de como se ordenan los electrones de valencia
Hibridación y Momento Dipolar Conceptos Previos El orbital o capa de valencia es el orbital asociado al más alto nivel cuántico que contiene electrones. La forma de como se ordenan los electrones de valencia
Capacidad de combinación. Capacidad de combinación La última capa de electrones de un átomo, se le conoce como capa de electrones de valencia
 Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
Preguntas Propuestas
 Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
Tema 4. Fuerzas intermoleculares
 Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
ACADEMIA DE QUÍMICA TURNO VESPERTINO
 INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Tema 3_2. ENLACE QUÍMICO
 Tema 3_2. ENLACE QUÍMICO Fuerzas de Coulomb: Una visión simplificada del enlace FORMACIÓN DE UN ENLACE Las cargas opuestas se atraen entre sí (atracción de Coulomb) Los electrones tienden a distribuirse
Tema 3_2. ENLACE QUÍMICO Fuerzas de Coulomb: Una visión simplificada del enlace FORMACIÓN DE UN ENLACE Las cargas opuestas se atraen entre sí (atracción de Coulomb) Los electrones tienden a distribuirse
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD
 TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
ANDALUCÍA / JUNIO 2000 LOGSE / QUÍMICA / OPCIÓN A /EXAMEN COMPLETO OPCIÓN A
 OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
Enlaces Primarios o fuertes Secundarios o débiles
 Capítulo III MET 2217 Tipos de enlaces atómicos y moleculares Enlaces Primarios o fuertes Secundarios o débiles Enlaces primarios Iónico Actúan fuerzas intermoleculares relativamente grandes, electrostáticas.
Capítulo III MET 2217 Tipos de enlaces atómicos y moleculares Enlaces Primarios o fuertes Secundarios o débiles Enlaces primarios Iónico Actúan fuerzas intermoleculares relativamente grandes, electrostáticas.
H 2 SO 4 + Cu CuSO 4 + SO 2 + H 2 O. SO H e - SO H 2 O. Cu Cu e - Cu Cu e - +
 1 Universidad de Castilla la Mancha Selectividad Junio 2.01 Opción A 1.- El ácido sulfúrico (tetraoxosulfato (VI) de hidrógeno) reacciona con el cobre para dar sulfato de cobre (II) (tetraoxosulfato (VI)
1 Universidad de Castilla la Mancha Selectividad Junio 2.01 Opción A 1.- El ácido sulfúrico (tetraoxosulfato (VI) de hidrógeno) reacciona con el cobre para dar sulfato de cobre (II) (tetraoxosulfato (VI)
Introducción: La importancia del enlace. químicos. Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen
 Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
LA TABLA PERIÓDICA. 1
 LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS
 ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
EJERCICIOS DE ENLACE QUIMICO 2º DE BACHILLERATO
 1- Coloca las siguientes moléculas por orden creciente de su polaridad: HBr, HF, HI y HCl Justifica brevemente la respuesta 2- Al comparar dos moléculas muy similares como el CO 2 y el SO 2 se observa
1- Coloca las siguientes moléculas por orden creciente de su polaridad: HBr, HF, HI y HCl Justifica brevemente la respuesta 2- Al comparar dos moléculas muy similares como el CO 2 y el SO 2 se observa
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
HISTORIA DE SU DESCUBRIMIENTO
 1 HISTORIA DE SU DESCUBRIMIENTO La primera referencia histórica escrita acerca del hidrógeno procede de Paracelso, célebre alquimista, quien en el s. XVI observó un aire (que se desprendía al hacer reaccionar
1 HISTORIA DE SU DESCUBRIMIENTO La primera referencia histórica escrita acerca del hidrógeno procede de Paracelso, célebre alquimista, quien en el s. XVI observó un aire (que se desprendía al hacer reaccionar
1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos.
 Evolución histórica de la Tabla Periódica 1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos. 1869: Mendeleev y Meyer: las propiedades
Evolución histórica de la Tabla Periódica 1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos. 1869: Mendeleev y Meyer: las propiedades
El H solo necesita 2 electrones en su capa de valencia como el He.
 Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Universidad de Puerto Rico-Humacao Departamento de Química Quím 3031 (http://www.uprh.edu/~quimorg)
 1 Universidad de Puerto Rico-umacao Departamento de Química Quím 3031 (http://wwwuprhedu/~quimorg) ESTRATEGIA PARA LA ESRITURA DE ESTRUTURAS DE LEWIS Primeramente se debe establecer el número de electrones
1 Universidad de Puerto Rico-umacao Departamento de Química Quím 3031 (http://wwwuprhedu/~quimorg) ESTRATEGIA PARA LA ESRITURA DE ESTRUTURAS DE LEWIS Primeramente se debe establecer el número de electrones
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
TEMA 4. ESTRUCTURA DE LAS MOLÉCULAS ORGÁNICAS
 W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
Docente: Raquel Villafrades Torres. Química General
 Propiedades Periódicas Docente: Raquel Villafrades Torres Química General UPB Introducción Las propiedades periódicas son aquellas que varían de forma regular por la posición que ocupan los elementos en
Propiedades Periódicas Docente: Raquel Villafrades Torres Química General UPB Introducción Las propiedades periódicas son aquellas que varían de forma regular por la posición que ocupan los elementos en
Propiedades Periódicas y Propiedades de los elementos
 Propiedades Periódicas y Propiedades de los elementos Se denominan propiedades periódicas, aquellas que tienen una tendencia de variación de acuerdo a la ubicación de los elementos en la tabla periódica.
Propiedades Periódicas y Propiedades de los elementos Se denominan propiedades periódicas, aquellas que tienen una tendencia de variación de acuerdo a la ubicación de los elementos en la tabla periódica.
Guía de Estudio para 1er Parcial Temas Selectos de Química
 Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Enlaces Químicos y Estados de la Materia
 Enlaces Químicos y Estados de la Materia 1.- Concepto de enlace químico Mientras que sólo hay alrededor de 118 elementos catalogados en la tabla periódica, obviamente hay más substancias en la naturaleza
Enlaces Químicos y Estados de la Materia 1.- Concepto de enlace químico Mientras que sólo hay alrededor de 118 elementos catalogados en la tabla periódica, obviamente hay más substancias en la naturaleza
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
energía de enlace distancia de enlace
 Enlace covalente 1 Enlace covalente Se da entre dos átomos no-metálicos por compartición de e de valencia. Dos átomos unidos mediante enlace covalente tienen menos energía que los dos átomos aislados.
Enlace covalente 1 Enlace covalente Se da entre dos átomos no-metálicos por compartición de e de valencia. Dos átomos unidos mediante enlace covalente tienen menos energía que los dos átomos aislados.
ACTIVIDAD ACUMULATIVA
 1 Primer Semestre ACTIVIDAD ACUMULATIVA ENLACE QUÍMICO ESTRUCTURA DE LEWIS NOMBRE: NOTA (ACUMULATIVA): CURSO: 1º MEDIO PUNTAJE: FECA: Objetivos: 1. Comprender los aspectos esenciales del modelo atómico
1 Primer Semestre ACTIVIDAD ACUMULATIVA ENLACE QUÍMICO ESTRUCTURA DE LEWIS NOMBRE: NOTA (ACUMULATIVA): CURSO: 1º MEDIO PUNTAJE: FECA: Objetivos: 1. Comprender los aspectos esenciales del modelo atómico
3.1. Estructura atómica
 3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS.
 ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13
 CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
Capítulo 5. Propiedades periódicas de los elementos
 Capítulo 5. Propiedades periódicas de los elementos Objetivos: Justificación de las propiedades periódicas de los elementos Radio atómico: Potenciales de ionización. Carácter metálico y no metálico de
Capítulo 5. Propiedades periódicas de los elementos Objetivos: Justificación de las propiedades periódicas de los elementos Radio atómico: Potenciales de ionización. Carácter metálico y no metálico de
Enlace químico: moléculas diatómicas
 Química General e Inorgánica A Enlace químico: moléculas diatómicas Tema 5 Los electrones de valencia son los electrones del nivel exterior de un átomo. Los electrones de valencia son los electrones que
Química General e Inorgánica A Enlace químico: moléculas diatómicas Tema 5 Los electrones de valencia son los electrones del nivel exterior de un átomo. Los electrones de valencia son los electrones que
16. Estructuras de Lewis (III)
 16. Estructuras de Lewis (III) ( Son todas las estructuras de Lewis creadas igual? Modelo 1. Dos posibles estructuras para el CO 2. Experimentalmente, encontramos que ambos enlaces C O en CO 2 son idénticos.
16. Estructuras de Lewis (III) ( Son todas las estructuras de Lewis creadas igual? Modelo 1. Dos posibles estructuras para el CO 2. Experimentalmente, encontramos que ambos enlaces C O en CO 2 son idénticos.
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
LA TABLA PERIÓDICA. Cuestiones generales. Propiedades periódicas
 Cuestiones generales. LA TABLA PERIÓDICA. 1.- Indica el nombre, símbolo, nombre del grupo a que pertenece y periodo de los elementos de números atómicos 3, 9, 16, 19, 38 y 51. 2.- a) Indica el nombre,
Cuestiones generales. LA TABLA PERIÓDICA. 1.- Indica el nombre, símbolo, nombre del grupo a que pertenece y periodo de los elementos de números atómicos 3, 9, 16, 19, 38 y 51. 2.- a) Indica el nombre,
El estudio se centrará en los compuestos heterocíclicos insaturados (alternados) aromáticos
 TEMA 5: ETRUCTURA Y PRPIEDADE GEERALE Aromaticidad en compuestos heterocíclicos El estudio se centrará en los compuestos heterocíclicos insaturados (alternados) aromáticos - Los no aromáticos tienen unas
TEMA 5: ETRUCTURA Y PRPIEDADE GEERALE Aromaticidad en compuestos heterocíclicos El estudio se centrará en los compuestos heterocíclicos insaturados (alternados) aromáticos - Los no aromáticos tienen unas
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
Dienos aislados. Dienos conjugados. Dienos acumulados (alenos)
 TEMA 10.- Hidrocarburos poliinsaturados. Clasificación. Dienos conjugados. Reacciones de adición. Cicloadiciones. Reacciones de Diels-Alder. Un dieno es un compuesto orgánico que tiene dos enlaces dobles.
TEMA 10.- Hidrocarburos poliinsaturados. Clasificación. Dienos conjugados. Reacciones de adición. Cicloadiciones. Reacciones de Diels-Alder. Un dieno es un compuesto orgánico que tiene dos enlaces dobles.
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
Resolución ejercicios PRÁCTICO 11
 Resolución ejercicios PRÁCTIC 11 1- a) La configuración electrónica del S es [Ne] 3s 2 3p 4, por lo tanto podemos decir que presenta 6 e - en la capa de valencia. Entonces el símbolo de Lewis para dicho
Resolución ejercicios PRÁCTIC 11 1- a) La configuración electrónica del S es [Ne] 3s 2 3p 4, por lo tanto podemos decir que presenta 6 e - en la capa de valencia. Entonces el símbolo de Lewis para dicho
Problemario de Talleres de Estructura de la Materia. DCBI/UAM-I. Obra Colectiva del. / Revisión octubre del 2012 UNIDAD 2
 UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
Contenido. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades periódicas:
 LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR FACULTAD DE CIENCIAS EXACTAS Y NATURALES ESCUELA DE CIENCIAS QUÍMICAS
 PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR FACULTAD DE CIENCIAS EXACTAS Y NATURALES ESCUELA DE CIENCIAS QUÍMICAS 1.- DATOS INFORMATIVOS MATERIA: Química General I CARRERA: Química Analítica NIVEL: Primero
PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR FACULTAD DE CIENCIAS EXACTAS Y NATURALES ESCUELA DE CIENCIAS QUÍMICAS 1.- DATOS INFORMATIVOS MATERIA: Química General I CARRERA: Química Analítica NIVEL: Primero
Repartido nº3 Estructura electrónica y Tabla Periódica
 La periferia: Recordamos: Repartido nº3 Estructura electrónica y Tabla Periódica En la periferia se encuentran los electrones. La cantidad de electrones de un átomo equivale a la cantidad de protones,
La periferia: Recordamos: Repartido nº3 Estructura electrónica y Tabla Periódica En la periferia se encuentran los electrones. La cantidad de electrones de un átomo equivale a la cantidad de protones,
Guía del docente. 1. Descripción curricular:
 Guía del docente. 1. Descripción curricular: - Nivel: 3º medio. - Subsector: Ciencias Químicas. - Unidad temática: Reactividad en química orgánica, hidrocarburos. - Palabras claves: reacciones orgánicas,
Guía del docente. 1. Descripción curricular: - Nivel: 3º medio. - Subsector: Ciencias Químicas. - Unidad temática: Reactividad en química orgánica, hidrocarburos. - Palabras claves: reacciones orgánicas,
