Los elementos químicos
|
|
|
- Héctor Juan Luis Bustos Sánchez
- hace 9 años
- Vistas:
Transcripción
1 Los elementos químicos Física y Química
2 Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2
3 Un elemento químico es un tipo de materia constituido por átomos de la misma clase. La clasificación más sencilla de los elementos es en metales y no metales. Metales y no metales Metales Son opacos y poseen un brillo característico (brillo metálico). Son buenos conductores del calor y la corriente eléctrica. Son maleables y dúctiles. Excepto el mercurio, que es líquido, son sólidos a temperatura ambiente. La mayoría tienen elevados puntos de fusión y ebullición. Ejemplos de metales: hierro, cobre, cinc, mercurio, oro, plata, níquel, plomo, etc. No metales No poseen brillo metálico. Son malos conductores del calor y la electricidad. A temperatura ambiente pueden ser sólidos, líquidos o gaseosos. En general tienen puntos de fusión y ebullición muy bajos. En estado sólido son frágiles y se rompen con facilidad. Ejemplos de no metales: hidrógeno, oxígeno, cloro, nitrógeno, carbono, flúor, helio, etc. Oxford University Press España, S. A. Física y Química 3º ESO 3
4 Las primeras clasificaciones periódicas Mendeleiev dispuso 63 elementos en orden creciente de masa atómica, para situar en una misma fila aquellos con propiedades parecidas. o Evitó colocar metales junto a no metales. o Permutó el orden entre el telurio y el yodo, para que el telurio estuviera junto al azufre y el selenio, y el yodo junto al bromo y el cloro. o Cuando las propiedades de un elemento no guardaban relación alguna con la posición que le correspondía según su masa atómica, dejaba ese hueco, para que más adelante pudiera ocuparlo un nuevo elemento, aún no descubierto. Oxford University Press España, S. A. Física y Química 3º ESO 4
5 Cómo se mide la masa de los átomos? Oxford University Press España, S. A. Física y Química 3º ESO 5
6 La unidad de masa atómica es la doceava parte de la masa de un átomo de C-12 ( 12 C). La masa atómica relativa es la masa de un átomo medida en relación con la doceava parte del átomo de C-12 y es una magnitud adimensional. Un espectrómetro de masas es un aparato que permite medir la masa de un átomo en comparación con la doceava parte del átomo de C-12. La masa atómica relativa de un elemento se calcula como la masa media ponderada de sus isótopos. masa atómica relativa = % isótopo m 1 + % isótopo m 2 + % isótopo m 3 Oxford University Press España, S. A. Física y Química 3º ESO 6
7 Clasificación actual de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 7
8 En la tabla periódica los elementos están ordenados de arriba abajo (grupos) y de izquierda a derecha (períodos) en orden creciente de número atómico. o Un grupo es cada una de las columnas verticales de la tabla periódica. Los elementos de un mismo grupo tienen el mismo número de electrones en la última capa (electrones de valencia). Existen 18 grupos, numerados del 1 al 18. o Un período es cada una de las filas horizontales de la tabla periódica. Los elementos de un mismo período tienen el mismo número de niveles electrónicos. Hay 7 períodos formando filas y numerados del 1 al 7. Metales y no metales en el sistema periódico Las propiedades metálicas de los elementos se acentúan a medida que nos desplazamos a la izquierda y a medida que bajamos en la tabla. Oxford University Press España, S. A. Física y Química 3º ESO 8
9 Oxford University Press España, S. A. Física y Química 3º ESO 9
10 La tabla periódica y la configuración electrónica de los elementos Grupo 18: helio, neón, argón, criptón, xenón y radón o Los elementos del grupo 18 reciben el nombre de gases nobles. Son elementos metálicos. o La configuración electrónica del helio es 2 0. o La configuración electrónica de la última capa del neón, argón, criptón, xenón y radón es 2 6. Grupo 17: flúor, cloro, bromo y yodo o Los elementos del grupo 17 se denominan halógenos. Son no metálicos. o La configuración electrónica de su última capa es 2 5, es decir, les falta un electrón para tener la configuración electrónica de un gas noble. o Tienden a formar iones con una carga negativa. Oxford University Press España, S. A. Física y Química 3º ESO 10
11 Grupo 1: litio, sodio, potasio, rubidio y cesio o A los elementos del grupo 1 se les llama alcalinos. Son elementos metálicos. o La configuración electrónica de su última capa es 1 0, es decir, les sobra un electrón para tener la misma configuración electrónica que la del gas noble más próximo. o Estos elementos tienden a formar iones con una carga positiva. Los elementos representativos o Son los elementos de los grupos 1, 2, 13, 14, 15, 16, 17 y 18. o La configuración electrónica de su capa más externa varía desde 1 0 hasta 2 6. Oxford University Press España, S. A. Física y Química 3º ESO 11
12 El Los método elementos científico químicos Agrupaciones de los átomos en los elementos: átomos, moléculas y cristales Oxford University Press España, S. A. Física y Química 3º ESO 12
13 El Los método elementos científico químicos están formados por la unión de átomos iguales, y los compuestos químicos por la unión de átomos de elementos diferentes. Algunos elementos químicos se encuentran en la naturaleza como átomos aislados, otros forman moléculas y muchos de ellos se presentan en forma de cristales. Átomos aislados: los elementos del grupo 18 o Los elementos del grupo 18, los gases nobles, se encuentran en forma de átomos aislados. o A temperatura ambiente son sustancias gaseosas que no conducen la corriente eléctrica. o Tienen su última capa electrónica completa, es decir, poseen ocho electrones, excepto el helio, que cuenta con dos. Esta configuración electrónica les proporciona gran estabilidad. Oxford University Press España, S. A. Física y Química 3º ESO 13
14 El Los método elementos científico químicos Formando moléculas: elementos no metálicos o Elementos como el hidrógeno, el oxígeno, el nitrógeno, el flúor, el cloro, el bromo, etc., se presentan en forma de moléculas diatómicas, es decir, H 2, O 2, N 2, F 2, Cl 2, Br 2 o A temperatura ambiente son sustancias gaseosas que no conducen la corriente eléctrica. Un enlace químico es una atracción de tipo electrostático entre dos o más átomos que permite que estos alcancen la estabilidad. Si el enlace se produce por compartición de electrones decimos que se trata de un enlace covalente. Oxford University Press España, S. A. Física y Química 3º ESO 14
15 El Los método elementos científico químicos Formando cristales covalentes: elementos no metálicos El átomo de carbono tiene cuatro electrones en su última capa. Puede formar cuatro enlaces covalentes. Forma un cristal covalente. Un cristal es un sólido cuyas partículas se ordenan conforme a un patrón que se repite en las tres direcciones del espacio El carbono puede encontrarse en la naturaleza en dos variedades: diamante y grafito. Cristal de diamante Cada átomo de carbono está unido a cuatro átomos de carbono. Esta red hace que el diamante sea un sólido muy duro, con altos puntos de fusión y ebullición. No conduce la corriente eléctrica. Cristal de grafito Cada átomo de carbono está unido a tres átomos de carbono en un mismo plano y en planos adyacentes a un cuarto átomo de carbono. Es un sólido blando y untuoso. Conduce la corriente eléctrica. Oxford University Press España, S. A. Física y Química 3º ESO 15
16 El Los método elementos científico químicos Formando cristales metálicos: elementos metálicos o Todos los metales conducen la corriente eléctrica. o La mayor parte de los metales poseen uno, dos o tres electrones en la capa más externa de sus átomos. En un cristal metálico, las partículas que constituyen la red son átomos (iones positivos) que han perdido esos electrones externos, los cuales están deslocalizados por todo el cristal (se dice que constituyen un «mar de electrones»), es decir, no pertenecen a un átomo en concreto. o Los metales conducen la corriente eléctrica porque estos electrones se pueden mover con facilidad por todo el cristal. o La mayoría de los metales son duros, porque sus átomos forman uniones muy compactas, y son dúctiles y maleables. o Este tipo de unión recibe el nombre de enlace metálico. Oxford University Press España, S. A. Física y Química 3º ESO 16
17 El Los método elementos científico químicos Propiedades de algunas familias de elementos químicos Oxford University Press España, S. A. Física y Química 3º ESO 17
18 El Los método elementos científico químicos Una familia o grupo es un conjunto de elementos químicos que presentan propiedades físicas y químicas parecidas. Estas propiedades varían de forma periódica dentro de la columna que ocupa el grupo. Dos de las familias más importantes son la de los alcalinos y la de los halógenos. Grupo 1: Alcalinos Propiedades La familia de los alcalinos está formada por: litio, sodio, potasio, rubidio y cesio. Son metales. Tienen brillo metálico. Tienen un electrón en la última capa. Los puntos de fusión y ebullición disminuyen al bajar en el grupo. Son sólidos blandos. Son buenos conductores de la electricidad y del calor. Reactividad Son los metales más reactivos que existen, por lo que no se encuentran en estado libre en la naturaleza, sino combinados con otros elementos. Reaccionan violentamente con el oxígeno y con el agua. Esta reactividad es mayor al bajar en el grupo. Oxford University Press España, S. A. Física y Química 3º ESO 18
19 El Los método elementos científico químicos Grupo 17: Halógenos Propiedades La familia de los halógenos está formada por: flúor, cloro, bromo y yodo. Son no metales. Tienen siete electrones en la última capa. Los puntos de fusión y ebullición aumentan al bajar en el grupo. A temperatura ambiente, el flúor y el cloro son gases, el bromo es un líquido y el yodo es un sólido. Reactividad Los halógenos son sustancias muy reactivas que deben manejarse en el laboratorio con mucha precaución. Por ejemplo, el flúor y el cloro son corrosivos y venenosos. Oxford University Press España, S. A. Física y Química 3º ESO 19
6. ELEMENTOS Y COMPUESTOS
 6. ELEMENTOS Y COMPUESTOS Las definiciones de elemento 1. Define sustancia simple y elemento. Una sustancia simple es una sustancia pura que no puede descomponerse en otras sustancias más sencillas por
6. ELEMENTOS Y COMPUESTOS Las definiciones de elemento 1. Define sustancia simple y elemento. Una sustancia simple es una sustancia pura que no puede descomponerse en otras sustancias más sencillas por
1. Los elementos químicos
 RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
LA MATERIA. Características de los átomos
 LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
Ejercicios UD. 4 Elementos y Compuestos Física y Química CEPA COSLADA
 1.- En qué consistía la ley de las triadas? Quién la propuso? 2.- Por qué la tabla donde se ordenan los elementos químicos se llama tabla periódica? Los elementos están ordenados en la tabla periódica
1.- En qué consistía la ley de las triadas? Quién la propuso? 2.- Por qué la tabla donde se ordenan los elementos químicos se llama tabla periódica? Los elementos están ordenados en la tabla periódica
4 Elementos y compuestos
 4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
TABLA PERIODICA. Ciencias naturales Ambientes Raymond Chang
 TABLA PERIODICA Ciencias naturales Ambientes Raymond Chang TABLA PERIODICA La organización más satisfactoria de los elementos fue obra de Dmitri Mendeleev, quien señalo que las propiedades, tanto físicas
TABLA PERIODICA Ciencias naturales Ambientes Raymond Chang TABLA PERIODICA La organización más satisfactoria de los elementos fue obra de Dmitri Mendeleev, quien señalo que las propiedades, tanto físicas
QUÍMICA FUNDAMENTAL. Tabla Periódica
 QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
CONFIGURACIÓN ELECTRÓNICA
 ÁTOMOS Y MOLÉCULAS CONFIGURACIÓN ELECTRÓNICA Cada uno de estos niveles puede contener a su vez varios subniveles energéticos que se designan con las letras s, p, d y f. Cada nivel energético dispone sólo
ÁTOMOS Y MOLÉCULAS CONFIGURACIÓN ELECTRÓNICA Cada uno de estos niveles puede contener a su vez varios subniveles energéticos que se designan con las letras s, p, d y f. Cada nivel energético dispone sólo
Conocer las formas de clasificación de los elementos según grupo y periodo. Identificar los criterios de clasificación de los elementos químicos.
 Conocer las formas de clasificación de los elementos según grupo y periodo. Identificar los criterios de clasificación de los elementos químicos. Relacionar características de los átomos y su orden en
Conocer las formas de clasificación de los elementos según grupo y periodo. Identificar los criterios de clasificación de los elementos químicos. Relacionar características de los átomos y su orden en
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS. Cuestiones de evaluación inicial. 2.- Cuántos protones y cuantos neutrones tiene el Carbono?
 UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
Aprendizaje esperado. Conocer la tabla periódica y sus características generales, estableciendo una relación con la configuración electrónica.
 Aprendizaje esperado Conocer la tabla periódica y sus características generales, estableciendo una relación con la configuración electrónica. Formulación de la Tabla Periódica En 1869 los trabajos realizados
Aprendizaje esperado Conocer la tabla periódica y sus características generales, estableciendo una relación con la configuración electrónica. Formulación de la Tabla Periódica En 1869 los trabajos realizados
2. Cuál(es) de las siguientes propiedades periódicas aumenta(n) al incrementarse el número atómico en un grupo?
 Programa Estándar Anual Nº Guía práctica Teoría atómica III: tabla periódica y propiedades periódicas Ejercicios PSU 1. En un sistema periódico muy simplificado, como el que se muestra en la figura, los
Programa Estándar Anual Nº Guía práctica Teoría atómica III: tabla periódica y propiedades periódicas Ejercicios PSU 1. En un sistema periódico muy simplificado, como el que se muestra en la figura, los
Colección de problemas Unidad 2
 Facultad de Química, UNAM Curso: Química General I Colección de problemas Unidad 2 1. Describe una contribución importante a la ciencia hecha por cada uno de los científicos siguientes: Dalton, Thomson,
Facultad de Química, UNAM Curso: Química General I Colección de problemas Unidad 2 1. Describe una contribución importante a la ciencia hecha por cada uno de los científicos siguientes: Dalton, Thomson,
Colegio Superior de Señoritas Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 -
 Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Respuesta Corta: Escriba en las líneas lo que se le solicita. 1. Cuál es el número atómico, de protones y de electrones de los siguientes
Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Respuesta Corta: Escriba en las líneas lo que se le solicita. 1. Cuál es el número atómico, de protones y de electrones de los siguientes
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 4
 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 4 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: DOCENTES: Química General La Tabla Periódica
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 4 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: DOCENTES: Química General La Tabla Periódica
Colección de ejercicios UNIDAD 2
 Facultad de Química, UNAM Curso: Química General I, gpo 8 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por cada uno de los siguientes
Facultad de Química, UNAM Curso: Química General I, gpo 8 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por cada uno de los siguientes
CIENCIAS II CON ENFASIS EN QUIMICA
 CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos.
 Evolución histórica de la Tabla Periódica 1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos. 1869: Mendeleev y Meyer: las propiedades
Evolución histórica de la Tabla Periódica 1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos. 1869: Mendeleev y Meyer: las propiedades
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1
 GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
INTRODUCCIÓN A LA QUÍMICA
 INTRODUCCIÓN A LA QUÍMICA TRABAJO PRÁCTICO N 1 4 Año A, B, C, D 2.015 Prof. María Laura Sepúlveda Broky INTRODUCCIÓN A LA QUÍMICA Prof. María Laura Sepúlveda Broky 1)A- Realizar un esquema de la Tabla
INTRODUCCIÓN A LA QUÍMICA TRABAJO PRÁCTICO N 1 4 Año A, B, C, D 2.015 Prof. María Laura Sepúlveda Broky INTRODUCCIÓN A LA QUÍMICA Prof. María Laura Sepúlveda Broky 1)A- Realizar un esquema de la Tabla
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Teoría atómica III: tabla periódica y propiedades periódicas Nº Ejercicios PSU 1. En la tabla periódica, los elementos están ordenados según un valor creciente de su
Programa Técnico Profesional QUÍMICA Teoría atómica III: tabla periódica y propiedades periódicas Nº Ejercicios PSU 1. En la tabla periódica, los elementos están ordenados según un valor creciente de su
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos
 3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
Elementos ordenados según su número atómico (Z, número de p + ) Hay 18 PERÍODOS
 TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
LECCIÓN Nº 03 TABLA PERIÓDICA
 LECCIÓN Nº 03 TABLA PERIÓDICA OBJETIVO ESPECÍFICO: Conocer las características estructurales y propiedades de las partículas subatómicas(electrón, protón y neutrón), modelos Reconocer Número atómico y
LECCIÓN Nº 03 TABLA PERIÓDICA OBJETIVO ESPECÍFICO: Conocer las características estructurales y propiedades de las partículas subatómicas(electrón, protón y neutrón), modelos Reconocer Número atómico y
Solución: Son sustancias moleculares la a) y la e), porque los átomos que las forman son de elementos no metálicos.
 1 El azufre es un elemento que está en el período 3 y el grupo 6 del sistema periódico. Escribe su distribución electrónica en capas. Si capta 2 electrones, qué configuración electrónica adquiere? Será
1 El azufre es un elemento que está en el período 3 y el grupo 6 del sistema periódico. Escribe su distribución electrónica en capas. Si capta 2 electrones, qué configuración electrónica adquiere? Será
LA TABLA PERIÓDICA. 1
 LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
1. Uno de los grandes aciertos de los postulados de Mendeleiev respecto a la ordenación de los elementos fue:
 miniprueba Clase 04 Problemas 1. Uno de los grandes aciertos de los postulados de Mendeleiev respecto a la ordenación de los elementos fue: a. Designar un lugar fijo para el hidrogeno. b. Ordenar los elementos
miniprueba Clase 04 Problemas 1. Uno de los grandes aciertos de los postulados de Mendeleiev respecto a la ordenación de los elementos fue: a. Designar un lugar fijo para el hidrogeno. b. Ordenar los elementos
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
Tabla Periódica y Propiedades Periódicas
 Tabla Periódica y Propiedades Periódicas Primeras clasificaciones periódicas. Fines S. XVIII Metales y no metales. 1829, Döbereiner Tríadas de comportamiento químico similar. A principios del siglo XIX
Tabla Periódica y Propiedades Periódicas Primeras clasificaciones periódicas. Fines S. XVIII Metales y no metales. 1829, Döbereiner Tríadas de comportamiento químico similar. A principios del siglo XIX
La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica.
 SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13
 CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
TABLA PERIÓDICA. La clasificación más sencilla de los elementos químicos consiste en catalogarlos en metales, no metales y gases nobles.
 TABLA PERIÓDICA En la tabla periódica, los elementos químicos se encuentran ordenados en orden creciente a su número atómico (Z), es decir, al número de protones que tienen en el núcleo. La tabla periódica
TABLA PERIÓDICA En la tabla periódica, los elementos químicos se encuentran ordenados en orden creciente a su número atómico (Z), es decir, al número de protones que tienen en el núcleo. La tabla periódica
Colección de ejercicios UNIDAD 2
 Facultad de Química, UNAM Curso: Química General I, gpo 14 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por: J. Dalton, J. J. Thomson,
Facultad de Química, UNAM Curso: Química General I, gpo 14 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por: J. Dalton, J. J. Thomson,
TEMA 2. ÁTOMO, MOLÉCULAS Y CRISTALES
 TEMA 2. ÁTOMO, MOLÉCULAS Y CRISTALES 1. El Sistema Periódico de los elementos. 2. El enlace químico. 3. Interpretación de las propiedades de las sustancias. INDICE 1. La primera clasificación de los elementos
TEMA 2. ÁTOMO, MOLÉCULAS Y CRISTALES 1. El Sistema Periódico de los elementos. 2. El enlace químico. 3. Interpretación de las propiedades de las sustancias. INDICE 1. La primera clasificación de los elementos
5 Elementos y compuestos químicos
 1. Por qué la tabla donde se ordenan los elementos químicos se llama tabla periódica? Los elementos están ordenados en la tabla periódica de forma que sus propiedades se repiten periódicamente cada cierto
1. Por qué la tabla donde se ordenan los elementos químicos se llama tabla periódica? Los elementos están ordenados en la tabla periódica de forma que sus propiedades se repiten periódicamente cada cierto
SOLUCIONES EJERCICIOS DE ENLACE QUÍMICO. 1º BCT
 SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
RESPUESTA Guía de ejercicios #5 Enlace químico
 Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
Departamento de Física y Química. 2.- Deduce el número de neutrones, protones y electrones de los átomos siguientes:
 1.- Para el átomo de Galio, 69 31Ga ; deduce el número de protones, electrones y neutrones. 2.- Deduce el número de neutrones, protones y electrones de los átomos siguientes: U ; Hg ; Th ; He; Ne 235 200
1.- Para el átomo de Galio, 69 31Ga ; deduce el número de protones, electrones y neutrones. 2.- Deduce el número de neutrones, protones y electrones de los átomos siguientes: U ; Hg ; Th ; He; Ne 235 200
1.5. TABLA PERIÓDICA.
 1.5. TABLA PERIÓDICA. 1.5.1. TABLA PERIÓDICA. La tabla periódica ordena todos los elementos conocidos según sus propiedades. Los últimos elementos, todavía no han recibido nombre oficial. El orden de los
1.5. TABLA PERIÓDICA. 1.5.1. TABLA PERIÓDICA. La tabla periódica ordena todos los elementos conocidos según sus propiedades. Los últimos elementos, todavía no han recibido nombre oficial. El orden de los
Ejercicios y respuestas del apartado: Propiedades de los períodos y de los grupos. Electronegatividad
 Ejercicios y respuestas del apartado: Propiedades de los períodos y de los grupos. Electronegatividad Propiedades periódicas (1) La electronegatividad en la tabla periódica disminuye cuanto más a la (1)
Ejercicios y respuestas del apartado: Propiedades de los períodos y de los grupos. Electronegatividad Propiedades periódicas (1) La electronegatividad en la tabla periódica disminuye cuanto más a la (1)
Contenidos. 1.- Primeras clasificaciones periódicas.
 LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
La tabla periódica de los elementos
 La tabla periódica de los elementos 4 año secundario Vamos a iniciar este tema realizando un vistazo a la tabla periódica de los elementos. Aquí les doy varios sitios a los que pueden acudir para conocerla.
La tabla periódica de los elementos 4 año secundario Vamos a iniciar este tema realizando un vistazo a la tabla periódica de los elementos. Aquí les doy varios sitios a los que pueden acudir para conocerla.
En la tabla periódica los elementos se clasifican periodos y grupos o familias.
 1 Curso: 1º medio Nombre alumno: Puntaje: Fecha: ACTIVIDAD ACUMULATIVA PROPIEDADES PERIÓDICAS Recordemos que: La primera tabla periódica o sistema periódico de los elementos fue presentada por Mendeleiev
1 Curso: 1º medio Nombre alumno: Puntaje: Fecha: ACTIVIDAD ACUMULATIVA PROPIEDADES PERIÓDICAS Recordemos que: La primera tabla periódica o sistema periódico de los elementos fue presentada por Mendeleiev
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Unidad II Química I PERIODICIDAD QUÍMICA Y TABLA PERIÓDICA
 Unidad II Química I PERIODICIDAD QUÍMICA Y TABLA PERIÓDICA Gloria Angélica Fuentes Zenteno 1 Índice 2.3.1 Antecedentes 2.3.2 Componentes de la Tabla Periódica Nombre Símbolo Número y Masa atómica Estructura
Unidad II Química I PERIODICIDAD QUÍMICA Y TABLA PERIÓDICA Gloria Angélica Fuentes Zenteno 1 Índice 2.3.1 Antecedentes 2.3.2 Componentes de la Tabla Periódica Nombre Símbolo Número y Masa atómica Estructura
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
COLEGIO SAN JOSÉ - Hijas de María Auxiliadora C/ Emilio Ferrari, 87 - Madrid Departamento de Ciencias Naturales
 TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS Y SOLUCIONES 4. El sistema periódico 1. Escribe la configuración electrónica de los 3 primeros elementos alcalinotérreos y explica razonadamente si estos elementos
TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS Y SOLUCIONES 4. El sistema periódico 1. Escribe la configuración electrónica de los 3 primeros elementos alcalinotérreos y explica razonadamente si estos elementos
Actividades de refuerzo
 Actividades de refuerzo 1. Localiza doce elementos del sistema periódico e indica si son metálicos o no metálicos y a qué grupo pertenecen. A R G O N O S P O I L A S D I G L O E R U N P B T O G I T U M
Actividades de refuerzo 1. Localiza doce elementos del sistema periódico e indica si son metálicos o no metálicos y a qué grupo pertenecen. A R G O N O S P O I L A S D I G L O E R U N P B T O G I T U M
Departamento de Física y Química Adaptaciones 3º E.S.O.
 Los elementos químicos se ordenan en la Tabla de los elementos (Tabla periódica) siguiendo el criterio de número atómico creciente, es decir, según el número de protones que tienen en el núcleo. El primer
Los elementos químicos se ordenan en la Tabla de los elementos (Tabla periódica) siguiendo el criterio de número atómico creciente, es decir, según el número de protones que tienen en el núcleo. El primer
b) La zona externa del átomo se llama CORTEZA. y ahí es donde se mueven los ELECTRONES
 PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
Propiedades Periódicas y Propiedades de los elementos
 Propiedades Periódicas y Propiedades de los elementos Se denominan propiedades periódicas, aquellas que tienen una tendencia de variación de acuerdo a la ubicación de los elementos en la tabla periódica.
Propiedades Periódicas y Propiedades de los elementos Se denominan propiedades periódicas, aquellas que tienen una tendencia de variación de acuerdo a la ubicación de los elementos en la tabla periódica.
Longitud y energía de enlace
 Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
DEPARTAMENTO DE FÍSICA Y QUÍMICA LUIS RUIZ MARTÍN FÍSICA Y QUÍMICA 3º DE ESO
 DEPARTAMENTO DE FÍSIA Y QUÍMIA LUIS RUIZ MARTÍN FÍSIA Y QUÍMIA 3º DE ESO ATIVIDAD 1: El modelo atómico de Dalton LOS ÁTOMOS Y SU OMPLEJIDAD 1.- uántos tipos de átomos hay en el dibujo de arriba? 2.- Qué
DEPARTAMENTO DE FÍSIA Y QUÍMIA LUIS RUIZ MARTÍN FÍSIA Y QUÍMIA 3º DE ESO ATIVIDAD 1: El modelo atómico de Dalton LOS ÁTOMOS Y SU OMPLEJIDAD 1.- uántos tipos de átomos hay en el dibujo de arriba? 2.- Qué
El átomo de S recibe 2 electrones y se transforma en un ión azufre, adquiriendo la configuración del gas noble Argón.
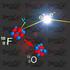 FUNDACIÓN EDUCACIONAL COLEGIO DE LOS SS.CC. - MANQUEHUE - Átomos, iones y moléculas. ENLACE QUÍMICO DEPARTAMENTO DE CIENCIAS PROFESORA: SILVINA IRIBERRI CURSO: SEGUNDO MEDIO Todos los objetos materiales
FUNDACIÓN EDUCACIONAL COLEGIO DE LOS SS.CC. - MANQUEHUE - Átomos, iones y moléculas. ENLACE QUÍMICO DEPARTAMENTO DE CIENCIAS PROFESORA: SILVINA IRIBERRI CURSO: SEGUNDO MEDIO Todos los objetos materiales
LOS ÁTOMOS Y LAS PROPIEDADES DE LA MATERIA. (Ciencias Elemental) PROFESORA GILDA DIAZ MAT H AND S C I ENCE PAR T NERSHIP FOR T HE 21S T CENTURY
 LOS ÁTOMOS Y LAS PROPIEDADES DE LA MATERIA (Ciencias Elemental) PROFESORA GILDA DIAZ MAT H AND S C I ENCE PAR T NERSHIP FOR T HE 21S T CENTURY ELEMENTARY AND MIDDLE S C HOOL MSP -21 ACADEMIA DE VERANO
LOS ÁTOMOS Y LAS PROPIEDADES DE LA MATERIA (Ciencias Elemental) PROFESORA GILDA DIAZ MAT H AND S C I ENCE PAR T NERSHIP FOR T HE 21S T CENTURY ELEMENTARY AND MIDDLE S C HOOL MSP -21 ACADEMIA DE VERANO
Modelo Pregunta 1A a) b) Septiembre Pregunta A1.- a) b) c) d) Junio Pregunta 1A a) b) c) d) Solución. Modelo Pregunta 1B.
 Modelo 2014. Pregunta 1A.- Cuando una muestra de átomos del elemento con Z = 19 se irradia con luz ultravioleta, se produce la emisión de electrones, formándose iones con carga +1. a) Escriba la configuración
Modelo 2014. Pregunta 1A.- Cuando una muestra de átomos del elemento con Z = 19 se irradia con luz ultravioleta, se produce la emisión de electrones, formándose iones con carga +1. a) Escriba la configuración
Antecedentes históricos. Clasificación periódica
 Antecedentes históricos Clasificación periódica El descubrimiento de un gran número de elementos y el estudio de sus propiedades puso de manifiesto entre algunos de ellos ciertas semejanzas. Esto indujo
Antecedentes históricos Clasificación periódica El descubrimiento de un gran número de elementos y el estudio de sus propiedades puso de manifiesto entre algunos de ellos ciertas semejanzas. Esto indujo
TEMA 5: MODELOS ATÓMICOS
 TEMA 5: MODELOS ATÓMICOS La pequeña historia del átomo es un ejemplo magnífico del MÉTODO CIENTÍFICO: se idean modelos de como creemos que es la realidad, que son válidos si explican hechos conocidos y
TEMA 5: MODELOS ATÓMICOS La pequeña historia del átomo es un ejemplo magnífico del MÉTODO CIENTÍFICO: se idean modelos de como creemos que es la realidad, que son válidos si explican hechos conocidos y
ORGANIZACIÓN DE LOS ELEMENTOS EN LA TABLA PERIÓICA PROPIEDADES PERIÓDICAS
 Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
ÁTOMOS Y RADIACTIVIDAD
 ÁTOMOS Y RADIACTIVIDAD 1 ATOMOS, MOLECULAS E IONES Atomo: Según Dalton un átomo se define como la cantidad básica de un elemento que puede intervenir en una combinación química. Los átomos están formados
ÁTOMOS Y RADIACTIVIDAD 1 ATOMOS, MOLECULAS E IONES Atomo: Según Dalton un átomo se define como la cantidad básica de un elemento que puede intervenir en una combinación química. Los átomos están formados
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS
 CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS Entre las propiedades de los elementos químicos existen semejanzas y diferencias que permiten formar grupos semejantes. Esta clasificación es útil para sistematizar
CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS Entre las propiedades de los elementos químicos existen semejanzas y diferencias que permiten formar grupos semejantes. Esta clasificación es útil para sistematizar
Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres).
 Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
COLEGIO PEDAGOGICO DE LOS ANDES. Asignatura: QUIMICA. Docente: Lic. Karina Díaz Pacheco Estudiante:
 COLEGIO PEDAGOGICO DE LOS ANDES Grado: 9 Periodo: Tercer Fecha : / / / / Asignatura: QUIMICA. Docente: Lic. Karina Díaz Pacheco Estudiante: Utiliza la tabla periódica. Selección múltiple con única respuesta
COLEGIO PEDAGOGICO DE LOS ANDES Grado: 9 Periodo: Tercer Fecha : / / / / Asignatura: QUIMICA. Docente: Lic. Karina Díaz Pacheco Estudiante: Utiliza la tabla periódica. Selección múltiple con única respuesta
GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : TABLA PERIODICA. Nombre alumno: Curso: Fecha:
 Liceo Juan ntonio Ríos Quinta Normal GU DE PRENDZJE QUMC 1º MED TEM : TBL PERDC Unidad temática: Estructura atómica (Tabla periódica) bjetivo General: Relacionar la estructura electrónica de los átomos
Liceo Juan ntonio Ríos Quinta Normal GU DE PRENDZJE QUMC 1º MED TEM : TBL PERDC Unidad temática: Estructura atómica (Tabla periódica) bjetivo General: Relacionar la estructura electrónica de los átomos
Asignatura: Química 2. Curso: 3 ro. de Media. Proyecto Nº 3. Mes: Marzo-Abril. Año: Prof.: Lic. Manuel B. Noboa G.
 Asignatura: Química 2. Curso: 3 ro. de Media. Proyecto Nº 3. Mes: Marzo-Abril. Año: 2014-2015. Prof.: Lic. Manuel B. Noboa G. Unidad Nº 3: Elementos de los Bloques P y D. Propósito Nº 1: P. C.: 20 de marzo
Asignatura: Química 2. Curso: 3 ro. de Media. Proyecto Nº 3. Mes: Marzo-Abril. Año: 2014-2015. Prof.: Lic. Manuel B. Noboa G. Unidad Nº 3: Elementos de los Bloques P y D. Propósito Nº 1: P. C.: 20 de marzo
A. VIVENCIA Elabora la siguiente sopa de letras y define los conceptos:
 INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
ACTIVIDAD ACUMULATIVA
 1 Primer Semestre ACTIVIDAD ACUMULATIVA ENLACE QUÍMICO ESTRUCTURA DE LEWIS NOMBRE: NOTA (ACUMULATIVA): CURSO: 1º MEDIO PUNTAJE: FECA: Objetivos: 1. Comprender los aspectos esenciales del modelo atómico
1 Primer Semestre ACTIVIDAD ACUMULATIVA ENLACE QUÍMICO ESTRUCTURA DE LEWIS NOMBRE: NOTA (ACUMULATIVA): CURSO: 1º MEDIO PUNTAJE: FECA: Objetivos: 1. Comprender los aspectos esenciales del modelo atómico
ACTIVIDADES PARA LA RECUPERACIÓN Y SUPERACIÓN DE INDICADORES PENDIENTES
 DOCENTE: Luisa Medina GRADO: Sexto ASIGNATURA: Química PERIODO: IV Tenga en cuenta: Todas las actividades escritas deben entregarse en hojas cuadriculadas (carta u oficio) legajadas en una carpeta. En
DOCENTE: Luisa Medina GRADO: Sexto ASIGNATURA: Química PERIODO: IV Tenga en cuenta: Todas las actividades escritas deben entregarse en hojas cuadriculadas (carta u oficio) legajadas en una carpeta. En
SEMANA 01 Estructura Atómica y Tabla Periódica. Licda. Lilian Judith Guzmán Melgar
 SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
A su vez, una molécula está compuesta por átomos. Cada uno de ellos posee unas propiedades diferentes en el interior de la molécula que constituyen.
 Constitución de la materia. Supongamos que cualquier sustancia de la naturaleza la dividimos en partes cada vez más pequeñas, conservando cada una de ellas las propiedades de la sustancia inicial. Si seguimos
Constitución de la materia. Supongamos que cualquier sustancia de la naturaleza la dividimos en partes cada vez más pequeñas, conservando cada una de ellas las propiedades de la sustancia inicial. Si seguimos
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
TEMA 3 LA TABLA PERIÓDICA
 TEMA 3 LA TABLA PERIÓDICA Mª PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Antecedentes de la Tabla Periódica 2. La TP y las configuraciones electrónicas 3. Radio atómico. Radio iónico 4. Energía de
TEMA 3 LA TABLA PERIÓDICA Mª PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Antecedentes de la Tabla Periódica 2. La TP y las configuraciones electrónicas 3. Radio atómico. Radio iónico 4. Energía de
ACADEMIA DE QUÍMICA TURNO VESPERTINO
 INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015)
 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
Configuraciones Electrónicas y Tabla Periódica: Problemas Prácticos
 Configuraciones Electrónicas y Tabla Periódica: Problemas Prácticos Historia del Átomo 1. Por qué no es posible para un electrón continuar girando en órbita alrededor del núcleo como un planeta alrededor
Configuraciones Electrónicas y Tabla Periódica: Problemas Prácticos Historia del Átomo 1. Por qué no es posible para un electrón continuar girando en órbita alrededor del núcleo como un planeta alrededor
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 3, Opción B Reserva 1, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva 3, Ejercicio
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
PROPIEDADES DE TABLA PERIÓDICA DE LOS ELEMENTOS
 PROPIEDADES DE TABLA PERIÓDICA DE LOS ELEMENTOS ELECTRONEGATIVIDAD: Es la capacidad que tiene un átomo para atraer los electrones necesarios y formar enlaces, en un grupo y periodo, aumenta la electronegatividad
PROPIEDADES DE TABLA PERIÓDICA DE LOS ELEMENTOS ELECTRONEGATIVIDAD: Es la capacidad que tiene un átomo para atraer los electrones necesarios y formar enlaces, en un grupo y periodo, aumenta la electronegatividad
Contenido. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades periódicas:
 LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
Tema 5: Propiedades de las sustancias en función n del tipo de enlace que poseen.
 Tema 5: Propiedades de las sustancias en función n del tipo de enlace que poseen. Relacionar las propiedades de las sustancias, con el tipo de enlace que tiene lugar entre los átomos que la constituyen,
Tema 5: Propiedades de las sustancias en función n del tipo de enlace que poseen. Relacionar las propiedades de las sustancias, con el tipo de enlace que tiene lugar entre los átomos que la constituyen,
Formativa para 2da. Oportunidad de Química I. 1er. Semestre Diciembre puntos. Nombre Grupo ETAPA I
 Formativa para 2da. Oportunidad de Química I. 1er. Semestre Diciembre 2016. 40 puntos Nombre Grupo ETAPA I LA QUÍMICA Y SU CONTRIBUCIÓN AL AVANCE DE LA CIENCIA Y LA TECNOLOGÍA. Define los siguientes Conceptos:
Formativa para 2da. Oportunidad de Química I. 1er. Semestre Diciembre 2016. 40 puntos Nombre Grupo ETAPA I LA QUÍMICA Y SU CONTRIBUCIÓN AL AVANCE DE LA CIENCIA Y LA TECNOLOGÍA. Define los siguientes Conceptos:
QUÍMICA COMÚN QC-04 TABLA PERIÓDICA
 QUÍMICA COMÚN QC-04 TABLA PERIÓDICA 2012 LA TABLA PERIÓDICA DE LOS ELEMENTOS QUÍMICOS El gran número de elementos conocidos y sustancias sintetizadas generó la necesidad urgente de clasificarlos. Se descubre
QUÍMICA COMÚN QC-04 TABLA PERIÓDICA 2012 LA TABLA PERIÓDICA DE LOS ELEMENTOS QUÍMICOS El gran número de elementos conocidos y sustancias sintetizadas generó la necesidad urgente de clasificarlos. Se descubre
INSTITUTO TÉCNICO MARIA INMACULADA CIENCIA, VIRTUD Y LABOR FORMANDO LIDERES ESTUDIANTILES PARA UN FUTURO MEJOR PLAN DE CLASE GRADO: SEPTIMO
 INSTITUTO TÉCNICO MARIA INMACULADA CIENCIA, VIRTUD Y LABOR FORMANDO LIDERES ESTUDIANTILES PARA UN FUTURO MEJOR PLAN DE CLASE GRADO: SEPTIMO ÁREA: Ciencias naturales ASIGNATURA: Química TEMA: Tabla periódica
INSTITUTO TÉCNICO MARIA INMACULADA CIENCIA, VIRTUD Y LABOR FORMANDO LIDERES ESTUDIANTILES PARA UN FUTURO MEJOR PLAN DE CLASE GRADO: SEPTIMO ÁREA: Ciencias naturales ASIGNATURA: Química TEMA: Tabla periódica
Docente: Raquel Villafrades Torres. Química General
 Propiedades Periódicas Docente: Raquel Villafrades Torres Química General UPB Introducción Las propiedades periódicas son aquellas que varían de forma regular por la posición que ocupan los elementos en
Propiedades Periódicas Docente: Raquel Villafrades Torres Química General UPB Introducción Las propiedades periódicas son aquellas que varían de forma regular por la posición que ocupan los elementos en
