Trabajo Practico nº2
|
|
|
- Javier Bustos Piñeiro
- hace 8 años
- Vistas:
Transcripción
1 Trabajo Practico nº2 Espectroscopía de Resonancia Paramagnética Electrónica (RPE). Introducción La Resonancia Paramagnética Electrónica (RPE, en inglés EPR: Electron Paramagnetic Resonance) es una técnica espectroscópica que permite obtener información sobre la estructura y dinámica de sistemas con electrones desapareados (i.e. sistemas paramagnéticos). En general, el concepto de EPR es similar al de la RMN (resonancia magnética nuclear), sólo que las señales observadas se deben a el/los electron/es desapareados en lugar de los espines nucleares (e.g. 1 H, 15 N, 13 C, etc.). Ejemplos de sistemas que se pueden investigar por EPR: - Centros paramagnéticos intrínsecos: o Radicales estables en química y biología. o Especies de corta vida, intermedios en reacciones químicas (t ½ ~100 ns). o Pares radicales y estados triplete en fotosíntesis y sistemas relacionados. o Radicales generados por el daño por irradiación (ADN, polímeros). o Iones de metales de transición (Cu 2+, Mn 2+, V 4+, Fe 3+, Cr 3+, Cr 5+, Mo 5+, Ti 1+, Ti 3+ ) presentes en catálisadores sintéticos y en metaloproteínas/metaloenzimas. o Defectos en semiconductores. o Endohedral fullerenos
2 - Sistemas diamagnéticos con spin introducido artificialmente: Debido a que la espectroscopia EPR es un excelente método para sondar estructura y dinámica en líquidos y sólidos, también se puede aplicar a sistemas diamagnéticos a través de la introducción de sondas de spin (en analogía a sondas de fluorescencia). o Mn 2+ reemplazando a Mg 2+ en sistemas biológicos. o Sondas de spin nitróxido para: Estructura y dinámica de proteínas Orden y dinámica de membranas biológicas Polímeros - Estructura, dinámica y degradación de polímeros Orden y dinámica de cristales líquidos Sensores de ph Procesos de autoensamblado Adsorción en superficies Las especies de radicales reactivos como el radical OH, el radical anion O 2-, O 2 singlete, etc., pueden ser detectados con trampas de espín, las cuales son moléculas que reaccionan con los radicales libres, convirtiéndose en radicales estables. Fundamento del experimento de EPR homogéneo: En el experimento EPR la muestra se coloca en el seno de un campo magnético
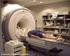
3 Figura 1: Espectrómetro de EPR onda continua (CW-EPR) de banda X (9.5 GHz). De manera simplificada, el electrón al ser una partícula cargada (negativamente) que gira (spin), genera un momento magnético. Este momento magnético ( S) generado por el spin electrónico en el seno de un campo magnético B posee una energía: E dipolo S B ecuación (1) Además se sabe que para el electrón, su momento magnético de spin es: g S ecuación (2) S e B Donde g e = es el factor g del electrón libre, y μ B es el magnetón de Bohr. Notar que el signo menos en ecuación 2 indica que S y S son antiparalelos! E B g S B ecuación (3) En base a las ecuaciones 1 y 2: dipolo S e B
4 De acuerdo a la ecuación 3, cuando los vectores S y B sean paralelos (i.e. S y B antiparalelos), la energía será máxima (cos 0º), mientras que será mínima cuando S y B sean antiparalelos (cos 180º). La aplicación del campo magnético externo elimina la degeneración de los estados de spin electrónico desapareado localizado en el centro paramagnético (e.g. radical, metal de transición): Figura 2: Dependencia del E entre niveles de spin electrónico con B 0. En B 0=0, los estados de spin están degenerados ( juntos en escala de energía), pero cuando el B 0 0 estos niveles se separan (esto se conoce como efecto Zeeman). La separación energética entre estos dos estados de spin viene dada por: E 1 1 (sup erior) (infe rior) ge B Bcos(0º ) g cos(180º ) 2 e B B g 2 e BB (4) Las transiciones entre los diferentes estados de espín pueden entonces ser inducidas por irradiación de una onda electromagnética a la frecuencia (de microondas) apropiada: E E h g B (5) ( 1/2) ( 1/2) fotón e B
5 En sistemas reales los electrones normalmente no están aislados, sino que están asociados con uno o más átomos. Hay varias consecuencias importantes de esto: - Un electrón desapareado puede ganar o perder momento angular, lo cual puede cambiar el valor de su factor g, haciendo que difiera del g e. Esto es especialmente importante para los sistemas químicos con iones de metales de transición. - El momento magnético de un núcleo con un spin nuclear distinto de cero (I 0) afectará a cualquier electrón desapareado cercano a ese átomo. Esto conduce al fenómeno de acoplamiento hiperfino (A), análogo al acoplamiento J en RMN, el cual divide la señal de resonancia de EPR en dobletes, tripletes y así sucesivamente. - Las interacciones de un electrón desapareado con su entorno influyen en la forma de una línea espectral de EPR. Las formas pueden proporcionar información estructural. - El factor g y el A en un átomo o molécula pueden no ser los mismos para todas las orientaciones de un electrón desemparejado en un campo magnético externo. Esta anisotropía depende de la estructura electrónica del átomo o molécula (por ejemplo, radical libre) en cuestión, y por lo tanto puede proporcionar información sobre el orbital atómico o molecular que contiene el electrón desemparejado. El factor g El factor g puede proporcionar información sobre la estructura electrónica de un centro paramagnético. Un electrón desapareado responde no sólo al campo magnético externo aplicado
6 por el espectrómetro B 0, sino también a cualquier campo magnético local de átomos o moléculas cercanas. El campo efectivo B eff experimentado por un electrón es: B (1 ) eff B0 Donde σ es una constante de apantallamiento similar a la de RMN, y puede tomar valores positivos o negativos. En base a esto, la ecuación 5 se puede escribir: h g B (6) e B eff h g (1 ) e BB0 (7) g g (1 ) e (8) h g B B 0 (9) (h = J s; B = J G -1 La ecuación 9 se utiliza para determinar el factor g en un experimento de EPR midiendo el B 0 al que se produce la resonancia (y conociendo ). Si g no es igual g e implica que la relación entre el momento magnético de spin electrónico ( S) y su momento magnético angular ( L) difiere del valor del electrón libre. Dado que el momento magnético de spin de un electrón es constante (aproximadamente el magnetón de Bohr), entonces el electrón debe haber ganado o perdido momento angular a través del acoplamiento spin-órbita. Debido a que los mecanismos de acoplamiento spin-órbita son bien comprendidos, la magnitud del cambio da información acerca de la naturaleza del orbital atómico (p, d, f) o molecular (σ, π) que contiene el electrón desapareado.
7 Obtención de un espectro de EPR Mientras que en la mayoría de las espectroscopías (UV-Vis, IR) los niveles de energía relevantes están fijos y ya están presentes en la muestra (electrónicos, vibracionales, rotacionales) y realiza un barrido de la longitud de onda de la radiación EM para detectar las absorciones correspondientes a saltos entre los niveles energéticos. En estos espectros se muestran los picos de absorción. En CW-EPR los niveles de energía responsables de la absorción del fotón de radiación EM están juntos pero se pueden generar colocando la muestra en el seno de un campo magnético exterior (B 0 ). En este caso, el E depende de la magnitud del B 0 (Figura 2) así que se mantiene la frecuencia constante (h constante) y se barre B 0 para detectar absorciones de energía. El espectro muestra la primera derivada de los picos de absorción (debido a que el sistema de detección de EPR es diferente al de las demás espectroscopías sensible a fase). Figura 3: señal de absorción y primera derivada correspondiente. El registro de la absorción de microondas por parte de la muestra da lugar al espectro de EPR. Este espectro es altamente sensible al medio físico y químico que rodea al centro donde se
8 encuentra el/los electron/es desapareado/s, y por lo tanto el EPR es muy útil para caracterizar de centros paramagnéticos y obtener cierta información estructural. Formas de los espectros (forma de línea) La desviación del factor g medido de la del electrón libre surge del acoplamiento spinórbita entre el estado fundamental y estados excitados. Debido a que los orbitales están orientados en la molécula, la magnitud de esta mezcla es dependiente de la dirección, o sea es anisotrópico. En una solución de baja viscosidad, cuando las moléculas rotan libremente en todas las direcciones se anula (se promedia) toda esta anisotropía. Sin embargo, cuando todas las moléculas paramagnéticas están en una orientación fija, como en un cristal, el factor g del espectro de EPR cambia si se gira el cristal dentro del espectrómetro. Esto se debe a la anisotropía del factor g. Para cada molécula paramagnética, existe un sistema de ejes único llamado sistema del eje principal. Los factores g medidos a lo largo de estos ejes se llaman los factores g principales y se etiquetan g x, g y y g z. La mayoría de los espectros de EPR de metales de transición en sistemas biológicos se obtienen en muestras de solución congelada. En estas muestras, los paramagnetos no están alineados en una dirección única como en un cristal orientado. Tampoco están girando rápidamente como en una solución de baja viscosidad. El acto de congelación fija a las moléculas en todas las orientaciones posibles. Por lo tanto, el espectro de una muestra congelada representa la suma de todas las orientaciones posibles y se denomina espectro de polvo.
9 La Figura 4 muestra los espectros de absorción y primera derivada para tres clases diferentes de anisotropía. En la primera clase, llamada isotrópica, todos los factores g principales son los mismos (Figura 4a). En la segunda clase, llamada axial, hay un eje único que difiere de los otros dos (gx = gy gz) (Fig. 4b yc). Se dice que el factor g a lo largo del eje único es paralelo con él, g z = g // mientras que los dos ejes restantes son perpendiculares a él, g x,y = g perp. La última clase, llamada rómbica, ocurre cuando todos los factores g difieren (figura 8d). Figura 4: tipos de anisotropía y señal de EPR típica observada Interacción hiperfina y superhiperfina: efecto del spin nuclear El momento magnético del electrón ( S ) puede representarse como una barra de imán. De la física básica, sabemos que un imán se alineará en un campo magnético externo (interacción
10 Zeeman). La física también nos dice que la energía de un imán de barra puede ser influenciada por la interacción con otro imán vecino. En este último caso, la magnitud de la interacción depende de la distancia de separación y de la alineación relativa de los dos imanes. En EPR hay tres tipos de interacción que pueden ocurrir. Los dos primeros tipos se deben a la interacción entre un electrón desapareado y un núcleo magnético. La interacción del electrón no apareado con el momento magnético nuclear se denomina interacción hiperfina nuclear. Generalmente se llama hiperfina si resulta del núcleo en el que se origina el electrón desapareado (Fig. 5A) y superhiperfina si es de un núcleo vecino (Fig. 5B). El tercer tipo es la interacción entre dos electrones no apareados en átomos diferentes normalmente dentro de una molécula, que se denomina interacción spin-spin (Fig. 5C). En la Tabla 1, se enumeran los núcleos que son importantes en biología. Se indican qué isótopos están presentes (abundancia natural), cuáles de estos tienen un spin nuclear, y el spin respectivo. Figura 4: tipos de interacción magnética que pueden ocurrir en EPR: interacción hiperfina (A), interacción superhiperfina (B) e interacción spin-spin (C). Por ejemplo, la interacción del electron con un núcleo con I=1/2 ( 1 H) dará como resultado un espectro con dos líneas:
11 Figura 6: efecto de campos magnéticos locales generados por espines nucleares (arriba). EPR observado para un electrón que interactúa con un spin nuclear I=1/2
12 Tabla 1:elementos e isótopos con sus espines nucleares correspondientes. La interacción hiperfina (y superhiperfina) puede hacer lucir un espectro de EPR complejo. La figura de abajo, parte A, muestra la interacción del electrón desapareado con diferentes núcleos magnéticos. La señal original se divide en dos o más señales con igual intensidad. Observe que la intensidad total de la señal no cambia y por lo tanto la amplitud de la señal se hace cada vez menor. La parte B, muestra cómo la forma de la línea se ve afectada por la interacción con más de un núcleo magnético (sin corrección para la pérdida de intensidad). El pequeño "árbol" o diagrama de palo en el lado derecho muestra cómo se puede calcular la intensidad relativa de las diferentes bandas. La parte C, muestra cómo se ve un espectro de una especie que tiene interacción con cuatro núcleos con I = 1. En los ejemplos utilizados en las partes B y C las interacciones son con núcleos que son idénticos. Los patrones se harán mucho más complejos ya
13 primera vista mucho menos informativos cuando el electrón es interacción con núcleos con diferentes espines nucleares (I) y constantes de acoplamiento (A). Obsérvese que independientemente del número de líneas hiperfinas el espectro de EPR está siempre centrado alrededor de la transición de Zeeman (línea punteada en la figura). En otras palabras, g puede determinarse a partir del valor del campo magnético en el centro del espectro (línea de puntos). Nótese, sin embargo, que en el caso de espines nucleares de n/2 no habrá un pico real en esta posición.
14 Objetivos: - Entender el fundamento de la espectroscopía de EPR. - Observar diferentes espectros de EPR de varias muestras. - Entender qué es un espectro isotrópico, axial y rómbico. - Determinar los valores de g en los espectros obtenidos. Metodología: - Según instrucciones del docente.
RESONANCIA MAGNÉTICA NUCLEAR
 RESONANCIA MAGNÉTICA NUCLEAR SPIN DEL NUCLEO El nucleo de algunos átomos poseen SPIN. Estos núcleos se comportan como si estuvieran girando... no sabemos si realmente giran! Es como la propiedad de un
RESONANCIA MAGNÉTICA NUCLEAR SPIN DEL NUCLEO El nucleo de algunos átomos poseen SPIN. Estos núcleos se comportan como si estuvieran girando... no sabemos si realmente giran! Es como la propiedad de un
Tema 3 El Átomo. Modelos Atómicos y Configuraciones Electrónicas
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 3 Rev 01 El Átomo. Modelos Atómicos y Configuraciones Electrónicas
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 3 Rev 01 El Átomo. Modelos Atómicos y Configuraciones Electrónicas
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica
 Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Curso 2015-2016 Problema 1 La línea principal del espectro
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Curso 2015-2016 Problema 1 La línea principal del espectro
Espectroscopía Clase integradora
 Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I
 El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Propiedades magnéticas
 Propiedades magnéticas Fuerzas magnéticas Las fuerzas magnéticas se generan mediante el movimiento de partículas cargadas Eléctricamente; existen junto a las fuerzas electrostáticas. Distribuciones del
Propiedades magnéticas Fuerzas magnéticas Las fuerzas magnéticas se generan mediante el movimiento de partículas cargadas Eléctricamente; existen junto a las fuerzas electrostáticas. Distribuciones del
Radiación. Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler. L. Infante 1
 Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León.
 Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
J H,H pequeño. Equivalencia química y equivalencia magnética
 La magnitud de J para 1 H, 1 H varía entre -20 y 20 Hz J a 2 enlaces 2 J H,H 10-15 Hz J a 3 enlaces 3 J H,H 3-10 Hz J a larga distancia H-C-C-C-H 4 J H,H pequeño Los J heteronucleares son mas grandes,
La magnitud de J para 1 H, 1 H varía entre -20 y 20 Hz J a 2 enlaces 2 J H,H 10-15 Hz J a 3 enlaces 3 J H,H 3-10 Hz J a larga distancia H-C-C-C-H 4 J H,H pequeño Los J heteronucleares son mas grandes,
Tema 3.-Espectroscopía de biomoléculas
 Tema 3.Espectroscopía de biomoléculas Tema 3.Espectroscopía de biomoléculas 3..El espectro electromagnético 3.2.Espectros de absorción y de emisión (espontánea y estimulada) 3.2..Momento dipolar de transición:
Tema 3.Espectroscopía de biomoléculas Tema 3.Espectroscopía de biomoléculas 3..El espectro electromagnético 3.2.Espectros de absorción y de emisión (espontánea y estimulada) 3.2..Momento dipolar de transición:
Enlace químico II: geometría molecular e hibridación de orbitales atómicos
 Enlace químico II: geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Teorías de cómo ocurren
Enlace químico II: geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Teorías de cómo ocurren
Efectos del solvente y del entorno local sobre la fluorescencia
 Efectos del solvente y del entorno local sobre la fluorescencia C 6 C 7 Temario Efectos generales del solvente Efectos específicos del solvente Efectos de la temperatura Transferencia interna de carga
Efectos del solvente y del entorno local sobre la fluorescencia C 6 C 7 Temario Efectos generales del solvente Efectos específicos del solvente Efectos de la temperatura Transferencia interna de carga
MODELOS ATOMICOS. Solución Å; Ultravioleta; 1106 m/s
 MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
Modelo Atómico. Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga (-)
 Modelo Atómico 1 Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga () Electrón Conceptos:» Neutralidad eléctrica» Carga elemental del
Modelo Atómico 1 Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga () Electrón Conceptos:» Neutralidad eléctrica» Carga elemental del
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS
 ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
CAPÍTULO 1. RESONANCIA PARAMAGNÉTICA ELECTRÓNICA (EPR)
 CAPÍTULO 1. RESONANCIA PARAMAGNÉTICA ELECTRÓNICA (EPR) 1.1. Introducción La Resonancia Paramagnética Electrónica EPR puede ser vista como una extensión del experimento de Stern-Gerlach, quienes mostraron
CAPÍTULO 1. RESONANCIA PARAMAGNÉTICA ELECTRÓNICA (EPR) 1.1. Introducción La Resonancia Paramagnética Electrónica EPR puede ser vista como una extensión del experimento de Stern-Gerlach, quienes mostraron
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES
 QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES 2013-1 Teoría: Dra. Karina Cuentas Gallegos Martes y jueves 10-12 hrs. Laboratorio: M.C. Mirna Guevara García Jueves 12-14 hrs. Curso de Química
QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES 2013-1 Teoría: Dra. Karina Cuentas Gallegos Martes y jueves 10-12 hrs. Laboratorio: M.C. Mirna Guevara García Jueves 12-14 hrs. Curso de Química
Átomos polielectrónicos Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas
 ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS. Tipos de radiaciones electromagnéticas según λ.
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
ANTECEDENTES Métodos generales de extracción y purificación
 ANTECEDENTES El estudio de los Agaves es de gran importancia debido a su uso tradicional como medicamento en diferentes culturas como la de la India y México. Los Agaves se utilizan como diuréticos, antisifilítico,
ANTECEDENTES El estudio de los Agaves es de gran importancia debido a su uso tradicional como medicamento en diferentes culturas como la de la India y México. Los Agaves se utilizan como diuréticos, antisifilítico,
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: El átomo y sus enlaces
 1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
Unidad I: Propiedades Periódicas: Masa y Enlace
 Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
TEMA 2: Resonancia Magnética Nuclear RMN-1H y 13C Fundamentos
 Fundamentos La Resonancia Magnética Nuclear (RMN) es la técnica que mayor información estructural proporciona. Ello se debe a que se observan los núcleos de los átomos y se puede conocer la influencia
Fundamentos La Resonancia Magnética Nuclear (RMN) es la técnica que mayor información estructural proporciona. Ello se debe a que se observan los núcleos de los átomos y se puede conocer la influencia
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
4. Identificar un isótopo radiactivo del carbono e indicar su uso. 5. Cuál es la configuración electrónica del vanadio?
 ESTRUCTURA ATÓMICA 1. Qué afirmación sobre el número de electrones, protones y neutrones del átomo es correcta? A El número de neutrones menos el número de electrones es cero. B. El número de protones
ESTRUCTURA ATÓMICA 1. Qué afirmación sobre el número de electrones, protones y neutrones del átomo es correcta? A El número de neutrones menos el número de electrones es cero. B. El número de protones
Configuración Electrónica
 Los subniveles se ordenan según el valor de n + l Distribución de los electrones en el átomo Número Orbitales que ocupan relativa A menor valor de n + l, menor energía (más estable) Válido sólo si l 3
Los subniveles se ordenan según el valor de n + l Distribución de los electrones en el átomo Número Orbitales que ocupan relativa A menor valor de n + l, menor energía (más estable) Válido sólo si l 3
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Elementos ordenados según su número atómico (Z, número de p + ) Hay 18 PERÍODOS
 TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
TABLA PERIÓDICA Elementos ordenados según su número atómico (Z, número de p + ) Columnas Filas GRUPOS PERÍODOS Familias de elementos con propiedades comunes Hay 18 División principal Elementos representativos
El Modelo Moderno y resultados de nuestro interés
 CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
 1 Universidad de Castilla La Mancha Septiembre 2015 SEPTIEMRE 2015 Opción A Problema 1.- Tenemos tres partículas cargadas q 1 = -20 C, q 2 = +40 C y q 3 = -15 C, situadas en los puntos de coordenadas A
1 Universidad de Castilla La Mancha Septiembre 2015 SEPTIEMRE 2015 Opción A Problema 1.- Tenemos tres partículas cargadas q 1 = -20 C, q 2 = +40 C y q 3 = -15 C, situadas en los puntos de coordenadas A
INTERACCIONES Y MATERIALES MAGNÉTICOS
 INTERACCIONES Y MATERIALES MAGNÉTICOS G U T I É R R E Z N Ú Ñ E Z D E B O R A H V A L E R I A I S L A S B A U T I S T A J O S É A L F R E D O L O E R A R U B A L C A V A J E S S I C A R I V E R O T R E
INTERACCIONES Y MATERIALES MAGNÉTICOS G U T I É R R E Z N Ú Ñ E Z D E B O R A H V A L E R I A I S L A S B A U T I S T A J O S É A L F R E D O L O E R A R U B A L C A V A J E S S I C A R I V E R O T R E
QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA
 QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013)
QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013)
PROBLEMARIO: Segundo Parcial Prof. Juan Pablo Herrera
 Universidad Nacional Experimental del Táchira Departamento de Química San Cristóbal, Estado Táchira-Venezuela Soluciones. PROBLEMARIO: Segundo Parcial Prof. Juan Pablo Herrera 1. Calcule la molaridad de
Universidad Nacional Experimental del Táchira Departamento de Química San Cristóbal, Estado Táchira-Venezuela Soluciones. PROBLEMARIO: Segundo Parcial Prof. Juan Pablo Herrera 1. Calcule la molaridad de
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS.
 PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
Tema 2_3. Átomos Polielectronicos y Sistema Periódico
 Tema 2_3. Átomos Polielectronicos y Sistema Periódico Caso más sencillo: átomo de helio (2 electrones) ĤΨ = EΨ ^ ^ Ĥ = T + V z r 12 x atracción del núcleo (+2e) sobre el electrón 1, a una distancia r 1
Tema 2_3. Átomos Polielectronicos y Sistema Periódico Caso más sencillo: átomo de helio (2 electrones) ĤΨ = EΨ ^ ^ Ĥ = T + V z r 12 x atracción del núcleo (+2e) sobre el electrón 1, a una distancia r 1
IEO-394 Semiconductores. Juan E. Martínez P. Docente. UdeA
 IEO-394 Semiconductores Juan E. Martínez P. Docente. UdeA Bandas de Energía Y Corrientes de Portadores en Semiconductores. PARTICION DE LOS NIVELES DE ENERGIA A medida que se traen juntos N átomos Cada
IEO-394 Semiconductores Juan E. Martínez P. Docente. UdeA Bandas de Energía Y Corrientes de Portadores en Semiconductores. PARTICION DE LOS NIVELES DE ENERGIA A medida que se traen juntos N átomos Cada
INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3.
 El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
EL MODELO ATOMICO DE BOHR
 EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
FÍSICA 4 PRIMER CUATRIMESTRE DE 2015 GUÍA 9: POTENCIALES EN 2-D Y 3-D, MOMENTO ANGULAR, ÁTOMO DE HIDRÓGENO, ESPÍN
 FÍSICA 4 PRIMER CUATRIMESTRE DE 2015 GUÍA 9: POTENCIALES EN 2-D Y 3-D, MOMENTO ANGULAR, ÁTOMO DE HIDRÓGENO, ESPÍN 1. Considere el siguiente potencial (pozo infinito): { 0 x a; y b y z c V(x)= sino Escribiendo
FÍSICA 4 PRIMER CUATRIMESTRE DE 2015 GUÍA 9: POTENCIALES EN 2-D Y 3-D, MOMENTO ANGULAR, ÁTOMO DE HIDRÓGENO, ESPÍN 1. Considere el siguiente potencial (pozo infinito): { 0 x a; y b y z c V(x)= sino Escribiendo
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico.
 EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
EXTRUCTURA ATOMICA ACTUAL
 ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ESTRUCTURA ATÓMICA. Utilizando el siguiente esquema vamos a configurar los electrones de los átomos e iones del ejercicio:
 ESTRUCTURA ATÓMICA 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes. Utilizando el siguiente
ESTRUCTURA ATÓMICA 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes. Utilizando el siguiente
Teoría de orbitales moleculares y orden de enlace Propiedades moleculares y configuraciones
 5/30/013 GEOMETRÍA MOLECULAR Y TEORÍA DE ENLACE Teoría de orbitales moleculares y orden de enlace Propiedades moleculares y configuraciones electrónicas Geometría Molecular y Enlace Químico Especies Poliatómicas:
5/30/013 GEOMETRÍA MOLECULAR Y TEORÍA DE ENLACE Teoría de orbitales moleculares y orden de enlace Propiedades moleculares y configuraciones electrónicas Geometría Molecular y Enlace Químico Especies Poliatómicas:
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica
 Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 3 de febrero de 205 Índice. Aproximación
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 3 de febrero de 205 Índice. Aproximación
Unidad 1 Estructura atómica de la materia. Teoría cuántica
 Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Tema 7.- Principios de fotoquímica
 Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
Estructura de la materia
 Estructura de la materia Cuestiones y problemas 1. Si la energía de ionización del K gaseoso es de 418 kj.mol 1 : a) Calcule la energía mínima que ha de tener un fotón para poder ionizar un átomo de K.
Estructura de la materia Cuestiones y problemas 1. Si la energía de ionización del K gaseoso es de 418 kj.mol 1 : a) Calcule la energía mínima que ha de tener un fotón para poder ionizar un átomo de K.
Thompson (1898) Rutherford (1911) Bohr (1913) Schrödinger (1926) NUMEROS CUANTICOS
 Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
Tema 6: Espectroscopia electrónica
 1.- Introducción -El color es uno de los aspectos más llamativos de los compuestos de coordinación. -Desde antiguo se conocen compuestos de coordinación que se usan como colorantes: Azul de prusia Fe 4
1.- Introducción -El color es uno de los aspectos más llamativos de los compuestos de coordinación. -Desde antiguo se conocen compuestos de coordinación que se usan como colorantes: Azul de prusia Fe 4
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS. Partícula Masa (g) Carga (Coulombs) Carga unitaria. Electrón
 MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
S.E.P. S.E.I.T DIRECCION GENERAL DE INSTITUTOS TECNOLOGICOS
 S.E.P. S.E.I.T DIRECCION GENERAL DE INSTITUTOS TECNOLOGICOS NOMBRE DE LA ASIGNATURA: QUIMICA ANALITICA II (4-2-10) NIVEL: LICENCIATURA. CARRERA: INGENIERIA BIOQUIMICA INGENIERIA QUIMICA CLAVE: ACC-9331
S.E.P. S.E.I.T DIRECCION GENERAL DE INSTITUTOS TECNOLOGICOS NOMBRE DE LA ASIGNATURA: QUIMICA ANALITICA II (4-2-10) NIVEL: LICENCIATURA. CARRERA: INGENIERIA BIOQUIMICA INGENIERIA QUIMICA CLAVE: ACC-9331
Preguntas Propuestas
 Preguntas Propuestas 1 ... Materia 1. Respecto a los alcances de la química, qué proposiciones son correctas? I. Tiene como objetivo producir conocimientos y nuevos materiales. II. Su alcance es solo a
Preguntas Propuestas 1 ... Materia 1. Respecto a los alcances de la química, qué proposiciones son correctas? I. Tiene como objetivo producir conocimientos y nuevos materiales. II. Su alcance es solo a
2. APARICIÓN DE NUEVOS HECHOS: ESPECTROS ATÓMICOS E HIPÓTESIS DE PLANCK 6. CONFIGURACIONES ELECTRÓNICAS: PRINCIPIO DE AUFBAU
 ÍNDICE 1. MODELO ATÓMICO DE RUTHERFORD 2. APARICIÓN DE NUEVOS HECHOS: ESPECTROS ATÓMICOS E HIPÓTESIS DE PLANCK 3. MODELO ATÓMICO DE BORH 4. CONCEPTO DE ORBITAL ATÓMICO 5. NÚMERO CUÁNTICOS Y SU SIGNIFICADO
ÍNDICE 1. MODELO ATÓMICO DE RUTHERFORD 2. APARICIÓN DE NUEVOS HECHOS: ESPECTROS ATÓMICOS E HIPÓTESIS DE PLANCK 3. MODELO ATÓMICO DE BORH 4. CONCEPTO DE ORBITAL ATÓMICO 5. NÚMERO CUÁNTICOS Y SU SIGNIFICADO
ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO. Lola Castelao
 ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO DALTON: el átomo es indivisible. MODELOS ATÓMICOS THOMSON: el átomo es una especie de pudín, formado por una masa cargada positivamente, dentro del cual se
ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO DALTON: el átomo es indivisible. MODELOS ATÓMICOS THOMSON: el átomo es una especie de pudín, formado por una masa cargada positivamente, dentro del cual se
Enlace químico II: geometría molecular e hibridación de orbitales atómicos
 Enlace químico II: geometría e hibridación de orbitales atómicos Capítulo 10 Modelo de la repulsión de los pares de electrones de la capa de valencia (): Predice la geometría de la molécula a partir de
Enlace químico II: geometría e hibridación de orbitales atómicos Capítulo 10 Modelo de la repulsión de los pares de electrones de la capa de valencia (): Predice la geometría de la molécula a partir de
Problema Interferencia de N ranuras.
 Problema 9. 4. Interferencia de N ranuras. Considere un obstáculo con tres ranuras separadas por una distancia d e iluminado con una onda plana de longitud de onda λ. Emplee el método de los fasores para
Problema 9. 4. Interferencia de N ranuras. Considere un obstáculo con tres ranuras separadas por una distancia d e iluminado con una onda plana de longitud de onda λ. Emplee el método de los fasores para
Resonancia Magnética Nuclear
 Víctor Moreno de la Cita Jesús J. Fernández Romero 25 de mayo de 2010 1 Base teórica 2 Medicina Química y análisis no destructivo Computación cuántica 3 4 Notación que emplea Kittel: µ = Momento magnético
Víctor Moreno de la Cita Jesús J. Fernández Romero 25 de mayo de 2010 1 Base teórica 2 Medicina Química y análisis no destructivo Computación cuántica 3 4 Notación que emplea Kittel: µ = Momento magnético
3.1. Estructura atómica
 3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
Con posterioridad el físico alemán Sommerfeld introdujo en el modelo la posibilidad de órbitas elípticas. Köningsberg, Munich, 1951
 4. El paso de una órbita a otra supone la absorción o emisión de radiación. El átomo sólo absorberá o emitirá la radiación justa para pasar de una órbita a otra. Las órbitas de los electrones son estables
4. El paso de una órbita a otra supone la absorción o emisión de radiación. El átomo sólo absorberá o emitirá la radiación justa para pasar de una órbita a otra. Las órbitas de los electrones son estables
EL ÁTOMO CONTENIDOS. ANTECEDENTES HISTÓRICOS. ( ) MODELOS ATÓMICOS. RAYOS CATÓDICOS. MODELO DE THOMSON.
 EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
b) Debe desarrollar las cuestiones y problemas de una de las dos opciones c) Puede utilizar calculadora no programable
 I.E.S BEARIZ DE SUABIA Instrucciones a) Duración: 1 hora y 30 minutos b) Debe desarrollar las cuestiones y problemas de una de las dos opciones c) Puede utilizar calculadora no programable d) Cada cuestión
I.E.S BEARIZ DE SUABIA Instrucciones a) Duración: 1 hora y 30 minutos b) Debe desarrollar las cuestiones y problemas de una de las dos opciones c) Puede utilizar calculadora no programable d) Cada cuestión
ÁTOMO ~ m NÚCLEO ~ mnucleón < m. MATERIA ~ 10-9 m. Átomo FÍSICA MATERIALES PARTÍCULAS
 ESTRUCTURA DE LA MATERIA Grupo D CURSO 20011 2012 EL NÚCLEO ATÓMICO DE QUÉ ESTÁN HECHAS LAS COSAS? MATERIA ~ 10-9 m Átomo FÍSICA MATERIALES ÁTOMO ~ 10-10 m NÚCLEO ~ 10-14 mnucleón < 10-15 m Electrón Protón
ESTRUCTURA DE LA MATERIA Grupo D CURSO 20011 2012 EL NÚCLEO ATÓMICO DE QUÉ ESTÁN HECHAS LAS COSAS? MATERIA ~ 10-9 m Átomo FÍSICA MATERIALES ÁTOMO ~ 10-10 m NÚCLEO ~ 10-14 mnucleón < 10-15 m Electrón Protón
Difracción con Rayos X
 Difracción con Rayos X Hurgando en la estructura de las moléculas En el ICMA se utilizan métodos de Difracción con Rayos X para conocer la estructura de la materia Algo de Historia Página Qué es la difracción
Difracción con Rayos X Hurgando en la estructura de las moléculas En el ICMA se utilizan métodos de Difracción con Rayos X para conocer la estructura de la materia Algo de Historia Página Qué es la difracción
2º Bachillerato. Química. Unidad 1 (Estructura atómica de la materia). Fotocopia 1.
 Partículas subatómicas Los átomos están formados por un núcleo (formado por protones y neutrones) rodeado por una nube de electrones, que se encuentran en la corteza. Entre núcleo y corteza hay espacio
Partículas subatómicas Los átomos están formados por un núcleo (formado por protones y neutrones) rodeado por una nube de electrones, que se encuentran en la corteza. Entre núcleo y corteza hay espacio
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
Atomos, Moléculas e Iones
 Atomo Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
Atomo Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
ESTRUCTURA ATÓMICA. SISTEMA PERIÓDICO Y ENLACE QUÍMICO
 1.- Un átomo A tiene como configuración electrónica: 1s 2 2s 2 2p 6 3s 2 3p 6 5s 1. a) Cuáles son los números cuánticos de su electrón más externo? b) Justifica la veracidad o falsedad de las siguientes
1.- Un átomo A tiene como configuración electrónica: 1s 2 2s 2 2p 6 3s 2 3p 6 5s 1. a) Cuáles son los números cuánticos de su electrón más externo? b) Justifica la veracidad o falsedad de las siguientes
Atomos, Moléculas e Iones. Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo
 Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Atomo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Atomo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS.
 PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
radiación electromagnética
 radiación electromagnética ondas propagándose en el espacio con velocidad c crestas amplitud l valles longitud de onda [ l]=cm, nm, μm, A Frecuencia=n=c/l [ n ]=HZ=1/s l= numero de ondas por unidad de
radiación electromagnética ondas propagándose en el espacio con velocidad c crestas amplitud l valles longitud de onda [ l]=cm, nm, μm, A Frecuencia=n=c/l [ n ]=HZ=1/s l= numero de ondas por unidad de
I.E. SEMINARIO MENOR DIOCESANO CONFIGURACIÓN. Configuración ELECTRÓNICA. electrónica. Esp. HARRISON MELENDEZ TARAZONA
 I.E. SEMINARIO MENOR DIOCESANO CONFIGURACIÓN Configuración ELECTRÓNICA electrónica Docente : Esp. HARRISON MELENDEZ TARAZONA APRENDIZAJE ESPERADO : Utiliza el diagrama de MOELLER para determinar la configuración
I.E. SEMINARIO MENOR DIOCESANO CONFIGURACIÓN Configuración ELECTRÓNICA electrónica Docente : Esp. HARRISON MELENDEZ TARAZONA APRENDIZAJE ESPERADO : Utiliza el diagrama de MOELLER para determinar la configuración
ESPECTROSCOPIA UV-VISIBLE
 ESPECTROSCOPIA UV-VISIBLE FUNDAMENTOS INSTRUMENTACION FUNCIONAMIENTO APLICACIONES FUNDAMENTOS La espectroscopia UV-Vis está basada en el proceso de absorción de la radiación ultravioleta-visible (radiación
ESPECTROSCOPIA UV-VISIBLE FUNDAMENTOS INSTRUMENTACION FUNCIONAMIENTO APLICACIONES FUNDAMENTOS La espectroscopia UV-Vis está basada en el proceso de absorción de la radiación ultravioleta-visible (radiación
ESTRUCTURA DE LA MATERIA 3
 ESTRUCTURA DE LA MATERIA 3 SISTEMA PERIÓDICO Mendeleiev (columnas) y Meyer (filas) clasificaron periodicamente los elementos basandose 1º) colocar los elementos por orden creciente de sus masa atómicas
ESTRUCTURA DE LA MATERIA 3 SISTEMA PERIÓDICO Mendeleiev (columnas) y Meyer (filas) clasificaron periodicamente los elementos basandose 1º) colocar los elementos por orden creciente de sus masa atómicas
NIVELES DE ENERGÍA EN LOS IONES DE LOS METALES DE TRANSICIÓN
 NIVELES DE ENERGÍA EN LOS IONES DE LOS METALES DE TRANSICIÓN INTRODUCCIÓN CÁLCULO DE LOS TERMINOS ESPECTROSCÓPICOS EN EL ION LIBRE. Acoplamiento de Russell-Saunders 2. Cálculo de los términos espectroscópicos
NIVELES DE ENERGÍA EN LOS IONES DE LOS METALES DE TRANSICIÓN INTRODUCCIÓN CÁLCULO DE LOS TERMINOS ESPECTROSCÓPICOS EN EL ION LIBRE. Acoplamiento de Russell-Saunders 2. Cálculo de los términos espectroscópicos
Prefacio... ix COMO UTILIZAR ESTE LIBRO... 1 QUE ES LA QUIMICA... 2 EL METODO CIENTIFICO... 3 LAS RAMAS DE LA QUIMICA... 3
 ÍNDICE Prefacio... ix 1 introducción a la química... 1 COMO UTILIZAR ESTE LIBRO... 1 QUE ES LA QUIMICA... 2 EL METODO CIENTIFICO... 3 LAS RAMAS DE LA QUIMICA... 3 2 el sistema métrico y la medición científica...
ÍNDICE Prefacio... ix 1 introducción a la química... 1 COMO UTILIZAR ESTE LIBRO... 1 QUE ES LA QUIMICA... 2 EL METODO CIENTIFICO... 3 LAS RAMAS DE LA QUIMICA... 3 2 el sistema métrico y la medición científica...
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
RADIACIÓN ELECTROMAGNÉTICA
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 1 RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL, 4 ed.; Ed. McGraw-Hill (1994), págs.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 1 RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL, 4 ed.; Ed. McGraw-Hill (1994), págs.
Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares
 Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares Enlace químico Cómo se unen los átomos? Cualquier teoría que de contestación a esta pregunta ha de explicar: Los diferentes tipos de enlace
Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares Enlace químico Cómo se unen los átomos? Cualquier teoría que de contestación a esta pregunta ha de explicar: Los diferentes tipos de enlace
Tabla Periódica y Propiedades Periódicas
 Tabla Periódica y Propiedades Periódicas 1. Las configuraciones electrónicas de los elementos nitrógeno y vanadio son respectivamente: Lo primero que debemos hacer es buscar en la Tabla Periódica los números
Tabla Periódica y Propiedades Periódicas 1. Las configuraciones electrónicas de los elementos nitrógeno y vanadio son respectivamente: Lo primero que debemos hacer es buscar en la Tabla Periódica los números
TEMA 3 ENLACE QUÍMICO (PARTE 2)
 TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
Unidad 1: Materia, estructura y Periodicidad Base experimental de la teoría cuántica y estructura atómica.
 Unidad 1: Materia, estructura y Periodicidad 1.7. Base experimental de la teoría cuántica y estructura atómica. Modelo de Dalton En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia
Unidad 1: Materia, estructura y Periodicidad 1.7. Base experimental de la teoría cuántica y estructura atómica. Modelo de Dalton En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia
SEMANA 01 Estructura Atómica y Tabla Periódica. Licda. Lilian Judith Guzmán Melgar
 SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
TEMA 6: Enlace químico en sistemas moleculares
 TEMA 6: Enlace químico en sistemas moleculares Índice 1) Introducción 2) Enlaces en molécula a.i. a.ii. a.iii. a.iv. Teoría de orbitales moleculares Teoría del enlace de valencia Resonancia Polaridad 3)
TEMA 6: Enlace químico en sistemas moleculares Índice 1) Introducción 2) Enlaces en molécula a.i. a.ii. a.iii. a.iv. Teoría de orbitales moleculares Teoría del enlace de valencia Resonancia Polaridad 3)
El enlace químico. Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM
 Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM El enlace químico Las átomos pueden formar enlaces por compartición de electrones Dos electrones compartidos forman un enlace simple.
Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM El enlace químico Las átomos pueden formar enlaces por compartición de electrones Dos electrones compartidos forman un enlace simple.
EL ESPECTRO ELECTROMAGNÉTICO
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
Materiales utilizados en diseños electrónicos
 Materiales utilizados en diseños electrónicos Unión Metálica Se producen cuando se unen átomos que tienen electronegatividad baja y cercana (metales), ninguno de los átomos atrae con gran fuerza los electrones
Materiales utilizados en diseños electrónicos Unión Metálica Se producen cuando se unen átomos que tienen electronegatividad baja y cercana (metales), ninguno de los átomos atrae con gran fuerza los electrones
A su vez, una molécula está compuesta por átomos. Cada uno de ellos posee unas propiedades diferentes en el interior de la molécula que constituyen.
 Constitución de la materia. Supongamos que cualquier sustancia de la naturaleza la dividimos en partes cada vez más pequeñas, conservando cada una de ellas las propiedades de la sustancia inicial. Si seguimos
Constitución de la materia. Supongamos que cualquier sustancia de la naturaleza la dividimos en partes cada vez más pequeñas, conservando cada una de ellas las propiedades de la sustancia inicial. Si seguimos
CAMPO MAGNÉTICO. El origen del magnetismo.
 CAMPO MAGNÉTICO. El origen del magnetismo. Los imanes atraen fuertemente a metales como el hierro, esto es debido a que son materiales que tienen un campo magnético propio. Vamos a tener en los imanes
CAMPO MAGNÉTICO. El origen del magnetismo. Los imanes atraen fuertemente a metales como el hierro, esto es debido a que son materiales que tienen un campo magnético propio. Vamos a tener en los imanes
Desde Estructura Atómica a Enlaces, y Relación Enlace-Propiedades
 Desde Estructura Atómica a Enlaces, y Relación Enlace-Propiedades Plan de Trabajo: Modelos de estructura electrónica del átomo Estructura de los átomos al estado fundamental Tabla periódica Electronegatividad
Desde Estructura Atómica a Enlaces, y Relación Enlace-Propiedades Plan de Trabajo: Modelos de estructura electrónica del átomo Estructura de los átomos al estado fundamental Tabla periódica Electronegatividad
GUÍA DE EJERCICIOS TABLA PERIÓDICA
 GUÍA DE EJERCICIOS TABLA PERIÓDICA Área Química Resultados de aprendizaje Extrae y analiza información para resolver ejercicios relacionados con configuración electrónica y propiedades periódicas, desarrollando
GUÍA DE EJERCICIOS TABLA PERIÓDICA Área Química Resultados de aprendizaje Extrae y analiza información para resolver ejercicios relacionados con configuración electrónica y propiedades periódicas, desarrollando
Problemas de Química (1ero Grado de Química). Tema 2. ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS
 Problemas de Química (1ero Grado de Química). Tema 2. ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1. Para el isótopo del elemento con Z = 36 y número másico 84 indique: (a) su número de protones; (b) su
Problemas de Química (1ero Grado de Química). Tema 2. ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1. Para el isótopo del elemento con Z = 36 y número másico 84 indique: (a) su número de protones; (b) su
Unidad 1: Teoría Cuántica y Estructura Atómica. 1.2 Base experimental de la teoría cuántica
 Unidad 1: Teoría Cuántica y Estructura Atómica 1.2 Base experimental de la teoría cuántica Thompson Dalton Rutherford Demócrito Naturaleza eléctrica de la materia La naturaleza de la luz CUANTOS Descubrimiento
Unidad 1: Teoría Cuántica y Estructura Atómica 1.2 Base experimental de la teoría cuántica Thompson Dalton Rutherford Demócrito Naturaleza eléctrica de la materia La naturaleza de la luz CUANTOS Descubrimiento
elementos reaccionan compuestos
 Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
