ESTRUCTURAS CARACTERÍSTICAS
|
|
|
- Felisa Iglesias Villanueva
- hace 8 años
- Vistas:
Transcripción
1 ESTRUCTURAS CARACTERÍSTICAS En este capítulo se describen algunas estructuras muy simples que permitirán analizar la disposición de los átomos de diversos compuestos característicos en los que el enlace responsable de su cohesión estructural es, básicamente, iónico. Compuestos AX Son aquellos en que la carga (valencia) del catión es la misma que la del anión, y por tanto, su relación estequiométrica es 1:1 (AX). Seguidamente de analizar estructuras con diversas relaciones de tamaño catión - anión, correspondientes a los límites que marcan los cambios de coordinación. 1 > R A /R X > 0.73 (CsCl) Esta relación de radios iónicos da lugar a coordinación cúbica (número de coordinación=8). En el CsCl los Cs se ubican en el centro de un cubo de Cl, y al revés, como se puede ver en la figura. En la figura superior se ha proyectado la estructura sobre (001) También adoptan esta disposición estructural los siguientes compuestos: NH 4 Cl (R A /R X =0.79); CsBr (R A /R X =0.86); CsI (R A /R X =0.76) En la figura de la izquierda se han representado 8 celdas fundamentales del CsCl (Cl gris; Cs rojo), a la vez que los respectivos poliedros de coordinación. En negro el cubo de coordinación del Cl dibujado con color más intenso; en azul el cubo de coordinación del Cs dibujado más intenso 0.73 < R A /R X < 0.41 Esta relación de tamaños favorece la coordinación octaédrica (NC=6), de manera que cada anión se rodea de seis cationes formando un octaedro de coordinación, y al revés. La estructura del NaCl es característica de este grupo de compuestos, y se adopta como disposición estructural, a partir de la cual describir otras estructures que están relacionadas, al menos por lo que respecta a su geometría.
2 La estructura del NaCl se puede describir como un empaquetado cúbico compacto de Na + (o Cl - ), en el cual los Cl - (o los Na + ) ocupan todas las posiciones de coordinación octaédrica, es decir, el centro del cubo y los centros de todas las aristas. En la figura superior se ha proyectado la estructura sobre (001) En la figura de la izquierda se han representado una celda fundamental del NaCl (Cl gris; Na rojo), a la vez que los respectivos poliedros de coordinación. En azul el octaedro de coordinación del Na central; en calabaza el octaedro de coordinación del Cl, para la cual cosa se ha dibujado un Na de la celda Como se puede ver en la figura, la disposición de los octaedros de coordinación de los cationes y de los aniones es tal que están opuestos por los vértices, disposición característica de los compuestos típicamente iónicos. Esta disposición estructural tiene lugar en todos los halogenuros de Li, Na y K, a pesar que algunos tienen relaciones R A /R X fuera del intervalo correspondiente a la coordinación octaédrica. Existen otros compuestos AX, con una relación de tamaños entre 0.73 y 0.41, pero con enlace apreciablemente metálico en lugar de iónico. En estos casos, la coordinación es octaédrica y la disposición estructural se puede describir tomando como ejemplo la del mineral nicolita (NiAs), por bien que hay otros como la pirrotina (FeS) o la breiktaupita (NiS) que también la adoptan. Estas estructuras se pueden describir como un empaquetado hexagonal compacto de aniones X (As en este ejemplo), mientras que los cationes A (Ni) ocupan las posiciones de coordinación octaédrica. Por tanto, seis átomos de As rodean cada uno de los átomos de Ni, pero en este caso, los respectivos octaedros de coordinación comparten una cara, en lugar de estar opuestos por un vértice, como en los cristales típicamente iónicos.
3 0.41 < R A /R X < 0.22 Esta relación de tamaños favorece la coordinación tetraédrica (NC=4). Dos compuestos característicos podrían ser las dos estructuras del ZnS descritas como disposiciones estructurales covalentes. De las dos, la correspondiente al mineral wurtzita (hexagonal) es más característica de los cristales con enlace polar (iónico), mientras que la de la esfalerita (cúbica) es más característica de cristales con enlace covalente. En su momento ya se discutió la diferente disposición de los tetraedros de coordinación de una y otra. Compuestos AX 2 En estos casos, la carga del catión (A) es doble de la del anión (X), y para que las estructuras sean eléctricamente neutras, hace falta que haya el doble de átomos de X que de A, dando lugar a la fórmula general AX 2. Seguidamente se describirán algunas estructuras de esta fórmula características para las diversas relaciones R A /R X : 1 < R A /R X < 0.73 (fluorita CaF 2 ) La estructura es similar a la del CsCl, pero para mantener la neutralidad eléctrica, solo uno de cada dos cubos de coordinación está ocupado por un átomo de Ca 2+ (F - gris; Ca 2+ rojo) De esta manera, los calcios están en coordinación cúbica (dibujado en calabaza), mientras que los F lo están en coordinación tetraédrica con cuatro átomos de Ca. En la figura, el átomo central de F está rodeado por los cuatro átomos de Ca formando un tetraedro de coordinación (dibujado en azul). Para mantener la periodicidad, la celda fundamental (la dibujada en la figura) abarca 8 cubos
4 de coordinación 0.73 < R A /R X < 0.41 (Rutilola TiO 2 ) En esta estructura los cationes Ti +4 se disponen en una celda tetragonal centrada en el interior, y los aniones O -2 forman un octaedro de coordinación a su alrededor < R A /R X < 0.29 (Cristobalita SiO 2 ) Ver cualquier libro Compuestos A 2 X Básicamente existen dos tipos de estructuras por estos compuestos: Na 2 O Conocida como antifluorita porqué la disposición de los átomos es idéntica, pero las posiciones de los F están ocupadas por los Na, y las de los Ca por los oxígenos. Cu 2 O (cuprita). En esta estructura los iones de Cu forman una celda cúbica centrada en el interior, mientras que los oxígenos forman un tetraedro de coordinación alrededor de Cu central.
5
Estructura de sólidos
 Estructura de sólidos Química Inorgánica - 2006 Tipos de estructuras cristalinas cristal enlace características molecular covalente-baja energía cristales blandos, bajo p.f. red covalente covalente cristales
Estructura de sólidos Química Inorgánica - 2006 Tipos de estructuras cristalinas cristal enlace características molecular covalente-baja energía cristales blandos, bajo p.f. red covalente covalente cristales
Tipos de estructuras. Introducción a la Ciencia de Materiales. M. Bizarro F. M. Sánchez
 Tipos de estructuras Empaquetamiento compacto Son estructuras formadas por átomos de igual tamaño que se unen mediante enlace metálico (esferas duras) A B A : A B C : FCC vs HCP El factor de empaquetamiento
Tipos de estructuras Empaquetamiento compacto Son estructuras formadas por átomos de igual tamaño que se unen mediante enlace metálico (esferas duras) A B A : A B C : FCC vs HCP El factor de empaquetamiento
Tema 4. Cristaloquímica. Descripción estructural y
 Tema 4. Cristaloquímica. Descripción estructural y estructuras tipos Qué objetivos tiene la Cristaloquímica? Las fases cristalinas son componentes esenciales de los materiales, y especificamente de los
Tema 4. Cristaloquímica. Descripción estructural y estructuras tipos Qué objetivos tiene la Cristaloquímica? Las fases cristalinas son componentes esenciales de los materiales, y especificamente de los
Consideraciones sobre estructuras representativas
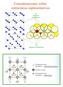 Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
TEMA 8 ESTRUCTURA CRISTALINA
 Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Cl Electrones de valencia: Cl: 7 3 = 21 P: 5 Total 26 Tres enlaces sencillos: - 6 Electrones restantes: 20
 ESTRUCTURAS DE LEWIS PARA EL ENLACE COVALENTE.- Lewis sugirió que los átomos comparten electrones para alcanzar la configuración de gas noble y tener así una estructura más estable. Salvo en el caso de
ESTRUCTURAS DE LEWIS PARA EL ENLACE COVALENTE.- Lewis sugirió que los átomos comparten electrones para alcanzar la configuración de gas noble y tener así una estructura más estable. Salvo en el caso de
Sólidos Arreglos y celdas unitarias. Ramón L. Hernández Castillo Enero 2012
 Sólidos Arreglos y celdas unitarias Ramón L. Hernández Castillo Enero 2012 Importancia de estudiar los sólidos cristalinos La mayoría de los compuestos inorgánicos son sólidos Casi todos los elementos
Sólidos Arreglos y celdas unitarias Ramón L. Hernández Castillo Enero 2012 Importancia de estudiar los sólidos cristalinos La mayoría de los compuestos inorgánicos son sólidos Casi todos los elementos
Estructura Cristalina de Sólidos
 Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
Química Inorgánica-63.13- Dra.Silvia E. Jacobo. Sólidos. Estructuras Cristalinas
 Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
Tema 8. Sólidos iónicos
 Tema 8. Sólidos iónicos Definiciones Estructuras iónicas Derivadas de CCP Derivadas de HCP Derivadas de empaquetamientos no compactos Racionalización de las estructuras iónicas Principios de Laves Reglas
Tema 8. Sólidos iónicos Definiciones Estructuras iónicas Derivadas de CCP Derivadas de HCP Derivadas de empaquetamientos no compactos Racionalización de las estructuras iónicas Principios de Laves Reglas
Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado
 Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado Física de la Materia Condensada, Cristalografía y Mineralogía. Facultad de Ciencias. Universidad de Valladolid. Estructura
Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado Física de la Materia Condensada, Cristalografía y Mineralogía. Facultad de Ciencias. Universidad de Valladolid. Estructura
TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES
 PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
Sólidos Covalentes. Tema 4: Estado Sólido. QUIMICA GENERAL Química Inorgánica Sólidos Covalentes
 Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
INTRODUCCIÓN AL ENLACE IÓNICO
 INTRODUCCIÓN AL ENLACE IÓNICO AUTORIA SILVIA GARCÍA SEPÚLVEDA TEMÁTICA FÍSICA Y QUÍMICA ETAPA BACHILLERATO Resumen A continuación voy a pasar a describir como se lleva a cabo el estudio del enlace químico,
INTRODUCCIÓN AL ENLACE IÓNICO AUTORIA SILVIA GARCÍA SEPÚLVEDA TEMÁTICA FÍSICA Y QUÍMICA ETAPA BACHILLERATO Resumen A continuación voy a pasar a describir como se lleva a cabo el estudio del enlace químico,
Ilustración 15.1. El número de coordinación en el NaCl es 6:6. Cada ion esta rodeado por seis iones que tienen carga opuesta a él.
 ENLACE IÓNICO Tú sabes que existen sustancias que forman sólidos cristalinos con altos puntos de fusión, que no conducen la corriente en estado sóliso pero se vuelven buenos conductores al fundirlos o
ENLACE IÓNICO Tú sabes que existen sustancias que forman sólidos cristalinos con altos puntos de fusión, que no conducen la corriente en estado sóliso pero se vuelven buenos conductores al fundirlos o
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES
 UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
SÓLIDOS I. Tipos de sólidos. Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada.
 SÓLIDOS I Tipos de sólidos Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada. Sólidos amorfos: no presentan estructuras ordenadas. 1 Sólidos cristalinos Hay posiciones
SÓLIDOS I Tipos de sólidos Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada. Sólidos amorfos: no presentan estructuras ordenadas. 1 Sólidos cristalinos Hay posiciones
Estado Sólido. Estado Sólido. Estado Sólido. Estado Sólido - + Sólidos cristalinos y sólidos amorfos
 Sólidos cristalinos y sólidos amorfos Sólidos cristalinos: presentan un ordenamiento regular en el espacio Sólidos amorfos: no presentan el ordenamiento típico de los cristalinos Región cristalina Región
Sólidos cristalinos y sólidos amorfos Sólidos cristalinos: presentan un ordenamiento regular en el espacio Sólidos amorfos: no presentan el ordenamiento típico de los cristalinos Región cristalina Región
EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA
 EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA Las 6 preguntas siguientes se refieren a la tabla periódica que se presenta. Los símbolos han sido asignados arbitrariamente. D H B A E M G J L R X Y N P Q Z T
EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA Las 6 preguntas siguientes se refieren a la tabla periódica que se presenta. Los símbolos han sido asignados arbitrariamente. D H B A E M G J L R X Y N P Q Z T
IMPERFECCIONES CRISTALINAS ANA QUIGUANTAR EDWIN RODRIGUES JEISON CORDOBA
 IMPERFECCIONES CRISTALINAS ANA QUIGUANTAR EDWIN RODRIGUES JEISON CORDOBA CORPORACION UNIVERSITARIA AUTONOMA DE NARIÑO FACULTAD DE INGENIERIA MECANICA SEGUNDO SEMESTRE CIENCIA DE LOS MATERIALES SAN JUAN
IMPERFECCIONES CRISTALINAS ANA QUIGUANTAR EDWIN RODRIGUES JEISON CORDOBA CORPORACION UNIVERSITARIA AUTONOMA DE NARIÑO FACULTAD DE INGENIERIA MECANICA SEGUNDO SEMESTRE CIENCIA DE LOS MATERIALES SAN JUAN
EJERCICIOS RESUELTOS DE ENLACE QUIMICO
 EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
En la figura 1.1 puede verse el cuarzo cristalino y no cristalino respectivamente.
 TEMA 3.- ESTRUCTURA CRISTALINA. 1.- Introducción. Conceptos fundamentales. Se han descrito los enlaces atómicos determinados por la configuración electrónica de los átomos individuales. Ahora se va a tratar
TEMA 3.- ESTRUCTURA CRISTALINA. 1.- Introducción. Conceptos fundamentales. Se han descrito los enlaces atómicos determinados por la configuración electrónica de los átomos individuales. Ahora se va a tratar
3. Cristaloquímica de los minerales.
 3. Cristaloquímica de los minerales. 3.1. Propiedades fundamentales de las sustancias cristalinas Se describen como materiales cristalinos aquellos materiales sólidos cuyos elementos constitutivos se repiten
3. Cristaloquímica de los minerales. 3.1. Propiedades fundamentales de las sustancias cristalinas Se describen como materiales cristalinos aquellos materiales sólidos cuyos elementos constitutivos se repiten
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
Estructura Interna de los Materiales
 TEMA III Estructura Interna de los Materiales LECCIÓN 3 Estructura Cristalina y Amorfa 1 3.1 ESTADOS DE LA MATERIA Ciencia y Tecnología de los Materiales La materia puede presentarse en tres estados: gaseoso,
TEMA III Estructura Interna de los Materiales LECCIÓN 3 Estructura Cristalina y Amorfa 1 3.1 ESTADOS DE LA MATERIA Ciencia y Tecnología de los Materiales La materia puede presentarse en tres estados: gaseoso,
Capítulo 2 La estructura de los sólidos cristalinos
 Capítulo 2 La estructura de los sólidos cristalinos TEMA 2: La estructura de los sólidos cristalinos 1. Los enlaces interatómicos 2. La estructura cristalina 3. Estructuras de empaquetamiento compacto
Capítulo 2 La estructura de los sólidos cristalinos TEMA 2: La estructura de los sólidos cristalinos 1. Los enlaces interatómicos 2. La estructura cristalina 3. Estructuras de empaquetamiento compacto
VARIACIONES PERIÓDICAS. Z = 53 Z = 53 Z = 53 Electrones = 54 Electrones = 53 Electrones = 52
 RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
RESOLUCIÓN PRÁCTICO 13 VARIACIONES PERIÓDICAS 1 a) Las variaciones en el tamaño atómico e iónico son el resultado de la influencia del nivel n y de la carga nuclear efectiva (Z ef ). I > I > I Z = 53 Z
ENLACE QUÍMICO II. 5.- De los compuestos iónicos KBr y NaBr, cuál será el más duro y cuál el de mayor temperatura de fusión?. Por qué?.
 ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
Tema 9. SOLIDOS COVALENTES
 Tema 9. SOLIDOS COVALENTES Introducción Estructuras de no-metales Boro Carbono Fósforo Arsénico, Antimonio y Bismuto Selenio y Telurio Estructuras de óxidos Estructuras basadas en tetraedros Estructuras
Tema 9. SOLIDOS COVALENTES Introducción Estructuras de no-metales Boro Carbono Fósforo Arsénico, Antimonio y Bismuto Selenio y Telurio Estructuras de óxidos Estructuras basadas en tetraedros Estructuras
Bloque II: Silicatos BLOQUE III: CERAMICAS TRADICIONALES SILICATOS. Bibliografía Química Inorgánica, Enrique Gutierrez Rios
 BLOQUE III: CERAMICAS TRADICIONALES SILICATOS Bibliografía Química Inorgánica, Enrique Gutierrez Rios 1 Características generales Estructuras tridimensionales: XRD Эn sólo Estado Sólido Aplicación industriales
BLOQUE III: CERAMICAS TRADICIONALES SILICATOS Bibliografía Química Inorgánica, Enrique Gutierrez Rios 1 Características generales Estructuras tridimensionales: XRD Эn sólo Estado Sólido Aplicación industriales
PROPIEDADES QUÍMICAS DEL SUELO
 PROPIEDADES QUÍMICAS DEL SUELO DEFINICIONES Ión: Átomos o moléculas que pierden o ganan electrones por lo cual adquieren una determinada carga; si ganan adquieren carga negativa: aniones (Cl -, NO 3- );
PROPIEDADES QUÍMICAS DEL SUELO DEFINICIONES Ión: Átomos o moléculas que pierden o ganan electrones por lo cual adquieren una determinada carga; si ganan adquieren carga negativa: aniones (Cl -, NO 3- );
Tema 14.- Definición, Clasificación y Conformado
 BLOQUE V.- MATERIALES CERÁMICOS Tema 14.- Definición, y Conformado William D. Callister, Jr Introducción a la Ciencia e Ingeniería de los Materiales. Tomo **. Ed. Reverté James F. Shackerlford Introducción
BLOQUE V.- MATERIALES CERÁMICOS Tema 14.- Definición, y Conformado William D. Callister, Jr Introducción a la Ciencia e Ingeniería de los Materiales. Tomo **. Ed. Reverté James F. Shackerlford Introducción
ESTRUCTURAS CRISTALINAS (P2)
 ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
4 Estructuras de los sólidos
 4 Estructuras de los sólidos 4.1 Comparación entre las propiedades de sólidos, líquidos y gases 4.2 Fuerzas entre moléculas y iones 4.3 Estructuras de los cristales 4.4 Sólidos metálicos 4.5 Sólidos iónicos
4 Estructuras de los sólidos 4.1 Comparación entre las propiedades de sólidos, líquidos y gases 4.2 Fuerzas entre moléculas y iones 4.3 Estructuras de los cristales 4.4 Sólidos metálicos 4.5 Sólidos iónicos
ÁTOMO Y ENLACE QUÍMICO
 ÁTM Y ENLACE QUÍMIC EJERCICIS DE ENTRENAMIENT PARA LA XIV LIMPÍADA NACINAL DE QUÍMICA Bibliografía recomendada Química, La Ciencia Central, T. L. Brown, H. E. LeMay, Jr., B. Burnsten. Editorial PrenticeHall
ÁTM Y ENLACE QUÍMIC EJERCICIS DE ENTRENAMIENT PARA LA XIV LIMPÍADA NACINAL DE QUÍMICA Bibliografía recomendada Química, La Ciencia Central, T. L. Brown, H. E. LeMay, Jr., B. Burnsten. Editorial PrenticeHall
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
EJERCICIOS DE ENLACE QUIMICO 2º DE BACHILLERATO
 1- Coloca las siguientes moléculas por orden creciente de su polaridad: HBr, HF, HI y HCl Justifica brevemente la respuesta 2- Al comparar dos moléculas muy similares como el CO 2 y el SO 2 se observa
1- Coloca las siguientes moléculas por orden creciente de su polaridad: HBr, HF, HI y HCl Justifica brevemente la respuesta 2- Al comparar dos moléculas muy similares como el CO 2 y el SO 2 se observa
Unidad I: Propiedades Periódicas: Masa y Enlace
 Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace.
 EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
1. Clasificación de sustancias por Plinio Sosa
 1. Clasificación de sustancias por Plinio Sosa a) Categorías límite Cómo agrupar tantas sustancias? Puede haber muchas maneras: por su color, por su textura, por su estado físico, por sus propiedades químicas
1. Clasificación de sustancias por Plinio Sosa a) Categorías límite Cómo agrupar tantas sustancias? Puede haber muchas maneras: por su color, por su textura, por su estado físico, por sus propiedades químicas
UNIDAD 1: LA MATERIA CRISTALINA
 UNIDAD 1: LA MATERIA CRISTALINA CONCEPTOS MATERIA CRISTALINA: Aquella cuyas partículas están perfectamente ordenadas en el espacio, ocupando posiciones fijas y a distancias regulares unas de otras, formando
UNIDAD 1: LA MATERIA CRISTALINA CONCEPTOS MATERIA CRISTALINA: Aquella cuyas partículas están perfectamente ordenadas en el espacio, ocupando posiciones fijas y a distancias regulares unas de otras, formando
Contenido. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades periódicas:
 LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
El H solo necesita 2 electrones en su capa de valencia como el He.
 Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
1.-La Cristalografía. 2.-Simetría
 1.-La Cristalografía La Cristalografía es la ciencia que se ocupa de los sólidos cristalinos y describe su estructura interna, es decir, como están distribuidos los átomos en su interior. También estudia
1.-La Cristalografía La Cristalografía es la ciencia que se ocupa de los sólidos cristalinos y describe su estructura interna, es decir, como están distribuidos los átomos en su interior. También estudia
Resolución de ejercicios PRÁCTICO 12
 Resolución de ejercicios PRÁCTIC 12 1) a) bservando la estructura de Lewis de la molécula BeH 2 podemos decir que el átomo de Be se une a dos átomos de H mediante dos enlaces simples. Una hibridación de
Resolución de ejercicios PRÁCTIC 12 1) a) bservando la estructura de Lewis de la molécula BeH 2 podemos decir que el átomo de Be se une a dos átomos de H mediante dos enlaces simples. Una hibridación de
Química Inorgánica Bloque d 1. BLOQUE d
 Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
TEMA 9 EL ENLACE IÓNICO Y LOS SÓLIDOS IÓNICOS
 TEMA 9 EL ENLACE IÓNICO Y LOS SÓLIDOS IÓNICOS Son aquellos en los que los iones constituyentes están unidos entre sí por fuerzas electrostáticas. Algunas de sus propiedades características son las siguientes:
TEMA 9 EL ENLACE IÓNICO Y LOS SÓLIDOS IÓNICOS Son aquellos en los que los iones constituyentes están unidos entre sí por fuerzas electrostáticas. Algunas de sus propiedades características son las siguientes:
Muchos elementos, al unirse a otros, manifiestan la tendencia a adquirir la estructura electrónica externa propia de los gases nobles.
 ENLACE QUÍMICO I 1. INTRODUCCIÓN. 2. ENLACE IÓNICO. 3. ENLACE COVALENTE. 4. ACTIVIDADES. 1. INTRODUCCIÓN. Se denomina enlace químico a las fuerzas que mantienen unidos los átomos, iones y moléculas cuando
ENLACE QUÍMICO I 1. INTRODUCCIÓN. 2. ENLACE IÓNICO. 3. ENLACE COVALENTE. 4. ACTIVIDADES. 1. INTRODUCCIÓN. Se denomina enlace químico a las fuerzas que mantienen unidos los átomos, iones y moléculas cuando
Contenidos. 1.- Primeras clasificaciones periódicas.
 LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
Introducción a los elementos metálicos y metalurgía
 Tema 7. Introducción a los elementos metálicos y Metalurgia. El enlace en los metales. Conductores y semiconductores. Los metales en la naturaleza. Preparación de la mena. Producción de los metales. La
Tema 7. Introducción a los elementos metálicos y Metalurgia. El enlace en los metales. Conductores y semiconductores. Los metales en la naturaleza. Preparación de la mena. Producción de los metales. La
Según Lewis el enlace covalente consiste en la unión de dos átomos que comparten uno o más pares de electrones.
 En 1916, Lewis resaltó que los gases nobles eran muy poco reactivos debido a que su configuración electrónica era muy estable, y sugirió que los átomos pueden adquirir estabilidad compartiendo electrones
En 1916, Lewis resaltó que los gases nobles eran muy poco reactivos debido a que su configuración electrónica era muy estable, y sugirió que los átomos pueden adquirir estabilidad compartiendo electrones
TEMA 6: Unidades Secundarias de Construcción (SBU) en fosfitos
 1.) Concepto TEMA 6: Unidades Secundarias de Construcción (SBU) en fosfitos Las estructuras abiertas se pueden construir a partir de una amplia variedad de unidades estructurales. La unidad estructural
1.) Concepto TEMA 6: Unidades Secundarias de Construcción (SBU) en fosfitos Las estructuras abiertas se pueden construir a partir de una amplia variedad de unidades estructurales. La unidad estructural
Las propiedades características de las sustancias están relacionadas con la forma en que están unidas sus partículas y las fuerzas entre ellas, es
 EL ENLACE QUÍMICO Las propiedades características de las sustancias están relacionadas con la forma en que están unidas sus partículas y las fuerzas entre ellas, es decir, con el tipo de ENLACE que existe
EL ENLACE QUÍMICO Las propiedades características de las sustancias están relacionadas con la forma en que están unidas sus partículas y las fuerzas entre ellas, es decir, con el tipo de ENLACE que existe
ENLACE IÓNICO. Este enlace tendrá lugar entre átomos de electronegatividad muy distinta: entre metales y no metales.
 ENLACE IÓNICO Si enfrentamos un átomo al que le falten pocos electrones en su capa de valencia para adquirir la configuración de gas noble (muy electronegativo, tendencia a coger electrones), tal como
ENLACE IÓNICO Si enfrentamos un átomo al que le falten pocos electrones en su capa de valencia para adquirir la configuración de gas noble (muy electronegativo, tendencia a coger electrones), tal como
ESTRUCTURA DE LA MATERIA QCA 01 ANDALUCÍA. 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad.
 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
Tema 3_2. ENLACE QUÍMICO
 Tema 3_2. ENLACE QUÍMICO Fuerzas de Coulomb: Una visión simplificada del enlace FORMACIÓN DE UN ENLACE Las cargas opuestas se atraen entre sí (atracción de Coulomb) Los electrones tienden a distribuirse
Tema 3_2. ENLACE QUÍMICO Fuerzas de Coulomb: Una visión simplificada del enlace FORMACIÓN DE UN ENLACE Las cargas opuestas se atraen entre sí (atracción de Coulomb) Los electrones tienden a distribuirse
Tema 3. DEFECTOS EN LA ESTRUCTURA CRISTALINA. SOLIDIFICACIÓN DE ME-
 ÍNDICE Prólogo... 15 Tema 1. INTRODUCCIÓN A LA CIENCIA E INGENIERÍA DE MATERIALES... 17 1.1. Introducción... 19 1.2. Los materiales en la sociedad actual... 19 1.3. Propiedades de los materiales... 23
ÍNDICE Prólogo... 15 Tema 1. INTRODUCCIÓN A LA CIENCIA E INGENIERÍA DE MATERIALES... 17 1.1. Introducción... 19 1.2. Los materiales en la sociedad actual... 19 1.3. Propiedades de los materiales... 23
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
LAS PROPIEDADES CARACTERÍSTICAS DE LAS SUSTANCIAS ESTÁN RELACIONADAS CON LA FORMA EN QUE ESTÁN UNIDAS SUS PARTÍCULAS Y LAS FUERZAS ENTRE ELLAS, ES
 EL ENLACE QUÍMICO LAS PROPIEDADES CARACTERÍSTICAS DE LAS SUSTANCIAS ESTÁN RELACIONADAS CON LA FORMA EN QUE ESTÁN UNIDAS SUS PARTÍCULAS Y LAS FUERZAS ENTRE ELLAS, ES DECIR, CON EL TIPO DE ENLACE QUE EXISTE
EL ENLACE QUÍMICO LAS PROPIEDADES CARACTERÍSTICAS DE LAS SUSTANCIAS ESTÁN RELACIONADAS CON LA FORMA EN QUE ESTÁN UNIDAS SUS PARTÍCULAS Y LAS FUERZAS ENTRE ELLAS, ES DECIR, CON EL TIPO DE ENLACE QUE EXISTE
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato
 Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
MINERALOGÍA TEMA INOSILICATOS. ÍNDICE Piroxenos Anfíboles. Celia Marcos Pascual
 MINERALOGÍA TEMA 27 27-4 INOSILICATOS ÍNDICE 27.4.1 Piroxenos 27.4.2 Anfíboles Los inosilicatos constituyen alrededor del 16% del peso de la corteza terrestre y se caracterizan porque en ellos los tetraedros
MINERALOGÍA TEMA 27 27-4 INOSILICATOS ÍNDICE 27.4.1 Piroxenos 27.4.2 Anfíboles Los inosilicatos constituyen alrededor del 16% del peso de la corteza terrestre y se caracterizan porque en ellos los tetraedros
Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Cristales metálicos
 Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta, de manera
Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta, de manera
Diferencias entre Figuras y
 10 Lección Refuerzo Matemáticas Diferencias entre Figuras y Cuerpos Geométricos APRENDO JUGANDO Competencia Aplica conocimientos acerca de las principales características de polígonos y cuerpos geométricos.
10 Lección Refuerzo Matemáticas Diferencias entre Figuras y Cuerpos Geométricos APRENDO JUGANDO Competencia Aplica conocimientos acerca de las principales características de polígonos y cuerpos geométricos.
3. DESARROLLO 3.1 ENLACE IONICO
 3. DESARROLLO Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. 3.1 ENLACE IONICO El enlace iónico
3. DESARROLLO Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. 3.1 ENLACE IONICO El enlace iónico
Diagrama de correlación de enlaces moleculares Antienlace : rojo 1s similar a 2s
 Redes Cristalinas Ciencia de Materiales Ing. en Mecatrónica Otoño 2009 Lilia Meza Montes-IFUAP Diagrama de correlación de enlaces moleculares Antienlace : rojo 1s similar a 2s Sólidos cristalinos y amorfos
Redes Cristalinas Ciencia de Materiales Ing. en Mecatrónica Otoño 2009 Lilia Meza Montes-IFUAP Diagrama de correlación de enlaces moleculares Antienlace : rojo 1s similar a 2s Sólidos cristalinos y amorfos
ORGANIZACIÓN DE LOS ELEMENTOS EN LA TABLA PERIÓICA PROPIEDADES PERIÓDICAS
 Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
PRIMERAS CLASIFICACIONES PERIÓDICAS
 LA TABLA PERIÓDICA PRIMERAS CLASIFICACIONES PERIÓDICAS Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades variaban periódicamente
LA TABLA PERIÓDICA PRIMERAS CLASIFICACIONES PERIÓDICAS Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades variaban periódicamente
Tema 2 Estructuras Cristalinas
 Tema 2 Estructuras Cristalinas Para poder comprender las propiedades de los materiales, y poder por tanto seleccionar el material idóneo para una aplicación específica, se hace necesario comprender la
Tema 2 Estructuras Cristalinas Para poder comprender las propiedades de los materiales, y poder por tanto seleccionar el material idóneo para una aplicación específica, se hace necesario comprender la
ENLACE QUÍMICO. Cátedra de Química General e Inorgánica Año 2016
 ENLACE QUÍMIC Cátedra de Química General e Inorgánica Año 2016 ns (1-2) ns2 np (1-6) La cantidad y disposición de los electrones en la capa más externa determinan las propiedades físicas y químicas de
ENLACE QUÍMIC Cátedra de Química General e Inorgánica Año 2016 ns (1-2) ns2 np (1-6) La cantidad y disposición de los electrones en la capa más externa determinan las propiedades físicas y químicas de
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN
 GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN 1. REVISIÓN DE TABLA PERIÓDICA 1.1 Completa el siguiente cuadro. Configuración electrónica externa Bloque
GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN 1. REVISIÓN DE TABLA PERIÓDICA 1.1 Completa el siguiente cuadro. Configuración electrónica externa Bloque
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Área del rectángulo y del cuadrado
 59 Área del rectángulo y del cuadrado El área del rectángulo es el producto de su base por su altura. El área del cuadrado es su lado elevado al cuadrado. 1. Mide con una regla y completa. Área del rectángulo:
59 Área del rectángulo y del cuadrado El área del rectángulo es el producto de su base por su altura. El área del cuadrado es su lado elevado al cuadrado. 1. Mide con una regla y completa. Área del rectángulo:
SÓLIDOS INORGÁNICOS. Tema 6. FUNDAMENTOS
 SÓLIDOS INORGÁNICOS Tema 6. Fundamentos Tema 7. Sólidos metálicos Tema 8. Sólidos iónicos Tema 9. Sólidos covalentes Tema 10. Sólidos moleculares Tema 11. Defectos y no-estequiometría Tema 12. Propiedades
SÓLIDOS INORGÁNICOS Tema 6. Fundamentos Tema 7. Sólidos metálicos Tema 8. Sólidos iónicos Tema 9. Sólidos covalentes Tema 10. Sólidos moleculares Tema 11. Defectos y no-estequiometría Tema 12. Propiedades
RESPUESTA Guía de ejercicios #5 Enlace químico
 Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
Características de electrones protones y neutrones
 Características de electrones protones y neutrones Carga eléctrica Masa Espín SI (C) Atómica SI(g) Atómica (uma) Protón +1,6021 10-19 +1 1,6725 10-24 1,0073 1/2 neutrón 0 0 1,6748 10-24 1,0087 1/2 electrón
Características de electrones protones y neutrones Carga eléctrica Masa Espín SI (C) Atómica SI(g) Atómica (uma) Protón +1,6021 10-19 +1 1,6725 10-24 1,0073 1/2 neutrón 0 0 1,6748 10-24 1,0087 1/2 electrón
TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS
 TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS E2A.S2010 Para la molécula CH 3 Cl: a) Establezca su geometría mediante la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. b) Razone
TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS E2A.S2010 Para la molécula CH 3 Cl: a) Establezca su geometría mediante la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. b) Razone
Problemario de Talleres de Estructura de la Materia. DCBI/UAM-I. Obra Colectiva del. / Revisión octubre del 2012 UNIDAD 2
 UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
GUÍA DE EJERCICIOS ENLACE
 GUÍA DE EJERCICIOS ENLACE Área Química Resultados de aprendizaje Aplicar y analizar características de moléculas, para predecir solubilidad, tipo de enlace que la forman y estructura más estable, potenciando
GUÍA DE EJERCICIOS ENLACE Área Química Resultados de aprendizaje Aplicar y analizar características de moléculas, para predecir solubilidad, tipo de enlace que la forman y estructura más estable, potenciando
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO
 ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
