Tema 9. SOLIDOS COVALENTES
|
|
|
- Vicenta Romero Vidal
- hace 9 años
- Vistas:
Transcripción
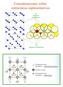
1 Tema 9. SOLIDOS COVALENTES Introducción Estructuras de no-metales Boro Carbono Fósforo Arsénico, Antimonio y Bismuto Selenio y Telurio Estructuras de óxidos Estructuras basadas en tetraedros Estructuras basadas en octaedros Otras estructuras Juan M. Gutiérrez-Zorrilla. Química Inorgánica. 2005
2 Introducción Los sólidos covalentes están formados por átomos covalentemente unidos a sus inmediatos vecinos. Los enlaces son direccionales y determinan el ordenamiento geométrico de los átomos en la estructura cristalina. La rigidez de su estructura electrónica hace que los sólidos covalentes sean duros y poco deformables. No son buenos conductores ni del calor ni la electricidad (no hay electrones libres). Algunos son semiconductores. El color depende de la energía del gap. Estructura de los cristales covalentes La formación de las redes cristalinas de sólidos covalentes debe entenderse en base a lo siguiente: El poliedro de coordinación de cada átomo depende de su estructura electrónica. La disposición y conexión de todos los poliedros de la red debe ser compatible con las exigencia de valencia de todos los átomos. Conectividad (P). Regla 8-N Las estructuras de los elementos no-s viene gobernada por la regla: P = 8-N P Tipo de estructura Dímeros Anillos Cadenas Capas Redes 3D Ejemplo I 2 S 8 α-se As diamante
3 Estructura de no-metales B icosaédrico C diamante C grafito N 2 O 2 O 3 F 2 Al Si diamante P negro capas P rojo cad. P 4 blanco S polimer. S 6 S 8 Cl 2 Ga Ge diamante As (gris) capas As 4 (amarillo) Se hélice Se 8 Br 2 In Sn (blanco) Sn (gris) diamante Sb (gris) capas Sb (amarillo) Te hélice I 2 Tl Pb Bi capas Po Boro Romboédrico: R-3m a=5.057å, α=58.06 Z=12 D=2.46 g cm 3 B-B(puente): Å B-B(icosaedro): Å
4 Diamante C Si Ge Sn Cúbico: Fd3m a (Å) V (Å 3 ) Z D(g cm 3 ) M-M (Å) Cullinan Diamond carats in its uncut state. Hexagonal: P3 a (Å) c (Å) V (Å 3 ) Z 4 D (g cm 3 ) Carbono (grafito) C-C: Å capa-capa: 3.35 Å
5 Fósforo (Hittorf) Monoclinico: P2/c a (Å) 9.21 b (Å) 9.15 c (Å) Å β ( ) V (Å 3 ) Z 84 D (g cm 3 ) 2.36 P-P (Å) Fósforo (negro) Ortorrómbico: Cmca a (Å) b (Å) c (Å) V (Å 3 ) Z 8 D (g cm 3 ) 2.71 P-P (Å) 2.22, 2.28
6 Arsénico, Antimonio y Bismuto As Sb Bi Trigonal: R-3m a (Å) c (Å) V(Å 3 ) Z D(g cm 3 ) M-M (Å) M-M(intercapas) Selenio Telurio Se Te Trigonal: P3 1 2 a(å) c(å) V (Å 3 ) Z 3 3 D(g cm 3 ) M-M (Å)
7 Óxidos basados en T d β-cristobalita (SiO 2 ) Cubico: Fd3m a (Å) V (Å 3 ) Z 8 D (g cm 3 ) Si-O (Å) Óxidos basados en O h Trióxodo de renio (ReO 3 ) Cubico: P m-3m a (Å) V (Å 3 ) 52.1 Estructuras relacionadas Z 1 WO 3, AlF 3, ScF 3, FeF 3, CoF 3 D (g cm 3 ) 7.46 Re-O (Å) 1.867
8 Perovskita Perovskita (BaTiO 3 ) Tetragonal: P 4mm a (Å) c (Å) V (Å 3 ) 64.3 Z 1 D (g cm 3 ) 6.02 Ti-O (Å) 1.87, 2.15, 2.00 Ba-O (Å) 2.79, 2.83, 2.88 Superconductor: YBa 2 Cu 3 O 7 YBa 2 Cu 3 O 9 YBa 2 Cu 3 O 7 Ba X3 2 O Y Cu O
9 K 2 NiF 4 Tetrafluoroniccolato de potasio Tetragonal: P 4/mmm a (Å) b (Å) V (Å Z 2 D (g cm 3 ) 3.35 Ni-F (Å) K-F (Å) 2.62, 2.77, 2.84 Estructuras relacionadas La 2 CuO 4 superconductores MgB 2 Hexagonal: P 6/mmm a (Å) b (Å) V (Å Z 1 D (g.cm 3 ) 2.81 B-B (Å) 1.78 Mg-Mg (Å) 3.09 B-Mg (Å) 2.51
10 χ(b) Triángulo de Ketalaar Metales Aleaciones Metálico χ(a) = χ(b) a lo largo de la diagonal Fases Subóxidos Sales Zintl iónicas Iónico Sales Intersticiales iónicas Intermedio polarizadas Estructura en capas Semiconductores No-metales Redes 3D (silicatos) Cadenas Enlace secundario Covalente Moléculas covalentes χ(a)
Sólidos Covalentes. Tema 4: Estado Sólido. QUIMICA GENERAL Química Inorgánica Sólidos Covalentes
 Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
TEMA 8 ESTRUCTURA CRISTALINA
 Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Sobre la estructura periódica de los sólidos elementales
 Sobre la estructura periódica de los sólidos elementales Gonzalo Gutiérrez * [email protected] 3 Agosto 2004 Las diferentes propiedades de los materiales se reflejan con mucha claridad
Sobre la estructura periódica de los sólidos elementales Gonzalo Gutiérrez * [email protected] 3 Agosto 2004 Las diferentes propiedades de los materiales se reflejan con mucha claridad
SÓLIDOS I. Tipos de sólidos. Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada.
 SÓLIDOS I Tipos de sólidos Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada. Sólidos amorfos: no presentan estructuras ordenadas. 1 Sólidos cristalinos Hay posiciones
SÓLIDOS I Tipos de sólidos Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada. Sólidos amorfos: no presentan estructuras ordenadas. 1 Sólidos cristalinos Hay posiciones
Estructura Cristalina de Sólidos
 Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
- Enlace Iónico - Enlace Covalente - Van der Waals - Polimorfismo y Transformaciones - Estructura Vítrea
 TEMA 3. ESTRUCTURA ATÓMICA Y PROPIEDADES FÍSICAS DE LOS MATERIALES CERÁMICOS ENLACE Y ESTRUCTURA - Enlace Iónico - Enlace Covalente - Van der Waals - Polimorfismo y Transformaciones - Estructura Vítrea
TEMA 3. ESTRUCTURA ATÓMICA Y PROPIEDADES FÍSICAS DE LOS MATERIALES CERÁMICOS ENLACE Y ESTRUCTURA - Enlace Iónico - Enlace Covalente - Van der Waals - Polimorfismo y Transformaciones - Estructura Vítrea
TEMA 5: INTROD. AL ESTADO SÓLIDO
 ESTADO SÓLIDO Figuras p1143 y p1146, Tipler 5ª Ed SEMICONDUCTORES Figuras p1141 y p1160, Tipler 5ª Ed DISPOSITIVOS http://axxon.com.ar/zap/c-zapping0127.htm Enlace químico: fuerza que mantiene unidos los
ESTADO SÓLIDO Figuras p1143 y p1146, Tipler 5ª Ed SEMICONDUCTORES Figuras p1141 y p1160, Tipler 5ª Ed DISPOSITIVOS http://axxon.com.ar/zap/c-zapping0127.htm Enlace químico: fuerza que mantiene unidos los
Diagrama de correlación de enlaces moleculares Antienlace : rojo 1s similar a 2s
 Redes Cristalinas Ciencia de Materiales Ing. en Mecatrónica Otoño 2009 Lilia Meza Montes-IFUAP Diagrama de correlación de enlaces moleculares Antienlace : rojo 1s similar a 2s Sólidos cristalinos y amorfos
Redes Cristalinas Ciencia de Materiales Ing. en Mecatrónica Otoño 2009 Lilia Meza Montes-IFUAP Diagrama de correlación de enlaces moleculares Antienlace : rojo 1s similar a 2s Sólidos cristalinos y amorfos
Tema 2.- Estructura de la Materia
 BLOQUE II.- ESTRUCTURA Estructura de la Materia * James F. Shackerlford Introducción a la Ciencia de Materiales para Ingenieros. Cuarta edición. Ed. Prentice Hall (1998) * Pat L. Mangonon Ciencia de Materiales:
BLOQUE II.- ESTRUCTURA Estructura de la Materia * James F. Shackerlford Introducción a la Ciencia de Materiales para Ingenieros. Cuarta edición. Ed. Prentice Hall (1998) * Pat L. Mangonon Ciencia de Materiales:
 El carbono y sus propiedades 1.-Definición El carbón es un combustible sólido de origen vegetal. El carbón o carbón mineral es una roca sedimentaria de color negro, muy rica en carbono, utilizada como
El carbono y sus propiedades 1.-Definición El carbón es un combustible sólido de origen vegetal. El carbón o carbón mineral es una roca sedimentaria de color negro, muy rica en carbono, utilizada como
Consideraciones sobre estructuras representativas
 Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
ESTADO SOLIDO. Propiedades 03/07/2012. Fuerte interacción entre partículas
 ESTADO SOLIDO Propiedades Fuerte interacción entre partículas Ocupan posiciones relativamente fijas las partículas vibran Tienen forma propia y definida Son prácticamente incompresibles No difunden entre
ESTADO SOLIDO Propiedades Fuerte interacción entre partículas Ocupan posiciones relativamente fijas las partículas vibran Tienen forma propia y definida Son prácticamente incompresibles No difunden entre
Química Inorgánica-63.13- Dra.Silvia E. Jacobo. Sólidos. Estructuras Cristalinas
 Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
Estado Sólido. Estado Sólido. Estado Sólido. Estado Sólido - + Sólidos cristalinos y sólidos amorfos
 Sólidos cristalinos y sólidos amorfos Sólidos cristalinos: presentan un ordenamiento regular en el espacio Sólidos amorfos: no presentan el ordenamiento típico de los cristalinos Región cristalina Región
Sólidos cristalinos y sólidos amorfos Sólidos cristalinos: presentan un ordenamiento regular en el espacio Sólidos amorfos: no presentan el ordenamiento típico de los cristalinos Región cristalina Región
SÓLIDOS INORGÁNICOS. Tema 6. FUNDAMENTOS
 SÓLIDOS INORGÁNICOS Tema 6. Fundamentos Tema 7. Sólidos metálicos Tema 8. Sólidos iónicos Tema 9. Sólidos covalentes Tema 10. Sólidos moleculares Tema 11. Defectos y no-estequiometría Tema 12. Propiedades
SÓLIDOS INORGÁNICOS Tema 6. Fundamentos Tema 7. Sólidos metálicos Tema 8. Sólidos iónicos Tema 9. Sólidos covalentes Tema 10. Sólidos moleculares Tema 11. Defectos y no-estequiometría Tema 12. Propiedades
QUÍMICA FUNDAMENTAL. Tabla Periódica
 QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
FORMULACIÓN Y NOMENCLATURA
 FORMULACIÓN Y NOMENCLATURA.- Formulación: Es la representación escrita de una molécula que se rige por unas normas universales establecidas por acuerdo de la comunidad científica..- Nomenclatura: Es el
FORMULACIÓN Y NOMENCLATURA.- Formulación: Es la representación escrita de una molécula que se rige por unas normas universales establecidas por acuerdo de la comunidad científica..- Nomenclatura: Es el
Tema 9: Sólidos covalentes no moleculares: a) Metales b) Sólidos covalentes no metálicos
 Tema 9: sólidos covalentes no moleculares 1 Tema 9: Sólidos covalentes no moleculares: a) Metales b) Sólidos covalentes no metálicos Epígrafes: Estructuras habituales en metales. Polimorfismo. Aleaciones.
Tema 9: sólidos covalentes no moleculares 1 Tema 9: Sólidos covalentes no moleculares: a) Metales b) Sólidos covalentes no metálicos Epígrafes: Estructuras habituales en metales. Polimorfismo. Aleaciones.
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Problemario de Talleres de Estructura de la Materia. DCBI/UAM-I. Obra Colectiva del. / Revisión octubre del 2012 UNIDAD 2
 UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
4 Los elementos. 4.1 Metales, no metales y semimetales. 4.2 Estructura de los metales
 4 Los elementos 4.1 Metales, no metales y semimetales 4.2 Estructura de los metales 4.3 Estructura de los no metales 4.4 Conductores y semiconductores 4.5 Aleaciones 4.6 Estado natural y extracción de
4 Los elementos 4.1 Metales, no metales y semimetales 4.2 Estructura de los metales 4.3 Estructura de los no metales 4.4 Conductores y semiconductores 4.5 Aleaciones 4.6 Estado natural y extracción de
Ejercicios y respuestas del apartado: Tabla periódica. Grupos y períodos. Metales, no metales y gases nobles
 Ejercicios y respuestas del apartado: Tabla periódica. Grupos y períodos. Metales, no metales y gases nobles Elementos de la tabla periódica (1) 1. Grupo de los halógenos: ---------> Símbolos: (1), (2),
Ejercicios y respuestas del apartado: Tabla periódica. Grupos y períodos. Metales, no metales y gases nobles Elementos de la tabla periódica (1) 1. Grupo de los halógenos: ---------> Símbolos: (1), (2),
Tema 2 Estructuras Cristalinas
 Tema 2 Estructuras Cristalinas Para poder comprender las propiedades de los materiales, y poder por tanto seleccionar el material idóneo para una aplicación específica, se hace necesario comprender la
Tema 2 Estructuras Cristalinas Para poder comprender las propiedades de los materiales, y poder por tanto seleccionar el material idóneo para una aplicación específica, se hace necesario comprender la
Tema 14.- Definición, Clasificación y Conformado
 BLOQUE V.- MATERIALES CERÁMICOS Tema 14.- Definición, y Conformado William D. Callister, Jr Introducción a la Ciencia e Ingeniería de los Materiales. Tomo **. Ed. Reverté James F. Shackerlford Introducción
BLOQUE V.- MATERIALES CERÁMICOS Tema 14.- Definición, y Conformado William D. Callister, Jr Introducción a la Ciencia e Ingeniería de los Materiales. Tomo **. Ed. Reverté James F. Shackerlford Introducción
Capítulo 2 La estructura de los sólidos cristalinos
 Capítulo 2 La estructura de los sólidos cristalinos TEMA 2: La estructura de los sólidos cristalinos 1. Los enlaces interatómicos 2. La estructura cristalina 3. Estructuras de empaquetamiento compacto
Capítulo 2 La estructura de los sólidos cristalinos TEMA 2: La estructura de los sólidos cristalinos 1. Los enlaces interatómicos 2. La estructura cristalina 3. Estructuras de empaquetamiento compacto
TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES
 PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
UNIDAD 1: LA MATERIA CRISTALINA
 UNIDAD 1: LA MATERIA CRISTALINA CONCEPTOS MATERIA CRISTALINA: Aquella cuyas partículas están perfectamente ordenadas en el espacio, ocupando posiciones fijas y a distancias regulares unas de otras, formando
UNIDAD 1: LA MATERIA CRISTALINA CONCEPTOS MATERIA CRISTALINA: Aquella cuyas partículas están perfectamente ordenadas en el espacio, ocupando posiciones fijas y a distancias regulares unas de otras, formando
ACADEMIA DE QUÍMICA TURNO VESPERTINO
 INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
ORGANIZACIÓN DE LOS ELEMENTOS EN LA TABLA PERIÓICA PROPIEDADES PERIÓDICAS
 Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
El H solo necesita 2 electrones en su capa de valencia como el He.
 Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
Estructura Atómica. Lic. Raúl Hernández Mazariegos
 Área de Química 2008 Estructura Atómica Lic. Raúl Hernández Mazariegos http://rhermazariegos.wordpress.com/ http://raulher.wordpress.com http://raulherqg.wordpress.com http://medicina.usac.edu.gt/quimica/
Área de Química 2008 Estructura Atómica Lic. Raúl Hernández Mazariegos http://rhermazariegos.wordpress.com/ http://raulher.wordpress.com http://raulherqg.wordpress.com http://medicina.usac.edu.gt/quimica/
ESTRUCTURAS CRISTALINAS (P2)
 ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
Tema 7. Metales. Empaquetamientos en 2D. El enlace metálico Teoría de bandas Conductividad eléctrica Semiconductividad
 Tema 7. Metales Empaquetamientos de esferas Empaquetamientos compactos Estructura de metales Aleaciones El enlace metálico Teoría de bandas Conductividad eléctrica Semiconductividad http://www.chem.ox.ac.uk/icl/heyes/structure_of_solids/strucsol.html
Tema 7. Metales Empaquetamientos de esferas Empaquetamientos compactos Estructura de metales Aleaciones El enlace metálico Teoría de bandas Conductividad eléctrica Semiconductividad http://www.chem.ox.ac.uk/icl/heyes/structure_of_solids/strucsol.html
CAPITULO 2 LA TABLA PERIODICA
 1.0079 1 H HIDROGENO 6.941 3 Li LITIO 22.989 11 Na SODIO 30.098 19 K POTASIO CAPITULO 2 LA TABLA PERIODICA ORDENAMIENTO ACTUAL GRUPOS Y PERIODOS PROPIEDADES PERIODICAS TAMAÑO POTENCIAL DE IONIZACION AFINIDAD
1.0079 1 H HIDROGENO 6.941 3 Li LITIO 22.989 11 Na SODIO 30.098 19 K POTASIO CAPITULO 2 LA TABLA PERIODICA ORDENAMIENTO ACTUAL GRUPOS Y PERIODOS PROPIEDADES PERIODICAS TAMAÑO POTENCIAL DE IONIZACION AFINIDAD
1. La búsqueda de los elementos. 2. Sistema periódico actual. 3. Los símbolos de los elementos. 4. Elementos naturales y artificiales. 5.
 1. La búsqueda de los elementos. 2. Sistema periódico actual. 3. Los símbolos de los elementos. 4. Elementos naturales y artificiales. 5. Uniones entre átomos. 6. Enlace covalente. 7. Enlace iónico. 8.
1. La búsqueda de los elementos. 2. Sistema periódico actual. 3. Los símbolos de los elementos. 4. Elementos naturales y artificiales. 5. Uniones entre átomos. 6. Enlace covalente. 7. Enlace iónico. 8.
Estructura Interna de los Materiales
 TEMA III Estructura Interna de los Materiales LECCIÓN 3 Estructura Cristalina y Amorfa 1 3.1 ESTADOS DE LA MATERIA Ciencia y Tecnología de los Materiales La materia puede presentarse en tres estados: gaseoso,
TEMA III Estructura Interna de los Materiales LECCIÓN 3 Estructura Cristalina y Amorfa 1 3.1 ESTADOS DE LA MATERIA Ciencia y Tecnología de los Materiales La materia puede presentarse en tres estados: gaseoso,
TABLA PERIODICA. Ciencias naturales Ambientes Raymond Chang
 TABLA PERIODICA Ciencias naturales Ambientes Raymond Chang TABLA PERIODICA La organización más satisfactoria de los elementos fue obra de Dmitri Mendeleev, quien señalo que las propiedades, tanto físicas
TABLA PERIODICA Ciencias naturales Ambientes Raymond Chang TABLA PERIODICA La organización más satisfactoria de los elementos fue obra de Dmitri Mendeleev, quien señalo que las propiedades, tanto físicas
1. Introducción 2. Configuración electrónica y clasificación periódica 3. Propiedades periódicas Cuestionario de orientación y problemas
 PRÓLOGO A LA PRIMERA EDICIÓN 13 PRÓLOGO A LA TERCERA EDICIÓN 15 CAPÍTULO 1 Estructura atómica 17 1. Introducción 2. Principales experimentos que contribuyeron al conocimiento de la estructura atómica 3.
PRÓLOGO A LA PRIMERA EDICIÓN 13 PRÓLOGO A LA TERCERA EDICIÓN 15 CAPÍTULO 1 Estructura atómica 17 1. Introducción 2. Principales experimentos que contribuyeron al conocimiento de la estructura atómica 3.
Semiconductores. La característica común a todos ellos es que son tetravalentes
 Semiconductores Un semiconductor es un dispositivo que se comporta como conductor o como aislante dependiendo del campo eléctrico en el que se encuentre. Elemento Grupo Electrones en la última capa Cd
Semiconductores Un semiconductor es un dispositivo que se comporta como conductor o como aislante dependiendo del campo eléctrico en el que se encuentre. Elemento Grupo Electrones en la última capa Cd
QUIMICA 1RO INGENIERIA INDUSTRIAL Y DE SISTEMAS EJECUTIVO PLUS INGENIERIO: LEONOR BARRAZA MARCELA RAMIREZ SANCHEZ TEMA: TABLA PERIODICA Y SUS
 QUIMICA 1RO INGENIERIA INDUSTRIAL Y DE SISTEMAS EJECUTIVO PLUS INGENIERIO: LEONOR BARRAZA MARCELA RAMIREZ SANCHEZ TEMA: TABLA PERIODICA Y SUS CARACTERISTICAS LOS ALCALINOS Explica que son aquellos metales
QUIMICA 1RO INGENIERIA INDUSTRIAL Y DE SISTEMAS EJECUTIVO PLUS INGENIERIO: LEONOR BARRAZA MARCELA RAMIREZ SANCHEZ TEMA: TABLA PERIODICA Y SUS CARACTERISTICAS LOS ALCALINOS Explica que son aquellos metales
2.1.- ESTRUCTURA DEL ÁTOMO
 2.1.- ESTRUCTURA DEL ÁTOMO El átomo está formado por un núcleo, que contiene nuetrones y protones, el que a su vez esta rodeado por electrones. La carga eléctrica de un átomo es nula. Número atómico es
2.1.- ESTRUCTURA DEL ÁTOMO El átomo está formado por un núcleo, que contiene nuetrones y protones, el que a su vez esta rodeado por electrones. La carga eléctrica de un átomo es nula. Número atómico es
A. VIVENCIA Elabora la siguiente sopa de letras y define los conceptos:
 INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13
 CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS. Cuestiones de evaluación inicial. 2.- Cuántos protones y cuantos neutrones tiene el Carbono?
 UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
3. La estructura de sólidos cristalinos 3.1 Conceptos fundamentales 3.2 Celda unitaria 3.3 Redes de Bravias 3.4 Estructuras cristalinas 3.
 Contenido 3. La estructura de sólidos cristalinos 3.1 Conceptos fundamentales 3.2 Celda unitaria 3.3 Redes de Bravias 3.4 Estructuras cristalinas 3.5 Volumen y densidad 3.6 Direcciones y planos cristalográficos
Contenido 3. La estructura de sólidos cristalinos 3.1 Conceptos fundamentales 3.2 Celda unitaria 3.3 Redes de Bravias 3.4 Estructuras cristalinas 3.5 Volumen y densidad 3.6 Direcciones y planos cristalográficos
6. ELEMENTOS Y COMPUESTOS
 6. ELEMENTOS Y COMPUESTOS Las definiciones de elemento 1. Define sustancia simple y elemento. Una sustancia simple es una sustancia pura que no puede descomponerse en otras sustancias más sencillas por
6. ELEMENTOS Y COMPUESTOS Las definiciones de elemento 1. Define sustancia simple y elemento. Una sustancia simple es una sustancia pura que no puede descomponerse en otras sustancias más sencillas por
PONTIFICIA UNIVERSIDAD CATOLICA DEL ECUADOR FACULTAD DE CIENCIAS EXACTAS Y NATURALES ESCUELA DE CIENCIAS QUÍMICAS
 PONTIFICIA UNIVERSIDAD CATOLICA DEL ECUADOR FACULTAD DE CIENCIAS EXACTAS Y NATURALES ESCUELA DE CIENCIAS QUÍMICAS 1.- DATOS INFORMATIVOS: Materia: Química Inorgánica Carrera: Química Analítica Nivel: Segundo
PONTIFICIA UNIVERSIDAD CATOLICA DEL ECUADOR FACULTAD DE CIENCIAS EXACTAS Y NATURALES ESCUELA DE CIENCIAS QUÍMICAS 1.- DATOS INFORMATIVOS: Materia: Química Inorgánica Carrera: Química Analítica Nivel: Segundo
11 LOS ÁTOMOS Y SUS ENLACES
 11 LOS ÁTOMOS Y SUS ENLACES EJERCICIOS PROPUESTOS 11.1 Por qué el modelo nuclear de átomo permite explicar el resultado de la experiencia de las partículas que rebotan en la lámina de oro? Por lógica,
11 LOS ÁTOMOS Y SUS ENLACES EJERCICIOS PROPUESTOS 11.1 Por qué el modelo nuclear de átomo permite explicar el resultado de la experiencia de las partículas que rebotan en la lámina de oro? Por lógica,
Física del Estado Sólido REDES CRISTALINAS. Dr. Andrés Ozols. Facultad de Ingeniería Universidad de Buenos Aires. Dr. A. Ozols 1
 Física del Estado Sólido REDES CRISTALINAS Dr. Andrés Ozols Facultad de Ingeniería Universidad de Buenos Aires 2009 Dr. A. Ozols 1 ÁTOMOS EN SÓLIDOS Dr. A. Ozols 2 ORDEN CRISTALINO y FORMA René Just Hauy
Física del Estado Sólido REDES CRISTALINAS Dr. Andrés Ozols Facultad de Ingeniería Universidad de Buenos Aires 2009 Dr. A. Ozols 1 ÁTOMOS EN SÓLIDOS Dr. A. Ozols 2 ORDEN CRISTALINO y FORMA René Just Hauy
APLICACIONES DE LOS NUEVOS MATERIALES A LA DOMÓTICA. Conjunto de sistemas que automatizan las diferentes instalaciones de una vivienda.
 LOS MATERIALES La ciencia de materiales estudia las propiedades físicas de los materiales, y los aplica en la ciencia y la ingeniería, para que puedan ser utilizados en obras, máquinas y herramientas.
LOS MATERIALES La ciencia de materiales estudia las propiedades físicas de los materiales, y los aplica en la ciencia y la ingeniería, para que puedan ser utilizados en obras, máquinas y herramientas.
La tabla periódica. Julius Lothar Meyer. Dimitri Ivanovich Mendeleev
 La tabla periódica Julius Lothar Meyer Dimitri Ivanovich Mendeleev Silvia Ponce López ITESM, Julio 2007 Contenidos Organización de los elementos en la tabla periódica Propiedades periódicas: radio atómico,
La tabla periódica Julius Lothar Meyer Dimitri Ivanovich Mendeleev Silvia Ponce López ITESM, Julio 2007 Contenidos Organización de los elementos en la tabla periódica Propiedades periódicas: radio atómico,
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
La fórmula química expresa la composición de moléculas y compuestos mediante símbolos químicos. 13 millones!!!
 La fórmula química expresa la composición de moléculas y compuestos mediante símbolos químicos El Nº de compuestos químicos conocidos es superior a 13 millones!!! Método sistemático de nombrar los compuestos:
La fórmula química expresa la composición de moléculas y compuestos mediante símbolos químicos El Nº de compuestos químicos conocidos es superior a 13 millones!!! Método sistemático de nombrar los compuestos:
NÚCLEO ATÓMICO Profesor: Juan T. Valverde
 6 1.- Deduce la masa atómica del litio a partir de sus isótopos Li con una abundancia del 7 7,5% y Li con una abundancia del 92,5%. http://www.youtube.com/watch?v=8vvo-xqynea&feature=youtu.be 2.- Calcula
6 1.- Deduce la masa atómica del litio a partir de sus isótopos Li con una abundancia del 7 7,5% y Li con una abundancia del 92,5%. http://www.youtube.com/watch?v=8vvo-xqynea&feature=youtu.be 2.- Calcula
4 Estructuras de los sólidos
 4 Estructuras de los sólidos 4.1 Comparación entre las propiedades de sólidos, líquidos y gases 4.2 Fuerzas entre moléculas y iones 4.3 Estructuras de los cristales 4.4 Sólidos metálicos 4.5 Sólidos iónicos
4 Estructuras de los sólidos 4.1 Comparación entre las propiedades de sólidos, líquidos y gases 4.2 Fuerzas entre moléculas y iones 4.3 Estructuras de los cristales 4.4 Sólidos metálicos 4.5 Sólidos iónicos
TEMA 3: ENLACE QUÍMICO
 I.E.S. Al-Ándalus. Dpto. de Física y Química. Curso 2004-05 FQ 1º Bach. Tema 3. Enlace Químico - 1 - TEMA 3: ENLACE QUÍMICO 3.1 Estabilidad atómica. Regla del Octete de Lewis 3.2 Enlace iónico. Propiedades
I.E.S. Al-Ándalus. Dpto. de Física y Química. Curso 2004-05 FQ 1º Bach. Tema 3. Enlace Químico - 1 - TEMA 3: ENLACE QUÍMICO 3.1 Estabilidad atómica. Regla del Octete de Lewis 3.2 Enlace iónico. Propiedades
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
CAPI TULO 1 SEMICONDUCTORES Clasificación de la materia INTRODUCCIÓN
 CAPI TULO 1 SEMICONDUCTORES INTRODUCCIÓN En este capítulo estudiaremos las características de los materiales semiconductores, su clasificación, como se forman, que los hace atractivos para la industria
CAPI TULO 1 SEMICONDUCTORES INTRODUCCIÓN En este capítulo estudiaremos las características de los materiales semiconductores, su clasificación, como se forman, que los hace atractivos para la industria
Contenido. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades periódicas:
 LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO
 ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
Capítulo 2 La estructura de los sólidos cristalinos
 Capítulo 2 La estructura de los sólidos cristalinos TEMA 2: La estructura de los sólidos cristalinos 1. Los enlaces interatómicos 2. La estructura cristalina 3. Estructuras cristalinas compactas 4. Direcciones
Capítulo 2 La estructura de los sólidos cristalinos TEMA 2: La estructura de los sólidos cristalinos 1. Los enlaces interatómicos 2. La estructura cristalina 3. Estructuras cristalinas compactas 4. Direcciones
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
LABORATORIO DE ESTADO SÓLIDO Y SEMICONDUCTORES 1.1. PRÁCTICA N o 1 REDES DE BRAVAIS Y ESTRUCTURAS CRISTALINAS
 LABORATORIO DE ESTADO SÓLIDO Y SEMICONDUCTORES 1.1 PRÁCTICA N o 1 REDES DE BRAVAIS Y ESTRUCTURAS CRISTALINAS 1. INTRODUCCIÓN 1.1 Red de Bravais y celda primitiva unidad Uno de los conceptos fundamentales
LABORATORIO DE ESTADO SÓLIDO Y SEMICONDUCTORES 1.1 PRÁCTICA N o 1 REDES DE BRAVAIS Y ESTRUCTURAS CRISTALINAS 1. INTRODUCCIÓN 1.1 Red de Bravais y celda primitiva unidad Uno de los conceptos fundamentales
ENLACE QUÍMICO. Ejemplos: BaCl 2 cloruro de bario; NH 3 amoníaco, AlCl 3 cloruro de Aluminio. Los enlaces son:
 ENLACE QUÍMICO Un cambio químico es el que transforma los elementos en compuestos. Esto es el resultado de las combinaciones de los átomos, uno da electrones, otro los recibe y se forma una nueva sustancia.
ENLACE QUÍMICO Un cambio químico es el que transforma los elementos en compuestos. Esto es el resultado de las combinaciones de los átomos, uno da electrones, otro los recibe y se forma una nueva sustancia.
Mineralogía CLASIFICACIÓN MINERAL
 Mineralogía CLASIFICACIÓN MINERAL CLASIFICACIÓN MINERAL La clasificación de los minerales más usada se basa en la composición química. CLASES FAMILIAS GRUPOS ESPECIES VARIEDADES CLASIFICACIÓN MINERAL CLASES:
Mineralogía CLASIFICACIÓN MINERAL CLASIFICACIÓN MINERAL La clasificación de los minerales más usada se basa en la composición química. CLASES FAMILIAS GRUPOS ESPECIES VARIEDADES CLASIFICACIÓN MINERAL CLASES:
En un vidrio corriente de sílice, los tetraedros están unidos por sus vértices formando una red dispersa sin orden de largo alcance (Figura 2.2.b).
 LECCION 7.- VIDRIO./. ESTRUCTURA DE ALGUNOS VIDRIOS. 1.- Introducción. La estructura de un vidrio de óxidos puede considerarse formada principalmente por voluminosos iones oxígeno dispuestos en coordinaciones
LECCION 7.- VIDRIO./. ESTRUCTURA DE ALGUNOS VIDRIOS. 1.- Introducción. La estructura de un vidrio de óxidos puede considerarse formada principalmente por voluminosos iones oxígeno dispuestos en coordinaciones
3.1. Tabla periódica. Para entender el comportamiento del plomo es necesario, conocer su ubicación en la tabla periódica
 III. FUNDAMENTOS TEORICOS DEL PLOMO 3.1. Tabla periódica. Para entender el comportamiento del plomo es necesario, conocer su ubicación en la tabla periódica 3.1.2. Componentes de la familia IVA de la tabla
III. FUNDAMENTOS TEORICOS DEL PLOMO 3.1. Tabla periódica. Para entender el comportamiento del plomo es necesario, conocer su ubicación en la tabla periódica 3.1.2. Componentes de la familia IVA de la tabla
CURSO DE AGUAS SUBTERRANEAS TEMA 13: LA CALIDAD DEL AGUA SUBTERRÁNEA
 CURSO DE AGUAS SUBTERRANEAS 2010 TEMA 13: LA CALIDAD DEL AGUA SUBTERRÁNEA Mario Valencia Cuesta Geólogo AGUAS SUBTERRÁNEAS LTDA. [email protected] INTRODUCCION A LAS AGUAS SUBTERRANEAS 2010 TEMA
CURSO DE AGUAS SUBTERRANEAS 2010 TEMA 13: LA CALIDAD DEL AGUA SUBTERRÁNEA Mario Valencia Cuesta Geólogo AGUAS SUBTERRÁNEAS LTDA. [email protected] INTRODUCCION A LAS AGUAS SUBTERRANEAS 2010 TEMA
Colegio Superior de Señoritas Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 -
 Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Respuesta Corta: Escriba en las líneas lo que se le solicita. 1. Cuál es el número atómico, de protones y de electrones de los siguientes
Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Respuesta Corta: Escriba en las líneas lo que se le solicita. 1. Cuál es el número atómico, de protones y de electrones de los siguientes
Asignatura: Química 2. Curso: 3 ro. de Media. Proyecto Nº 3. Mes: Marzo-Abril. Año: Prof.: Lic. Manuel B. Noboa G.
 Asignatura: Química 2. Curso: 3 ro. de Media. Proyecto Nº 3. Mes: Marzo-Abril. Año: 2014-2015. Prof.: Lic. Manuel B. Noboa G. Unidad Nº 3: Elementos de los Bloques P y D. Propósito Nº 1: P. C.: 20 de marzo
Asignatura: Química 2. Curso: 3 ro. de Media. Proyecto Nº 3. Mes: Marzo-Abril. Año: 2014-2015. Prof.: Lic. Manuel B. Noboa G. Unidad Nº 3: Elementos de los Bloques P y D. Propósito Nº 1: P. C.: 20 de marzo
Acuerdo 286. Química. Nomenclatura Inorgánica. Recopiló: M.C. Macaria Hernández Chávez
 Acuerdo 286 Química Nomenclatura Inorgánica Recopiló: M.C. Macaria Hernández Chávez Nomenclatura química inorgánica La Química tiene un lenguaje propio para nombrar las sustancias puras, ya sean simples
Acuerdo 286 Química Nomenclatura Inorgánica Recopiló: M.C. Macaria Hernández Chávez Nomenclatura química inorgánica La Química tiene un lenguaje propio para nombrar las sustancias puras, ya sean simples
EL SISTEMA PERIODICO HISTORIA DEL SISTEMA PERIÓDICO
 HISTORIA DEL SISTEMA PERIÓDICO Durante el siglo XIX, y a medida que avanzaba el conocimiento sobre los elementos químicos, se observó que algunos de ellos tenían propiedades semejantes. Los científicos
HISTORIA DEL SISTEMA PERIÓDICO Durante el siglo XIX, y a medida que avanzaba el conocimiento sobre los elementos químicos, se observó que algunos de ellos tenían propiedades semejantes. Los científicos
Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Cristales metálicos
 Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta, de manera
Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta, de manera
4 Elementos y compuestos
 4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
IEO-394 Semiconductores. Juan E. Martínez P. Docente. UdeA
 IEO-394 Semiconductores Juan E. Martínez P. Docente. UdeA Bandas de Energía Y Corrientes de Portadores en Semiconductores. PARTICION DE LOS NIVELES DE ENERGIA A medida que se traen juntos N átomos Cada
IEO-394 Semiconductores Juan E. Martínez P. Docente. UdeA Bandas de Energía Y Corrientes de Portadores en Semiconductores. PARTICION DE LOS NIVELES DE ENERGIA A medida que se traen juntos N átomos Cada
TABLA PERIÓDICA DE LOS ELEMENTOS. Li Be B C N O F Ne
 TABLA PERIÓDICA DE LOS ELEMENTOS La tabla periódica de los elementos fue presentada por Mendeleiev en 1869 como una manera de clasificar los elementos conocidos. Permitía establecer relaciones entre sus
TABLA PERIÓDICA DE LOS ELEMENTOS La tabla periódica de los elementos fue presentada por Mendeleiev en 1869 como una manera de clasificar los elementos conocidos. Permitía establecer relaciones entre sus
Propiedades Periódicas y Propiedades de los elementos
 Propiedades Periódicas y Propiedades de los elementos Se denominan propiedades periódicas, aquellas que tienen una tendencia de variación de acuerdo a la ubicación de los elementos en la tabla periódica.
Propiedades Periódicas y Propiedades de los elementos Se denominan propiedades periódicas, aquellas que tienen una tendencia de variación de acuerdo a la ubicación de los elementos en la tabla periódica.
Compuestos Químicos. Capítulo 3 Sec. 3.1-3.6 Rosamil Rey, PhD CHEM 2115
 Compuestos Químicos Capítulo 3 Sec. 3.1-3.6 Rosamil Rey, PhD CHEM 2115 Tipos de enlaces Enlaces covalentes comparten electrones entre átomos y forman compuestos moleculares. Estos compuestos son representados
Compuestos Químicos Capítulo 3 Sec. 3.1-3.6 Rosamil Rey, PhD CHEM 2115 Tipos de enlaces Enlaces covalentes comparten electrones entre átomos y forman compuestos moleculares. Estos compuestos son representados
Cl Electrones de valencia: Cl: 7 3 = 21 P: 5 Total 26 Tres enlaces sencillos: - 6 Electrones restantes: 20
 ESTRUCTURAS DE LEWIS PARA EL ENLACE COVALENTE.- Lewis sugirió que los átomos comparten electrones para alcanzar la configuración de gas noble y tener así una estructura más estable. Salvo en el caso de
ESTRUCTURAS DE LEWIS PARA EL ENLACE COVALENTE.- Lewis sugirió que los átomos comparten electrones para alcanzar la configuración de gas noble y tener así una estructura más estable. Salvo en el caso de
EL BINGO DE LOS ELEMENTOS. Aprenda la Tabla Periódica de los Elementos mientras juega este bingo.
 EL BINGO DE LOS ELEMENTOS Aprenda la Tabla Periódica de los Elementos mientras juega este bingo. 1 Cómo jugar este bingo Se juega como cualquier otro bingo. Imprima una o varias copias de los cartones
EL BINGO DE LOS ELEMENTOS Aprenda la Tabla Periódica de los Elementos mientras juega este bingo. 1 Cómo jugar este bingo Se juega como cualquier otro bingo. Imprima una o varias copias de los cartones
INSTITUTO POLITECNICO NACIONAL
 INSTITUTO POLITECNICO NACIONAL CECYT NO. 1 GONZALO VÁZQUEZ VELA GUÍA DE QUÍMICA I PERIÓDO ESCOLAR 2015-2016 ACADEMIA DE QUÍMICA TURNO VESPERTINO 1 Materia y Energía 1.- Calcula la energía, en Joules y
INSTITUTO POLITECNICO NACIONAL CECYT NO. 1 GONZALO VÁZQUEZ VELA GUÍA DE QUÍMICA I PERIÓDO ESCOLAR 2015-2016 ACADEMIA DE QUÍMICA TURNO VESPERTINO 1 Materia y Energía 1.- Calcula la energía, en Joules y
PSU QUIMICA 2010 RAOV - CYQ
 1 PSU QUIMICA 2010 RAOV - CYQ 2 NUMERO ATOMICO Y NUMERO MASICO 1.- Si los átomos A, B y C presentan la siguiente cantidad de partículas subatómicas: A.- 12 protones, 14 neutrones, 12 electrones B.- 12
1 PSU QUIMICA 2010 RAOV - CYQ 2 NUMERO ATOMICO Y NUMERO MASICO 1.- Si los átomos A, B y C presentan la siguiente cantidad de partículas subatómicas: A.- 12 protones, 14 neutrones, 12 electrones B.- 12
Capítulo 2: Los Minerales. Geología Física
 Capítulo 2: Los Minerales Geología Física La materia y su composición TODO lo que tenga masa y ocupe espacio es materia La materia se presenta en uno de tres estados o fases, todos ellos importantes para
Capítulo 2: Los Minerales Geología Física La materia y su composición TODO lo que tenga masa y ocupe espacio es materia La materia se presenta en uno de tres estados o fases, todos ellos importantes para
FIZ Física Contemporánea
 FIZ1111 - Física Contemporánea Interrogación N o 3 17 de Junio de 2008, 18 a 20 hs Nombre completo: hrulefill Sección: centering Buenas Malas Blancas Nota Table 1. Instrucciones - Marque con X el casillero
FIZ1111 - Física Contemporánea Interrogación N o 3 17 de Junio de 2008, 18 a 20 hs Nombre completo: hrulefill Sección: centering Buenas Malas Blancas Nota Table 1. Instrucciones - Marque con X el casillero
PROPIEDADES QUÍMICAS DEL SUELO
 PROPIEDADES QUÍMICAS DEL SUELO DEFINICIONES Ión: Átomos o moléculas que pierden o ganan electrones por lo cual adquieren una determinada carga; si ganan adquieren carga negativa: aniones (Cl -, NO 3- );
PROPIEDADES QUÍMICAS DEL SUELO DEFINICIONES Ión: Átomos o moléculas que pierden o ganan electrones por lo cual adquieren una determinada carga; si ganan adquieren carga negativa: aniones (Cl -, NO 3- );
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN ÍNDICE
 CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN
 GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN 1. REVISIÓN DE TABLA PERIÓDICA 1.1 Completa el siguiente cuadro. Configuración electrónica externa Bloque
GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN 1. REVISIÓN DE TABLA PERIÓDICA 1.1 Completa el siguiente cuadro. Configuración electrónica externa Bloque
Capacidad de combinación. Capacidad de combinación La última capa de electrones de un átomo, se le conoce como capa de electrones de valencia
 Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
MOLÉCULAS Y FUERZAS INTERMOLECULARES
 4 MLÉULAS Y UERZAS TERMLEULARES SLUES A LAS ATVDADES DE AL DE UDAD Método RPEV e hibridación 1 Las nubes electrónicas que se dibujan en torno al átomo central en el método RPEV, son una representación
4 MLÉULAS Y UERZAS TERMLEULARES SLUES A LAS ATVDADES DE AL DE UDAD Método RPEV e hibridación 1 Las nubes electrónicas que se dibujan en torno al átomo central en el método RPEV, son una representación
EL ENLACE QUÍMICO ENLACE IÓNICO
 EL ENLACE QUÍMIC IES La Magdalena. Avilés. Asturias Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden
EL ENLACE QUÍMIC IES La Magdalena. Avilés. Asturias Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden
