Polaridad de una molécula
|
|
|
- María del Pilar Ruiz Lucero
- hace 6 años
- Vistas:
Transcripción
1 Polaridad de una molécula Una molécula se considera polar si existe un momento dipolar neto debido a sus enlaces Depende de su geometría Una molécula formada por enlaces polares no necesariamente debe ser polar Si una molécula es polar se la puede representar mediante un dipolo
2 Polaridad de una molécula
3 Fuerzas intermoleculares
4 Fuerza ión-ión Son las que se establecen entre iones de igual o distinta carga: Los iones con cargas de signo opuesto se atraen Los iones con cargas del mismo signo se repelen La magnitud de la fuerza electrostática viene definida por la ley de Coulomb y es directamente proporcional a la magnitud de las cargas e inversamente proporcional al cuadrado de la distancia que las separa. También llamada de puente salino. Frecuentes entre una enzima y su sustrato, entre los aminoácidos de una proteína.
5
6 Fuerzas Ión-dipolo Son las que se establecen entre un ión y una molécula polar. Presenta en la solvatación cuando el NaCl se disuelve en agua por la atracción que existe entre los iones Na+ y Cl- y los correspondientes polos con carga opuesta de la molécula de agua. Esta solvatación de los iones es capaz de vencer las fuerzas que los mantienen juntos en el estado sólido. La capa de agua de hidratación que se forma en torno a ciertas proteínas y que resulta tan importante para su función.
7
8 Fuerza Ión Dipolo Inducido Tienen lugar entre un ión y una molécula apolar. La proximidad del ión provoca una distorsión en la nube electrónica de la molécula apolar que se convierte (de modo transitorio) en una molécula polarizada. En este momento se produce una atracción entre el ión y la molécula polarizada. Presenta en la interacción entre el ión Fe++ de la hemoglobina y la molécula de O 2, que es apolar. Esta interacción es la que permite la unión reversible del O 2 a la hemoglobina y el transporte de O 2 desde los pulmones hacia los tejidos
9
10 INTERACCIONES HIDROFÓBICAS En un medio acuoso, las moléculas hidrofóbicas tienden a asociarse para evitar interaccionar con el agua. Lo hace por razones termodinámicas: las moléculas hidrofóbicas se asocian para minimizar el número de moléculas de agua que puedan estar en contacto con las moléculas hidrofóbicas Este fenómeno se denomina efecto hidrofóbico y es el responsable de que determinados lípidos formen agregados supramoleculares. Se establecen entre los fosfolípidos que forman las membranas celulares (forman bicapas)
11
12 Fuerzas de van der Waals Son fuerzas de atracción débiles que se establecen entre moléculas que presentan enlaces covalentes, son muy numerosas y desempeñan un papel fundamental en varios procesos biológicos. Las fuerzas de van der Waals incluyen: Fuerzas dipolo-dipolo (también llamadas fuerzas de Keesom), entre las que se incluyen los puentes de hidrógeno Fuerzas dipolo-dipolo inducido (también llamadas fuerzas de Debye) Fuerzas dipolo instantáneo-dipolo inducido (también llamadas fuerzas de dispersión o fuerzas de London)
13 Fuerza Dipolo Dipolo Una molécula es un dipolo cuando existe una distribución asimétrica de los electrones debido a que la molécula está formada por átomos de distinta electronegatividad. Como consecuencia de ello, los electrones se encuentran preferentemente en las proximidades del átomo más electronegativo. Se crean así dos regiones (o polos) en la molécula, una con carga parcial negativa y otra con carga parcial positiva. Cuando dos moléculas polares (dipolos) se aproximan, se produce una atracción entre el polo positivo de una de ellas y el negativo de la otra. Esta fuerza de atracción entre dos dipolos es tanto más intensa cuanto mayor es la polarización de dichas moléculas polares o, dicho de otra forma, cuanto mayor sea la diferencia de electronegatividad entre los átomos enlazados
14 Puente de Hidrogeno El enlace puente de hidrógeno es muy polar y el átomo de hidrógeno es el centro de cargas positivas que será atraído hacia los pares de electrones no compartidos de los átomos mas electronegativos de otras moléculas. Es un caso especial de interacción dipolo-dipolo Se producen cuando un átomo de hidrógeno está unido covalentemente a un elemento que sea: muy electronegativo y con pares de e- sin compartir Tamaño muy pequeño y capaz, de aproximarse al núcleo del hidrógeno Estas condiciones se cumplen en el caso de los átomos de F, O y N. Fundamental en bioquímica, ya que: condiciona la estructura espacial de las proteínas y de los ácidos nucleicos presente en distintos tipos de biomoléculas de procesos
15
16 FUERZAS DIPOLO-DIPOLO INDUCIDO Tienen lugar entre una molécula polar y una molécula apolar. La carga de una molécula polar provoca una distorsión en la nube electrónica de la molécula apolar y la convierte, de modo transitorio, en un dipolo. En este momento se establece una fuerza de atracción entre las moléculas.
17 FUERZAS DIPOLO INSTANTÁNEO- DIPOLO INDUCIDO Las fuerzas de dispersión son fuerzas atractivas débiles que se establecen fundamentalmente entre moléculas no polares, aunque también están presentes en las moléculas polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. La formación de un dipolo instantáneo en una molécula origina la formación de un dipolo inducido en una molécula vecina originándose una fuerza débil de atracción entre las dos.
18
19 Enlace disulfuro Enlace covalente que se produce cuando dos grupos sulfhidrilo (SH) reaccionan para formar un puente disulfuro o puente SS (enlace entre átomos de azufre). La energía de este enlace es de 60 kcal por mol. Es considerado un enlace fuerte, aunque no lo es tanto como un enlace carbono-carbono o carbono-hidrógeno, por lo tanto es un grupo bastante reactivo. La longitud del puente disulfuro es de 2.05 Å. El enlace disulfuro se forma por oxidación de los grupos SH, es decir, en presencia de oxígeno, se liberan los hidrógenos de los grupos SH y los átomos de azufre quedan enlazados. Estos enlaces son muy importantes en la definición de la estructura proteica terciaria.
20
21
MOLÉCULAS POLAReS Y NO POLAReS
 MOLÉCULAS POLAReS Y NO POLAReS Una molécula polar presenta distribución asimétrica de las cargas eléctricas debido a la diferencia de electronegatividad de los átomos que la forman. Presenta dos zonas
MOLÉCULAS POLAReS Y NO POLAReS Una molécula polar presenta distribución asimétrica de las cargas eléctricas debido a la diferencia de electronegatividad de los átomos que la forman. Presenta dos zonas
Longitud y energía de enlace
 Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
n = = 1; 1234; 4; l l= = 0; 1; m m = = 0; 0 ; + 0; s 12; 2; = s s s = ½ ½
 ENLACE QUÍMICO 2012 6p 5d Energía 6s 4 f 5p 4d 5s 4s 4p 3d 3p 3s 2s 1s 2p nn == 4; 1; 2; 3; 0; 2; + 0; 2; ss = s= += +½ 1; ll == 1; 2; 3; 4; 0; m 2; 1; m == + 1; 0; 2; 1; s= +½ +½ ½ Enlaces según
ENLACE QUÍMICO 2012 6p 5d Energía 6s 4 f 5p 4d 5s 4s 4p 3d 3p 3s 2s 1s 2p nn == 4; 1; 2; 3; 0; 2; + 0; 2; ss = s= += +½ 1; ll == 1; 2; 3; 4; 0; m 2; 1; m == + 1; 0; 2; 1; s= +½ +½ ½ Enlaces según
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES
 ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias
 Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos?
 qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos? Academia de Química, ITESM, campus Qro. 1 FUERZAS INTERMOLECULARES Academia de Química, ITESM, campus Qro. 2 FUERZAS INTERMOLECULARES
qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos? Academia de Química, ITESM, campus Qro. 1 FUERZAS INTERMOLECULARES Academia de Química, ITESM, campus Qro. 2 FUERZAS INTERMOLECULARES
Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares
 Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares Enlace químico Cómo se unen los átomos? Cualquier teoría que de contestación a esta pregunta ha de explicar: Los diferentes tipos de enlace
Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares Enlace químico Cómo se unen los átomos? Cualquier teoría que de contestación a esta pregunta ha de explicar: Los diferentes tipos de enlace
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Interacciones químicas de no enlace. Fuerzas de van der Waals
 Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
TEMA 3 ENLACE QUÍMICO (PARTE 2)
 TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
Unidad 2 Enlace Químico
 Unidad 2 Enlace Químico OPCIÓN A 1. Defina: Resonancia: Concepto propuesto por Pauling para explicar las situaciones en las que ninguna de las posibles estructuras de Lewis de una molécula explica la estructura
Unidad 2 Enlace Químico OPCIÓN A 1. Defina: Resonancia: Concepto propuesto por Pauling para explicar las situaciones en las que ninguna de las posibles estructuras de Lewis de una molécula explica la estructura
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Actividad introductoria: Aplicación en la industria de las fuerzas intermoleculares.
 Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO. Fundamentos y Didáctica de la Física y la Química
 Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO Fundamentos y Didáctica de la Física y la Química Según la regla del octeto, una de las estructuras más estables de los elementos es tener ocho
Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO Fundamentos y Didáctica de la Física y la Química Según la regla del octeto, una de las estructuras más estables de los elementos es tener ocho
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables.
 TEMA 3. ENLACE QUÍMICO Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables. Para explicar el enlace químico,
TEMA 3. ENLACE QUÍMICO Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables. Para explicar el enlace químico,
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace.
 EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
elementos reaccionan compuestos
 Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Tema 3. CUESTIONES SOBRE ENLACE QUÍMICO
 Tema 3. CUESTIONES SOBRE ENLACE QUÍMICO Cuestión 1 Considere las siguientes propiedades de las las moléculas N 2, O 2 y F 2 : Energía de enlace (kj mol 1 ) Temperatura de ebullición (K) N 2 O 2 F 2 Energía
Tema 3. CUESTIONES SOBRE ENLACE QUÍMICO Cuestión 1 Considere las siguientes propiedades de las las moléculas N 2, O 2 y F 2 : Energía de enlace (kj mol 1 ) Temperatura de ebullición (K) N 2 O 2 F 2 Energía
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Tema 4. Fuerzas intermoleculares
 Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
TEMA 5. FUERZAS INTERMOLECULARES
 TEMA 5. FUERZAS ITERMLECULARES Interacciones de Van der Waals. Enlace de hidrógeno. Fuerzas intermoleculares y propiedades físicas. Aplicaciones a sistemas biológicos. De acuerdo con los modelos de enlace
TEMA 5. FUERZAS ITERMLECULARES Interacciones de Van der Waals. Enlace de hidrógeno. Fuerzas intermoleculares y propiedades físicas. Aplicaciones a sistemas biológicos. De acuerdo con los modelos de enlace
Enlaces Primarios o fuertes Secundarios o débiles
 Capítulo III MET 2217 Tipos de enlaces atómicos y moleculares Enlaces Primarios o fuertes Secundarios o débiles Enlaces primarios Iónico Actúan fuerzas intermoleculares relativamente grandes, electrostáticas.
Capítulo III MET 2217 Tipos de enlaces atómicos y moleculares Enlaces Primarios o fuertes Secundarios o débiles Enlaces primarios Iónico Actúan fuerzas intermoleculares relativamente grandes, electrostáticas.
TEMA 2. EL ENLACE QUÍMICO. NOCIONES SOBRE EL ENLACE CONVALENTE Y LAS MOLÉCULAS COVALENTES QUÍMICA 2º BACHILLERATO.
 El enlace covalente se produce cuando se unen átomos no metálicos entre sí o con el hidrógeno, átomos con electronegatividades semejantes y altas en general. Se forma básicamente por compartición de electrones
El enlace covalente se produce cuando se unen átomos no metálicos entre sí o con el hidrógeno, átomos con electronegatividades semejantes y altas en general. Se forma básicamente por compartición de electrones
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Enlaces Químicos y Estados de la Materia
 Enlaces Químicos y Estados de la Materia 1.- Concepto de enlace químico Mientras que sólo hay alrededor de 118 elementos catalogados en la tabla periódica, obviamente hay más substancias en la naturaleza
Enlaces Químicos y Estados de la Materia 1.- Concepto de enlace químico Mientras que sólo hay alrededor de 118 elementos catalogados en la tabla periódica, obviamente hay más substancias en la naturaleza
M +n X -n EL ENLACE QUIMICO. Clase 05
 EL ENLACE QUIMICO Clase 05 Cuando dos átomos se aproximan entre sí, se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tienden a unir los átomos, otras tienden a separarlos. En la mayoría
EL ENLACE QUIMICO Clase 05 Cuando dos átomos se aproximan entre sí, se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tienden a unir los átomos, otras tienden a separarlos. En la mayoría
Estructura y función de biomoléculas. Termodinámica en Bioquímica. Interacciones no-covalentes entre moléculas.
 Estructura y función de biomoléculas. Termodinámica en Bioquímica. Interacciones no-covalentes entre moléculas. Temario Bases químicas y termodinámicas de la vida. Las interacciones que determinan la estructura
Estructura y función de biomoléculas. Termodinámica en Bioquímica. Interacciones no-covalentes entre moléculas. Temario Bases químicas y termodinámicas de la vida. Las interacciones que determinan la estructura
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA. Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas
 BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
BLOQUE I: LA BASE MOLECULAR Y FÍSICO-QUÍMICA DE LA VIDA Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas Tema 2.- Componentes químicos de la célula: biomoléculas inorgánicas A.- Los
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
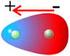 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
ENLACE QUÍMICO. La fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman una sustancia
 ENLACE QUÍMICO La fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman una sustancia Concepto importante para la química: Diversidad de sustancias Características y propiedades
ENLACE QUÍMICO La fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman una sustancia Concepto importante para la química: Diversidad de sustancias Características y propiedades
GUÍA DE APOYO PARA EXAMEN DE QUÍMICA 1 MEDIO ALUMNAS NO INSCRITAS. ITEM I.- VERDADERO O FALSO: Marque con V o F en cada oración. Fundamente las falsas
 GUÍA DE APOYO PARA EXAMEN DE QUÍMICA 1 MEDIO ALUMNAS NO INSCRITAS Recuerden que el día del examen deben traer su TABLA PERIÓDICA. ITEM I.- VERDADERO O FALSO: Marque con V o F en cada oración. Fundamente
GUÍA DE APOYO PARA EXAMEN DE QUÍMICA 1 MEDIO ALUMNAS NO INSCRITAS Recuerden que el día del examen deben traer su TABLA PERIÓDICA. ITEM I.- VERDADERO O FALSO: Marque con V o F en cada oración. Fundamente
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
Liceo nº3 Nocturno Química 4º año Repartido nº4 Enlace químico
 Repartido nº4 Enlace químico Formulas de Lewis o Diagramas de Lewis: Para representar la formación del enlace químico utilizamos representaciones gráficas que se denominan diagramas de puntos (o diagramas
Repartido nº4 Enlace químico Formulas de Lewis o Diagramas de Lewis: Para representar la formación del enlace químico utilizamos representaciones gráficas que se denominan diagramas de puntos (o diagramas
Regla del octeto Gilbert Newton Lewis
 Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
CLASE Nº 4 ENLACE QUÍMICO
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Parámetros de enlace. Jesús Gracia Mora
 Parámetros de enlace Jesús Gracia Mora La presentación, material adicional, ejercicios y bibliografía se encuentran a su disposición en: http://depa.pquim.unam.mx/qi/ Que es un enlace químico? Diferentes
Parámetros de enlace Jesús Gracia Mora La presentación, material adicional, ejercicios y bibliografía se encuentran a su disposición en: http://depa.pquim.unam.mx/qi/ Que es un enlace químico? Diferentes
ENLACE QUÍMICO Y FUERZAS INTERMOLECULARES. Elaboró M. en C. Miguel Angel Jaime Vasconcelos (2016)
 ENLACE QUÍMICO Y FUERZAS INTERMOLECULARES Enlace químico El enlace químico se puede entender de manera simple como la unión entre dos o más átomos, esta unión se asocia a su vez con una energía en la que
ENLACE QUÍMICO Y FUERZAS INTERMOLECULARES Enlace químico El enlace químico se puede entender de manera simple como la unión entre dos o más átomos, esta unión se asocia a su vez con una energía en la que
UNIDAD 16. PROPIEDADES FÍSICAS DE COMPUESTOS ORGÁNICOS )Qué fuerzas mantienen unidas las moléculas?
 ASPECTOS FISICOQUÍMICOS DE SUSTANCIAS PURAS Y MEZCLAS UNIDAD 16. PROPIEDADES FÍSICAS DE COMPUESTOS ORGÁNICOS )Qué fuerzas mantienen unidas las moléculas? Desempeño Esperado: El estudiante identifica los
ASPECTOS FISICOQUÍMICOS DE SUSTANCIAS PURAS Y MEZCLAS UNIDAD 16. PROPIEDADES FÍSICAS DE COMPUESTOS ORGÁNICOS )Qué fuerzas mantienen unidas las moléculas? Desempeño Esperado: El estudiante identifica los
3. DESARROLLO 3.1 ENLACE IONICO
 3. DESARROLLO Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. 3.1 ENLACE IONICO El enlace iónico
3. DESARROLLO Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. 3.1 ENLACE IONICO El enlace iónico
1. EL ENLACE QUÍMICO. Una estructura de Lewis esta conformada por el símbolo del elemento y un punto por cada electrón de valencia que posea. ...
 1. EL ENLACE QUÍMIC La mayoría de la materia esta conformada por moléculas o iones formados por los átomos. Una molécula es un agregado de, por lo menos, dos átomos y que mantienen unidos por medio de
1. EL ENLACE QUÍMIC La mayoría de la materia esta conformada por moléculas o iones formados por los átomos. Una molécula es un agregado de, por lo menos, dos átomos y que mantienen unidos por medio de
BIOQUÍMICA TEMA 1. EL AGUA
 BIOQUÍMICA TEMA 1. EL AGUA D. Ph. Daniel Díaz Plascencia. Contacto: dplascencia@uach.mx www.lebas.com.mx CONCEPTO DE BIOQUÍMICA La bioquímica es una ciencia que estudia la composición química de los seres
BIOQUÍMICA TEMA 1. EL AGUA D. Ph. Daniel Díaz Plascencia. Contacto: dplascencia@uach.mx www.lebas.com.mx CONCEPTO DE BIOQUÍMICA La bioquímica es una ciencia que estudia la composición química de los seres
ENLACE COVALENTE. Z = 1 Hidrógeno H: 1s 1 Z = 6 Carbono C: 1s 2 2s 2 2p 2 Z = 7 Nitrógeno N: 1s 2 2s 2 2p 3 Z = 8 Oxígeno O: 1s 2 2s 2 2p 4 H H H 2
 ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
ENLACE QUIMICO. Q.F. Luis José Torres Santillán
 ENLACE QUIMICO Q.F. Luis José Torres Santillán Enlace Químico Se define como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial
ENLACE QUIMICO Q.F. Luis José Torres Santillán Enlace Químico Se define como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA QUÍMICA TEMA 3: ENLACES QUÍMICOS.
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA : ENLACES QUÍMICOS http://emestrada.wordpress.com a) Escriba la estructura de Lewis para las moléculas N y 4 C. b) Dibuje la geometría de cada
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA : ENLACES QUÍMICOS http://emestrada.wordpress.com a) Escriba la estructura de Lewis para las moléculas N y 4 C. b) Dibuje la geometría de cada
Enlace químico. 5. Dadas las siguientes sustancias: CS 2 (lineal), HCN (lineal), NH 3 (piramidal) y H 2 O (angular):
 Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
SOLUCIONES EJERCICIOS DE ENLACE QUÍMICO. 1º BCT
 SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza.
 Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza. Tipos de sustancias Sustancias metálicas: tienen puntos de fusión variables,
Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza. Tipos de sustancias Sustancias metálicas: tienen puntos de fusión variables,
TEMA 5: construyen todas las sustancias: agua, madera, metales...varias son las preguntas que surgen:
 TEMA 5: ENLACE QUÍMICO Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias: agua, madera, metales...varias son las preguntas
TEMA 5: ENLACE QUÍMICO Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias: agua, madera, metales...varias son las preguntas
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES Niveles de energía Modelo atómico actual Orbitales Configuración electrónica Tabla periódica Cada electrón puede encontrarse con más probabilidad en
FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES Niveles de energía Modelo atómico actual Orbitales Configuración electrónica Tabla periódica Cada electrón puede encontrarse con más probabilidad en
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
Entre moléculas. Enlace por Puente de Hidrógeno. Fuerzas de Van der Waals
 enlace Tipos de enlaces Iónico: Se produce entre elementos con electronegatividades muy diferentes: metal con nometal. Se unen iones entre sí. Metálico Metales entre sí. Covalente No metales entre sí.
enlace Tipos de enlaces Iónico: Se produce entre elementos con electronegatividades muy diferentes: metal con nometal. Se unen iones entre sí. Metálico Metales entre sí. Covalente No metales entre sí.
Tema 7 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD
 Tema 7 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD 1 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD 1. Concepto y naturaleza química de la biofase 2. Lípidos: acciones inespecíficas 3. Proteínas: enzimas
Tema 7 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD 1 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD 1. Concepto y naturaleza química de la biofase 2. Lípidos: acciones inespecíficas 3. Proteínas: enzimas
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato
 Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Química Orgánica General
 Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
2/15/2013. Estructura ENLACE QUIMICO Y MOLÉCULAS. Tipos de enlace Enlace iónico Enlace metálico Enlace covalente CH 4 CH 3 OH.
 ENLACE QUIMICO Y MOLÉCULAS Tipos de enlace Enlace iónico Enlace metálico Enlace covalente Símbolos de Lewis y regla dl del octeto Compuestos químicos: Representaciones Metano CH 4 Etanol CH 3 OH Ácido
ENLACE QUIMICO Y MOLÉCULAS Tipos de enlace Enlace iónico Enlace metálico Enlace covalente Símbolos de Lewis y regla dl del octeto Compuestos químicos: Representaciones Metano CH 4 Etanol CH 3 OH Ácido
TEMA 6: Enlace químico en sistemas moleculares
 TEMA 6: Enlace químico en sistemas moleculares Índice 1) Introducción 2) Enlaces en molécula a.i. a.ii. a.iii. a.iv. Teoría de orbitales moleculares Teoría del enlace de valencia Resonancia Polaridad 3)
TEMA 6: Enlace químico en sistemas moleculares Índice 1) Introducción 2) Enlaces en molécula a.i. a.ii. a.iii. a.iv. Teoría de orbitales moleculares Teoría del enlace de valencia Resonancia Polaridad 3)
GEOMETRÍA MOLECULAR. TEORÍA DE LA REPULSIÓN DE LOS PARES ELECTRÓNICOS DE LA CAPA DE VALENCIA (RPECV).
 ENLAE QUÍMI. ENLAE VALENTE GEMETRÍA MLEULAR. TERÍA DE LA REULSIÓN DE LS ARES ELETRÓNIS DE LA AA DE VALENIA (REV). La teoría de la REV nos ayuda a ver la geometría de las moléculas y esta a su vez a entender
ENLAE QUÍMI. ENLAE VALENTE GEMETRÍA MLEULAR. TERÍA DE LA REULSIÓN DE LS ARES ELETRÓNIS DE LA AA DE VALENIA (REV). La teoría de la REV nos ayuda a ver la geometría de las moléculas y esta a su vez a entender
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
Fuerzas de Van der Waals. Momento Dipolar
 Momento Dipolar Muchas moléculas eléctricamente neutras, esto es, sin carga neta, poseen una distribución de cargas no homogénea. Esto se debe a que los átomos que las forman tienen diferente electronegatividad,
Momento Dipolar Muchas moléculas eléctricamente neutras, esto es, sin carga neta, poseen una distribución de cargas no homogénea. Esto se debe a que los átomos que las forman tienen diferente electronegatividad,
TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS
 TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS E2A.S2010 Para la molécula CH 3 Cl: a) Establezca su geometría mediante la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. b) Razone
TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS E2A.S2010 Para la molécula CH 3 Cl: a) Establezca su geometría mediante la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. b) Razone
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
07/02/2015 EL ENLACE QUÍMICO. Tema 5
 EL ENLACE QUÍMICO Tema 5 Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
EL ENLACE QUÍMICO Tema 5 Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
jueves, 18 de septiembre de 14
 BIOELEMENTOS Y BIOMOLÉCULAS BIOELEMENTO Elemento químico que constituye las moléculas de los seres vivos. Se dividen en : PRIMARIOS: C,H,O,N,P y S. Son los más abundantes (96,2%) SECUNDARIOS: Na+, K+,
BIOELEMENTOS Y BIOMOLÉCULAS BIOELEMENTO Elemento químico que constituye las moléculas de los seres vivos. Se dividen en : PRIMARIOS: C,H,O,N,P y S. Son los más abundantes (96,2%) SECUNDARIOS: Na+, K+,
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
QUÍMICA. Tema 3. Enlace Químico
 Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
BIOQUIMICA Y FISIOLOGÍA MICROBIANA. Dra. Yenizey Merit Alvarez Cisneros
 BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
SOLUCIONARIO GUÍAS ESTÁNDAR ANUAL. Biomoléculas orgánicas: proteínas y ácidos nucleicos SGUICES003CB31-A16V1
 SOLUCIONARIO GUÍAS ESTÁNDAR ANUAL Biomoléculas orgánicas: proteínas y ácidos nucleicos SGUICES003CB31-A16V1 SOLUCIONARIO GUÍA Biomoléculas orgánicas: proteínas y ácidos nucleicos Ítem Alternativa Habilidad
SOLUCIONARIO GUÍAS ESTÁNDAR ANUAL Biomoléculas orgánicas: proteínas y ácidos nucleicos SGUICES003CB31-A16V1 SOLUCIONARIO GUÍA Biomoléculas orgánicas: proteínas y ácidos nucleicos Ítem Alternativa Habilidad
Química 2º de Bachillerato
 Química 2º de Bachillerato Tema 3 Enlace químico Contenidos Tipos de sustancias y de enlace Enlace iónico Enlace metálico Enlace covalente Estructuras de Lewis Geometría molecular: RPECV Enlace de valencia:
Química 2º de Bachillerato Tema 3 Enlace químico Contenidos Tipos de sustancias y de enlace Enlace iónico Enlace metálico Enlace covalente Estructuras de Lewis Geometría molecular: RPECV Enlace de valencia:
Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales.
 ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
BIOELEMENTOS AGUA Y SALES MINERALES
 BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
Tema 2. Estructura atómica y enlace químico
 Tema 2. Estructura atómica y enlace químico 1. El enlace químico 1.1. Energía de enlace 1.2. Longitud de enlace 1.3. Ángulos de enlace, momento dipolar de una molécula 1.4. Electronegatividad 1.5. Curva
Tema 2. Estructura atómica y enlace químico 1. El enlace químico 1.1. Energía de enlace 1.2. Longitud de enlace 1.3. Ángulos de enlace, momento dipolar de una molécula 1.4. Electronegatividad 1.5. Curva
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
Base molecular de la vida. TEMA 6 LIBRO (Pág. 131)
 Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos Bioelementos
Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos Bioelementos
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
ENLACE QUÍMICO II. 5.- De los compuestos iónicos KBr y NaBr, cuál será el más duro y cuál el de mayor temperatura de fusión?. Por qué?.
 ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA El enlace químico Nº Ejercicios PSU 1. Con respecto a la razón por la que se enlazan los átomos, cuál de las siguientes alternativas es correcta? A) Los átomos se enlazan
Programa Técnico Profesional QUÍMICA El enlace químico Nº Ejercicios PSU 1. Con respecto a la razón por la que se enlazan los átomos, cuál de las siguientes alternativas es correcta? A) Los átomos se enlazan
Tema 1: Estructura atómica y enlace químico.
 Tema 1: Estructura atómica y enlace químico. 1.1 Introducción a la química Orgánica 1.2 Enlace y estructura de la Materia 1.3 Teoría de Enlace de Valencia e hibridación 1.4 Teoría de Orbitales Moleculares
Tema 1: Estructura atómica y enlace químico. 1.1 Introducción a la química Orgánica 1.2 Enlace y estructura de la Materia 1.3 Teoría de Enlace de Valencia e hibridación 1.4 Teoría de Orbitales Moleculares
ENLACE QUÍMICO. Elemento F O Cl N C S H Electronegatividad 4,0 3,5 3,0 3,0 2,5 2,5 2,1
 ENLACE QUÍMICO 1 - a) Diseñe un ciclo de Born-Haber para el MgCl 2. b) Defina el menos cuatro de los siguientes conceptos: - Energía de ionización. - Energía de disociación. - Afinidad electrónica. - Energía
ENLACE QUÍMICO 1 - a) Diseñe un ciclo de Born-Haber para el MgCl 2. b) Defina el menos cuatro de los siguientes conceptos: - Energía de ionización. - Energía de disociación. - Afinidad electrónica. - Energía
LA FORMA DE LAS MOLÉCULAS
 LA FORMA DE LAS MOLÉCULAS Dr. Hugo Cerecetto Prof. Titular de Química Temario 7. Las formas de las moléculas: Estructura de Lewis Distancias de enlace Ángulos de enlace Geometría molecular Bibliografía
LA FORMA DE LAS MOLÉCULAS Dr. Hugo Cerecetto Prof. Titular de Química Temario 7. Las formas de las moléculas: Estructura de Lewis Distancias de enlace Ángulos de enlace Geometría molecular Bibliografía
Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres).
 Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
Enlace Químico. Química General I 2012
 Enlace Químico Química General I 2012 Los electrones de valencia son los electrones del último orbital en un átomo, son los causantes de los enlaces químicos. Grupo e - configuración # de valencia 1A ns
Enlace Químico Química General I 2012 Los electrones de valencia son los electrones del último orbital en un átomo, son los causantes de los enlaces químicos. Grupo e - configuración # de valencia 1A ns
EJERCICIOS DE ENLACE. a) Amoniaco. b) Tricloruro de boro. c) Metano.
 EJERCICIOS DE ENLACE 1. Deduzca, según la teoría de Repulsión de Pares de Electrones de la Capa de Valencia, la geometría de las siguientes moléculas e indique la polaridad de las mismas: a) Amoniaco.
EJERCICIOS DE ENLACE 1. Deduzca, según la teoría de Repulsión de Pares de Electrones de la Capa de Valencia, la geometría de las siguientes moléculas e indique la polaridad de las mismas: a) Amoniaco.
ENLACES QUIMICOS FUNDAMENTACIÓN TEÓRICA Y EJERCICIOS
 ENLACES QUIMICOS FUNDAMENTACIÓN TEÓRICA Y EJERCICIOS Cuando dos o mas átomos se aproximan entre si, se ejercen varias fuerzas entre ellos. Algunas de esas fuerzas unen los átomos; otras tienden a separarlos.
ENLACES QUIMICOS FUNDAMENTACIÓN TEÓRICA Y EJERCICIOS Cuando dos o mas átomos se aproximan entre si, se ejercen varias fuerzas entre ellos. Algunas de esas fuerzas unen los átomos; otras tienden a separarlos.
EJERCICIOS RESUELTOS DE ENLACE QUIMICO
 EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
Capítulo 2: Enlace químico
 Capítulo 2: Enlace químico ACTIVIDADES DE RECAPITULACIÓN 1. Cuál será la electrovalencia de los siguientes elementos: Al, K, Br, Ne? Teniendo en cuenta la configuración electrónica del nivel de valencia,
Capítulo 2: Enlace químico ACTIVIDADES DE RECAPITULACIÓN 1. Cuál será la electrovalencia de los siguientes elementos: Al, K, Br, Ne? Teniendo en cuenta la configuración electrónica del nivel de valencia,
Masa atómica. La masa de un átomo en unidades de masa atómica (uma) es el número total de protones y neutrones en el átomo.
 Masa atómica La masa de un átomo en unidades de masa atómica (uma) es el número total de protones y neutrones en el átomo. Isotopos Los isótopos son átomos del mismo elemento con diferentes masas. Los
Masa atómica La masa de un átomo en unidades de masa atómica (uma) es el número total de protones y neutrones en el átomo. Isotopos Los isótopos son átomos del mismo elemento con diferentes masas. Los
