MINISTERIO DE SANIDAD Y CONSUMO
|
|
|
- Soledad Ramos Sandoval
- hace 6 años
- Vistas:
Transcripción
1 7010 Sábado 17 febrero 2007 BOE núm. 42 MINISTERIO DE SANIDAD Y CONSUMO 3383 ORDEN SCO/322/2007, de 9 de febrero, por la que se establecen los requisitos de trazabilidad y de notificación de reacciones y efectos adversos graves de la sangre y de los componentes sanguíneos. La Directiva 2002/98/CE del Parlamento Europeo y del Consejo, de 27 de enero de 2003, al objeto de garantizar un elevado nivel de protección de la salud humana estableció las normas de calidad y seguridad para la extracción y verificación de la sangre humana y sus componentes sea cual sea su destino, y para su tratamiento, almacenamiento y distribución cuando el destino es la. Así mismo, a fin de prevenir la transmisión de enfermedades por la sangre y sus componentes, así como para garantizar un nivel equivalente de seguridad y calidad, esta directiva exigió el establecimiento de requisitos relativos a la trazabilidad, un procedimiento comunitario de notificación de reacciones y efectos adversos graves, así como un formato de notificación de las reacciones y efectos adversos graves común para todos los Estados miembros. Todas estas previsiones se han recogido en la Directiva 2005/61/CE de la Comisión, de 30 de septiembre de 2005, por la que se aplica la Directiva 2002/98/CE del Parlamento Europeo y del Consejo en lo relativo a los requisitos de trazabilidad y a la notificación de reacciones y efectos adversos graves. El Real Decreto 1088/2005, de 16 de septiembre, por el que se establecen los requisitos técnicos y condiciones
2 BOE núm. 42 Sábado 17 febrero mínimas de la hemodonación y de los centros y servicios de, por el que se transpuso la Directiva 2002/98/CE del Parlamento Europeo y del Consejo, del 27 de enero de 2003, por la que se establecen normas de calidad y de seguridad para la extracción, verificación, tratamiento, almacenamiento y distribución de sangre humana y sus componentes y por la que se modifica la Directiva 2001/ 83/CE, exige el establecimiento de un sistema que permita garantizar la trazabilidad mediante procedimientos de vigilancia organizados que comporten la identificación única e inequívoca de las donaciones, la del donante y del paciente, así como la instauración y el mantenimiento de sistemas de registros, que posibiliten a su vez la evaluación de la información. El artículo 43.3 del citado real decreto prevé que el Ministerio de Sanidad y Consumo establecerá, de acuerdo a las directrices que dicte la Unión Europea, las normas y especificaciones mínimas en lo relativo a los requisitos de trazabilidad y a la notificación de reacciones y efectos adversos graves. Mediante esta disposición se incorpora al ordenamiento jurídico interno la Directiva 2005/61/CE de la Comisión, de 30 de septiembre de En su tramitación han sido oídos los sectores afectados y consultadas las Comunidades Autónomas, el Consejo Interterritorial del Sistema Nacional de Salud y el Comité Científico para la Seguridad Transfusional. Esta orden se dicta en desarrollo de lo previsto en el artículo 43.3 del Real Decreto 1088/2005, de 16 de septiembre, y al amparo de lo dispuesto en su disposición final segunda. En su virtud, con la aprobación previa del Ministro de Administraciones Públicas y de acuerdo con el Consejo de Estado, dispongo: Artículo 1. Objeto y ámbito de aplicación. 1. Esta orden establece los requisitos y especificaciones mínimas relativas a la trazabilidad de la sangre y componentes sanguíneos, así como a la notificación de reacciones y efectos adversos graves. 2. Lo dispuesto en esta orden será de aplicación en toda la red nacional de centros y servicios de, determinada en el artículo 35 del Real Decreto 1088/2005, de 16 de septiembre, por el que se establecen los requisitos técnicos y condiciones mínimas de la hemodonación y de los centros y servicios de. Artículo 2. Definiciones. A efectos de esta orden se entenderá por: a) Centro: Hospitales, clínicas, fabricantes de hemoderivados e institutos de investigación biomédica a los que puede suministrarse sangre o componentes sanguíneos. b) : El centro de, servicio de hospitalario o centro en el que se realice la que, en cada caso, comunica reacciones y efectos adversos graves a las autoridades competentes. c) Comité de : Estructura hospitalaria constituida por un número variable de profesionales según áreas, tamaño y grado de especialización de cada hospital, y cuya responsabilidad es asegurar la calidad y seguridad del ejercicio transfusional. d) Distribución: Acción de expedir sangre y componentes a otros centros de, servicios de o productores de productos derivados de la sangre y del plasma. No incluye el envío de sangre o componentes para al receptor. e) Efecto adverso grave: Cualquier hecho desfavorable vinculado a la extracción, verificación, tratamiento, almacenamiento y distribución de sangre y componentes, que pueda conducir a la muerte del paciente o a estados que puedan hacer peligrar su vida, a minusvalías o incapacidades, o dé lugar a hospitalización o enfermedad o, en su caso las prolongue. f) Hemovigilancia: Conjunto de procedimientos organizados de vigilancia relativos a los efectos o reacciones adversas graves o inesperadas que puedan aparecer a lo largo de la cadena transfusional, desde la extracción de la sangre y componentes hasta el seguimiento de los receptores, todo ello con el fin de prevenir, y tratar su aparición o recurrencia. g) Imputabilidad: La probabilidad de que una reacción adversa grave en un receptor pueda atribuirse a la sangre o al componente transfundido, o de que un efecto adverso grave en un donante pueda atribuirse al proceso de la donación. h) Reacción adversa grave: Respuesta nociva e inesperada en el donante o en el paciente, en relación con la extracción o la de sangre o de sus componentes, y que resulte mortal, potencialmente mortal, que produzca invalidez o incapacidad, o que dé lugar a hospitalización o enfermedad o, en su caso, las prolongue. i) Receptor: Persona que ha recibido una de sangre o componentes sanguíneos. j) Suministro: Liberación por un centro o servicio de de sangre o de componentes sanguíneos para uso transfusional. k) Trazabilidad: La capacidad de efectuar el seguimiento de cada unidad de sangre o componente desde el donante hasta su destino final (ya sea a un receptor o a un fabricante de medicamentos), o su destrucción y viceversa. Artículo 3. Requisitos y especificaciones relativos a la trazabilidad. 1. Cada servicio o centro de, al suministrar sangre o componentes para, dispondrá de un procedimiento de verificación de que cada unidad suministrada ha sido transfundida al receptor a quien iba destinada, o que permita verificar su destino ulterior en caso de no ser utilizada para. 2. En todos los centros y servicios de existirá un sistema de registro de cada unidad de sangre o componentes recibidos, así como del destino final de cada unidad o componente recibido, ya sea transfundido, eliminado o devuelto al centro de que lo distribuyó. 3. En cada centro de existirá un identificador único, que permita su vinculación precisa con cada unidad de sangre extraída y con cada componente elaborado. Artículo 4. Registro de datos de trazabilidad. Los centros de, servicios de u otros centros implicados conservarán los datos que figuran en el anexo I, en periodo y forma tal como se recoge en el artículo 42 del Real Decreto 1088/2005, de 16 de septiembre. Artículo 5. Notificación de reacciones adversas graves. 1. Los servicios de dispondrán de procedimientos para guardar el registro de todas las transfusiones y para notificar de forma inmediata a los centros de cualquier reacción adversa grave en los receptores, atribuible a la calidad y seguridad de la sangre o los componentes sanguíneos. 2. El comité de, constituido en los centros con práctica transfusional, será el órgano responsa-
3 7012 Sábado 17 febrero 2007 BOE núm. 42 ble de realizar el análisis y la evaluación de las reacciones adversas asociadas a la. 3. A efectos de notificación, los centros informantes cumplirán, al menos, las siguientes especificaciones: a) Dispondrán de un sistema que garantice que todas las reacciones adversas graves se comuniquen a la autoridad sanitaria competente mediante procedimientos que incluyan, como mínimo, los datos que figuran en los formularios del anexo II, partes A y C. b) Notificarán a la autoridad sanitaria competente toda la información pertinente sobre reacciones adversas graves clasificadas en los niveles 2 ó 3 de la escala de imputabilidad, según se expone en la parte B del anexo II, atribuibles a la calidad y la seguridad de la sangre y componentes. c) Notificarán a la autoridad sanitaria competente, en cuanto se confirme, cualquier caso de transmisión de agentes infecciosos por la sangre o componentes. d) Notificarán a la autoridad sanitaria competente sobre las acciones emprendidas en cuanto a otros componentes involucrados que hayan distribuido para o para la ulterior fabricación de derivados plasmáticos. e) Evaluarán las posibles reacciones adversas graves con arreglo a los niveles de imputabilidad y gravedad establecidos en el anexo II, parte B. f) Una vez finalizada la investigación, cumplimentarán el correspondiente formulario y notificarán a la autoridad sanitaria competente las reacciones adversas graves, incluyendo como mínimo la información que figura en el formulario del anexo II, parte C. g) Presentarán anualmente a la autoridad sanitaria competente un informe completo de las reacciones adversas graves, incluyendo como mínimo la información que figura en el formulario del anexo II, parte D. Artículo 6. Notificación de efectos adversos graves. 1. Los centros y servicios de dispondrán de procedimientos que garanticen el mantenimiento adecuado de los registros de cualquier efecto adverso grave que pueda afectar a la calidad o la seguridad de la sangre y sus componentes. 2. A efectos de la correspondiente notificación los centros informantes cumplirán, al menos, las siguientes especificaciones: a) Dispondrán de procedimientos de notificación para comunicar a la autoridad sanitaria competente, en cuanto se constaten, toda la información pertinente sobre efectos adversos graves que puedan poner en peligro a donantes o receptores distintos de los directamente involucrados en el caso concreto. Esta información contendrá, como mínimo, la recogida en el formulario del anexo III, parte A b) Evaluarán los efectos adversos graves en relación a la detección de posibles causas evitables. c) Una vez finalizada la investigación, cumplimentarán el correspondiente formulario y notificarán a la autoridad sanitaria competente los efectos adversos graves, incluyendo como mínimo la información que figura en el formulario del anexo III, parte B. d) Presentarán anualmente a la autoridad sanitaria competente un informe completo de los efectos adversos graves, incluyendo como mínimo la información que figura en el formulario del anexo III, parte C. Artículo 7. Importación de sangre y componentes. La sangre y componentes sanguíneos importados de terceros países, incluidos los utilizados como materia prima o de partida para la fabricación de medicamentos derivados de la sangre y plasma humano, deben cumplir normas y especificaciones equivalentes a las establecidas en la presente orden, en cuanto a la trazabilidad y a la notificación de reacciones y efectos adversos graves. Artículo 8. Informe anual e intercambio de información. 1. A efectos del informe anual que debe presentarse a la Comisión Europea, las autoridades sanitarias competentes remitirán al Ministerio de Sanidad y Consumo, antes del 1 de mayo de cada año, los formularios cumplimentados que figuran en la parte D del anexo II y en la parte C del anexo III, referidos a las reacciones y efectos adversos graves acontecidos en el año anterior. 2. Cuando la autoridad sanitaria competente reciba información que se refiera a reacciones o efectos graves que puedan poner en peligro a donantes o receptores distintos de los directamente involucrados en el caso concreto, deberá ponerlo en conocimiento del Ministerio de Sanidad y Consumo lo más rápidamente posible. 3. Cuando se comunique un efecto o reacción adversa grave que por su origen pueda suponer una situación de riesgo para más de un centro, región o país, el Ministerio de Sanidad y Consumo lo comunicará a la mayor brevedad posible tanto a las autoridades sanitarias competentes autonómicas, como a las autoridades de los Estados miembros, al fin de garantizar la retirada y eliminación, si procede, de los elementos defectuosos. Artículo 9. Protección de datos y confidencialidad. 1. El tratamiento y las comunicaciones de datos de los donantes y receptores, derivado del cumplimiento de lo dispuesto en esta orden por los centros informantes, se someterá a lo dispuesto en la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal. 2. Se adoptarán, en todo caso, las medidas de seguridad de nivel alto previstas en el Reglamento de medidas de seguridad de los ficheros automatizados que contengan datos de carácter personal, tal como se establece en el Real Decreto 994/1999, de 11 de junio. Artículo 10. Infracciones y sanciones. En cuanto a infracciones y sanciones se seguirá lo dispuesto en los artículos 46 y 47 del Real Decreto 1088/ 2005, de 16 de septiembre. Disposición final primera. Incorporación de derecho de la Unión Europea. Mediante esta orden se transpone al derecho español la Directiva 2005/61/CE de la Comisión, de 30 de septiembre de 2005, por la que se aplica la Directiva 2002/98/CE del Parlamento Europeo y del Consejo en lo relativo a los requisitos de trazabilidad y a la notificación de reacciones y efectos adversos graves. Disposición final segunda. Entrada en vigor. La presente orden entrará en vigor el día siguiente al de su publicación en el «Boletín Oficial del Estado». Madrid, 9 de febrero de La Ministra de Sanidad y Consumo, Elena Salgado Méndez.
4 BOE núm. 42 Sábado 17 febrero Centros de Transfusión Sanguínea 1. Identificación del Centro de Transfusión ANEXO I REGISTRO DE DATOS DE TRAZABILIDAD 2. Identificación del donante de sangre o componente sanguíneo 3. Identificación de la unidad de sangre 4. Identificación de cada componente sanguíneo 5. Fecha de extracción (año/mes/día) 6. Centros a los que se distribuyen las unidades de sangre o los componentes sanguíneos, o destino ulterior Otros Centros 0. Identificación del Servicio de Transfusión 1. Identificación del proveedor del componente sanguíneo 2. Identificación de cada componente sanguíneo suministrado 3. Identificación del receptor de la 4. Para las unidades no transfundidas, confirmación de su destino ulterior 5. Fecha de la, eliminación o devolución (año/mes/día) 6. En su caso, nº de lote del componente 1. ANEXO II NOTIFICACIÓN de REACCIONES ADVERSAS GRAVES PARTE A Formulario de notificación rápida de presuntas reacciones adversas graves 2. Identificación del informe 3. Fecha del informe (año/mes/día) 4. Fecha de (año/mes/día 5. Edad y sexo del receptor 6. Fecha de la reacción adversa grave (año/mes/día) 7. Reacción adversa grave a: -Sangre total -Hematíes -Concentrados plaquetarios -Plasma -Otros. Especificar 8. En caso de donación, tipo de donación: Donación Autóloga /Homologa 9. Tipos de reacciones adversas graves - Hemólisis inmune por incompatibilidad ABO - Hemólisis inmune por otro aloanticuerpo - Hemólisis por causa no inmune - Infección bacteriana transmitida por - Anafilaxis/hipersensibilidad - Lesión pulmonar aguda relacionada con la - Infección vírica trasmitida por la (VHB/ VHC/VIH-I-II) - Otras infecciones víricas trasmitidas por la (especifíquese) - Infección parasitaria trasmitida por la (paludismo) - Otra infección parasitaria trasmitida por la (especifíquese) - Púrpura postransfusional - Enfermedad de injerto contra huésped - Hemosiderosis transfusional - Error en la administración de componentes - Otras reacciones graves en el receptor - Incidente relacionado con la donación 10. es de imputabilidad (NA, 0-3)
5 7014 Sábado 17 febrero 2007 BOE núm. 42 PARTE B Reacciones adversas graves es de imputabilidad es de imputabilidad para evaluar reacciones adversas graves de imputabilidad Explicación NA No evaluable Son insuficientes los datos para evaluar la imputabilidad 0 Excluida Hay pruebas fehacientes que no dejan lugar a dudas de que la reacción adversa se debe a otras causas. Improbable Hay pruebas que permiten atribuir la reacción adversa a causas distintas de la sangre o los componentes sanguíneos 1 Posible Las pruebas no permiten atribuir con exactitud la reacción adversa ni a la sangre o los componentes sanguíneos ni a otras causas 2 Probable/sugestivo Las pruebas permiten atribuir claramente la reacción adversa a la sangre o a un componente sanguíneo, y no es explicable por otras causas 3 Cierta/seguro Hay pruebas fehacientes que no dejan lugar a dudas de que la reacción adversa se debe a la sangre o a un componente sanguíneo. Reacciones adversas graves es de gravedad No signos 0 Signos inmediatos sin riesgo vital y resolución completa 1 Signos inmediatos con riesgo vital 2 Morbilidad a largo plazo 3 Muerte del paciente 4 PARTE C Formulario de confirmación de reacciones adversas graves Identificación del informe Fecha de confirmación (año/mes/día) Fecha de la reacción adversa grave (año/mes/día) Confirmación de la reacción adversa grave (Si/No) de imputabilidad (NA, 0-3) Cambio de tipo de reacción adversa grave (Si/No) En caso afirmativo, especifíquese Curso clínico (si se conoce): - Curación - Secuelas leves - Secuelas importantes - Defunción
6 BOE núm. 42 Sábado 17 febrero Período cubierto por el informe En el presente cuadro se hace referencia a [ ] Sangre total [ ] Hematíes [ ] Plaquetas [ ] Plasma [ ] Otros (especifíquese) (emplee un cuadro por cada componente) Hemólisis inmune Hemólisis por causa no inmune PARTE D Formulario de notificación anual de reacciones adversas graves Por incompatibilidad ABO Por otro aloanticuerpo Infección bacteriana transmitida por la Anafilaxis / hipersensibilidad Lesión pulmonar aguda relacionada con la Infección vírica transmitida por la Infección parasitaria transmitida por la Púrpura postransfusional VHB VHC VIH I-II Otras (especifíquense) Paludismo Otras (especifíquense) Enfermedad de injerto contra huésped Otras reacciones graves (especifíquense) Hemosiderosis transfusional Error en la administración de componentes Número total de unidades suministradas (número total de unidades por componente sanguíneo) Número total de receptores de (número total de receptores transfundidos por componentes sanguíneo) (si se conoce) Número de unidades transfundidas (número total de componentes sanguíneos [unidades] transfundidos en el período cubierto por el informe) (si se conoce) Número total notificado Número de defunciones Número de reacciones adversas graves e imputabilidad, nivel 0 a 3 tras confirmación (véase el anexo II A) No evaluable Incidente relacionado con la donación
7 7016 Sábado 17 febrero 2007 BOE núm. 42 Identificación del informe Fecha del informe (año/mes/día) Fecha del efecto adverso grave (año/mes/día) Efecto adverso grave, que puede afectar a la calidad y la seguridad del componente sanguíneo, debido a un problema en: La extracción de sangre total La extracción por aféresis La verificación de las donaciones El procesamiento El almacenamiento La distribución Los materiales Otros (especifíquese) ANEXO III NOTIFICACIÓN DE EFECTOS ADVERSOS GRAVES PARTE A Formulario de notificación rápida de efectos adversos graves Producto defectuoso Fallo de los equipos Desglose Error humano Otro (especifíquese) Identificación del informe Fecha de confirmación (año/mes/día) Fecha del efecto adverso grave (año/mes/día) Análisis de las causas subyacentes (detállese) Medidas correctoras tomadas (detállense) PARTE B Formulario de confirmación de efectos adversos graves PARTE C Formulario de notificación anual de efectos adversos graves Período cubierto por el informe De 1 de enero a 31 de diciembre de (año) Número total de unidades de sangre y de componentes sanguíneos procesados: Efecto adverso grave, que afecta a Desglose la calidad y la seguridad del componente sanguíneo, debido a Número total Producto Fallo de los Error Otro un problema en: defectuoso equipos humano (especifíquese) La extracción de sangre total La extracción por aféresis La verificación de las donaciones El procesamiento El almacenamiento La distribución Los materiales Otros (especifíquese)
COMISIÓN DE LAS COMUNIDADES EUROPEAS. Proyecto de DIRECTIVA../ /CE DE LA COMISIÓN
 COMISIÓN DE LAS COMUNIDAD EUROPEAS Proyecto de DIRECTIVA../ /CE DE LA COMISIÓN de [ ] por la que se aplica la Directiva 2002/98/CE del Parlamento Europeo y del Consejo en lo relativo a los requisitos de
COMISIÓN DE LAS COMUNIDAD EUROPEAS Proyecto de DIRECTIVA../ /CE DE LA COMISIÓN de [ ] por la que se aplica la Directiva 2002/98/CE del Parlamento Europeo y del Consejo en lo relativo a los requisitos de
21692 ORDEN SCO/4224/2004, de 16 de diciembre, por
 42038 Martes 28 diciembre 2004 BOE núm. 312 21692 ORDEN SCO/4224/2004, de 16 de diciembre, por la que se modifica el anexo del Real Decreto 1917/1997, de 19 de diciembre, por el que se establecen las normas
42038 Martes 28 diciembre 2004 BOE núm. 312 21692 ORDEN SCO/4224/2004, de 16 de diciembre, por la que se modifica el anexo del Real Decreto 1917/1997, de 19 de diciembre, por el que se establecen las normas
LEGISLACIÓN CONSOLIDADA. TEXTO CONSOLIDADO Última modificación: sin modificaciones
 Real Decreto 1343/2007, de 11 de octubre, por el que se establecen normas y especificaciones relativas al sistema de calidad de los centros y servicios de transfusión. Ministerio de Sanidad y Consumo «BOE»
Real Decreto 1343/2007, de 11 de octubre, por el que se establecen normas y especificaciones relativas al sistema de calidad de los centros y servicios de transfusión. Ministerio de Sanidad y Consumo «BOE»
Entidades de distribución Entidades de intermediación
 Entidades de distribución Entidades de intermediación M Luisa Tarno DICM AEMPS 17/12/2013 Índice Requisitos Funciones Obligaciones Marco legal anterior Ley 29/2006,de 26 de julio, de garantías y uso racional
Entidades de distribución Entidades de intermediación M Luisa Tarno DICM AEMPS 17/12/2013 Índice Requisitos Funciones Obligaciones Marco legal anterior Ley 29/2006,de 26 de julio, de garantías y uso racional
(BOE núm. 134, de 5 de junio de 2003)
 Real Decreto 605/2003, de 23 de mayo, por el que se establecen medidas para el tratamiento homogéneo de la información sobre las listas de espera en el Sistema Nacional de Salud. Última actualización:
Real Decreto 605/2003, de 23 de mayo, por el que se establecen medidas para el tratamiento homogéneo de la información sobre las listas de espera en el Sistema Nacional de Salud. Última actualización:
ESTADÍSTICA ESTATAL DE CENTROS Y SERVICIOS DE TRANSFUSIÓN 2010
 ESTADÍSTICA ESTATAL DE CENTROS Y SERVICIOS DE TRANSFUSIÓN 2010 CUMPLIMENTACIÓN DEL CUESTIONARIO. INSTRUCCIONES, DEFINICIONES Y OTRAS CONSIDERACIONES A.- IDENTIFICACIÓN DEL CENTRO Además de los datos habituales
ESTADÍSTICA ESTATAL DE CENTROS Y SERVICIOS DE TRANSFUSIÓN 2010 CUMPLIMENTACIÓN DEL CUESTIONARIO. INSTRUCCIONES, DEFINICIONES Y OTRAS CONSIDERACIONES A.- IDENTIFICACIÓN DEL CENTRO Además de los datos habituales
LEGISLACIÓN CONSOLIDADA. TEXTO CONSOLIDADO Última modificación: 5 de octubre de 2007
 Orden de 13 de mayo de 1985 sobre medicamentos sometidos a especial control médico en su prescripción y utilización. Ministerio de Sanidad y Consumo «BOE» núm. 121, de 21 de mayo de 1985 Referencia: BOE-A-1985-9174
Orden de 13 de mayo de 1985 sobre medicamentos sometidos a especial control médico en su prescripción y utilización. Ministerio de Sanidad y Consumo «BOE» núm. 121, de 21 de mayo de 1985 Referencia: BOE-A-1985-9174
MINISTERIO DE AGRICULTURA, PESCA Y ALIMENTACIÓN
 BOE núm. 311 Viernes 28 diciembre 2001 49997 MINISTERIO DE AGRICULTURA, PESCA Y ALIMENTACIÓN 24746 REAL DECRETO 1377/2001, de 7 de diciembre, por el que se modifica el Real Decreto 1980/1998, de 18 de
BOE núm. 311 Viernes 28 diciembre 2001 49997 MINISTERIO DE AGRICULTURA, PESCA Y ALIMENTACIÓN 24746 REAL DECRETO 1377/2001, de 7 de diciembre, por el que se modifica el Real Decreto 1980/1998, de 18 de
QUÉ HACER CUANDO SUFRES UNA REACCIÓN ADVERSA A UN MEDICAMENTO (RAM)?
 QUÉ HACER CUANDO SUFRES UNA REACCIÓN ADVERSA A UN MEDICAMENTO (RAM)? Sabes qué es una reacción adversa a un medicamento? (Concepto, Estadísticas, RAM grave) Cómo actuar cuando sufres una reacción adversa?
QUÉ HACER CUANDO SUFRES UNA REACCIÓN ADVERSA A UN MEDICAMENTO (RAM)? Sabes qué es una reacción adversa a un medicamento? (Concepto, Estadísticas, RAM grave) Cómo actuar cuando sufres una reacción adversa?
MINISTERIO DE MEDIO AMBIENTE, Y MEDIO RURAL Y MARINO SECRETARÍA DE ESTADO DE CAMBIO CLIMÁTICO DIRECCION GENERAL DE CALIDAD Y EVALUACION AMBIENTAL
 MINISTERIO DE MEDIO AMBIENTE, Y MEDIO RURAL Y MARINO SECRETARÍA DE ESTADO DE CAMBIO CLIMÁTICO DIRECCION GENERAL DE CALIDAD Y EVALUACION AMBIENTAL PROYECTO DE REAL DECRETO POR EL QUE SE ESTABLECEN NORMAS
MINISTERIO DE MEDIO AMBIENTE, Y MEDIO RURAL Y MARINO SECRETARÍA DE ESTADO DE CAMBIO CLIMÁTICO DIRECCION GENERAL DE CALIDAD Y EVALUACION AMBIENTAL PROYECTO DE REAL DECRETO POR EL QUE SE ESTABLECEN NORMAS
Comunidad Autónoma de Galicia; Farmacovigilancia. DECRETO 170/2002, de 2 de mayo, de la Consellería de Sanidad de la Junta de Galicia
 Comunidad Autónoma de Galicia; Farmacovigilancia DECRETO 170/2002, de 2 de mayo, de la Consellería de Sanidad de la Junta de Galicia por el que se crea la Red Gallega de Alerta sobre Riesgos Relacionados
Comunidad Autónoma de Galicia; Farmacovigilancia DECRETO 170/2002, de 2 de mayo, de la Consellería de Sanidad de la Junta de Galicia por el que se crea la Red Gallega de Alerta sobre Riesgos Relacionados
PROYECTO DE REAL DECRETO POR EL QUE SE REGULA LA TRAZABILIDAD DE LOS MEDICAMENTOS DE USO HUMANO
 PROYECTO DE REAL DECRETO POR EL QUE SE REGULA LA TRAZABILIDAD DE LOS MEDICAMENTOS DE USO HUMANO 1 El artículo 87 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de medicamentos y productos
PROYECTO DE REAL DECRETO POR EL QUE SE REGULA LA TRAZABILIDAD DE LOS MEDICAMENTOS DE USO HUMANO 1 El artículo 87 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de medicamentos y productos
1. NORMATIVA APLICABLE
 SECRETARIA DE ESTADO DE MEDIO AMBIENTE MINISTERIO DE AGRICULTURA, ALIMENTACIÓN Y MEDIO AMBIENTE DIRECCION GENERAL DE CALIDAD Y EVALUACION AMBIENTAL Y MEDIO NATURAL NOTA SOBRE LA APLICACIÓN DE LA NORMATIVA
SECRETARIA DE ESTADO DE MEDIO AMBIENTE MINISTERIO DE AGRICULTURA, ALIMENTACIÓN Y MEDIO AMBIENTE DIRECCION GENERAL DE CALIDAD Y EVALUACION AMBIENTAL Y MEDIO NATURAL NOTA SOBRE LA APLICACIÓN DE LA NORMATIVA
NORMATIVA DE APLICACIÓN EN LA PRODUCCIÓN DE HUEVOS SEGÚN EL MODELO EUROPEO DE PRODUCCIÓN
 NORMATIVA DE APLICACIÓN EN LA PRODUCCIÓN DE HUEVOS SEGÚN EL MODELO EUROPEO DE PRODUCCIÓN 1. Ley 14/1986 de 25 de abril General de Sanidad 2. Real Decreto 1254/1991, de 2 de agosto, por el que se dictan
NORMATIVA DE APLICACIÓN EN LA PRODUCCIÓN DE HUEVOS SEGÚN EL MODELO EUROPEO DE PRODUCCIÓN 1. Ley 14/1986 de 25 de abril General de Sanidad 2. Real Decreto 1254/1991, de 2 de agosto, por el que se dictan
INTERVENCIÓN SANITARIA EN SITUACIONES DE RIESGO PARA LA SALUD PÚBLICA
 INTERVENCIÓN SANITARIA EN SITUACIONES DE RIESGO PARA LA SALUD PÚBLICA Aprobado por el Consejo Interterritorial del Sistema Nacional de Salud de 18 de Diciembre de 2013 INTRODUCCIÓN El derecho a la protección
INTERVENCIÓN SANITARIA EN SITUACIONES DE RIESGO PARA LA SALUD PÚBLICA Aprobado por el Consejo Interterritorial del Sistema Nacional de Salud de 18 de Diciembre de 2013 INTRODUCCIÓN El derecho a la protección
MINISTERIO SANIDAD Y CONSUMO BOE 21 mayo 1985, núm. 121, [pág ];
![MINISTERIO SANIDAD Y CONSUMO BOE 21 mayo 1985, núm. 121, [pág ]; MINISTERIO SANIDAD Y CONSUMO BOE 21 mayo 1985, núm. 121, [pág ];](/thumbs/57/40756945.jpg) RCL 1985\1155 Legislación (Disposición Vigente a 14/6/2006) Orden de 13 mayo 1985 MINISTERIO SANIDAD Y CONSUMO BOE 21 mayo 1985, núm. 121, [pág. 14580]; ESPECIALIDADES FARMACÉUTICAS. Medicamentos sometidos
RCL 1985\1155 Legislación (Disposición Vigente a 14/6/2006) Orden de 13 mayo 1985 MINISTERIO SANIDAD Y CONSUMO BOE 21 mayo 1985, núm. 121, [pág. 14580]; ESPECIALIDADES FARMACÉUTICAS. Medicamentos sometidos
LEGISLACIÓN CONSOLIDADA. TEXTO CONSOLIDADO Última modificación: 27 de diciembre de 2012
 Real Decreto 823/2008, de 16 de mayo, por el que se establecen los márgenes, deducciones y descuentos correspondientes a la distribución y dispensación de medicamentos de uso humano. Ministerio de Sanidad
Real Decreto 823/2008, de 16 de mayo, por el que se establecen los márgenes, deducciones y descuentos correspondientes a la distribución y dispensación de medicamentos de uso humano. Ministerio de Sanidad
EL PARLAMENTO EUROPEO Y EL CONSEJO DE LA UNIÓN EUROPEA,
 REGLAMENTO (CE) NÚM. 1830/2003 DEL PARLAMENTO EUROPEO Y DEL CONSEJO, DE 22 DE SEPTIEMBRE DE 2003, RELATIVO A LA TRAZABILIDAD Y AL ETIQUETADO DE ORGANISMOS MODIFICADOS GENÉTICAMENTE Y A LA TRAZABILIDAD
REGLAMENTO (CE) NÚM. 1830/2003 DEL PARLAMENTO EUROPEO Y DEL CONSEJO, DE 22 DE SEPTIEMBRE DE 2003, RELATIVO A LA TRAZABILIDAD Y AL ETIQUETADO DE ORGANISMOS MODIFICADOS GENÉTICAMENTE Y A LA TRAZABILIDAD
COLECTA Y TRANSFUSIÓN DE SANGRE Y SUS REACCIONES ADVERSAS
 Boletín Informativo No.6, 2009 Red Distrital de Sangre Bogotá COLECTA Y TRANSFUSIÓN DE SANGRE Y SUS REACCIONES ADVERSAS Por: Sonia Esperanza Rebollo. Bact. Ms. Epidemiología Oscar Andrés Peñuela B. MD,
Boletín Informativo No.6, 2009 Red Distrital de Sangre Bogotá COLECTA Y TRANSFUSIÓN DE SANGRE Y SUS REACCIONES ADVERSAS Por: Sonia Esperanza Rebollo. Bact. Ms. Epidemiología Oscar Andrés Peñuela B. MD,
COMISIÓN DE LAS COMUNIDADES EUROPEAS. Proyecto de DIRECTIVA../ /CE DE LA COMISIÓN
 COMISIÓN DE LAS COMUNIDAD EUROPEAS Proyecto de DIRECTIVA../ /CE DE LA COMISIÓN de [ ] por la que se aplica la Directiva 2002/98/CE del Parlamento Europeo y del Consejo en lo que se refiere a las normas
COMISIÓN DE LAS COMUNIDAD EUROPEAS Proyecto de DIRECTIVA../ /CE DE LA COMISIÓN de [ ] por la que se aplica la Directiva 2002/98/CE del Parlamento Europeo y del Consejo en lo que se refiere a las normas
INFORME DE HEMOVIGILANCIA 2009. PROGRAMA AUTONÓMICO RED DE HEMOVIGILANCIA DE ASTURIAS
 INFORME DE HEMOVIGILANCIA 2009. PROGRAMA AUTONÓMICO RED DE HEMOVIGILANCIA DE ASTURIAS El presente informe se ha realizado con los datos enviados desde cada uno de los Servicios de Transfusión Hospitalarios
INFORME DE HEMOVIGILANCIA 2009. PROGRAMA AUTONÓMICO RED DE HEMOVIGILANCIA DE ASTURIAS El presente informe se ha realizado con los datos enviados desde cada uno de los Servicios de Transfusión Hospitalarios
NORMATIVA SOBRE MEDICAMENTOS VETERINARIOS: RESPONSABILIDADES DEL VETERINARIO
 NORMATIVA SOBRE MEDICAMENTOS VETERINARIOS: DEL VETERINARIO Ramiro Casimiro Elena. Consejero Técnico del DMV (AEMPS). 13 VITORIA de Noviembre 13.11.2014 de 2014 1 ÍNDICE NORMATIVA SOBRE MEDICAMENTOS VETERINARIOS.
NORMATIVA SOBRE MEDICAMENTOS VETERINARIOS: DEL VETERINARIO Ramiro Casimiro Elena. Consejero Técnico del DMV (AEMPS). 13 VITORIA de Noviembre 13.11.2014 de 2014 1 ÍNDICE NORMATIVA SOBRE MEDICAMENTOS VETERINARIOS.
Artículo 1. Objeto y ámbito de aplicación
 Orden TAS/ por la que se regula el envío por las empresas de los datos del certificado de empresa al Servicio Público de Empleo Estatal por medios electrónicos. La ORDEN TAS/3261/2006, de 19 de octubre,
Orden TAS/ por la que se regula el envío por las empresas de los datos del certificado de empresa al Servicio Público de Empleo Estatal por medios electrónicos. La ORDEN TAS/3261/2006, de 19 de octubre,
Programa 11. Control sobre criterios microbiológicos de seguridad alimentaria
 Programa 11 Control sobre criterios microbiológicos de seguridad alimentaria PROGRAMA 11: CONTROL SOBRE CRITERIOS MICROBIOLÓGICOS DE SEGURIDAD ALIMENTARIA de las empresas alimentarias en relación con estos
Programa 11 Control sobre criterios microbiológicos de seguridad alimentaria PROGRAMA 11: CONTROL SOBRE CRITERIOS MICROBIOLÓGICOS DE SEGURIDAD ALIMENTARIA de las empresas alimentarias en relación con estos
Programa 12. Control de anisakis
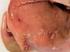 Programa 12 Control de anisakis PROGRAMA 12: CONTROL DE ANISAKIS 1. INTRODUCCIÓN El Anisakis spp. es un parásito que se encuentra en el pescado y cuyas larvas pasan activas al aparato digestivo humano
Programa 12 Control de anisakis PROGRAMA 12: CONTROL DE ANISAKIS 1. INTRODUCCIÓN El Anisakis spp. es un parásito que se encuentra en el pescado y cuyas larvas pasan activas al aparato digestivo humano
Normas de Buena Práctica Clínica El papel de la autoridad sanitaria. Consecuencias del incumplimiento para promotores e investigadores
 Normas de Buena Práctica Clínica El papel de la autoridad sanitaria. Consecuencias del incumplimiento para promotores e investigadores Carmen Aguado D. G. Ordenación e Inspección Consejería de Sanidad
Normas de Buena Práctica Clínica El papel de la autoridad sanitaria. Consecuencias del incumplimiento para promotores e investigadores Carmen Aguado D. G. Ordenación e Inspección Consejería de Sanidad
LEGISLACIÓN CONSOLIDADA. TEXTO CONSOLIDADO Última modificación: sin modificaciones
 Real Decreto 1315/2005, de 4 de noviembre, por el que se establecen las bases de los sistemas de seguimiento y verificación de emisiones de gases de efecto invernadero en las instalaciones incluidas en
Real Decreto 1315/2005, de 4 de noviembre, por el que se establecen las bases de los sistemas de seguimiento y verificación de emisiones de gases de efecto invernadero en las instalaciones incluidas en
sobre la evaluación de solvencia
 EBA/GL/2015/11 19.08.2015 Directrices de la ABE sobre la evaluación de solvencia 1 Índice Sección 1 Obligaciones de cumplimiento y de notificación 3 Sección 2 Objeto, ámbito de aplicación y definiciones
EBA/GL/2015/11 19.08.2015 Directrices de la ABE sobre la evaluación de solvencia 1 Índice Sección 1 Obligaciones de cumplimiento y de notificación 3 Sección 2 Objeto, ámbito de aplicación y definiciones
BOLETÍN OFICIAL DEL ESTADO
 Núm. 315 Viernes 30 de diciembre de 2016 Sec. I. Pág. 91253 I. DISPOSICIONES GENERALES MINISTERIO DE HACIENDA Y FUNCIÓN PÚBLICA 12484 Orden HFP/1978/2016, de 28 de diciembre, por la que se aprueba el modelo
Núm. 315 Viernes 30 de diciembre de 2016 Sec. I. Pág. 91253 I. DISPOSICIONES GENERALES MINISTERIO DE HACIENDA Y FUNCIÓN PÚBLICA 12484 Orden HFP/1978/2016, de 28 de diciembre, por la que se aprueba el modelo
Diario Oficial de la Unión Europea. (Actos no legislativos) REGLAMENTOS
 L 146/1 II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) 2016/879 DE LA COMISIÓN de 2 de junio de 2016 por el que se establecen, de conformidad con el Reglamento (UE) n. o 517/2014 del
L 146/1 II (Actos no legislativos) REGLAMENTOS REGLAMENTO DE EJECUCIÓN (UE) 2016/879 DE LA COMISIÓN de 2 de junio de 2016 por el que se establecen, de conformidad con el Reglamento (UE) n. o 517/2014 del
PROCEDIMIENTO DE TRAZABILIDAD UNIDAD DE MEDICINA TRANSFUSIONAL
 UNIDAD DE MEDICINA TRANSFUSIONAL Página: 1 de 19 Introducción y definiciones La trazabilidad es un sistema organizado de registros, que permite ubicar e identificar la sangre y sus componentes en forma
UNIDAD DE MEDICINA TRANSFUSIONAL Página: 1 de 19 Introducción y definiciones La trazabilidad es un sistema organizado de registros, que permite ubicar e identificar la sangre y sus componentes en forma
Tema 15. Distribución farmacéutica. Legislación y deontología farmacéutica
 Tema 15. Distribución farmacéutica Legislación y deontología farmacéutica 1 LEGISLACIÓN ESTATAL DISPOSICIONES LEGALES Real decreto 2259/1994 por el que se regula los almacenes farmacéuticos y la distribución
Tema 15. Distribución farmacéutica Legislación y deontología farmacéutica 1 LEGISLACIÓN ESTATAL DISPOSICIONES LEGALES Real decreto 2259/1994 por el que se regula los almacenes farmacéuticos y la distribución
Reglamento de Higiene de piensos. Situación n en España
 Reglamento de Higiene de piensos. Situación n en España Leonor Algarra Solís Jefe de Área Alimentacion Animal Dirección n General de Ganadería M.A.P.A. Nueva Legislación n Alimentaría : Nuevo enfoque Legislación
Reglamento de Higiene de piensos. Situación n en España Leonor Algarra Solís Jefe de Área Alimentacion Animal Dirección n General de Ganadería M.A.P.A. Nueva Legislación n Alimentaría : Nuevo enfoque Legislación
Manual de uso óptimo de la sangre: análisis del contenido
 Manual de uso óptimo de la sangre: análisis del contenido Dr. Miguel Lozano Molero Servicio de Hemoterapia y Hemostasia Hospital Clínico Universitario Barcelona Organizaciones Europeas Consejo de Europa
Manual de uso óptimo de la sangre: análisis del contenido Dr. Miguel Lozano Molero Servicio de Hemoterapia y Hemostasia Hospital Clínico Universitario Barcelona Organizaciones Europeas Consejo de Europa
ALIMENTOS Y BEBIDAS CARNES, AVES, CAZA Y DERIVADOS GENERALES
 ALIMENTOS Y BEBIDAS CARNES, AVES, CAZA Y DERIVADOS GENERALES Página 1 ORDEN DE 24 DE SEPTIEMBRE DE 1992 POR LA QUE SE ESTABLECEN LAS CONDICIONES DE SOLICITUD DE CLASIFICACIÓN DE LOS ESTABLECIMIENTOS ELABORADORES
ALIMENTOS Y BEBIDAS CARNES, AVES, CAZA Y DERIVADOS GENERALES Página 1 ORDEN DE 24 DE SEPTIEMBRE DE 1992 POR LA QUE SE ESTABLECEN LAS CONDICIONES DE SOLICITUD DE CLASIFICACIÓN DE LOS ESTABLECIMIENTOS ELABORADORES
BOLETÍN OFICIAL DEL ESTADO
 Núm. 223 Viernes 16 de septiembre de 2011 Sec. I. Pág. 98660 I. DISPOSICIONES GENERALES MINISTERIO DE MEDIO AMBIENTE, Y MEDIO RURAL Y MARINO 14783 Real Decreto 1149/2011, de 29 de julio, por el que se
Núm. 223 Viernes 16 de septiembre de 2011 Sec. I. Pág. 98660 I. DISPOSICIONES GENERALES MINISTERIO DE MEDIO AMBIENTE, Y MEDIO RURAL Y MARINO 14783 Real Decreto 1149/2011, de 29 de julio, por el que se
Este documento ha sido descargado de El portal de los profesionales de la seguridad.
 ORDEN DEF/2437/2006, DE 16 DE JULIO DEL MINISTERIO DE DEFENSA, POR LA QUE SE CREAN FICHEROS DE DATOS DE CARÁCTER PERSONAL DEL INSTITUTO SOCIAL DE LAS FUERZAS ARMADAS (BOE NÚM. 178 DE 27 DE JULIO DE 2006)
ORDEN DEF/2437/2006, DE 16 DE JULIO DEL MINISTERIO DE DEFENSA, POR LA QUE SE CREAN FICHEROS DE DATOS DE CARÁCTER PERSONAL DEL INSTITUTO SOCIAL DE LAS FUERZAS ARMADAS (BOE NÚM. 178 DE 27 DE JULIO DE 2006)
Trazabilidad como instrumento de gestión en la actividad sanitaria
 Trazabilidad como instrumento de gestión en la actividad sanitaria Gestión y Liderazgo para la Acreditación Hospitalaria Octubre 2014 Carmen Gloria Alarcón Hacemos bien el 99,9% de las cosas el 99,9% de
Trazabilidad como instrumento de gestión en la actividad sanitaria Gestión y Liderazgo para la Acreditación Hospitalaria Octubre 2014 Carmen Gloria Alarcón Hacemos bien el 99,9% de las cosas el 99,9% de
TEXTO. REGISTRO BOMEH: 17/2015 PUBLICADO EN: BOE n.º 95, de 21 de abril de Disponible en:
 TÍTULO: Resolución de 6 de abril de 2015, del Instituto Nacional de Estadística, por la que se crean y modifican ficheros de datos de carácter personal. REGISTRO NORM@DOC: 44679 BOMEH: 17/2015 PUBLICADO
TÍTULO: Resolución de 6 de abril de 2015, del Instituto Nacional de Estadística, por la que se crean y modifican ficheros de datos de carácter personal. REGISTRO NORM@DOC: 44679 BOMEH: 17/2015 PUBLICADO
BALEARES Distribución por Temas
 BALEARES Distribución por Temas Calidad y resultados de la atención sanitaria; 1 Seguridad alimentaria; 11 Demografía; 2 Demografía; 1 Derechos de los consumidores; 1 Medicamentos y Productos Sanitarios;
BALEARES Distribución por Temas Calidad y resultados de la atención sanitaria; 1 Seguridad alimentaria; 11 Demografía; 2 Demografía; 1 Derechos de los consumidores; 1 Medicamentos y Productos Sanitarios;
Ítem Evaluación Escala/Rango Ítem Evaluación Escala/Rango. NA 1 2 3 4 Probabilidad Ocurrencia. N NS S PM M Consecuencias
 PROGRAMA DE BIOVIGILANCIA 1 FICHA DE REPORTE DE INCIDENTES Y EVENTOS ADVERSOS 1. Entidad que notifica 1.1 Fecha y hora de reporte: 1.2 Institución Prestadora de Servicios de Salud 1.3 Banco de Tejidos
PROGRAMA DE BIOVIGILANCIA 1 FICHA DE REPORTE DE INCIDENTES Y EVENTOS ADVERSOS 1. Entidad que notifica 1.1 Fecha y hora de reporte: 1.2 Institución Prestadora de Servicios de Salud 1.3 Banco de Tejidos
Tema 2. LEGISLACIÓN FARMACÉUTICA Y SANITARIA FUNDAMENTAL. Legislación y deontología farmacéutica
 Tema 2. LEGISLACIÓN FARMACÉUTICA Y SANITARIA FUNDAMENTAL Legislación y deontología farmacéutica 1. LEGISLACIÓN ESTATAL ESQUEMA Ley Orgánica de Medidas Especiales de Salud Pública (3/1986) Ley General de
Tema 2. LEGISLACIÓN FARMACÉUTICA Y SANITARIA FUNDAMENTAL Legislación y deontología farmacéutica 1. LEGISLACIÓN ESTATAL ESQUEMA Ley Orgánica de Medidas Especiales de Salud Pública (3/1986) Ley General de
La Ley 14/1986, de 25 de abril, General de Sanidad, establece en el artículo 3.1, que los medios y actuaciones del sistema sanitario
 DECRETO 10/2001, DE 25 DE ENERO, POR EL QUE SE ESTABLECEN LAS NORMAS RELATIVAS A LA FORMACIÓN DE LOS MANIPULADORES DE ALIMENTOS, AUTORIZACIÓN, CONTROL Y SUPERVISIÓN DE LOS CENTROS Y PROGRAMAS DE FORMACIÓN
DECRETO 10/2001, DE 25 DE ENERO, POR EL QUE SE ESTABLECEN LAS NORMAS RELATIVAS A LA FORMACIÓN DE LOS MANIPULADORES DE ALIMENTOS, AUTORIZACIÓN, CONTROL Y SUPERVISIÓN DE LOS CENTROS Y PROGRAMAS DE FORMACIÓN
Técnico en Hematología y Hemoterapia. Sanidad, Dietética y Nutrición
 Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
PROCEDIMIENTOS A APLICAR A CEMENTOS NO SUJETOS AL MARCADO CE
 PROCEDIMIENTOS A APLICAR A CEMENTOS NO SUJETOS REAL DECRETO 605/2006, de 19 de mayo, por el que se aprueban los procedimientos para la aplicación de la norma UNE-EN 197-2:2000 a los cementos no sujetos
PROCEDIMIENTOS A APLICAR A CEMENTOS NO SUJETOS REAL DECRETO 605/2006, de 19 de mayo, por el que se aprueban los procedimientos para la aplicación de la norma UNE-EN 197-2:2000 a los cementos no sujetos
Diario Oficial de la Unión Europea L 97/3
 12.4.2011 Diario Oficial de la Unión Europea L 97/3 REGLAMENTO (UE) N o 349/2011 DE LA COMISIÓN de 11 de abril de 2011 por el que se aplica el Reglamento (CE) n o 1338/2008 del Parlamento Europeo y del
12.4.2011 Diario Oficial de la Unión Europea L 97/3 REGLAMENTO (UE) N o 349/2011 DE LA COMISIÓN de 11 de abril de 2011 por el que se aplica el Reglamento (CE) n o 1338/2008 del Parlamento Europeo y del
Modificación de las medidas de control de accidentes graves
 Modificación de las medidas de control de accidentes graves REAL DECRETO 119/2005, de 4 de febrero, por el que se modifica el Real Decreto 1254/1999, de 16 de julio, por el que se aprueban medidas de control
Modificación de las medidas de control de accidentes graves REAL DECRETO 119/2005, de 4 de febrero, por el que se modifica el Real Decreto 1254/1999, de 16 de julio, por el que se aprueban medidas de control
BOLETÍN OFICIAL DEL ESTADO
 Núm. 25 Sábado 29 de enero de 2011 Sec. I. Pág. 9569 I. DISPOSICIONES GENERALES MINISTERIO DE LA PRESIDENCIA 1644 Real Decreto 101/2011, de 28 de enero, por el que se establecen las normas básicas que
Núm. 25 Sábado 29 de enero de 2011 Sec. I. Pág. 9569 I. DISPOSICIONES GENERALES MINISTERIO DE LA PRESIDENCIA 1644 Real Decreto 101/2011, de 28 de enero, por el que se establecen las normas básicas que
O.M. de 26 de julio de 1993. Modificación Amianto. Instituto Nacional de Seguridad.. Página 1 de 6
 O.M. de 26 de julio de 1993. Modificación Amianto. Instituto Nacional de Seguridad.. Página 1 de 6 Modificación del Reglamento sobre Trabajos con Riesgo de Amianto Orden de 26 de julio de 1993 por la que
O.M. de 26 de julio de 1993. Modificación Amianto. Instituto Nacional de Seguridad.. Página 1 de 6 Modificación del Reglamento sobre Trabajos con Riesgo de Amianto Orden de 26 de julio de 1993 por la que
DEFINICIONES. Página 18 de 22. hemovigilancia.ghas@sespa.princast.es
 DEFINICIONES Centro de Transfusión: centro sanitario en el que se efectúa cualquiera de las actividades relacionadas con la extracción y verificación de la sangre humana o sus componentes, sea cual sea
DEFINICIONES Centro de Transfusión: centro sanitario en el que se efectúa cualquiera de las actividades relacionadas con la extracción y verificación de la sangre humana o sus componentes, sea cual sea
BOLETÍN OFICIAL DEL ESTADO
 Núm. 288 Lunes 2 de diciembre de 2013 Sec. I. Pág. 95451 I. DISPOSICIONES GENERALES MINISTERIO DE AGRICULTURA, ALIMENTACIÓN Y MEDIO AMBIENTE 12568 Orden AAA/2231/2013, de 25 de noviembre, por la que se
Núm. 288 Lunes 2 de diciembre de 2013 Sec. I. Pág. 95451 I. DISPOSICIONES GENERALES MINISTERIO DE AGRICULTURA, ALIMENTACIÓN Y MEDIO AMBIENTE 12568 Orden AAA/2231/2013, de 25 de noviembre, por la que se
TRANSFUSIÓN EN ESPAÑA MAPA DE RIESGOS
 TRANSFUSIÓN EN ESPAÑA MAPA DE RIESGOS 16º Seminario Internacional de Hemovigilancia (IHN) Barcelona 5-7 marzo de 2014 Magdalena Pérez Jiménez Unidad de Hemovigilancia DG Salud Pública, Calidad e Innovación
TRANSFUSIÓN EN ESPAÑA MAPA DE RIESGOS 16º Seminario Internacional de Hemovigilancia (IHN) Barcelona 5-7 marzo de 2014 Magdalena Pérez Jiménez Unidad de Hemovigilancia DG Salud Pública, Calidad e Innovación
BOLETÍN OFICIAL DEL ESTADO
 Núm. 307 Jueves 24 de diciembre de 2015 Sec. I. Pág. 121965 I. DISPOSICIONES GENERALES MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD 14083 Real Decreto 1091/2015, de 4 de diciembre, por el que se
Núm. 307 Jueves 24 de diciembre de 2015 Sec. I. Pág. 121965 I. DISPOSICIONES GENERALES MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD 14083 Real Decreto 1091/2015, de 4 de diciembre, por el que se
RESOLUCION 797 Reglamento de la Decisión 516 sobre Control y Vigilancia Sanitaria de Productos Cosméticos
 RESOLUCION 797 Reglamento de la Decisión 516 sobre Control y Vigilancia Sanitaria de Productos Cosméticos LA SECRETARIA GENERAL DE LA COMUNIDAD ANDINA, VISTOS: El artículo 30 literal b) del Acuerdo de
RESOLUCION 797 Reglamento de la Decisión 516 sobre Control y Vigilancia Sanitaria de Productos Cosméticos LA SECRETARIA GENERAL DE LA COMUNIDAD ANDINA, VISTOS: El artículo 30 literal b) del Acuerdo de
Norma de calidad para determinados tipos de leche conservada parcial o totalmente deshidratada destinados a la alimentación humana.
 Real Decreto 1054/2003, de 1 de agosto, por el que se aprueba la Norma de calidad para determinados tipos de leche conservada parcial o totalmente deshidratada Sumario: Artículo único. Aprobación de la
Real Decreto 1054/2003, de 1 de agosto, por el que se aprueba la Norma de calidad para determinados tipos de leche conservada parcial o totalmente deshidratada Sumario: Artículo único. Aprobación de la
b) Hojas interiores de relación de operaciones intracomunitarias. c) Hojas interiores de rectificación de períodos anteriores.
 Orden EHA/769/2010, de 18 de marzo, por la que se aprueba el modelo 349 de declaración recapitulativa de operaciones intracomunitarias, así como los diseños físicos y lógicos y el lugar, forma y plazo
Orden EHA/769/2010, de 18 de marzo, por la que se aprueba el modelo 349 de declaración recapitulativa de operaciones intracomunitarias, así como los diseños físicos y lógicos y el lugar, forma y plazo
VIGILANCIA DE PRODUCTOS SANITARIOS
 VIGILANCIA DE PRODUCTOS SANITARIOS Madrid, 19 de Mayo de 2011 Sociedad Española de Cardiología Carmen Valls. Consejera Técnica Sistema de vigilancia de productos sanitarios Notificación de los incidentes
VIGILANCIA DE PRODUCTOS SANITARIOS Madrid, 19 de Mayo de 2011 Sociedad Española de Cardiología Carmen Valls. Consejera Técnica Sistema de vigilancia de productos sanitarios Notificación de los incidentes
FUNCIÓN DE CUMPLIMIENTO NORMATIVO (CONSIDERANDO LOS IMPACTOS DE MIFID EN LAS FUNCIONES DE CONTROL DE RIESGOS Y AUDITORÍA INTERNA)
 (CONSIDERANDO LOS IMPACTOS DE MIFID EN LAS FUNCIONES DE CONTROL DE RIESGOS Y AUDITORÍA INTERNA) ACCIÓN: 2.8 DEL PLAN DE ADAPTACIÓN TIPO FUNCIÓN DE ( CONSIDERANDO LOS IMPACTOS MIFID EN LAS FUNCIONES DE
(CONSIDERANDO LOS IMPACTOS DE MIFID EN LAS FUNCIONES DE CONTROL DE RIESGOS Y AUDITORÍA INTERNA) ACCIÓN: 2.8 DEL PLAN DE ADAPTACIÓN TIPO FUNCIÓN DE ( CONSIDERANDO LOS IMPACTOS MIFID EN LAS FUNCIONES DE
NTE AS Centro Producción de Componentes Sanguíneos NORMAS TECNICAS ESPECÍFICAS AUTORIZACION SANITARIA UNIDADES DE PRODUCCION COMPONENTES SANGUÍNEOS
 NORMAS TECNICAS ESPECÍFICAS AUTORIZACION SANITARIA UNIDADES DE PRODUCCION COMPONENTES SANGUÍNEOS I. INTRODUCCIÓN Definición: La Unidad de Procesamiento de Componentes Sanguíneos está constituida por las
NORMAS TECNICAS ESPECÍFICAS AUTORIZACION SANITARIA UNIDADES DE PRODUCCION COMPONENTES SANGUÍNEOS I. INTRODUCCIÓN Definición: La Unidad de Procesamiento de Componentes Sanguíneos está constituida por las
MANUAL DE PROCESOS DEL SGIC. Directriz 3: Garantía y mejora de la calidad del personal académico y de apoyo a la docencia
 Directriz 3: Garantía y mejora de la calidad del personal académico y de apoyo a la docencia P3.6: Proceso de formación del personal académico 1. Objeto 2. Alcance 3. Referencias/Normativa 4. Definiciones
Directriz 3: Garantía y mejora de la calidad del personal académico y de apoyo a la docencia P3.6: Proceso de formación del personal académico 1. Objeto 2. Alcance 3. Referencias/Normativa 4. Definiciones
NAVARRA Distribución por Temas
 NAVARRA Distribución por Temas Utilización de la atención sanitaria; 7 Seguridad alimentaria; 1 Condiciones de vida y trabajo; 8 Salud ambiental; 1 Demografía; 2 Recursos sanitarios; 4 Derechos de los
NAVARRA Distribución por Temas Utilización de la atención sanitaria; 7 Seguridad alimentaria; 1 Condiciones de vida y trabajo; 8 Salud ambiental; 1 Demografía; 2 Recursos sanitarios; 4 Derechos de los
MINISTERIO DE EMPLEO Y SEGURIDAD SOCIAL
 MINISTERIO DE EMPLEO Y SEGURIDAD SOCIAL Proyecto de Orden Ministerial por la que se modifica la Orden ESS/484/2013, de 26 de marzo, por la que se regula el Sistema de remisión electrónica de datos en el
MINISTERIO DE EMPLEO Y SEGURIDAD SOCIAL Proyecto de Orden Ministerial por la que se modifica la Orden ESS/484/2013, de 26 de marzo, por la que se regula el Sistema de remisión electrónica de datos en el
Acreditación como herramienta para la seguridad del paciente. Dr. Héctor A. Baptista González
 Acreditación como herramienta para la seguridad del paciente Dr. Héctor A. Baptista González Declaración de No Conflicto de interés El contenido de este material no representa necesariamente los intereses
Acreditación como herramienta para la seguridad del paciente Dr. Héctor A. Baptista González Declaración de No Conflicto de interés El contenido de este material no representa necesariamente los intereses
BOLETÍN OFICIAL DEL ESTADO
 Núm. 36 Sábado 11 de febrero de 2017 Sec. III. Pág. 9652 III. OTRAS DISPOSICIONES MINISTERIO DE EMPLEO Y SEGURIDAD SOCIAL 1404 Orden ESS/109/2017, de 10 de febrero, por la que se modifica la Orden ESS/1423/2012,
Núm. 36 Sábado 11 de febrero de 2017 Sec. III. Pág. 9652 III. OTRAS DISPOSICIONES MINISTERIO DE EMPLEO Y SEGURIDAD SOCIAL 1404 Orden ESS/109/2017, de 10 de febrero, por la que se modifica la Orden ESS/1423/2012,
sobre las notificaciones de pasaporte de intermediarios de crédito con arreglo a la Directiva 2014/17/UE («Directiva de crédito hipotecario»)
 EBA/GL/2015/19 19.10.2015 Directrices sobre las notificaciones de pasaporte de intermediarios de crédito con arreglo a la Directiva 2014/17/UE («Directiva de crédito hipotecario») 1 1. Obligaciones de
EBA/GL/2015/19 19.10.2015 Directrices sobre las notificaciones de pasaporte de intermediarios de crédito con arreglo a la Directiva 2014/17/UE («Directiva de crédito hipotecario») 1 1. Obligaciones de
I. Comunidad Autónoma
 Página 15464 I. Comunidad Autónoma 3. Otras disposiciones Consejería de Agricultura y Agua 5567 Orden de 28 de marzo de 2012 de la Consejería de Agricultura y Agua, por la que se establece la convocatoria
Página 15464 I. Comunidad Autónoma 3. Otras disposiciones Consejería de Agricultura y Agua 5567 Orden de 28 de marzo de 2012 de la Consejería de Agricultura y Agua, por la que se establece la convocatoria
TEXTO. REGISTRO BOMEH: 1/2016 PUBLICADO EN: BOE n.º 312, de 30 de diciembre de 2015.
 TÍTULO: Orden HAP/2835/2015, de 28 de diciembre, por la que se aprueba el modelo 113 de comunicación de datos relativos a las ganancias patrimoniales por cambio de residencia cuando se produzca a otro
TÍTULO: Orden HAP/2835/2015, de 28 de diciembre, por la que se aprueba el modelo 113 de comunicación de datos relativos a las ganancias patrimoniales por cambio de residencia cuando se produzca a otro
En función del tipo de producto elaborado pueden ser aplicables, de forma adicional, otras normas.
 1/5 Y MEDIO AMBIENTE DIRECCIÓN GENERAL DE PRODUCCIONES Y MERCADOS AGRARIOS COMISION NACIONAL DE COORDINACIÓN EN MATERIA DE ALIMENTACIÓN ANIMAL ACUERDO DE LA COMISIÓN NACIONAL EN MATERIA DE ALIMENTACIÓN
1/5 Y MEDIO AMBIENTE DIRECCIÓN GENERAL DE PRODUCCIONES Y MERCADOS AGRARIOS COMISION NACIONAL DE COORDINACIÓN EN MATERIA DE ALIMENTACIÓN ANIMAL ACUERDO DE LA COMISIÓN NACIONAL EN MATERIA DE ALIMENTACIÓN
DIRECTRICES SOBRE LA HERRAMIENTA DE SEGREGACIÓN DE ACTIVOS EBA/GL/2015/ Directrices
 EBA/GL/2015/05 07.08.2015 Directrices sobre la determinación de cuándo podría la liquidación de los activos o pasivos con arreglo a los procedimientos de insolvencia ordinarios influir negativamente en
EBA/GL/2015/05 07.08.2015 Directrices sobre la determinación de cuándo podría la liquidación de los activos o pasivos con arreglo a los procedimientos de insolvencia ordinarios influir negativamente en
Reglamento (Euratom) nº 1493/93 del Consejo, de 8 de junio de 1993, relativo a. a los traslados de sustancias radiactivas entre los Estados miembros
 Reglamento (Euratom) nº 1493/93 del Consejo, de 8 de junio de 1993, relativo a los traslados de sustancias radiactivas entre los Estados miembros Diario Oficial n L 148 de 19/06/1993 P. 0001-0007 REGLAMENTO
Reglamento (Euratom) nº 1493/93 del Consejo, de 8 de junio de 1993, relativo a los traslados de sustancias radiactivas entre los Estados miembros Diario Oficial n L 148 de 19/06/1993 P. 0001-0007 REGLAMENTO
Memoria de Vigilancia de células y tejidos. Organización Nacional de Trasplantes
 Memoria de Vigilancia de células y tejidos Organización Nacional de Trasplantes Año 2014 En mayo de 2008 la Comisión de Trasplantes del Consejo Interterritorial aprobó por primera vez un sistema común
Memoria de Vigilancia de células y tejidos Organización Nacional de Trasplantes Año 2014 En mayo de 2008 la Comisión de Trasplantes del Consejo Interterritorial aprobó por primera vez un sistema común
PREVENCIÓN DE RIESGOS LABORALES vs PROTECCION DE DATOS DE CARÁCTER PERSONAL
 PREVENCIÓN DE RIESGOS LABORALES vs PROTECCION DE DATOS DE CARÁCTER PERSONAL NORMATIVA REGULADORA EN MATERIA DE PROTECCION DE DATOS DE CARÁCTER PERSONAL Ley Orgánica 15/1999, de 13 de diciembre. Transposición
PREVENCIÓN DE RIESGOS LABORALES vs PROTECCION DE DATOS DE CARÁCTER PERSONAL NORMATIVA REGULADORA EN MATERIA DE PROTECCION DE DATOS DE CARÁCTER PERSONAL Ley Orgánica 15/1999, de 13 de diciembre. Transposición
BOLETÍN OFICIAL DEL ESTADO
 Núm. 257 Jueves 23 de octubre de 2014 Sec. I. Pág. 85903 I. DISPOSICIONES GENERALES MINISTERIO DE ECONOMÍA Y COMPETITIVIDAD 10744 Orden ECC/1936/2014, de 16 de octubre, por la que se dictan normas de control
Núm. 257 Jueves 23 de octubre de 2014 Sec. I. Pág. 85903 I. DISPOSICIONES GENERALES MINISTERIO DE ECONOMÍA Y COMPETITIVIDAD 10744 Orden ECC/1936/2014, de 16 de octubre, por la que se dictan normas de control
Programa de seguridad en atención en salud Del Compromiso de Gestión N 8 a la Ley
 Programa de seguridad en atención en salud Del Compromiso de Gestión N 8 a la Ley 20.584 Enf. Mat. Andrica Bustos Muñoz Depto. Calidad y Seguridad del Paciente Subsecretaría de Redes Asistenciales Ministerio
Programa de seguridad en atención en salud Del Compromiso de Gestión N 8 a la Ley 20.584 Enf. Mat. Andrica Bustos Muñoz Depto. Calidad y Seguridad del Paciente Subsecretaría de Redes Asistenciales Ministerio
ES Diario Oficial de la Unión Europea L 157/ 33. DIRECTIVA 2004/41/CE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 21 de abril de 2004
 30.4.2004 ES Diario Oficial de la Unión Europea L 57/ 33 DIRECTIVA 2004/4/CE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 2 de abril de 2004 por la que se derogan determinadas directivas que establecen las
30.4.2004 ES Diario Oficial de la Unión Europea L 57/ 33 DIRECTIVA 2004/4/CE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 2 de abril de 2004 por la que se derogan determinadas directivas que establecen las
1/2005, de 9 de marzo, por la que se regula el régimen de comercio de derechos de emisión de gases de efecto invernadero.
 Real Decreto X/X de DD de MM, por el que se establecen las normas básicas que han de regir los sistemas de acreditación y verificación de las emisiones de gases de efecto invernadero y los datos toneladas-kilómetro
Real Decreto X/X de DD de MM, por el que se establecen las normas básicas que han de regir los sistemas de acreditación y verificación de las emisiones de gases de efecto invernadero y los datos toneladas-kilómetro
Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico.
 Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico. Dr. Eduardo Fernández Quintana Centro de Farmacovigilancia e Información Terapéutica de Canarias de Canarias.
Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico. Dr. Eduardo Fernández Quintana Centro de Farmacovigilancia e Información Terapéutica de Canarias de Canarias.
PROCEDIMIENTO DE CONDICIONES DE ALMACENAMIENTO Y TRANSPORTE DE COMPONENTES SANGUÍNEOS
 Páginas: 1 de 8 PROCEDIMIENTO DE CONDICIONES DE ALMACENAMIENTO Y TRANSPORTE DE COMPONENTES SANGUÍNEOS Elaborado por: Revisado por: Aprobado por: T.M. Mauricio Gutiérrez Cea Encargado TM. Carlos Figueroa
Páginas: 1 de 8 PROCEDIMIENTO DE CONDICIONES DE ALMACENAMIENTO Y TRANSPORTE DE COMPONENTES SANGUÍNEOS Elaborado por: Revisado por: Aprobado por: T.M. Mauricio Gutiérrez Cea Encargado TM. Carlos Figueroa
REAL DECRETO 1799/2003, DE 26 DE DICIEMBRE, POR EL QUE SE REGULA EL CONTENIDO DE LAS LISTAS ELECTORALES Y DE LAS COPIAS DEL CENSO ELECTORAL
 REAL DECRETO 1799/2003, DE 26 DE DICIEMBRE, POR EL QUE SE REGULA EL CONTENIDO DE LAS LISTAS ELECTORALES Y DE LAS COPIAS DEL CENSO ELECTORAL Texto vigente desde 8 de febrero de 2009 JUNTA ELECTORAL CENTRAL
REAL DECRETO 1799/2003, DE 26 DE DICIEMBRE, POR EL QUE SE REGULA EL CONTENIDO DE LAS LISTAS ELECTORALES Y DE LAS COPIAS DEL CENSO ELECTORAL Texto vigente desde 8 de febrero de 2009 JUNTA ELECTORAL CENTRAL
Programa Subregional de Farmacovigilancia de Centroamérica y República Dominicana
 Programa Subregional de Farmacovigilancia de Centroamérica y Alerta Informativa No. 05/2016 RIESGO DE CONTAMINACIÓN CRUZADA CON CEFALOSPORINAS DE VARIOS MEDICAMENTOS FABRICADOS POR LABORATORIOS NORMON,
Programa Subregional de Farmacovigilancia de Centroamérica y Alerta Informativa No. 05/2016 RIESGO DE CONTAMINACIÓN CRUZADA CON CEFALOSPORINAS DE VARIOS MEDICAMENTOS FABRICADOS POR LABORATORIOS NORMON,
INGURUMEN, LURRALDE DEPARTAMENTO DE MEDIO AMBIENTE,
 INGURUMEN, LURRALDE DEPARTAMENTO DE MEDIO AMBIENTE, Ó PLIEGO DE PRESCRIPCIONES TECNICAS PARA EL SUMINISTRO, INSTALACION Y MANTENIMIENTO DE DOS LOTES DE EQUIPOS, PARA LA RED AUTOMATICA DE CONTROL Y VIGILANCIA
INGURUMEN, LURRALDE DEPARTAMENTO DE MEDIO AMBIENTE, Ó PLIEGO DE PRESCRIPCIONES TECNICAS PARA EL SUMINISTRO, INSTALACION Y MANTENIMIENTO DE DOS LOTES DE EQUIPOS, PARA LA RED AUTOMATICA DE CONTROL Y VIGILANCIA
: BOMEH: PUBLICADO EN:
 TÍTULO: Orden HAP/214/2016, de 18 de febrero, por la que se aprueba la relación de valores negociados en mercados organizados, con su valor de negociación medio correspondiente al cuarto trimestre de 2015,
TÍTULO: Orden HAP/214/2016, de 18 de febrero, por la que se aprueba la relación de valores negociados en mercados organizados, con su valor de negociación medio correspondiente al cuarto trimestre de 2015,
Etiquetado de alimentos envasados por titulares del comercio al por menor
 Subdirección General de Salud Pública Consulta Consulta: Número: Inf14059 Etiquetado de alimentos envasados por titulares del comercio al por menor Informe de fecha 28/07/2014 actualizado el 17/10/16 I
Subdirección General de Salud Pública Consulta Consulta: Número: Inf14059 Etiquetado de alimentos envasados por titulares del comercio al por menor Informe de fecha 28/07/2014 actualizado el 17/10/16 I
L 329/26 Diario Oficial de la Unión Europea (Actos cuya publicación no es una condición para su aplicabilidad) COMISIÓN
 L 329/26 Diario Oficial de la Unión Europea 25.11.2006 II (Actos cuya publicación no es una condición para su aplicabilidad) COMISIÓN DECISIÓN DE LA COMISIÓN de 17 de noviembre de 2006 que modifica la
L 329/26 Diario Oficial de la Unión Europea 25.11.2006 II (Actos cuya publicación no es una condición para su aplicabilidad) COMISIÓN DECISIÓN DE LA COMISIÓN de 17 de noviembre de 2006 que modifica la
Real Decreto 183/2004, de 30 enero SUMARIO
 (Disposición Vigente) Real Decreto 183/2004, de 30 enero RCL 2004\366 SANIDAD. Regula la tarjeta sanitaria individual. MINISTERIO SANIDAD Y CONSUMO BOE 12 febrero 2004, núm. 37, [pág. 6386] - Sumario -
(Disposición Vigente) Real Decreto 183/2004, de 30 enero RCL 2004\366 SANIDAD. Regula la tarjeta sanitaria individual. MINISTERIO SANIDAD Y CONSUMO BOE 12 febrero 2004, núm. 37, [pág. 6386] - Sumario -
XV JORNADAS MEDICINA TRANSFUSIONAL
 XV JORNADAS MEDICINA TRANSFUSIONAL Dr. GARCIA GALA Coordinador Hemovigilancia Asturias 16-17 MAYO 2013 HEMOVIGILANCIA ACTIVIDADES GHAS NOTIFICACIONES PROPUESTAS La hemovigilancia incluye la detección,
XV JORNADAS MEDICINA TRANSFUSIONAL Dr. GARCIA GALA Coordinador Hemovigilancia Asturias 16-17 MAYO 2013 HEMOVIGILANCIA ACTIVIDADES GHAS NOTIFICACIONES PROPUESTAS La hemovigilancia incluye la detección,
EVOLUCIÓN DE LOS REGÍMENES DE REPARACIÓN DE DAÑOS POR PRODUCTOS DEFECTUOSOS EN EUROPA DESDE LA EXPERIENCIA EN CATALUÑA
 EVOLUCIÓN DE LOS REGÍMENES DE REPARACIÓN DE DAÑOS POR PRODUCTOS DEFECTUOSOS EN EUROPA DESDE LA EXPERIENCIA EN CATALUÑA ALFONS CONESA I BADIELLA DIRECTOR Agència Catalana del Consum Generalitat de Catalunya
EVOLUCIÓN DE LOS REGÍMENES DE REPARACIÓN DE DAÑOS POR PRODUCTOS DEFECTUOSOS EN EUROPA DESDE LA EXPERIENCIA EN CATALUÑA ALFONS CONESA I BADIELLA DIRECTOR Agència Catalana del Consum Generalitat de Catalunya
MINISTERIO DE SANIDAD Y CONSUMO
 31288 Martes 20 septiembre 2005 BOE núm. 225 MINISTERIO DE SANIDAD Y CONSUMO 15514 REAL DECRETO 1088/2005, de 16 de septiembre, por el que se establecen los requisitos técnicos y condiciones mínimas de
31288 Martes 20 septiembre 2005 BOE núm. 225 MINISTERIO DE SANIDAD Y CONSUMO 15514 REAL DECRETO 1088/2005, de 16 de septiembre, por el que se establecen los requisitos técnicos y condiciones mínimas de
EL PORTAL DE INFORMACIÓN REACH y CLP
 EL Jornada Técnica sobre el Reglamento CLP Madrid, 25 de marzo de 2010 Patricia López Mancisidor EL PORTAL DE INFORMACIÓN REACH Y CLP NOTIFICACIÓN DE SUSTANCIAS EL PORTAL DE INFORMACIÓN REACH Y CLP Objetivos
EL Jornada Técnica sobre el Reglamento CLP Madrid, 25 de marzo de 2010 Patricia López Mancisidor EL PORTAL DE INFORMACIÓN REACH Y CLP NOTIFICACIÓN DE SUSTANCIAS EL PORTAL DE INFORMACIÓN REACH Y CLP Objetivos
COLEGIO TERRIT. DE ADMINISTRADORES DE FINCAS DE EXTREMADURA
 15601 COLEGIO TERRIT. DE ADMINISTRADORES DE FINCAS DE EXTREMADURA ACUERDO de 9 de mayo de 2014 sobre modificación y creación de ficheros de datos de carácter personal de titularidad pública. (2014AC0004)
15601 COLEGIO TERRIT. DE ADMINISTRADORES DE FINCAS DE EXTREMADURA ACUERDO de 9 de mayo de 2014 sobre modificación y creación de ficheros de datos de carácter personal de titularidad pública. (2014AC0004)
CONSEJERÍA DE SALUD MANIPULADORES DE ALIMENTOS SITUACIÓN ACTUAL. Secretaría General de Salud Pública y Participación.
 CONSEJERÍA DE SALUD MANIPULADORES DE ALIMENTOS SITUACIÓN ACTUAL Secretaría General de Salud Pública y Participación. Sevilla, mayo 2011 1 ESTADO DE SITUACION Y ELEMENTOS A CONSIDERAR EN EL NUEVO MARCO
CONSEJERÍA DE SALUD MANIPULADORES DE ALIMENTOS SITUACIÓN ACTUAL Secretaría General de Salud Pública y Participación. Sevilla, mayo 2011 1 ESTADO DE SITUACION Y ELEMENTOS A CONSIDERAR EN EL NUEVO MARCO
LA LOGISTICA INVERSA DEL MEDICAMENTO
 PRIMER FORO INTERNACIONAL PILOT LA LOGISTICA INVERSA DEL MEDICAMENTO Ramón Arnal Presidente Grupo Safa Zaragoza, 8 de mayo de 2001 Cadena del medicamento LABORATORIOS 368 HOSPITALES 782 MÉDICOS 171.494
PRIMER FORO INTERNACIONAL PILOT LA LOGISTICA INVERSA DEL MEDICAMENTO Ramón Arnal Presidente Grupo Safa Zaragoza, 8 de mayo de 2001 Cadena del medicamento LABORATORIOS 368 HOSPITALES 782 MÉDICOS 171.494
BOLETÍN OFICIAL DEL ESTADO
 Núm. 258 Miércoles 26 de octubre de 2011 Sec. I. Pág. 111503 I. DISPOSICIONES GENERALES MINISTERIO DE ECONOMÍA Y HACIENDA 16749 Real Decreto 1359/2011, de 7 de octubre, por el que se aprueba la relación
Núm. 258 Miércoles 26 de octubre de 2011 Sec. I. Pág. 111503 I. DISPOSICIONES GENERALES MINISTERIO DE ECONOMÍA Y HACIENDA 16749 Real Decreto 1359/2011, de 7 de octubre, por el que se aprueba la relación
BOLETÍN OFICIAL DE LA COMUNIDAD DE MADRID
 B.O.C.M. Núm. 151 LUNES 27 DE JUNIO DE 2016 Pág. 111 I. COMUNIDAD DE MADRID C) Otras Disposiciones Consejería de Economía, Empleo y Hacienda 19 RESOLUCIÓN de 8 de junio de 2016, de la Dirección General
B.O.C.M. Núm. 151 LUNES 27 DE JUNIO DE 2016 Pág. 111 I. COMUNIDAD DE MADRID C) Otras Disposiciones Consejería de Economía, Empleo y Hacienda 19 RESOLUCIÓN de 8 de junio de 2016, de la Dirección General
DECISION 780. Creación y Actualización del Sistema de Registros Estadísticos en los Países Miembros de la Comunidad Andina
 DECISION 780 Creación y Actualización del Sistema de Registros Estadísticos en los Países Miembros de la Comunidad Andina LA COMISIÓN DE LA COMUNIDAD ANDINA, VISTOS: Los Artículos 3, 51 y 54 del Acuerdo
DECISION 780 Creación y Actualización del Sistema de Registros Estadísticos en los Países Miembros de la Comunidad Andina LA COMISIÓN DE LA COMUNIDAD ANDINA, VISTOS: Los Artículos 3, 51 y 54 del Acuerdo
FUNCIONES DEL CCAES MARCO NORMATIVO. Marta Cortés García. Madrid, 20 Noviembre 2012
 FUNCIONES DEL CCAES MARCO NORMATIVO Marta Cortés García Madrid, 20 Noviembre 2012 Qué es el CCAES? El Centro de Coordinación de Alertas y Emergencias Sanitarias, creado en el año 2004, es un Centro dependiente
FUNCIONES DEL CCAES MARCO NORMATIVO Marta Cortés García Madrid, 20 Noviembre 2012 Qué es el CCAES? El Centro de Coordinación de Alertas y Emergencias Sanitarias, creado en el año 2004, es un Centro dependiente
ÁREA DERECHO TRIBUTARIO.
 ÁREA DERECHO TRIBUTARIO. OBLIGACIÓN DE INFORMACIÓN PAÍS POR PAÍS (COUNTRY BY COUNTRY REPORTING) El Reglamento del Impuesto sobre Sociedades (RIS), aprobado mediante el Real Decreto 634/2015, de 10 de julio,
ÁREA DERECHO TRIBUTARIO. OBLIGACIÓN DE INFORMACIÓN PAÍS POR PAÍS (COUNTRY BY COUNTRY REPORTING) El Reglamento del Impuesto sobre Sociedades (RIS), aprobado mediante el Real Decreto 634/2015, de 10 de julio,
INFORME RESUMIDO SOBRE TRAZABILIDAD ALIMENTARIA
 INFORME RESUMIDO SOBRE TRAZABILIDAD ALIMENTARIA Texto de la Agencia Española de Seguridad Alimentaria. Ministerio de Sanidad y Consumo. Reglamento 178/2002 del Parlamento Europeo. Especial mención al punto
INFORME RESUMIDO SOBRE TRAZABILIDAD ALIMENTARIA Texto de la Agencia Española de Seguridad Alimentaria. Ministerio de Sanidad y Consumo. Reglamento 178/2002 del Parlamento Europeo. Especial mención al punto
INTERVENCIÓN SANITARIA EN SITUACIONES DE RIESGO PARA LA SALUD PÚBLICA
 INTERVENCIÓN SANITARIA EN SITUACIONES DE RIESGO PARA LA SALUD PÚBLICA Noviembre 2013 DIRECCION GENERAL SALUD PUBLICA, CALIDAD E INNOVACIÓN Intervención Sanitaria en Situaciones de riesgo para la Salud
INTERVENCIÓN SANITARIA EN SITUACIONES DE RIESGO PARA LA SALUD PÚBLICA Noviembre 2013 DIRECCION GENERAL SALUD PUBLICA, CALIDAD E INNOVACIÓN Intervención Sanitaria en Situaciones de riesgo para la Salud
Procedimiento de Revisión por la Dirección del Sistema de Gestión Integral
 Página: 1 de 1 Hoja de Control de Emisión y Revisiones. N de Revisión Páginas Afectadas Motivo del Cambio Aplica a partir de: 0 Todas Generación de documento 15-Agosto-2009 1 Todas Mejora del documento
Página: 1 de 1 Hoja de Control de Emisión y Revisiones. N de Revisión Páginas Afectadas Motivo del Cambio Aplica a partir de: 0 Todas Generación de documento 15-Agosto-2009 1 Todas Mejora del documento
