LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (I)
|
|
|
- Óscar Márquez Venegas
- hace 5 años
- Vistas:
Transcripción
1 LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (I) Se va a emplear la fotografía digital, para estudiar la electrólisis de disoluciones salinas y la migración de iones a los electrodos. Se necesita una fuente de corriente continua, que podemos montar con dos pilas de 4,5 voltios conectadas en serie, dos electrodos inertes de grafito o acero, o simplemente unos clips, que se pueden enganchar en las cubetas o dos minas de lápices negros, cables de conexión, unas cajas petri o cubetitas, tal como muestra la foto ( fig.1). Fig.1 Dado que en el proceso electroquímico se produce la migración de iones H + y OH - y su posible descarga en los electrodos, para poner de manifiesto, la mayor concentración de alguno de ellos en la disolución, necesitaremos un indicador ácido base. Los aquí empleados, para el reconocimiento en pantalla, son la fenolftaleína, si debemos identificar una mayor concentración de iones OH - y el azul de bromotimol, para reseñar la mayor concentración de H +. Pero si no disponemos de ellos también se pueden usar indicadores naturales (véase el tema Indicadores ácido base I), o rojo de metilo, verde de metilo y violeta de metilo. Se va a utilizar en este primer trabajo disoluciones de yoduro potásico, yodato potásico y bromuro sódico. En las disoluciones aparecerán los iones de la sal, así como los iones H + y OH -. El que se descarguen unos u otros en los electrodos, dependerá del trabajo útil necesario para hacerlo; siempre se descargará primero, el que necesite menos trabajo, lo cual, dejando aparte fenómenos secundarios (sobretensiones 1, solvataciones, reacciones anómalas etc), que afectan fundamentalmente a los iones H + y OH -, dependerá de los potenciales normales de reducción de las distintas formas y será regulado por la ecuación de Nernst. De esta manera se pueden ordenar los iones en sus respectivas carreras hacia los electrodos, por su mayor facilidad de descarga. Si cubrimos unos milímetros del fondo de la caja Petri con una disolución diluida de KI, en la disolución aparecerán los iones K +, H +, I - y OH -. De acuerdo con lo enunciado antes, en el ánodo, se descarga primero el ion yoduro, según el proceso: En el ánodo (+) : 2I - - 2e = I 2 (s) 1 El aumento de tensión depende también de los electrodos empleados, de la densidad de corriente, y es muy sensible especialmente a la producción de gases.
2 En el cátodo (-): 2H + +2e = H 2 (g) El K + no se descargar, por lo que en disolución surge un exceso de OH - respecto de los iones H +, que se puede caracterizar por un aumento del ph, lo cual podrá provocar la aparición del color rojo violáceo de la fenolftaleína. En el entorno de los electrodos, se modifica instantáneamente la concentración de H + y OH - (inicialmente el ph sería 7). La desaparición de H + al descargarse en el cátodo hace que en esa zona aumente especialmente la concentración de iones OH - Los procesos se podrían explicar, a un nivel elemental, con el dibujo de la figura 2, que corresponde al esquema a los iones que existen al principio en la disolución, indicando las flechas, aquéllos, que según los procesos redox, se descargarán. El indicador fenolftaleína, actuará como chivato, en aquellas zonas cuyo ph suba de 10 (vira de incoloro a rojizovioláceo a ph>10). Los procesos que tienen lugar, sin embargo, son más complicados, como lo demuestra la fotografía digital. En la primera foto del proceso (fig.3) se observa el desprendimiento de burbujas de hidrógeno en el electrodo negativo, a partir de la reducción del H +. Este hecho provoca la disminución de concentración de iones H +. Por ese motivo la disolución con una gota de fenolftaleína, comienza en esta zona a tomar color rojizo-violeta (fig.4) 2. Fig.2. Fig.3 Fig.4 En el ánodo, se formará yodo molecular, pero realmente no se encuentra en esta disposición, ya que se vería su color pardo violeta característico. Como es muy soluble en KI, forma en esa disolución complejos KI 3 y KI 5 (este último se podría reconocer con disolución de almidón, ya que se introduce en el hueco helicoidal que forma la amilosa, produciendo un complejo con un color azul oscuro), pero realmente no lo hacemos porque su color y olor son característicos por si mismos. 2 Las figuras 3 y 4, son sucesivas, aunque se hayan movido los terminales de los electrodos, y no lo parezcan
3 El detalle de los procesos en el cátodo y en el ánodo (sin indicador), están recogidos en las fotos siguientes (fig.5 y 6). Estas fotos están hechas con electrodos de grafito en un montaje de mayor precisión. Fig.5 Fig.6 En el detalle de la figura 6, se observa en el ánodo, aparte de la formación del yodo, el desprendimiento de burbujas. Una posible interpretación de la aparición de esas burbujas podría ser a que con posterioridad a la aparición del yodo, también se produce O 2, lo que supondría la realización del siguiente proceso: OH - -2e- = ½ O 2 (gas) + H + El cual a su vez provocará un aumento de la concentración de H +, en dicha zona, que posteriormente se verá neutralizada por el mayor aumento de la concentración de OH -. La difusión de los iones OH -, hace que el color de la fenoltaleína se extienda por toda la disolución (fig.7 y 8) Fig.7 Fig.8 Finalmente la zona de los electrodos (cátodo y ánodo) queda conforme a los detalles que aparecen en las figuras 9 y 10, (hechas con electrodos de grafito) y después de homogenizar ligeramente la disolución.
4 Fig.9 Fig.10 Naturalmente el color del indicador (fenolftaleína), con el propio color del KI 3 al mezclarse, enmascara muchos procesos secundarios, por eso, se ha realizado una nueva electrolisis sin indicador, y además se reduce a 4,5V la diferencia de potencial entre los electrodos. Los resultados se observan en los detalles de la figura 11 (cátodo) y en la 12 (ánodo). En esta nueva electrolisis se ha empleado un cátodo de acero inoxidable. Fig.11 Fig.12 Se aprecia, una pérdida de color en marrón rojizo del KI 3, debido a que este compuesto en medio básico, experimenta un proceso redox de desproporción: 3I 3 - (aq) + 6OH - (aq) IO 3 - (aq) + 8I - (aq)+ 3H 2 O(L) Tanto el yodato como el yoduro son incoloros, por eso el marrón rojizo, amarillea. Si se emplea azul de bromotimol como indicador (vira del amarillo al azul a ph básico), los resultados son muy espectaculares, porque no domina tanto una tonalidad como cuando se usaba la fenolftaleína (fig 13 y 14)
5 Fig.13 Fig.14 ELECTRÓLISIS DEL YODATO POTÁSICO Si el mismo proceso lo efectuamos con una disolución de yodato potásico, el yodato, que es un ion muy voluminoso no se descarga tan fácilmente como ocurría con el yoduro; así que en el ánodo lo hace el ion OH -, en el cátodo se descarga el ion H +, tal como ocurría antes, según los procesos: Ánodo : OH - -2e- = ½ O 2 (gas) + H + Cátodo: 2H + + 2e = H 2 (g) Por lo tanto mientras que en el ánodo disminuye la concentración de OH - (ph ácido), en el cátodo aumenta dicha concentración (ph básico), por lo que la fenolftaleína sólo virará en el entorno del cátodo. Las fotos que reflejan los procesos son las siguientes (fig.15 y 16) Fig.15 Fig.16 Se puede comparar y ver las diferencias entre la electrólisis del yoduro potásico y la del yodato potásico. En ésta se desprenden en los electrodos inicialmente hidrógeno y oxígeno, mientras que en la anterior el desprendimiento de oxígeno era anómalo. Igualmente en ésta, el medio básico se circunscribe al entorno del cátodo, mientras que en aquella la disolución final era marcadamente básica.
6 ELECTRÓLISIS DEL BROMURO SÓDICO La electrólisis del bromuro sódico es similar a la del yoduro, con la salvedad de que el bromuro al descargarse y producir bromo, su aparición es menos llamativa que la del yodo. El proceso se esquematiza en el dibujo de la figura17. Los procesos redox serían: En el ánodo: 2Br - (aq) -2e = Br 2 (L) En el cátodo: 2H + (aq) + 2e = H 2 (g) En la disolución quedarían los iones Na + y OH - Para determinar la variación del ph en las inmediaciones del ánodo se puede emplear la fenolftaleína (las fotos digitales que siguen el proceso, serían las de las figuras 18 y 19, por este orden) o el Fig.17 azul de bromotimol que vira a azul en medio básico (fotos 20, 21 y 22). En esta última se aprecia un cambio de color a verde, posiblemente por reacción del bromo con el propio indicador o por combinación de sus colores característicos según el ph. Fig.18 Fig.19 Fig.20 Fig.21
7 Fig.22 También se observa en el ánodo, el desprendimiento de burbujas, como ocurría en le caso del KI, y que atribuimos a la formación de O 2
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (II)
 LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (II) Se van a presentar tres electrólisis en diferentes condiciones y con distintos electrodos, a fin de observar la influencia de estas condiciones en sus resultados
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (II) Se van a presentar tres electrólisis en diferentes condiciones y con distintos electrodos, a fin de observar la influencia de estas condiciones en sus resultados
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (V)
 LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (V) Se va a presentar la electrólisis de sales de elementos pesados con diferentes aniones a fin de observar la electrodeposición de estos metales, si la hubiere.
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (V) Se va a presentar la electrólisis de sales de elementos pesados con diferentes aniones a fin de observar la electrodeposición de estos metales, si la hubiere.
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (III)
 LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (III) Se va a presentar la electrólisis de sales de elementos del mismo grupo (el 12), con diferentes aniones a fin de observar la electrodeposición de estos metales.
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (III) Se va a presentar la electrólisis de sales de elementos del mismo grupo (el 12), con diferentes aniones a fin de observar la electrodeposición de estos metales.
REACCIONES REDOX CON DICROMATO POTÁSICO
 REACCIONES REDOX CON DICROMATO POTÁSICO Se han comenzado los trabajos de Química a la gota con las reacciones redox del permanganato potásico, un oxidante característico y visualmente muy interesante por
REACCIONES REDOX CON DICROMATO POTÁSICO Se han comenzado los trabajos de Química a la gota con las reacciones redox del permanganato potásico, un oxidante característico y visualmente muy interesante por
ELECTRÓLISIS DEL SULFATO DE CINC: EFECTO DE LA CONCENTRACIÓN
 ELECTRÓLISIS DEL SULFATO DE CINC: EFECTO DE LA CONCENTRACIÓN ELECTRÓLISIS DEL SULFATO DE CINC(II) La electrólisis del sulfato de cinc se ha estudiado desde el punto de vista cualitativo, ahora se va a
ELECTRÓLISIS DEL SULFATO DE CINC: EFECTO DE LA CONCENTRACIÓN ELECTRÓLISIS DEL SULFATO DE CINC(II) La electrólisis del sulfato de cinc se ha estudiado desde el punto de vista cualitativo, ahora se va a
, mientras que en el cátodo: 2H + + 2e H, lo
 Redox 8 141*. Las primeras electrólisis fueran realizadas por el inglés Humphrey Davy, a principios del siglo XIX, tan pronto se desarrollaron las pilas de Volta, y se realizaron en sólidos fundidos. Para
Redox 8 141*. Las primeras electrólisis fueran realizadas por el inglés Humphrey Davy, a principios del siglo XIX, tan pronto se desarrollaron las pilas de Volta, y se realizaron en sólidos fundidos. Para
ELECTROLISIS DEL CLORURO DE ESTAÑO(II) Fotografía 1
 ELECTROLISIS DEL CLORURO DE ESTAÑO(II) Introducción En esta web, en la sección de Química a la gota y en el apartado electrolisis salinas V (ubicada en el almacén) se ha expuesto, mediante fotografía digital,
ELECTROLISIS DEL CLORURO DE ESTAÑO(II) Introducción En esta web, en la sección de Química a la gota y en el apartado electrolisis salinas V (ubicada en el almacén) se ha expuesto, mediante fotografía digital,
OXIDACIÓN-REDUCCIÓN. PAU-tipos de problemas
 OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA - (TIPO I)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA - (TIPO I) Las preguntas de este tipo constan de un enunciado y de cuatro posibilidades de respuesta, entre las cuales debe escoger la que considere
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA - (TIPO I) Las preguntas de este tipo constan de un enunciado y de cuatro posibilidades de respuesta, entre las cuales debe escoger la que considere
-0,36-0,44 Zn 2+ +2e Zn -0,76 Mn 2+ +2e Mn -1,19 Al 3+ +3e Al -1,66 Mg 2+ +2e Mg -2,37 Na + +e Na -2,71 K + +e K -2,92 Li + +e Li -3,05
 Redox 8 141*. Las primeras electrólisis fueran realizadas por el inglés Humphrey Davy, a principios del siglo XIX, tan pronto se desarrollaron las pilas de Volta, y se realizaron en sólidos fundidos. Para
Redox 8 141*. Las primeras electrólisis fueran realizadas por el inglés Humphrey Davy, a principios del siglo XIX, tan pronto se desarrollaron las pilas de Volta, y se realizaron en sólidos fundidos. Para
OXIDACIÓN-REDUCCIÓN. PAU-tipos de problemas
 OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
EQUILIBRIO QUÍMICO 2
 EQUILIBRIO QUÍMICO 2 Los desplazamientos de equilibrio con la transferencia de energía. Termómetros químicos. Muchos de los intercambios de ligandos en la formación de complejos ocurren con absorción o
EQUILIBRIO QUÍMICO 2 Los desplazamientos de equilibrio con la transferencia de energía. Termómetros químicos. Muchos de los intercambios de ligandos en la formación de complejos ocurren con absorción o
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA. 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué?
 REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
Complejos del Co (continuación)
 Complejos del Co (continuación) Los compuestos de coordinación del cobalto(iii), que fueron los primeros estudiados, son difíciles de obtener, puesto que son menos estables que los de Co(II) vistos con
Complejos del Co (continuación) Los compuestos de coordinación del cobalto(iii), que fueron los primeros estudiados, son difíciles de obtener, puesto que son menos estables que los de Co(II) vistos con
PROBLEMA VISUALES DE QUÍMICA. PVQ14-1*** Aproximación al Número de Avogadro. Fotografía 2. Fotografía 1
 PROBLEMA VISUALES DE QUÍMICA PVQ1-1*** Aproximación al Número de Avogadro Fotografía Fotografía 1 Las fotografías dadas visualizan un experimento que popularizó Langmuir en 1919, para calcular aproximadamente
PROBLEMA VISUALES DE QUÍMICA PVQ1-1*** Aproximación al Número de Avogadro Fotografía Fotografía 1 Las fotografías dadas visualizan un experimento que popularizó Langmuir en 1919, para calcular aproximadamente
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS REACCIONES DE TRANSFERENCIA DE ELECTRONES
 CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS 2001-2012 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. El KMnO 4, en medio ácido sulfúrico, reacciona con el H 2 O 2 para dar MnSO
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS 2001-2012 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. El KMnO 4, en medio ácido sulfúrico, reacciona con el H 2 O 2 para dar MnSO
Redox 10. Fig.1. Fig.2
 Redox 10 Foto 1 Foto 2 181. Si se dispone una moneda de cobre, sobre una disolución de nitrato de plata (foto 1), los resultados se aprecian en la foto 2. Se ha obtenido lo que fue llamado un árbol de
Redox 10 Foto 1 Foto 2 181. Si se dispone una moneda de cobre, sobre una disolución de nitrato de plata (foto 1), los resultados se aprecian en la foto 2. Se ha obtenido lo que fue llamado un árbol de
Les remito la justificación económica y la memoria final correspondiente al proyecto de innovación docente
 Les remito la justificación económica y la memoria final correspondiente al proyecto de innovación docente ID2015/0131. Preparación de ácido nítrico a partir del aire ATENTAMENTE Emilio Rodríguez Fernández
Les remito la justificación económica y la memoria final correspondiente al proyecto de innovación docente ID2015/0131. Preparación de ácido nítrico a partir del aire ATENTAMENTE Emilio Rodríguez Fernández
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
PILAS Y ELECTRÓLISIS. Foto: Gabriel Acquistapace
 PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX
 TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva,
de todos los dados el correcto será el: a) A b) B c) C d) D
 Redox 3 41*. Uno de los experimentos que puedes hacer perfectamente en el laboratorio y que te permitiría recordar el proceso de la pila Daniell, sería sumergir una lámina o chapa de cinc en un vaso de
Redox 3 41*. Uno de los experimentos que puedes hacer perfectamente en el laboratorio y que te permitiría recordar el proceso de la pila Daniell, sería sumergir una lámina o chapa de cinc en un vaso de
Problemas de electrolisis. Resueltos
 Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA
 QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
REACCIONES DE OXIDACIÓN-REDUCCIÓN
 10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
Redox 7. la única correcta, sería la: a) A b)b c)c d)d
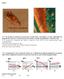 Redox 7 121*. En las fotos se muestra la reacción entre el ácido nítrico concentrado y el cobre, indicándose los productos de la reacción. La observación de las mismas y el ajuste correspondiente, te hará
Redox 7 121*. En las fotos se muestra la reacción entre el ácido nítrico concentrado y el cobre, indicándose los productos de la reacción. La observación de las mismas y el ajuste correspondiente, te hará
Física y Química 4º ESO: guía interactiva para la resolución de ejercicios
 REACCIONES QUÍMICAS Oxidación reducción. Pilas Física y Química º ESO: guía interactiva para la resolución de ejercicios I.E.S. Élaios Departamento de Física y Química EJERCICIO 1 Indica cuáles de las
REACCIONES QUÍMICAS Oxidación reducción. Pilas Física y Química º ESO: guía interactiva para la resolución de ejercicios I.E.S. Élaios Departamento de Física y Química EJERCICIO 1 Indica cuáles de las
ELECTROLISIS. QUÍMICA 2º bachillerato. 29/05/201
 ELECTROLISIS QUÍMICA 2º bachillerato 29/05/201 www.profesorjano.org www.profesorjano.com www.profesorjano.info 1 ESQUEMA GENERAL Definición - Diferencias con una pila (1) Descripción cualitativa: Electrolisis
ELECTROLISIS QUÍMICA 2º bachillerato 29/05/201 www.profesorjano.org www.profesorjano.com www.profesorjano.info 1 ESQUEMA GENERAL Definición - Diferencias con una pila (1) Descripción cualitativa: Electrolisis
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. Indique, razonadamente, si cada una de las siguientes transformaciones es una reacción de oxidación-reducción, identificando, en su caso, el agente oxidante
REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. Indique, razonadamente, si cada una de las siguientes transformaciones es una reacción de oxidación-reducción, identificando, en su caso, el agente oxidante
Reacciones de transferencia de electrones
 DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO Actividades tema 8 Reacciones de transferencia de electrones Reacciones de oxidación-reducción 1.-Asigna el número
DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO Actividades tema 8 Reacciones de transferencia de electrones Reacciones de oxidación-reducción 1.-Asigna el número
7º) En la tabla siguiente se indican los potenciales estándar de distintos pares en disolución acuosa: Fe2+/Fe = - 0,44 V Cu2+/Cu = 0,34 V
 EJERCICIOS DE OXIDACIÓN Y REDUCCIÓN 1º) Ajuste las siguientes ecuaciones iónicas, en medio ácido, por el método del ión-electrón: a) MnO4 + I Mn2+ + I2 b) VO43 + Fe2+ VO2+ + Fe3+ c) Cl2 + I Cl + I2 2º)
EJERCICIOS DE OXIDACIÓN Y REDUCCIÓN 1º) Ajuste las siguientes ecuaciones iónicas, en medio ácido, por el método del ión-electrón: a) MnO4 + I Mn2+ + I2 b) VO43 + Fe2+ VO2+ + Fe3+ c) Cl2 + I Cl + I2 2º)
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
COLEGIO DE BACHILLERES PLANTEL 5 SATÉLITE PRÁCTICAS DE LABORATORIO QUÍMICA II TERCER SEMESTRE
 COLEGIO DE BACHILLERES PLANTEL 5 SATÉLITE PRÁCTICAS DE LABORATORIO QUÍMICA II TERCER SEMESTRE PRACTICA # 1 CAMBIOS QUÍMICOS OBJETIVO DE LA PRÁCTICA: Identificar que los cambios químicos están acompañados
COLEGIO DE BACHILLERES PLANTEL 5 SATÉLITE PRÁCTICAS DE LABORATORIO QUÍMICA II TERCER SEMESTRE PRACTICA # 1 CAMBIOS QUÍMICOS OBJETIVO DE LA PRÁCTICA: Identificar que los cambios químicos están acompañados
Reacciones Redox. Química General e Inorgánica Ingeniería Ambiental
 Reacciones Redox Hasta esta guía hemos aprendido a balancear ecuaciones químicas sencillas por tanteo, pero muchas ecuaciones son demasiado complejas para que este procedimiento de balanceo por tanteo
Reacciones Redox Hasta esta guía hemos aprendido a balancear ecuaciones químicas sencillas por tanteo, pero muchas ecuaciones son demasiado complejas para que este procedimiento de balanceo por tanteo
Unidad 8 Reacciones de oxidaciónreducción
 Unidad 8 Reacciones de oxidaciónreducción 1. Reacciones de Oxidación: proceso por el cual un reductor pierde electrones. Reducción: proceso por el cual un oxidante gana electrones. 2 2. Número de oxidación
Unidad 8 Reacciones de oxidaciónreducción 1. Reacciones de Oxidación: proceso por el cual un reductor pierde electrones. Reducción: proceso por el cual un oxidante gana electrones. 2 2. Número de oxidación
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
NOTA CALI/ORDEN/PRES ORTOGRAFÍA PUNTUACIÓN EXPRESIÓN NOTA FINAL
 1.- Formule o nombre los compuestos siguientes: a) Nitrito de escandio b) Peróxido de plata c) Ácido 2-hidroxiprop-2-enoico d) NH 4 H 2 PO 4 e) Y(CN) 3 f) C H 2 =CHCON(CH 3 ) 2 Res. a) Sc(NO 2 ) 3 ; b)
1.- Formule o nombre los compuestos siguientes: a) Nitrito de escandio b) Peróxido de plata c) Ácido 2-hidroxiprop-2-enoico d) NH 4 H 2 PO 4 e) Y(CN) 3 f) C H 2 =CHCON(CH 3 ) 2 Res. a) Sc(NO 2 ) 3 ; b)
Laboratorio de Agroindustria II. Calidad de Leche
 Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
ELECTROQUÍMICA. 1. Conceptos de oxidación-reducción
 ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
ELECTRÓLISIS DEL AGUA FRANCISCO MORENO HUESO. 18 de noviembre de 2013
 18 de noviembre de 2013 Índice General 1 FUNDAMENTO TEÓRICO Índice General 1 FUNDAMENTO TEÓRICO 2 MATERIAL Y REACTIVOS Índice General 1 FUNDAMENTO TEÓRICO 2 MATERIAL Y REACTIVOS 3 PROCEDIMIENTO EXPERIMENTAL
18 de noviembre de 2013 Índice General 1 FUNDAMENTO TEÓRICO Índice General 1 FUNDAMENTO TEÓRICO 2 MATERIAL Y REACTIVOS Índice General 1 FUNDAMENTO TEÓRICO 2 MATERIAL Y REACTIVOS 3 PROCEDIMIENTO EXPERIMENTAL
Celda de combustible AFC casera
 Propuesta de construcción de pila de pila AFC casera: Se trata de conseguir producir la reacción electroquímica de manera económica y sencilla para obtener energía a partir de hidrógeno y oxígeno. Para
Propuesta de construcción de pila de pila AFC casera: Se trata de conseguir producir la reacción electroquímica de manera económica y sencilla para obtener energía a partir de hidrógeno y oxígeno. Para
QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS
 1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
TABLA DE CONTENIDOS. 1.1.El diclofenaco como contaminante medioambiental Procesos de tratamiento de aguas residuales 19
 TABLA DE CONTENIDOS 1.INTRODUCCIÓN 9 1.1.El diclofenaco como contaminante medioambiental. 17 1.2.Procesos de tratamiento de aguas residuales 19 1.2.1.Métodos físicos 19 1.2.2.Métodos biológicos 20 1.2.3.Métodos
TABLA DE CONTENIDOS 1.INTRODUCCIÓN 9 1.1.El diclofenaco como contaminante medioambiental. 17 1.2.Procesos de tratamiento de aguas residuales 19 1.2.1.Métodos físicos 19 1.2.2.Métodos biológicos 20 1.2.3.Métodos
OXIDACIÓN REDUCCIÓN QCA 09 ANDALUCÍA
 OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
ANDALUCÍA / JUNIO 03. LOGSE / QUÍMICA / OPCIÓN A / EXAMEN COMPLETO
 OPCIÓN A 1.- Formule o nombre los compuestos siguientes: a) peróxido de bario b) ácido clórico. c) 1,2- etanodiol. d) MnI 2. e) FeSO 4. f) CH h CH. 2.- Dado el elemento de Z= 19: a) Escriba su configuración
OPCIÓN A 1.- Formule o nombre los compuestos siguientes: a) peróxido de bario b) ácido clórico. c) 1,2- etanodiol. d) MnI 2. e) FeSO 4. f) CH h CH. 2.- Dado el elemento de Z= 19: a) Escriba su configuración
QUÍMICA Reactividad y equilibrio químico. Oxido - reducción. Tutora: Romina Saavedra
 QUÍMICA Reactividad y equilibrio químico Oxido - reducción Tutora: Romina Saavedra Balance de reacciones de óxido reducción Una reacción redox o de óxido reducción se caracteriza por la existencia de dos
QUÍMICA Reactividad y equilibrio químico Oxido - reducción Tutora: Romina Saavedra Balance de reacciones de óxido reducción Una reacción redox o de óxido reducción se caracteriza por la existencia de dos
RELACIÓN DE PROBLEMAS PROPUESTOS
 RELACIÓN DE PROBLEMAS PROPUESTOS 1) Una disolución con una concentración inicial 1 molar de ácido acético (ácido etanoico) tiene una concentración en equilibrio de ion hidronio, H 3 O +, 4,2.10 3 molar.
RELACIÓN DE PROBLEMAS PROPUESTOS 1) Una disolución con una concentración inicial 1 molar de ácido acético (ácido etanoico) tiene una concentración en equilibrio de ion hidronio, H 3 O +, 4,2.10 3 molar.
PILAS ELECTROQUÍMICAS
 PILAS ELECTROQUÍMICAS Las pilas electroquímicas se llaman también células galvánicas, células electroquímicas, pilas galvánicas, pilas voltaicas, pilas eléctricas o, simplemente, pilas. Como ya hemos visto,
PILAS ELECTROQUÍMICAS Las pilas electroquímicas se llaman también células galvánicas, células electroquímicas, pilas galvánicas, pilas voltaicas, pilas eléctricas o, simplemente, pilas. Como ya hemos visto,
UD 8. Aplicaciones de los equilibrios ácido-base
 UD 8. Aplicaciones de los equilibrios ácido-base 8.1 Efecto del ion común. 8.2 Disoluciones reguladoras del ph. 8.3 Sistemas reguladores biológicos. 8.4 Valoraciones ácido-base. 8.5 Indicadores ácido-base.
UD 8. Aplicaciones de los equilibrios ácido-base 8.1 Efecto del ion común. 8.2 Disoluciones reguladoras del ph. 8.3 Sistemas reguladores biológicos. 8.4 Valoraciones ácido-base. 8.5 Indicadores ácido-base.
Unidad 6: ELECTROQUIMICA
 Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
El punto final de una valoración o una titulación se puede determinar por varios procedimientos.
 IDENTIFICACION DE LOS PUNTOS FINALES El punto final de una valoración o una titulación se puede determinar por varios procedimientos. En una reacción analítica al analista le es importante encontrar lo
IDENTIFICACION DE LOS PUNTOS FINALES El punto final de una valoración o una titulación se puede determinar por varios procedimientos. En una reacción analítica al analista le es importante encontrar lo
Paso 2: Escribir las correspondientes semireacciones sin ajustar y. Paso 3: Ajustar en cada semireacción todos los elementos a
 Tema 21 21.1. Reacciones de oxidación-reducción Química y electricidad 21.2. Celdas electroquímicas 21.3. Potencial de electrodo 1 2 21.1. Reacciones de oxidación-reducción (redox) Son reacciones de transferencia
Tema 21 21.1. Reacciones de oxidación-reducción Química y electricidad 21.2. Celdas electroquímicas 21.3. Potencial de electrodo 1 2 21.1. Reacciones de oxidación-reducción (redox) Son reacciones de transferencia
Degradación electroquímica del diclofenaco en disolución acuosa 5. CONCLUSIONES
 5. CONCLUSIONES 88 5.1 BDD/Grafito: No se obtienen resultados reproducibles utilizando un cátodo de grafito. No se diferencian distintas tendencias de curva en proporción a la intensidad aplicada. En el
5. CONCLUSIONES 88 5.1 BDD/Grafito: No se obtienen resultados reproducibles utilizando un cátodo de grafito. No se diferencian distintas tendencias de curva en proporción a la intensidad aplicada. En el
REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015
 REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015 1- El permanganato de potasio actúa como oxidante en medio ácido, dando como producto Mn 2+. Por el contrario, como oxidante en medio básico el
REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015 1- El permanganato de potasio actúa como oxidante en medio ácido, dando como producto Mn 2+. Por el contrario, como oxidante en medio básico el
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA QUÍMICA TEMA 7: REACCIONES REDOX.
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 7: REACCIONES REDOX http://emestrada.wordpress.com Dada la siguiente reacción redox en disolución acuosa: KMnO + KI + HSO I + MnSO + K SO + HO
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 7: REACCIONES REDOX http://emestrada.wordpress.com Dada la siguiente reacción redox en disolución acuosa: KMnO + KI + HSO I + MnSO + K SO + HO
Electroquímica. Cátedra de Geoquímica
 Electroquímica Cátedra de Geoquímica 1 ELECTROQUÍMICA: Parte de la Química que estudia las reacciones en las que hay transferencia de electrones, conocidas como REDOX Dada una reacción: Identificar el
Electroquímica Cátedra de Geoquímica 1 ELECTROQUÍMICA: Parte de la Química que estudia las reacciones en las que hay transferencia de electrones, conocidas como REDOX Dada una reacción: Identificar el
Celdas Galvánicas y Electrolíticas
 Celdas Galvánicas y Electrolíticas Reacciones de óxido-reducción Reacciones en las cuales una o más de las sustancias intervinientes modifica su estado de oxidación. Znº (s) + Cu +2 (ac) Zn 2+ (ac) + Cuº
Celdas Galvánicas y Electrolíticas Reacciones de óxido-reducción Reacciones en las cuales una o más de las sustancias intervinientes modifica su estado de oxidación. Znº (s) + Cu +2 (ac) Zn 2+ (ac) + Cuº
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción A Reserva 3, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción A Reserva 3, Ejercicio 3, Opción
Capítulo 18 Electroquímica
 Capítulo 18 Electroquímica Adaptado por: Ileana Nieves Martínez Corriente Eléctrica Corriente (i) de agua cantidad de agua que pasa en un periodo de tiempo Eléctrica cantidad de carga eléctrica (Q) que
Capítulo 18 Electroquímica Adaptado por: Ileana Nieves Martínez Corriente Eléctrica Corriente (i) de agua cantidad de agua que pasa en un periodo de tiempo Eléctrica cantidad de carga eléctrica (Q) que
Grupo VII. Méndez Montes María José
 Grupo VII Méndez Montes María José Grupo VII Flúor Cloro Bromo Yodo Ástato Propiedades Como a los átomos sólo les falta un electrón para adquirir una configuración tipo gas noble, los elementos forman
Grupo VII Méndez Montes María José Grupo VII Flúor Cloro Bromo Yodo Ástato Propiedades Como a los átomos sólo les falta un electrón para adquirir una configuración tipo gas noble, los elementos forman
ACCIÓN CATALÍTICA EN LA DESCOMPOSICIÓN DEL PERÓXIDO DE HIDRÓGENO
 CATÁLISIS INTRODUCCIÓN. En los oscuros comienzos de la química, cuando ésta era tan sólo alquimia, existía la creencia de que las transformaciones de la materia, se podían avivar por determinadas sustancias,
CATÁLISIS INTRODUCCIÓN. En los oscuros comienzos de la química, cuando ésta era tan sólo alquimia, existía la creencia de que las transformaciones de la materia, se podían avivar por determinadas sustancias,
TEMA-11 Electroquímica
 QUÍMICA I TEMA-11 Electroquímica Tecnólogo en Minería 1 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos químicos 2 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos
QUÍMICA I TEMA-11 Electroquímica Tecnólogo en Minería 1 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos químicos 2 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos
Tema 9: Electroquímica
 1.Dado el siguiente diagrama de una celda electroquímica: Pt(s) H 2 (g) H + (ac) Ag + (ac) Ag(s) Cual es la reacción global balanceada de la celda? A) 2H + (ac) + 2Ag + (ac) H 2 (g) + 2Ag(s) B) H 2 (g)
1.Dado el siguiente diagrama de una celda electroquímica: Pt(s) H 2 (g) H + (ac) Ag + (ac) Ag(s) Cual es la reacción global balanceada de la celda? A) 2H + (ac) + 2Ag + (ac) H 2 (g) + 2Ag(s) B) H 2 (g)
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 15 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 15 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
TEMA 8. Equilibrios Redox y de Solubilidad. Grabado de Heinrich Khunrath, Amphitheatrum Sapientiae Aeternae Hannover, 1609
 TEMA 8. Equilibrios Redox y de Solubilidad Grabado de Heinrich Khunrath, Amphitheatrum Sapientiae Aeternae Hannover, 1609 Equilibrio Redox: Estados de Oxidación ESTADOS DE OXIDACIÓN Muchos elementos forman
TEMA 8. Equilibrios Redox y de Solubilidad Grabado de Heinrich Khunrath, Amphitheatrum Sapientiae Aeternae Hannover, 1609 Equilibrio Redox: Estados de Oxidación ESTADOS DE OXIDACIÓN Muchos elementos forman
Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química
 1 Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química 1. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado
1 Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química 1. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado
PIP 4º ESO IES SÉNECA TRABAJO EXPERIMENTAL EN FÍSICA Y QUÍMICA
 1. REACCIÓN REDOX Una reacción redox muy conocida es la reducción del permanganato. Si dicho proceso se lleva a cabo en medio ácido, el ion permanganato (MnO4 - ), de color violeta intenso en disolución,
1. REACCIÓN REDOX Una reacción redox muy conocida es la reducción del permanganato. Si dicho proceso se lleva a cabo en medio ácido, el ion permanganato (MnO4 - ), de color violeta intenso en disolución,
Cinética de la reacción entre los iones peroxodisulfato y yoduro
 Cinética de la reacción entre los iones peroxodisulfato y yoduro Objetivo Medir experimentalmente la variación de la concentración de peroxodisulfato a medida que transcurre la reacción con el ión yoduro
Cinética de la reacción entre los iones peroxodisulfato y yoduro Objetivo Medir experimentalmente la variación de la concentración de peroxodisulfato a medida que transcurre la reacción con el ión yoduro
ELECTROLISIS DE UNA DISOLUCIÓN DE YODURO DE POTASIO. PILA ELECTROLÍTICA
 VIII-1 PRÁCTICA-8 ELECTROLISIS DE UNA DISOLUCIÓN DE YODURO DE POTASIO. PILA ELECTROLÍTICA En esta práctica estudiaremos algunos aspectos prácticos de las reacciones de oxidación-reducción que no son espontáneas.
VIII-1 PRÁCTICA-8 ELECTROLISIS DE UNA DISOLUCIÓN DE YODURO DE POTASIO. PILA ELECTROLÍTICA En esta práctica estudiaremos algunos aspectos prácticos de las reacciones de oxidación-reducción que no son espontáneas.
Práctica 5: Termoquímica: Celdas galvánicas
 Práctica 5: Termoquímica: Celdas galvánicas Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Construir, varias celdas galvánicas o voltaicas y medir el potencial
Práctica 5: Termoquímica: Celdas galvánicas Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Construir, varias celdas galvánicas o voltaicas y medir el potencial
Tema 15: Equilibrio óxido-reducción Reacciones de oxidación-reducción (redox)
 : Equilibrio óxido-reducción 15.1 Reacciones de oxidación-reducción 15.2 Ajuste de reacciones redox: método del ión-electrón 15.3 Volumetrías redox. Indicadores. 15.4 Energía eléctrica asociada a procesos
: Equilibrio óxido-reducción 15.1 Reacciones de oxidación-reducción 15.2 Ajuste de reacciones redox: método del ión-electrón 15.3 Volumetrías redox. Indicadores. 15.4 Energía eléctrica asociada a procesos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio 6, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio 6, Opción B
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA 1 REACIONES DE OXIDACIÓNREDUCCIÓN Son aquellas en las que se produce una transferencia de electrones entre dos sustancias.
REACCIONES DE TRANSFERENCIA DE ELECTRONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA 1 REACIONES DE OXIDACIÓNREDUCCIÓN Son aquellas en las que se produce una transferencia de electrones entre dos sustancias.
Septiembre Pregunta B1.- Ajuste las siguientes reacciones iónicas redox. Indique para cada caso el agente oxidante y el reductor.
 Modelo 2014. Pregunta 4A.- A 30 ml de una disolución de CuSO 4 0,1 M se le añade aluminio metálico en exceso. a) Escriba y ajuste las semirreacciones de reducción y oxidación e indique el comportamiento
Modelo 2014. Pregunta 4A.- A 30 ml de una disolución de CuSO 4 0,1 M se le añade aluminio metálico en exceso. a) Escriba y ajuste las semirreacciones de reducción y oxidación e indique el comportamiento
Reacciones redox espontáneas
 Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
La distribución energética de los 7 electrones d, del Co(II), según el tipo de disposición es:
 Complejos del Cobalto 1 Los compuestos de coordinación del cobalto(ii), no tan conocidos como los de Co(III) que fueron los primeros estudiados, son también importantes, dado que el ion dispone de 7 electrones
Complejos del Cobalto 1 Los compuestos de coordinación del cobalto(ii), no tan conocidos como los de Co(III) que fueron los primeros estudiados, son también importantes, dado que el ion dispone de 7 electrones
Física 4º E.S.O. 2014/15
 Física 4º E.S.O. 2014/15 Problemas de Química Ficha número 13 1.- Ajusta las siguientes reacciones químicas: a) Na 2 CO 3 + HCl NaCl + CO 2 + H 2 O (Sol: Na 2 CO 3 + 2 HCl 2 NaCl + CO 2 + H 2 O) b) PBr
Física 4º E.S.O. 2014/15 Problemas de Química Ficha número 13 1.- Ajusta las siguientes reacciones químicas: a) Na 2 CO 3 + HCl NaCl + CO 2 + H 2 O (Sol: Na 2 CO 3 + 2 HCl 2 NaCl + CO 2 + H 2 O) b) PBr
Vamos a reaccionar una solución de lactosa 5%, solución de fehling A, solución de fehling B.
 RECONOCIMIENTO DE LOS HIDRATOS DE CARBONO. Los monosacáridos son el grupo funcional más simple de los hidratos de carbono y se clasifican según estén formados por un aldehído o por una cetona. Una de las
RECONOCIMIENTO DE LOS HIDRATOS DE CARBONO. Los monosacáridos son el grupo funcional más simple de los hidratos de carbono y se clasifican según estén formados por un aldehído o por una cetona. Una de las
REACCIONES RED-OX QCA 05
 1.- Se dispone de una pila con dos electrodos de Cu y Ag sumergidos en una disolución 1 M de sus respectivos iones, Cu + y Ag +. Conteste sobre la veracidad o falsedad de las afirmaciones siguientes: a)
1.- Se dispone de una pila con dos electrodos de Cu y Ag sumergidos en una disolución 1 M de sus respectivos iones, Cu + y Ag +. Conteste sobre la veracidad o falsedad de las afirmaciones siguientes: a)
Electrólisis AGUSTÍN BINORA - Reacciones redox espontáneas
 Electrólisis AGUSTÍN BINORA - AGUSBINORA@YAHOO.COM.AR Reacciones redox espontáneas A partir de la tabla de potenciales de electrodo predijimos que se iban a producir todas las reacciones menos la del ácido
Electrólisis AGUSTÍN BINORA - AGUSBINORA@YAHOO.COM.AR Reacciones redox espontáneas A partir de la tabla de potenciales de electrodo predijimos que se iban a producir todas las reacciones menos la del ácido
QUÍMICA. En el transcurso de la reacción se rompen y se forman enlaces, y
 OPCIÓN A QUÍMICA. 1. (2,5 puntos) A partir de los siguientes datos: Molécula Enlaces ΔH enlace (kj mol -1 ) H 2 H H - 436 O 2 O O - 496 H 2 O O-H - 463 Estime la entalpía estándar de formación de la molécula
OPCIÓN A QUÍMICA. 1. (2,5 puntos) A partir de los siguientes datos: Molécula Enlaces ΔH enlace (kj mol -1 ) H 2 H H - 436 O 2 O O - 496 H 2 O O-H - 463 Estime la entalpía estándar de formación de la molécula
Zn 2e Zn +2 proceso de oxidación Ánodo Polo negativo. Cu e Cu proceso de reducción Cátodo Polo positivo. Zn + Cu +2 Zn+2 + Cu
 Tema 4(II).PILAS Y CELDAS ELECTROLÍTICAS PILAS GALVÁNICAS Los procesos redox son procesos de transferencia de electrones. Podemos aprovechar tales procesos para producir corriente eléctrica si conseguimos
Tema 4(II).PILAS Y CELDAS ELECTROLÍTICAS PILAS GALVÁNICAS Los procesos redox son procesos de transferencia de electrones. Podemos aprovechar tales procesos para producir corriente eléctrica si conseguimos
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca
 1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
Volumetrías ácido-base. Química Analítica Autor: Joaquín A. Ortuño
 Volumetrías ácido-base VALORACIÓN DE UN ÁCIDO FUERTE (HCl) CON UNA BASE FUERTE (NaOH) Etapas: 1. Antes del punto de equivalencia: ph de una disolución de ácido fuerte. 2. En el punto de equivalencia: ph
Volumetrías ácido-base VALORACIÓN DE UN ÁCIDO FUERTE (HCl) CON UNA BASE FUERTE (NaOH) Etapas: 1. Antes del punto de equivalencia: ph de una disolución de ácido fuerte. 2. En el punto de equivalencia: ph
QQuímica P.A.U. ELECTROQUÍMICA 1 ELECTROQUÍMICA
 QQuímica P.A.U. ELECTROQUÍMICA 1 ELECTROQUÍMICA PROBLEMAS REACCIONES 1. En el laboratorio se puede preparar cloro gas haciendo reaccionar permanganato del potasio sólido con ácido clorhquídrico concentrado.
QQuímica P.A.U. ELECTROQUÍMICA 1 ELECTROQUÍMICA PROBLEMAS REACCIONES 1. En el laboratorio se puede preparar cloro gas haciendo reaccionar permanganato del potasio sólido con ácido clorhquídrico concentrado.
Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno.
 PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN
 II PRÁCTICA 2 CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
II PRÁCTICA 2 CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
Tema 9: Reacciones de oxidación-reducción
 Tema 9: Reacciones de oxidación-reducción Proceso de oxidación-reducción. Ajuste de reacciones red-ox. Potencial de electrodo. Celda electroquímica. Esquema de la celda. Potenciales estandar de los electrodos.
Tema 9: Reacciones de oxidación-reducción Proceso de oxidación-reducción. Ajuste de reacciones red-ox. Potencial de electrodo. Celda electroquímica. Esquema de la celda. Potenciales estandar de los electrodos.
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
Capítulo 20: Electroquímica
 Capítulo 20: Electroquímica Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química Quimica general II, Electroquímica p.1 Cosas importantes Electroquímica
Capítulo 20: Electroquímica Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química Quimica general II, Electroquímica p.1 Cosas importantes Electroquímica
Cómo se corroe el acero en el agua marina?
 Cómo se corroe el acero en el agua marina? Para entender la protección catódica, primero debemos entender el mecanismo de corrosión. Para que ocurra corrosión, se deben cumplir tres condiciones. 1. Dos
Cómo se corroe el acero en el agua marina? Para entender la protección catódica, primero debemos entender el mecanismo de corrosión. Para que ocurra corrosión, se deben cumplir tres condiciones. 1. Dos
