FICHA TÉCNICA. Esta vacuna puede contener una cantidad residual de neomicina (ver secciones 4.3 y 4.4).
|
|
|
- Isabel Morales Álvarez
- hace 8 años
- Vistas:
Transcripción
1 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Varivax polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de su reconstitución, una dosis (0,5 ml) contiene: Virus de la varicela ** (cepa Oka/Merck) (vivos, atenuados) >1.350 UFP *** ** Producidos en células diploides humanas (MRC-5). *** UFP = Unidades Formadoras de Placa Esta vacuna puede contener una cantidad residual de neomicina (ver secciones 4.3 y 4.4). Excipientes: Para consultar la lista completa de excipientes ver sección FORMA FARMACÉUTICA Polvo y disolvente para suspensión inyectable. Polvo blanco o blanquecino y disolvente líquido incoloro y transparente. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Varivax está indicado para la vacunación frente a varicela en individuos a partir de 12 meses de edad (ver secciones 4.2 y 5.1). Varivax se puede administrar a niños a partir de 9 meses de edad bajo circunstancias especiales, como para cumplir con los calendarios nacionales de vacunación o en situaciones de brote epidémico (ver secciones 4.2, 4.5 y 5.1). Varivax también se puede administrar a individuos susceptibles que han estado expuestos a varicela. La vacunación dentro de los 3 días posteriores a la exposición puede prevenir una infección clínicamente aparente o modificar el curso de la infección. Además, existen algunos datos que indican que la vacunación hasta 5 días después de la exposición puede modificar el curso de la infección (ver sección 5.1). 4.2 Posología y forma de administración Posología El uso de Varivax debe estar basado en las recomendaciones oficiales. Individuos menores de 9 meses de edad Varivax no se debe administrar a individuos menores de 9 meses de edad. Individuos a partir de 9 meses de edad 1 de 15
2 Los individuos deben recibir dos dosis de Varivax para asegurar la protección óptima frente a varicela (ver sección 5.1). Individuos entre 9 y 12 meses de edad En los casos en los que la vacunación se inicia entre los 9 y los 12 meses de edad es necesaria una segunda dosis que debe ser administrada después de un intervalo mínimo de 3 meses (ver sección 5.1). Individuos entre 12 meses y 12 años de edad Para los individuos entre 12 meses y 12 años de edad, al menos debe transcurrir un mes entre la primera y la segunda dosis (ver sección 5.1). Nota: las recomendaciones oficiales aplicables pueden variar en relación con la necesidad de una o dos dosis y el intervalo entre dosis de vacunas que contienen varicela. Los individuos de edad comprendida entre 12 meses y 12 años con una infección asintomática de VIH [CDC Clase 1] con un porcentaje de linfocitos T CD4 + específicos de cada edad > 25%, deben recibir dos dosis con un intervalo de 12 semanas. Individuos a partir de 13 años de edad y mayores Los individuos a partir de 13 años de edad y mayores deben recibir dos dosis administradas con un intervalo de 4-8 semanas. Si el intervalo entre las dosis excede de 8 semanas, la segunda dosis deberá administrarse tan pronto como sea posible (ver sección 5.1). Hay datos disponibles sobre la eficacia protectora hasta 9 años después de la vacunación (ver sección 5.1). Sin embargo, no se ha determinado todavía la necesidad de dosis de refuerzo. Si Varivax se administra a individuos seronegativos antes de un periodo de inmunosupresión planeada o posible en un futuro (como es el caso de individuos que estén esperando un transplante de órgano y aquéllos que estén en periodo de remisión de una enfermedad maligna), la pauta de vacunación deberá tener en cuenta el intervalo requerido después de la segunda dosis para poder alcanzar la máxima protección (ver secciones 4.3, 4.4, y 5.1). No existen datos de la eficacia protectora ni de la respuesta inmune a Varivax en personas seronegativas mayores de 65 años. Forma de administración La vacuna debe inyectarse por vía intramuscular (IM) o subcutánea (SC). Los lugares preferidos de inyección son la región anterolateral del muslo en niños pequeños y la región deltoidea en niños mayores, adolescentes y adultos. La vacuna debe administrarse por vía subcutánea en pacientes con trombocitopenia o cualquier trastorno de la coagulación. NO ADMINISTRAR POR VÍA INTRAVASCULAR. Precauciones que deben tomarse antes de manipular o administrar este medicamento: Ver sección Contraindicaciones Antecedentes de hipersensibilidad a cualquier vacuna frente a la varicela, a alguno de los excipientes o a la gelatina o neomicina (que pueden estar presentes como residuos traza, ver secciones 4.4 y 6.1).Discrasias sanguíneas, leucemia, linfomas de cualquier tipo u otras neoplasias malignas que afecten a los sistemas hemático y linfático. Individuos que estén recibiendo tratamiento inmunosupresor (incluidas dosis altas de corticosteroides) (ver sección 4.8). Inmunodeficiencia humoral o celular grave (primaria o adquirida), por ejemplo inmunodeficiencia grave combinada, agammaglobulinemia y SIDA o infección por VIH sintomática, o con un porcentaje de linfocitos T CD4 + específicos de cada edad en niños menores de 12 meses: CD4 + <25%; niños entre 2 de 15
3 12-35 meses: CD4 + < 20%; niños entre meses: CD4 + <15% (ver sección 4.4 y 4.8). Individuos con una historia familiar de inmunodeficiencia congénita o hereditaria, salvo si se demuestra la inmunocompetencia del receptor potencial de la vacuna. Tuberculosis activa no tratada. Cualquier enfermedad que presente fiebre >38,5ºC; sin embargo, una fiebre con temperatura inferior no es por sí misma una contraindicación a la vacunación. Embarazo. Además, se debe evitar un embarazo durante 1 mes después de la vacunación (ver sección 4.6). 4.4 Advertencias y precauciones especiales de empleo Como con todas las vacunas inyectables, deberá estar inmediatamente disponible un tratamiento médico adecuado y supervisión para el caso de que sucediera una reacción anafiláctica rara después de la administración de la vacuna. Como en otras vacunas, existe la posibilidad de reacciones de hipersensibilidad, no sólo al principio activo, sino también a los siguientes excipientes y trazas de residuos presentes en la vacuna: gelatina hidrolizada y neomicina (ver secciones 2 y 6.1). Como sucede con otras vacunas, Varivax no protege completamente a todos los individuos frente a la varicela adquirida de forma natural. Los ensayos clínicos sólo han valorado la eficacia desde las 6 semanas después de una dosis única en individuos sanos hasta los 12 años de edad, o desde 6 semanas después de la segunda dosis en individuos mayores (ver sección 5.1). Se puede considerar la vacunación en pacientes con determinadas inmunodeficiencias dónde los beneficios sobrepasan a los riesgos (por ejemplo personas con VIH asintomáticas, deficiencias de subclases de IgG, neutropenia congénita, enfermedad granulomatosa crónica, y enfermedades con deficit del complemento. Los pacientes inmunocomprometidos que no tienen contraindicación para esta vacunación (ver sección 4.3) pueden no responder tan bien como los individuos inmunocompetentes; por lo tanto, algunos de estos pacientes pueden adquirir varicela en caso de contacto, a pesar de la apropiada administración de la vacuna. En estos pacientes se deberá hacer un seguimiento cuidadoso de la aparición de signos de varicela. Los receptores de la vacuna deben evitar el uso de salicilatos durante las 6 semanas posteriores a la vacunación (ver sección 4.5). Transmisión En raras ocasiones, es posible la transmisión del virus de la vacuna desde individuos sanos vacunados que desarrollen o no una erupción de tipo varicelosa a contactos susceptibles sanos, mujeres embarazadas e inmunodeprimidos (ver sección 4.8). Por tanto, los receptores de la vacuna deberán intentar evitar, en la medida de lo posible, un contacto estrecho con personas susceptibles de alto riesgo hasta 6 semanas después de la vacunación. En aquellas circunstancias en las que sea inevitable el contacto con personas de alto riesgo, antes de la vacunación se deberá valorar el riesgo potencial de transmisión del virus de la vacuna frente al riesgo de adquirir y transmitir el virus de la varicela de tipo salvaje (ver sección 4.8). Entre las personas susceptibles de alto riesgo se encuentran: Individuos inmunocomprometidos (ver sección 4.3); Mujeres embarazadas sin historial positivo de varicela documentado ni evidencia de laboratorio de infección previa; Recién nacidos de madres sin historial positivo de varicela documentado ni evidencia de laboratorio de infección previa. 3 de 15
4 4.5 Interacción con otros medicamentos y otras formas de interacción Varivax no debe mezclarse con ninguna otra vacuna o medicamento en la misma jeringa. Otras vacunas inyectables o medicamentos se deben administrar en inyecciones separadas y en diferentes lugares de inyección. Administración concomitante con otras vacunas Varivax se ha administrado a niños pequeños al mismo tiempo pero en un lugar de inyección diferente que la vacuna combinada frente a sarampión, parotiditis y rubéola, vacuna conjugada frente al Haemophilus influenzae tipo b, vacuna frente a la hepatitis B, vacuna frente a difteria/tétanos/tos ferina de célula entera y vacuna oral frente a la polio. No hubo evidencia de una diferencia clínicamente relevante en las respuestas inmunes a ninguno de los antígenos cuando se administraron concomitantemente con Varivax. Si la vacuna antivaricela de virus vivos (cepa Oka/Merck) no se administra concomitantemente con la vacuna de virus vivos frente a sarampión, parotiditis y rubéola, deberá respetarse un intervalo de 1 mes entre estas dos vacunas de virus vivos. No se ha evaluado la administración concomitante de Varivax y vacunas tetravalentes, pentavalentes o hexavalentes (preparadas a partir de la vacuna de difteria, tétanos y tos ferina acelular [DTPa]). Se deberá posponer la vacunación al menos 5 meses tras transfusiones de sangre o plasma o la administración de inmunoglobulina inespecífica humana o de inmunoglobulina de varicela-zóster (IGVZ). La administración de productos derivados de la sangre que contienen anticuerpos frente al virus varicela zóster, incluyendo IGVZ u otras preparaciones de inmunoglobulinas, dentro del plazo de 1 mes tras la dosis de Varivax, puede reducir la respuesta inmune a la vacuna y reducir por ello su eficacia protectora. Por lo tanto, se deberá evitar la administración de cualquiera de estos productos hasta 1 mes después de la dosis de Varivax, a menos que se considere que es esencial. Los receptores de la vacuna deberán evitar el uso de salicilatos durante las 6 semanas posteriores a la vacunación con Varivax, ya que se ha notificado la aparición del síndrome de Reye después del uso de salicilatos durante la infección con el virus salvaje de la varicela (ver sección 4.4). 4.6 Fertilidad, embarazo y lactancia Fertilidad No se han llevado a cabo estudios de reproducción animalcon Varivax. No se ha evaluado si Varivax puede afectar a la fertilidad. Embarazo Las mujeres embarazadas no se deben vacunar con VARIVAX. Sin embargo, el daño fetal no ha sido documentado cuando se administran vacunas de varicela a mujeres embarazadas. Se desconoce si VARIVAX puede provocar daño fetal cuando se administra a una mujer embarazada o si puede afectar a la capacidad reproductora. Se debe evitar el embarazo durante 1 mes después de la vacunación. Las mujeres que estén intentando un embarazo deben ser advertidas para que lo retrasen. Lactancia Debido al riesgo teórico de transmisión de la cepa del virus de la vacuna desde la madre al niño, Varivax generalmente no está recomendado para mujeres en periodo de lactancia (ver también sección 4.4). La vacunación de las mujeres expuestas con historial negativo de varicela o que se conozca que son seronegativas a la varicela se deberá evaluar en base a criterios individuales. 4 de 15
5 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. 4.8 Reacciones adversas a) Resumen del perfil de seguridad En los ensayo s clínicos, se administró una formulación congelada y otra estable en nevera de la vacuna antivaricela de virus vivos (cepa Oka/Merck) a aproximadamente individuos sanos de edad ³ 12 meses que fueron monitorizados hasta 42 días después de cada dosis. Aparentemente, no hubo un incremento en el riesgo de acontecimientos adversos con el uso de Varivax en individuos seropositivos. El perfil de seguridad de la formulación estable en nevera de la vacuna antivaricela de virus vivos (cepa Oka/Merck) fue generalmente similar al perfil de seguridad de formulaciones anteriores de la vacuna. En un estudio doble ciego y controlado con placebo en 956 individuos sanos de edades comprendidas entre 12 meses y 14 años, de los que 914 fueron serológicamente confirmados como susceptibles a la varicela, los únicos acontecimientos adversos detectados con una tasa significativamente mayo r en los receptores de la vacuna que en los receptores del placebo fueron dolor (26,7% frente a 18,1%), enrojecimiento en el punto de inyección (5,7% frente a 2,4%) y erupción de tipo varicelosa en áreas distintas del punto de inyección (2,2% frente a 0,2%). En un ensayo clínico, 752 niños recibieron Varivax, bien por vía intramuscular o bien por vía subcutánea. El perfil general de seguridad de las dos vías de administración fue equiparable, aunque las reacciones en el punto de administración fueron menos frecuentes en el grupo IM (20,9%) comparado con el grupo SC (34,3%). En un estudio post-comercialización con la vacuna antivaricela de virus vivos (cepa Oka/Merck) llevado a cabo para evaluar la seguridad a corto plazo (seguimiento de 30 ó 60 días) en el que participaron aproximadamente niños de 12 meses a 12 años de edad y individuos de edad igual o superior a 13 años, no se notificaron acontecimientos adversos graves asociados a la vacuna. b) Resumen tabulado de las reacciones adversas Ensayos clínicos A lo largo de los ensayo s clínicos en los cuales se evaluó la causalidad (5.185 sujetos), se notificaron los siguientes acontecimientos adversos en asociación temporal con la vacunación: Los acontecimientos adversos se clasifican según su frecuencia utilizando la siguiente convención : Muy frecuentes ( > 1/10), Frecuentes ( > 1/100 a <1/10), ( > 1/1.000 a <1/100), ( >1/ a <1/1.000) Individuos sanos de 12 meses a 12 años de edad (1 dosis) Acontecimientos adversos Trastornos de la sangre y del sistema linfático Linfadenopatía, Linfadenitis, Trombocitopenia Trastornos del sistema nervioso Cefalea, Somnolencia Apatía, Nerviosismo, Agitación, Hipersomnia, Anormalidad en el sueño, Cambios emocionales, Alteraciones de la marcha, Crisis febril, Temblor Trastornos oculares Conjuntivitis Conjuntivitis aguda, Lagrimeo, Edema en el párpado, Irritación Frecuencia 5 de 15
6 Trastornos del oído y del laberinto Dolor de oído Trastornos respiratorios, torácicos y mediastínicos Tos, Congestión nasal, Congestión respiratoria, Rinorrea Sinusitis, Estornudos, Congestión pulmonar, Epistaxis, Rinitis, Sibilancia, Bronquitis, Infección respiratoria, Neumonía Trastornos del metabolismo y de la nutrición Anorexia Infecciones e infestaciones Infección del tracto respiratorio superior Frecuentes Gripe, Gastroenteritis, Otitis, Otitis media, Faringitis, Varicela, Exantema viral, Infección viral Infección, Candidiasis, Enfermedad tipo gripal, Lesión tipo mordedura/picadura no venenosa Trastornos gastrointestinales Diarrea, Vómitos Dolor abdominal, Náuseas, Flatulencia, Hematoquecia, Úlcera bucal Trastornos de la piel y del tejido subcutáneo Erupción, Erupción de tipo sarampión/rubéola, Erupción de Frecuentes tipo varicelosa (media generalizada de 5 lesiones) Dermatitis de contacto, Exantema del pañal, Eritema, Miliaria rubra, Prurito, Urticaria Rubefacción, Vesículas, Dermatitis atópica, Eccema, Acné, Herpes simple, Erupción semejante a urticaria, Contusión, Dermatitis, Erupción medicamentosa, Impétigo, Infección de la piel, Sarampión, Quemaduras solares Trastornos musculoesqueléticos y del tejido conjuntivo Dolor musculoesquelético, Mialgia, Dolor en la cadera, pierna o cuello, Rigidez Trastornos vasculares Extravasación Trastornos generales y alteraciones en el lugar de administración Fiebre Muy frecuentes Eritema en el lugar de inyección, Erupción, Dolor/Dolor a la presión/molestias, Hinchazón y Erupción de tipo varicelosa Frecuentes (media de 2 lesiones en el lugar de inyección) Astenia/fatiga, Equimosis en el lugar de inyección, Hematoma, Induración, Erupción, Malestar Eccema en el lugar de inyección, Bultos, Calor, Erupción semejante a urticaria, Decoloración, Inflamación, Rigidez, Trauma, Aspereza/Sequedad, Edema/Hinchazón, Dolor/Dolor a la presión/molestias, Sensación de calor, Calor al tacto, Hemorragia en el lugar de inyección, Anormalidad en los labios Trastornos psiquiátricos Irritabilidad Frecuentes Llanto, Insomnio, Trastornos del sueño Individuos sanos de 12 meses a 12 años de edad (2 dosis recibidas con un intervalo > 3 meses) Se notificaron los siguientes acontecimientos adversos graves asociados temporalmente con la vacunación en individuos de edades comprendidas entre 12 meses y 12 años a los que se administró vacuna antivaricela de virus vivos (cepa Oka/Merck): diarrea, crisis febril, fiebre, artritis post-infecciosa, vómitos. 6 de 15
7 Las tasas de acontecimientos adversos clínicos sistémicos después de una segunda dosis de Varivax fueron generalmente similares o menores que aquellos observados con la primera dosis. Las tasas de reacciones en el punto de inyección (fundamentalmente eritema e hinchazón) fueron mayores después de una segunda dosis (ver sección 5.1 para descripción del estudio). Individuos sanos de edad igual o superior a 13 años (la mayoría recibió 2 dosis con un intervalo de 4-8 semanas) No se valoró la causalidad en individuos de edad igual o superior a 13 años, con la excepción de acontecimientos adversos graves. No obstante, a lo largo de los estudios clínicos (1.648 sujetos), los siguientes acontecimientos se asociaron temporalmente con la vacunación: Acontecimientos adversos Frecuencia Trastornos de la piel y del tejido subcutáneo Erupción de tipo varicelosa (media generalizada de Frecuentes 5 lesiones) Trastornos generales y alteraciones en el lugar de administración Fiebre >37,7ºCoral, Eritema en lugar de inyección, Muy frecuentes Dolor e hinchazón Erupción en el lugar de inyección, Prurito y erupción de tipo varicelosa (media de 2 lesiones en Frecuentes el lugar de inyección) Equimosis en el lugar de inyección, Hematoma, Poco Frecuentes Induración, Entumecimiento y Calor Pesadez, Hiperpigmentación, Rigidez Seguimiento post-comercialización Los siguientes acontecimientos adversos se han notificado espontáneamente en relación temporal a Varivax durante su uso tras la comercialización a nivel mundial: Acontecimientos adversos + Trastornos de la sangre y del sistema linfático Anemiaaplásica, Trombocitopenia(incluyendo púrpuratrombocitopénicaidiopática(pti)), Linfadenopatía Trastornos del sistema nervioso Accidente cerebrovascular, Convulsiones febriles y no febriles, Síndrome de Guillain-Barré, Mielitis transversa, Parálisis de Bell, Ataxia *, Vértigo/Mareo, Parestesia, Meningitis aséptica Trastornos respiratorios, torácicos y mediastínicos Neumonitis Trastornos de la piel y del tejido subcutáneo Síndrome de Stevens-Johnson, Eritema multiforme, Púrpura de Henoch-Schönlein, Infecciones bacterianas secundarias de piel y tejidos blandos, incluidos Impétigo y Celulitis Infecciones e infestaciones Encefalitis *, Faringitis, Neumonía *, Varicela (cepa de la vacuna), Herpes zóster * Trastornos generales y alteraciones en el lugar de administración Irritabilidad Trastornos del sistema inmunológico Anafilaxis (incluyendo shock anafiláctico) y fenómenos relacionados tales como Edema Angioneurótico, Edema Facial y Edema Periférico, Anafilaxis en individuos con o sin antecedentes de alergia Trastornos gastrointestinales Náuseas, Vómitos 7 de 15
8 + Debido a que estos acontecimientos se notifican de forma voluntaria a partir de una población de tamaño indeterminado, no siempre es posible valorar de forma fiable su frecuencia ni establecer una relación causal con la exposición a la vacuna.por lo tanto, se asigna la categoría de frecuencia No conocida a estos acontecimientos adversos. * Estos acontecimientos adversos notificados con la vacuna antivaricela de virus vivos (cepa Oka/Merck) son también una consecuencia de la infección por el virus salvaje de la varicela. Noexiste indicio de un riesgo incrementado de estos acontecimientos adversos después de la vacunación en comparación con la enfermedad de tipo salvaje, en base a los estudios de seguimiento activo post-comercialización o informes de seguimiento pasivo post-comercialización (ver sección 5.1 y Estudios clínicos post-comercialización). Ver sección c. Las erupciones después de la vacunación en las cuales se aisló la cepa Oka/Merck fueron generalmente leves (ver sección 5.1). c) Descripción de algunas reacciones adversas Casos de herpes zóster en estudios clínicos En los ensayos clínicos se notificaron 12 casos de herpes zóster en individuos vacunados de edades comprendidas entre 12 meses y 12 años durante el seguimiento de personas-año. Esto dio como resultado el cálculo de una incidencia de al menos 14 casos por personas-año en comparación con 77 casos por personas-año después de una infección con el virus salvaje de la varicela. En1.652 individuos vacunados de edad igual o superior a 13 años, se notificaron 2 casos de herpes zóster. Los 14 casos fueron leves y no se comunicaron secuelas. En otro ensayoclínico en individuos entre 12 meses y 12 años de edad, se notificaron dos casos de herpes zóster en el grupo que recibió una dosis de vacuna y no hubo ningún caso en el grupo de dos dosis. Estos individuos fueron monitorizados durante 10 años después de la vacunación. Los datos del seguimiento activo en niños vacunados con la vacuna antivaricela de virus vivos (cepa Oka/Merck) y monitorizados durante 14 años después de la vacunación no mostraron un aumento en la frecuencia de herpes zóster en comparación con niños con varicela previa de tipo salvaje en el periodo antes de la vacunación. Sin embargo, en la actualidad se desconoce el efecto a largo plazo de la vacuna antivaricela de virus vivos (cepa Oka/Merck) en la incidencia del herpes zóster (ver sección 5.1). Transmisión En base a notificaciones aisladas de casos durante el seguimiento post-comercialización, existe la rara posibilidad de que el virus de la vacuna pueda transmitirse a contactos de personas vacunadas que desarrollen o no una erupción de tipo varicelosa (ver sección 4.4). Uso concomitante de la vacuna antivaricela de virus vivos (cepa Oka/Merck) con otras vacunas pediátricas Cuando la vacuna antivaricela de virus vivos (cepa Oka/Merck) se administró concomitantemente con la vacuna frente a sarampión, parotiditis y rubéola (Vacuna Triple Vírica) a individuos de edad comprendida entre los 12 y 23 meses, se notificó fiebre (>38,9ºC, equivalente oral, Días 0 a 42 después de la vacunación) en un 26-40%(ver también sección 4.5). d) Otras poblaciones especiales Individuos inmunocomprometidos Se ha notificado tras la comercialización retinitis necrotizante en individuos inmunocomprometidos. Ancianos La experiencia de los ensayos clínicos no ha identificado diferencias en el perfil de seguridad entre los ancianos (individuos de edad > 65 años) y sujetos más jóvenes. 8 de 15
9 Notificación de sospechas de reacciones adversas Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: Sobredosis Se ha comunicado la administración accidental de más dosis de la recomendada de vacuna antivaricela de virus vivos (cepa Oka/Merck) (se inyectó una dosis mayor a la recomendada, o se administró más de una inyección, o el intervalo entre las inyecciones fue menor que el recomendado). En estos casos, se describieron los siguientes acontecimientos adversos: enrojecimiento en el lugar de inyección, molestias, inflamación; irritabilidad; molestias gastrointestinales (por ejemplo hematemesis, emesis fecal, gastroenteritis con vómitos y diarrea); tos e infección viral. Ninguno de estos casos tuvo secuelas a largo plazo. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Vacunas víricas- virus de la varicela Código ATC: J07BK01 Evaluación de la eficacia clínica Eficacia en individuos menores de 12 meses de edad No se ha evaluado la eficacia clínica cuando la vacunación se inicia antes de los 12 meses de edad. Régimen de una dosis en individuos sanos de 12 meses a 12 años de edad En ensayos clínicos combinados empleando formulaciones anteriores de la vacuna antivaricela de virus vivos (cepa Oka/Merck) a dosis comprendidas entre aproximadamente y UFP, la mayoría de los sujetos que recibieron la vacuna antivaricela de virus vivos (cepa Oka/Merck) y se expusieron al virus de tipo salvaje, se encontraron completamente protegidos frente a la varicela o desarrollaron una forma más leve de la enfermedad. En particular, se evaluó la eficacia protectora de la vacuna antivaricela de virus vivos (cepa Oka/Merck) empezando 42 días después de la vacunación de 3 maneras diferentes: 1. en un ensayo clínico doble ciego y controlado con placebo, durante 2 años (N=956; eficacia del 95 al 100%; formulación conteniendo UFP); 2. mediante la evaluación de la protección frente a la enfermedad tras la exposición familiar a lo largo de 7 a 9 años de observación (N=259; eficacia del 81 al 88%; formulación conteniendo UFP); y 3. mediante la comparación de las tasas de varicela a lo largo de 7 a 9 años en los vacunados frente a datos de control históricos desde 1972 a 1978 (N=5.404; eficacia del 83 al 94%; formulación conteniendo UFP). En un grupo de individuos de edad comprendida entre los 12 meses y 12 años que recibieron una dosis de la vacuna antivaricela de virus vivos (cepa Oka/Merck), se observaron casos de infección (ocurriendo más de 6 semanas después de la vacunación) en un periodo de seguimiento de hasta 13 años. De los casos, 20 (1,7%) se clasificaron como graves (número de lesiones > 300 y temperatura oral > 37,8 C). Los datos mencionados, comparados con la proporción del 36% de casos graves observados tras la infección por el virus salvaje en controles históricos no vacunados, representa una reducción relativa del 95% en el porcentaje de casos graves observados en los vacunados que adquirieron la infección tras la vacunación. 9 de 15
10 Se ha investigado la profilaxis de la varicela mediante la vacunación hasta 3 días después de la exposición en dos pequeños estudios controlados. El primer estudio demostró que ninguno de los 17 niños desarrolló varicela después de una exposición familiar, en comparación con 19 de los 19 contactos sin vacunar. En un segundo estudio de profilaxis post-exposición controlado con placebo, uno de los 10 niños en el grupo de los vacunados, frente a 12 de los 13 niños en el grupo placebo, desarrolló varicela. En un estudio no controlado en un ámbito hospitalario, 148 pacientes, de los cuales 35 eran inmunocomprometidos, recibieron una dosis de la vacuna antivaricela de 1 a 3 días después de la exposición a la varicela y ninguno desarrolló la enfermedad. Los datos publicados sobre la prevención de la varicela a los 4-5 días de la exposición son escasos. En un ensayo doble-ciego, se randomizaron para recibir placebo o vacuna antivaricela 26 hermanos de niños con varicela activa. En el grupo que recibió vacuna antivaricela, 4 de los 13 niños (30,8%) desarrollaron la enfermedad, de los cuales 3 niños fueron vacunados en los días 4-5. Sin embargo, la enfermedad fue leve (1, 2 y 50 lesiones). Por el contrario, 12 de los 13 niños (92,3%) en el grupo placebo desarrollaron la varicela típica (60 a 600 lesiones). Por lo tanto, la vacunación 4 a 5 días después de la exposición a la varicela puede modificar el curso de cualquier caso secundario de varicela. Régimen de dos dosis en individuos sanos de 12 meses a 12 años de edad En un estudio comparando 1 dosis (N=1.114) y 2 dosis (N=1.102) administradas con un intervalo de 3 meses, la eficacia estimada de la vacuna frente a todos los grados de gravedad de la enfermedad de la varicela durante un período de observación de 10 años fue del 94% para 1 dosis y del 98% para 2 dosis (p <0,001). Durante el período de observación de 10 años, la tasa acumulativa de varicela fue del 7,5% después de 1 dosis y del 2,2% después de 2 dosis. La mayor parte de casos de varicela notificados en los receptores de 1 dosis o 2 dosis de vacuna fueron leves. Régimen de dos dosis en individuos sanos de edad igual o superior a 13 años Se evaluó la eficacia protectora en la exposición familiar durante un periodo de 6 a 7 años después de la administración de 2 dosis con un intervalo de 4 a 8 semanas en individuos de edad igual o superior a 13 años. La tasa de eficacia clínica osciló desde aproximadamente el 80 al 100%. Inmunogenicidad de la vacuna antivaricela de virus vivos (cepa Oka/Merck) Régimen de una dosis en individuos de 12 meses a 12 años de edad Se ha establecido en estudios clínicos que la inmunogenicidad de la formulación estable en nevera es similar a la inmunogenicidad de formulaciones anteriores para las que se evaluó la eficacia. Se ha demostrado que un título > 5 unidades gpelisa/ml (gpelisa es un ensayo muy sensible que no está disponible comercialmente) a las 6 semanas después de la vacunación constituye una buena correlación con protección clínica. Sin embargo, no se conoce si un título > 0,6 unidades gpelisa/ml se correlaciona con protección a largo plazo. Respuesta inmune humoral en individuos de 12 meses a 12 años de edad Se observó la seroconversión (basada en un punto de corte del análisis que generalmente corresponde a > 0,6 unidades gpelisa/ml) en el 98% de los individuos susceptibles de 12 meses a 12 años de edad que recibieron dosis comprendidas entre las y las UFP. Se generaron títulos de anticuerpos frente a varicela ³ 5 unidades gpelisa/ml en aproximadamente el 83% de estos individuos. En el 93% de los individuos vacunados de edad comprendida entre 12 y 23 meses, la administración de Varivax refrigerado (8.000 UFP/dosis ó UFP/dosis) indujo títulos de anticuerpos frente a varicela ³ 5 unidades gpelisa/ml 6 semanas después de la vacunación. Respuesta inmune humoral en individuos de edad igual o superior a 13 años En 934 individuos de edad igual o superior a 13 años, varios ensayos clínicos con la vacuna antivaricela de virus vivos (cepa Oka/Merck) a dosis comprendidas entre aproximadamente 900 a UFP, han demostrado una tasa de seroconversión (títulos de anticuerpos antivaricela ³ 0,6 unidades gpelisa/ml) tras 10 de 15
11 1 dosis de la vacuna comprendida entre el 73 y el 100%. La proporción de sujetos con títulos de anticuerpos > 5 unidades gpelisa/ml varió del 22 al 80%. Después de 2 dosis de vacuna (601 sujetos) a dosis comprendidas entre aproximadamente 900 a UFP, la tasa de seroconversión varió del 97 al 100% y la proporción de sujetos con títulos de anticuerpos > 5 unidades gpelisa/ml varió del 76 al 98%. No existen datos sobre la respuesta inmune a Varivax en personas seronegativas al virus varicela zóster (VVZ) de edad >65 años. Inmunidad humoral de acuerdo a la vía de administración En un estudio comparativo en 752 sujetos que recibieron Varivax bien por vía intramuscular o bien por vía subcutánea se demostró un perfil de inmunogenicidad similar con ambas vías de administración. Régimen de dos dosis en individuos sanos de 12 meses a 12 años de edad En un estudio multicéntrico, niños sanos entre 12 meses y 12 años de edad recibieron una dosis de Varivax o dos dosis administradas con un intervalo de 3 meses. Los resultados de inmunogenicidad se muestran en la siguiente tabla. Varivax Régimen de una dosis (N=1.114) 6 semanas post-vacunación 6 semanas Tasa de seroconversión 98,9% (882/892) 99,5% (847/851) Porcentaje con título de 84,9% (757/892) 87,3% anticuerpos VVZ =5 (743/851) unidades gpelisa/ml (tasa de seroprotección) Media geométrica de los títulos (unidades gpelisa/ml) Varivax Régimen de dos dosis (N=1.102) 6 semanas post-dosis 2 post-dosis 1 99,9% (768/769) 12,0 12,8 141,5 99,5% (765/769) Los resultados de este estudio y de otros estudios en los que una segunda dosis de vacuna se administró de 3 a 6 años después de la dosis inicial demuestran un refuerzo significativo de la respuesta de anticuerpos del virus varicela zóster con una segunda dosis. Los niveles de anticuerpos del virus varicela zóster después de dos dosis administradas con un intervalo de 3 a 6 años es equiparable a aquellos obtenidos cuando las dos dosis se administran con un intervalo de 3 meses. Las tasas de seroconversión fueron aproximadamente del 100% después de la primera dosis y del 100% después de la segunda dosis. La tasa de seroprotección de la vacuna (> 5 unidades gpelisa/ml) fue de aproximadamente el 85% después de la primera dosis y del 100% después de la segunda dosis y la media geométrica de los títulos (GMT) aumentó una media de unas 10 veces después de la segunda dosis (para seguridad ver sección 4.8). Régimen de dos dosis en individuos sanos de 9 a 12 meses de edad en el momento de la primera dosis Se llevó a cabo un ensayo clínico con la vacuna combinada de sarampión, parotiditis, rubéola y varicela (cepa Oka/Merck) (MMRV) administrada siguiendo una pauta de 2 dosis, administradas con un intervalo de 3 meses en sujetos sanos de 9 a 12 meses de edad en el momento de la primera dosis. El perfil de seguridad después de las dosis 1 y 2 fue en general comparable para todas las cohortes de edad. En el grupo completo de análisis (sujetos vacunados independientemente de su título basal de anticuerpos) se obtuvieron tasas de seroprotección del 100% frente a varicela después de la dosis 2, sin considerar la edad de los vacunados en el momento de la primera dosis. 11 de 15
12 Las tasas de seroprotección y las medias geométrica de los títulos (GMTs) frente a varicela para el grupo completo de análisis se incluyen en la siguiente tabla. Vacuna MMRV Dosis 1 a los 9 meses Dosis 2 a los 12 meses (N = 527) Vacuna MMRV Dosis 1 a los 11 meses Dosis 2 a los 14 meses (N = 480) Vacuna MMRV Dosis 1 a los 12 meses Dosis 2 a los 15 meses (N = 466) Tasa de seroprotecció n frente a varicela [IC 95%] (título >5 unidades gpelisa/ml) Media geométrica de los títulos [IC 95%] (unidades gpelisa/ml) 6 semanas tras dosis 1 93,1% [90,6; 95,1] 12 [12; 13] 6 semanas tras dosis 2 100% [99,3; 100] 321 [293; 352] 6 semanas tras dosis 1 97,0% [95,1; 98,4] 15 [14; 15] 6 semanas tras dosis 2 100% [99,2; 100] 411 [376; 450] 6 semanas tras dosis 1 6 semanas tras dosis 2 96,5% [94,4; 98,0] 15 [14; 15] 100% [99,2; 100] 481 [441; 526] Duración de la respuesta inmune Régimen de una dosis en individuos de 12 meses a 12 años de edad En aquellos estudios clínicos con individuos sanos de 12 meses a 12 años de edad que han sido monitorizados durante largo tiempo después de una única dosis de vacuna, el 99,1% (3.092/3.120) presentó anticuerpos antivaricela detectables (> 0,6 unidades gpelisa/ml) a 1 año; el 99,4% (1.382/1.391) a los 2 años; el 98,7% (1.032/1.046) a los 3 años; el 99,3% (997/1.004) a los 4 años; el 99,2% (727/733) a los 5 años; y el 100% (432/432) a los 6 años después de la vacunación. Régimen de dos dosis en individuos de 12 meses a 12 años de edad Durante 9 años de seguimiento, la media geométrica de los títulos (GMT) y el porcentaje de sujetos con títulos de anticuerpos de virus varicela zóster > 5 unidades gpelisa/ml en receptores de dos dosis fueron mayores que en los receptores de una dosis para el primer año de seguimiento y equiparables durante el periodo entero de seguimiento. La tasa acumulativa de persistencia de anticuerpos de virus varicela zóster con ambos regímenes permaneció muy elevada en el año 9 (99,0% para el grupo de 1 dosis y 98,8% para el grupo de 2 dosis). Individuos de edad igual o superior a 13 años En estudios clínicos con individuos sanos de edad igual o superior a 13 años que recibieron 2 dosis de la vacuna, el 97,9% (568/580) presentaron anticuerpos antivaricela detectables (> 0,6 unidades gpelisa/ml) a 1 año; el 97,1% (34/35) a los 2 años; el 100% (144/144) a los 3 años; el 97,0% (98/101) a los 4 años; el 97,5% (78/80) a los 5 años; y el 100% (45/45) a los 6 años después de la vacunación. Se ha observado un aumento en los niveles de anticuerpos de los vacunados tras la exposición al virus salvaje de la varicela, lo que podría explicar la aparente persistencia a largo plazo de los niveles de anticuerpos después de la vacunación en esos estudios. Se desconoce la duración de la respuesta inmune tras la administración de la vacuna antivaricela de virus vivos (cepa Oka/Merck) en ausencia de un refuerzo con el tipo salvaje (ver sección 4.2). 12 de 15
13 Se demostró la existencia de memoria inmunológica mediante la administración de una dosis de refuerzo de la vacuna antivaricela de virus vivos (cepa Oka/Merck) 4 a 6 años después de la primera vacunación en 419 individuos que tenían entre 1 y 17 años de edad en el momento de la primera inyección. La media geométrica de los títulos de anticuerpos (GMT) anterior a la dosis de refuerzo era de 25,7 unidades gpelisa/ml, y se incrementó hasta 143,6 unidades gpelisa/ml aproximadamente 7-10 días después de la dosis de refuerzo. Efectividad de la vacuna antivaricela de virus vivos (cepa Oka/Merck) Estudios observacionales de efectividad a largo plazo de Varivax Los datos de seguimiento de dos estudios observacionales de efectividad en EE.UU confirmaron que la vacunación generalizada frente a varicela reduce el riesgo de varicela aproximadamente en un 90%. Además el riesgo reducido de varicela se mantuvo a nivel poblacional durante al menos 15 años tanto en individuos vacunados como en individuos no vacunados. Los datos también sugieren que la vacunación frente a varicela puede reducir el riesgo de herpes zóster en individuos vacunados. En el primer estudio, estudio prospectivo de cohorte a largo plazo, aproximadamente 7600 niños vacunados en 1995 con la vacuna antivaricela en su segundo año de vida fueron seguidos activamente durante 14 años para estimar la incidencia de varicela y herpes zóster. Al final del estudio en 2009, se constató que el 38% de los niños en estudio habían recibido una segunda dosis de la vacuna frente a varicela. Es importante mencionar que en 2006 se recomendó una segunda dosis de vacuna frente a varicela en EE.UU. Durante el seguimiento completo, la incidencia de varicela fue aproximadamente 10 veces más baja entre los niños vacunados que entre los niños de la misma edad en el periodo antes de la vacunación (la efectividad estimada de la vacuna en el periodo que duró el estudio fue de entre un 73% y 90%). En relación al herpes zóster, durante el periodo de seguimiento se produjeron menos casos de herpes zóster entre los vacunados frente a varicela que los esperados de acuerdo con la tasa de herpes zóster en niños de la misma edad que tuvieron varicela previa de tipo salvaje durante el periodo antes de la vacunación (riesgo relativo = 0,61, IC 95% 0,43 0,89). Los casos de varicela en vacunados y de herpes zóster fueron, en general, leves. En un segundo estudio de vigilancia a largo plazo, se realizaron cinco estudios transversales sobre la incidencia de varicela, cada uno de una muestra aleatoria de aproximadamente 8000 niños y adolescentes de 5 a 19 años de edad, durante 15 años, desde 1995 (periodo prevacunal) hasta Los resultados mostraron en conjunto un descenso gradual de las tasas de varicela de entre un 90% a un 95% (aproximadamente de 10 a 20 veces) desde 1995 a 2009 en todos los grupos de edad, tanto en niños y adolescentes vacunados como en no vacunados. Además, se observó un descenso de aproximadamente un 90% (aproximadamente 10 veces) en las tasas de hospitalización por varicela en todos los grupos de edad. 5.2 Propiedades farmacocinéticas La evaluación de las propiedades farmacocinéticas no se requiere para las vacunas. 5.3 Datos preclínicos sobre seguridad No se han desarrollado estudios preclínicos tradicionales de seguridad, pero no existen aspectos preclínicos que se consideren relevantes para la seguridad clínica más allá de los datos incluidos en otras secciones de la Ficha Técnica. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Polvo : Sacarosa Gelatina hidrolizada 13 de 15
14 Urea Cloruro de sodio L-glutamato monosódico Fosfato de disodio anhidro Fosfato dihidrógeno de potasio Cloruro de potasio Para información sobre componentes residuales en cantidades traza, ver secciones 2, 4.3 y 4.4. Disolvente : Agua para preparaciones inyectables. 6.2 Incompatibilidades La vacuna no debe mezclarse con otros medicamentos. La vacuna no debe reconstituirse con otros medicamentos excepto con los mencionados en la sección Periodo de validez 2 años Después de la reconstitución, se deberá usar la vacuna inmediatamente. Sin embargo, se ha demostrado la estabilidad de la preparación durante 30 minutos entre +20ºC y +25ºC. Desechar la vacuna si no se utiliza durante los 30 minutos siguientes a su preparación. 6.4 Precauciones especiales de conservación Conservar en nevera (entre 2ºC y 8ºC). Conservar el vial en el embalaje exterior para protegerlo de la luz. No congelar. 6.5 Naturaleza y contenido del envase Vial Vial de 3 ml (vidrio), con tapón (goma de butilo) y tapa flip-off (aluminio). Jeringa precargada Jeringa precargada de 1 ml (vidrio), con tapón del émbolo (goma de clorobutilo) y tapón en el extremo (goma de estireno-butadieno), sin aguja; jeringa precargada de 1 ml (vidrio) con tapón del émbolo (goma de clorobutilo) y tapón en el extremo (goma de estireno-butadieno) con 2 agujas separadas en el blister; o jeringa precargada de 1 ml (vidrio) con tapón del émbolo (goma de clorobutilo), con aguja. Envases de 1 y 10 dosis. Puede que solamente estén comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación y otras manipulaciones Instrucciones para la preparación de la vacuna Evitar el contacto con desinfectantes. Para reconstituir la vacuna, utilizar solamente el agua para preparaciones inyectables que se incluye en la jeringa precargada. 14 de 15
15 En las presentaciones que contienen la jeringa precargada sin aguja fija, dentro del acondicionamiento secundario se pueden encontrar 2 agujas separadas: una aguja se emplearía para la reconstitución y la otra para la administración. La aguja debe colocarse fírmemente en el extremo de la jeringa y asegurarla por rotación de un cuarto de vuelta (90º). Inyectar el contenido completo de la jeringa precargada en el vial que contiene el polvo. Agitar suavemente para mezclarlo totalmente. Extraer totalmente el contenido del vial con la misma jeringa e inyectar la vacuna por vía subcutánea o intramuscular. Se deberá inspeccionar visualmente la vacuna reconstituida para detectar cualquier partícula extraña y/o variación en su apariencia física. La vacuna no debe usarse si se detecta cualquier partícula extraña o si la apariencia no es un líquido incoloro transparente a amarillo pálido después de la reconstitución. Es importante utilizar una nueva jeringa y nueva aguja estériles para cada paciente con el fin de prevenir la transmisión de agentes infecciosos de una persona a otra. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Sanofi Pasteur MSD, S.A. Avenida del Partenón Madrid 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN 14/10/ FECHA DE LA REVISIÓN DEL TEXTO Diciembre de 15
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
FICHA TÉCNICA. Nota: La utilización de Priorix debe realizarse de acuerdo a las recomendaciones oficiales.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA. * cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
Vacunas Varicela- Herpes Zoster. Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC
 Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
FICHA TÉCNICA. STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. No se han establecido la seguridad y efectividad en niños menores de 12 meses.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vaqta 25 Unidades/0,5 ml suspensión inyectable en jeringa precargada. Vacuna antihepatitis A, inactivada, adsorbida. Para niños y adolescentes. 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vaqta 25 Unidades/0,5 ml suspensión inyectable en jeringa precargada. Vacuna antihepatitis A, inactivada, adsorbida. Para niños y adolescentes. 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DURAMUNE CACHORROS DP + C Liofilizado y disolvente para suspensión inyectable para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
PROSPECTO: INFORMACIÓN PARA EL USUARIO. PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos
 PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado)
 1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA INGREDIENTES ACTIVOS Cada dosis de 0,5 ml de vacuna reconstituida contiene:
 1. NOMBRE DEL MEDICAMENTO PENTAVAC Vacuna de difteria, tétanos, tosferina acelular y poliomielitis inactivada, adsorbida y Vacuna de Haemophilus influenzae tipo b conjugada. 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO PENTAVAC Vacuna de difteria, tétanos, tosferina acelular y poliomielitis inactivada, adsorbida y Vacuna de Haemophilus influenzae tipo b conjugada. 2. COMPOSICIÓN CUALITATIVA
Vacunaciones en grupos de riesgo
 Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
FICHA TECNICA. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
Vacuna triple vírica (sarampión, rubeola, parotiditis)
 Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
PROGRAMA DE VACUNACIONES VACUNACIÓN FRENTE A VARICELA A LOS 11 AÑOS
 PROGRAMA DE VACUNACIONES VACUNACIÓN FRENTE A VARICELA A LOS 11 AÑOS Revisión noviembre 2012 El Calendario Oficial de Vacunaciones de Castilla y León incluye desde 2005 la vacuna frente a la varicela a
PROGRAMA DE VACUNACIONES VACUNACIÓN FRENTE A VARICELA A LOS 11 AÑOS Revisión noviembre 2012 El Calendario Oficial de Vacunaciones de Castilla y León incluye desde 2005 la vacuna frente a la varicela a
Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Por dosis de 0,4 ml de vacuna reconstituida con el diluyente (agua para preparaciones inyectables):
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac KC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 0,4 ml de vacuna reconstituida con el diluyente
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac KC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 0,4 ml de vacuna reconstituida con el diluyente
POLIOMIELITIS INTRODUCCIÓN INDICACIONES
 POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. TRIAXIS, suspensión inyectable.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
VACUNACIÓN EN HUESPEDES ESPECIALES
 VACUNACIÓN EN HUESPEDES ESPECIALES E N F E R M E R A V A N E S A A R G Ü E L L O INMUNIDAD BACTERIANAS VIRALES VIVAS ATENUADAS BCG Sarampión Paperas Rubéola Varicela OPV Fiebre Amarilla Rotavirus INACTIVADAS
VACUNACIÓN EN HUESPEDES ESPECIALES E N F E R M E R A V A N E S A A R G Ü E L L O INMUNIDAD BACTERIANAS VIRALES VIVAS ATENUADAS BCG Sarampión Paperas Rubéola Varicela OPV Fiebre Amarilla Rotavirus INACTIVADAS
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS
 VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO M-M-RVAXPRO polvo y disolvente para suspensión inyectable Vacuna del sarampión, la parotiditis y la rubéola
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO M-M-RVAXPRO polvo y disolvente para suspensión inyectable Vacuna del sarampión, la parotiditis y la rubéola
Prospecto: información para el usuario. DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral)
 Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Lactofilus polvo oral
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
Documentos Técnicos n.º 2
 Documentos Técnicos n.º 2 1 PAUTAS HABITUALES DE VACUNACIÓN Y ACTUALIZACIÓN DE CALENDARIO DE VACUNACIONES. AÑO 2006. Lo deseable es incorporar al niño que comienza o completa su vacunación al calendario
Documentos Técnicos n.º 2 1 PAUTAS HABITUALES DE VACUNACIÓN Y ACTUALIZACIÓN DE CALENDARIO DE VACUNACIONES. AÑO 2006. Lo deseable es incorporar al niño que comienza o completa su vacunación al calendario
FICHA TÉCNICA. Polisacárido capsular Vi purificado de Salmonella typhi (cepa Ty2)...25 microgramos
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE
 FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
FICHA TÉCNICA. Carbocisteína 50 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES
 DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Vacunación Infantil. www.madrid.org
 Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Sustancias activas: Virus RSB, cepa EV908, inactivado mínimo 10 5,5 *
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BOVIPAST RSP, suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BOVIPAST RSP, suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. SPASMOBRONCHAL 0,03 mg/ml SOLUCIÓN INYECTABLE PARA EQUINO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SPASMOBRONCHAL 0,03 mg/ml SOLUCIÓN INYECTABLE PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SPASMOBRONCHAL 0,03 mg/ml SOLUCIÓN INYECTABLE PARA EQUINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
Prospecto: información para el usuario
 Prospecto: información para el usuario Boostrix, Suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
Prospecto: información para el usuario Boostrix, Suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
Esquema nacional de vacunación 2015
 Esquema nacional de vacunación 2015 Definiciones en el PAI Susceptible Cualquier persona o animal que supuestamente no posee suficiente resistencia contra un agente patógeno determinado, que le proteja
Esquema nacional de vacunación 2015 Definiciones en el PAI Susceptible Cualquier persona o animal que supuestamente no posee suficiente resistencia contra un agente patógeno determinado, que le proteja
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FOSFOEVAC 10,8g / 24,4g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada frasco contiene: Fosfato disódico
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FOSFOEVAC 10,8g / 24,4g solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada frasco contiene: Fosfato disódico
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
BOLETÍN EPIDEMIOLÓGICO DE CASTILLA-LA MANCHA DICIEMBRE 2002/ Vol.14 /No 50 PREVENCIÓN Y CONTROL DE LA GRIPE (II)*
 BOLETÍN EPIDEMIOLÓGICO DE CASTILLA-LA MANCHA DICIEMBRE 2002/ Vol.14 /No 50 PREVENCIÓN Y CONTROL DE LA GRIPE (II)* RECOMENDACIONES DEL COMITÉ ASESOR DE ESTRATEGIAS DE INMUNIZACIÓN RECOMENDACIONES PARA EL
BOLETÍN EPIDEMIOLÓGICO DE CASTILLA-LA MANCHA DICIEMBRE 2002/ Vol.14 /No 50 PREVENCIÓN Y CONTROL DE LA GRIPE (II)* RECOMENDACIONES DEL COMITÉ ASESOR DE ESTRATEGIAS DE INMUNIZACIÓN RECOMENDACIONES PARA EL
La vacuna pentavalente oral contra rotavirus puede ser tolerable
 La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de
La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de
VACUNACIÓN FRENTE A LA ENFERMEDAD NEUMOCÓCICA EN MAYORES EN CASTILLA-LA MANCHA
 VACUNACIÓN FRENTE A LA ENFERMEDAD NEUMOCÓCICA EN MAYORES EN CASTILLA-LA MANCHA JUSTIFICACION El neumococo (Streptococcus Pneumoniae) es el responsable de enfermedades invasoras, entre las que destacan
VACUNACIÓN FRENTE A LA ENFERMEDAD NEUMOCÓCICA EN MAYORES EN CASTILLA-LA MANCHA JUSTIFICACION El neumococo (Streptococcus Pneumoniae) es el responsable de enfermedades invasoras, entre las que destacan
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA. 2. ANTES DE USAR Minoxidil Viñas 5% solución cutánea
 1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Focetria suspensión inyectable en jeringa precargada Vacuna antigripal pandémica (antígenos de superficie,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Focetria suspensión inyectable en jeringa precargada Vacuna antigripal pandémica (antígenos de superficie,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ALIZIN 30 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 1 ml contiene: sustancia activa
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ALIZIN 30 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 1 ml contiene: sustancia activa
Innovax ILT suspensión y disolvente para suspensión inyectable para pollos
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Innovax ILT suspensión y disolvente para suspensión inyectable para pollos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis (0,2 ml) de vacuna reconstituida
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Innovax ILT suspensión y disolvente para suspensión inyectable para pollos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis (0,2 ml) de vacuna reconstituida
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
Prospecto: información para el usuario. Cebión 500 mg granulado para solución oral. Ácido ascórbico (Vitamina C)
 Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
CALENDARIO DE VACUNACIONES PARA ADOLESCENTES Y ADULTOS.
 Calendario de vacunaciones sistemáticas del adulto y recomendaciones de vacunación para los adultos que presentan determinadas condiciones médicas o conductas de riesgo Grupo de Vacunas de la Sociedad
Calendario de vacunaciones sistemáticas del adulto y recomendaciones de vacunación para los adultos que presentan determinadas condiciones médicas o conductas de riesgo Grupo de Vacunas de la Sociedad
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
. Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje.
 . Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje. GMSI C/09 Las vacunaciones recomendadas para destinos
. Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje. GMSI C/09 Las vacunaciones recomendadas para destinos
QUÉ ES LA HEPATITIS C? CÓMO SE CONTAGIA?
 QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Rotavec Corona Emulsión inyectable para bovino 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Rotavec Corona Emulsión inyectable para bovino 2. COMPOSICIÓN
Transfusión de sangre
 Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
INFORMACIÓN ADICIONAL
 DE: DIRECCIÓN GENERAL DE SALUD PÚBLICA 01/12/2015 VACUNACIÓN FRENTE A TOS FERINA EN EL TERCER TRIMESTRE ASUNTO: DEL EMBARAZO INFORMACIÓN ADICIONAL Referencia: mmd VACUNA A EMPLEAR Hasta nueva indicación
DE: DIRECCIÓN GENERAL DE SALUD PÚBLICA 01/12/2015 VACUNACIÓN FRENTE A TOS FERINA EN EL TERCER TRIMESTRE ASUNTO: DEL EMBARAZO INFORMACIÓN ADICIONAL Referencia: mmd VACUNA A EMPLEAR Hasta nueva indicación
Que es la rubéola? Todas las personas que se contagian con el virus de la rubéola tienen los síntomas de la enfermedad?
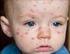 Que es la rubéola? Es una enfermedad causad por un virus. Se caracteriza por fiebre, ganglios agrandados (principalmente en el cuello y detrás de las orejas) y erupción en la piel que dura de 3 a 5 días,
Que es la rubéola? Es una enfermedad causad por un virus. Se caracteriza por fiebre, ganglios agrandados (principalmente en el cuello y detrás de las orejas) y erupción en la piel que dura de 3 a 5 días,
Menalgil B 6 Comprimidos
 agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
LOS SÍNTOMAS DE LA INFECCIÓN AGUDA POR VIH SERÍAN MÁS VARIADOS DE LO QUE SE PENSABA
 LOS SÍNTOMAS DE LA INFECCIÓN AGUDA POR VIH SERÍAN MÁS VARIADOS DE LO QUE SE PENSABA Se identifican diversos síntomas atípicos de la primo infección, algunos de ellos graves, aunque poco frecuentes Nota:
LOS SÍNTOMAS DE LA INFECCIÓN AGUDA POR VIH SERÍAN MÁS VARIADOS DE LO QUE SE PENSABA Se identifican diversos síntomas atípicos de la primo infección, algunos de ellos graves, aunque poco frecuentes Nota:
PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014.
 PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014. A quiénes está dirigida la campaña? A todas aquellas personas nacidas entre 1967 y 1986 que no puedan comprobar
PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014. A quiénes está dirigida la campaña? A todas aquellas personas nacidas entre 1967 y 1986 que no puedan comprobar
PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA
 PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA 22.05.2015 Este procedimiento de actuación se enmarca en el desarrollo
PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA 22.05.2015 Este procedimiento de actuación se enmarca en el desarrollo
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Prospecto: información para el usuario. Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro
 Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
FICHA TÉCNICA. Líquido oral. Líquido oleoso homogéneo, transparente, de color amarillo pálido
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
Plasimine está indicado para el tratamiento de las siguientes infecciones cutáneas causadas por microorganismos sensibles (ver sección 5.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH)
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Porcilis ColiClos suspensión inyectable para cerdos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Porcilis ColiClos suspensión inyectable para cerdos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada sobre de MOVICOL Pediátrico contiene los siguientes principios activos:
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
Prospecto: información para el usuario. Benzac 100 mg/g gel Peróxido de benzoilo
 Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario. Sorbenor 1g solución oral Aspartato de Arginina
 Prospecto: información para el usuario Sorbenor 1g solución oral Aspartato de Arginina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Sorbenor 1g solución oral Aspartato de Arginina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Mª Ángeles Suárez Rodríguez. Noviembre 2015
 Mª Ángeles Suárez Rodríguez. Noviembre 2015 MOTIVO DE CONSULTA Paciente varón de 20 meses que acude a consulta por manchas en la piel. Comenta la familia que las manchas aparecieron hace 24 horas. No han
Mª Ángeles Suárez Rodríguez. Noviembre 2015 MOTIVO DE CONSULTA Paciente varón de 20 meses que acude a consulta por manchas en la piel. Comenta la familia que las manchas aparecieron hace 24 horas. No han
County of Santa Cruz. Preguntas Generales Acerca del Sarampión HEALTH SERVICES AGENCY COMMUNICABLE DISEASE UNIT. Qué es el sarampión?
 County of Santa Cruz HEALTH SERVICES AGENCY COMMUNICABLE DISEASE UNIT POST OFFICE BOX 962, 1060 EMELINE AVENUE SANTA CRUZ, CA 95061-0962 (831) 454-4114 FAX: (831) 454-5049 TDD: (831) 454-4123 Preguntas
County of Santa Cruz HEALTH SERVICES AGENCY COMMUNICABLE DISEASE UNIT POST OFFICE BOX 962, 1060 EMELINE AVENUE SANTA CRUZ, CA 95061-0962 (831) 454-4114 FAX: (831) 454-5049 TDD: (831) 454-4123 Preguntas
Prospecto: información para el usuario. NovoThirteen 2.500 UI polvo y disolvente para solución inyectable
 Prospecto: información para el usuario NovoThirteen 2.500 UI polvo y disolvente para solución inyectable catridecacog (factor XIII de coagulación recombinante) Este medicamento está sujeto a seguimiento
Prospecto: información para el usuario NovoThirteen 2.500 UI polvo y disolvente para solución inyectable catridecacog (factor XIII de coagulación recombinante) Este medicamento está sujeto a seguimiento
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos
 GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
FICHA TÉCNICA. Cantidad: Los ingredientes activos en 1 ml de VITALIPID INFANTIL corresponden a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
