Gabriel Villalobos Profesor de Física y Química de secundaria MEZCLAS
|
|
|
- Valentín Gutiérrez Navarrete
- hace 8 años
- Vistas:
Transcripción
1 MEZCLAS Gabriel Villalobos 1. Sistemas materiales homogéneos y heterogéneos Clasificación Desde un punto de vista experimental. Podemos clasificar la materia que nos encontramos en la naturaleza entre: Sistemas materiales homogéneos. Son aquellos que tienen la misma composición y propiedades en cualquier punto del sistema. Como por ejemplo, el agua del grifo, un trozo de acero, la sal de la cocina, el aire que respiramos Sistemas materiales heterogéneos. Tienen distintas composiciones y propiedades en distintas partes. Por ejemplo, un trozo de granito, el agua turbia de un charco, un trozo de madera, la sangre, la leche Alguien puede pensar que la sangre y la leche son homogéneas, pero al mirarlas por un microscopio, se ven unas partes distintas de otras. Sustancias puras y mezclas Los sistemas heterogéneos son claramente una mezcla de varias sustancias, puesto que a simple vista o con ayuda de un microscopio se pueden distinguir unas sustancias de otras de las que forman la mezcla. Sin embargo, un sistema material homogéneo puede tratarse de una sustancia pura (que puede ser simple o compuesto), o puede tratarse de una mezcla de sustancias, pero que se encuentran mezcladas a nivel de partículas. Puesto que las partículas no las alcanzamos a ver, ya que son muy pequeñas, no podemos apreciar ni con un microscopio unas partes distintas de otras. El agua del grifo es un ejemplo de sistema material homogéneo que no es una sustancia pura, puesto que junto con el agua, se encuentra mezclado a nivel de partículas distintas sales y óxidos. Otro ejemplo, es el aire, que es una mezcla de nitrógeno, oxígeno y argón fundamentalmente. El acero es una aleación de hierro y carbono, sus partículas están entremezcladas. Reconocimiento de sustancias puras de las mezclas homogéneas La pregunta está clara, si tenemos un sistema material homogéneo, cómo podemos saber si se trata de una sustancia pura o de una mezcla homogénea? La matera de hacerlo es teniendo en cuenta que las propiedades características de una sustancia pura, no cambian ante los cambios de estado o ante una división del sistema material en dos partes. Homogeneidad ante los cambios de estado. Con este nombre estamos indicando la propiedad de que las sustancias puras mantienen sus propiedades ante los cambios de estado. Por ejemplo, se calentamos agua pura hasta que hierva (a presión atmosférica), comprobaremos que hierve a 100ºC, y mientras hierve, la temperatura no 1
2 cambia. Esto es debido a que la temperatura de ebullición a esta presión es siempre 100ºC, no cambia. Sin embargo, si hervimos agua del grifo, observaremos que empieza a hervir a una temperatura un poquito mayor de 100ºC, y que mientras hierve, la temperatura no permanece constante, sino que va aumentando, aunque muy lentamente. Es decir, la propiedad temperatura de ebullición no permanece constante, sino que va aumentando. Homogeneidad ante la división. De esta manera, estamos llamando a la propiedad que nos dice que las sustancias puras, al dividirlas en dos, mantienen sus propiedades características. Depende de cómo dividamos el sistema material. Desde luego, si el agua del grifo contenida en un vaso la repartimos entre dos recipientes, podemos comprobar que el agua de los dos recipientes tienen propiedades idénticas. Pero si hervimos el agua del grifo, podemos comprobar que cuando se escape toda el agua, habrá dejado un rastro blanco en el fondo del recipiente. Esta sustancia se encontraba antes mezclada en el agua, y ahora está pegada en el recipiente. Por tanto, si condensamos los gases que se producen, conseguimos dividir el agua del grifo en dos partes, quedándonos dos sustancias distintas: agua pura y sales. Si el agua que hervimos fuese agua pura (agua destilada), cuando se escapara toda el agua, veríamos que no deja ningún rastro, que si recogemos los gases y los condensamos nuevamente, veremos que tiene las mismas propiedades que antes, ya que se trata de la misma sustancia. 2. Métodos de separación de mezclas Se aprovecharán las propiedades de la mezcla Como hemos dicho con anterioridad, la mayoría de las sustancias nos las encontramos mezcladas en la naturaleza. Sin embargo, se han ideado distintos métodos para separar las sustancias que nos interesa de estas mezclas. Dependiendo de cuáles sean las propiedades de las sustancias mezcladas se utilizará un procedimiento u otro para separar las mezclas. Por ejemplo, si alguien recoge la arenilla que hay en una canaleta de un tejado, puede comprobar que mezclada con la tierra hay micrometeoritos. Diariamente caen estos micrometeoritos. Suelen ser pequeñas esferitas de hierro. Miradas por el microscopio se ve que se debieron fundir al entrar a la atmósfera, y que se han solidificado nuevamente mientras caían. Cómo podemos separar los micrometeoritos del resto de la tierra? Podría hacerse de distintas maneras, pero una manera muy rápida de hacerlo, es aprovechando que los micrometeoritos son atraídos por un imán, mientras que el resto de la tierra no. Por consiguiente, echamos la mezcla sobe un papel, y por debajo ponemos un imán. Veremos cómo unas pequeñas partículas se quedan pegadas al imán con el papel por medio. Si le damos la vuelta, se caerá la tierra menos los micrometeoritos. Así, se nos quedan separados los micrometeoritos del resto una vez que recojamos las partículas que se quedaron en el papel. 2
3 Como vemos, hemos aprovechado las propiedades de esta mezcla, para separar la sustancia que nos interesaba. Esto mismo habrá que hacer con cualquier mezcla que queramos separar. Habrá que ver qué propiedades podremos aprovechar. Sin embargo, hay algunos métodos que suelen utilizarse muy a menudo cuando la mezcla cumple unas determinadas propiedades. A veces, para separar una mezcla, hay que aplicar más de un método como ya veremos. Decantación Este método se utiliza con mezclas líquidas heterogéneas, en las que hay sustancias con distintas densidades. Por ejemplo, el agua turbia es una mezcla heterogénea ya que hay pequeñas partículas sólidas en suspensión. Una manera de separar estas partículas del resto de agua, es mediante la decantación. Este método consiste simplemente en dejar reposar esta mezcla en un recipiente el tiempo necesario. Las particulitas sólidas, se van depositando en el fondo. Al cabo de cierto tiempo, podrá observarse que el agua ha quedado transparente con todo el lodo en el fondo. Ahora es cuestión de ir recogiendo el agua de encima con mucho cuidado (sin remover) con una jeringuilla o una pipeta. De esta manera, podremos recuperar gran cantidad de agua. No quiere decir que esta agua recuperada sea agua pura. Seguramente esté mezclada con sales que habrá que separar ahora por otro método. Si lo que queremos recuperar es el lodo seco sin agua, lo que deberemos hacer es quitarle todo el agua que podamos, y luego ponerlo en un recipiente ancho el resto que nos quede para que se evapore el agua restante. Por decantación también se puede separar una mezcla de dos líquidos que no mezclen bien (inmiscibles), como por ejemplo agua y aceite. Al dejar reposar esta mezcla, el aceite (que es menos denso) se sitúa en la superficie, y el resto es agua. Con una jeringuilla o con una pipeta, podemos extraer de la mezcla gran cantidad de aceite. Si lo que se quiere es recuperar el agua (el líquido que queda abajo), se utiliza un embudo de decantación. Es un recipiente de vidrio con forma de embudo y con una llave en el fondo. Abriendo esta llave, podemos dejar que salga el líquido que queda abajo en la mezcla. Centrifugado Este método es en definitiva una decantación. En un tubo de ensayo se introduce la mezcla, y se hace girar muy rápidamente. Para esto se utilizan centrifugadoras, que son máquinas diseñadas para este fin. El efecto de centrifugar es hacer como una decantación con una gravedad mucho más grande que la que tenemos, así se consiguen separar mezclas líquidas heterogéneas muy finas. Como la sangre, la leche, etc. Filtrado En un laboratorio de Química se utiliza papel de filtro para filtrar. Este papel tiene sus poros lo suficientemente grandes como para que pasen las moléculas de los líquidos, pero no las pequeñas partículas que tenga un líquido en suspensión. 3
4 Por eso, este método se utiliza para mezclas líquidas heterogéneas, consistentes en un sólido en suspensión con un líquido. Podría ser, agua turbia. O por ejemplo, cuando en el laboratorio, después de una reacción se forma un precipitado que cae al fondo, lo podemos recuperar filtrando. Calentamiento a sequedad Se utiliza este método en el caso de mezclas líquidas homogéneas, como por ejemplo, el agua del grifo. Se trata de calentar la mezcla hasta la ebullición. El líquido empieza a transformarse en gas escapándose, mientras que las sales disueltas se van quedando. Al final queda una costra en el fondo del recipiente. Así, lo que hacemos es recuperar las sales que había disueltas en el agua. Cristalización Este método, igual que el anterior, se utiliza para mezclas líquidas gaseosas. La diferencia está en que no calentamos el líquido, sino que dejamos que se evapore a temperatura ambiente. Lógicamente, utilizaremos este método cuando no tengamos prisa, o cuando que ramos recuperar las sustancias disueltas en forma de pequeños cristales. Al tratarse de un método muy lento, da tiempo a que las partículas disueltas se vayan ordenando conforme se van quedando sin el líquido. En un laboratorio de química, se utilizan unos recipientes de vidrio especiales (cristalizadores), que son muy anchos para que el líquido se evapore más rápido. Destilación Se suele utilizar este método para separar una mezcla homogénea de dos líquidos. Por ejemplo, agua y alcohol. Son dos líquidos que se mezclan muy bien, por eso se trata de una mezcla homogénea. La destilación se produce en un alambique. Se trata de un matraz que contiene la mezcla con un termómetro incorporado. Este matraz se va a calentar hasta la ebullición. Si lo que tenemos es una mezcla de agua y alcohol, empezará a hervir la mezcla a una temperatura intermedia entre 78.6ºC (que es la temperatura de ebullición del etanol) y 100ºC (que es la temperatura de ebullición del agua), dependiendo de las cantidades en las que se encuentren los dos líquidos. Los gases que se producen son de etanol ya que hierve a una temperatura inferior que el agua. Así, la mezcla cada vez será más pobre en alcohol y más rica en agua. Por eso, cada vez, la mezcla hierve a una temperatura mayor (puesto que cada vez hay más agua). Cuando la temperatura del matraz llegue a 100 ºC, sabemos que ya se ha escapado todo el alcohol, y o que queda es agua. Así habemos recuperado el agua. El alcohol también se recupera, puesto que en un alambique, los gases son reconducidos y enfriados para que vuelvan a estado líquido. Por eso el alcohol se recupera en otro recipiente. 4
5 3. Disoluciones Utilidad de las disoluciones Una disolución, es una mezcla homogénea. Por tanto, se trata de dos o más sustancias mezcladas a nivel de moléculas o átomos, de tal manera que es imposible observar que la disolución no es una sustancia pura. Ya hemos estudiado cómo identificar si un sistema material homogéneo se trata de una sustancia pura o de una mezcla. En los laboratorios se utilizan mucho las disoluciones. Por qué? Por varias razones. Imagínate que queremos utilizar para un experimento gramos de una sustancia sólida. Sería una locura trabajar con una cantidad tan pequeña. Cometeríamos muchos errores, ya que esta cantidad podría tener un volumen en torno a un milímetro cúbico. Pero si esta sustancia se mezcla bien con el agua, podríamos echar 1 g de ella y mezclarla con agua hasta completar un volumen total de un litro. La cantidad g, es 1/200 parte de 1 g, por consiguiente, si cogemos 5 cm 3 del litro de disolución, que es 1/200 parte del litro, tenemos la seguridad de que en esos 5 cm 3 hay g de nuestra sustancia. Un volumen de 5 cm 3 es una cantidad bastante cómoda de manejar. Por otro lado, otra ventaja es a la hora de hacer reaccionar nuestra sustancia con cualquier otra. Como veremos cuando estudiemos las reacciones químicas, una sustancia reacciona más rápido cuanto mayor sea el grado de división. Y nuestra sustancia en disolución se encuentra ya dividida al máximo. Una disolución puede encontrarse en estado sólido (como las aleaciones), en estado líquido (como las sales en el agua del grifo) o en estado gaseoso (como el aire). En los laboratorios se utiliza mucho, por las razones anteriores, disoluciones líquidas. A la sustancia que se encuentra en mayor cantidad, que se encuentra en el mismo estado que la propia disolución, se le llama disolvente. A la otra sustancia que se encuentra en menor proporción, se le llama soluto. En una disolución puede haber varios solutos. Por ejemplo, si disolvemos sal en agua, el agua es el disolvente, y la sal el soluto. Volumen de una disolución líquida Experimentalmente se comprueba que los volúmenes no se pueden sumar al formar una disolución. Es decir, al mezclar un determinado volumen de sal con un determinado volumen de agua, no se obtiene una disolución cuyo volumen sea la suma de estos dos volúmenes. Se comprueba que el volumen de la mezcla, siempre es menor que el de la suma de volúmenes. Al mezclarse las moléculas o átomos, ocupan menos, ya que entre los huecos de las moléculas de una sustancia se introducen las de la otra sustancia. La masa de una disolución sí que es la suma de las masas. Ya que el número de moléculas o átomos que tengamos antes de mezclar es el mismo que después de mezclar. Disolver sólidos en líquidos 5
6 Cuando se quiere formar una disolución de un sólido en un líquido, es conveniente tener en cuenta los factores que favorecen los factores que hacen el proceso de disolución más rápido. Primero, cuanto mayor sea el grado de división del sólido, más rápidamente se disuelve. Si queremos disolver sal en agua, se disuelve antes si echamos sal triturada que si echamos un trozo del mineral de sal. Las moléculas de agua tienen que atacar a las moléculas de sal para ir arrancándoles de la red cristalina. Esto ocurre antes, cuantas más moléculas de sal estén en contacto con las moléculas de agua. Segundo, si agitamos, hacemos que se disuelva antes. Ya que al agitar, hacemos que las moléculas de sal recién arrancadas, se separen del trozo de cristal para que otras moléculas de agua puedan atacar a las siguientes moléculas de sal. Y tercero, calentar mientras se disuelve. Se puede entender que aumentar la temperatura, aumenta la velocidad de disolución ya que es otra menara indirecta de agitar. Concentración de una disolución Cuando formamos una disolución, podemos hacerla en distintas proporciones. Ya veremos en el siguiente apartado cómo puede expresarse numéricamente la proporción de soluto que hay en una disolución. Ahora, sólo introduciremos una terminología que se utiliza mucho al hablar de disoluciones relacionada con la concentración. Cuando a una disolución, no le cabe más soluto disuelto, es decir, si tratamos de disolver más, vemos que no se puede, se dice que la disolución está saturada. Por ejemplo, en un vaso de agua, se puede ir disolviendo sal poco a poco. Se observa que la sal desaparece completamente ante nuestros ojos. Pero llega un momento, en que si tratamos de disolver más sal, vemos que cae al fondo. Ya no se disuelve. Entonces, decimos que la disolución está saturada. Una disolución es concentrada, si le falta poco para que esté saturada. Es decir, tiene mucho soluto, con respecto al que le cabe. Por último, una disolución es diluida, si tiene poco soluto en comparación con el soluto que le cabe para que esté saturada. Si tenemos una disolución con una concentración grande y queremos transformarla a otra con una concentración menor, deberemos añadir disolvente. Así la proporción de soluto en la disolución disminuye. A este proceso, se le llama diluir. Como vemos, diluir es añadir disolvente a una disolución para hacer su concentración menor. Se confunde muchas veces diluir con disolver. Lo contrario a diluir es concentrar. Si queremos concentrar una disolución, lo más fácil, es añadir soluto: así, aumenta la proporción de soluto en la disolución. Solubilidad La solubilidad de una sustancia e n otra, es un dato numérico que nos informa de la cantidad máxima que se puede disolver la primera en la segunda 6
7 sustancia. Es decir, nos indica cuánta sustancia podemos mezclar para saturar la disolución. Este dato tiene sentido sobre todo, en disoluciones de solutos sólidos en líquidos, o de gases en líquidos, que es cuando se pueden saturar las disoluciones. Por ejemplo, al disolver alcohol en agua, no tiene sentido hablar de solubilidad, ya que esta disolución nunca se satura. Una manera muy habitual de expresar la saturación, es indicando cuántos gramos de soluto se pueden disolver el 100 g de disolvente. Este valor es distinto lógicamente para cada sustancia. Por ejemplo, la solubilidad de cloruro sódico (sal de cocina) en agua es de g g agua Esto significa que en 100 g de agua, o lo que es lo mismo para el caso del agua, en 100 cm 3 de agua, se pueden disolver 36 g de sal como máximo. La solubilidad del azúcar en agua es g g agua En 100 cm 3 de agua, s puede disolver 204 g de azúcar. Vulgarmente, decimos que el azúcar es más soluble en agua que la sal, ya que en el mismo volumen de agua, cabe más azúcar que sal. Los datos anteriores, son la solubilidad a 20ºC. Hay que indicar siempre la temperatura a la que se ha determinado la solubilidad, ya que la solubilidad depende de la temperatura. En general, al aumentar la temperatura de una disolución de sólido en líquido, aumenta la solubilidad. Así, si tenemos una disolución saturada, si la calentamos, podremos conseguir disolver algo más. Al contrario ocurre con las disoluciones de gases en líquidos. Si aumentamos la temperatura, le cabe menos gas disuelto. Por eso, podemos ver que al abrir una botella de refresco con gas, se escapa mucho gas si el refresco está caliente. Sin embargo, si está frío, no se escapa a penas gas al abrir la botella. Ahora podemos comprender lo perjudicial que puede ser que el agua de un río o un lago, aumente un poco. Los peces respiran el oxígeno que hay disuelto en el agua. Si aumenta la temperatura del agua, se escapa oxígeno, ya que no cabe tanto disuelto, y los peces, pueden morir asfixiados. Propiedades coligativas de las disoluciones Son propiedades que no dependen de la naturaleza de las sustancias que forman el soluto y el disolvente, ni de la cantidad en gramos de soluto que haya disueltos. Únicamente dependen de la cantidad de moléculas (o átomos) de soluto que hay disueltos. Las propiedades coligativas a las que nos vamos a referir son la temperatura de fusión, la temperatura de ebullición y la ósmosis. Cuando tenemos una sustancia pura, como por ejemplo agua (que sabemos que a la presión de una atmósfera funde a 0ºC y hierve a 100ºC), y le 7
8 disolvemos otra sustancia (da igual qué sustancia), la temperatura de fusión se hará menor que 0ºC. Ahora podemos entender mejor, por qué echamos sal en las carreteras para fundir el hielo. Al añadir sal al hielo, estamos haciendo que se mezclen y se forma una disolución de sal en agua, cuya temperatura de fusión no está a 0ºC, sino que a -17.8ºC. Por tanto, si estamos a una temperatura, por ejemplo de - 5ºC, estaremos a una temperatura por encima de la temperatura de fusión de la disolución de agua con sal. La temperatura de ebullición es una temperatura que está entre las temperaturas de ebullición de las dos sustancias. Así, si mezclamos sal y agua, la temperatura de ebullición será mayor de 100ºC. Tanto mayor cuantas más moléculas de sal disolvamos. Si por el contrario, disolvemos alcohol en agua, la temperatura de ebullición estará entre 100ºC y 78ºC, que es la temperatura de ebullición del alcohol. Veamos en qué consiste el fenómeno de la ósmosis. Supongamos que tenemos un tubo en forma de U, donde en la parte de abajo hay una membrana semipermeable, que separa la U en dos partes. Una membrana semipermeable es una membrana que deja pasar a través de sus poros moléculas muy pequeñas, como pueden ser las de agua. Si por ejemplo en el agua disolvemos sal, las moléculas de sal no caben por los poros de esta membrana. Imaginemos que echamos agua pura por una de las ramas del tubo en U. Qué pasará? Pues que poco a poco, irán pasando moléculas de agua a través de la membrana, hasta que el nivel del agua sea igual en las dos ramas. En el equilibrio, no significa que no estén pasando moléculas a través de la membrana. Lo que ocurre es que pasan moléculas de agua en ambos sentidos a igual velocidad. Imaginemos, que por una de las ramas del tubo en U echamos un poquito de sal para que se disuelva. Observaríamos que el nivel del líquido en la disolución de sal en agua, iría aumentando hasta llegar a un equilibrio, en el que el nivel del agua pura queda por debajo del nivel de la disolución. Explicación. Cuando echamos la sal en una de las ramas, estamos haciendo que las moléculas de agua de la disolución, tengan más dificultad en pasar por 8
9 la membrana, ya les están estorbando las moléculas más gordas de sal que hay mezcladas con ellas. Por tanto, se ha roto el equilibrio que antes de echar la sal había. Ahora van a pasar más moléculas de agua desde el agua pura hasta la disolución, que al revés. Por consiguiente, el volumen de disolución aumenta, y su nivel sube. Conforme sube el nivel, hace que la presión en el fondo de la disolución aumente, y obliga a las moléculas de agua de la disolución, que pasen más rápidamente hacia en agua pura a través de la membrana. En el momento que se igualen las velocidades de paso de las moléculas de agua en los dos sentidos, se alcanzará un nuevo equilibrio, pero con los niveles a distintas alturas. Al aumento de presión que aparece en la disolución, se le llama presión osmótica. Esta presión es muy importante para mantener las células hinchadas. 4. Expresiones de la concentración de una disolución Hay muchas maneras de expresar la proporción de soluto que hay en una disolución. Nosotros vamos a estudiar dos de ellas. Tanto por ciento en masa o en peso Se expresa la concentración de la disolución indicando en qué tanto por ciento en peso (o masa, es lo mismo) se encuentra el soluto en toda la disolución. Es decir, se indica los gramos de soluto que hay en 100 g de disolución. Se deduce fácilmente la siguiente fórmula para calcular la concentración por este método. m ( g) soluto % P = 100 m( g) disolución Donde m(g) significa la masa expresada en gramos. Esta forma de indicar la concentración se suele utilizar en disoluciones sólidas. Gramos por litro de disolución Se expresa los gramos de soluto que hay en cada litro de disolución. Para calcular la concentración den gramos por litro, se deduce fácilmente la siguiente expresión, m ( g) soluto g / l = V ( l) disolución Donde V (l) significa el volumen de la disolución expresado en gramos. Se utiliza esta manera en disoluciones de sólidos o gases en líquidos. Ejemplo Determinemos la concentración de una disolución saturada de sal en agua a 20ºC. La densidad de esta disolución es de 1030 g/l. Anteriormente, hemos dicho que la solubilidad de la sal en agua es de 9
10 g g agua Gabriel Villalobos Esto significa que en 136 g de disolución, 36 g son de sal y 100 g de agua. Lo tenemos todo para calcular la concentración en tanto por ciento en peso. m( g) soluto 36 g % P = 100 = 100 = 26.47% m( g) disolución 136 g Hay que interpretar correctamente este resultado. De cada 100 g de esta disolución, g son de sal. Para calcular la concentración en g/l, es necesario determinar el volumen de la disolución. Para ello, es necesario conocer la densidad de la disolución. Con la expresión de la densidad de la disolución, vamos a determinar el volumen de disolución que ocupa una masa de 136 g de disolución. m m 136 g d = V = = = l = 132 cm V d g 1030 l Luego los 136 g de disolución ocupan 132 cm 3. m( g) soluto 36 g g / l = = V ( l) disolución l = La interpretación de este resultado es que en cada litro de disolución hay g de sal. Tanto por ciento en volumen Se emplea para disoluciones de líquidos en líquidos o gases en gases. Se expresa la concentración de la disolución indicando en qué tanto por ciento en volumen se encuentra el soluto en toda la disolución. Es decir, se indica los litros de soluto que hay en 100 litros de disolución. En realidad puede ser cualquier unidad de volumen. Se deduce fácilmente la siguiente fórmula para calcular la concentración por este método. V ( l) soluto % V = 100 V ( l) disolución Donde V (l) significa el volumen expresado en litros. Esta manera de indicar la concentración la vemos mucho en las bebidas. Por ejemplo un whisky de 40º (cuarenta grados), es una disolución de varias sustancias en agua, y que el alcohol se encuentra en una concentración del 40% en volumen. En un litro de este whisky, 0.4 l = 400 cm 3 son de alcohol puro. g l 3 10
TEMA 3. CLASIFICACIÓN DE LA MATERIA.
 TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
FÍSICA Y QUÍMICA 3ºESO
 TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3ºESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. Por ejemplo siempre tienen
TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3ºESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. Por ejemplo siempre tienen
----------SOLUCIÓN ---------- 1. (b) 8. (a) 2. (a) 29. (b) 30. (c) 22. (d) 23. (b) 24. (a) 25. (b) 26. (d) 27. (c) 28. (a)
 29. Si la presión externa del ambiente que rodea a un líquido aumenta, qué le pasa a la temperatura a la que hierve? a) disminuye b) aumenta c) no cambia d) no se puede saber 30. Las gotas de agua que
29. Si la presión externa del ambiente que rodea a un líquido aumenta, qué le pasa a la temperatura a la que hierve? a) disminuye b) aumenta c) no cambia d) no se puede saber 30. Las gotas de agua que
Tema 13: La materia Ciencias Naturales 1º ESO página 1. Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
 Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
MEZCLAS Y DISOLUCIONES
 Unidades Didácticas Adaptadas 1 MEZCLAS Y DISOLUCIONES Qué vamos a estudiar en este tema?. Aquí tienes el esquema. 1. Las sustancias puras y las mezclas. 2. Observamos las mezclas a nuestro alrededor!
Unidades Didácticas Adaptadas 1 MEZCLAS Y DISOLUCIONES Qué vamos a estudiar en este tema?. Aquí tienes el esquema. 1. Las sustancias puras y las mezclas. 2. Observamos las mezclas a nuestro alrededor!
Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia.
 TEMA 02 Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia. -.-.-.-.-.-.-.-.-..-..-..-..-..-..-.-..-..-..-..-..-.-..-.-..-.-.-.-..-.-...-..-.-..-.-..-.-..-.-..-.-..-.-..-.-..-.-
TEMA 02 Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia. -.-.-.-.-.-.-.-.-..-..-..-..-..-..-.-..-..-..-..-..-.-..-.-..-.-.-.-..-.-...-..-.-..-.-..-.-..-.-..-.-..-.-..-.-..-.-
PCPI Ámbito Científico-Tecnológico LA MATERIA
 LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación.
 PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
2 Sustancias puras y mezclas
 2 Sustancias puras y mezclas Sustancias puras Llamamos sustancia pura a cualquier material que tiene unas propiedades características que la distinguen claramente de otras. Algunas de estas propiedades
2 Sustancias puras y mezclas Sustancias puras Llamamos sustancia pura a cualquier material que tiene unas propiedades características que la distinguen claramente de otras. Algunas de estas propiedades
Tema 3: Ecuaciones químicas y concentraciones
 Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
LA MATERIA, SUS PROPIEDADE, ESTADOS Y DIFERENTES CLASES DE SUSTANCIAS
 LA MATERIA, SUS PROPIEDADE, ESTADOS Y DIFERENTES CLASES DE SUSTANCIAS 1.- Todos los objetos y cuerpos están formados por alguna sustancia. Las sustancias puede ser distintas, pero todo es materia. La materia
LA MATERIA, SUS PROPIEDADE, ESTADOS Y DIFERENTES CLASES DE SUSTANCIAS 1.- Todos los objetos y cuerpos están formados por alguna sustancia. Las sustancias puede ser distintas, pero todo es materia. La materia
DISOLUCIONES. Molécula de agua (disolvente) iones solvatados
 DISOLUCIONES Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la
DISOLUCIONES Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la
Tema 4: Sustancias puras y mezclas
 Tema 4: Sustancias puras y mezclas Esquema de trabajo: 1. Sustancias puras: Tipos: elementos y compuestos. 2. Mezclas: Tipos: Homogénea y heterogénea 3. Disoluciones Concepto Componentes Tipos de disoluciones
Tema 4: Sustancias puras y mezclas Esquema de trabajo: 1. Sustancias puras: Tipos: elementos y compuestos. 2. Mezclas: Tipos: Homogénea y heterogénea 3. Disoluciones Concepto Componentes Tipos de disoluciones
Tema 7. Las mezclas. Introducción
 Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
Tema 7. Las mezclas Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las sustancias puras son los elementos y los compuestos que
TEORÍA CINÉTICA. CAMBIOS DE ESTADO 3ºESO
 1. ESTADOS DE AGREGACIÓN DE LA MATERIA La materia se puede encontrar en la naturaleza en tres estados de agregación o estados físicos: sólido, líquido y gaseoso. Estos estados poseen unas propiedades que
1. ESTADOS DE AGREGACIÓN DE LA MATERIA La materia se puede encontrar en la naturaleza en tres estados de agregación o estados físicos: sólido, líquido y gaseoso. Estos estados poseen unas propiedades que
Disoluciones químicas
 Disoluciones químicas Recordemos. Qué son las disoluciones químicas? Mezcla homogénea, constituida por dos o más componentes Soluciones = disoluciones COMPONENTES DE UNA DISOLUCION SOLUTO: Es la sustancia
Disoluciones químicas Recordemos. Qué son las disoluciones químicas? Mezcla homogénea, constituida por dos o más componentes Soluciones = disoluciones COMPONENTES DE UNA DISOLUCION SOLUTO: Es la sustancia
Solubilidad. Material de apoyo, Segundo Medio monica.ibanez@lbvm. onica.ibanez@lbvm.clcl 15:21
 Solubilidad Material de apoyo, Segundo Medio monica.ibanez@lbvm. onica.ibanez@lbvm.clcl Obj. de hoy: Señalar que es Solubilidad y los factores que la afectan. Qué es algo SOLUBLE? La Solubilidad corresponde
Solubilidad Material de apoyo, Segundo Medio monica.ibanez@lbvm. onica.ibanez@lbvm.clcl Obj. de hoy: Señalar que es Solubilidad y los factores que la afectan. Qué es algo SOLUBLE? La Solubilidad corresponde
Curso 2014/15 Física y Química 3º ESO ACTIVIDADES DE REFUERZO PRIMER TRIMESTRE Nombre: Apellidos:
 Curso 2014/15 Física y Química 3º ESO ACTIVIDADES DE REFUERZO PRIMER TRIMESTRE Nombre: Apellidos: Fecha de entrega: día del examen de recuperación. 1. Contesta brevemente las siguientes preguntas relacionadas
Curso 2014/15 Física y Química 3º ESO ACTIVIDADES DE REFUERZO PRIMER TRIMESTRE Nombre: Apellidos: Fecha de entrega: día del examen de recuperación. 1. Contesta brevemente las siguientes preguntas relacionadas
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq
 qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq ACTIVIDADES DE RECUPERACIÓN DE FÍSICA Y QUÍMICA 3º ESO 2º TRIMESTRE
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq ACTIVIDADES DE RECUPERACIÓN DE FÍSICA Y QUÍMICA 3º ESO 2º TRIMESTRE
1. a) Define Sustancia pura: Es aquella que tiene la misma composición y las mismas propiedades. b) Define Disolución: Es una mezcla homogénea.
 Tema 3. LA MATERIA Y SU ASPECTO MEZCLAS Y SUSTANCIAS PURAS 1. a) Define Sustancia pura: Es aquella que tiene la misma composición y las mismas propiedades. b) Define Disolución: Es una mezcla homogénea.
Tema 3. LA MATERIA Y SU ASPECTO MEZCLAS Y SUSTANCIAS PURAS 1. a) Define Sustancia pura: Es aquella que tiene la misma composición y las mismas propiedades. b) Define Disolución: Es una mezcla homogénea.
MEZCLAS Y METODOS http://biologiaudes.wordpress.com/periodo-4/mezclas-y-metodos-deseparacion/de SEPARACION
 MEZCLAS Y METODOS http://biologiaudes.wordpress.com/periodo-4/mezclas-y-metodos-deseparacion/de SEPARACION Las Mezclas Son materiales que contienen dos o más sustancias simple, que pueden ser separadas
MEZCLAS Y METODOS http://biologiaudes.wordpress.com/periodo-4/mezclas-y-metodos-deseparacion/de SEPARACION Las Mezclas Son materiales que contienen dos o más sustancias simple, que pueden ser separadas
MEZCLAS Y DISOLUCIONES. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 MEZCLAS Y DISOLUCIONES Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las
MEZCLAS Y DISOLUCIONES Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Ya sabes que los sistemas materiales se pueden clasificar según su composición en sustancias puras y mezclas. Las
CIENCIAS DE LA NATURALEZA 1º ESO BLOQUE FÍSICA / QUÍMICA
 CIENCIAS DE LA NATURALEZA 1º ESO BLOQUE FÍSICA / QUÍMICA El último bloque de la asignatura de ciencias de la naturaleza corresponde al estudio de los conceptos más básicos de física y química. La FÍSICA
CIENCIAS DE LA NATURALEZA 1º ESO BLOQUE FÍSICA / QUÍMICA El último bloque de la asignatura de ciencias de la naturaleza corresponde al estudio de los conceptos más básicos de física y química. La FÍSICA
ESTADOS DE LA MATERIA. CAMBIOS DE ESTADO.
 ESTADOS DE LA MATERIA. CAMBIOS DE ESTADO. Propiedades generales y específicas. Densidad. Estados de agregación de la materia. Cambios de estado. Diferencias entre evaporación y ebullición. Temperatura
ESTADOS DE LA MATERIA. CAMBIOS DE ESTADO. Propiedades generales y específicas. Densidad. Estados de agregación de la materia. Cambios de estado. Diferencias entre evaporación y ebullición. Temperatura
1. MATERIA Y SU ASPECTO
 1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS
 TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
1. Las propiedades de los gases
 1. Las propiedades de los gases Para establecer por qué las diferentes sustancias tienen unas propiedades características de cada una de ellas (densidades, puntos de cambios de estado, solubilidad en agua,
1. Las propiedades de los gases Para establecer por qué las diferentes sustancias tienen unas propiedades características de cada una de ellas (densidades, puntos de cambios de estado, solubilidad en agua,
Métodos de separación en mezclas
 Los métodos de separación están basados en las diferentes propiedades físicas (como la densidad, la temperatura de ebullición, la solubilidad, el estado de agregación, etc.) de las sustancias que componen
Los métodos de separación están basados en las diferentes propiedades físicas (como la densidad, la temperatura de ebullición, la solubilidad, el estado de agregación, etc.) de las sustancias que componen
Tema 3 CLASIFICACIÓN DE LA MATERIA
 Clasificación de la materia 1 Tema 3 CLASIFICACIÓN DE LA MATERIA 1. ÁTOMOS Y MOLÉCULAS... 1 2. SUSTANCIAS PURAS Y MEZCLAS.... 2 2.1. SUSTANCIAS PURAS... 2 2.2. MEZCLAS... 2 3. SEPARACIÓN DE LOS COMPONENTES
Clasificación de la materia 1 Tema 3 CLASIFICACIÓN DE LA MATERIA 1. ÁTOMOS Y MOLÉCULAS... 1 2. SUSTANCIAS PURAS Y MEZCLAS.... 2 2.1. SUSTANCIAS PURAS... 2 2.2. MEZCLAS... 2 3. SEPARACIÓN DE LOS COMPONENTES
Materia. Mezclas Son aquellas que están formados por 2 o más sustancias.
 Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
Componentes de una disolución. El disolvente El soluto Concentración de una disolución. concentración solubilidad
 Componentes de una disolución. Todas las disoluciones tienen dos componentes: El disolvente es el componente que se encuentra en mayor proporción. Este componente no cambia de estado. El soluto es el componente
Componentes de una disolución. Todas las disoluciones tienen dos componentes: El disolvente es el componente que se encuentra en mayor proporción. Este componente no cambia de estado. El soluto es el componente
oluciones del apartado «Resuelve problemas»
 S oluciones del apartado «Resuelve problemas» Pág. 1 19 Un café con azúcar es una mezcla homogénea o heterogénea? Es una disolución de sólidos (café y azúcar) en agua. 20 Un material formado por moléculas
S oluciones del apartado «Resuelve problemas» Pág. 1 19 Un café con azúcar es una mezcla homogénea o heterogénea? Es una disolución de sólidos (café y azúcar) en agua. 20 Un material formado por moléculas
Actividad: Mezcla homogénea o heterogénea?
 Mezcla homogénea o heterogénea? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Mezcla homogénea o heterogénea? Cuál es la diferencia entre una mezcla homogénea y una heterogénea?
Mezcla homogénea o heterogénea? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Mezcla homogénea o heterogénea? Cuál es la diferencia entre una mezcla homogénea y una heterogénea?
Cuando la sustancia que se difunde es el agua, y cuando la difusión se lleva a cabo a través de una membrana semi-permeable el proceso se llama
 OSMOSIS Cuando la sustancia que se difunde es el agua, y cuando la difusión se lleva a cabo a través de una membrana semi-permeable el proceso se llama ósmosis. También el movimiento del agua hacia abajo
OSMOSIS Cuando la sustancia que se difunde es el agua, y cuando la difusión se lleva a cabo a través de una membrana semi-permeable el proceso se llama ósmosis. También el movimiento del agua hacia abajo
CONCENTRACIÓN DE LAS DISOLUCIONES
 CONCENTRACIÓN DE LAS DISOLUCIONES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza
CONCENTRACIÓN DE LAS DISOLUCIONES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza
CLASIFICACIÓN DE LA MATERIA
 1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1.- Como se presenta la materia a) Sistemas homogéneos: b) Sistemas heterogéneos: 2.- Las mezclas: a) Mezclas heterogéneas:
 T3: Diversidad de la materia. 1.- Como se presenta la materia. a) Sistemas homogéneos: Son sistemas materiales que tienen el mismo aspecto en cualquiera de sus partes. Ejm: agua, aluminio, agua de mar
T3: Diversidad de la materia. 1.- Como se presenta la materia. a) Sistemas homogéneos: Son sistemas materiales que tienen el mismo aspecto en cualquiera de sus partes. Ejm: agua, aluminio, agua de mar
4. TEORÍA ATÓMICO-MOLECULAR
 4. TEORÍA ATÓMICO-MOLECULAR Sustancias que reaccionan 1. Explica qué son los procesos o cambios físicos y pon ejemplos de ellos. Los procesos o cambios físicos no producen modificaciones en la naturaleza
4. TEORÍA ATÓMICO-MOLECULAR Sustancias que reaccionan 1. Explica qué son los procesos o cambios físicos y pon ejemplos de ellos. Los procesos o cambios físicos no producen modificaciones en la naturaleza
Apuntes Disoluciones
 Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la propia disolución
Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir el soluto, el disolvente y la propia disolución
Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la
 Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
Se entiende por disolución toda mezcla homogénea de dos o más componentes en proporción variable.
 6. DISOLUCIONES 6.1. Generalidades Se entiende por disolución toda mezcla homogénea de dos o más componentes en proporción variable. Las disoluciones objeto de nuestro estudio serán binarias, en las que
6. DISOLUCIONES 6.1. Generalidades Se entiende por disolución toda mezcla homogénea de dos o más componentes en proporción variable. Las disoluciones objeto de nuestro estudio serán binarias, en las que
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Sistemas Físicos y Químicos
 1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
Cantidad de sustancia. Gases. Disoluciones.
 1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
UNIDAD DIDÁCTICA: MEZCLAS Y DISOLUCIONES
 Unidades Didácticas Adaptadas: MEZCLAS Y DISOLUCIONES 1 UNIDAD DIDÁCTICA: MEZCLAS Y DISOLUCIONES Qué vamos a estudiar en este tema?. Aquí tienes el esquema. 1. Las sustancias puras y las mezclas. 2. Observamos
Unidades Didácticas Adaptadas: MEZCLAS Y DISOLUCIONES 1 UNIDAD DIDÁCTICA: MEZCLAS Y DISOLUCIONES Qué vamos a estudiar en este tema?. Aquí tienes el esquema. 1. Las sustancias puras y las mezclas. 2. Observamos
La riqueza en peso nos dice que en 100 gramos de disolución hay 37 gramos de soluto, de modo que en 1180 gramos de disolución habrá:
 40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
LA MATERIA. - Masa - Volumen -Energía - Carga eléctrica. Propiedades generales
 TEMA 2 La Materia LA MATERIA Propiedades generales - Masa - Volumen -Energía - Carga eléctrica Propiedades características - Densidad - Punto de fusión - Punto de ebullición -Conductividad eléctrica -
TEMA 2 La Materia LA MATERIA Propiedades generales - Masa - Volumen -Energía - Carga eléctrica Propiedades características - Densidad - Punto de fusión - Punto de ebullición -Conductividad eléctrica -
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq
 qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq Actividades de recuperación de 2º trimestre 3º ESO wertyuiopasdfghjklzxcvbnmqwertyui
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq Actividades de recuperación de 2º trimestre 3º ESO wertyuiopasdfghjklzxcvbnmqwertyui
LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES
 LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES I.- INTRODUCCIÓN A) Soluciones La materia puede presentarse en forma de mezclas o sustancias puras. Cuando una mezcla tiene una composición uniforme, en cualquier
LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES I.- INTRODUCCIÓN A) Soluciones La materia puede presentarse en forma de mezclas o sustancias puras. Cuando una mezcla tiene una composición uniforme, en cualquier
Cuáles de ellas son una disolución? Por qué dices que son disoluciones? Puedes identificar alguna sustancia que las forma?
 : MATERIAL PARA EL ALUMNADO Sustancias solubles y no solubles en agua Actividad 1. Qué sabemos sobre las sustancias solubles? Identificar bebidas que utilizamos en nuestra vida cotidiana. En nuestra vida
: MATERIAL PARA EL ALUMNADO Sustancias solubles y no solubles en agua Actividad 1. Qué sabemos sobre las sustancias solubles? Identificar bebidas que utilizamos en nuestra vida cotidiana. En nuestra vida
DISOLUCIONES. Líquido (H 2 O)
 DISOLUCIONES IES La Magdalena. Avilés. Asturias Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir
DISOLUCIONES IES La Magdalena. Avilés. Asturias Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos a más sustancias. En las disoluciones hay que distinguir
TEMA 2: LA MATERIA: CÓMO SE PRESENTA?
 TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
TEMA 3.- Naturaleza de la. materia (II)
 TEMA 3.- Naturaleza de la 1.- Concepto de mezcla. Tipos. materia (II) ÍNDICE GENERAL 2.- Separación de los componentes de una mezcla. 2.1.- Separación de los componentes de mezclas heterogéneas. 2.1.1.-
TEMA 3.- Naturaleza de la 1.- Concepto de mezcla. Tipos. materia (II) ÍNDICE GENERAL 2.- Separación de los componentes de una mezcla. 2.1.- Separación de los componentes de mezclas heterogéneas. 2.1.1.-
Ejercicios resueltos sobre el estado de agregación de la materia. Estudio de las disoluciones
 Ejercicios resueltos sobre el estado de agregación de la materia. Estudio de las disoluciones Recordemos algunos conceptos teóricos en nuestro nivel. Toda disolución tiene dos componentes: a) Soluto b)
Ejercicios resueltos sobre el estado de agregación de la materia. Estudio de las disoluciones Recordemos algunos conceptos teóricos en nuestro nivel. Toda disolución tiene dos componentes: a) Soluto b)
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS
 PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
CONTENIDOS MÍNIMOS Y CRITERIOS DE EVALUACIÓN
 4 La materia: estados de agregación. Objetivos Observar el aspecto y otras características de la materia, en sus diversos estados de agregación: sólido, líquido y gaseoso. Distinguir y aplicar a ejercicios
4 La materia: estados de agregación. Objetivos Observar el aspecto y otras características de la materia, en sus diversos estados de agregación: sólido, líquido y gaseoso. Distinguir y aplicar a ejercicios
PROBLEMAS DE DISOLUCIONES 1º Bachillerato.-
 1 - Cuántos gramos de ácido nítrico son necesarios para preparar 1,5 litros de disolución acuosa de dicho ácido 0,6 M?. (Solución: 56,7 g) 2 - Una disolución 0,25 m de cloruro de sodio contiene 58,5 g
1 - Cuántos gramos de ácido nítrico son necesarios para preparar 1,5 litros de disolución acuosa de dicho ácido 0,6 M?. (Solución: 56,7 g) 2 - Una disolución 0,25 m de cloruro de sodio contiene 58,5 g
LA MATERIA SISTEMAS MATERIALES CAMBIOS PROPIEDADES POSEE SE TRANSFORMA FORMA. pueden ser. pueden ser. pueden ser QUÍMICOS FÍSICOS
 LA MATERIA POSEE FORMA SE TRANSFORMA PROPIEDADES SISTEMAS MATERIALES CAMBIOS pueden ser pueden ser pueden ser GENERALES PARTICULARES ESPECIFÍCAS HOMOGÉNEOS HETEROGÉNEOS FÍSICOS QUÍMICOS MASA VOLUMEN TEMPERATURA
LA MATERIA POSEE FORMA SE TRANSFORMA PROPIEDADES SISTEMAS MATERIALES CAMBIOS pueden ser pueden ser pueden ser GENERALES PARTICULARES ESPECIFÍCAS HOMOGÉNEOS HETEROGÉNEOS FÍSICOS QUÍMICOS MASA VOLUMEN TEMPERATURA
SUSTANCIAS PURAS (Repaso) MEZCLAS (Repaso)
 Física y Química 4 ESO DISOLUCIONES Pág. 1 SUSTANCIAS PURAS (Repaso) MEZCLAS (Repaso) Pág. 2 DISOLUCIONES Física y Química 4 ESO DISOLUCIONES CONCEPTO DE DISOLUCIÓN. COMPONENTES DE UNA DISOLUCIÓN. Una
Física y Química 4 ESO DISOLUCIONES Pág. 1 SUSTANCIAS PURAS (Repaso) MEZCLAS (Repaso) Pág. 2 DISOLUCIONES Física y Química 4 ESO DISOLUCIONES CONCEPTO DE DISOLUCIÓN. COMPONENTES DE UNA DISOLUCIÓN. Una
Materia: Todo aquello que existe en el universo, que posee masa y está ocupando un lugar en el
 LA QUÍMICA La química estudia la naturaleza de la materia, su composición, propiedades, transformaciones que sufre y las leyes que gobiernan esos cambios. Materia: Todo aquello que existe en el universo,
LA QUÍMICA La química estudia la naturaleza de la materia, su composición, propiedades, transformaciones que sufre y las leyes que gobiernan esos cambios. Materia: Todo aquello que existe en el universo,
Todo lo que vemos es materia
 Todo lo que vemos es materia CLASIFICACIÓN DE LA MATERIA La materia se presenta en la naturaleza en forma de sustancias puras y mezclas, de modo que podemos establecer la siguiente clasificación: CLASIFICACIÓN
Todo lo que vemos es materia CLASIFICACIÓN DE LA MATERIA La materia se presenta en la naturaleza en forma de sustancias puras y mezclas, de modo que podemos establecer la siguiente clasificación: CLASIFICACIÓN
Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua.
 Sistemas materiales Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua. Mezcla Heterogénea: unión de dos o más sustancias de
Sistemas materiales Materia: es aquello que ocupa un lugar en el espacio y cuyas propiedades percibimos por los sentidos. Es diversa y discontinua. Mezcla Heterogénea: unión de dos o más sustancias de
SOLUCIONES. Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva Santiago (Concepción)
 SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
Física y Química: guía interactiva para la resolución de ejercicios
 Física y Química: guía interactiva para la resolución de ejercicios CLASIFICACIÓN DE LA MATERIA I.E.S. Élaios Departamento de Física y Química EJERCICIO 1 (a) En un vaso tenemos alcohol que calentamos
Física y Química: guía interactiva para la resolución de ejercicios CLASIFICACIÓN DE LA MATERIA I.E.S. Élaios Departamento de Física y Química EJERCICIO 1 (a) En un vaso tenemos alcohol que calentamos
d (g/cm 3 ) d (kg/l) Masa Volumen a) Un kilogramo de etanol ocupa más volumen que un kilogramo de acetona.
 La materia. Los líquidos Ficha de trabajo 1 Nombre y apellidos:... Curso:... Fecha: La densidad de los líquidos El líquido más abundante es el agua, cuya densidad es de 1 kg/l; debido a ello, estamos habituados
La materia. Los líquidos Ficha de trabajo 1 Nombre y apellidos:... Curso:... Fecha: La densidad de los líquidos El líquido más abundante es el agua, cuya densidad es de 1 kg/l; debido a ello, estamos habituados
TEMA 2: DIVERSIDAD DE LA MATERIA
 TEMA 2: DIVERSIDAD DE LA MATERIA 1.- La materia: sustancias puras y mezclas. 1.1.- La materia. 1.1.1.- Estados de agregación de la materia. 1.1.2.- Propiedades generales y características de la materia.
TEMA 2: DIVERSIDAD DE LA MATERIA 1.- La materia: sustancias puras y mezclas. 1.1.- La materia. 1.1.1.- Estados de agregación de la materia. 1.1.2.- Propiedades generales y características de la materia.
03 DISOLUCIONES. 2 Observando la curva de solubilidad del clorato potásico, responder:
 03 DISOLUCIONES 1 Sabemos que cierta disolución tiene una concentración de c = 512 g/l. Si su densidad es1,43 g/l, expresa el valor de su concentración en tanto por ciento. 2 Observando la curva de solubilidad
03 DISOLUCIONES 1 Sabemos que cierta disolución tiene una concentración de c = 512 g/l. Si su densidad es1,43 g/l, expresa el valor de su concentración en tanto por ciento. 2 Observando la curva de solubilidad
Soluciones y solubilidad Capítulo 3
 Soluciones y solubilidad Capítulo 3 Editorial Contexto 010 - www.editorialcontexto.com.uy - 9019493 Una solución es todo sistema homogéneo formado por más de una sustancia. Al mencionar soluciones es necesario
Soluciones y solubilidad Capítulo 3 Editorial Contexto 010 - www.editorialcontexto.com.uy - 9019493 Una solución es todo sistema homogéneo formado por más de una sustancia. Al mencionar soluciones es necesario
La materia se puede definir como todo aquello que tiene masa y ocupa un volumen.
 Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
MATERIAL DE LABORATORIO
 MATERIAL DE LABORATORIO Vasos de precipitado. Pueden ser de dos formas: altos o bajos. Sin graduar o graduados y nos dan un volumen aproximado (los vasos al tener mucha anchura nunca dan volúmenes precisos).
MATERIAL DE LABORATORIO Vasos de precipitado. Pueden ser de dos formas: altos o bajos. Sin graduar o graduados y nos dan un volumen aproximado (los vasos al tener mucha anchura nunca dan volúmenes precisos).
Experimental Intercolegial. Mezclas
 Prueba experimental intercolegial 25 de junio de 2010 Experimental Intercolegial Mezclas Introducción En nuestra vida, diariamente tenemos contacto con algún tipo de mezcla, como por ejemplo, el aire que
Prueba experimental intercolegial 25 de junio de 2010 Experimental Intercolegial Mezclas Introducción En nuestra vida, diariamente tenemos contacto con algún tipo de mezcla, como por ejemplo, el aire que
CONCEPTOS BÁSICOS EN QUÍMICA
 CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
Calorimetría y cambios de estado
 Calorimetría y cambios de estado Calor y temperatura En primer lugar, tenemos que saber distinguir entre estos dos conceptos. En el lenguaje cotidiano los utilizamos como si fueran lo mismo, pero en física
Calorimetría y cambios de estado Calor y temperatura En primer lugar, tenemos que saber distinguir entre estos dos conceptos. En el lenguaje cotidiano los utilizamos como si fueran lo mismo, pero en física
DISOLUCIONES 1.- QUÉ ES UNA DISOLUCIÓN?
 DISOLUCIONES 1.- QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y
DISOLUCIONES 1.- QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y
Clasificación de la materia
 Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
2. Estados de agregación de la materia: sólido, líquido y gaseoso.
 TEMA 3. La materia. Estados de agregación de la materia: sólido, líquido y gaseoso. Teoría cinética y cambios de estado. Sustancias puras y mezclas. Métodos de separación de mezclas. Disoluciones. 1. La
TEMA 3. La materia. Estados de agregación de la materia: sólido, líquido y gaseoso. Teoría cinética y cambios de estado. Sustancias puras y mezclas. Métodos de separación de mezclas. Disoluciones. 1. La
RELACIÓN DE PROBLEMAS. DISOLUCIONES Y PROPIEDADES COLIGATIVAS.
 RELACIÓN DE PROBLEMAS. Y PROPIEDADES COLIGATIVAS. 1.- Se disuelven 150 gramos de etanol (CH 3 CH 2 OH), de densidad 0,8 g /cm 3, en agua hasta completar 0,5 litros de disolución. Calcular el porcentaje
RELACIÓN DE PROBLEMAS. Y PROPIEDADES COLIGATIVAS. 1.- Se disuelven 150 gramos de etanol (CH 3 CH 2 OH), de densidad 0,8 g /cm 3, en agua hasta completar 0,5 litros de disolución. Calcular el porcentaje
2. Métodos de separación de los componentes de una mezcla.
 TEMA 3: Mezclas, disoluciones y sustancias puras. 1. Clasificación de la materia. 2. Métodos de separación de los componentes de una mezcla. 3. Disoluciones. a) Definición. b) Cómo se preparan. c) Concentración.
TEMA 3: Mezclas, disoluciones y sustancias puras. 1. Clasificación de la materia. 2. Métodos de separación de los componentes de una mezcla. 3. Disoluciones. a) Definición. b) Cómo se preparan. c) Concentración.
UNIDADES DE CONCENTRACIÓN
 Colegio San Esteban Diácono Departamento de Ciencias Química IIº Medio Prof. Juan Pastrián / Sofía Ponce de León UNIDADES DE CONCENTRACIÓN 1. Porcentaje masa/masa (%m/m) Cantidad en masa (g) de un componente
Colegio San Esteban Diácono Departamento de Ciencias Química IIº Medio Prof. Juan Pastrián / Sofía Ponce de León UNIDADES DE CONCENTRACIÓN 1. Porcentaje masa/masa (%m/m) Cantidad en masa (g) de un componente
TRANSFORMACIONES QUÍMICAS 1.- SUSTANCIAS PURAS, ELEMENTOS Y COMPUESTOS
 TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS
 UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
QUÍMICA I. TEMA 1: Estado Físico de la materia
 QUÍMICA I TEMA 1: Estado Físico de la materia Tecnólogo Minero - 2014 E s q u e m a d e l a C l a s e Tema 1: Estado físico de la materia La materia Clasificación de la materia Estado Sólido, liquido y
QUÍMICA I TEMA 1: Estado Físico de la materia Tecnólogo Minero - 2014 E s q u e m a d e l a C l a s e Tema 1: Estado físico de la materia La materia Clasificación de la materia Estado Sólido, liquido y
ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD
 Práctico 2 Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten;
Práctico 2 Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten;
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Propiedades Coligativas. Química General II 2011
 Propiedades Coligativas Química General II 2011 Propiedades coligativas Son propiedades de las disoluciones líquidas. Dependen de la concentración del soluto, mas que de la naturaleza de la disolución.
Propiedades Coligativas Química General II 2011 Propiedades coligativas Son propiedades de las disoluciones líquidas. Dependen de la concentración del soluto, mas que de la naturaleza de la disolución.
La materia y sus propiedades
 SECCIÓN 1.2 La materia y sus propiedades Todo lo que te rodea está formado por materia. Los libros, los escritorios, las computadoras, los árboles y los edificios están formados por materia, al igual que
SECCIÓN 1.2 La materia y sus propiedades Todo lo que te rodea está formado por materia. Los libros, los escritorios, las computadoras, los árboles y los edificios están formados por materia, al igual que
2. MECANISMO DE DISOLUCIÓN Y DE HIDRATACIÓN DE IONES.
 1. QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y el disolvente
1. QUÉ ES UNA DISOLUCIÓN? Disoluciones, en química, mezclas homogéneas de dos o más sustancias. El soluto es el componente que se encuentra en distinto estado físico que la disolución; y el disolvente
Estados de la materia y cambios de fase
 3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
3 Año de Química: Sistemas Materiales Prof. Javier Ponce Qué es Ciencia? Ciencia (en latíns cientia, de scire, conocer ), término que en su sentido más amplio se emplea para referirse al conocimiento sistematizado
EJERCICIOS DE EQUILIBRIO QUÍMICO.
 EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
2 - Se han recogido en un vaso 150 ml de agua del mar. Se sabe que su densidad es 1,2 g/cm 3. Cuál será la masa contenida en el vaso?
 SISTEMAS MATERIALES 1- Calcular la densidad en Kg/m 3, en Kg/dm 3 y en g/cm 3 del agua y del hierro sabiendo que 100 g de estas sustancias ocupan respectivamente, un volumen de 0,1 dm 3 y 12,7 cm 3. 2
SISTEMAS MATERIALES 1- Calcular la densidad en Kg/m 3, en Kg/dm 3 y en g/cm 3 del agua y del hierro sabiendo que 100 g de estas sustancias ocupan respectivamente, un volumen de 0,1 dm 3 y 12,7 cm 3. 2
QUÍMICA 2º Bachillerato Ejercicios: Cálculos en Química
 1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
Temperatura. Temperatura. La temperatura es la energía cinética promedio de las partículas. Calor. El calor es una transferencia de energía
 Temperatura Temperatura La temperatura es la energía cinética promedio de las partículas Calor El calor es una transferencia de energía Diferencias entre calor y temperatura Todos sabemos que cuando calentamos
Temperatura Temperatura La temperatura es la energía cinética promedio de las partículas Calor El calor es una transferencia de energía Diferencias entre calor y temperatura Todos sabemos que cuando calentamos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
Problemas disoluciones
 Problemas disoluciones Determinar la concentración de una disolución expresada de diferentes formas: g/l, % en masa y en volumen, Molaridad y fracción molar Preparar disoluciones a partir de solutos sólidos
Problemas disoluciones Determinar la concentración de una disolución expresada de diferentes formas: g/l, % en masa y en volumen, Molaridad y fracción molar Preparar disoluciones a partir de solutos sólidos
TEMA 1. LA MATERIA Y SU ESTUDIO ACTIVIDADES
 TEMA 1. LA MATERIA Y SU ESTUDIO ACTIVIDADES 1. Lee el siguiente texto sobre el método científico y contesta a las preguntas Galileo inventó un telescopio con el que observó el planeta Júpiter y cuatro
TEMA 1. LA MATERIA Y SU ESTUDIO ACTIVIDADES 1. Lee el siguiente texto sobre el método científico y contesta a las preguntas Galileo inventó un telescopio con el que observó el planeta Júpiter y cuatro
UNIDAD 3: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN
 UNIDAD 3: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN MATERIA Es todo aquello que ocupa un lugar en el espacio y tiene la característica de tener masa. SÓLIDOS LÍQUIDOS Algoritmo para reconocer cada uno: SEPARACIÓN
UNIDAD 3: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN MATERIA Es todo aquello que ocupa un lugar en el espacio y tiene la característica de tener masa. SÓLIDOS LÍQUIDOS Algoritmo para reconocer cada uno: SEPARACIÓN
Formas de expresar la concentración de disoluciones. Química General II 2011
 Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
PRÁCTICA 9 PROPIEDADES COLIGATIVAS: DESCENSO CRIOSCÓPICO. Medir el punto de fusión de un compuesto orgánico (para-diclorobenceno) puro.
 PRÁCTICA 9 PROPIEDADES COLIGATIVAS: DESCENSO CRIOSCÓPICO OBJETIVOS Medir el punto de fusión de un compuesto orgánico (para-diclorobenceno) puro. Estudiar el efecto que tiene la adición de pequeñas cantidades
PRÁCTICA 9 PROPIEDADES COLIGATIVAS: DESCENSO CRIOSCÓPICO OBJETIVOS Medir el punto de fusión de un compuesto orgánico (para-diclorobenceno) puro. Estudiar el efecto que tiene la adición de pequeñas cantidades
SOLUCIONARIO. Soluciones. Primer trimestre: PRUEBA A. Sección 1: LOS GASES
 1T Soluciones Primer trimestre: PRUEBA A Sección 1: LOS GASES Si el alumno acierta los cinco ítems que aparecen a continuación: Los sólidos están formados por partículas que se atraen, y los gases, por
1T Soluciones Primer trimestre: PRUEBA A Sección 1: LOS GASES Si el alumno acierta los cinco ítems que aparecen a continuación: Los sólidos están formados por partículas que se atraen, y los gases, por
Departamento Ciencias. Física y Química MATERIA. se clasifica en. SUSTANCIAS PURAS pueden ser. por métodos. físicos originan. Compuestos.
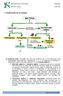 1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
