FARMACOVIGILANCIA. Nota informativa de la AEMPS publicada con fecha 15 de enero de Ref: MUH (FV), 02/2013 y 03/2013
|
|
|
- Francisco Javier Plaza Pérez
- hace 7 años
- Vistas:
Transcripción
1 FARMACOVIGILANCIA Notificación electrónica de sospechas de Reacciones Adversas a Medicamentos por parte de los profesionales sanitarios y los ciudadanos Nota informativa de la AEMPS publicada con fecha 15 de enero de Ref: MUH (FV), 02/2013 y 03/2013 Una de las labores de la Agencia Española de Medicamentos y Productos Sanitarios es la vigilancia de la seguridad de los medicamentos una vez que éstos se encuentran comercializados. Una de las fuentes de información para cumplir este cometido son las notificaciones de sospechas de reacciones adversas a medicamentos (RAM). Hasta ahora estas notificaciones llegaban al Sistema Español de Farmacovigilancia de medicamentos de uso Humano enviadas por los profesionales sanitarios y la industria farmacéutica. La AEMPS ha puesto a disposición de los profesionales sanitarios y de los ciudadanos la página web con objeto de que puedan notificar directamente y de forma electrónica las sospechas de reacciones adversas a medicamentos. Esta dirección web se incluirá de forma paulatina en las fichas técnicas y los prospectos de los medicamentos autorizados en España. En ningún caso esta notificación debe ser considerada un mecanismo de denuncia ni sustituye a la consulta con el médico sobre las posibles reacciones adversas que pudieran aparecer durante el tratamiento. Presenta dos tipos de formularios: uno para ciudadanos y otro para profesionales sanitarios. Si el notificador pertenece a una Comunidad Autónoma que dispone de un formulario electrónico propio, la web le redirecciona automáticamente a dicho formulario. De este modo, a través de un único punto, se puede notificar en todo el Estado español. Está accesible en las diferentes lenguas cooficiales. El formulario permite notificar daños que han sido consecuencia de errores de medicación garantizando la anonimidad del notificador. Una vez completado el formulario, se envía automáticamente al centro de farmacovigilancia de la Comunidad Autónoma del notificador, para su evaluación e incorporación a la base de datos FEDRA sin datos que permitan la identificación personal. El envío de las notificaciones se realiza con las debidas condiciones de seguridad. Cuáles son las características de este nuevo formulario electrónico para la notificación de sospechas de reacciones adversas? Contiene enlaces a textos explicativos (Agencia española de Medicamentos y Productos Sanitarios [Web]. Enero de Notificación de sospechas de reacciones adversas a medicamentos (RAM) de uso Humano. Disponible en: aemps.gob.es/vigilancia/medicamentosusohumano/sefv-h/nra-sefv-h/ home.htm) para facilitar la comprensión y la interpretación de esta forma de notificación de sospechas de RAM. Actualidad en Farmacología y Terapéutica marzo 2013 volumen 11 nº1-19 -
2 Fingolimod (Gilenya ): se amplían las recomendaciones de monitorización Nota informativa de la AEMPS publicada con fecha 14 de enero de Ref: MUH (FV), 01/2013 Se recomienda aplicar el mismo esquema de monitorización establecido para los pacientes a los que se les administra la primera dosis de fingolimod en: Determinados pacientes a los que se les ha interrumpido el tratamiento. Aquellos casos en los que tras administrar la primera dosis, los pacientes presenten bradiarritmia que precise de tratamiento farmacológico. Gilenya (fingolimod) es un medicamento autorizado en la Unión Europea desde enero de 2011, indicado en monoterapia, para el tratamiento de aquellos pacientes con esclerosis múltiple remitente recurrente muy activa en los que la enfermedad es grave y de rápida evolución, o bien no han respondido al tratamiento con interferón beta. En enero de 2012 se recomendó, que para prevenir el posible riesgo cardiovascular, debían tenerse en cuenta nuevas advertencias de uso y debía llevarse a cabo una estrecha monitorización de los pacientes tras la administración de la primera dosis del medicamento. Posteriormente, en diciembre de 2012, se ha llevado a cabo una revisión de los datos procedentes de siete estudios realizados con fingolimod. Dicha revisión puso de manifiesto la necesidad de monitorizar estrechamente a determinados pacientes después de llevar a cabo la interrupción del tratamiento, y a aquellos otros en los que, tras administrar la primera dosis de fingolimod, presenten bradiarritmia que precise de tratamiento farmacológico. Por este motivo, la Agencia Española de Medicamentos y Productos Sanitarios recomienda repetir el mismo esquema de monitorización establecido para los pacientes a los que se les administra la primera dosis de fingolimod cuando: Aparezca bradiarritmia que precise tratamiento farmacológico tras la administración de la primera dosis de fingolimod. Se recuerda que estos pacientes deberán ser monitorizados en un centro médico al menos durante toda la noche. Se interrumpa la administración del medicamento durante al menos un día durante las primeras 2 semanas de tratamiento. Se interrumpa la administración del medicamento durante más de 7 días durante las semanas 3ª y 4ª de tratamiento. Se interrumpa la administración del medicamento durante más de dos semanas después de transcurrido el primer mes de tratamiento. Si el tratamiento se interrumpe durante periodos de tiempo inferiores a los anteriormente mencionados, la administración de la siguiente dosis de fingolimod podrá realizarse según el calendario inicialmente establecido. Adicionalmente a estas nuevas recomendaciones, se recuerda que el esquema de monitorización establecido tras la administración de la primera dosis de fingolimod es el siguiente: Realizar un electrocardiograma antes de administrar la primera dosis y a las 6 horas de administrada ésta. Medir la tensión arterial y la frecuencia cardiaca cada hora durante las 6 primeras horas, siendo recomendable una monitorización electrocardiográfica continua durante este periodo. Se recomienda prolongar el tiempo de monitorización más allá de las 6 horas posteriores a la administración de la primera dosis de fingolimod si: o Al final del periodo de las 6 horas el paciente presenta la frecuencia cardiaca más baja de las observadas desde que se le administró la dosis del medicamento volumen 11 nº 1 marzo 2013 Actualidad en Farmacología y Terapéutica
3 En este caso la monitorización deberá prolongarse hasta que la frecuencia se normalice y en cualquier caso al menos, durante un periodo de 2 horas. o Si durante las 6 horas posteriores a la administración de la primera dosis de fingolimod se presenta alguna de las siguientes condiciones clínicas, se recomienda prolongar la monitorización al menos durante toda la noche: Frecuencia cardiaca 45 lpm Intervalo QTc 500 msec Bloqueo AV (no preexistente) de 2º grado o superior. Inicio de la revisión de la seguridad de los medicamentos que contienen tetrazepam Nota informativa de la AEMPS publicada con fecha 17 de enero de Ref: MUH (FV), 04/2013 La Agencia Española de Medicamentos y Productos Sanitarios informa del inicio de la revisión de los medicamentos que contienen tetrazepam en el contexto del Comité europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC). Este procedimiento finalizará en abril y no es necesario por el momento ningún tipo de acción adicional en los pacientes tratados con este medicamento. La AEMPS ha informado sobre el inicio de la revisión de los medicamentos que contienen tetrazepam por parte del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC), comité científico de la Agencia Europea de Medicamentos constituido por representantes de todas las agencias nacionales europeas. Esta revisión se lleva a cabo a iniciativa de las autoridades francesas como consecuencia de algunos datos nuevos sobre una mayor frecuencia de reacciones adversas cutáneas graves con este medicamento en comparación con otras benzodiacepinas. Estas reacciones adversas ya están descritas en la ficha técnica. El procedimiento que sigue es el de un arbitraje por el artículo 107i de la Directiva 2001/83/EC y finalizará en abril. Este tipo de procedimiento se pone en marcha cuando alguno de los Estados miembros o la propia Comisión Europea considera que puede ser necesaria una acción conjunta en toda la Unión Europea por un problema de seguridad. Sin embargo, el inicio del procedimiento no prejuzga el resultado final del mismo ya que los datos aportados por las autoridades francesas deben ser estudiados por el PRAC en el contexto de otros datos y consideraciones que se puedan aportar durante el procedimiento de arbitraje. En España hay un único medicamento que contiene tetrazepam como principio activo, Myolastan de Sanofi Aventis, S.A., ampliamente utilizado como relajante muscular en el contexto de diferentes patologías musculoesqueléticas. La AEMPS no considera que sea necesaria ninguna acción o medida adicional en este momento y hasta que concluya el arbitraje. Una vez finalizado el mismo, la AEMPS informará a los pacientes y a los profesionales de su resultado y, en su caso, de las acciones llevadas a cabo. Actualidad en Farmacología y Terapéutica marzo 2013 volumen 11 nº1-21 -
4 Inicio de la revisión de la seguridad de los anticonceptivos orales combinados de tercera y cuarta generación Nota informativa de la AEMPS publicada con fecha 29 de enero de Ref: MUH (FV), 06/2013 La AEMPS ha informado del inicio de la revisión de los anticonceptivos orales de tercera y cuarta generación por parte del Comité para la Evaluación de Riesgos en Farmacovigilancia. Los anticonceptivos orales combinados de tercera y cuarta generación son aquellos que contienen como progestágeno los siguientes principios activos: desogestrel, gestodeno, norgestimato, drospirenona o nomegestrol. Esta revisión se lleva a cabo a iniciativa de las autoridades francesas y tiene como objetivo evaluar si la información actualmente proporcionada en las fichas técnicas y los prospectos es suficiente para que los profesionales sanitarios y las usuarias puedan tomar la mejor decisión sobre su tratamiento. La seguridad de los anticonceptivos orales ha sido revisada de forma continua por las Agencias de medicamentos de los países de la Unión Europea. Es un hecho ampliamente conocido que el uso de los anticonceptivos orales conlleva un riesgo muy poco frecuente de tromboembolismo venoso. En términos absolutos este riesgo oscila entre 20 y 40 casos por cada mujeres usuarias y año y varía con los diferentes anticonceptivos orales, estando los anticonceptivos orales de tercera y cuarta generación en el rango superior de riesgo. Esta información está incluida en la ficha técnica y los prospectos de los diferentes anticonceptivos, que se han ido actualizando a lo largo de los años conforme se ha ido disponiendo de nuevos datos procedentes de estudios epidemiológicos. La revisión actual no está motivada por nuevos datos ni existe actualmente ningún motivo para modificar los tratamientos en curso, aunque se recuerda a profesionales y usuarias la necesidad de seguir las instrucciones de la ficha técnica y el prospecto de los medicamentos para garantizar su uso seguro. Inicio de la revisión del balance beneficio-riesgo de los medicamentos que contienen acetato de ciproterona en combinación con etinilestradiol Nota informativa de la AEMPS publicada con fecha 30 de enero de Ref: MUH (FV), 07/2013 La AEMPS ha informado del inicio de la revisión del balance beneficio-riesgo de los medicamentos que contienen acetato de ciproterona en combinación con etinilestradiol. Esta revisión es consecuencia del comunicado emitido por la Agencia Francesa de Medicamentos en el que anuncia su decisión de suspender próximamente la comercialización de estos medicamentos. El argumento principal de dicha Agencia para adoptar esta decisión es el riesgo de tromboembolismo y su posible uso al margen de la indicación de uso autorizada en Francia (tratamiento del acné). En nuestro país, los medicamentos compuestos por acetato de ciproterona en combinación con etinilestradiol fueron autorizados por primera vez en En el año 2002 se restringió su indicación al tratamiento de enfermedades andrógeno-dependientes en mujeres, tales como acné, especialmente las formas pronunciadas y aquellas que van acompañadas de seborrea, o de inflamación o formación de nódulos (acné papulopustuloso, acné volumen 11 nº 1 marzo 2013 Actualidad en Farmacología y Terapéutica
5 noduloquístico), alopecia androgénica y formas leves de hirsutismo. Las fichas técnicas de estos productos indican que si bien son medicamentos que actúan como anticonceptivo oral, no deberán utilizarse en mujeres solamente con fines anticonceptivos. Su empleo debe reservarse para aquellas mujeres que requieran tratamiento de las enfermedades andrógenodependientes indicadas. Adicionalmente se recomienda la suspensión del tratamiento 3 ó 4 ciclos después de la resolución completa de las enfermedades indicadas, no debiéndose continuar la administración solamente con fines anticonceptivos. Estas restricciones se realizaron en base al resultado de diversos estudios epidemiológicos que mostraban un riesgo de tromboembolismo venoso mayor que el obtenido en usuarias de anticonceptivos orales combinados. ampliamente conocido que aparece recogido en las fichas técnicas de estos medicamentos; en ellas se especifica que su uso se encuentra contraindicado en pacientes con antecedentes de tromboembolismo arterial o venoso, o en aquellos que presenten factores de riesgo que puedan predisponer a sufrir eventos de este tipo. En base a los datos de consumo del Sistema Nacional de Salud se estima que en nuestro país el número de usuarias de estos medicamentos durante el año 2011 oscilaría entre y Medicamentos que contienen acetato de ciproterona en combinación con etinilestradiol actualmente comercializados en España: Diane 35, acetato de ciproterona/etinilestradiol Sandoz, Dialider, etinilestradiol/ciproterona Gineservice y Gyneplen. El tromboembolismo es un riesgo identificado y Bivalirudina (Angiox ): se recuerda el esquema de dosificación autorizado de bivalirudina para el tratamiento de pacientes sometidos a intervención coronaria percutánea Se han recibido notificaciones de uso inapropiado de Angiox (bivalirudina) para el tratamiento de pacientes sometidos a intervención coronaria percutánea. Por este motivo el titular de la autorización de este medicamento ha distribuido en enero una carta entre los profesionales sanitarios recordando a los profesionales sanitarios las siguientes premisas sobre el esquema autorizado de dosificación: Los profesionales sanitarios deben garantizar que se cumple la pauta de administración aprobada de Angiox para el tratamiento de pacientes que se someten a intervención coronaria percutánea; la dosis recomendada de bivalirudina en pacientes que se someten a este procedimiento es un bolo intravenoso de 0,75 mg/kg de peso corporal que debe ir seguido inmediatamente de una perfusión intravenosa a una velocidad de 1,75 mg/kg/hora durante el tiempo que dure el procedimiento como mínimo. Si tras administrar el bolo IV no se inicia inmediatamente la perfusión IV, se obtendrán concentraciones plasmáticas de bivalirudina subterapéuticas en cuestión de minutos. Insuficiencia renal: en pacientes con insuficiencia renal moderada que vayan a someterse a una ICP la dosis de perfusión intravenosa de bivalirudina debe reducirse a 1,4 mg/kg/ hora y se debe controlar el tiempo de coagulación activada (TCA). Bivalirudina está contraindicada en pacientes con insuficiencia renal grave (VFG <30 ml/ min) y en pacientes que se someten a diálisis. Actualidad en Farmacología y Terapéutica marzo 2013 volumen 11 nº1-23 -
6 Tredaptive (ácido nicotínico+laropiprant): suspensión de comercialización Nota informativa de la AEMPS publicada con fecha 18 de enero de Ref: MUH (FV), 05/2013 Tras la finalización de la revisión de los resultados disponibles del estudio HPS2- THRIVE, se ha concluido que actualmente el balance beneficio-riesgo de Tredaptive es desfavorable. En consecuencia se ha decidido suspender la autorización de comercialización de este medicamento. A partir del próximo 26 de enero, Tredaptive dejará de estar disponible. La AEMPS informó el pasado 21 de diciembre sobre el inicio de la revisión del balance beneficio-riesgo de Tredaptive después de conocerse los resultados preliminares del ensayo clínico HPS2-THRIVE (ver Nota Informativa MUH (FV) 18/2012). Posteriormente, en el mes de enero, la información disponible sobre los resultados de este estudio ha sido revisada por el Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia y el Comité de Medicamentos de Uso Humano, comités científicos de la Agencia Europea de Medicamentos. Las conclusiones de esta revisión han sido las siguientes: Los resultados preliminares del estudio HPS2-THRIVE indican que el uso de Tredaptive junto con una estatina, no aporta beneficio adicional en la prevención de acontecimientos cardiovasculares mayores respecto al uso de una estatina sola. En este estudio se ha observado una frecuencia mayor de reacciones adversas graves (hemorragias, debilidad muscular, infecciones, diabetes mellitus) en el grupo tratado con Tredaptive respecto al tratado solo con estatina. Con estos resultados, se considera que actualmente el balance beneficio-riesgo de Tredaptive es desfavorable. Tomando como base estas conclusiones, estos comités han recomendado la suspensión de comercialización de Tredaptive. En consecuencia, la AEMPS ha informado a los profesionales sanitarios de lo siguiente: La suspensión de comercialización de Tredaptive a partir del 26 de enero, fecha a partir de la cual ya no se puede prescribir ni dispensar. En los pacientes que utilizaban Tredaptive se debía suspender el tratamiento con el mismo, valorándose en su caso otras opciones terapéuticas. Para ello, los pacientes deben concertar una consulta con su médico. La devolución, a partir del 26 de enero, de las existencias disponibles de Tredaptive en oficinas de farmacia y almacenes de distribución por los canales habituales. No se han identificado subgrupos de pacientes en los que el uso de esta terapia combinada pudiese aportar algún beneficio adicional volumen 11 nº 1 marzo 2013 Actualidad en Farmacología y Terapéutica
Boletín Informativo de Farmacovigilancia de Ceuta nª 20, Febrero/2013
 SUMARIO: BOLETÍN Nº 20 FEBRERO DE 2.013 1. Seguridad cardiovascular de los AINE tradicionales: conclusiones de la revisión de los últimos estudios publicados. 2. Tredaptive (Ácido nicotínico + laropiprant.):
SUMARIO: BOLETÍN Nº 20 FEBRERO DE 2.013 1. Seguridad cardiovascular de los AINE tradicionales: conclusiones de la revisión de los últimos estudios publicados. 2. Tredaptive (Ácido nicotínico + laropiprant.):
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS. Esther Salgueiro 10, 17 de Marzo de 2015
 FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012
 Fecha de publicación: 29 de marzo de 2012 - Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012 Se han producido casos de sobredosis con la administración IV de Perfalgan 10mg/ml
Fecha de publicación: 29 de marzo de 2012 - Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012 Se han producido casos de sobredosis con la administración IV de Perfalgan 10mg/ml
La Ciproterona acetato- Etinilestradiol como principios activos a dosis fija en Anticonceptivos orales y riesgo de Eventos Tromboembólicos.
 Pág. 1 de 6 La Ciproterona acetato- Etinilestradiol como principios activos a dosis fija en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad
Pág. 1 de 6 La Ciproterona acetato- Etinilestradiol como principios activos a dosis fija en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad
Conclusiones científicas y motivos de las conclusiones
 Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización y explicación pormenorizada de las diferencias con respecto a la recomendación
Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización y explicación pormenorizada de las diferencias con respecto a la recomendación
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO TERAPÉUTICO C09 AGENTES QUE ACTÚAN SOBRE EL SISTEMA RENINA ANGIOTENSINA
 ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO TERAPÉUTICO C09 AGENTES QUE ACTÚAN SOBRE EL SISTEMA RENINA ANGIOTENSINA CLASIFICACIÓN ATC C09A INHIBIDORES DE LA ECA, MONOFÁRMACOS C09AA - Inhibidores de la ECA,
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO TERAPÉUTICO C09 AGENTES QUE ACTÚAN SOBRE EL SISTEMA RENINA ANGIOTENSINA CLASIFICACIÓN ATC C09A INHIBIDORES DE LA ECA, MONOFÁRMACOS C09AA - Inhibidores de la ECA,
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 FORMULARIO PARA LA NOTIFICACIÓN DE EMBARAZOS PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos
FORMULARIO PARA LA NOTIFICACIÓN DE EMBARAZOS PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos
La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos.
 Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
Informe mensual. Medicamentos. Enero. sobre. de Uso Humano y Productos Sanitarios. Información dirigida a profesionales sanitarios
 Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Información dirigida a profesionales sanitarios Fecha de publicación: 8 de febrero de ÍNDICE Medicamentos de uso humano 1. Nuevos
Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Información dirigida a profesionales sanitarios Fecha de publicación: 8 de febrero de ÍNDICE Medicamentos de uso humano 1. Nuevos
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
 ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
Valdoxan /Thymanax (agomelatina)
 Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
Agencia Española de Medicamentos y Productos Sanitarios.
 Guía para notificar sospechas de Reacciones Adversas dirigida a Promotores de Estudios Posautorización no Titulares de Autorización de Comercialización. www.notificaram.es Medicamentos y Productos Sanitarios
Guía para notificar sospechas de Reacciones Adversas dirigida a Promotores de Estudios Posautorización no Titulares de Autorización de Comercialización. www.notificaram.es Medicamentos y Productos Sanitarios
Notificación de acontecimientos adversos en Ensayos clínicos. 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica.
 Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
Anexo II. Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto
 Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico.
 Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico. Dr. Eduardo Fernández Quintana Centro de Farmacovigilancia e Información Terapéutica de Canarias de Canarias.
Registro y Notificación de acontecimientos y reacciones adversas durante el Ensayo Clínico. Dr. Eduardo Fernández Quintana Centro de Farmacovigilancia e Información Terapéutica de Canarias de Canarias.
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA
 Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
Comunicación dirigida a profesionales sanitarios
 Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
Ficha técnica Página 1
 1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
Composición. Cada 100 ml de solución contiene: cloruro de sodio 10 g. agua para inyectables c.s.p. 100 ml. Proporciona meq/ml:
 Composición Cada 100 ml de solución contiene: cloruro de sodio 10 g agua para inyectables c.s.p. 100 ml Proporciona meq/ml: 1 / 13 sodio 1,711 Cloruro 1,711 Osmolaridad 3,422 mosmol/ml. Acción farmacológica
Composición Cada 100 ml de solución contiene: cloruro de sodio 10 g agua para inyectables c.s.p. 100 ml Proporciona meq/ml: 1 / 13 sodio 1,711 Cloruro 1,711 Osmolaridad 3,422 mosmol/ml. Acción farmacológica
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 1 Conclusiones científicas El 7 de junio de 2017, se informó a la Comisión Europea (CE) de un caso mortal de insuficiencia hepática fulminante en un paciente tratado con
Anexo IV Conclusiones científicas 1 Conclusiones científicas El 7 de junio de 2017, se informó a la Comisión Europea (CE) de un caso mortal de insuficiencia hepática fulminante en un paciente tratado con
Domperidona: pequeño aumento del riesgo de arritmias ventriculares graves o muerte cardiaca súbita.
 Pág. 1 de 5 Domperidona: pequeño aumento del riesgo de arritmias ventriculares graves o muerte cardiaca súbita. El objetivo de esta alerta internacional es difundir información sobre la seguridad y eficacia
Pág. 1 de 5 Domperidona: pequeño aumento del riesgo de arritmias ventriculares graves o muerte cardiaca súbita. El objetivo de esta alerta internacional es difundir información sobre la seguridad y eficacia
Toctino (alitretinoína)
 1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
LEFLUNOMIDA. Información sobre seguridad para los profesionales sanitarios
 LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
ALERTA RÁPIDA EUROPEA DEL MEDICAMENTO VETERINARIO VELACTIS
 Sanitarios AEMPS ALERTA RÁPIDA EUROPEA DEL MEDICAMENTO VETERINARIO VELACTIS Fecha de publicación: 1 de julio de 2016 Categoría: MEDICAMENTOS VETERINARIOS, SEGURIDAD. Referencia: MVET, 5/2016 Suspensión
Sanitarios AEMPS ALERTA RÁPIDA EUROPEA DEL MEDICAMENTO VETERINARIO VELACTIS Fecha de publicación: 1 de julio de 2016 Categoría: MEDICAMENTOS VETERINARIOS, SEGURIDAD. Referencia: MVET, 5/2016 Suspensión
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS.
 POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS. Los fármacos biosimilares son fármacos biológicos aprobados por la Agencia Europea del Medicamento (EMA)
POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS. Los fármacos biosimilares son fármacos biológicos aprobados por la Agencia Europea del Medicamento (EMA)
Servei de Control de Medicaments i Productes Sanitaris
 Assumpte/Asunto: JEXT 300 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,3 ml y JEXT 150 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,15 m
Assumpte/Asunto: JEXT 300 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,3 ml y JEXT 150 microgramos SOLUCIÓN INYECTABLE EN PLUMA PRECARGADA, 1 pluma precargada de 0,15 m
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización.
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización. Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización. Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
AMBITO DE APLICACIÓN:
 agencia española de medicamentos y productos sanitarios CIRCULAR Nº 03/2004 DEPENDENCIA: Agencia Española de Medicamentos y Productos Sanitarios CONTENIDO: Circular informativa sobre condiciones de prescripción,
agencia española de medicamentos y productos sanitarios CIRCULAR Nº 03/2004 DEPENDENCIA: Agencia Española de Medicamentos y Productos Sanitarios CONTENIDO: Circular informativa sobre condiciones de prescripción,
Prospecto: información para el usuario. No use PANFUNGOL 400 mg óvulos. Ketoconazol
 Prospecto: información para el usuario PANFUNGOL 400 mg óvulos Ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Prospecto: información para el usuario PANFUNGOL 400 mg óvulos Ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Información dirigida a profesionales sanitarios
 Información dirigida a profesionales sanitarios Dolores Montero AEMPS VII eami,, Cancún, n, 15-17 17 octubre 2008 Información a profesionales sanitarios Esencial para garantizar que la actividad reguladora
Información dirigida a profesionales sanitarios Dolores Montero AEMPS VII eami,, Cancún, n, 15-17 17 octubre 2008 Información a profesionales sanitarios Esencial para garantizar que la actividad reguladora
Asunto/assumpte: Criterios para el uso de doxorrubicina liposomal pegilada (Caelyx) durante la situación de desabastecimiento del mercado
 Asunto/assumpte: Criterios para el uso de doxorrubicina liposomal pegilada (Caelyx) durante la situación de desabastecimiento del mercado Ref.: NI04/12 Us tramet, adjunta, la Nota Informativa de la Agencia
Asunto/assumpte: Criterios para el uso de doxorrubicina liposomal pegilada (Caelyx) durante la situación de desabastecimiento del mercado Ref.: NI04/12 Us tramet, adjunta, la Nota Informativa de la Agencia
Asunto/assumpte: Restricción del uso del implantes de relleno inyectable Macrolane para el aumento del volumen mamario con fines estéticos
 Asunto/assumpte: Restricción del uso del implantes de relleno inyectable Macrolane para el aumento del volumen mamario con fines estéticos PRODUCTOS AFECTADOS: Implante de relleno inyectable Macrolane,
Asunto/assumpte: Restricción del uso del implantes de relleno inyectable Macrolane para el aumento del volumen mamario con fines estéticos PRODUCTOS AFECTADOS: Implante de relleno inyectable Macrolane,
Toctino (alitretinoína)
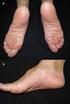 1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII)
 Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII) Puede consultar esta información en formato PDF COMUNICACIÓN SOBRE RIESGOS DE MEDICAMENTOS
Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII) Puede consultar esta información en formato PDF COMUNICACIÓN SOBRE RIESGOS DE MEDICAMENTOS
NOTA DE SEGURIDAD SOBRE PRÓTESIS MAMARIAS POLY IMPLANT (PIP)
 SUBDIRECCIÓN GENERAL DE PRODUCTOS SANITARIOS NOTA DE SEGURIDAD SOBRE PRÓTESIS MAMARIAS POLY IMPLANT (PIP) Ref.: 005/Marzo 2010 31 de marzo de 2010 Posible aumento de casos de rotura e inflamaciones locales
SUBDIRECCIÓN GENERAL DE PRODUCTOS SANITARIOS NOTA DE SEGURIDAD SOBRE PRÓTESIS MAMARIAS POLY IMPLANT (PIP) Ref.: 005/Marzo 2010 31 de marzo de 2010 Posible aumento de casos de rotura e inflamaciones locales
neumonía asociada a ventilación mecánica).
 FARMACOVIGILANCIA Doripenem (Doribax ): nuevas recomendaciones de uso en pacientes con neumonía nosocomial (Nota informativa de la AEMPS publicada con fecha 25 de junio de 2012. Ref: MUH (FV), 10/2012
FARMACOVIGILANCIA Doripenem (Doribax ): nuevas recomendaciones de uso en pacientes con neumonía nosocomial (Nota informativa de la AEMPS publicada con fecha 25 de junio de 2012. Ref: MUH (FV), 10/2012
FICHA TÉCNICA. Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
Medicamentos biológicos y biosimilares
 Medicamentos biológicos y biosimilares Guía breve para el paciente Qué son los medicamentos biológicos? Los medicamentos biológicos son moléculas grandes y complejas, que se obtienen a partir de organismos
Medicamentos biológicos y biosimilares Guía breve para el paciente Qué son los medicamentos biológicos? Los medicamentos biológicos son moléculas grandes y complejas, que se obtienen a partir de organismos
Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Maria Teresa Herdeiro Adolfo Figueiras
 Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Adolfo Figueiras Reacción Adversa a Medicamento cualquier respuesta a un medicamento que sea nociva y no intencionada
Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Adolfo Figueiras Reacción Adversa a Medicamento cualquier respuesta a un medicamento que sea nociva y no intencionada
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Productos Sanitarios AEMPS PROCEDIMIENTO PARA DECLARAR UN MEDICAMENTO COMO INNOVACIÓN GALÉNICA DE INTERÉS TERAPÉUTICO, PREVISTO EN LA ORDEN SPI/3052/2010, DE 26 DE NOVIEMBRE, POR LA QUE
Nota informativa Productos Sanitarios AEMPS PROCEDIMIENTO PARA DECLARAR UN MEDICAMENTO COMO INNOVACIÓN GALÉNICA DE INTERÉS TERAPÉUTICO, PREVISTO EN LA ORDEN SPI/3052/2010, DE 26 DE NOVIEMBRE, POR LA QUE
INSTRUCTIVO EXTERNO PLAN DE FARMACOVIGILANCIA PARA PRODUCTOS NATURALES PROCESADOS DE USO MEDICINAL.
 INSTRUCTIVO EXTERNO PLAN DE FARMACOVIGILANCIA PARA PRODUCTOS NATURALES PROCESADOS DE USO MEDICINAL. Versión [1.0] Coordinación General Técnica de Certificaciones Dirección Técnica de Registro Sanitario,
INSTRUCTIVO EXTERNO PLAN DE FARMACOVIGILANCIA PARA PRODUCTOS NATURALES PROCESADOS DE USO MEDICINAL. Versión [1.0] Coordinación General Técnica de Certificaciones Dirección Técnica de Registro Sanitario,
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Farmacovigilancia. Tipos de RAM. Morbilidad y mortalidad asociada al consumo de medicamentos.
 Notificación Espontánea de Reacciones Adversas a Medicamentos () Reacción Medicamento Adversa a Tipos de Cualquier respuesta a un medicamento que sea nociva y no intencionada Se produce a dosis utilizadas
Notificación Espontánea de Reacciones Adversas a Medicamentos () Reacción Medicamento Adversa a Tipos de Cualquier respuesta a un medicamento que sea nociva y no intencionada Se produce a dosis utilizadas
Farmacovigilancia. César Alik Pedrajo Zenteno. Dictaminador Especializado COMISION DE EVIDENCIA Y MANEJO DE RIESGOS.
 Farmacovigilancia. César Alik Pedrajo Zenteno. Dictaminador Especializado COMISION DE EVIDENCIA Y MANEJO DE RIESGOS. DIRECCIÓN EJECUTIVA DE FARMACOPEA Y FARMACOVIGILANCIA. 14 Septiembre de 2012. FARMACOVIGILANCIA
Farmacovigilancia. César Alik Pedrajo Zenteno. Dictaminador Especializado COMISION DE EVIDENCIA Y MANEJO DE RIESGOS. DIRECCIÓN EJECUTIVA DE FARMACOPEA Y FARMACOVIGILANCIA. 14 Septiembre de 2012. FARMACOVIGILANCIA
Informaciones de interés
 100 Información Terapéutica del Sistema Nacional de Salud Informaciones de interés MEDIDAS ADOPTADAS EN MATERIA DE FARMACOVIGILANCIA Ultimamente se han desarrollado diversas actuaciones relacionadas con
100 Información Terapéutica del Sistema Nacional de Salud Informaciones de interés MEDIDAS ADOPTADAS EN MATERIA DE FARMACOVIGILANCIA Ultimamente se han desarrollado diversas actuaciones relacionadas con
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE
 TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), julio 2015 Índice
TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), julio 2015 Índice
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
UNIDAD DE SEGURIDAD DEL PACIENTE
 Página 1 de 5 DE: UNIDAD DE (USP) DIRIGIDA A: FACULTATIVOS ESPECIALISTAS Y PERSONAL DE ENFERMERÍA DEL ÁREA DE SALUD DE IBIZA Y FORMENTERA 1. ASUNTO: Prevención de errores durante la administración de medicamentos.
Página 1 de 5 DE: UNIDAD DE (USP) DIRIGIDA A: FACULTATIVOS ESPECIALISTAS Y PERSONAL DE ENFERMERÍA DEL ÁREA DE SALUD DE IBIZA Y FORMENTERA 1. ASUNTO: Prevención de errores durante la administración de medicamentos.
INSTRUCCIÓN 1/2003. Dirección General de Recursos Sanitarios Departamento de Sanidad y Seguridad Social
 INSTRUCCIÓN 1/2003 Dirección General de Recursos Sanitarios Departamento de Sanidad y Seguridad Social Asunto Requisitos para la realización de estudios post-autorización de medicamentos en los centros
INSTRUCCIÓN 1/2003 Dirección General de Recursos Sanitarios Departamento de Sanidad y Seguridad Social Asunto Requisitos para la realización de estudios post-autorización de medicamentos en los centros
Prospecto: información para el usuario. Loratadina Aristo 10 mg comprimidos EFG Loratadina
 Prospecto: información para el usuario Loratadina Aristo 10 mg comprimidos EFG Loratadina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Loratadina Aristo 10 mg comprimidos EFG Loratadina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario. GASTROFRENAL 200 mg cápsulas duras Cromoglicato de sodio
 Prospecto: información para el usuario GASTROFRENAL 200 mg cápsulas duras Cromoglicato de sodio Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario GASTROFRENAL 200 mg cápsulas duras Cromoglicato de sodio Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
 23 April 2015 EMA/PRAC/273926/2015 Pharmacovigilance Risk Assessment Committee Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto Adoptado por el PRAC
23 April 2015 EMA/PRAC/273926/2015 Pharmacovigilance Risk Assessment Committee Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto Adoptado por el PRAC
PROSPECTO: INFORMACIÓN PARA EL USUARIO. CITICOLINA Normon 1000 mg solución inyectable EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
Anexo II. Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 12 Conclusiones científicas y motivos para la modificación de los términos de
Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 12 Conclusiones científicas y motivos para la modificación de los términos de
INSTRUCTIVO EXTERNO ENMIENDAS O MODIFICACIONES EN ENSAYOS CLÍNICOS. Versión [1.0]
![INSTRUCTIVO EXTERNO ENMIENDAS O MODIFICACIONES EN ENSAYOS CLÍNICOS. Versión [1.0] INSTRUCTIVO EXTERNO ENMIENDAS O MODIFICACIONES EN ENSAYOS CLÍNICOS. Versión [1.0]](/thumbs/67/57830378.jpg) Versión [1.0] Coordinación Técnica de Certificaciones, Autorizaciones y Buenas Prácticas Sanitarias Dirección Técnica de Ensayos Clínicos Septiembre, 2017 Página 3 de 7 CONTENIDO 1. OBJETIVO DEL INSTRUCTIVO...
Versión [1.0] Coordinación Técnica de Certificaciones, Autorizaciones y Buenas Prácticas Sanitarias Dirección Técnica de Ensayos Clínicos Septiembre, 2017 Página 3 de 7 CONTENIDO 1. OBJETIVO DEL INSTRUCTIVO...
PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009).
 PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009). PRESCRIPCIÓN DE OSELTAMIVIR: El médico que atienda al paciente realizará la prescripción en receta
PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009). PRESCRIPCIÓN DE OSELTAMIVIR: El médico que atienda al paciente realizará la prescripción en receta
NORMA DE COMPETENCIA LABORAL
 Página 1 de 5 VERSION VERSION AVALADA MESA SECTORIAL MESA SECTORIAL SERVICIOS A LA SALUD REGIONAL BOGOTA CENTRO CENTRO DE FORMACIÓN DE TALENTO HUMANO EN SALUD METODOLOGO RUTH NADITH MEDINA PEREZ VERSION
Página 1 de 5 VERSION VERSION AVALADA MESA SECTORIAL MESA SECTORIAL SERVICIOS A LA SALUD REGIONAL BOGOTA CENTRO CENTRO DE FORMACIÓN DE TALENTO HUMANO EN SALUD METODOLOGO RUTH NADITH MEDINA PEREZ VERSION
FICHA TÉCNICA. Solución transparente e incolora, sin partículas visibles, estéril y apirógena.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de sodio 0,9% PHYSAN solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Cada 100 ml de solución contienen: Cloruro de sodio 0,9 g - Composición
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de sodio 0,9% PHYSAN solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Cada 100 ml de solución contienen: Cloruro de sodio 0,9 g - Composición
1.- DATOS GLOBALES DEL SISTEMA ESPAÑOL DE FARMACOVIGILANCIA (SEFV-H) EN 2009 Y 2010. DATOS DE LA CIUDAD AUTÓNOMA DE CEUTA.
 BOLETÍN Nº 17 FEBRERO DE 2012 SUMARIO: 1. Datos globales del Sistema Español de Farmacovigilancia () en y. Datos de la Ciudad Autónoma de Ceuta 2. Notas Informativas de seguridad para profesionales sanitarios
BOLETÍN Nº 17 FEBRERO DE 2012 SUMARIO: 1. Datos globales del Sistema Español de Farmacovigilancia () en y. Datos de la Ciudad Autónoma de Ceuta 2. Notas Informativas de seguridad para profesionales sanitarios
Farmacovigilancia. Curso de Diplomado en Sanidad
 Farmacovigilancia Curso de Diplomado en Sanidad 2010 FARMACOVIGILANCIA Conjunto de procedimientos de detección, registro y evaluación de las reacciones adversas, para la determinación de su incidencia,
Farmacovigilancia Curso de Diplomado en Sanidad 2010 FARMACOVIGILANCIA Conjunto de procedimientos de detección, registro y evaluación de las reacciones adversas, para la determinación de su incidencia,
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Traducción no oficial del prospecto en alemán
 Traducción no oficial del prospecto en alemán Prospecto: información para el paciente Información para usuarios Medivitan iv Ampollas 5 mg, 1 mg, 1,05 mg solución inyectable Principios activos: clorhidrato
Traducción no oficial del prospecto en alemán Prospecto: información para el paciente Información para usuarios Medivitan iv Ampollas 5 mg, 1 mg, 1,05 mg solución inyectable Principios activos: clorhidrato
Bisolvon Expectorante jarabe
 PROSPECTO: INFORMACIÓN PARA EL PACIENTE Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
PROSPECTO: INFORMACIÓN PARA EL PACIENTE Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA
 1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
"Recomendaciones de tratamiento antiviral en infecciones respiratorias bajas 2010"
 "Recomendaciones de tratamiento antiviral en infecciones respiratorias bajas 2010" 14 de junio de 2010 Comités Nacionales de Infectología y Pediatría Ambulatoria Sociedad Argentina de Pediatría Enfermedad
"Recomendaciones de tratamiento antiviral en infecciones respiratorias bajas 2010" 14 de junio de 2010 Comités Nacionales de Infectología y Pediatría Ambulatoria Sociedad Argentina de Pediatría Enfermedad
Asunto/assumpte: PROBLEMAS DE SUMINISTRO CON EL MEDICAMENTO PEDEA 5 mg/ml SOLUCION INYECTABLE, 4 ampollas de 2 ml (Nº Registro , C.N.
 Asunto/assumpte: PROBLEMAS DE SUMINISTRO CON EL MEDICAMENTO PEDEA 5 mg/ml SOLUCION INYECTABLE, 4 ampollas de 2 ml (Nº Registro 04284001, C.N. 650320) Ref.: NI37/13 (MOD) Us tramet, adjunta, la Nota Informativa
Asunto/assumpte: PROBLEMAS DE SUMINISTRO CON EL MEDICAMENTO PEDEA 5 mg/ml SOLUCION INYECTABLE, 4 ampollas de 2 ml (Nº Registro 04284001, C.N. 650320) Ref.: NI37/13 (MOD) Us tramet, adjunta, la Nota Informativa
Modificaciones respecto a la anterior edición. Elaborado: Revisado Aprobado: Dirección Médica Dirección Enfermería
 Protocolo de nueva elaboración Modificaciones respecto a la anterior edición Elaborado: Revisado Aprobado: Comisión Infección, profilaxis y política antibiótica Dirección Médica Dirección Enfermería Dirección
Protocolo de nueva elaboración Modificaciones respecto a la anterior edición Elaborado: Revisado Aprobado: Comisión Infección, profilaxis y política antibiótica Dirección Médica Dirección Enfermería Dirección
Restricciones de dispensación para isotretinoína
 Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD. DECRETO EJECUTIVO No (De 27 de agosto de 2007 ) EL PRESIDENTE DE LA REPÚBLICA,
 1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
Prospecto: información para el paciente. Fisiológico B.Braun 0,9% Solución para perfusión
 Prospecto: información para el paciente Fisiológico B.Braun 0,9% Solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto ya que puede
Prospecto: información para el paciente Fisiológico B.Braun 0,9% Solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto ya que puede
NOVEDADES INTERNACIONALES Y NACIONALES EN SEGURIDAD DE MEDICAMENTOS MAYO 2013
 NOVEDADES INTERNACIONALES Y NACIONALES EN SEGURIDAD DE MEDICAMENTOS MAYO 2013 INTERNACIONALES DE AGENCIAS REGULATORIAS BEVACIZUMAB Anticuerpo monoclonal Riesgo de fascitis necrotizante. (Health Canada,
NOVEDADES INTERNACIONALES Y NACIONALES EN SEGURIDAD DE MEDICAMENTOS MAYO 2013 INTERNACIONALES DE AGENCIAS REGULATORIAS BEVACIZUMAB Anticuerpo monoclonal Riesgo de fascitis necrotizante. (Health Canada,
COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS
 COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS Actualización de la indicación, contraindicaciones y advertencias de los medicamentos que contienen acetato de ciproterona 2 mg /etinilestradiol 35 mcg
COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS Actualización de la indicación, contraindicaciones y advertencias de los medicamentos que contienen acetato de ciproterona 2 mg /etinilestradiol 35 mcg
FICHA TÉCNICA. Adultos y adolescentes mayores de 12 años: de 250 a 500 mg al día distribuidos en dos tomas (mañana y noche)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ultra-Levura 250 mg granulado para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene: Saccharomyces boulardii 250 mg Excipientes con
3. TERMINOS Y DEFINICIONES:
 Página 1 de 6 1. OBJETIVOS. Este documento establece la metodología a seguir para la discusión, en los grupos de expertos de farmacovigilancia a todos los niveles de las sospechas de Reacción Adversa a
Página 1 de 6 1. OBJETIVOS. Este documento establece la metodología a seguir para la discusión, en los grupos de expertos de farmacovigilancia a todos los niveles de las sospechas de Reacción Adversa a
Contenido del prospecto
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Fresenius Kabi solución para perfusión Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento: - Conserve este
PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Fresenius Kabi solución para perfusión Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento: - Conserve este
Atención Farmacéutica
 Atención Farmacéutica Los farmacéuticos, como parte del Sistema Nacional de Salud, comparten con los pacientes, los médicos, otros profesionales de la salud, y las Autoridades Sanitarias, la misión de
Atención Farmacéutica Los farmacéuticos, como parte del Sistema Nacional de Salud, comparten con los pacientes, los médicos, otros profesionales de la salud, y las Autoridades Sanitarias, la misión de
C/ Tomàs Forteza, Palma Tel.: Fax.:
 Asunto/assumpte: Nota Informativa para profesionales sanitarios. Uso de Oseltamivir y Zanamivir en niños de cualquier edad, en mujeres gestantes y mujeres en período de lactancia y en personas con problemas
Asunto/assumpte: Nota Informativa para profesionales sanitarios. Uso de Oseltamivir y Zanamivir en niños de cualquier edad, en mujeres gestantes y mujeres en período de lactancia y en personas con problemas
VACUNACIÓN FRENTE A MENINGOCOCO B (BEXSERO ) Tatiana Amil Pena MIR-4 Pediatría
 VACUNACIÓN FRENTE A MENINGOCOCO B (BEXSERO ) Tatiana Amil Pena MIR-4 Pediatría ÍNDICE Introducción: el meningococo y la enfermedad meningocócica Vacunación frente al meningococo B: Vacuna frente a meningococo
VACUNACIÓN FRENTE A MENINGOCOCO B (BEXSERO ) Tatiana Amil Pena MIR-4 Pediatría ÍNDICE Introducción: el meningococo y la enfermedad meningocócica Vacunación frente al meningococo B: Vacuna frente a meningococo
SODIOFOLIN 50 mg/ml solución para inyección o perfusión intravenosa
 L e a t o d o e l p r o s p e c t o d e t e n i d a m e n t e a n t e s d e e m p e z a r En este prospecto 1. Qué es Sodiofolin 50 mg/ml solución para inyección o perfusión intravenosa y para qué se utiliza
L e a t o d o e l p r o s p e c t o d e t e n i d a m e n t e a n t e s d e e m p e z a r En este prospecto 1. Qué es Sodiofolin 50 mg/ml solución para inyección o perfusión intravenosa y para qué se utiliza
Prospecto: información para el usuario. ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico
 Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Conocer los procedimientos que utiliza la farmacovigilancia y la normativa que la regula.
 FARMACOVIGILANCIA Diplomado en Salud Pública OBJETIVOS Autor: María Cristina Navarro Pemán Divulgar la Farmacovigilancia y las acciones que destina a la identificación, evaluación y prevención de los riesgos
FARMACOVIGILANCIA Diplomado en Salud Pública OBJETIVOS Autor: María Cristina Navarro Pemán Divulgar la Farmacovigilancia y las acciones que destina a la identificación, evaluación y prevención de los riesgos
Prospecto: información para el usuario. ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico
 Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Modificaciones que afectan a los medicamentos de Uso Humano
 JORNADA INFORMATIVA SOBRE LAS MODIFICACIONES, EN EL ÁMBITO DE LA AEMPS, DE LA LEY DE GARANTIAS SANITARIAS Y USO RACIONAL DE LOS MEDICAMENTOS Y PRODUCTOS SANITARIOS Modificaciones que afectan a los medicamentos
JORNADA INFORMATIVA SOBRE LAS MODIFICACIONES, EN EL ÁMBITO DE LA AEMPS, DE LA LEY DE GARANTIAS SANITARIAS Y USO RACIONAL DE LOS MEDICAMENTOS Y PRODUCTOS SANITARIOS Modificaciones que afectan a los medicamentos
VARIACIONES RELATIVAS A LA FARMACOVIGILANCIA VETERINARIA
 VARIACIONES RELATIVAS A LA FARMACOVIGILANCIA VETERINARIA FRANCISCO DE ASÍS ORTEGA HUEDO Jefe de Sección SGMV 1 - Normativa en vigor - Estructura RD Artículo 2 -> Modificación RD 1246/2008 -> Centrándonos
VARIACIONES RELATIVAS A LA FARMACOVIGILANCIA VETERINARIA FRANCISCO DE ASÍS ORTEGA HUEDO Jefe de Sección SGMV 1 - Normativa en vigor - Estructura RD Artículo 2 -> Modificación RD 1246/2008 -> Centrándonos
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Cromoglicato sódico Fisons 40 mg/ml solución para pulverización nasal
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Cromoglicato sódico Fisons 40 mg/ml solución para pulverización nasal Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene
PROSPECTO: INFORMACIÓN PARA EL USUARIO Cromoglicato sódico Fisons 40 mg/ml solución para pulverización nasal Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene
Sector Farmacovigilancia IT.PRM.01_w. Notificación de sospecha de reacción adversa a Medicamentos
 Página 1 de 5 GENERALIDADES: La sospecha de reacción(es) adversa (s) a cualquier agente terapéutico deberá ser notificada al Sistema Nacional de Farmacovigilancia, incluyendo automedicación, medicamentos
Página 1 de 5 GENERALIDADES: La sospecha de reacción(es) adversa (s) a cualquier agente terapéutico deberá ser notificada al Sistema Nacional de Farmacovigilancia, incluyendo automedicación, medicamentos
RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGULACIÓN FARMACÉUTICA (RED PARF) GUIA DEL MANUAL DEL INVESTIGADOR
 RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGULACIÓN FARMACÉUTICA (RED PARF) GRUPO DE TRABAJO BUENAS PRÁCTICAS CLÍNICAS DOCUMENTO DE TRABAJO GUIA DEL MANUAL DEL INVESTIGADOR ÍNDICE 1. Introducción y
RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGULACIÓN FARMACÉUTICA (RED PARF) GRUPO DE TRABAJO BUENAS PRÁCTICAS CLÍNICAS DOCUMENTO DE TRABAJO GUIA DEL MANUAL DEL INVESTIGADOR ÍNDICE 1. Introducción y
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib)
 Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Prospecto: Información para el paciente. LacTEST 0,45 g polvo para solución oral Gaxilosa
 Prospecto: Información para el paciente LacTEST 0,45 g polvo para solución oral Gaxilosa Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su
Prospecto: Información para el paciente LacTEST 0,45 g polvo para solución oral Gaxilosa Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su
1.- RIESGO CARDIOVASCULAR DE DOSIS ALTAS DE IBUPROFENO O DEXIBUPROFENO: RECOMENDACIONES DE USO (NOTA INFORMATIVA AEMPS MUH (FV) 04/2015)
 Número 27 AGOSTO 2015 SUMARIO: 1.- RIESGO CARDIOVASCULAR DE DOSIS ALTAS DE IBUPROFENO O DEXIBUPROFENO: RECOMENDACIONES DE USO 2.- POMALIDOMIDA ( IMNOVID ): RIESGO DE TOXICIDAD HEPÁTICA GRAVE, INSUFICIENCIA
Número 27 AGOSTO 2015 SUMARIO: 1.- RIESGO CARDIOVASCULAR DE DOSIS ALTAS DE IBUPROFENO O DEXIBUPROFENO: RECOMENDACIONES DE USO 2.- POMALIDOMIDA ( IMNOVID ): RIESGO DE TOXICIDAD HEPÁTICA GRAVE, INSUFICIENCIA
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
Entidades de distribución Entidades de intermediación
 Entidades de distribución Entidades de intermediación M Luisa Tarno DICM AEMPS 17/12/2013 Índice Requisitos Funciones Obligaciones Marco legal anterior Ley 29/2006,de 26 de julio, de garantías y uso racional
Entidades de distribución Entidades de intermediación M Luisa Tarno DICM AEMPS 17/12/2013 Índice Requisitos Funciones Obligaciones Marco legal anterior Ley 29/2006,de 26 de julio, de garantías y uso racional
JARRAIBIDEA INSTRUCCIÓN 6/00
 JARRAIBIDEA INSTRUCCIÓN 6/00 NORK : OSAKIDETZAKO ZUZENDARI NAGUSIAK DE: DIRECTOR GENERAL DE OSAKIDETZA/SVS NORI: ZERBITZU ERAKUNDEETAKO ZUZENDARI GERENTE ETA ZUZENDARI MEDIKOAK KERKUNTZA BATZORDEAK ETA
JARRAIBIDEA INSTRUCCIÓN 6/00 NORK : OSAKIDETZAKO ZUZENDARI NAGUSIAK DE: DIRECTOR GENERAL DE OSAKIDETZA/SVS NORI: ZERBITZU ERAKUNDEETAKO ZUZENDARI GERENTE ETA ZUZENDARI MEDIKOAK KERKUNTZA BATZORDEAK ETA
