ESTRATEGIA DIDÁCTICA PARA LA PRÁCTICA DE LABORATORIO DE MICROBIOLOGIA. Editorial
|
|
|
- Jorge Rico Miguélez
- hace 6 años
- Vistas:
Transcripción
1 Editorial
2 ESTRATEGIA DIDÁCTICA PARA LA PRÁCTICA DE LABORATORIO DE MICROBIOLOGIA Editorial Estrategia didáctica para la práctica de laboratorio de microbiología, es una publicación editada por la Universidad Tecnocientífica del Pacifico S.C., calle 20 de Noviembre, 75, Col. Mololoa, C.P Tel. (311) , Julio Primera Edición digital. ISBN Queda prohibida la reproducción total o parcial de los contenidos e imágenes de la publicación sin previa autorización de La Universidad Tecnocientífica del Pacifico S.C.
3 ESTRATEGIA DIDÁCTICA PARA LA PRÁCTICA DE LABORATORIO DE MICROBIOLOGIA Autores María Guadalupe Orozco Benítez Rafael Martín Murray Núñez Vianey Alexandra Murray Orozco Alethia Aramara Murray Orozco Edición Gisela Juliet Estrada Illán Jesus Ernesto Caravantes Estrada Diseño de Portada Cruz Daniela Estrada Escalante
4 PRESENTACIÓN Esta estrategia didáctica de técnicas de laboratorio de microbiología general está diseñada como material didáctico de laboratorio para cursar la unidad de aprendizaje de Microbiología General, que forma parte de los planes de estudio de las carreras de Médico veterinario zootecnista, Ingeniero agrónomo, Ingeniero Pesquero y Biólogo. Carreras de Nivel superior impartidas en la Universidad Autónoma de Nayarit. Es importante que los alumnos que inician su experiencia en el laboratorio en el manejo de microorganismos cuenten con técnicas de laboratorio que expliquen de manera sencilla el procedimiento de las prácticas con la finalidad de realizar un trabajo seguro y eficiente.. Esta estrategia de técnicas de laboratorio inicia con un capítulo sobre Seguridad en el laboratorio, con los antecedentes y reglas de seguridad más importantes que deberán conocer y practicar siempre, cada práctica está estructurada de la siguiente manera: Introducción, propósito de la práctica, normas de seguridad, desarrollo de la práctica, materiales y equipo a utilizar, procedimiento y cuestionario. Las prácticas que contiene esta guía son sencillas y los materiales y equipo que se necesitan para realizar cada una de las prácticas planteadas son básicos en los laboratorios de microbiología general.
5 Índice Prácticas generales de seguridad en el laboratorio NOM Practica 1.Uso del Microscopio... 9 Práctica 2.Tinciones Básicas Práctica 3. Preparación y esterilización de material de laboratorio Práctica 4. Preparación de Medios de cultivo y siembra Práctica 5. Aislamiento y cuantificación de microorganismos a partir de muestras ambientales (agua) Referencias... 70
6 PRÁCTICAS GENERALES DE SEGURIDAD EN EL LABORATORIO NOM El Laboratorio debe seguir prácticas generales de seguridad basadas en la Normas Oficiales Mexicanas de las cuales se han seleccionado algunas que determinan su buen funcionamiento y se describen a continuación. ESPECIFICACIONES NORMAS OFICIALES MEXICANAS CONDICIONES DEL MEDIO AMBIENTE El laboratorio cuenta con las condiciones y niveles de iluminaciones suficientes y adecuadas para el tipo de actividad que realiza. Se cuenta con normas de Seguridad e Higiene que permitan reducir el riesgo de accidentes en el área de trabajo. Se prohíbe en zonas controladas el consumo de alimentos, bebidas y tabaco, el uso de cosméticos y sustancias para ser aplicadas en la piel, así como el empleo de pañuelos que no sean desechables. NOM-025-STPS-1999 NOM-017-STP-2001 NOM-087-ECOL-1995 SISTEMA CONTRA INCENDIOS Se instalarán equipos contra incendio de acuerdo al grado de riesgo de incendio, a la clase de fuego que se pueda presentar en el laboratorio y a la cantidad de materiales en el almacén y proceso. La puertas de salida normales de las rutas de evacuación y de las salidas de emergencia, deberán ser libres de obstáculos, candados, picaportes o cerraduras con seguros puestos NOM-002-STPS-2000 NOM-002-STPS
7 durante las horas laborales Los extintores deben ser revisados al momento de su instalación y, posteriormente, a intervalos no mayores de un mes. NOM-002-STPS-2000 EQUIPOS DE PROTECCIÓN Equipo de personal, selección, uso y manejo en los centros de trabajo Sistema para la identificación y comunicación de peligros y riesgos por sustancias químicas peligrosas en los centros de trabajo NOM-017-STPS-2001 NOM-018-STPS-2000 Procedimientos generales de seguridad durante el desarrollo de la práctica a) Detección de riesgos Tipo de riesgo Como evitarlos Como proceder en caso de un accidente Cortaduras Reactivos mal cerrados (salpicadura en la piel) Trabajar apegado al protocolo de la práctica. Supervisar que los reactivos estén colocados de acuerdo a su grado de toxicidad. Que los frascos permanezcan cerrados y ventilados. Detener el sangrado y hacer curación en caso de no requerir atención médica De manera general lavar inmediatamente con abundante agua. Es conveniente retirar la ropa para evitar que el corrosivo quede atrapado entre la ropa y la piel. Revisar particularidades en cada práctica. 7
8 b) Desechos o residuos: Tipo de desechos Como descartarlos Tipo de contenedor Vidrios y agujas RPBI (Residuos Peligrosos Biológico- Infecciosos) Basura común En depósitos de basura En depósitos de basura En depósitos de basura Depositarlos en contenedores para material punzo cortante. Depositarlos en contenedores con accionador de pie y en bolsas rojas con la leyenda RPBI Depositarlos en contenedores con accionado de pie y en bolsas negras, rotular con la leyenda basura común. 8
9 PRACTICA 1. USO DEL MICROSCOPIO INTRODUCCIÓN El microscopio es una herramienta de uso indispensable en el campo de diversas áreas científicas, tal es el caso de la Histología, Embriología, Microbiología, Biología Celular, Diagnóstico Clínico, Micología, Protozoología, Parasitología, Histopatología, entre otras. Se considera como una herramienta que ha jugado un papel importante en los avances científicos; se puede decir que señala el inicio de la Biología moderna, a partir de las observaciones de los estudiosos del siglo XVII; Leeuwenhoek, Hooke y otros. El microscopio es un instrumento óptico mecánico que modula energía y aumenta el ángulo de visión humana para producir imágenes amplificadas de un objeto cualquiera. Actualmente existen varios tipos de microscopios, los cuales se han clasificado de acuerdo a diferentes criterios como son: 1. Número de pasos de imagen producidos en el microscopio. 2. Tipo de energía empleada o modulada por el microscopio en la producción de la imagen. Según el número de pasos de imagen los microscopios se clasifican en simples o compuestos. Al considerar el tipo de energía que utilizan para la formación de la imagen, se pueden clasificar en: fotónicos, electrónicos y de rayos X. En general, cualquier microscopio requiere los siguientes elementos: una fuente (como un haz de fotones o de electrones), una muestra sobre la que actúa dicha fuente, un receptor de la información proporcionada por la interacción de la fuente con la muestra, y un procesador de esta información (en general, un ordenador). 9
10 El microscopio, de micro- (pequeño) y scope (observar), es un instrumento que permite observar objetos que son demasiado pequeños para ser vistos a simple vista. El tipo más común y el primero que se inventó fue el microscopio óptico. Se trata de un instrumento óptico que contiene una o varias lentes que permiten obtener una imagen aumentada del objeto y que funciona por refracción. Microscopio compuesto. El microscopio compuesto u óptico está formado por dos lentes, el cual se compone de una parte mecánica y una óptica. En su trayectoria el haz luminoso procedente de la lámpara que pasa primero directamente a través del diafragma al condensador. Gracias al sistema de lentes que posee el condensador, la luz es concentrada sobre la preparación a observar, la laminilla colocada en la platina. Así el haz de luz penetra en el objetivo y sigue por el tubo hasta llegar al lente ocular, donde es captado por el ojo del observador ver (Figura 1). Fig. 1 Partes del microscopio compuesto. 10
11 Así, la imagen ampliada por el lente objetivo a manera de lupa se modifica mediante otro sistema de lentes, el ocular. El aumento final conseguido es igual al producto de los aumentos del objetivo por los del ocular. En el microscopio óptico este aumento tiene un límite, que se denomina "poder de resolución" y que es aproximadamente de 1200 aumentos; esto es detalles, hasta de 0.2 m. Parte Mecánica. La base del microscopio, suficientemente pesada para ser estable, soporta la platina fija, sobre la que se coloca la preparación a observar. La preparación se mantiene por un carro, con desplazamientos rectangulares, con un vernier. En algunos aparatos la platina puede tener desplazamientos verticales. Gracias a una cremallera (tornillos macros y micrométricos) que regulan la puesta a punto. En otros casos la platina solo se desplaza horizontalmente. El brazo, parte rígida, soporta el dispositivo porta ocular y el revólver o portaobjetivos. En el monocular los dos dispositivos están separados por un tubo, de manera que la distancia entre el ocular y el objetivo sea de 170 mm. En los binoculares, un sistema de prismas reemplaza al tubo. El dispositivo porta ocular es un tubo simple en el monocular o en el binocular, es donde se encuentran los prismas. Los dos oculares se pueden desplazar de acuerdo a la distancia entre ambas pupilas del observador, y además uno de los oculares es móvil sobre su eje para corregir las diferencias de convergencia entre los dos ojos. El portaobjetivos o revólver, permite su desplazamiento por rotación y permite sustituirlos. Bajo la platina se halla el porta condensador móvil, conteniendo el diafragma. Debajo de él, un espejo permite regular la fuente luminosa. 11
12 Parte Óptica. La fuente luminosa, es de filamento de tungsteno. El espejo, que tiene una cara plana y la otra cóncava, debe, a partir de una fuente luminosa, enviar un haz de rayos paralelos al eje óptico del microscopio. El condensador, es una lente que enfoca la luz en el preparado, permitiendo la formación de un cono con el vértice en el preparado y la base en el lente frontal del objetivo. La entrada de luz se regula con el diafragma iris. El diámetro de abertura del diafragma depende del campo y debe coincidir con él. La abertura de luz debe ser menor a la abertura del objeto usado. Se regula por medio de diafragmas anulares. Las características de los objetivos son las siguientes: Abertura numérica (AN); que es igual al índice de refracción del medio (n) en el que la lente se encuentra (1 para el aire, 1.33 para el agua pura, y hasta 1.56 para algunos aceites) por el seno del semi-ángulo máximo formado por los rayos que pueden penetrar en el lente frontal del objetivo (Fig. 2) Aire Aceite Fig. 2. Ganancia en apertura con aceite de inmersión (derecha) en contraste con un objetivo seco (izquierda). Aumento; agrandamiento de la imagen introducida por el objetivo, el objetivo produce una imagen real del preparado dentro del microscopio. El aumento se mide en diámetros (X). Hay diferentes tipos objetivos de los, 4X, 10X, 40X y l00x (inmersión en aceite). 12
13 Corrección de aberraciones; para formar una imagen clara, el lente debe enfocar cada rayo de luz desde un punto del preparado dando un punto de la imagen. Cuando esto falla, se llama aberración. Microscopios electrónicos Estos microscopios son grandes y complejos. Utilizan electrones en vez de luz y aumentan los objetos hasta 250,000 veces. Las imágenes que se producen son en blanco y negro, y muchas veces tienen colores falsos. El microscopio electrónico de barrido (MEB) sirve para examinar la superficie de los objetos. Produce imágenes de gran aumento (más de cien mil veces, ofrece un poder de resolución de aproximadamente 2 nm) y muestra la forma real de los objetos. Además de mostrar increíbles figuras, el microscopio electrónico investigador muestra detalles que pueden ser de vital importancia para científicos en muchas áreas, como la medicina. Trabaja examinando la superficie de un objeto con un delgado haz electrónico. El microscopio electrónico de transmisión (MET) trabaja iluminando, un ejemplar en la platina con un haz de electrones y enfocando y aumentando la imagen con lentes magnéticas. Esta imagen electrónica, que es invisible, se transforma en una imagen normal, visible mediante una pantalla especial. Microscopio digital Es un microscopio que utiliza una conexión USB a la computadora para producir imágenes o videos a todo color en la pantalla del monitor. Las imágenes que se originan son digitales que se pueden almacenar, borrar o editar, imprimirlas; insertarlas en distintos tipos de producciones: presentaciones multimedia, documentos, sitio web, a un mensaje electrónico, etc. Microscopio cuántico El microscopio cuántico es un microscopio que forma parte de los instrumentos llamados nanoscopios porque posibilitan ver objetos del tamaño en nanómetros y aún menores, se conoce como "microscopio de barrido de efecto túnel" (STM) y 13
14 fue presentado en 1982 por Heinrich Rohrer y Gerd Binnig. Ambos recibieron por esto el Premio Nobel de Física en Propósito de la práctica Conocer y manejar el microscopio compuesto, además de conocer el funcionamiento de otros tipos de microscopios. Normas de seguridad específicas de la práctica Normas de seguridad específicas Las referidas en las prácticas generales de seguridad. Desarrollo de la práctica. Material. Papel seda. Preparaciones fijas Abatelenguas. Palillos de dientes Microscopios compuestos Portaobjetos y cubreobjetos Azul de metileno Goteros. Agua de estanque. Preparaciones teñidas Procedimiento. Familiarizarse con cada una de las partes del microscopio y sus nombres. Limpiar los lentes de los objetivos con el papel seda. Limpiar objetivo de inmersión con papel seda, no usar solventes orgánicos, ya que puede disolver el material que mantiene sujeta la lente. Familiarizarse con el funcionamiento de cada parte que compone el microscopio. Observar a través de los oculares utilizando ambos ojos y ajustar la entrada de luz abriendo o cerrando el diafragma. 14
15 Observar las preparaciones fijas que serán proporcionadas por tu profesor. Empezar a observar con el objetivo de menor aumento y aumentar gradualmente la resolución. Esquematizar las observaciones de cada caso indicando el aumento utilizado. Observar una gota del agua de estanque. Utilizar el método anterior. Esquematizar las observaciones de cada caso indicando el aumento utilizado. Realizar un raspado de la cavidad oral de tu compañero. Utilizar células del carrillo. Colocar una pequeña gota en un portaobjetos y homogeneizar en ella lo obtenido del raspado. Colocar una gota de azul de metileno, un cubreobjetos y observar la preparación. Empezar con el objetivo de menor aumento. Esquematizar los resultados indicando el aumento utilizado CUESTIONARIO. Cómo se calcula el aumento de observación en el microscopio compuesto? Define que es el poder de resolución y cómo se calcula. Qué es la apertura numérica y como se relaciona con el poder de resolución? Explica el funcionamiento de los siguientes microscopios. Microscopio electrónico. Microscopio electrónico de barrido. Microscopio de contraste de fases. Microscopio de fluorescencia. Cuál es la mejor forma de visualizar (a) una preparación fija teñida, (b) una gota de agua, (c) la cutícula vegetal. Argumenta tu respuesta. 15
16 OBSERVACIONES CON MICROSCOPIO ÓPTICO Fotografía 1. Glóbulos rojos de mamífero teñidos con colorante de Wright. Microscopio óptico objetivo de 100X. Tomada con cámara de teléfono móvil. foto 1. Cutícula de cebolla teñida vista al microscopio óptico 40X. tomada con cámara de teléfono móvil. Fotografía 2. Glóbulos rojos de ave (nucleados) teñidos con colorante de Wright. Microscopio óptico objetivo de 100X. Tomada con cámara de teléfono móvil. Fotografía 3. Células de cebolla teñidas con azul de metileno. Microscopio óptico objetivo de 40X. Tomada con cámara de teléfono móvil. 16
17 PRÁCTICA 2. TINCIONES BASICAS INTRODUCCIÓN Para apreciar con mayor definición la morfología y agrupación de las bacterias es necesario teñirlas con soluciones colorantes que reaccionan químicamente con las estructuras bacterianas. Los colorantes son compuestos orgánicos y pueden ser ácidos o básicos de acuerdo a su afinidad para reaccionar con compuestos celulares básicos o ácidos respectivamente. Debido a que los microorganismos son seres pequeños con un índice de refracción cercano al agua, se requieren tinciones biológicas que permitan su visualización al microscopio. Actualmente, las tinciones son utilizadas para evidenciar estructuras celulares tales como pared, cápsula, esporas, flagelos, organelos, etc., así como para demostrar funciones fisiológicas. Las tinciones que se realizan en el laboratorio se llevan a cabo con colorantes derivados de la anilina. Los colorantes derivados de la anilina están compuestos por uno o más anillos bencénicos y se asocian a la producción de color al oxidarse o reducirse. Los anillos bencénicos poseen algunos radicales químicos tales como C=C, C=O, C=S, C=N, N=N, N=O, etc., los cuales funcionan como cromóforos, el número de ellos en una molécula determinará la intensidad del color del compuesto. Los colorantes se clasifican en dos grupos: ácidos y básicos de acuerdo a su estructura química. De hecho, los colorantes básicos tiñen estructuras celulares ácidas, por ejemplo el ADN. Contrariamente, los colorantes ácidos teñirán estructuras básicas, por ejemplo, las que se encuentran en el citoplasma. 17
18 Las técnicas de tinción más comúnmente usadas son: Tinción Simple Tinción de Gram Tinción de Cápsula Tinción de Espora Tinción para BAAR Figura 1.1 Morfología bacteriana. Al microscopio es posible observar diferencias morfológicas entre las células bacteriana. Forma y Tamaño Las tinciones usadas en el laboratorio de Microbiología, han permitido identificar tres tipos morfológicos celulares. Cilíndrica (bacilos) Esférica (cocos) Espiralada (espirilos) 18
19 Son unicelulares y a menudo se agrupan formando agregados o filamentos. Generalmente son muy pequeñas su tamaño es del orden del micrón. Las de forma bacilar generalmente tienen 1 u de diámetro y 5 u de largo, las de 20 o más micras de largo se consideran "gigantes". Las bacterias gigantes son de crecimiento lento, la mayor de ellas es Thiomargarita namibiensis, bacteria esférica cuyo diámetro puede alcanzar 0,75 mm. Al microscopio los miembros de los géneros Pseudomonas y Bacillus se observan como varillas (bacilos) rectos. El género Vibrio aparece como un bacilo curvado o forma de coma. Corynebacterium tiene forma de maza y tendencia a cambiar de forma. Mycobacterium presenta ramificaciones incipientes. El género Streptomyces puede formar un micelio. El método usual de división en procariotas es la fisión binaria. Tras el alargamiento de la célula construyen de fuera hacia dentro paredes transversales que van progresando, y las células hijas se separan. Sin embargo muchas de ellas en determinadas condiciones, permanecen unidas durante un cierto tiempo, dando origen a agrupaciones características. Según el plano y número de divisiones las bacterias esféricas pueden agruparse formando diplococos, estreptococos, estafilococos y sarcinas.. Fig. 1.2 (Izquierda). Morfología clásica de una espirilo. En la fotografía de muestra al espirilo Treponema pallidum, la spiroqueta que causa la sífilis. (derecha). La fotografía muestra la morfología celular de los cocos. 19
20 TINCIÓN SIMPLE Para realizar la tinción simple se requiere de colorantes como el cristal violeta, el azul de metileno, el rojo congo, o de algún otro colorante para el cual la célula tenga afinidad. El fundamento de la tinción, de hecho, se basa en afinidad de la célula por el colorante de acuerdo a la carga de ambos. Esta tinción es para detectar al microorganismo entero, de manera que la morfología y las agrupaciones celulares resulten visibles. TINCIÓN NEGATIVA Los colorantes ácidos, no son atraídos por la mayoría de las bacterias por que los iones negativos del colorante son repelidos por la superficie bacteriana cargada nativamente, de modo que el colorante es repelido por la bacteria y colorea en cambio el fondo de la preparación y así resultan los microorganismos muy visibles por al contraste con el fondo oscuro. Esta preparación de bacterias incoloras sobre un fondo coloreado se llama tinción negativa, ver Fig 1.3. a b Fig. 1.3 Cápsula bacteriana. Se observan las cápsulas bacteriana por tinción negativa con tinta china (a) y con la tinción de Maneval (b). La tinta china y el rojo congo no penetran la cápsula, por lo que se pone de manifiesto como una estructura clara sobre un fondo oscuro. 20
21 Propósito específico de la práctica Estudiar la afinidad al colorante en las bacterias. Estudiar la respuesta en cuanto al tipo de pared celular bacteriana. Normas de seguridad específicas de la práctica Normas de seguridad específicas. Las referidas en las prácticas generales de seguridad. Desarrollo de la práctica Material Cultivos Reactivos Equipo S. aureus y K. pneumoniae en agar nutritivo. Azul de metileno Cristal Violeta Reactivos de Maneval A y B Tinta china Platinas con control de temperatura. Procedimiento. Tinción simple En un portaobjetos colocar una gota pequeña de agua y homogeneizar una azada de la colonia elegida; extenderla para formar una película delgada. Dejarla secar y después fijarla a la llama. Hacer la tinción para cada cultivo. Una vez seco el frotis colocarlo en la barra de tinción y añadir cristal violeta o azul de metileno a elección durante 1 minuto. Lavar suavemente con agua corriente, escurrir y dejar secar. Observar a microscopio con el objetivo de inmersión (100X). 21
22 Tinción negativa con el método de Maneval modificado. Determina la presencia de cápsula bacteriana en los cultivos que se le proporcionaron, utilizando los métodos de tinción negativa que a continuación se describen. Coloca dos gotas de Maneval A (rojo congo) separadamente en cada laminilla. Tomar una asada de K. pneumoniae y mezclarlo en una de las gotas de Maneval A, haciendo movimientos giratorios con el asa. Extender la suspensión de manera que quede una película delgada. Hacer lo mismo con el cultivo de S. aureus en la otra gota de Maneval A. Permitir que ambas preparaciones sequen a temperatura ambiente. NO FIJAR EL FROTIS AL CALOR. Cubrir la preparación con Maneval B (fucsina ácida) y dejar que actúe durante 1 min. Lavar suavemente con agua corriente y secar el frotis mediante un ligero contacto con una toalla de papel. Observar al microscopio con el objetivo de inmersión. Las cápsulas se observan como halos incoloros. El espacio intercelular se observa de un color oscuro y las células bacterianas de color rojo. Tinción con tinta china. En una laminilla coloca separadamente dos gotas de tinta china. Tomar una asada de K. pneumoniae y suspenderlo homogéneamente en una de las gotas de tinta china. Hacer lo mismo en la otra gota de tinta china con una asada de cultivo de S. aureus. Colocar un cubreobjetos sobre cada preparación y presionarlos suavemente con un trozo de toalla de papel absorbente. 22
23 La cápsula se observa como un halo incoloro alrededor de los microorganismos, gracias al contraste proporcionado por la coloración negra tanto del espacio intercelular como de las células microbianas. CUESTIONARIO Explique que es la afinidad al colorante En la tinción simple cuál es la carga electrostática del colorante utilizado. En la tinción negativa cuál es la carga electrostática del colorante utilizado. En base a la respuesta de las preguntas 2 y 3, qué carga electrostática tienen las bacterias y explica por qué. Tinción de Gram. En 1844 un médico danés Christian Gram, desarrolló un método de tinción de gran utilidad que lleva su nombre. La técnica es valiosa en los laboratorios de microbiología y permite revelar los detalles referentes a la forma y agrupación bacteriana así como cualquier otra técnica de tinción. Permite además, clasificar a las bacterias en dos grandes grupos: Gram positivas y Gram negativas La figura 1.4 y 1.5 muestran la estructura y diferencias entre los dos tipos de paredes bacterianas Gram positivas y Gram negativas. Las paredes celulares de ambos grupos, poseen una capa basal de peptidoglicanos responsables de la rigidez característica de la pared. Sin embargo, existen diferencias estructurales en lo que respecta a las capas más externas. Las bacterias Gram positivas están constituidas principalmente por ácidos teicoicos con diversas sustituciones químicas. (En el caso de las Gram negativas existe una membrana externa cuya constitución química es similar a la de cualquier otra membrana biológica fosfolípidos y proteínas) pero que poseen 23
24 además un alto contenido de lipopolisacárido (LPS o endotoxina). Como se detalla en la (figura 1.6). Durante el proceso de tinción, tanto las bacterias Gram positivas como las Gram negativas toman el colorante primario. Sin embargo, al aplicar el agente decolorante, la pared de las bacterias Gram positivas sufre una deshidratación que impide la salida del colorante. En el caso de las bacterias Gram negativas, el agente decolorante destruye la integridad de la membrana externa, incrementando así su permeabilidad, lo cual permite la salida del colorante primario (Fig. 1.7). Fig. 1.4 Estructura general de una pared de bacterias Gram +. Al aplicar el colorante de contraste, este no puede penetrar fácilmente en las bacterias Gram positivas debido a la deshidratación de la pared, además de que estas bacterias quedaron previamente teñidas con el colorante primario. Por el contrario, las bacterias Gram negativas se tiñen fácilmente con el colorante de contraste. El resultado final es que las bacterias Gram positivas se tiñen de violeta y las Gram negativas de rojo (Fig. 1.4 y 1.5). 24
25 La tinción de Gram es aplicada en forma universal como primer paso en la identificación de las bacterias (Fig. 1.6). Desafortunadamente existen algunos grupos bacterianos en los cuales la tinción de Gram no es de utilidad taxonómica, por ejemplo: las espiroquetas, los micoplasmas, las micobacterias, las clamidias y las rickettsias. Fig 1.5 Estructura general de una pared de bacterias Gram. El método de la tinción de Gram ha sufrido varias modificaciones y algunas de estas son incluso mejores que el método original. Los objetivos principales para modificar la tinción han sido: Obtener un colorante primario más estable que el original, ya que éste se deteriora rápidamente. Reducir el tiempo requerido para completar la técnica. 25
26 Propósito específico de la práctica El alumno realizará la técnica de tinción de Gram. Observará y explicará las diferencias tintoriales entre los dos grupos. Normas de seguridad específicas de la práctica Normas de seguridad específicas Las referidas en las prácticas generales de seguridad. GRAM POSITIVAS GRAM NEGATIVAS FIJAR LA MUESTRA CRISTAL VIOLETA IODO LUGOL DECOLORACIÓN SAFRANINA Figura 1.6 Tinción de Gram. Etapas para la realización de una tinción de Gram y su observación en el microscopio. Desarrollo de la práctica Material Cultivos Reactivos S. aureus y K. pneumoniae en agar nutritivo Cultivo mixto de S. aureus y K. pneumoniae en agar nutritivo Juego de reactivos para la Tinción de Gram KOH al 3% 26
27 Procedimiento 1. Prepare frotis fijos a partir de cada uno de los cultivos y una vez secos, fijar al calor pasando la preparación por la llama del mechero unas tres veces. 2. Cubra el frotis con la solución de cristal violeta (colorante primario). Una o dos gotas son suficientes para cubrir el área del frotis. Deje actuar el colorante por 15 segundos. Lave con agua corriente. 3. Sacuda la laminilla para eliminar las gotas gruesas de agua. Aplique la solución de yodo (mordiente) y déjela actuar durante 15 segundos. Lave con agua corriente de la llave. 4. Sacuda la laminilla y aplique el alcohol cetona (agente decolorante) durante 3 a 5 segundos. Lave nuevamente con agua corriente. Sacuda la laminilla y agregue la safranina (colorante de contraste y déjela actuar por 15 segundos). Lave con agua corriente, seque el frotis por presión con una toalla absorbente o al aire, y observe al microscopio con el objetivo de inmersión (100X). Al microscopio podrá observar las diferencias de coloración entre los dos grupos de paredes bacterianas (Fig. 1.7). Existen algunas variantes que pueden afectar los resultados de la tinción de Gram, por ejemplo: Las bacterias en los cultivos viejos (más de 24 H de incubación) liberan enzimas por autólisis. Estas degradan a la pared celular de las bacterias y modifican sus propiedades estructurales, propiciando que las bacterias Gram positivas se tiñan de color rojo. Esta misma situación se puede presentar al observar frotis directos de los tejidos animales infectados. 27
28 Una decoloración excesiva puede ocasionar que las bacterias Gram positivas se tiñan de rojo. Una decoloración deficiente puede ocasionar que las bacterias Gram negativas se tiñan de violeta. Los frotis gruesos pueden teñirse irregularmente. Fig Observación microscópica de bacterias Gram positivas (violeta), y Gram negartivas (rojas). Prueba de Hidróxido de potasio (KOH) al 3%. La prueba de KOH nos permite ratificar los resutados de la tinción de Gram. Esta prueba consiste en colocar sobre un a laminilla una gota de KOH al 3% y con el asa hacer en ella una suspensión de las bacterias problema mezclando con movimientos giratorios durante 1 a 3 minutos. Si al separar el asa de la mezcla se forma una hebra viscosa, esto indica que se trata de bacterias Gram negativas. Si la hebra no se forma, se trata de bacterias Gram positivas. 28
29 CUESTIONARIO. Enliste un mínimo de 5 géneros bacterianos Gram positivos y un mínimo de 5 para Gram negativos, de importancia médica, veterinaria e industrial. Realice un esquema topológico de la estructura de la pared de las bacterias Gram positivos y de las Gram negativos. Con base a la pared celular de las paredes de Gram positivos y Gram negativos, explica que acción ejerce el alcohol en cada una de ellas. Explique el papel que desempeña el mordiente en la tinción. Explica la teoría más aceptada para explicar las diferencias tintoriales en la técnica de Gram. Tinción de BAAR. Las bacterias ácido alcohol resistentes forman un grupo de microorganismos que se definen en base a sus propiedades tintoriales. Son relativamente impermeables a los colorantes básicos, pero una vez teñidos, retienen el colorante con tenacidad, resistiendo la decoloración con solventes orgánicos acidificados (por ejemplo alcohol-ácido). La ácido alcohol resistencia está determinada por la pared celular, la cual además de contener peptidoglicano, está constituida por un alto porcentaje de glicolípidos hidrofóbicos. Un componente importante de estos, son los ácidos micólicos (Fig. 1.8). La presencia de estas capas hidrofóbicas previene la penetración de soluciones acuosas, siendo esta la causa por la cual estos microorganismos no pueden teñirse con los métodos convencionales (tinción de Gram). Uno de los métodos más comúnmente usados para demostrar la resistencia al ácido alcohol es el método de Ziehl-Neelsen. En este método la penetración del 29
30 colorante primario se facilita debido a que este se encuentra disuelto en fenol y a que es aplicado en presencia de calor. Fig. 1.8 Estructura general de la pared de una bacteria ácido alcohol resistente. Una vez que el colorante penetra a la célula bacteriana, este se combina con las mismas estructuras con las que se combina en cualquier otra bacteria (ácidos nucleicos, proteínas, etc.) y además reacciona con ácidos micólicos libres, lo cual hace que la pared celular se vuelva aún más hidrofóbica. Con la tinción de Ziehl-Neelsen, tanto las bacterias ácido alcohol resistentes como las no ácido alcohol resistentes se tiñen con el colorante primario. Sin embargo, al aplicar el agente decolorante, compuesto por una mezcla de alcohol ácido, éste no soubiliza los lípidos de la pared de las bacterias ácido alcohol resistentes, y por lo tanto no se decoloran. Las bacterias no ácido alcohol resistentes se decoloran fácilmente, por lo que se vuelven a teñir al aplicar el colorante de contraste (Fig. 1.9). 30
31 Este grupo de bacterias está representado principalmente por el género Mycobacterium. Algunas especies de este género juegan un papel muy importante como agentes etiológicos de la tuberculosis y otras enfermedades crónicas granulomatosas tanto en el hombre como en los animales. Fig Bacilos acido alcohol resistentes teñidos con la técnica de Ziehl-Neelsen. En el análisis de un frotis de material clínico sospechoso de contener bacilos de la tuberculosis, el hallazgo de un solo bacilo ácido alcohol resistente puede tener valor diagnóstico, ya que en la mayoría de los casos no son abundantes. Sin embargo, la interpretación del hallazgo de bacilos ácido alcohol resistentes debe de hacerse con cautela y con base a la historia clínica y otras pruebas de laboratorio, ya que la presencia de especies saprófitas de Mycobacterium podría conducir a un diagnóstico falso. Por otra parte, existen algunas especies de Corynebacterium y Nocardia que ocasionalmente pueden comportarse como bacterias ácido alcohol resistentes. Propósito específico de la práctica El alumno realizará la técnica de tinción de Ziehl- Neelsen para la observación de bacterias ácido alcohol resistentes. Conocerá la importancia en patogenicidad de las especies de Mycobacterium. Describirá los componentes de las paredes de bacterias ácido alcohol resistentes 31
32 Normas de seguridad específicas de la práctica Normas de seguridad específicas Las referidas en las prácticas generales de seguridad. Desarrollo de la práctica Material Equipo Material Biológico Reactivos Palillos de madera estériles Papel filtro Platinas con regulación de temperatura Espectoraciones frescas de sujetos sanos Juego de reactivos de Ziehl Neelsen Procedimiento Utilizando una sola laminilla prepare dos frotis a partir de las muestras que se le proporcionarán, utiliza palillo de madera, no use asa de platino. Fíjelos en una platina caliente. Tíñalos siguiendo la técnica de Ziehl Neelsen. Tinción de Ziehl Neelsen. 1. Coloque un trozo de papel absorbente sobre el frotis, el cual debe ser más pequeño que la superficie de la laminilla. 2. Humedezca el papel con la fucsina fenicada (colorante primario) y coloque el frotis sobre una caja de petri y ésta sobre la platina caliente (70 0 C). Continúe agregando colorante para evitar que el frotis se seque. Permita la emisión de vapores durante 5 minutos. Retire el frotis de la platina, quíte el papel, déjelo enfriar y lave con agua corriente de la llave. 3. Decolore con el alcohol ácido, permitiéndole actuar durante 2 minutos. Es importante realizar la decoloración perfectamente, ya que de no ser así se corre el riesgo de observar reacciones falsas positivas. Lave con agua corriente de la llave. 4. Contraste con azul de metileno de Loeffler durante 1 minuto Lave con agua corriente, seque y observe al microscopio con el objetivo de inmersión. 32
33 5. Los microorganismos ácido alcohol resistentes se tiñen de color rojo, los no ácido alcohol resistentes de color azul. CUESTIONARIO. 1. Mencione la importancia en patogenicidad de los componentes de la pared celular de Mycobacterium tuberculosis. 2. Mencione la utilidad taxonómica y diagnóstica de la tinción de Ziehl Neelsen. 3. Investigue la razón por la cual los BAAR no se decoloran con el alcohol ácido. 4. Explique el fundamento de las tinciones realizadas. 5. Menciona en qué tipo de muestras se investiga BAAR. 6. Explique por qué no se recomienda utilizar el asa de nicromo para la extensión del frotis. 7. Enliste 5 especies de bacterias ácido alcohol resistentes de importancia médica y veterina Tinción de Esporas. La espora bacteriana es una estructura altamente deshidratada y rígida, que es formada por algunos géneros bacterianos tales como BaciIIus y Clostridium. Estos responden de manera diferente al efecto que las condiciones ambientales tienen sobre la formación de la espora. Por ejemplo B. anthracis, microorganismo aerobio estricto, solamente puede formar esporas en condiciones de aerobiosis. Contrariamente, los bacilos del género Clostridium, anaerobios estrictos, no forman esporas en aerobiosis. La esporulación es un mecanismo especializado cuya función es encerrar un genoma en un vehículo aislante que le permita la germinación posterior en un medio adecuado. Las esporas bacterianas mantienen un estado de criptobiosis o 33
34 vida latente, con escasa actividad metabólica. Asimismo, muestran una marcada resistencia al calor, a la desecación, a la congelación y a diversos agentes químicos y radiaciones. Figura Anatomía de una espora. Se esquematizan las cubiertas que forman la espora bacteria. La capa está constituida por proteínas parecidas a la queratina, las cuales vuelven impermeable a la espora y la protegen de la acción de substancias químicas. El centro contiene dipicolinato de calcio, el cual aunado al alto estado de deshidratación del protoplasma, es responsable de la marcada resistencia que muestra la espora al calor y a la desecación. Durante la síntesis del ácido dipicolínico, los iones de Ca ++ se acumulan, y en las esporas maduras, el dipicolinato aparentemente actúa como un quelante de Ca ++. Una vez que han sido liberadas las esporas maduras por autólisis de la célula vegetativa, la espora muestra un alto grado de resistencia al calor, radiación y sustancias químicas. La resistencia al calor es debida a la alta concentración de dipicolinato de calcio, y a su bajo contenido en agua. Por otra parte, se ha visto que la resistencia a la radiación es proporcional al número de puentes disulfuro presentes en la capa externa proteica, la cual es rica 34
35 en proteínas con cisteina parecida a la queratina. La envoltura impermeable de la espora presenta además, resistencia a la entrada de sustancias químicas. Las esporas son estructuras ovales o esféricas que pueden encontrarse tanto intracelularmente, como fuera de la bacteria (célula vegetativa). Por su localización dentro de la célula pueden ser centrales, sub-terminales o terminales y presentan además variación en su tamaño. Estas características son de utilidad taxonómica para la identificación de algunas especies de los géneros capaces de esporular. Espora Célula vegetativa Fig Tinción de Schaeffer y Fulton observada al microscopio. En una preparación teñida con la técnica de Gram las esporas aparecen como cuerpos refringentes sin teñir. Para teñirlas se utiliza la tinción de Schaeffer y Fulton en la que es necesario aplicar calor para forzar la entrada del colorante primario (verde malaquita) y una vez que este ha penetrado, al lavar la preparación y agregar un colorante de contraste (safranina), las células vegetativas se tiñen de rojo y la espora permanece teñida de verde. (Fig. 1.11). Propósito específico de la práctica El alumno realizará la técnica de tinción de Schaeffer y Fulton para la observación de esporas bacterianas. El alumno conocerá el fundamento de la tinción de Schaeffer y Fulton. Mencionará las principales características estructurales de la espora bacteriana. 35
36 Explicará la función de la espora bacteriana. Conocerá la función de los reactivos utilizados en la tinción de Schaeffer y Fulton. Mencionará la utilidad taxonómica y diagnóstica de la tinción de Schaeffer y Fulton. Enlistará géneros bacterianos capaces de esporular de importancia médica, veterinaria e industrial. Normas de seguridad específicas de la práctica Normas de seguridad específicas Las referidas en las prácticas generales de seguridad. Desarrollo de la práctica Material. Cultivos Equipo Reactivos Cultivo de Bacillus subtillis en agar nutritivo Platinas con regulación de temperatura Juego de reactivos para tinción de Gram Juego de reactivos para tinción de Schaeffer y Fulton Procedimiento Prepare 3 frotis fijos a partir del cultivo. Uno de los frotis será teñido con la tinción de Gram, los dos restantes serán teñidos con el método de Schaeffer y Fulton descrito a continuación. Aplique Fulton A (verde malaquita) y calienta en la platina hasta la emisión de vapores. Contraste con Fulton B (safranina) durante 15 segundos. Lave, seque y observe al microscopio con el objetivo de inmersión (l00x). 36
37 El método de tinción de Schaeffer y Fulton puede practicarse en frío, permitiendo actuar al Fulton A durante 10 minutos. CUESTIONARIO. Explique cada una de las etapas de esporulación. Mencione cuáles son las especies formadoras de esporas. Cuáles de ellas tienen importancia clínica (humana y veterinaria) e industrial. Discuta la importancia de las esporas en infección. Tienen importancia en patogénesis? Qué importancia tienen los géneros de B. anthracis y C. botulinum. Explique la importancia de B. thuringiensis en biorremediación. Cuál es el componente químico específico de las esporas? Explique por qué debe de calentarse el frotis en la tinción de esporas. Por su localización como se clasifican las esporas Explique cuáles son los factores que estimulan la formación de esporas en bacterias. 37
38 OBSERVACIONES AL MICROSCOPIO ÓPTICO TINCIÓN DE GRAM. a b c d Fotografía 1. Tinción de Gram. a) Bacterias Gram negativas, b) Bacterias Gram positivas, c) cocos Gram positivos d) bacilos Gram positivos con espora intermedia. Vistos con microscopio óptico objetivo de 100X. Tomadas con cámara de teléfono móvil. 38
39 PRÁCTICA 3. PREPARACIÓN Y ESTERILIZACIÓN DE MATERIAL DE LABORATORIO. La esterilización es un proceso por medio del cual se eliminan por remoción o muerte todos aquellos microorganismos encontrados en un objeto, superficie o medio. Por lo tanto un objeto libre de estos microorganismos se dice que se encuentra estéril. El concepto de esterilidad es absoluto, es decir, no existe un material casi, más o menos o 99% estéril. En el trabajo cotidiano de un laboratorio de microbiología es necesario que todo el material como pipetas, tubos de ensaye, cajas de Petri (vidrio o de plástico), medios de cultivo y soluciones estén estériles. Debe prevenirse que el material esterilizado se conserve estéril. Así, antes de esterilizarse, a los matraces con medio de cultivo se les pone un tapón de algodón que evitará el acceso de microorganismos del ambiente al medio de cultivo. También es necesario proteger este tapón con papel para evitar que se humedezca durante la esterilización con calor húmedo. Existen varios métodos físicos y químicos de esterilización, la selección de uno o de otro depende de la naturaleza del material que se piensa esterilizar. Dentro de los métodos físicos más comúnmente utilizados se encuentra la esterilización por calor, la cual se puede llevar a cabo con calor seco o húmedo y la filtración. Calor seco Se aplica en un horno calentado eléctricamente que se controla mediante termostatos, y que está provisto de un ventilador circulante que asegura la uniformidad de la temperatura. La esterilización con calor seco se usa principalmente para material de vidrio y materiales sólidos estables al calor, requiere mayor duración e intensidad porque la conducción del calor es menos rápida que en un ambiente húmedo. La temperatura que se utiliza es generalmente entre 160 y C durante 1.5 horas. 39
40 Las cajas de Petri de vidrio y las pipetas se colocan en cilindros de metal con aberturas que permitan el paso del aire caliente. La inactivación de los contaminantes ocurre por pérdida de agua y oxidación de todos sus componentes esenciales. Calor Húmedo El autoclave comúnmente utilizado en el laboratorio es del tipo olla de presión. Presenta una cámara vertical de metal, provista de una tapa metálica fuerte que se aprieta y cierra herméticamente mediante un aro de goma. Se dispone en la tapa una válvula para la salida de aire y de vapor, un indicador de presión y una válvula de seguridad (Fig. 2.). El agua del fondo del autoclave se calienta mediante mechero o resistencia eléctrica. Este tipo de esterilización generalmente se realiza a 121º C durante 15 minutos, la temperatura se alcanza utilizando vapor de agua a una presión de 15 lb/pulg 2 (2 atm/cm 2 ). Estas condiciones de esterilización con calor húmedo pueden variar de acuerdo al volumen y tipo de autoclave que se usa y del material a esterilizar. El material a esterilizar no debe estar herméticamente cerrado. La muerte de los organismos contaminantes ocurre principalmente por desnaturalización de las macromoléculas (proteínas, ADN y ARN) proteínas. Para determinar la eficiencia del proceso de esterilización se emplean los indicadores biológicos de esterilización. Específicamente cuando se esteriliza con calor húmedo se utilizan, junto al material que se esteriliza, ampolletas que contienen esporas viables de Bacillus thermophilus que son inactivadas a 121º C durante 12 minutos. Después de la esterilización se incuban las esporas y se analiza si éstas sobrevivieron o no al proceso de esterilización. También existen cintas que con un vire de un indicador químico indican si se alcanzaron las condiciones por calor. 40
41 Figura 2. Autoclave vertical eléctrica Tyndalización Este proceso designado así después de que el científico Tyndall utilizara un vaporizador de Koch que es una caja metálica en el fondo de la cual, el agua hierve mediante un mechero de gas o una resistencia. El material que va a tratarse permanece en una bandeja perforada, inmediatamente por encima del nivel de agua. La tapa es cónica de manera que el agua de condensación resbala por las laterales en lugar de gotear sobre el contenido. Un pequeño orificio en la parte superior de la tapa permiten que salgan el aire y el vapor. Se utiliza este método para medios de cultivo que pueden alterarse por el exceso de calor. Filtración La filtración a través de membranas es usada para esterilizar soluciones de sustancias termolábiles en donde los microorganismos son retenidos en el filtro, el filtrado estéril debe recibirse también en un recipiente estéril. 41
42 Algunos microorganismos son capaces de atravesar los filtros de membrana (virus, algunas bacterias y espiroquetas). Actualmente los filtros se fabrican con ésteres de celulosa (acetato de celulosa, nitrato de celulosa, colodión, etc). Presentan una elevada velocidad de filtración y se fabrican con una gran variedad de diámetro de poro, para evitar el paso de partículas virales. El material de la membrana es autoclaveable. Dentro de los métodos químicos, se pueden utilizar una gran variedad de sustancias, todas ellas reciben el nombre de desinfectantes o biocidas. Desinfección Se considera que las sustancias químicas que destruyen o matan a los microorganismos son bactericidas, y bacteriostáticos son aquellas sustancias químicas que inhiben el crecimiento microbiano. Las sustancias antisépticas en cambio son aquellas cuya toxicidad es baja y su actividad antimicrobiana puede ser utilizada sobre los tejidos vivos. Algunas de las sustancias químicas son reactivos ordinarios, otros son formulaciones especiales, registradas con nombres comerciales. Existe un espectro aproximado de sensibilidad de los microorganismos a los desinfectantes. Los más sensibles son las bacterias vegetativas, los hongos y los virus que contienen lípidos. Las micobacterias y los virus que no contienen lípidos son menos sensibles y las esporas son por lo general resistentes. 42
43 Tabla 1. Propiedades de algunos desinfectantes. ACTIVO CONTRAACTIVO CONTRA TOXICIDAD Hongos G+ G- Mycobac terias Esporas Piel Ojos Pulmones Fenólicos Hipocloritos Alcoholes Formaldehído Glutaraldehido Iodóforos buena++ media+ débil- nula Los desinfectantes utilizados más corrientemente en el laboratorio son los fenoles líquidos y los hipocloritos. Los aldehidos tienen una acción limitada y el alcohol y mezclas de alcoholes son menos populares. Los compuestos yodóforos y de amonio cuaternario sueles ser muy usados y de gran efectividad, ya que presentan mayor actividad antibacteriana y menor toxicidad que los mercuriales, lo 43
44 cual convierte a este último grupo en inadecuados para usarlos en el laboratorio. (Tabla 1). Otras sustancias tales como el óxido de etileno y la propiolactona se usan comercialmente en la preparación de material de equipo estéril para hospitales y laboratorios, pero no se emplean en la descontaminación de desechos de laboratorio. Propósito específico de la práctica Preparar para la esterilización el material de vidrio más usado en el laboratorio de Microbiología. Conocer y manejar el material de equipo más común para la esterilización y trabajo en condiciones de esterilidad. Comprobar la necesidad de manejar la Microbiología en áreas asépticas. Normas de seguridad específicas de la práctica Normas de seguridad específicas Las referidas en las prácticas generales de seguridad. Desarrollo de la práctica. Material Material Equipo Matraz Erlenmeyer de 500 ml. Matraz Erlenmeyer de 50 ml. Tubos de ensaye de l6 x l50. Tubos de ensaye de l3 x l00. Cajas de Petri de vidrio. Algodón, papel de envoltura, pinzas, tijeras, ligas, clips, canastillas metálicas. Autoclave 44
45 Preparación y esterilización del material Con esta práctica adquirirás las habilidades para la preparación y esterilización del material de laboratorio usado en microbiología. Preparación para la elaboración de gorros. Corta el papel estraza en forma de rectángulo, del tamaño según se necesita. Dobla el papel a la mitad con respecto a la parte larga del mismo. Dobla las puntas superiores, uniéndolas por el centro. De la parte inferior dobla hacia arriba al borde de la hoja que queda encima, hasta la altura de las puntas unidas y dale media vuelta al papel. Dobla las puntas de los lados, hasta la altura donde sobresale el doblez. De la parte inferior dobla hacia arriba, el borde sobresaliente de la hoja hasta el doblez interior. Da media vuelta al papel obteniendo de esta manera el gorro. Fig. (2.1) Fig. 2.1 Matraz Erlenmeyer con gorro de papel. 45
46 Elaboración de tapones de algodón. Los tapones son utilizados en diferentes tamaños ( tubos y matraces) por lo que el procedimiento es una forma generalizada del proceso.como base para la elaboración: con una tira de algodón de (15-20 cm. de largo, 3 cm. de ancho y un grosor de 0.5 cm.) aproximadamente, y con una gasa de 10 x 10 cm, podrás obtener un tapón adecuado para un matraz de 500 ml. : Corta una tira de algodón, de largo adecuado a las necesidades ( para un matraz de 500 ml) Con una pinza de disección presiona uno de los extremos. Enrolla el algodón en la pinza, de una manera que quede firme el enrollado. Por otro lado, corta el cuadro de gasa adecuado al tamaño requerido colócalo en la boca (del matraz o de los tubos de ensayo), procurando centrarlo. Con la pinza y el algodón enrollado en ella, presiona la gasa hacia adentro del matraz, de manera que entre uniformemente por todos lados a la boca de este, dejando a flote la punta superior del algodón. La pinza deberás sacarla del algodón dando una vuelta en sentido contrario al enrollado para que afloje, y jala hacia arriba presionando el algodón para que no salga de la boca del matraz o de los tubos de ensayo. Hasta este paso, deben quedar cuatro puntas de la gasa colgado a los lados de la boca del matraz: dos de las puntas que se encuentran opuestamente, amárralas entre si formando un lazo. Enseguida amarra las otras dos puntas restantes, de esta manera obtendrás el tapón de algodón. 46
47 Fig 2.2. Matraz Erlenmeyer con tapón de algodón Preparación y envolturas de pipetas. La preparación de las pipetas para su esterilización es sencilla, los pasos se describen a continuación: Lava las pipetas perfectamente con agua y jabón y sécalas por 10 minutos en la estufa a 100 C. Con un clip introduce en la boquilla de succión un filtro de algodón, de forma que el algodón entre suavemente y sin romperse con la presión del clip. Este tapón tiene una doble función, una es para evitar que en un descuido de succión forzada, por obstrucción de la pipeta, ingiera el alumno el producto succionado al destaparse bruscamente, y la segunda razón es para evitar que por la boquilla de succión entren microorganismos que alteren el trabajo realizado. Corta una tira de papel estraza de aproximadamente 5 cm de ancho y 30 cm de largo. Dobla el extremo inferior aproximadamente 2 cm. Coloca la pipeta con la punta a la mitad del doblez anterior y con un ángulo de aproximadamente grados de inclinación con respecto a la posición del papel estraza. 47
48 Realiza un segundo doblez, tapando la punta de la pipeta con la porción de papel que sobresale a la punta de la pipeta. Has un tercer doblez a la punta de la pipeta que queda en el ángulo de inclinación, de manera que cubra completamente la punta de la pipeta. Da vuelta a la pipeta procurando que el papel vaya envolviéndola en forma de espiral. Verifica que el enrollado no quede flojo, en caso de estarlo, reafirma el papel con respecto a la forma de la pipeta. En la parte superior, dobla hacia abajo el papel sobresaliente. Pega el extremo con cinta adhesiva de papel y escribe la capacidad volumétrica de la pipeta sobre el papel. (Fig. 2.3). Fig. 2.3 Pipetas de vidrio envueltas con papel. Procedimiento para la envoltura de cajas de Petri. Es necesario envolver las cajas Petri antes de esterilizarlas para evitar que al término de la esterilización estén expuestas al medio ambiente y se contaminen de nuevo. Corta papel estraza, de tamaño adecuado para el número de cajas que se desees envolver y coloca las mismas en el centro del papel. Une los bordes de los costados al centro cubriendo las cajas que se envuelven. 48
49 En la parte superior une los bordes de ambos lados y esta unión dóblala a la mitad. Has un segundo doblez, quedando recargado éste sobre las cajas. Dobla las puntas del papel de cada una de las esquinas al centro. Da vuelta al material, quedando el doblez hacia abajo. Dobla las puntas salientes del papel en los lados de las cajas hacia arriba y al centro de las cajas y asegúralos con cinta adhesiva. (Fig. 2.4). Fig Cajas de petri envueltas con papel. CUESTIONARIO. Con qué finalidad se les pone a las pipetas algodón? Cuál es el método más apropiado para esterilizar el siguiente material? Solución de vitaminas. Cajas de Petri de plástico limpias. Cajas de Petri de plástico de desecho. Talco. Aceite mineral. Instrumental de cirugía. 49
50 Ropa contaminada. Cadáveres de animales. Sangre para transfusión. 3. Investiga la razón por la cual la temperatura se incrementa proporcional a la presión de vapor. 50
51 PRÁCTICA 4. SIEMBRA EN MEDIOS DE CULTIVO EN PLACA Y OBSERVACIÓN DE MORFOLOGÍA COLONIAL INTRODUCCIÓN La inoculación en medios de cultivo es el contacto de los microorganismos con el medio. La inoculación de medios de cultivo en el laboratorio para el desarrollo e identificación de microorganismos es un procedimiento fundamental e importante y el uso de técnicas apropiadas dará por resultado un óptimo crecimiento. Las inoculaciones se realizan utilizando asas de nicromo o de platino y deben de hacerse cerca del mechero, evitando movimientos bruscos o excesiva lentitud en las manipulaciones para evitar contaminación. Para realizar el estudio de las bacterias es necesario recuperarlas del hábitat natural donde se encuentran y hacer que proliferen en medios artificiales que proporcionen sus requerimientos nutricionales. A este procedimiento se le conoce como cultivo bacteriano in vitro. Las bacterias para su metabolismo necesitan donadores y aceptores de Hidrógeno, fuentes de Carbono, fuentes de Nitrógeno y Minerales. Además del uso de un medio nutritivamente adecuado para el cultivo bacteriano, es necesario considerar factores ambientales tales como la temperatura, ph, humedad relativa y atmósfera de incubación. Medios de cultivo básicos Son medios simples que promueven el desarrollo de microorganismos nutricionalmente poco exigentes. Estos medios reciben también el nombre de medios generales. Se utilizan principalmente para la realización de análisis cuantitativos, muestreos de medio ambiente o superficies y conservación de cepas. Ejemplo: agar nutritivo, caldo nutritivo, agar de soya y tripticaseína, caldo triptosa, agar triptosa, etc. 51
52 Medios enriquecidos Son medios que han sido suplementados con elementos que proporcionan factores de crecimiento para promover el desarrollo de microorganismos de requerimientos nutricionales exigentes. Estos medios generalmente contienen uno o más de los siguientes ingredientes: sangre, suero, plasma, líquido ascítico, huevo, carne, vitaminas, aminoácidos específicos, NAD o hemina entre otros. Ejemplos; agar sangre, agar chocolate, agar infusión cerebro corazón, medio Lowenstein-Jensen, etc. Medios selectivos Estos medios contienen substancias inhibitorias para suprimir total o parcialmente el desarrollo de microorganismos no deseados. Las substancias utilizadas con mayor frecuencia son colorantes, sales inorgánicas, sales biliares, antibióticos y detergentes. Los medios selectivos tienen una gran utilidad para el aislamiento de gérmenes patógenos a partir de muestras clínicas que contengan bacterias de la microflora normal. Ejemplo: agar Verde Brillante y agar SaImoneIIa ShigeIIa selectivos Salmonella spp. para Agar MacConkey, ENDO y eosina azul de metileno (EMB del inglés eosin metilen blue); selectivo para enterobacterias. Agar manitol sal, agar Staphylococcus110 y agar Chapman Stone; selectivos para Staphylococcus spp. Es importante recordar que también se logra un efecto selectivo hacia ciertos grupos de microorganismos simplemente variando la temperatura y la atmósfera de incubación. 52
53 Medios diferenciales Estos medios contienen indicadores que permiten diferenciar algunos géneros o especies bacterianas por el aspecto característicos de sus colonias. La mayoría de los medios selectivos son también diferenciales. Ejemplos: Agar verde brillante, agar Salmonella Shigella, agar MacConkey, ENDO EMB. etc. Estos permiten diferenciar enterobacterias fermentadoras de la lactosa (coliformes) de las no fermentadoras de la lactosa (no coliformes). Agar Manitol Sal, para diferenciar estafilococos fermentadores del manitol (S. aureus) de los no fermentadores del manitol (S. epidermidis). Cuando el microorganismo a seleccionar a partir de una población mixta es fastidioso (nutricionalmente exigente), se utilizan medios enriquecidos adicionados con algunos de los inhibidores antes mencionados. Ejemplos de medios de este tipo son: agar PPLO con acetato de talio y penicilina, utilizado para el aislamiento de Mvcoplasma spp. Agar sangre con telurito de potasio, utilizado para el aislamiento de Listeria spp. Agar sangre con azida de sodio utilizado para el aislamiento de Streptococcus spp. Medios de enriquecimiento. Estos medios son liquidas y poseen efecto inhibitorio sobre ciertos géneros bacterianos, favoreciendo al mismo tiempo el desarrollo de otros que se encuentran en menor proporción en la muestra. Son medios muy utilizados en la bacteriología del tracto intestinal, principalmente para el aislamiento de Salmonella spp a partir de muestras de heces en las cuáles el número de salmonelas puede ser bajo en comparación al elevado número de bacterias que normalmente habitan en el tracto intestinal. 53
54 Estos medios se inoculan mediante un hisopo o bien depositando directamente la muestra en el medio en una proporción de 1:10 (por ejemplo 1 gramo de muestra en 10 ml de medio). El periodo de incubación en estos medios debe ser de 18 horas y es necesario resembrar a partir de ellos en medios selectivos y diferenciales para identificar colonias características. Ejemplos de estos medios son el caldo selenita y el caldo tetrationato, medios de enriquecimiento para Salmonella spp. Medios de transporte Son medios utilizados para el transporte de las muestras clínicas desde el lugar de su colección hasta el laboratorio. Su finalidad es preservar la viabilidad de los microorganismos cuyo aislamiento va a intentarse posteriormente. La composición de este tipo de medios varía considerablemente de acuerdo al microorganismo cuya viabilidad se desea preservar. Estos medios pueden ser desde una simple solución fisiológica amortiguadora hasta medios más complejos que contienen substancias inhibitorias, agentes reductores, substancias osmóticamente activas (sacarosa), suero, etc. Algunos ejemplos de estos medios son: medio de Stuart, medio de Carry-Blair, utilizados como medios de transporte de uso general para un gran número de bacterias aerobias y anaerobias. Solución amortiguadora de Bovarnik, para preservar la viabilidad de Clamidias y Rickettsias. Composición de los medios de cultivo Muchos microorganismos requieren solo los medios ordinarios de cultivo; otros necesitan medios específicos para su desarrollo o para ayudar a la identificación cuando las características del cultivo y las reacciones específicas son los factores determinantes. 54
55 Formula y preparación de medios de cultivo Cada medio de cultivo presenta su fórmula y en los medios preparados comercialmente se presenta su fórmula y se describe su preparación. A continuación se da un ejemplo: Ejemplo: Caldo de extracto de carne o caldo nutritivo Extrato de carne de buey 3 g o 0.3% Peptona g o 1% Cloruro sódico... 5 g o 0.5% Propósito específico de la práctica 1. Preparar medios de cultivo selectivos, diferenciales y de enriquecimiento y vaciar en caja de petri. 2. Preparar medios de cultivo y vaciar en tubo (recto e inclinado). Normas de seguridad específicas de la práctica Normas de seguridad específicas Las referidas en las prácticas generales de seguridad. 55
56 Desarrollo de la práctica. Material. Material Equipo Matraz Erlenmeyer de 500 ml. Matraz Erlenmeyer de 50 ml. Tubos de ensaye de l6 x l50. Tubos de ensaye de l3 x l00. Cajas de Petri de vidrio o plástico Algodón, papel de envoltura, pinzas, tijeras, ligas, clips, canastillas metálicas. Medios de cultivo (EMB, SS, agar 110, agar gelosa sangre, Caldo nutritivo). Autoclave Preparación de medios de cultivo Pesa la cantidad de medio de cultivo proporcional al volumen que se va a preparar (la referencia del fabricante está dada en gramos de medio por litro de agua destilada). Coloca el medio (polvo) en un matraz Erlenmeyer, agrega la mitad de agua destilada y agita para lograr la disolución del polvo, después ajusta el volumen total con el agua destilada restante. En una parrilla de calentamiento coloca el matraz con el medio de cultivo. Inicia el calentamiento, agitando el matraz periódicamente. Continua con el calentamiento hasta que la mezcla quede transparente. A eso se le llama clarificación del medio. Enseguida coloca el matraz con el medio de cultivo en la autoclave y esterilízalo siguiendo las recomendaciones del fabricante del medio de cultivo. 56
57 Retira el medio de la autoclave y dejar enfriar a temperatura de 45 ºC y 50 ºC para evitar que se gelifique.. Vacía el medio de cultivo cerca de la flama del mechero para evitar contaminación, tapa la caja y déjala reposar hasta que gelifique el agar. Una vez que hayas vaciado el medio en todas las cajas, espera a que gelifique Coloca las cajas boca abajo y guárdalas en refrigeración hasta su uso. Nota: Los pasos del 9 al 12 debes realizarlos en campana de flujo laminar si existe en el laboratorio. CUESTIONARIO. 1. Mencione las diferencias que existen entre los siguientes medios de cultivo: básico, enriquecido, diferencial, selectivo, de enriquecimiento y de transporte. 2. Cite tres ejemplos de cada tipo de medio (selectivo, diferencial y transporte) 2. Porque se recomienda colocar las cajas de petri con el medio de cultivo ya gelificado en posición invertida en refrigeración? Morfología colonial: Cuando se examinan los microorganismos asociados o presentes en un animal, planta, suelo, agua o alimento se encuentra una gran variedad de ellos y raramente hay un solo tipo de microorganismo. Si se quiere trabajar con un cultivo puro, se deben obtener colonias separadas o aisladas. La observación cuidadosa de las colonias muestra que éstas varían en apariencia. Una colonia o clona microbiana esta constituida por individuos de la misma especie provenientes de una célula o de un grupo de ellas. Las colonias bacterianas presentan características morfológicas muy variadas, mismas que son constantes para cada especie bacteriana en idénticas condiciones de cultivo. 57
58 Estas características pueden modificarse cuando factores tales como humedad relativa, medio de cultivo, temperatura y atmósfera de incubación varían. Por definición un buen aislamiento en placa es aquel que nos da colonias aisladas, con una distancia que permita distinguir y describir la morfología colonial que incluye: Tamaño. Se describe en milímetros y puede variar desde colonias extremadamente pequeñas que miden apenas una fracción de milímetro hasta aquellas que llegan a medir 10 mm.; algunas especies bacterianas pueden extenderse en toda la superficie de la caja. Para poder observarlas es necesario utilizar un microscopio estereoscópico. Color. Las colonias pueden tener variados colores, debido a pigmentos propios o absorción de algunas sustancias del medio. Forma. Puede ser puntiforme, circular o irregular. Las colonias puntiformes son tan pequeñas que no se les puede distinguir el resto de sus características. Bordes. Pueden ser enteros o mostrar irregularidades como lóbulos, filamentos, proyecciones como dientes de sierra o enrollados. Elevacion. La colonia puede ser plana o elevada, esta última a su vez puede ser convexa, pilvinada, umbonada crateriforme o umbilicada. Superficie. Puede ser lisa, rugosa o granular. Aspecto.Puede ser húmedo o seco. Luz reflejada. Puede ser brillante o mate. Luz transmitida. Puede ser transparente, translúcida u opaca. Producción de pigmento. Algunas bacterias producen pigmentos solubles en agua, que puede difundir al medio de cultivo. 58
59 Consistencia. Dura o suave, esta última puede ser butirosa, mucoide o friable. Esta característica se determina tocando la colonia con el asa y por lo tanto debe ser la última en describirse Con la experiencia en la observación de cultivos, las características de morfología colonial vienen a constituir una guía muy útil en el reconocimiento de los principales grupos de microorganismos. Tabla 2. Morfología colonial. MORFOLOGIA COLONIALOLONIAL Termino T Tamaño. Características Diámetro (mm) Forma Puntiforme, circular, irregular, filamentosa, fusiforme y rizoide Elevación Plana, elevada, convexa, abovedada, umbonada, pulvinada, crateriforme. Borde Entero, ondulado, lobulado, estriado y lobulado, dentado y rizoide Color Blanco, negro, amarillo, naranja, ect. Luz reflejada 59
60 Brillante, mate. Luz z LuzLuz transmitida Opaca, translucida, transparente. Consistencia Cremosa, viscosa, membranosa, quebradiza o rugosa OlorOlor Fétido, a uvas, a pescado, etc. Reacción de hemólisis. Cuando se inocula agar gelosa sangre, es posible observar adicionalmente a la morfología colonial, una reacción llamada hemólisis, producida por microorganismos que destruyen los eritrocitos del medio de cultivo, debido a la producción de toxinas. La reacción se observa como una zona transparente alrededor de las colonias hemolíticas. a b c Fig. 3. Reacción de Hémolisis. a) hemólisis gamma, b) hémolisis beta, c) hémolisis gamma. 60
61 Inoculación de medios sólidos por la técnica de estría tomar un inóculo bacteriano con el asa de nicromo estéril y fría. extender el inóculo sobre una parte de la superficie del medio, al que se llamará zona de descarga. esterilizar nuevamente el asa de nicromo en la llama de reducción y posteriormente en la de oxidación, con la finalidad que el inóculo se proyecte. trazar estrías a partir de la zona de descarga, de manera que cubra otra porción de la superficie del agar para diluir el inóculo. Tener cuidado de no penetrar la superficie del agar. esterilizar el asa y volver a trazar estrías hasta cubrir toda la superficie, al terminar la inoculación esterilizar nuevamente el asa. Rotular las cajas de petri con los nombre de cada equipo y demás datos importantes. incubar las cajas a 37 o C por 24 h. Pasado el tiempo de incubación, observar la morfología colonial. Fig. (4). Fig. 4. Técnica de inoculación por estría en placa. 61
62 CUESTIONARIO Con que objetivo se realiza la técnica de inoculación por estría en medios de cultivos sólidos. Observa la morfología colonial en cada una de las placas inoculadas y anota tus resultados de acuerdo a la tabla 2. Compara tus observaciones con la tabla 3. y registra tus comentarios. Tabla 3. Placas de cultivo con crecimiento de bacterias. Agar Crecimiento de bacterias en placa. Para qué se utiliza? Observación al microscopio óptico. Métodos Estándar Es un medio utilizado para el recuento de bacterias aeróbicas a partir de agua, aguas residuales, alimentos y productos lácteos. Dextrosa Sabouraud (DX) Es un medio utilizado en procedimientos cualitativos para el cultivo de dermatofitos. 62
63 Base agar Sangre (BS) Es un medio utilizado para facilitar el crecimiento de microorganismos exigentes, bacterias Gram negativas (-) y Gram positivas (+). Ejem. (Estreptococos, Listeria ) Salmonella Shigella (SS) Es un medio de cultivo selectivo y diferencial utilizado para el aislamiento de Salmonella spp. Y de algunas de Shigellaspp. A partir de heces y alimentos. Eosina azul de Metileno (EMB) Es un medio de cultivo diferencial utilizado para el aislamiento de enterobacterias, este sirve para la diferenciación entre organismos fermentadores y no fermentadores de lactosa. citrato de Simmons (CS) Es un medio de cultivo utilizado para la diferenciación de enterobacterias. Mac Conkey Es un medio de cultivo en el cual las peptonas, aportan los nutrientes necesarios para el desarrollo bacteriano, la lactosa es el hidrato de carbono fermentable y la mezcla de sales biliares y el cristal violeta son los agentes selectivos que inhiben el desarrollo de gran parte de la flora Gram (+). 63
64 Extracto de malta Es un medio de cultivo que permite el crecimiento de microorganismos considerados generalmente como muy difíciles de cultivar en el los gérmenes mantienen su virulencia antigenicidad y otras características serológicas. 64
65 PRACTICA 5. AISLAMIENTO Y CUANTIFICACIÓN DE MICROOGANISMOS A PARTIR DE MUESTRAS AMBIENTALES (AGUA) INTRODUCCIÓN Los microorganismos desempeñan un papel más importante en el ambiente, de lo que podrían sugerir sus dimensiones tan pequeñas. Cada microorganismo en un ecosistema interactúa con su entorno, modificando marcadamente en algunos casos, las características del ecosistema. El término microambiente, describe el lugar donde vive un microorganismo. Lo que puede parecer un ambiente uniforma, por ejemplo una migaja de tierra, en realidad puede tener diferentes microambientes química y físicamente distintos. Las condiciones fisicoquímicas en el microambiente pueden cambiar con rapidez, por ello los microambientes son heterogéneos y las condiciones en un microambiente determinado pueden variar rápidamente; esto explica el que se encuentren microorganismos fisiológicamente diferentes (aerobios, anaerobios, fotótrofos, autótrofos, etc) en la misma pequeña muestra de tierra lodo o agua. Existen diferentes técnicas que permiten cuantificar el número de microorganismos que se tienen en una muestra. Algunas de ellas cuantifican de forma total tanto microorganismos viables como muertos. Sin embargo, en microbiología es importante cuantificar la viabilidad, ya que es un indicativo potencial del poder patogénico que pudiera tener dicha muestra. El tipo de técnica que se utiliza para cuantificar a los microorganismos, va a depender del tipo de muestra de que se trate y de la carga que contenga. Por lo que se cuentan con técnicas para la cuantificación de microorganismos en aguas, en alimentos, en superficies inertes, etc. 65
66 No obstante el tipo de metodología que se seleccione para la cuantificación, una de las herramientas que permiten un cálculo más apegado a la realidad es la dilución seriada, la cual consiste en diluir logarítmicamente la muestra original, permitiendo de esta manera el crecimiento discreto de los microorganismos sobre las placas de agar y su cuantificación más certera. Propósito específico de la práctica. Que el alumno aprenda la técnica cuantitativa para determinar el número de microorganismos viables El alumno aprenderá a realizar una serie de diluciones y se comprobará que el número original de las bacterias disminuirá de acuerdo al nivel de dilución de una forma logarítmica o exponencial. El alumno se dará cuenta de la gran diversidad de microorganismos que se pueden encontrar en cualquier muestra ambiental. Normas de seguridad específicas de la Práctica. Normas de seguridad específicas Las normas oficiales mexicanas especificas para la práctica 66
67 Desarrollo de la práctica Material Material Equipo Muestra Medios de Cultivo 6 pipetas de 1 ml estériles 1 mechero de Bunsen 5 cajas de petri estériles. Estufa bacteriológica Muestra de agua (pozo, tinaco, filtro, entre otros) 5 tubos con 9 ml de agua destilada estéril 5 tubos con 20 a 25 ml de agar nutritivo estéril. Procedimiento. Hacer diluciones 1/10, 1/100, 1/1000, 1/10,000, 1/100,000 y 1/1000,000 de la muestra en condiciones asépticas; colocando en cada caja rotulada 1 ml del cultivo de la dilución correspondiente. Agregar a cada caja 15 ml de agar fundido (50º C); agitando por rotación para homogeneizar la muestra. Dejar solidificar el agar e incubar a 37º C por 48 horas. Observar los resultados, cuantificar y realizar sus cálculos. 67
68 Fig. 5. Esquema del procedimiento para cuantificación de microorganismos a partir de muestras ambientales (agua). 68
PRÁCTICO N 3. Técnicas para la observación, aislamiento y conservación de microorganismos
 PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
AcuaNatura ÍNDICE TÉCNICAS DE TINCIÓN
 TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
PRACTICA 2 TINCION DE GRAM
 PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
Microscopio y observación de células
 I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
Métodos para estudiar las células
 Métodos para estudiar las células Sumario Historia de la Teoría Celular Estructura y función celular Transporte celular Métodos para estudiar las células El microscopio compuesto de luz El microscopio
Métodos para estudiar las células Sumario Historia de la Teoría Celular Estructura y función celular Transporte celular Métodos para estudiar las células El microscopio compuesto de luz El microscopio
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE
 PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
Agentes desinfectantes objetos inertes. Agentes antisépticos tejidos vivos
 Agentes desinfectantes son agentes químicos capaces de matar los microorganismos patógenos de un material. Pueden presentar efectos tóxicos sobre tejidos vivos, por lo que se suelen usar sólo en objetos
Agentes desinfectantes son agentes químicos capaces de matar los microorganismos patógenos de un material. Pueden presentar efectos tóxicos sobre tejidos vivos, por lo que se suelen usar sólo en objetos
TEMA 9. Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas
 TEMA 9 Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas Tema 9. Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas 1. Examen microscópico del material
TEMA 9 Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas Tema 9. Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas 1. Examen microscópico del material
INSTRUMENTOS BÁSICOS DE UN LABORATORIO
 INSTRUMENTOS BÁSICOS DE UN LABORATORIO Trasfondo y Contenido En un laboratorio se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio. Pueden
INSTRUMENTOS BÁSICOS DE UN LABORATORIO Trasfondo y Contenido En un laboratorio se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio. Pueden
Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo
 Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo Objetivos. Que el alumno conozca los principios generales de las técnicas de esterilización
Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo Objetivos. Que el alumno conozca los principios generales de las técnicas de esterilización
Teoría Celular PROF. AURORA FERRO
 Teoría Celular PROF. AURORA FERRO Desarrollo de la teoría celular La unidad básica estructural y funcional de los seres vivos es la célula. Si bien hay células que, como la yema de un huevo, son perceptibles
Teoría Celular PROF. AURORA FERRO Desarrollo de la teoría celular La unidad básica estructural y funcional de los seres vivos es la célula. Si bien hay células que, como la yema de un huevo, son perceptibles
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM
 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS
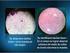 PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
TALLER No 1 MAPA CONCEPTUAL DE LA CÉLULA
 TALLER No 1 MAPA CONCEPTUAL DE LA CÉLULA 1. COMPLETE EL MAPA CONCEPTUAL. FUNCIONES: NUCLEO CROMOSOMAS NUCLEOLOS ESTRUCTURA LA CELULA MEMBRANA CELULAR FUNCIONES: FUNCIONES MITOCONDRIAS: RIBOSOMAS: CITOPLASMA
TALLER No 1 MAPA CONCEPTUAL DE LA CÉLULA 1. COMPLETE EL MAPA CONCEPTUAL. FUNCIONES: NUCLEO CROMOSOMAS NUCLEOLOS ESTRUCTURA LA CELULA MEMBRANA CELULAR FUNCIONES: FUNCIONES MITOCONDRIAS: RIBOSOMAS: CITOPLASMA
PRACTICA Núm. 1 EL MICROSCOPIO. Conocer sus partes y su función, así como el cuidado, manejo y utilidad en el Laboratorio de Microbiología.
 PRACTICA Núm. 1 EL MICROSCOPIO I. OBJETIVO Conocer sus partes y su función, así como el cuidado, manejo y utilidad en el Laboratorio de Microbiología. II. INTRODUCCION El microscopio es indispensable en
PRACTICA Núm. 1 EL MICROSCOPIO I. OBJETIVO Conocer sus partes y su función, así como el cuidado, manejo y utilidad en el Laboratorio de Microbiología. II. INTRODUCCION El microscopio es indispensable en
Laboratorio de Introducción a la Microbiología. Practico N 1
 Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
Microorganismos. Microbiología General 11-P
 Microorganismos Microbiología General 11-P Microorganismo Los microorganismos también llamados microbios son seres diminutos que individualmente son demasiado pequeños para ser observados a simple vista.
Microorganismos Microbiología General 11-P Microorganismo Los microorganismos también llamados microbios son seres diminutos que individualmente son demasiado pequeños para ser observados a simple vista.
Ver objetos minúsculos que los tenemos cerca lo hacemos gracias al microscopio.
 1 Ver objetos minúsculos que los tenemos cerca lo hacemos gracias al microscopio. Ver objetos grandes que están muy lejos de la Tierra lo conseguimos gracias al telescopio. Las invenciones del microscopio
1 Ver objetos minúsculos que los tenemos cerca lo hacemos gracias al microscopio. Ver objetos grandes que están muy lejos de la Tierra lo conseguimos gracias al telescopio. Las invenciones del microscopio
LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS
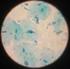 LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS INTRODUCCIÓN En el universo biológico se encuentran dos tipos de células: procariotas y eucariotas. Estas últimas a
LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS INTRODUCCIÓN En el universo biológico se encuentran dos tipos de células: procariotas y eucariotas. Estas últimas a
ESTRUCTURA Y FUNCION CELULAR
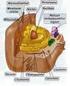 ESTRUCTURA Y FUNCION CELULAR Sumario Historia de la teoría celular Estructura y función celular 1. El núcleo 2. Los organelos citoplásmicos 3. Los organelos de células vegetales Transporte celular Métodos
ESTRUCTURA Y FUNCION CELULAR Sumario Historia de la teoría celular Estructura y función celular 1. El núcleo 2. Los organelos citoplásmicos 3. Los organelos de células vegetales Transporte celular Métodos
o Solución de KOH al 0,01% Disolver el colorante en el alcohol, y añadir la solución de KOH
 OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
Células. 2ª Parte: Células procariotas. Tema 13 de Biología NS Diploma BI Curso
 Células 2ª Parte: Células procariotas Tema 13 de Biología NS Diploma BI Curso 2012-2014 Estructura de la célula procariota: Escherichia coli Las bacterias son las células procariotas típicas. Tienen pequeño
Células 2ª Parte: Células procariotas Tema 13 de Biología NS Diploma BI Curso 2012-2014 Estructura de la célula procariota: Escherichia coli Las bacterias son las células procariotas típicas. Tienen pequeño
Por qué en un resultado positivo siempre cambia a amarillo intenso pero solo algunos emiten fluorescencia?
 Biología 3725 L COLILERT Por qué en un resultado positivo siempre cambia a amarillo intenso pero solo algunos emiten fluorescencia? ENTEROLERT Cuál es el propósito de utilizar enterolert, que nos dice
Biología 3725 L COLILERT Por qué en un resultado positivo siempre cambia a amarillo intenso pero solo algunos emiten fluorescencia? ENTEROLERT Cuál es el propósito de utilizar enterolert, que nos dice
Células. Tema 13 de Biología NS Diploma BI Curso
 Células procariotas 2ª Parte: Células Tema 13 de Biología NS Diploma BI Curso 2013-2015 Diversidad del dominio Eubacteria Grupo muy amplio de bacterias que, debido a su gran variedad genética, participan
Células procariotas 2ª Parte: Células Tema 13 de Biología NS Diploma BI Curso 2013-2015 Diversidad del dominio Eubacteria Grupo muy amplio de bacterias que, debido a su gran variedad genética, participan
Logros. Crecimiento bacteriano. Crecimiento. Finalidad de las bacterias
 Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
PRACTICA N 1 RECONOCIMIENTO DEL EQUIPO DE LABORATORIO
 PRACTICA N 1 RECONOCIMIENTO DEL EQUIPO DE LABORATORIO Objetivo: Conocer detalladamente cada instrumento utilizado en las prácticas de microbiología (forma, uso, material con el que está elaborado etc.).
PRACTICA N 1 RECONOCIMIENTO DEL EQUIPO DE LABORATORIO Objetivo: Conocer detalladamente cada instrumento utilizado en las prácticas de microbiología (forma, uso, material con el que está elaborado etc.).
MANUAL DE INSTRUCCIONES
 Contraste de fases MANUAL DE INSTRUCCIONES Modelo B-380 B-500 B-800 B-1000 Versión: 2 Publicado: 18, 08, 2014 Introducción al contraste de fases Las preparaciones sin teñir y por lo tanto transparentes
Contraste de fases MANUAL DE INSTRUCCIONES Modelo B-380 B-500 B-800 B-1000 Versión: 2 Publicado: 18, 08, 2014 Introducción al contraste de fases Las preparaciones sin teñir y por lo tanto transparentes
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
UNIVERSIDAD TECNOLOGICA NACIONAL
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
 TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
Técnicas de observación de microorganismos
 Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO
 RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
Material de uso frecuente en el laboratorio de química. Figura Nombre Uso / Características. Crisol. Espátula de porcelana. Capsula de porcelana
 Material de uso frecuente en el laboratorio de química. En un Laboratorio de Química se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio.
Material de uso frecuente en el laboratorio de química. En un Laboratorio de Química se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio.
V Olimpiada Española de Biología: Fase Nacional
 Código de Identificación 4 últimos dígitos- letra DNI V Olimpiada Española de Biología: Fase Nacional PRÁCTICA 3: IDENTIFICACIÓN DE POLEN Y SUS RELACIONES CON DISTINTOS TIPOS DE POLINIZACIÓN. USO DEL MICROSCOPIO
Código de Identificación 4 últimos dígitos- letra DNI V Olimpiada Española de Biología: Fase Nacional PRÁCTICA 3: IDENTIFICACIÓN DE POLEN Y SUS RELACIONES CON DISTINTOS TIPOS DE POLINIZACIÓN. USO DEL MICROSCOPIO
PRÁCTICA 5. TEJIDOS VEGETALES III. TEJIDO EPIDÉRMICO Y PERIDÉRMICO.
 UNIVERSIDAD DE GUADALAJARA CENTRO UNIVERSITARIO DE LOS LAGOS INGENIERÍA EN BIOQUÍMICA MATERIA: BOTÁNICA SEMESTRE: 2014B PROF. DRA. EN C. SOFÍA LOZA CORNEJO PRÁCTICA 5. TEJIDOS VEGETALES III. TEJIDO EPIDÉRMICO
UNIVERSIDAD DE GUADALAJARA CENTRO UNIVERSITARIO DE LOS LAGOS INGENIERÍA EN BIOQUÍMICA MATERIA: BOTÁNICA SEMESTRE: 2014B PROF. DRA. EN C. SOFÍA LOZA CORNEJO PRÁCTICA 5. TEJIDOS VEGETALES III. TEJIDO EPIDÉRMICO
TRABAJO PRÁCTICO Nº 1 LA CÉLULA VEGETAL
 BIODIVERSIDAD DE VEGETALES (Paleontólogos) Guía de Trabajos Prácticos 2015 TRABAJO PRÁCTICO Nº 1 LA CÉLULA VEGETAL DESCRIPCIÓN Y FUNCIONAMIENTO DEL MICROSCOPIO ÓPTICO Un microscopio óptico (figuras 1 y
BIODIVERSIDAD DE VEGETALES (Paleontólogos) Guía de Trabajos Prácticos 2015 TRABAJO PRÁCTICO Nº 1 LA CÉLULA VEGETAL DESCRIPCIÓN Y FUNCIONAMIENTO DEL MICROSCOPIO ÓPTICO Un microscopio óptico (figuras 1 y
Pág ª) Qué es un ser vivo? Un ser formado por células que es capaz de desempeñar las tres funciones vitales:
 TEMA 1 Pág. 160 1ª) Qué es un ser vivo? Un ser formado por células que es capaz de desempeñar las tres funciones vitales: Pág. 10 2ª ) Qué reinos de seres vivos habitan en la tierra? Moneras, protoctistas,
TEMA 1 Pág. 160 1ª) Qué es un ser vivo? Un ser formado por células que es capaz de desempeñar las tres funciones vitales: Pág. 10 2ª ) Qué reinos de seres vivos habitan en la tierra? Moneras, protoctistas,
ÓPTICA GEOMÉTRICA MODELO 2016
 ÓPTICA GEOMÉTRICA MODELO 2016 1- Se desea obtener una imagen virtual de doble tamaño que un objeto. Si se utiliza: a) Un espejo cóncavo de 40 cm de distancia focal, determine las posiciones del objeto
ÓPTICA GEOMÉTRICA MODELO 2016 1- Se desea obtener una imagen virtual de doble tamaño que un objeto. Si se utiliza: a) Un espejo cóncavo de 40 cm de distancia focal, determine las posiciones del objeto
Métodos de esterilización y desinfección
 Objetivo Métodos de esterilización y desinfección Curso: Métodos en Fitopatología 24 de abril de 2012 Ing. Agr. MSc. Vivienne Gepp Que el estudiante se familiarice con los procesos de desinfección y esterilización
Objetivo Métodos de esterilización y desinfección Curso: Métodos en Fitopatología 24 de abril de 2012 Ing. Agr. MSc. Vivienne Gepp Que el estudiante se familiarice con los procesos de desinfección y esterilización
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
La célula. Unidad Los seres vivos están formados por células
 La célula Unidad Los seres vivos están formados por células Definición de célula. Es la unidad anatómico y funcional de todo ser vivo. Tiene función de autoconservación y autorreproducción. Es por esto,
La célula Unidad Los seres vivos están formados por células Definición de célula. Es la unidad anatómico y funcional de todo ser vivo. Tiene función de autoconservación y autorreproducción. Es por esto,
MANEJO DE RESIDUOS EN LABORATORIO
 MANEJO DE RESIDUOS EN LABORATORIO Abril de 2012 PELIGROS AL MEDIO AMBIENTE SUSTANCIAS Y OBJETOS PELIGROSOS VARIOS: Presentan un riesgo no cubierto dentro de las otras clases. Se inclyen en esta división
MANEJO DE RESIDUOS EN LABORATORIO Abril de 2012 PELIGROS AL MEDIO AMBIENTE SUSTANCIAS Y OBJETOS PELIGROSOS VARIOS: Presentan un riesgo no cubierto dentro de las otras clases. Se inclyen en esta división
Trabajo práctico Nº 6. Introducción. Ejercicio teórico MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS. Objetivo. Procedimiento.
 Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
1. TEORÍA CELULAR 2. ORGANIZACIÓN CELULAR PROCARIOTA 3. ORGANIZACIÓN CELULAR EUCARIOTA: ANIMAL Y VEGETAL
 LAS CÉLULAS INDICE: 1. TEORÍA CELULAR 2. ORGANIZACIÓN CELULAR PROCARIOTA 3. ORGANIZACIÓN CELULAR EUCARIOTA: ANIMAL Y VEGETAL 1º.- TEORÍA CELULAR Los principios básicos de la teoría celular son: La célula
LAS CÉLULAS INDICE: 1. TEORÍA CELULAR 2. ORGANIZACIÓN CELULAR PROCARIOTA 3. ORGANIZACIÓN CELULAR EUCARIOTA: ANIMAL Y VEGETAL 1º.- TEORÍA CELULAR Los principios básicos de la teoría celular son: La célula
El descubrimiento de la célula
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema III: La Célula
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema III: La Célula
TEST RESIDUOS SANITARIOS
 1) LOS RESIDUOS SANITARIOS SE CLASIFICAN, EN FUNCIÓN DE LOS RIESGOS, EN: a) 4 grupos: 0I, II, III y IV. b) 3 grupos: 0I, II y III. c) 2 grupos: 0I y II. d) Ninguna es correcta. 2) NO SE INCLUYE EN EL GRUPO
1) LOS RESIDUOS SANITARIOS SE CLASIFICAN, EN FUNCIÓN DE LOS RIESGOS, EN: a) 4 grupos: 0I, II, III y IV. b) 3 grupos: 0I, II y III. c) 2 grupos: 0I y II. d) Ninguna es correcta. 2) NO SE INCLUYE EN EL GRUPO
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
13. Por qué no se observa dispersión cuando la luz blanca atraviesa una lámina de vidrio de caras planas y paralelas? 14. Sobre una lámina de vidrio,
 PROBLEMAS ÓPTICA 1. Una de las frecuencias utilizadas en telefonía móvil (sistema GSM) es de 900 MHz. Cuántos fotones GSM necesitamos para obtener la misma energía que con un solo fotón de luz violeta,
PROBLEMAS ÓPTICA 1. Una de las frecuencias utilizadas en telefonía móvil (sistema GSM) es de 900 MHz. Cuántos fotones GSM necesitamos para obtener la misma energía que con un solo fotón de luz violeta,
INICIACIÓN EN LA OBSERVACIÓN MICROSCÓPICA.
 UN MUNDO PEQUEÑO: INICIACIÓN EN LA OBSERVACIÓN MICROSCÓPICA. Autor: Francisco Luis López Rodríguez DNI: 80 127 204 -B INTRODUCCIÓN Para poder ver un objeto es necesario que la luz reflejada o emitida por
UN MUNDO PEQUEÑO: INICIACIÓN EN LA OBSERVACIÓN MICROSCÓPICA. Autor: Francisco Luis López Rodríguez DNI: 80 127 204 -B INTRODUCCIÓN Para poder ver un objeto es necesario que la luz reflejada o emitida por
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA
 PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
LA ORGANIZACIÓN DEL CUERPO HUMANO
 LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
Empaques para Esterilización. Ing. Jaime Zohrer
 Empaques para Esterilización Ing. Jaime Zohrer jzohrer@arjomedical.com A que le tenemos mas miedo? Leon Bacteria Cual mata a mas personas? Leon Bacteria 35 >20,000 Como nos protegemos? Jaula de Hierro
Empaques para Esterilización Ing. Jaime Zohrer jzohrer@arjomedical.com A que le tenemos mas miedo? Leon Bacteria Cual mata a mas personas? Leon Bacteria 35 >20,000 Como nos protegemos? Jaula de Hierro
CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN
 II PRÁCTICA 2 CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
II PRÁCTICA 2 CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
IV - ÓPTICA PAU.98 PAU.98
 1.- Dónde debe colocarse un objeto para que un espejo cóncavo forme imágenes virtuales?. Qué tamaño tienen estas imágenes?. Realiza las construcciones geométricas necesarias para su explicación PAU.94
1.- Dónde debe colocarse un objeto para que un espejo cóncavo forme imágenes virtuales?. Qué tamaño tienen estas imágenes?. Realiza las construcciones geométricas necesarias para su explicación PAU.94
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO.
 LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
EJERCICIOS: PREGUNTAS
 ATLAS de H I STOLOGÍA VEGETAL y AN I M AL TÉCNICAS HISTOLÓGICAS EJERCICIOS: PREGUNTAS Manuel Megías, Pilar Molist, Manuel A. Pombal, Manuel Departamento de Biología Funcional y Ciencias de la Salud. Facultad
ATLAS de H I STOLOGÍA VEGETAL y AN I M AL TÉCNICAS HISTOLÓGICAS EJERCICIOS: PREGUNTAS Manuel Megías, Pilar Molist, Manuel A. Pombal, Manuel Departamento de Biología Funcional y Ciencias de la Salud. Facultad
MARCO TEÓRICO. Título: Célula: estructura función. Diversidad celular. Docente: Rolando Hernández Lazo
 Título: Célula: estructura función. Diversidad celular. Docente: Rolando Hernández Lazo OBJETIVOS Al final de esta práctica el estudiante deberá comprobar que: Las células vegetales como las animales poseen
Título: Célula: estructura función. Diversidad celular. Docente: Rolando Hernández Lazo OBJETIVOS Al final de esta práctica el estudiante deberá comprobar que: Las células vegetales como las animales poseen
LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218. Práctica de Laboratorio No. 3 CALIBRACIÓN DE MATERIAL VOLUMÉTRICO ANALÍTICO
 UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 3 COMPETENCIAS A LOGRAR:
UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 3 COMPETENCIAS A LOGRAR:
PRACTICA No.9 REACCIONES QUIMICAS I
 PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
LA CÉLULA. Hecho por: Alba García Murillo 1º B
 LA CÉLULA Hecho por: Alba García Murillo 1º B dhñ Xf R La célula es la unidad más pequeña dotada de vida. Todos los seres vivos están formados por células: -Una célula : unicelulares Ejem: La salmonella
LA CÉLULA Hecho por: Alba García Murillo 1º B dhñ Xf R La célula es la unidad más pequeña dotada de vida. Todos los seres vivos están formados por células: -Una célula : unicelulares Ejem: La salmonella
SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado por: Licda. Vivian Margarita Sánchez Garrido
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
Laboratorio 4: Tinción de microorganismos. Biol 3725L
 Laboratorio 4: Tinción de microorganismos Biol 3725L 1 ml 1 ml Repaso de diluciones 0.1 ml 1 ml 1 ml 9 ml 1 / 10 10-1 99 ml 9.9ml 9 ml 1 / 100 10-3 1 ml 0.1/ 10 1/ 100 10-5 1/10 10-6 1 ml 9 ml 1/10 10-7
Laboratorio 4: Tinción de microorganismos Biol 3725L 1 ml 1 ml Repaso de diluciones 0.1 ml 1 ml 1 ml 9 ml 1 / 10 10-1 99 ml 9.9ml 9 ml 1 / 100 10-3 1 ml 0.1/ 10 1/ 100 10-5 1/10 10-6 1 ml 9 ml 1/10 10-7
PREPARACIÓN DE MEDIOS DE CULTIVO
 Introducción Clasificación de los medios de cultivo Almacenamiento de los medios de cultivo Trabajo Práctico Nº 6 PREPARACIÓN DE MEDIOS DE CULTIVO Objetivo Fundamento Procedimiento Resultados Bibliografía
Introducción Clasificación de los medios de cultivo Almacenamiento de los medios de cultivo Trabajo Práctico Nº 6 PREPARACIÓN DE MEDIOS DE CULTIVO Objetivo Fundamento Procedimiento Resultados Bibliografía
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
UNIDAD 1. D. Borja Blanco Vives. Profesor de Biología y Geología 4ºESO
 UNIDAD 1. D. Borja Blanco Vives. Profesor de Biología y Geología 4ºESO 1. LA COMPOSICIÓN DE LOS SERES VIVOS. Todos los seres vivos están formados por: - materia inorgánica: agua y sales minerales - materia
UNIDAD 1. D. Borja Blanco Vives. Profesor de Biología y Geología 4ºESO 1. LA COMPOSICIÓN DE LOS SERES VIVOS. Todos los seres vivos están formados por: - materia inorgánica: agua y sales minerales - materia
1. Introducción 2. Formas acelulares: los virus 3. Los procariotas: bacterias, cianofíceas y micoplasmas 4. Métodos y técnicas microbiológicas
 1. INTRODUCCIÓN Diversidad y Clasificación 1. Introducción 2. Formas acelulares: los virus 3. Los procariotas: bacterias, cianofíceas y micoplasmas 4. Métodos y técnicas microbiológicas Desde que Pasteur
1. INTRODUCCIÓN Diversidad y Clasificación 1. Introducción 2. Formas acelulares: los virus 3. Los procariotas: bacterias, cianofíceas y micoplasmas 4. Métodos y técnicas microbiológicas Desde que Pasteur
CONOCIENDO EL MICROSCOPIO
 CONOCIENDO EL MICROSCOPIO Historia del Microscopio 1590. Primer microscopio compuesto fue construido por los holandeses H. Jansen y Z. Jansen 1611 Kepler sugirió la manera de construir un microscopio compuesto
CONOCIENDO EL MICROSCOPIO Historia del Microscopio 1590. Primer microscopio compuesto fue construido por los holandeses H. Jansen y Z. Jansen 1611 Kepler sugirió la manera de construir un microscopio compuesto
PRÁCTICO N 4 CARBOHIDRATOS
 PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
PRÁCTICA 1: Funcionamiento laboratorio. Normas y material
 PRÁCTICA 1: Funcionamiento laboratorio. Normas y material OBJETIVO: 1. Familiarizarse con el uso y manejo de todo el material del laboratorio, así como con las normas para un buen funcionamiento del mismo.
PRÁCTICA 1: Funcionamiento laboratorio. Normas y material OBJETIVO: 1. Familiarizarse con el uso y manejo de todo el material del laboratorio, así como con las normas para un buen funcionamiento del mismo.
TRABAJO PRÁCTICO N 3: Identificación microbiana
 TRABAJO PRÁCTICO N 3: Identificación microbiana PARTE A: Identificación Fenotípica 1.-Pruebas Bioquímicas 2- Coloraciones 3. Uso del Manual Bergey Pruebas Bioquímicas Son una serie de pruebas que permiten
TRABAJO PRÁCTICO N 3: Identificación microbiana PARTE A: Identificación Fenotípica 1.-Pruebas Bioquímicas 2- Coloraciones 3. Uso del Manual Bergey Pruebas Bioquímicas Son una serie de pruebas que permiten
Dependiendo de la forma de llevar a cabo su funcionamiento, existen tres tipos de autoclave industrial:
 TIPOS DE AUTOCLAVE INDUSTRIAL Dependiendo de la forma de llevar a cabo su funcionamiento, existen tres tipos de autoclave industrial: - Autoclave industrial de desplazamiento por gravedad. Se inyecta a
TIPOS DE AUTOCLAVE INDUSTRIAL Dependiendo de la forma de llevar a cabo su funcionamiento, existen tres tipos de autoclave industrial: - Autoclave industrial de desplazamiento por gravedad. Se inyecta a
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL
 UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
Práctica # 2: Reconocimiento de Material de Laboratorio Y Técnicas Experimentales
 República Bolivariana de Venezuela Ministerio del poder popular para la Educación Unidad Educativa Colegio Aplicación Palo Gordo-Edo. Táchira Lcda. Katherine Gómez Práctica # 2: Reconocimiento de Material
República Bolivariana de Venezuela Ministerio del poder popular para la Educación Unidad Educativa Colegio Aplicación Palo Gordo-Edo. Táchira Lcda. Katherine Gómez Práctica # 2: Reconocimiento de Material
Colegio Marista San José - Ampliación de Biología y Geología Tema 5: Del átomo a la célula.
 La teoría celular. La idea de que los seres vivos están constituidos por células y que cada una de ellas proviene de otra, que ya existía con anterioridad, es relativamente reciente. Es en la segunda mitad
La teoría celular. La idea de que los seres vivos están constituidos por células y que cada una de ellas proviene de otra, que ya existía con anterioridad, es relativamente reciente. Es en la segunda mitad
Protocolos Laboratorio de Microbiología Experimental 2014 PREPARACIONES MICROBIOLÓGICAS
 PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I
 UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
Compuestos físicos para la desinfección del agua: -Luz Ultravioleta (UV) - Radiación electrónic -Rayos Gamma - Sonido - Calor
 Que es la desinfección de las aguas La desinfección del agua significa la extracción, desactivación o eliminación de los microorganismos patógenos que existen en el agua. La destrucción y/o desactivación
Que es la desinfección de las aguas La desinfección del agua significa la extracción, desactivación o eliminación de los microorganismos patógenos que existen en el agua. La destrucción y/o desactivación
NORMAS DE UTILIZACION Y CONSERVACION DE LOS DESINFECTANTES.
 1 NORMAS DE UTILIZACION Y CONSERVACION DE LOS DESINFECTANTES. Desinfectante: sustancia química que destruye los microorganismos y que se aplica sobre material inerte sin alterarlo de forma sensible. Niveles
1 NORMAS DE UTILIZACION Y CONSERVACION DE LOS DESINFECTANTES. Desinfectante: sustancia química que destruye los microorganismos y que se aplica sobre material inerte sin alterarlo de forma sensible. Niveles
Actividad: Cómo ocurren las reacciones químicas?
 Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Tema 2 AHORRO EN CONSUMO DE ENERGÉTICOS MANTENIMIENTO
 Tema 2 AHORRO EN CONSUMO DE ENERGÉTICOS MANTENIMIENTO Objetivo específico : Ahorro en el consumo de energéticos Objetivo específico Conocer las acciones mas importantes que se deben llevar acabo en la
Tema 2 AHORRO EN CONSUMO DE ENERGÉTICOS MANTENIMIENTO Objetivo específico : Ahorro en el consumo de energéticos Objetivo específico Conocer las acciones mas importantes que se deben llevar acabo en la
Sensor de humedad. Además estos sensores existen en formas tanto analógicas como digitales.
 Sensor de humedad Fundamentos básicos Un sensor de humedad es un dispositivo que mide la humedad relativa en un área dada, este puede ser utilizado tanto en interiores como en exteriores. Además estos
Sensor de humedad Fundamentos básicos Un sensor de humedad es un dispositivo que mide la humedad relativa en un área dada, este puede ser utilizado tanto en interiores como en exteriores. Además estos
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II
 UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
EXCEPCIÓN A LA TEORÍA CELULAR: LOS VIRUS OTRAS FORMAS ACELULARES INFECCIOSAS: - VIROIDES - PRIONES
 EXCEPCIÓN A LA TEORÍA CELULAR: LOS VIRUS OTRAS FORMAS ACELULARES INFECCIOSAS: - VIROIDES - PRIONES LOS VIRUS Los virus son parásitos obligados, lo que implica que necesitan siempre células huésped vivas
EXCEPCIÓN A LA TEORÍA CELULAR: LOS VIRUS OTRAS FORMAS ACELULARES INFECCIOSAS: - VIROIDES - PRIONES LOS VIRUS Los virus son parásitos obligados, lo que implica que necesitan siempre células huésped vivas
Esterilización y limpieza
 Esterilización y limpieza Importancia de la limpieza y esterilización del material Evitar infecciones cruzadas (transmisión de microorganismos infecciosos de un individuo infectado a otro) Complicaciones
Esterilización y limpieza Importancia de la limpieza y esterilización del material Evitar infecciones cruzadas (transmisión de microorganismos infecciosos de un individuo infectado a otro) Complicaciones
Ejercicio 3. La Célula (Capítulo 7) Preparado por: Prof. Ángel A. Ortiz-Vélez
 Universidad de Puerto Rico en Ponce: Departamento de Biología: BIOL 3013: 2004-2005 Ejercicio 3. La Célula (Capítulo 7) Preparado por: Prof. Ángel A. Ortiz-Vélez Introducción Células Procarioticas La célula
Universidad de Puerto Rico en Ponce: Departamento de Biología: BIOL 3013: 2004-2005 Ejercicio 3. La Célula (Capítulo 7) Preparado por: Prof. Ángel A. Ortiz-Vélez Introducción Células Procarioticas La célula
TRABAJO PRÁCTICO EL MICROSCOPIO
 Cátedra de Biología Escuela de Medicina Veterinaria Universidad Nacional de Río Negro TRABAJO PRÁCTICO EL MICROSCOPIO OBJETIVOS Reconocer las características de un microscopio óptico, ejercitar las normas
Cátedra de Biología Escuela de Medicina Veterinaria Universidad Nacional de Río Negro TRABAJO PRÁCTICO EL MICROSCOPIO OBJETIVOS Reconocer las características de un microscopio óptico, ejercitar las normas
El propósito principal de la deshidratación de alimentos es prolongar la durabilidad
 1.1 INTRODUCCIÓN El propósito principal de la deshidratación de alimentos es prolongar la durabilidad del producto final. El objetivo primordial del proceso de deshidratación es reducir el contenido de
1.1 INTRODUCCIÓN El propósito principal de la deshidratación de alimentos es prolongar la durabilidad del producto final. El objetivo primordial del proceso de deshidratación es reducir el contenido de
Técnicas de Estudio de las células
 Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
GUIA II DE LABORATORIO I. REINOS DE LA NATURALEZA
 1 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD ESCUELA DE CIENCIAS BASICAS, TECNOLOGIA E INGENIERIA CURSO DE BIOLOGIA TUTORA: YAMILE CORTES Yamile.cortes@unad.edu.co labbiologiayamilecortesunad.wordpress.com
1 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD ESCUELA DE CIENCIAS BASICAS, TECNOLOGIA E INGENIERIA CURSO DE BIOLOGIA TUTORA: YAMILE CORTES Yamile.cortes@unad.edu.co labbiologiayamilecortesunad.wordpress.com
FICHAS COMPLEMENTARIAS. REFLEXIÓN
 FICHAS COMPLEMENTARIAS. REFLEXIÓN I.- DESCRIPCIÓN DE LOS COMPONENTES Para realizar las prácticas de óptica vas a usar: 1.- Banco óptico: es una base metálica sobre la que colocar los diferentes montajes.
FICHAS COMPLEMENTARIAS. REFLEXIÓN I.- DESCRIPCIÓN DE LOS COMPONENTES Para realizar las prácticas de óptica vas a usar: 1.- Banco óptico: es una base metálica sobre la que colocar los diferentes montajes.
ESTERILIZACIÓN. Dra. FLOR TERESA GARCÍA HUAMÁN
 ESTERILIZACIÓN Dra. FLOR TERESA GARCÍA HUAMÁN Se denomina esterilización al proceso por el cual se obtiene un producto libre de microorganismos viables. El proceso de esterilización debe ser diseñado,
ESTERILIZACIÓN Dra. FLOR TERESA GARCÍA HUAMÁN Se denomina esterilización al proceso por el cual se obtiene un producto libre de microorganismos viables. El proceso de esterilización debe ser diseñado,
MICROSCOPIO. Partes de un Microscopio Óptico
 MICROSCOPIO Partes de un Microscopio Óptico 1 Partes mecánicas 1.- PIE: Porción que sostiene un microscopio 2.- BRAZO: Pieza que va unida en su parte inferior al pie, y que en su parte superior lleva tres
MICROSCOPIO Partes de un Microscopio Óptico 1 Partes mecánicas 1.- PIE: Porción que sostiene un microscopio 2.- BRAZO: Pieza que va unida en su parte inferior al pie, y que en su parte superior lleva tres
Microscopio Electrónico
 Microscopio Electrónico Prof. Iván Rebolledo El microscopio electrónico fue desarrollado en los años 30 y fue utilizado con especímenes biológicos por Albert Claude, Keith Porter y George Palade en los
Microscopio Electrónico Prof. Iván Rebolledo El microscopio electrónico fue desarrollado en los años 30 y fue utilizado con especímenes biológicos por Albert Claude, Keith Porter y George Palade en los
LABORATORIO 6. TITULO : Propiedades de los Gases
 37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
La organización del cuerpo humano. Punto 1: Los niveles de organización.
 La organización del cuerpo humano Punto 1: Los niveles de organización. ATOMO MOLECULA Unidad constituyente más pequeña de la materia ordinaria. Conjunto de al menos dos átomos enlazados covalentes que
La organización del cuerpo humano Punto 1: Los niveles de organización. ATOMO MOLECULA Unidad constituyente más pequeña de la materia ordinaria. Conjunto de al menos dos átomos enlazados covalentes que
