Propagación del alga Caulerpa sertularioides (Chlorophyta) en Bahía Culebra, Golfo de Papagayo, Pacífico norte de Costa Rica
|
|
|
- Ana María Calderón Moreno
- hace 6 años
- Vistas:
Transcripción
1 UNIVERSIDAD DE COSTA RICA SISTEMA DE ESTUDIOS DE POSTGRADO PROGRAMA REGIONAL DE MAESTRÍA EN BIOLOGÍA Propagación del alga Caulerpa sertularioides (Chlorophyta) en Bahía Culebra, Golfo de Papagayo, Pacífico norte de Costa Rica Tesis sometida a la consideración de la Comisión de Estudios de Posgrado en Biología para optar por el grado de Magíster Scientiae CINDY FERNÁNDEZ GARCÍA Ciudad Universitaria Rodrigo Facio Costa Rica 2007
2 DEDICATORIA T Å ytå Ä tm ct? `t? ]âtç}é ç `tâ? ÑÉÜ áâ tñéçé ÇvÉÇw v ÉÇtÄ t ÄÉ ÄtÜzÉ wx Å vtüüxütaaa Fotografía: Cindy Fernández, Playa Blanca, Bahía Culebra ii
3 AGRADECIMIENTOS Este trabajo fue realizado gracias al apoyo económico de la Vicerrectoría de Investigación de la Universidad de Costa Rica, financiando a través del proyecto de Monitoreo de Arrecifes coralinos de Jorge Cortés, así como de la fundación IDEA WILD y el apoyo generoso de mis padres. A Don Ricardo por sus invaluables y sabios consejos, sobretodo por la confianza que depositó en mí, durante este trabajo y por facilitarme la mejor herramienta de trabajo para desempeñarme en este campo: su colección de libros. Le prometo siempre recordar esa frase que me dijo cuando iniciamos este proyecto buscar ideas innovadoras... A Don Jorge por darme la inspiración para amar la ciencia, por sus consejos, apoyarme siempre en los proyectos y facilitarme el realizar esta investigación. A Gerardo Avalos por brindarme su asesoramiento en ecología y estadística multivariada que enriquecieron este trabajo. A Bryan Wysor por la revisión del anteproyecto y su asesoría en las metodologías al inicio de proyecto. A Oscar Rocha, Gabriel y James Karkashian, de la Escuela de Biología, por ayudarme en las exploraciones genéticas que tratamos de realizar. A Javier Alvarado de la Escuela de Geología por toda su ayuda con el tamizaje de las muestras de sustrato. Al ICT por el préstamo de las instalaciones en Playa Panamá y por el apoyo constante en los proyectos, especialmente a Miguel y a Gumer, que nos recibieron todos los meses. Al Instituto Metereológico Nacional por facilitarme los datos de la estación del aeropuerto Daniel Oduber. A Cecilia Pineda, del Museo Nacional de Costa Rica, por facilitarme el aceso a la colección de algas. Y a los operadores de turismo y pescadores de la zona que muy amablemente respondieron las entrevistas. A todo el CIMAR MUCHAS GRACIAS. A Gerardo Umaña, José Vargas, Ingo Werthmann, Alvaro Morales y especialmente a Jenaro Acuña por sus consejos y apoyo. A Carlos Jiménez por sus acertados consejos en las metodologías y a Odalisca Breedy y Rita Vargas por el apoyo psicológico para continuar y por su amistad. A Eva y Bernadethe por toda la ayuda en el campo, a Jeffry por los consejos en el análisis estadístico y a Eddy por su ayuda con los análisis químicos. A Eleazar, Leda, Fabián, Don Rigo por todo el apoyo logístico y molestias de última hora, que se resolvieron iii
4 gracias a su colaboración, pero más que el apoyo logístico muchas gracias por su amistad. A mi familia por su comprensión, sobretodo en esos días especiales que me perdí, pero sobretodo por su apoyo y amor. Finalmente quiero agradecer muy especialmente a Chepe, Jaime y Davis por su compañía, dedicación y amistad porque sin hablar debajo del agua pudimos lograr esa comunicación, sin ustedes no hubiera podido realizar este trabajo. Especialmente a mi cómplice por su apoyo y paciencia... iv
5
6 ÍNDICE Pág Dedicatoria. ii Agradecimientos iii Lista de Cuadros..viii Lista de Figuras.....x Prefacio.....xiv Capítulo 1. Historia natural del alga Caulerpa sertularioides (S.G. Gmelin) M. Howe 1905 (Chlorophyta) en Bahía Culebra, Golfo de Papagayo, Costa Rica. Resumen...1 Introducción...2 Materiales y Métodos 3 Resultados..8 Discusión.14 Capítulo 2. Factores ambientales involucrados en la propagación del alga Caulerpa sertularioides (Chlorophyta), en una zona de afloramiento costero, Bahía Culebra, Golfo de Papagayo, Costa Rica. Resumen..19 Introducción.20 Materiales y Métodos..22 Resultados 29 Discusión.44 Capítulo 3. Impacto de la propagación de Caulerpa sertularioides (Chlorophyta) en los ecosistemas coralinos de Bahía Culebra, Golfo de Papagayo, Costa Rica. Resumen..51 Introducción.52 Materiales y Métodos..54 Resultados 57 Discusión.63 vi
7 Capítulo 4. Consideraciones sociales y ambientales para el manejo de la propagación del alga verde Caulerpa sertularioides en el ambiente marino de Bahía Culebra, Golfo de Papagayo, Costa Rica. Resumen..70 Introducción.71 Materiales y Métodos..72 Resultados y Discusión Anexos.79 Referencias vii
8 LISTA DE CUADROS Cuadro Pag. Capítulo 1. Historia natural del alga Caulerpa sertularioides (S.G. Gmelin) M. Howe 1905 (Chlorophyta) en Bahía Culebra, Golfo de Papagayo, Costa Rica Observaciones realizadas sobre el estado de los talos de C. sertularioides y presencia de epífilos, en Bahía Culebra, Golfo de Papagayo, entre agosto del 2003 y marzo del El sombreado indica presencia Variación de dos medidas morfológicas de Caulerpa sertularioides en marzo 2004 y octubre 2005, en Bahía Culebra, Golfo de Papagayo...12 Capítulo 2. Factores ambientales involucrados en la propagación del alga Caulerpa setularioides (Chlorophyta), en una zona de afloramiento costero, Bahía Culebra, Golfo de Papagayo, Costa Rica Promedio y desviación estándar mensual de la precipitación, brillo solar y velocidad del viento, en época seca (noviembre-abril) y en época lluviosa (mayooctubre), entre enero 1999 y diciembre 2005, en Bahía Culebra, Golfo de Papagayo. Datos suministrados por el Instituto Meteorológico Nacional de la estación meteorológica del Aeropuerto Daniel Oduber Parámetros físico-químicos de Bahía Culebra, Golfo de Papagayo, desde marzo 2004 a marzo Densidades (# frondas/10 cm 2 ) máximas y mínimas promedio del número de frondas medidas en tres sitios de muestreo, entre marzo 2004 y marzo 2005, Bahía Culebra, Golfo de Papagayo Porcentajes máximos y mínimos promedio de cobertura de C. sertularioides medidos en tres sitios de muestreo, entre marzo 2004 y marzo 2005, Bahía Culebra, Golfo de Papagayo Temperatura promedio y desviación estándar en cada pecera a lo largo de una semana en el laboratorio del CIMAR, UCR Diferencias máximas y mínimas medidas del largo del estolón, número de frondas y peso húmedo después de una semana de crecimiento en laboratorio, bajo diferentes condiciones de temperatura y nutrimentos Clasificación y comparación del ambiente marino de Bahía Culebra, según las concentraciones de nitrato y fosfato viii
9 Capítulo 3. Impacto de la propagación de Caulerpa sertularioides (Chlorophyta) en los ecosistemas coralinos de Bahía Culebra, Golfo de Papagayo, Costa Rica Crecimiento promedio (+ desviación estándar), máximo y mínimo (mm/mes) medidos en las colonias del coral Pocillopora elegans en un sitio con C. sertularioides y en un sitio sin C. sertularioides, entre mayo 2004 y junio 2005 en Bahía Culebra, Golfo de Papagayo Índices de diversidad y número total de cuadrículas donde aparecieron de macroalgas encontradas en los transectos en Playa La Penca y Punta Arenilla, Bahía Culebra, Golfo de Papagayo Índices de Diversidad y densidad (ind/m 2 ) de invertebrados encontrados en los transectos en Playa La Penca y Punta Arenilla, Bahía Culebra, Golfo de Papagayo Promedio y desviación estándar de la densidad de nudibranquios y poliquetos en sitios con presencia y ausencia de C. sertularioides Promedio del crecimiento (mm/mes) del coral Pocillopora elegans en el Pacífico Oriental ix
10 LISTA DE FIGURAS Figura Pag. Capítulo 1. Historia natural del alga Caulerpa sertularioides (S.G. Gmelin) M. Howe 1905 (Chlorophyta) en Bahía Culebra, Golfo de Papagayo, Costa Rica Localización del área de estudio y de los sitios con presencia o ausencia de parches de C. sertularioides a lo largo de Bahía Culebra, Golfo de Papagayo, Pacífico norte de Costa Rica. Los puntos negros indican presencia del alga y las x indican ausencia de esta Medidas morfológicas del talo de C. sertularioides (modificado de Chaverri 1996) Porcentaje del tamaño de grano y estimación de la cobertura de C. sertularioides, por sitio en Bahía Culebra, Golfo de Papagayo. 0=ausente, 1= poca, 2= común, 3= mucha Promedio del crecimiento y desviación estándar del estolón de C. sertularioides a lo largo de un mes, en tres épocas del año (diciembre 2003, marzo 2004 y setiembre 2004) en Bahía Culebra, Golfo de Papagayo Frondas después de libración de gametos. A. Detalle de las papilas por donde se expulsan los gametos, B. Detalle de la punta de la fronda después de la liberación de los gametos Promedio y desviación estándar del diámetro del estolón de Caulerpa sertularioides a tres profundidades, en dos meses muestreados (marzo 2004 octubre 2004) en Bahía Culebra, Golfo de Papagayo Promedio y desviación estándar de la longitud de la fronda de Caulerpa sertularioides a tres profundidades, en los meses muestreados (marzo 2004 octubre 2004) en Bahía Culebra, Golfo de Papagayo Capítulo 2. Factores ambientales involucrados en la propagación del alga Caulerpa setularioides (Chlorophyta), en una zona de afloramiento costero, Bahía Culebra, Golfo de Papagayo, Costa Rica Localización del área de estudio y de los sitios de muestreo en Bahía Culebra, Golfo de Papagayo. Los círculos negros indican los sitios donde se realizaron medidas de los parches del alga y la toma de factores ambientales. Los números donde se contabilizó la cobertura y densidad de frondas en cuadrículas permanentes desde marzo 2004 hasta marzo Las letras las estaciones de nutrimentos. El asterisco indica el sitio de donde se extrajeron talos del alga para el experimento en laboratorio...25 x
11 2.2. Esquema de medición del área de los parches de C. sertularioides: A. Medida de los puntos máximos del parche cada 30º, B. Conformación del polígono Experimento en laboratorio del crecimiento de C. sertularioides bajo diferentes tratamientos de temperatura y nutrimentos. A. Peceras con los tres tratamientos de temperatura. B. Esquema de los componentes de cada pecera Promedios mensuales de: A. Precipitación (mm) y velocidad del viento (km/h). B. Brillo solar (hrs por día). Entre enero 1999 y diciembre 2005, en Bahía Culebra, Golfo de Papagayo. El sombreado indica la época seca Valores mensuales promedio de temperatura (ºC), salinidad ( ), clorofila a (µg/l), medidos en Bahía Culebra, Golfo de Papagayo, entre marzo 2004 y marzo El sombreado indica la época seca Valores mensuales promedio de sedimentos en suspensión (mg/l) y tasa de sedimentación (mg/cm 2 /día), medidos en Bahía Culebra, Golfo de Papagayo, entre marzo 2004 y marzo El sombreado indica la época seca Concentración promedio y desviaciones estándar en época seca y lluviosa de los nutrimentos, desde abril 1999 hasta marzo 2005, en Bahía Culebra, Golfo de Papagayo Promedios mensuales de fosfato, nitrito, nitrato, silicato y amonio, a 15 m de profundidad entre abril 1999 y marzo 2005, utilizando los promedios mensuales de cinco estaciones distribuidas a lo largo de Bahía Culebra, Golfo de Papagayo. El sombreado indica la época seca Análisis de Componentes Principales (ACP) de los factores físico-químicos estudiados en Bahía Culebra entre marzo 2004 y marzo A. Componente Principal 1 (CP1) vs Componente Principal 2 (CP2). B. Componente Principal 2 (CP2) vs Componente Principal 3 (CP3). Los tres CP explican un 65.2% de la variación Dinámica mensual del área de los parches de C. sertularioides, entre agosto 2003 y marzo 2005, en cinco sitios de muestreo en Bahía Culebra, Golfo de Papagayo. El sombreado indica la época seca Promedio y desviación estándar de la densidad de frondas (# frondas/cm 2 ) en época seca y en época lluviosa en tres sitios de muestreo, entre marzo 2004 y marzo 2005, Bahía Culebra, Golfo de Papagayo Promedio y desviación estándar del porcentaje de cobertura de C. sertularioides, de cinco cuadrículas, en tres sitios de muestreo, entre marzo 2004 y marzo 2005, Bahía Culebra, Golfo de Papagayo Promedio y desviación estándar de la densidad de frondas (#Frondas/10cm 2 ) y de la cobertura (%) de C. sertularioides de tres sitios de muestreo, entre marzo 2004 y marzo 2005, en Bahía Culebra, Golfo de Papagayo. El sombreado indica la época seca xi
12 2.14. Promedio y desviación estándar de la diferencia entre la medida final e inicial (durante una semana) del largo del estolón (cm), número de frondas y peso húmedo (g) de C. sertularioides, en condiciones de laboratorio con tres tratamientos de temperatura Promedio y desviación estándar de la diferencia entre la medida final e inicial (durante una semana) del largo del estolón (cm), número de frondas y peso húmedo (g) de C. sertularioides, en condiciones de laboratorio con dos tratamientos de nutrimentos Distribución mundial de Caulerpa sertularioides Capítulo 3. Impacto de la propagación de Caulerpa sertularioides (Chlorophyta) en los ecosistemas coralinos de Bahía Culebra, Golfo de Papagayo, Costa Rica Ubicación de los sitios de muestreo: Playa La Penca, Playa Blanca y Punta Arenilla, Bahía Culebra, Golfo de Papagayo, Pacífico norte de Costa Rica Colonias de Pocillopora elegans teñidas con alizarina en Playa La Penca, Bahía Culebra. A. Colonias sobre un parche de arena sin C. sertularioides, B. Colonias sobre un parche de C. sertularioides Crecimiento promedio y desviación estándar de Pocillopora elegans en sitios con y sin Caulerpa en época lluviosa (mayo 2004 a noviembre 2004) y seca (diciembre 2004 a junio 2005) en Playa La Penca, Bahía Culebra Promedio y desviación estándar del porcentaje cobertura y densidad de frondas (# frondas/10 cm 2 ) de C. sertularioides, en época seca y en época lluviosa, entre mayo 2004 y junio 2005, en Playa La Penca, Bahía Culebra Interacciones entre las colonias de los corales de Bahía Culebra y el alga C. sertularioides. A. Sobrecrecimiento de C. sertularioides sobre una colonia de Pocillopora elegans, B. Roce de las frondas del alga en una colonia de Pocillopora sp., C. Roce de las frondas del alga en una colonia de Psacommocora stellata Capítulo 4. Consideraciones sociales y ambientales para el manejo de la propagación del alga verde Caulerpa sertularioides en el ambiente marino de Bahía Culebra, Golfo de Papagayo, Costa Rica Localización del área de estudio y de los sitios con presencia o ausencia de parches de C. sertularioides a lo largo de Bahía Culebra, Golfo de Papagayo. Los puntos negros indican presencia del alga y las x indican ausencia de esta 73 xii
13 4.2. Observaciones y opiniones de los entrevistados con respecto a diferentes situaciones que se presentan entorno a la propagación del alga Caulerpa sertularioides, en Bahía Culebra Modelo sobre los efectos directos que tienen los factores que interactúan en Bahía Culebra en el desarrollo de C. sertularioides.. 75 xiii
14 PREFACIO El presente trabajo de tesis denominado Propagación del alga Caulerpa sertularioides (Chlorophyta) en Bahía Culebra, Golfo de Papagayo, Pacífico norte de Costa Rica, fue sometido a la consideración de la Comisión de Estudios de Posgrado en Biología para optar por el grado de Magíster Scientiae. Esta tesis consiste de cuatro capítulos, escritos de acuerdo con el formato de la Revista de Biología Tropical, de la Universidad de Costa Rica. En Bahía Culebra, se ha observado una propagación del alga verde C. sertularioides, desde hace aproximadamente seis años. Su efecto en las comunidades bénticas se ha notado especialmente en el reemplazo de la flora algal, sobrecrecimiento de colonias de coral y cambios en la abundancia y diversidad de organismos. Muchos de los sitios, donde se ha observado el crecimiento rápido de C. sertularioides, son importantes por su desarrollo arrecifal, tienen gran potencial para el turismo y para la pesca y extracción de peces para acuarios. El Capítulo 1 describe la historia natural de C. sertularioides en la Bahía, y contribuye con datos para entender la distribución, biología y ecología de la propagación del alga. Esto es importante ya que el estudio de la biología de poblaciones de especies oportunistas es útil para identificar puntos para su manejo adecuado, antes de pensar en una erradicación completa. Se hicieron recorridos en varios puntos alrededor de la bahía, entre agosto del 2003 y marzo del 2005, para ubicar los parches del alga. En cada sitio se anotaron observaciones generales como: profundidad a la que se encontró creciendo, estado general de la población, estado reproductivo, presencia de epífilos sobre las frondas y tipo de sustrato con un análisis granulométrico. A la vez se cuantificó el largo del estolón in situ y se realizaron experimentos en laboratorio sobre la elongación del estolón de C. sertularioides bajo condiciones controladas. Finalmente se midieron caracteres morfológicos de C. sertularioides para determinar la variabilidad de los talos por profundidad y por época. En Bahía Culebra, C. sertularioides, se desarrolla principalmente desde la línea intermareal, en pozas, donde en marea baja llega el rocío de las olas, hasta profundidades de 17 m, cubriendo gran cantidad de sustratos incluyendo rocas, arena, corales vivos y muertos. Entre los 3 y 6 m de profundidad alcanza la mayor cobertura. Muchos de los sitios donde se ha observado el crecimiento rápido de C. sertularioides son de gran importancia por el desarrollo arrecifal. Los sitios con mayor cobertura y densidad de frondas se encuentran donde el sustrato está compuesto por xiv
15 granos gruesos, principalmente fragmentos de pocilopóridos que favorecen la adhesión de los estolones de C. sertularioides. Los sitios donde actualmente hay una gran cobertura del alga, muestran arrecifes de gran extensión, gran grosor arrecifal y altas coberturas de coral vivo. En el litoral interno de la bahía se da un limitado crecimiento de corales y en algunas secciones yacen bajo una cubierta de fango proveniente de un pequeño estuario, limitando el crecimiento del alga al ser sitios más turbios y con un sustrato compuesto por granos finos en su mayoría, donde los estolones no pueden sostenerse. En todos los sitios donde se da crecimiento del alga, se observó que los talos tienen reproducción sexual. Se logró observar un desove sincronizado de gametos, donde varios parches se encontraron desovando simultáneamente. C. sertularioides tiene la capacidad de formar un talo nuevo cuando se corta una fronda o una sección del talo, por lo que la reproducción de los individuos es principalmente asexual, por fragmentación de frondas y estolones que constantemente se observaron flotando en las aguas de la Bahía. En este estudio, se observa que el crecimiento del estolón tiene un crecimiento mayor al de otras especies nativas de Caulerpa, pero no tan acelerado como las especies invasivas C. taxifolia y C. racemosa en el Mediterranéo. C. sertularioides presenta plasticidad morfológica, lo que le da la capacidad de distribuirse en varios ambientes, al adaptar sus frondas y estolones a diferentes condiciones que se presenten por el cambio de profundidad como oleaje, intensidad lumínica, temperatura, además de la disponibilidad de sustrato y la herbivoría. Las causas de la expansión de las especies del género Caulerpa, se asocian a cambios en las condiciones del agua que favorecen a estas especies oportunistas, tales como los aumentos o disminuciones de temperatura o el aumento de nutrimentos, favorecido por las características intrínsecas del género Caulerpa, como son: la poca herbivoría debido al alto contenido de toxinas, la fácil adaptación a diferentes condiciones y la reproducción asexual por fragmentación, originada naturalmente y por las anclas de los botes de turismos y pescadores. Por esto en el Capítulo 2, se describen las características ambientales que caracterizan la bahía, desde marzo del 2004 hasta marzo del El estudio analiza el comportamiento de la: salinidad ( ), clorofila a (µg/l), temperatura (ºC), sedimentos en suspensión (mg/l), tasa de sedimentación (mg/cm 2 /día), precipitación (mm), brillo solar (horas de sol por día) y velocidad del viento (km/h). A la vez se muestra por primera vez un análisis de los nutrimentos (PO -3 4, NO -, 2 NO - 3, NH + 4 y SIO 4 ) desde 1999 hasta el Se determinaron cúales son xv
16 los factores que afectan principalmente la dinámica de la Bahía por medio de un análisis de componentes Principales (ACP), lo cual es de gran ayuda para tratar de determinar cúales parámetros tienen influencia sobre la dinámica del alga. Aunado a esto, se evaluó la dinámica de los parches, cobertura del alga y la densidad de las frondas estacionalmente. Para esto se midió la variación del área de los parches, la cobertura y densidad de frondas de C. sertularioides en tres sitios de la bahía. Finalmente se realizaron experimentos de crecimiento del alga, en laboratorio en condiciones controladas bajo diferentes tratamientos de temperatura y nutrimentos. Bahía Culebra, presenta un clima estacional con dos épocas bien marcadas, dándose una mayor precipitación y una disminución en el brillo solar y la velocidad del viento en época lluviosa entre mayo y octubre. Los meses más lluviosos de esta época son setiembre y octubre. En julio, se presenta el Veranillo de San Juan, caracterizado por una disminución en el promedio de lluvia y un aumento en la radiación solar y en la velocidad del viento, en comparación con los otros meses de la época lluviosa. La época seca inicia en noviembre, siendo este un mes de transición y termina en abril. La temperatura del agua también mostró ser una variable con alta estacionalidad, aumentando en la época lluviosa y disminuyendo en la época seca por el surgimiento costero. La salinidad muestra sus máximos valores en la época seca, coincidiendo con disponibilidad de sol para calentar el agua y evaporarla, y los mínimos en la época lluviosa coincidiendo con los picos de mayor precipitación, que produce una dilución de las aguas de la bahía. La clorofila muestra aumentos y disminuciones fluctuantes, se encontró un pico de 3.8 µg/l en octubre y la mínima concentración obtenida fue 0.4 µg/l en agosto. Según modelos basados en temperatura y clorofila, con los datos obtenidos en este estudio, en ciertos meses del año, Bahía Culebra se clasifica como un sitio eutrófico con estrés causado por nutrimentos. La mayor descarga de sedimentos coincide con la época de lluvias, mientras que la tasa de sedimentación mostró poca variación temporal en comparación con los sedimentos en suspensión. Al comparar estas dos variables con otros estudios, la bahía se clasifica como una zona de bajo impacto por estos factores, con una tasa de sedimentación promedio de 3.03 mg/cm 2 /día y una concentración de sedimentos suspendidos de 6.18 mg/cm 2 /día. La concentración de nutrimentos es muy variable, mostrando picos tanto en la época seca como en la lluviosa. Los mayores picos de nutrimentos en su mayoría se dan en la época seca, durante el afloramiento costero. Sin embargo, hay un aporte xvi
17 importante en la época lluviosa entre agosto y octubre, que concuerdan con los picos de mayor precipitación, indicando que en la bahía se da escorrentía de nutrimentos por erosión del suelo. Se nota una mayor concentración de fosfato, nitrato y amonio en época seca, mientras que el silicato y el nitrito muestran mayor concentración en la época lluviosa Sin embargo, no se encontraron diferencias significativas entre las -3 - épocas por nutrimento. Al analizar el PO 4 y el NO 3 de este estudio con otros, Bahía Culebra se clasifica como un sitio eutrófico en ambas épocas del año. El Análisis de Componentes Principales evidenció que el fosfato, el nitrato, los sedimentos en suspensión, la tasa de sedimentación y la temperatura juegan un papel preponderante en el ecosistema marino de Bahía Culebra. Únicamente la temperatura mostró diferencias significativas entre épocas, variando con respecto al afloramiento y la entrada de agua dulce por escorrentía. Así mismo son dependientes de factores como la precipitación y la velocidad del viento y las horas de sol durante el día. En general el área de los parches, la densidad de frondas y la cobertura de C. sertularioides, llegaron al máximo en la época seca y a través de los meses tendieron a aumentar por el afloramiento de nutrimentos. Lo contrario sucede en la época lluviosa donde las medidas anteriores tienden a disminuir, los parches son muy difusos e incluso pueden desaparecer y se observan estolones aislados. Sin embargo, se observa un aumento en el área de los parches entre agosto y octubre, coincidiendo con picos de precipitación y nutrimentos, que está relacionado con aportes de materia orgánica vía aguas pluviales que entran a la bahía por riachuelos, esteros y posiblemente por escorrentía de aguas tratadas para el riego de zonas verdes. Al analizar las medidas del alga con los tratamientos de nutrimentos en laboratorio, estas tienden a aumentar cuando los talos están en concentraciones altas de nutrimentos y al disminuir la temperatura a 22 ºC. Lo que demuestra que, si bien es cierto, que los nutrimentos juegan un papel importante en el crecimiento de C. sertularioides, la interacción de otros factores como la disminución en la temperatura son factores que en sinergia contribuyen al crecimiento de esta especie y en consecuencia a la degradación del ecosistema arrecifal de Bahía Culebra. En el Capítulo 3, se describen los efectos que provoca la propagación sobre los organismos arrecifales de Bahía Culebra y contribuye con datos in situ para respaldar la hipótesis de que las macroalgas pueden ser la causa y no la consecuencia de la degradación de los corales y en general del ecosistema arrecifal. Se realizaron una serie de mediciones en sitios con la presencia del alga y en sitios sin el alga, sobre: variación xvii
18 en las tasas del crecimiento de coral, para la cual se tiñeron colonias de coral con alizarina roja, se cuantificaron los cambios en la diversidad, en la abundancia de invertebrados bénticos y macroalgas. En Bahía Culebra la propagación de C. sertularioides afecta la tasa de crecimiento de la colonias de Pocillopora elegans. Según observaciones en la bahía, los mecanismos de interacción entre estos dos organismos se dan por: 1- acumulación de sedimento, 2- interferencia en el crecimiento del coral por sobrecrecimiento en el tejido de coral (sin embargo esto parece no tener un efecto en la sobrevivencia del coral, ya que muchas veces se da corte de frondas por los cangrejos del género Trapezia sp.) y 3- disminución en el crecimiento por la constante abrasión de las frondas sobre el tejido vivo del coral. Se obtuvieron diferencias significativas en los sitios con y sin Caulerpa, dándose un mayor crecimiento en las colonias en el sitio sin el alga. Además, se obtuvo una diferencia en el crecimiento de las colonias durante las épocas muestreadas, con un mayor crecimiento en la época lluviosa. La medida en que el alga afecta los corales varía con la cobertura del alga y la densidad de las frondas que dependen del incremento en los nutrimentos y disminución en la temperatura, lo cual varía con la época del año. La propagación de C. sertularioides causa modificaciones en la estructura de las comunidades bénticas, provocando: 1- disminución en el crecimiento de los corales ramosos, como Pocillopora por abrasión y eliminación en la penetración de luz para las zooxantelas, 2- mortandad de colonias del coral Psammocora stellata por sobrecrecimiento, 3- cambios en la abundancia y composición de especies bénticas en los sitios donde se encuentra, por disminución de especies de otras algas, 4- disminución de especies de invertebrados y 5- aumento de especies oportunistas como nudibranquios y poliquetos, que se favorecen con la presencia del alga. Así mismo, la presencia de herbívoros juega un papel importante en la dinámica anterior, por lo que es necesario realizar estudios sobre abundancia, diversidad, biomasa y sobrepesca de estas especies para determinar la influencia que tienen en la propagación de C. sertularioides en la bahía. Finalmente, el Capítulo 4 muestra los resultados de una encuesta realizada a pescadores y operadores de turismo de la zona, para analizar la percepción que tienen los usuarios de los recursos de la Bahía con respecto a este problema. La mayoría de los encuestados concuerda en que el alga siempre ha estado en la Bahía desde hace muchos años, sin embargo el crecimiento acelerado se empezó a ver entre 2001 y Estos xviii
19 aseveran que en los primeros sitios donde se empezó a ver este crecimiento acelerado son sitios con alta visitación turística y donde constantemente se observan anclados una gran cantidad de botes. Muchos de los usuarios de la Bahía se muestran preocupados por esta situación y están concientes que el alga afecta el ambiente y su actividad debido a los desajustes en el equilibrio del sistema arrecifal y una gran mayoría acepta que se ha dado corte de frondas por las anclas de sus embarcaciones y han observado a turistas inexpertos cortando trozos del alga con sus aletas. En conclusión esta alga ha logrado colonizar muchos ambientes de la Bahía por sus características de ágil propagación como lo son: la dispersión por corte de frondas, reproducción sexual que da variación genética y la fácil adaptación a diversos ambientes de profundidad y sustrato, lo cual se ve favorecido por las temperaturas frías, nutrimentos (que afloran en la época seca y por la escorrentía en la época lluviosa) y por eliminación de herbívoros, como peces y erizos, por pesca para acuarios. Lo anterior tiene como consecuencias, la modificación en la estructura de las comunidades bénticas, disminuyendo el crecimiento de los corales, disminución de especies de otras algas y de especies de invertebrados y aumento de especies oportunistas. De acuerdo con los resultados de los datos recopilados, se desprenden las siguientes recomendaciones: 1- estudiar con mayor precisión las comunidades de herbívoros, 2- protección y monitoreo de sitios donde actualmente no se da el crecimiento del alga o esta se encuentra en baja cobertura, 3- extracción manual entre junio y julio donde la cobertura y el área de los parches disminuyen, 4- realizar una campaña divulgativa para evitar el desprendimiento de trozos del alga, 5- limitar o cerrar la entrada de buzos a sitios donde la cobertura del alga en el sustrato es alta, 6- continuar con los monitoreos de nutrimentos en las zonas de construcción y de riego de zonas verdes para determinar posibles vertimientos de estos en el agua. 7- elaborar un reglamento de actividades responsables para los operadores de turismo y 8- exigir plantas de tratamiento de desechos orgánicos a hoteles y comunidades aledañas a Bahía Culebra, para controlar y evitar el ingreso de nutrimentos a la bahía que favorecen el crecimiento de C. sertularioides. De acuerdo con las consideraciones anteriores, es necesario iniciar un plan de protección de los ambientes coralinos de la bahía. Se espera que la información suministrada en este trabajo, sirva como una herramienta educativa, divulgativa y de toma de decisiones para las autoridades y los habitantes que viven en las cercanías de Bahía Culebra y se benefician de sus recursos marino-costeros. xix
20 CAPÍTULO 1. Historia natural del alga Caulerpa sertularioides (S.G. Gmelin) M. Howe 1905 (Chlorophyta) en Bahía Culebra, Golfo de Papagayo, Costa Rica RESUMEN Este trabajo describe la historia natural del alga C. sertularioides que se ha propagado en una zona de afloramiento costero. Se caracterizan los patrones de distribución del alga, su cobertura, estado de la población, tasa de propagación por mes y se describen las adaptaciones reproductivas y variación morfológica del largo de la fronda y del diámetro de estolón por profundidad y entre épocas. La colonización de C. sertularioides es muy reciente y ésta ha logrando colonizar una variedad de sustratos, hasta los 17 m de profundidad. Esta alga se propaga principalmente por reproducción asexual por cortes de frondas y estolones que constantemente se observaron flotando en las aguas de la bahía. Los talos muestran reproducción sexual, que le da variabilidad genética a la población, potenciando la adaptación de esta especie oportunista, a cambios en los factores físicos, químicos y ambientales de Bahía Culebra. El crecimiento del alga está limitado por el tipo de sustrato y su composición. Muestra mayor cobertura donde el sustrato se compone de granos gruesos con residuos de esqueletos de pocilopóridos. Los sitios más turbios y con un sustrato compuesto por granos finos limitan el crecimiento del alga, ya que los estolones no pueden sostenerse. Muchos de los sitios donde la cobertura del alga es alta, son aledaños con zonas costeras de construcciones de hoteles, con poblados cercanos, puntos importantes de buceo y estructuras arrecifales complejas. El estolón se alarga rápidamente, con un crecimiento máximo in situ de 31.2 cm/mes y de 1.5 cm/día en condiciones de laboratorio, alargándose en meses donde se da un aumento de nutrimentos por el afloramiento costero y por escorrentía de los suelos en época lluviosa. La adaptatividad morfológica y fisiológica son determinantes en favorecer la distribución de C. sertularioides, donde su plasticidad morfológica en sinergia con su propagación predominantemente clonal y reproducción sexual le da a esta especie una respuesta flexible para adaptarse a diferentes ambientes. Esta especie adapta sus frondas y estolones a diferentes condiciones asociadas a cambios de profundidad y época del año, tales como oleaje, intensidad lumínica, disponibilidad de sustrato y herbivoría. La forma y el tamaño del estolón está determinado en gran parte por el tipo de sustrato y el largo de la fronda depende de la disponibilidad de luz, corrientes y la herbivoría. 1
21 INTRODUCCIÓN Las especies del género Caulerpa (Bryopsidales, Caulerpaceae, Chlorophyta) se caracterizan por poseer un estolón rastrero (caulos = tallo, erpo = rastrero) en forma de tubo del cual salen ramificaciones (frondas) que tienen diversas formas según las diferentes especies (Taylor 1967, Van den Hoek et al. 1998). Los estolones se adhieren por medio de rizoides al sustrato, el cual puede ser arenoso, fangoso o rocoso. Hay talos que pueden llegar a medir hasta 30 cm de alto y cada individuo es sifonal, es decir, consisten de una sola célula grande multinucleada. Esta célula mantiene su forma y consistencia por medio de las trabéculas, constituidas de celulosa de la pared celular (Dawes 1981, Van den Hoek et al. 1998). Todas las especies de este género se desarrollan en ambientes marinos y se encuentran en aguas templadas, aunque están más ampliamente distribuidas en aguas tropicales (Trainor 1978, Van den Hoek et al. 1998). Muchas de las especies del género Caulerpa son arrecifales, y por tanto, están expuestas a un daño considerable por herbivoría. Como mecanismo de defensa contra herbívoros, en el contenido celular se encuentran metabolitos llamados caulerpinas y caulerpicinas, que pueden alcanzar una alta toxicidad. Estos compuestos varían en toxicidad dependiendo de la especie (Doty y Aguilar-Santos 1966, Paul y Fenical 1986). La reproducción de Caulerpa es principalmente asexual, por fragmentación (se forma un talo nuevo cuando se corta una fronda o una sección del talo). El género puede propagarse de forma clonal con gran facilidad (Collado-Vides y Robledo 1999). Según Smith y Walters (1999) en las algas sifonales los fragmentos de hasta 2 mm pueden formar un talo nuevo. De las 84 especies de Caulerpa reportadas por Guiry y Nic Dhonncha (2006), 12 se encuentran a lo largo de la costa Caribe costarricense, en los arrecifes del sur de esta costa (Dawson 1962, Wellington 1973, 1974, Soto 1983, Kemperman y Stegenga 1986, Soto y Ballantine 1986), mientras que 4 especies están reportadas para el Pacífico del país (Fernández y Alvarado en prep): C. racemosa, C. peltata, C. serrulata, C. sertularioides. Esta última fue descrita por Howe (1905) y debe su nombre a su semejanza con un hidrozoario cuyo género es Sertularia. Caulerpa sertularioides es una especie que se caracteriza por sus frondas en forma de pluma, ocasionalmente ramificadas, con pínulas cilíndricas de forma acicular, de hasta 20 cm de altura y 1-2 cm de ancho. Es común observarla formando parches en áreas someras de arena, presente entre los pastos marinos y hasta más de 10 m de profundidad (Schnetter y Bula-Meyer 2
22 1982, Littler y Littler 2000), con una amplia distribución tropical y subtropical en todos los océanos. En el Pacífico Oriental su límite norte se encuentra en el Golfo de California (Dawson 1944) y su límite sur en la Isla Gorgona, Colombia (Schnetter y Bula-Meyer 1982). Se ha reportado en México (Taylor 1945, Scrosati 2001), Nicaragua (Dawson 1962), Costa Rica (Fernández y Cortés 2005), Panamá (Wysor 2004) y Colombia (Schnetter y Bula-Meyer 1982). Para el Pacífico de Costa Rica no había sido reportada en artículos publicados hasta el 2005 (Fernández y Cortés 2005). Sin embargo, hay un espécimen de esta especie colectado en 1933 en el Golfo Dulce, el cual se encuentra en la colección del herbario del Museo Nacional de Costa Rica (CR a). A pesar de su amplia distribución los estudios sobre la ecología de poblaciones de C. sertularioides son muy escasos, en comparación con otras especies del género Caulerpa (Scrosati 2001). Por ejemplo C. taxifolia, una de las especies marinas invasoras más estudiada a nivel mundial. En general las poblaciones de C. sertularioides presentan propagaciones efímeras, como en la Isla Uva, en Panamá, donde esta se expandió por el sustrato marino por un periodo de un año, produciendo un 100% de mortalidad del coral Psammocora stellata por sobrecrecimiento y desplazamiento de otras especies de algas (Glynn y Maté 1997). Investigaciones recientes en Bahía Culebra, Pacífico norte de Costa Rica, han revelado una propagación continua de C. sertularioides en los últimos cinco años, que está afectando los ecosistemas marinos de esta zona (Fernández y Cortés 2005). Los ambientes marinos de esta bahía tienen gran importancia ecológica por su desarrollo arrecifal y económica por la explotación de los recursos pesqueros y turísticos, de los cuales se benefician las comunidades aledañas. Por lo que este trabajo describirá la historia natural de esta especie en la bahía, al caracterizar los patrones de distribución del alga y su cobertura, midiendo la tasa de propagación por mes y describiendo las adaptaciones reproductivas y morfológicas a las diferentes condiciones ambientales que se dan en esta bahía. MATERIALES Y MÉTODOS Área de estudio El presente trabajo se llevó acabo en Bahía Culebra (10º 35 N, 85º 40 O), ubicada dentro del Golfo de Papagayo en el litoral norte del Pacífico costarricense (Fig. 1.1), entre agosto 2003 y marzo Esta bahía se extiende desde las Islas Huevos hasta las Islas Pelonas, frente a Punta 3
23 Cacique que separa Playa Hermosa de Playas del Coco, incluyendo el litoral interno de la bahía hasta el sector de Puerto Culebra y el Estero Iguanita (Jiménez 2001). Es una bahía protegida, de aproximadamente 20 km 2 de extensión y con una profundidad menor o igual a 35 m, donde se puede encontrar una gran variedad de ambientes para el desarrollo de la vida marina (Jiménez 1998, 2001). Toda la región del Golfo de Papagayo está fuertemente influenciada por los vientos alisios del noreste en época seca. Estos vientos desplazan el agua superficial en dirección opuesta a la costa, disminuyendo la profundidad de la termoclina en la zona, produciendo descensos en la temperatura de hasta 10 ºC y un aumento en nutrimentos por el afloramiento de las aguas de profundidad (Brénes et al. 1995, Jiménez y Cortés 2003). Este sitio presenta alta estacionalidad, donde la temperatura promedio del agua en la época de afloramiento es de ºC y en época de no afloramiento de ºC. Por otro lado, la salinidad aumenta en la época seca por la evaporación y disminuye en la época lluviosa por la escorrentía y precipitación (Jiménez 1998). Los ambientes marinos de esta bahía han sido ampliamente estudiados desde 1997 por sus características biológicas y físico-químicas particulares, especialmente el afloramiento costero, la presencia de importantes comunidades coralinas y por el desarrollo de megaproyectos turísticos (Cortés , Jiménez 1997, 1998, 2001, Jiménez y Cortés 2003, Jiménez et al. 2001, Dominici-Arosemena et al. 2005, Fernández y Cortés 2005, May-Collado y Morales-Ramírez 2005, Rodríguez 2005, Sunagawa 2005). Además, la bahía y en general el Golfo de Papagayo, mantienen una importante pesquería de pargos y dorado. Actualmente, el Centro de Investigación en Ciencias del Mar y Limnología de la Universidad de Costa Rica, mantiene un monitoreo constante de las características físicas, químicas y biológicas de los ecosistemas arrecifales de Bahía Culebra, con el fin de detectar y distinguir posibles cambios en el ambiente arrecifal debido al impacto natural y/o humano. Descripción de la distribución de Caulerpa sertularioides Para rescatar datos históricos sobre la permanencia y distribución de esta alga en Bahía Culebra, se realizaron encuestas a los usuarios de los recursos de la bahía (Anexo 1). Todos los entrevistados tenían entre 3 y más de 10 años de bucear en los ambientes marinos, con dos actividades principales: la extracción de recursos (36% de los entrevistados) y el buceo recreativo (64% de los entrevistados). 4
24 Asimismo, se realizaron recorridos en diferentes puntos alrededor de la bahía para ubicar los parches del alga. En cada sitio se tomó la mínima y la máxima profundidad a la que se encontró el alga y se realizó una estimación de la cobertura de C. sertularioides bajo las siguientes categorías: 0= ausente, 1= poca (1% - 30%), 2= común (30% - 60%), 3= mucha (60% -100%). En cada sitio se tomaron tres muestras entre 300 y 500 g del sustrato, para determinar posibles preferencias en el crecimiento del alga ante la composición del sustrato. A cada muestra se le realizó un tamizaje con diferentes tamaños de poro (2 mm, 850 µm, 425 µm, 250 µm, 150 µm, 75 µm) y se pesó la cantidad de sedimento que quedó en cada tamiz, para determinar los porcentajes de los diferentes componentes del sustrato. Para este análisis se agruparon los componentes del sustrato por peso en: fino (150 µm, 75 µm, <75µm), medio (850 µm, 425 µm, 250 µm) y grueso (>2mm). Tasa de propagación La tasa de propagación se determinó por medio del largo del estolón por mes. Para esto se midió el largo del estolón in situ en tres sitios de la bahía a aproximadamente 4 m de profundidad (Islas Huevos, Playa Blanca y Playa La Penca) y en tres épocas del año (diciembre 2003, marzo 2004, setiembre 2004). En cada sitio se removieron todos los talos de C. sertularioides de 5 cuadrículas permanentes de 50 cm 2, marcadas con varillas, las cuales se ubicaron en medio de un parche del alga. Un mes después se midieron todos los estolones que crecieron dentro de la cuadrícula, con un vernier (+ 0.05). Se calcularon promedios y desviaciones estándar por mes y se realizó un análisis de varianza (ANDEVA) para determinar diferencias entre meses, al cual se le realizó una prueba a posteriori de Tuckey. Los datos del largo del estolón fueron transformados con log 10 (x+1) para que estos se ajustaran a la distribución normal. Además, se realizaron experimentos sobre la elongación del estolón de C. sertularioides bajo condiciones controladas de laboratorio. Se llevaron talos al Laboratorio de Algas del Centro de Investigación en Ciencias del Mar y Limnología (CIMAR), de la Universidad de Costa Rica. Estos se sometieron a una temperatura aproximada de 27 ºC (temperatura promedio de la bahía) con una salinidad de 32 y un ciclo de doce horas luz y doce horas oscuridad (correspondiente con las condiciones físicas típicas de la bahía). 5
25 Fig Localización del área de estudio y de los sitios con presencia o ausencia de parches de C. sertularioides a lo largo de Bahía Culebra, Golfo de Papagayo, Pacífico norte de Costa Rica. Los puntos negros indican presencia del alga y las x indican ausencia de esta. 6
26 Adaptaciones a las condiciones ambientales A lo largo del periodo de muestreo en cada sitio se realizaron observaciones generales del estado de las algas, tales como: estolones aislados, presencia de frondas nuevas o viejas, estado reproductivo y presencia epífilos en las frondas. Finalmente, se midieron 2 caracteres morfológicos de C. sertularioides: largo de la fronda y diámetro de estolón. Estos caracteres se escogieron según trabajos de Meinesz et al. (1995) y Dumay et al. (2002). El fin de estas mediciones fue determinar si existe alguna variabilidad en los talos por profundidad y entre épocas: seca (marzo 2004) y lluviosa (octubre 2004). Se tomaron muestras de talos del alga a tres profundidades en tres sitios diferentes: 2 m (Playa La Penca, Islas Huevos y Punta Flor), 5 m (Playa La Penca, Punta Cacique y Playa Blanca) y 10 m (Playa La Penca, Islas Huevos e Islas Pelonas). La escogencia de los sitios por profundidad, dependió de la disponibilidad de parches del alga. De cada muestra se escogieron al azar 50 frondas y 50 estolones, los cuales fueron fotografiados posteriormente en el laboratorio, con una cámara digital Nikon Coolpix Por último, se procedió a medir la longitud de las frondas y el diámetro del estolón (Fig. 1.2) por medio del software UTHSCSA Image Tool versión 3.0. Para el análisis de datos se calcularon promedios y desviaciones estándar para los dos caracteres y se aplicaron análisis de varianza (ANDEVA) para determinar diferencias entre la longitud de la fronda y el diámetro del estolón por profundidad y entre meses, y se realizaron pruebas a posteriori de Tuckey. Los datos de longitud de la fronda fueron transformados usando log 10 (x+1) y los datos del diámetro del estolón por profundidad no se transformaron ya que se ajustaron a la distribución normal. Todos los análisis estadísticos se realizaron utilizando los softwares Systat 8.0. y JMP IN Fig Medidas morfológicas del talo de C. sertularioides (modificado de Chaverri 1996) 7
27 RESULTADOS Descripción de la distribución de Caulerpa sertularioides La mayoría de los encuestados concuerda en que el alga siempre ha estado en la bahía desde hace muchos años, sin embargo, el crecimiento acelerado se empezó a ver entre los años La mayoría concuerda en que los primeros sitios donde se empezó a ver este crecimiento acelerado fueron: Ocotal, en la zona rocosa de Playa del Coco, Bajo Mero, Mata Palo, Punta Gorda y Tortuga (Fig. 1.1), la mayoría de estos sitios tienen alta visitación turística y en el caso de Ocotal, es donde constantemente se anclan una gran cantidad de botes. Caulerpa sertularioides, crece desde la línea intermareal, en pozas donde en marea baja llega el rocío de las olas, hasta profundidades de 17 m. Se observa en extensiones continuas que han colonizado gran cantidad de sustratos incluyendo rocas, arena, corales vivos y muertos. En algunas zonas entre 3 y 6 m de profundidad alcanza la mayor cobertura en el sustrato y puede llegar casi al 100%, con densidades de hasta 108 frondas por cada 10 cm 2, después de los 12 a 17 m la densidad y cobertura consiste de estolones aislados y poco densos en frondas. El alga ha colonizado una gran cantidad de sitios a lo largo de la bahía (Fig. 1.1). Sitios como Ocotal, Playa La Penca y Playa Blanca presentan parches muy densos y extensos, que cubren aproximadamente entre 2-4 ha por sitio. En Islas Huevos, Islas Pelonas y Punta Flor los parches llegan a alcanzar grandes extensiones pero suelen ser temporales. Cabe resaltar que dentro de los sitios donde no se encuentra presente el alga o la cobertura es baja, el sustrato es muy fino y con poco o ningún sustrato grueso. Tal es el caso de Bahía Manzanillo 1, Bahía Iguanita, Islas Huevos 1, Playa del Coco y Bahía Virador. Asimismo, los sitios con mayor cobertura y densidad de frondas se dan en Playa La Penca, Ocotal, Playa Blanca, Islas Pelonas y Punta Cacique, adonde el sustrato está compuesto por granos gruesos, principalmente fragmentos de pocilopóridos (Figs. 1.1, 1.3). 8
28 Fig Porcentaje del tamaño de grano y estimación de la cobertura de C. sertularioides, por sitio en Bahía Culebra, Golfo de Papagayo. 0=ausente, 1= poca, 2= común, 3= mucha. Tasa de propagación Esta alga se propaga principalmente por reproducción asexual por cortes de frondas y estolones que constantemente se observaron flotando en las aguas de la bahía. La propagación es muy acelerada ya que el estolón se alarga rápidamente, con un crecimiento promedio del estolón, medido in situ, de 11.7 ± 6.2 cm/mes, un crecimiento mínimo de 1.4 cm/mes (diciembre 2004) y un crecimiento máximo de 31.2 cm/mes (setiembre 2004). Se encontraron diferencias significativas en el crecimiento del estolón entre los tres meses muestreados (F 2,144 =5.797 p<0.004). Estas diferencias, según el análisis a posteriori de Tuckey, se dan principalmente entre marzo 2004 y setiembre 2004 (Fig. 1.4), con un mayor crecimiento en setiembre. En cuanto a los datos de laboratorio se encontró que el promedio de crecimiento del estolón es de cm/día alcanzando un máximo crecimiento de 1.5 cm/día. 9
29 Fig Promedio del crecimiento y desviación estándar del estolón de C. sertularioides a lo largo de un mes, en tres épocas del año (diciembre 2003, marzo 2004 y setiembre 2004) en Bahía Culebra, Golfo de Papagayo. Adaptaciones a condiciones ambientales Se observaron meses donde los estolones se encontraban aislados y baja densidad de frondas que coincidieron con los meses de la época lluviosa (Cuadro 1.1). A la vez a lo largo del periodo de estudio se observaron dos epífilos muy comunes creciendo sobre las frondas de C. sertularioides: un alga roja del género Polysiphonia y un briozoario filamentoso, cuya presencia coincide con la disponibilidad de frondas nuevas (Cuadro 1.1). 10
30 Cuadro 1.1. Observaciones realizadas sobre el estado de los talos de C. sertularioides y presencia de epífilos, en Bahía Culebra, Golfo de Papagayo, entre agosto del 2003 y marzo del El sombreado indica presencia. ago-03 sep-03 oct-03 nov-03 dic-03 ene-04 feb-04 mar-04 abr-04 may-04 jun-04 jul-04 ago-04 sep-04 oct-04 nov-04 dic-04 ene-05 feb-05 mar-05 Presencia de Briozoario Presencia de Epífilos Rojos Frondas Nuevas Estolones Aislados Reproducción sexual Se logró observar una liberación in situ de gametos. Esto ocurrió el 3 de enero 2005 a las 7:40 a.m., en Punta Flor, donde varios parches se encontraron liberando sincronizadamente sus gametos por las papilas (Fig. 1.5 A), formando una nube densa verde sobre los parches del alga. Al finalizar el evento las frondas y estolones quedaron blancos (Fig. 1.5 B). De esta manera, se reconocieron varios eventos de liberación de gametos, por medio de la coloración blancuzca de las frondas. Esta coloración se notó en meses donde se dan cambios bruscos en temperatura (febrero 2004 y enero 2005) o alta intensidad de lluvias (setiembre 2003 y octubre 2004) (Cuadro 1.1). A. B. 1mm 5mm Fig Frondas después de libración de gametos. A. Detalle de las papilas por donde se expulsan los gametos, B. Detalle de la punta de la fronda después de la liberación de los gametos. 11
31 Al analizar las medidas morfológicas se obtuvo un grosor máximo en el estolón de 0.34 cm (marzo 2004, 2 m profundidad), el mínimo fue de 0.04 cm (marzo 2004, 2 m profundidad); una longitud máxima de las frondas de 15.9 cm (octubre 2004, 2 m profundidad) y una longitud mínima de 0.79 cm (marzo 2004, 5 m profundidad). Sin embargo, los diámetros promedios mayores son a 5 y 10 m y la mayor longitud de las frondas promedio se da a 10 m (Cuadro 1.2). Cuadro.1.2. Variación de dos medidas morfológicas de Caulerpa sertularioides en marzo 2004 y octubre 2005, en Bahía Culebra, Golfo de Papagayo. Marzo 04 Octubre 04 Diámetro del estolón (cm) Alto de la Fronda (cm) Profundidad 2 m 5 m 10 m 2 m 5 m 10 m Promedio Desv. Est Máximo Mínimo Promedio Desv. Est Máximo Mínimo Con respecto al diámetro del estolón, tanto en marzo como en octubre, el mayor grosor se dio a 5 m de profundidad y se encontraron diferencias significativas, por profundidad y por mes (F 5,1050 = 9.5, p<0.000), según el análisis a posteriori, dándose esas diferencias principalmente entre 2 y 5 m y siendo más grueso el estolón en marzo (Fig. 1.6). En cuanto a las frondas también, se encontraron diferencias significativas en la longitud de la fronda por profundidad y entre meses (F 5,982 = 116.8, p<0.000), según el análisis a posteriori de Tuckey dándose estas diferencias entre todas las profundidades y aumentando el largo de la fronda conforme aumenta la profundidad. Se encontró que la mayor longitud de las frondas se da en octubre (Fig. 1.7.). 12
32 Fig Promedio y desviación estándar del diámetro del estolón de Caulerpa sertularioides a tres profundidades, en dos meses muestreados (marzo 2004 octubre 2004) en Bahía Culebra, Golfo de Papagayo. Fig Promedio y desviación estándar de la longitud de la fronda de Caulerpa sertularioides a tres profundidades, en los meses muestreados (marzo 2004 octubre 2004) en Bahía Culebra, Golfo de Papagayo. 13
33 DISCUSIÓN Descripción de la distribución de Caulerpa sertularioides En Bahía Culebra, C. sertularioides es un alga nativa de la zona que siempre se mantuvo en bajas densidades. Recientemente ha desarrollado un acelerado crecimiento, colonizando una gran variedad de sustratos y llegando hasta la máxima profundidad reportada para la especie (17 m). En otros sitios del Pacífico Oriental Tropical, C. sertularioides se desarrolla principalmente en diferentes sustratos incluyendo rocas, arena, corales vivos y muertos (Schnetter y Bula-Meyer 1982, Glynn y Maté 1997, Wysor 2004). En el Pacífico de Panamá, Wysor (2004), la reporta desde pozas intermareales hasta 16 m. Para Colombia, Schnetter y Bula-Meyer (1982), informan la presencia de C. sertularioides desde la línea de bajamar hasta 1 m de profundidad. En el Caribe y en el Océano Pacífico Central, se ha encontrado hasta 10 m en zonas de arrecife (Littler y Littler 2000, 2003). En comparación con otras especies del género, C. sertularioides, no ha logrado colonizar grandes profundidades. Como por ejemplo, C. taxifolia, un alga bien establecida en el Mediterráneo, se desarrolla conspicuamente en profundidades entre los 0 y 30 m, alcanzando máximas coberturas y densidades entre 5 y 15 m. No obstante se le ha encontrado hasta los 100 m de profundidad en aguas claras, cubriendo gorgonias (Belsher y Meinesz 1995). C. racemosa en ese mismo lugar se distribuye de 0 a 40 m de profundidad (Piazzi et al. 2001) y C. prolifera a 58 m (Belsher y Meinesz 1995). Según los datos obtenidos en este estudio, C. sertularioides muestra patrones de distribución dependiendo del tipo de sustrato. Los sitios con mayor cobertura y densidad de frondas se dan donde el sustrato está compuesto por granos gruesos, principalmente fragmentos de pocilopóridos, como en Playa La Penca, Ocotal y Playa Blanca. La mayoría de los arrecifes de estos sitios se desarrollan sobre una estructura basal muerta de Pocillopora spp. (Glynn et al. 1983, Jiménez 1998), cuyos trozos de corales muertos favorecen la adhesión de los estolones de C. sertularioides, ya que proveen de superficies y agujeros por donde el alga sujeta los estolones (Dumay et al. 2002). Por otro lado, los sitios más turbios y con un sustrato compuesto por granos finos limita el crecimiento del alga (Fig. 1.3), ya que los estolones no logran sostenerse. Esto ocurre en el litoral interno de la bahía, desde Punta Mala hasta el Puerto de Culebra, donde no se encuentra presente 14
34 el alga (Fig. 1.1). Estos sitios presentan varios arrecifes coralinos muertos, sobre los cuales actualmente ocurre un limitado crecimiento de corales y algunas secciones yacen bajo una cubierta de fango proveniente de un pequeño estuario (Jiménez 1998). Asimismo, muchos de los sitios donde la cobertura del alga es alta, son aledaños con zonas costeras de construcciones de hoteles, con poblados cercanos, puntos importantes de buceo y estructuras arrecifales complejas (Jiménez 1998), como por ejemplo: Playa Blanca, Bajo Mero, Playa La Penca- Punta Cacique, Islas Pelonas y Ocotal (donde anclan gran cantidad de botes). En Playa Blanca, donde actualmente hay una gran cobertura del alga, se da la mayor cantidad de especies de corales siendo uno de los arrecifes de mayor extensión. Playa La Penca presenta uno de los sitios con mayor grosor arrecifal y Punta Cacique presenta la mayor cobertura de coral vivo de la bahía (Jiménez 2001), la flora y fauna béntica de estos sitios se encuentran amenazados por la propagación del alga ya que la permanencia de esta, es constante durante todo el año (Fernández y Cortés 2005). Los sitios donde las coberturas del alga son medias y los parches tienden a ser temporales, en su mayoría son arrecifes muertos de Pocillopora spp., se encuentran muy cerca de la costa y a poca profundidad, como sucede entre Punta Flor y Puerto Culebra y Playa Panamá (Fig. 1.1, Jiménez 1998). En el litoral de la bahía entre Puerto Culebra y Playa Panamá, el único arrecife vivo está en Punta Arenilla, al norte de Playa Panamá. Por sus condiciones granulométricas y poca turbidez del agua (Fig. 1.3) este es un sitio donde potencialmente se podría dar el crecimiento del alga; sin embargo, aún no se han observado talos de ésta (Fig. 1.1). Esta sección de la costa es una antigua plataforma coralina de Pocillopora spp. de poca extensión, donde actualmente ocurre un crecimiento arrecifal moderado dominado por P. elegans (Jiménez 1998), por lo tanto este sitio debe ser monitoreado para prevenir futuros asentamientos de fragmentos del alga. Tasa de propagación La capacidad fisiológica de C. sertularioides de resistir alta radiación solar sin desecarse, hace que los talos puedan permanecer flotando varios días hasta llegar a un sitio donde puedan adherirse y colonizar un sustrato (Benzie et al. 2000). Una vez asentados los talos, se pueden propagar fácilmente, ya que Caulerpa es un género con crecimiento rápido y eficiente (Collado- Vides y Robledo 1999). Según Smith y Walters (1999) en las algas sifonales (como Caulerpa), 15
35 los fragmentos de hasta 2 mm pueden recrecer y formar un talo nuevo. Este crecimiento clonal es la forma más efectiva en los ambientes acuáticos y muchas plantas y algas se fragmentan fácilmente y sus partes pueden convertirse en un clon independiente. Estos fragmentos se multiplican y se dispersan con facilidad por corrientes (Begon et al. 1996). Una vez que ha colonizado un sustrato nuevo esta alga expande su estolón, variando con las condiciones ambientales de cada mes. En promedio esta especie crece más en meses donde se da un aumento de nutrimentos por el afloramiento costero (diciembre) y por escorrentía de los suelos en época lluviosa (setiembre). En comparación con otras especies del género, que no presentan características de propagación, C. sertularioides en la bahía muestra mayor alargamiento del estolón (1.1 cm/día). Williams et al. (1985) reporta medidas del estolón de C. mexicana de 1.0 cm/día, de C. cupressoides de 0.8 cm/día y de C. prolifera de 0.4 cm/día. Si bien, los estolones de C. sertularioides cubren rápidamente varios m 2 del fondo marino de Bahía Culebra, las tasas de crecimiento no llegan a ser tan altas como otras especies del género que son altamente invasivas. Por ejemplo, para C. taxifolia, una de las especies del género mayormente conocida por su propagación agresiva, se han reportado crecimientos del estolón de hasta 8 cm diarios y para C. racemosa, en el Mediterráneo, un crecimiento del estolón de aproximadamente 2 cm/día (Dalton 2000). Asimismo, al comparar el máximo crecimiento del estolón en condiciones de laboratorio de C. sertularioides en este estudio (1.5 cm/día), se observa que se tiene un crecimiento muy similar con otros experimentos realizados. En un estudio realizado por Mishra y Kefford (1969) en condiciones de laboratorio a 26ºC, el alga crece a una tasa de 1.5 cm/día. Adaptaciones a las condiciones ambientales En todos los sitios donde se da crecimiento del alga verde, se observó que los talos tienen reproducción sexual. Esto se logró detectar por observación indirecta de talos con la coloración transparente, que se da en todas las especies de Caulerpa. Este es un género holocárpico, es decir, que todo el contenido vegetativo se divide en células reproductivas, por lo que después de que se liberan los gametos lo único que queda son la paredes celulares vacías (Van den Hoek et al. 1998) y de ahí esta coloración traslúcida de los talos. 16
36 La reproducción sexual se da por medio de anisogametos biflagelados que son liberados a la columna de agua, por medio de papilas que salen del estolón y de las frondas (Dawes 1981, Bold y Wynne 1985, Van den Hoek et al. 1998). Según Clifton (1997) y Clifton y Clifton (1999) este género tiene sincronía para liberar sus gametos y la fecundación se da en el agua, el zigoto se desarrolla en una estructura esférica que contiene un núcleo primario y finalmente se asienta en un sustrato. Sin embargo, aún no son muy conocidos los mecanismos de comunicación entre las algas por medio de los cuales todos los talos liberan sus gametos al mismo tiempo. La ventaja que le da la reproducción sexual a estas algas es la variabilidad genética, potenciando la adaptación de estas especies oportunistas (Allendorf y Lundquist 2003) a cambios en los factores físicos, químicos y ambientales de Bahía Culebra. El impacto de esto se ha observado en la rápida colonización y amplia distribución del alga en los ambientes arrecifales, mostrando adaptaciones morfológicas y fisiológicas. Caulerpa sertularioides presenta plasticidad fenotípica. Esto se ha demostrado en muchas especies del género Caulerpa y por esto posee una alta diversidad de especies distribuidas ampliamente por todo el mundo (Gacia et al. 1996, Smith y Walters 1999, Sernerpont et al. 2003). La plasticidad fenotípica es la habilidad de un genotipo de expresarse en diferentes formas en diferentes ambientes y esta se expresa como una variación discreta de tipos alternativos en diferentes ambientes (Begon et al. 1996) y representa una importante estrategia adaptativa en algunas algas tropicales (Lewis y Norris 1987). La adaptatividad morfológica y fisiológica son determinantes en favorecer la distribución de C. sertularioides (Collado-Vides y Robledo 1999), donde su plasticidad morfológica en sinergia con su propagación predominantemente clonal y reproducción sexual le da a esta especie una respuesta flexible para adaptarse a diferentes ambientes (Sernerpont et al. 2003). Fisiológicamente tiene capacidad de resistir la desecación en las pozas intermareales, manteniendo su contenido acuoso en estos sitios, donde la radiación solar es mayor y la permanencia del agua varía con el ciclo de mareas. Esto mismo se ha observado en otras algas del género como C. taxifolia en el Mediterráneo (Benzie et al. 2000). Se observó que la variación morfológica de C. sertularioides en sus frondas y estolones dependen de la profundidad y de la estación del año, esto mismo se ha observado en otros estudios con otras especies del género (Meinesz et al. 1995). Esta población expresa su rango de variación morfológica largando o acortando las frondas y engrosando o adelgazando el estolón. Esta especie tiene la capacidad de distribuirse en varios ambientes, al adaptar sus frondas y 17
37 estolones a diferentes condiciones asociadas a cambios de profundidad, tales como oleaje, intensidad lumínica, disponibilidad de sustrato y la herbivoría. La forma y el tamaño del estolón esta determinado en gran parte por el tipo de sustrato. Este estudio demostró que cuando C. sertularioides crece sobre rocas a poca profundidad (máxima irradiación solar) el estolón es grueso para sostenerse de la rocas. Una vez que las algas alcanzan mayores profundidades y el sustrato es más fino los estolones son más delgados y ramificados para sostenerse de los gránulos del sustrato y obtener más fácilmente los nutrimentos (Debelius & Baensch, 1997). En cuanto a las frondas se obtuvo que, a poca profundidad, donde hay alta disponibilidad de luz, las frondas tienden a ser cortas e incluso pueden estar ausentes. En estos sitios, la corriente es más fuerte, por lo que las frondas podrían romperse con facilidad. Collado-Vides y Robledo (1999) encontraron que en especies, como C. cupressoides, el tamaño de la fronda disminuye entre más movimiento del agua exista y que disminución en el tamaño de la fronda le brinda mayor capacidad hidrodinámica al talo. Estas zonas son arrecifes rocosos donde hay un aumento de herbivoría sobre las algas (Day 1983) y es muy común observar peces del género Stegastes spp., los cuales son animales muy territoriales que podan las algas de su territorio constantemente (Allen y Robertson 1998). El largo de las frondas aumenta conforme aumenta la profundidad donde la disponibilidad de luz disminuye y la corriente es menor. En conclusión, C. sertularioides es una especie nativa de Bahía Culebra, que muestra adaptaciones a varios ambientes. Se presencia se asocia con la cercanía de comunidades costeras y hoteles y está limitada por el grueso y composición del sustrato. Asimismo presenta altas tasas de crecimiento y propagación clonal, lo que hace más rápida su propagación por toda la bahía. Las adaptaciones morfológicas y fisiológicas se favorecen por la variabilidad genética que se da con la presencia de la reproducción sexual. 18
38 CAPÍTULO 2. Factores ambientales involucrados en la propagación del alga Caulerpa sertularioides (Chlorophyta), en una zona de afloramiento costero, Bahía Culebra, Golfo de Papagayo, Costa Rica RESUMEN Muestreos recientes en una zona de afloramiento costero han revelado la propagación de C. sertularioides en los últimos cinco años, con sus consecuentes variaciones en el ecosistema arrecifal. Se describen las características ambientales que imperan en Bahía Culebra, para determinar los principales factores que influyen la dinámica de la bahía y que están favoreciendo la propagación de esta alga. Se cuantificó la fluctuación estacional in situ del área de parches, la densidad de frondas y de la cobertura de C. sertularioides a lo largo de un año y en laboratorio bajo 3 tratamientos de temperatura y 2 de nutrimentos en condiciones controladas. Con los datos ambientales analizados se observa que la bahía muestra una estacionalidad marcada. La temperatura y la salinidad son variables con alta estacionalidad y la primera presenta variaciones de hasta 7ºC. Bahía Culebra es una zona de bajo impacto por las tasas de sedimentación y los sedimentos en suspensión y estos últimos muestran fluctuaciones muy similares a la precipitación por entradas de agua por escorrentía. De acuerdo con los promedios de clorofila a y nutrimentos como fosfato y nitrato, la bahía tiende a ser un sitio eutrófico temporalmente lo que favorece el crecimiento de las algas. En la época seca estos factores aumentan debido al afloramiento de aguas de profundidad ricas en nutrimentos y entre agosto y octubre, aumentan por la escorrentía de nutrimentos por el lavado de la tierra por las lluvias. El fosfato, el nitrato, los sedimentos en suspensión, tasa de sedimentación y la temperatura son los componentes que explicaron la variación en las aguas de Bahía Culebra, pero únicamente la temperatura mostró diferencias significativas entre las épocas seca y lluviosa. El área de los parches, la densidad de frondas y el porcentaje de cobertura de C. sertularioides, tendieron a aumentar en la época seca por afloramiento de nutrimentos y aguas frías (70.7% de cobertura y 50.0 frondas/10cm 2, en promedio). Lo contrario sucede en la época lluviosa donde los parches tienden a disminuir su área, en estos meses la concentración de nutrimentos tiende a caer por debajo del promedio de la bahía (por debajo del 40% y la densidad de frondas por debajo de 20 frondas/10 cm 2 ); los límites son muy difusos e incluso pueden desaparecer. En junio y julio los parches se ven disminuidos en casi su totalidad dejando talos aislados. Se observó un aumento en el área de los parches entre 19
39 agosto y octubre (46.3% de cobertura y 29.5 frondas/10 cm 2 ), que coinciden con picos de precipitación y de los nutrimentos. Esto está relacionado con aportes de materia orgánica por las aguas que entran a la bahía por escorrentía, entre otros. Sin embargo, este pico de crecimiento es menor al de la época de afloramiento. La abundancia, la cobertura y la densidad se explican por el favorecimiento de nutrimentos producto del afloramiento costero y lavado de los suelos y por las temperaturas frías del afloramiento. Este estudio demuestra que si bien los nutrimentos juegan un papel importante en el crecimiento de C. sertularioides, también la disminución de la temperatura es un factor que en sinergia contribuye a la propagación de C. sertularioides y en consecuencia el equilibrio del ecosistema arrecifal de Bahía Culebra. INTRODUCCIÓN Existen varios géneros de macroalgas que en determinadas condiciones pueden propagarse agresivamente e invadir desde varios metros cuadrados a hectáreas del fondo marino, como: Undaria pinnatifida y Sargassum muticum (Phaeophyta) (Piazzi et al. 2001), Grateloupia doryphora (Rhodophyta) (Marston y Villalard-Bohnsack 2002), Enteromorpha sp., Ulva sp. y Codium fragile (Chlorophyta) (Garbary y Jess 2000) y en especial las especies del género Caulerpa que pueden ser oportunistas con gran capacidad para propagarse (Meinesz et al. 1993, Collado-Vides y Robledo 1999, Smith y Walters 1999, Ceccherelli et al. 2000). El género Caulerpa se caracteriza por una gran variación morfológica y por esto posee una alta diversidad de especies distribuidas por todo el mundo (Gacia et al. 1996, Smith y Walters 1999, Sernerpont et al. 2003). La propagación predominantemente clonal y su plasticidad fenotípica le da a las especies de Caulerpa, una respuesta flexible para adaptarse a diferentes ambientes (Sernerpont et al. 2003). Este género ha sido ampliamente estudiado desde muchos puntos de vista, pero principalmente por los impactos económicos como consecuencia de la capacidad de propagación invasora que presentan varias de sus especies (Knowlton 2000). Según Withgott (2002), se cree que varias de las especies de Caulerpa tienen la capacidad de propagarse e invadir varias hectáreas, si las condiciones ambientales se los permiten. Caulerpa taxifolia es una de las especies invasoras más estudiadas del ambiente marino (Meinesz y Hesse 1991, Meinesz et al. 1993, Smith y Walters 1999, Fama et al a, b). Es nativa de los mares tropicales, pero en los acuarios de Alemania se le observó creciendo rápidamente en aguas frías, adaptándose a tolerar aguas de baja temperatura, con un crecimiento 20
40 de hasta 8 cm diarios (Dalton 2000). Esta especie ha reemplazado las especies de algas y de pastos marinos, alcanzando a cubrir más de 20 mil hectáreas del suelo costero marino de California y de seis naciones del Mediterráneo (Jousson et al. 2000, Withgott 2002). Su rápida propagación se le atribuye a su fácil adaptación morfológica y fisiológica; principalmente por el trasporte de fragmentos que por corrientes se distribuyen, logran asentarse y forman un talo nuevo (Belsher y Meinesz 1995). La expansión de esta especie ha causado cambios en la biodiversidad, así como efectos negativos en el turismo y en las pesquerías locales (Meusnier et al. 2001, Wiedenmann et al. 2001). Otra especie que tiene la característica de propagarse fácilmente es C. racemosa. Esta fue introducida al Mediterráneo desde el Mar Rojo (Ceccherelli et al. 2000) y posee características similares e impactos biológicos como C. taxifolia (Piazzi et al. 2001). En Panamá las cepas de C. sertularioides y C. racemosa aparecieron cubriendo el fondo marino en alfombras densas, entre julio 1988 y octubre 1989, en la Isla Uva, Golfo de Chiriquí. Según observaciones el resultado produjo un 100% de mortalidad del coral Psammocora stellata por sobrecrecimiento y desplazamiento de otras especies de algas (Glynn y Maté 1997). Asimismo, Scrosati (2001) estudió una población de C. sertularioides, en Baja California, México, durante un periodo de dos años, donde los parches se forman en ciertas épocas del año y desaparecen totalmente en otras, en este caso la temperatura del agua parece ser un factor que juega un papel importante en la abundancia de esta alga. Las causas de la expansión de las especies del género Caulerpa, se asocian a cambios en las condiciones del agua que favorecen a estas especies oportunistas, tales como cambios en la temperatura o aumento en las concentraciones de nutrimentos (Bell 1992, Lapointe 1997, Raven y Geider 1988). Esto se ve favorecido por las características intrínsecas del género Caulerpa, como son: la poca herbivoría por poseer toxinas, la fácil adaptación morfológica y fisiológica a diferentes condiciones ambientales y la reproducción asexual por fragmentación. Muestreos recientes en Bahía Culebra, Pacífico norte de Costa Rica, han revelado una propagación de C. sertularioides en los últimos cinco años. Es común observarla formando parches en sustrato arenoso, rocoso y coralino muerto; desde la zona intermareal hasta 17 m de profundidad (Obs. pers). Esta alga verde ha remplazando la flora algal, está sobrecreciendo colonias de coral y produciendo cambios en la diversidad y abundancia de organismos (Fernández y Cortés 2005). En otros sitios del Pacífico Oriental, como Panamá (Glynn y Maté 1997) y México (Scrosati 2001), se han encontrado propagaciones efímeras de esta especie, sin 21
41 embargo en Bahía Culebra la población se ha mantenido permanente durante los últimos cinco años. Hasta el momento no se sabe qué factores están favoreciendo la propagación en la bahía y cómo influyen en la población del alga. El objetivo de este capítulo es describir las características ambientales que imperaron en Bahía Culebra entre marzo 2004 y marzo 2005, para determinar los principales factores que influyen en la dinámica de la bahía y que están favoreciendo la propagación de esta alga. Aunado a esto, se describe la fluctuación en el área, cobertura y densidad de las frondas de los parches del alga. Asimismo, se analizó por primera vez la variación temporal de la concentración de los nutrimentos (PO -3 -, 4, NO 2 NO - 3, NH + 4 y SIO 4 ) entre 1999 y 2005, con el fin de determinar cambios determinantes en las concentraciones que hayan favorecido el desarrollo de C. sertularioides. MATERIALES Y MÉTODOS Área de estudio El presente trabajo se llevó acabo en Bahía Culebra (10º 35 N, 85º 40 O), ubicada dentro del Golfo de Papagayo en el litoral norte del Pacífico costarricense, desde agosto 2003 hasta marzo 2005 (Fig. 2.1). Esta bahía se extiende desde las Islas Huevos hasta las Islas Pelonas, incluyendo el litoral interno de la bahía hasta el sector de Puerto Culebra y el Estero Iguanita (Jiménez 2001). La región del Golfo de Papagayo está fuertemente influenciada por los vientos alisios del noreste, que se dan en la época seca. Estos vientos desplazan el agua superficial en dirección opuesta a la costa, disminuyendo la profundidad de la termoclina en la zona y produciendo descensos en la temperatura de hasta 10ºC por el afloramiento de las aguas de profundidad. Factores ambientales Para el análisis de los factores ambientales se recolectaron muestras mensuales en 5 sitios de la bahía: 1- Islas Huevos, 2- Playa Blanca, 3- Punta Flor, 4- La Penca-Cacique e 5- Islas Pelonas (Fig. 2.1). En cada sitio se midieron los siguientes factores físico-químicos del agua: salinidad ( ), clorofila a (µg/l), temperatura (ºC), sedimentos en suspensión (mg/l) y tasa de 22
42 sedimentación (mg/cm 2 /día). También se analizaron muestras de nutrimentos de la bahía desde 1999 hasta Estas muestras fueron colectadas en 5 puntos (A-E) de la bahía (Fig A-E), a una profundidad aproximada de 15 m, y se determinó la concentración (µm) de los siguientes nutrimentos: fosfato (PO -3 4 ), nitrito (NO - 2 ), nitrato (NO - 3 ), amonio (NH + 4 ) y silicato (SiO 4 ). Tambien se obtuvieron datos ambientales de precipitación (mm), brillo solar (horas de sol por día) y velocidad del viento (km/h), del Instituto Meteorológico Nacional de Costa Rica, de la estación del Aeropuerto Internacional Daniel Oduber Quirós (10º 35 N, 85º 32 O, 80 m de elevación), ubicada en las cercanías de Bahía Culebra. Para medir la salinidad se tomaron muestras de agua en el campo cada mes, las cuales fueron analizadas con un refractómetro manual (ATAGO, modelo S/Mill-E). Los sedimentos en suspensión se colectaron en la superficie, por medio de una botella de 3.8 l, los cuales fueron colectados a través de filtros de fibra de vidrio marca Whatman GF/C previamente pesados. Una vez separada la muestra, los filtros prepesados se colocaron en un horno a 60ºC por aproximadamente 24 h y luego fueron pesados en una balanza analítica, con una precisión de Con el fin de determinar fluctuaciones de nutrimentos se determinó la concentración de clorofila a. Para esto, se recolectaron muestras de agua de la superficie por medio de botellas oscuras de 1 l. Seguidamente, se filtraron utilizando filtros de fibra de vidrio marca Whatman GF/C. Para el análisis de concentración de clorofila a, se siguió la metodología de Lorenzen y Jeffrey (1978), se utilizó un espectrofotómetro Shimadudzu UV- 160 A y se calculó la concentración de clorofila a por medio de la siguiente fórmula: Clorofila a (µg/l) = 12 ml acetona x [11.64(A 663 -A 650 ) 2.16(A 645 A 750 ) (A 630 -A 750 )] Volumen de la muestra (ml) A= Absorbancia La temperatura se midió por medio de sensores (Stow Away XTI), ubicados bajo el agua, de forma continua cada 30 min, lo que permitió determinar fluctuaciones en la temperatura durante todo el periodo de muestreo. La tasa de sedimentación se cuantificó por medio de tres trampas de sedimento en cada sitio de muestreo. Las trampas constaron de tubos de PVC (21 cm de alto y 8 cm de diámetro), que se colocaron en estacas de hierro a 50 cm del sustrato y distanciadas unas de otras 23
43 aproximadamente 2 m. Las trampas se retiraron cada mes, cerrándose con tapas bajo el agua, y se reemplazaron con otras nuevas. Una vez en el laboratorio se decantó el agua y se trasladó el sedimento atrapado a cajas de petri previamente pesadas. Luego las cajas de petri con sedimento fueron secadas en un horno a 70 ºC hasta peso constante y finalmente se calculó la razón de sedimento en mg/cm 2 /día (Cintrón et al. 1994, Rogers et al. 2001). Para determinar la concentración de los nutrimentos, se colectaron muestras de agua a aproximadamente 15 m de profundidad en botellas oscuras, en 5 estaciones de la bahía (Fig. 2.1, A-E). Los nutrimentos fueron medidos por análisis químico siguiendo los procedimientos de Strickland y Parsons (1972) y el protocolo del laboratorio de química del Centro de Investigación en Ciencias del Mar y Limnología (CIMAR). Para determinar la concentración de nutrimentos (fosfatos, nitratos, nitritos, silicatos y amonio) se utilizó un espectrofotómetro Shimadudzu UV- 160 A. En varios meses la concentración de amonio, se mantuvo por debajo de los niveles de detección, por lo que en muchos casos no se graficó y no se utilizó en análisis posteriores. Análisis de datos Para determinar los factores más importantes que afectan los ambientes marinos de Bahía Culebra, se realizó un Análisis de Componentes Principales (ACP) basado en una matriz de correlación de acuerdo a Clarke y Warwick (1994) utilizando los promedios mensuales de cada parámetro ambiental desde marzo 2004 hasta marzo Se utilizaron los factores más importantes identificados por el ACP, para determinar diferencias entre las épocas del año (seca y lluviosa). Se realizó un análisis de varianza (ANDEVA) para los factores que se normalizaron y un análisis no paramétrico de Kruskal-Wallis para los datos que no se ajustaron a una normal. A la vez se realizó un análisis de Kruskal-Wallis para determinar diferencias significativas en los nutrimentos por años (desde 1999 hasta 2005) y en las variables ambientales de precipitación, velocidad del viento y brillo solar entre años (desde 1999 hasta 2005), seguidos por pruebas a posteriori de U de Mann Whitney. Los datos de nutrimentos se transformaron con log 10 (x+1). En todos los análisis estadísticos se utilizó Systat 8.0 y JMP IN
44 Fig Localización del área de estudio y de los sitios de muestreo en Bahía Culebra, Golfo de Papagayo. Los círculos negros indican los sitios donde se realizaron medidas de los parches del alga y la toma de factores ambientales. Los números donde se contabilizó la cobertura y densidad de frondas en cuadrículas permanentes desde marzo 2004 hasta marzo Las letras las estaciones de nutrimentos. El asterisco indica el sitio de donde se extrajeron talos del alga para el experimento en laboratorio. 25
45 Influencia de los factores ambientales sobre la población de Caulerpa sertularioides Se realizaron evaluaciones iniciales en toda la bahía para escoger los sitios de muestreo, donde se tomaron datos mensuales de la variación estacional del área de parches permanentes. Para esto se eligieron 5 sitios de Bahía Culebra: Islas Huevos, Playa Blanca, Punta Flor, Playa La Penca e Islas Pelonas (Fig. 2.1). En cada sitio se marcaron parches aislados, colocando una varilla en el extremo sur de este y se lanzaron líneas rectas desde la varilla con una cinta métrica cada 30 grados, medidos con una brújula, y se tomó la medida del punto hasta donde llegaba el parche (Fig. 2.2 A). Seguidamente cada parche se dibujó uniendo todos los puntos para conformar un polígono (Fig. 2.2 B) y por medio del programa UTASCA Image Tool versión 3.0, se midió el área del polígono. Se dejaron de tomar medidas en el caso de que el parche se uniera con otros parches no medidos, desapareciera o no se distinguieran sus límites. Fig Esquema de medición del área de los parches de C. sertularioides: A. Medida de los puntos máximos del parche cada 30º, B. Conformación del polígono. 26
46 Asimismo se midió la variación mensual de la densidad de frondas y de la cobertura de C. sertularioides en tres sitios de la bahía: Islas Huevos, Playa Blanca y Playa La Penca (Fig. 2.1), entre marzo 2004 y marzo En cada sitio se establecieron con varillas cinco cuadrículas permanentes de 50 x 50 cm 2, que fueron ubicadas en medio de un parche del alga. Mensualmente se midió el porcentaje de cobertura en cada cuadrícula y se contabilizó el número de frondas en seis cuadrantes de 10 cm 2 escogidos por medio de una tabla de números aleatorios. Para el análisis estadístico se calcularon promedios y desviaciones estándar de los porcentajes de cobertura y del número de frondas por sitio y entre los tres sitios para obtener un promedio de toda la bahía. Se realizaron pruebas de varianza (ANDEVA) para determinar diferencias entre la cobertura y densidad de frondas por sitios y entre estaciones (seca y lluviosa). Los datos fueron trasformados con Box y Cox para logar una distribución normal. Experimentos de laboratorio Se realizaron experimentos de crecimiento en laboratorio del alga C. sertularioides bajo diferentes tratamientos de temperatura y nutrimentos en condiciones controladas. Estos se llevaron acabo en el Laboratorio de Algas del Centro de Investigación en Ciencias del Mar y Limnología (CIMAR), de la Universidad de Costa Rica. Las algas fueron sometidas a diferentes condiciones controlando variables como salinidad (32 ) y un ciclo de doce horas luz y doce horas oscuridad. Para los experimentos, los talos del alga fueron extraídos de Playa Blanca (Fig. 2.1), los cuales fueron colocados en peceras con los diferentes tratamientos durante dos semanas para que se aclimataran. Esto debido a que en observaciones preliminares las algas tendieron a liberar gametos cuando se dio un cambio drástico en la temperatura o en los nutrimentos y una gran parte de sus frondas y estolones quedaron vacíos. Una vez aclimatados se escogieron aleatoriamente trozos de C. sertularioides a los cuales se les midió inicialmente el largo del estolón, el número de frondas y el peso húmedo, medidas que se repitieron una semana después. Además, se analizaron muestras de nutrimentos, temperatura y salinidad del agua regularmente con el fin de que las condiciones fueran constantes. Para el caso de la temperatura se colocaron tres peceras con diferentes temperaturas: 31ºC (temperatura reportada en año de El Niño), 27ºC (temperatura promedio de la bahía) y 22ºC (temperatura promedio periodo de afloramiento) (Jiménez 1998). Para controlar la variación en la 27
47 temperatura, a cada pecera se le colocó un sensor de temperatura (Stow Away XTI) programado para tomar una medida cada 30 minutos. Para el tratamiento con nutrimentos se colocaron dos peceras, que se mantuvieron a 27ºC (temperatura promedio de la bahía), con diferentes concentraciones de nutrimentos que se midieron al inicio del experimento: alta (agua de Caldera, Puntarenas) y baja (agua de Bahía Culebra en época lluviosa). La concentración alta contuvo aproximadamente un 30% más en la concentración de los nutrimentos, que en la concentración baja. A cada pecera con los diferentes tratamientos se le colocaron tres recipientes de vidrio y cada uno de estos contuvo cuatro talos de C. sertularioides separados unos de otros (Fig. 2.3). A. B. Fig Experimento en laboratorio del crecimiento de C. sertularioides bajo diferentes tratamientos de temperatura y nutrimentos. A. Peceras con los tres tratamientos de temperatura, B. Esquema de los componentes de cada pecera. Para el análisis estadístico de los datos se utilizaron promedios y desviaciones estándar de las medidas en cada tratamiento. Para comparar diferencias entre tratamientos se utilizaron pruebas de análisis de varianza (ANDEVA) para el número de frondas y el largo del estolón, a las cuales se les aplicaron pruebas a posteriori de Tuckey. Además y se realizaron pruebas no paramétricas de Kruskal-Wallis para determinar diferencias en el peso húmedo por tratamiento, a las cuales se les aplicaron pruebas a posteriori de U de Mann-Whitney con corrección de Bonferroni. En todos los análisis estadísticos se utilizó Systat 8.0. y JMP IN
48 RESULTADOS Estacionalidad de Bahía Culebra Con los datos ambientales analizados entre 1999 y 2005, en Bahía Culebra, se observa una estacionalidad marcada, dada por la precipitación, el brillo solar y la velocidad del viento. La época lluviosa da inicio en mayo cuando la precipitación promedio de lluvias fue de mm, el brillo solar de hrs/día y la velocidad del viento de km/h. Esta finaliza en octubre con un promedio de lluvia de mm, un brillo solar de hrs/día y una velocidad del viento de km/h. Los meses más lluviosos de esta época son setiembre y octubre. En julio, se da el Veranillo de San Juan donde en comparación con otros meses de la época lluviosa, el promedio de lluvia disminuye ( mm), la radiación solar aumenta levemente ( hrs/día) y la velocidad del viento aumenta ( km/h). Noviembre es un mes de transición entre la época lluviosa y la seca, se da una disminución de las lluvias ( mm) y un incremento en el brillo solar ( hrs/día) ( km/h), asimismo aumenta la velocidad de los vientos, que indica el inicio del afloramiento costero, por lo que en este estudio, noviembre, se incluyó en la época seca. Esta época termina en abril, el cual es un mes con poca precipitación ( mm), alto brillo solar ( hrs/día) y alta velocidad del viento ( km/h) (Cuadro 2.1, Fig. 2.4). Al comparar los promedios de los factores en cada época, se obtuvo que en época lluviosa, en comparación con la seca, se dan 247 mm más de lluvia, 3 h menos de luz por día y una disminución en la velocidad del viento de 8.8 km/h (Cuadro 2.1, Fig. 2.4). No se encontraron diferencias significativas entre años, desde 1999 hasta el 2005 en cuanto a los tres factores ambientales (p>0.005, Fig. 2.4) 29
49 Cuadro 2.1. Promedio y desviación estándar mensual de la precipitación, brillo solar y velocidad del viento, en época seca (noviembre-abril) y en época lluviosa (mayo-octubre), entre enero 1999 y diciembre 2005, en Bahía Culebra, Golfo de Papagayo. Datos suministrados por el Instituto Meteorológico Nacional de la estación meteorológica del Aeropuerto Daniel Oduber. Época Precipitación (mm) Brillo Solar (h/día) Velocidad del Viento(km/h) Seca Lluviosa Factores físicos y químicos del agua La temperatura del agua fue una variable con alta estacionalidad, aumentando en la época lluviosa y disminuyendo en la época seca, coincidiendo con un incremento en la velocidad del viento, lo que causa que la termoclina se desplace hacia la superficie y se dé el afloramiento costero (Cuadro 2.2, Fig. 2.5). El mayor valor de temperatura tuvo lugar en setiembre 2004, mientras que la mínima fue registrada en marzo La salinidad mostró valores máximos en la época seca y los mínimos en la época lluviosa. En época seca esto se da por el calentamiento de las aguas debido a la evaporación, producto de un aumento en la disponibilidad de horas de sol en este periodo (Cuadro 2.2), mientras que en época lluviosa los descensos en salinidad coinciden con los picos de mayor precipitación, lo cual indica una dilución de las aguas de la bahía (Cuadro 2.2, Fig. 2.5). La clorofila a tiende a mantenerse en un ámbito entre 0.4 y 2 µg/l. Muestra aumentos variables en los meses lluviosos y en los meses de afloramiento. Disminuye en julio y agosto y aumenta considerablemente hasta 3.8 µg/l en octubre (Cuadro 2.2, Fig. 2.5). Los sedimentos en suspensión muestran fluctuaciones muy similares a la precipitación. En la época lluviosa se dan entradas de agua a la bahía por la lluvia y por escorrentía del suelo que depositan sedimentos y nutrimentos en el agua (Cuadro 2.2, Fig. 2.4, 2.6). Mientras que la tasa de sedimentación mostró poca variación en comparación con los sedimentos en suspensión (Cuadro 2.2, Fig. 2.6). 30
50 Cuadro 2.2. Parámetros físico-químicos de Bahía Culebra, Golfo de Papagayo, desde marzo 2004 a marzo Variable Promedio y Desv. Est. Máximo Mínimo Promedio y Desv. Est. Ép. Seca (nov-abr) Promedio y Desv. Est. Ép. Lluviosa (may-oct) Temperatura ( C) 27.2 ± ± ± 0.5 Salinidad ( ) 32.8 ± ± ± 1.2 Clorofila a (µg/l) 1.3 ± ± ± 1.1 Sedimentos en suspensión (mg/l) 6.2 ± ± ± 1.7 Tasa de sedimentación (mg/cm 2 /día) 3.0 ± ± ± 0.5 PO -3 4 (µm) 0.48 ± ± ± 0.2 NO 2 - (µm) 0.27 ± fld 0.10 ± ± 0.5 NO 3 - (µm) 2.34 ± fld 2.38 ± ± 1.9 NH 4 + (µm) 0.06 ± fdl 0.11 ± 0.2 fdl SiO 4 (µm) 1.11 ± fdl 1.10 ± ± 2.1 Precipitación (mm) ± ± ± Brillo Solar (hrs/día) 7.8 ± ± ± 0.5 Velocidad del Viento (km/hrs) 13.2 ± ± ± 2.2 fdl=fuera del límite de detección 31
51 Fig Promedios mensuales de: A. Precipitación (mm) y velocidad del viento (km/h). B. Brillo solar (hrs por día). Entre enero 1999 y diciembre 2005, en Bahía Culebra, Golfo de Papagayo. El sombreado indica la época seca. 32
52 Fig Valores mensuales promedio de temperatura (ºC), salinidad ( ), clorofila a (µg/l), medidos en Bahía Culebra, Golfo de Papagayo, entre marzo 2004 y marzo El sombreado indica la época seca. Fig Valores mensuales promedio de sedimentos en suspensión (mg/l) y tasa de sedimentación (mg/cm 2 /día), medidos en Bahía Culebra, Golfo de Papagayo, entre marzo 2004 y marzo El sombreado indica la época seca. 33
53 Patrón temporal de los nutrimentos Según el análisis de los nutrimentos desde 1999 hasta el 2005 por año, no se encontraron diferencias significativas de cada nutrimento por año (p > 0.005). Los nutrimentos mostraron ser parámetros muy variables, con picos tanto en la época seca como en la lluviosa. La mayoría de los picos altos se dieron en la época seca, durante el afloramiento costero, sin embargo hay un aporte importante en la época lluviosa entre agosto y octubre, dependiendo del año (Fig. 2.7, 2.8). Estos últimos concuerdan con los picos de mayor precipitación (Fig. 2.4). Al comparar los nutrimentos por época se nota una mayor concentración de fosfato, nitrato y amonio en época seca, mientras que el silicato y el nitrito mostraron mayor concentración en la época lluviosa. Sin embargo, para ningún nutrimento se encontraron diferencias significativas entre las épocas (p> 0.005, Fig. 2.7). Fig Concentración promedio y desviaciones estándar en época seca y lluviosa de los nutrimentos, desde abril 1999 hasta marzo 2005, en Bahía Culebra, Golfo de Papagayo. 34
54 Fig Promedios mensuales de fosfato, nitrito, nitrato, silicato y amonio, a 15 m de profundidad entre abril 1999 y marzo 2005, utilizando los promedios mensuales de cinco estaciones distribuidas a lo largo de Bahía Culebra, Golfo de Papagayo. El sombreado indica la época seca. 35
55 Análisis de Componente Principales (ACP) En total, se identificaron 3 componentes que explicaron el 65.2% de la variación en las aguas de Bahía Culebra entre marzo 2004 y marzo El Componente Principal 1 (CP1) explicó un 26.7% de la variación y está compuesto por el fosfato, el nitrato y los sedimentos en suspensión (Fig. 2.9 A). El Componente Principal 2 (CP2) explicó un 22.5% de la variación y está compuesto por la tasa de sedimentación (Fig. 2.9 B). Finalmente, el Componente Principal 3 (CP3) explicó un 16.0% de la variación y está compuesto por la temperatura (Fig. 2.9 B). De estos cinco factores encontrados en el ACP, únicamente la temperatura mostró diferencias significativas entre época seca y época lluviosa (F 1,11 =12.099, p=0.005) (Cuadro 2.1), mientras que el nitrito, el fosfato, los sedimentos en suspensión y la tasa de sedimentación no mostraron diferencias significativas por época. A. B. Fig Análisis de Componentes Principales (ACP) de los factores físico-químicos estudiados en Bahía Culebra entre marzo 2004 y marzo A. Componente Principal 1 (CP1) vs Componente Principal 2 (CP2). B. Componente Principal 2 (CP2) vs Componente Principal 3 (CP3). Los tres CP explican un 65.2% de la variación. 36
56 Influencia de los factores ambientales sobre la población de Caulerpa sertularioides En general los parches de C. sertularioides, tendieron a aumentar su área en la época seca. Desde noviembre hasta abril los parches pueden aumentar su área en promedio 18%, obteniendo la mayor ampliación en área de un 25%, en Playa La Penca entre noviembre 2004 y enero Lo contrario sucede en la época lluviosa donde los parches tienden a disminuir su área, los límites son muy difusos e incluso pueden desaparecer. Específicamente, en los meses de junio y julio los parches se ven disminuidos en casi su totalidad dejando talos aislados. Sin embargo, se observa un aumento en el área de los parches entre agosto y octubre, coincidiendo con picos de precipitación y de los nutrimentos como fosfato, nitrito y nitrato (Figs. 2.4, 2.8). Entre noviembre y febrero algunos parches se dejaron de medir porque se unieron con otros, mientras que entre abril y junio se dejaron de medir porque desaparecieron, quedando frondas aisladas, donde los límites no eran claros (Fig. 2.10). Fig Dinámica mensual del área de los parches de C. sertularioides, entre agosto 2003 y marzo 2005, en cinco sitios de muestreo en Bahía Culebra, Golfo de Papagayo. El sombreado indica la época seca. 37
57 En cuanto a la densidad de frondas, las máximas encontradas se dieron en época seca, mientras que las mínimas se dieron en época lluviosa (Cuadro 2.3). Se encontraron diferencias significativas en las densidades de las frondas entre las épocas y entre los tres sitios de muestreo (F 5,183 =13.5, p<0.0001). Se encontró una densidad significativamente mayor de frondas en la época seca (noviembre- abril) en comparación con la época lluviosa (mayo octubre) (Cuadro 2.3, Fig. 2.11). Donde Playa Blanca presentó ser el sitio con mayor densidad de frondas e Isla Huevos el sitio con la menor densidad de frondas por cada 10 cm 2 (Fig. 2.11). Cuadro 2.3. Densidades (# frondas/10 cm 2 ) máximas y mínimas promedio del número de frondas medidas en tres sitios de muestreo, entre marzo 2004 y marzo 2005, Bahía Culebra, Golfo de Papagayo. Playa Blanca Playa La Penca Islas Huevos Máximo 54.4 (Feb-05) 45.5 (Feb-05) 59.1 (Feb-05) Mínimo 8.2 (Jun-04) 5.6 (Mar-05) 7.3 (Jun-04) 1.0 (Mar-04) 3.9 (Jun-04) Fig Promedio y desviación estándar de la densidad de frondas (# frondas/cm 2 ) en época seca y en época lluviosa en tres sitios de muestreo, entre marzo 2004 y marzo 2005, Bahía Culebra, Golfo de Papagayo. 38
58 Al analizar el porcentaje de cobertura se encontraron las máximas coberturas en febrero 2005 y setiembre 2004, mientras que las mínimas se dieron en los demás meses de la época lluviosa y en marzo 2005 (Cuadro 2.4). A la vez se encontraron diferencias significativas en el promedio del porcentaje de cobertura entre los tres sitios de muestreo y entre épocas (F 5,183 =7.9, p<0.0001), donde Playa Blanca es el sitio con mayor porcentaje de cobertura e Isla Huevos con el menor porcentaje de cobertura (Figs. 2.12), encontrándose más cobertura del alga en época seca (noviembre-abril) que en época lluviosa (mayo octubre) en todos los sitios (Fig. 2.12). Cuadro 2.4. Porcentajes máximos y mínimos promedio de cobertura de C. sertularioides medidos en tres sitios de muestreo, entre marzo 2004 y marzo 2005, Bahía Culebra, Golfo de Papagayo. Playa Blanca Playa La Penca Islas Huevos Máximo 68.8% (Feb-05) 74.4% (Set-04) 61.2% (Dic-04) 82.0% (Feb-05) Mínimo 7.2% (May-05) 8.0% (Jun-04) 4.4% (Mar-05) 8.4% (Jun-04) 1.0% (Mar-05) 4.8% (Jun-04) Fig Promedio y desviación estándar del porcentaje de cobertura de C. sertularioides en época seca y en época lluviosa en tres sitios de muestreo, entre marzo 2004 y marzo 2005, Bahía Culebra, Golfo de Papagayo. 39
59 En general, el promedio del porcentaje de cobertura y la densidad de frondas de C. sertularioides de los tres sitios de muestreo, tienen un patrón muy similar de variación entre los diferentes meses de muestreo. En la época lluviosa el porcentaje de cobertura tiende a mantenerse por debajo del 40% y la densidad de frondas por debajo de 20 frondas/10 cm 2, a excepción de setiembre 2004 donde se dio un pico de cobertura de 46.3% y en agosto y setiembre donde se dieron picos de 29.5 frondas/10 cm 2 y 24.8 frondas/10 cm 2, respectivamente. En la época seca, después de noviembre, incrementó el promedio de la cobertura y la densidad de frondas, donde se alcanzaron las máximas medidas en febrero del 2005, con un 70.7% de cobertura y 50.0 frondas/10cm 2 (Fig. 2.13). Fig Promedio y desviación estándar de la densidad de frondas (#Frondas/10cm 2 ) y de la cobertura (%) de C. sertularioides de los tres sitios de muestreo, entre marzo 2004 y marzo 2005, en Bahía Culebra, Golfo de Papagayo. El sombreado indica la época seca. 40
60 Experimentos de laboratorio En el laboratorio, la temperatura de las peceras se mantuvo con pocas variaciones a lo largo del periodo de estudio (Cuadro 2.5). Los máximos valores alcanzados del largo del estolón, número de frondas y peso húmedo, se dieron en condiciones donde los nutrimentos son altos, seguidos en orden descendente por los valores medidos en las peceras con una temperatura de 27ºC, 22ºC y 31ºC (Cuadro 2.6). Cuadro 2.5. Temperatura promedio y desviación estándar en cada pecera a lo largo de una semana en el laboratorio del CIMAR, UCR. 22 ºC 27 ºC 31 ºC Nutrimento Alto Nutrimento Bajo Promedio ºC Desviación estándar Cuadro 2.6. Diferencias máximas y mínimas medidas del largo del estolón, número de frondas y peso húmedo después de una semana de crecimiento en laboratorio, bajo diferentes condiciones de temperatura y nutrimentos. Largo Estolón (cm) Numero de frondas Peso Húmedo (g) Máximo Mínimo Máximo Mínimo Máximo Mínimo Temperatura Nutrimentos 22ºC ºC ºC Alto Bajo (-) El signo negativo indica una disminución en la medida inicial 41
61 En cuanto a los tratamientos de temperatura se encontraron diferencias significativas en el largo del estolón (F 2,33 = 3.822, p = 0.032), según el análisis a posteriori de Tuckey; estas diferencias se dan principalmente entre los estolones que se encontraron a 22ºC y 31ºC. Igualmente en el peso húmedo (g) se encontraron diferencias significativas (KW=6.092, p=0.048, gl=2, n=36), según la prueba a posteriori de Mann-Whitney estas diferencias se dan, igualmente, entre 22ºC y 31ºC. Finalmente en cuanto al número de frondas no se encontraron diferencias significativas por variación en la temperatura (p > 0.005). Después de una semana de exposición a las diferentes temperaturas, el largo del estolón disminuye cuando aumenta la temperatura. A 22ºC y 27ºC su largo tiende a aumentar paulatinamente, mientras que a 31ºC el estolón tiende a disminuir. El número de frondas aumenta a 22ºC mientras que a 27ºC y 31ºC el número de frondas tiende a disminuir. Lo mismo sucede con el peso húmedo de los talos, estos tienden a aumentar el peso a 22ºC mientras que a 27ºC y 31ºC el peso disminuye (Fig. 2.14). Fig Promedio y desviación estándar de la diferencia entre la medida final e inicial (durante una semana) del largo del estolón (cm), número de frondas y peso húmedo (g) de C. sertularioides, en condiciones de laboratorio con tres tratamientos de temperatura. 42
62 Al analizar las medidas con los tratamientos de nutrimentos no se encontraron diferencias significativas en el largo del estolón, número de frondas y peso húmedo (p > 0.005) de los talos. Sin embargo, las tres medidas tienden a aumentar cuando los talos están en concentraciones altas de nutrimentos. En concentraciones bajas de nutrimentos el largo del estolón tiende a aumentar, sin embargo, el crecimiento es menor que en altas concentraciones, mientras que el número de frondas y el peso húmedo del talo tienden a disminuir (Fig. 2.15). Fig Promedio y desviación estándar de la diferencia entre la medida final e inicial (durante una semana) del largo del estolón (cm), número de frondas y peso húmedo (g) de C. sertularioides, en condiciones de laboratorio con dos tratamientos de nutrimentos. 43
63 DISCUSIÓN Factores ambientales Desde 1999 hasta el 2005, las condiciones ambientales se han mantenido muy similares, sin cambios abruptos, a excepción de una intensificación en las lluvias en setiembre Con los datos proporcionados por el Instituto Meteorológico, desde 1999 hasta el 2005, para este estudio se plantea que la época seca inicia en noviembre, considerándose este como un mes de transición entre la época seca y la lluviosa. En este mes inicia el afloramiento costero y se debilita en abril, coincidiendo con la finalización de la época seca. Anteriormente en la literatura hay reiteradas menciones a restringir el período de afloramiento a los meses de noviembre a marzo (Brenes et al. 1995) y hay otras referencias que indican que el período de los vientos Papagayos se inician en diciembre y se extienden hasta abril (Jiménez 1998). La temperatura de agua es uno de los factores que tienen más influencia por el efecto de los vientos en la superficie del agua. Ésta mostró ser una variable con alta estacionalidad y a lo largo del año presenta variaciones de 7ºC. En comparación con el Pacífico sur (3ºC, Alvarado 2006), esta variación es mucho mayor en Bahía Culebra, por lo que los organismos en esta zona de afloramiento muestran adaptaciones a los cambios bruscos de temperatura. Asimismo la salinidad del agua mostró variación estacional. En general, en toda la costa del Pacífico de Costa Rica se presentan dichas variaciones (Jiménez 1998, Alvarado 2006). Bahía Culebra es una zona de bajo impacto por las tasas de sedimentación (mg/cm 2 /día) y los sedimentos en suspensión (mg/l). La bahía muestra valores por debajo de los reportados en el Pacífico sur (tasa de sedimentación promedio BC: , PNMB: y sedimentos suspendidos BC: , PNMB: ), donde la influencia de estos factores juegan un papel muy importante en la dinámica de los ambientes marinos del sur (Alvarado 2006). Además, según Rogers (1990), un arrecife con estrés humano se da cuando la tasa de sedimentación (mg/cm 2 /día) y la concentración de sedimentos en suspensión (mg/l) son mayores a 10. De acuerdo con los promedios de clorofila a y nutrimentos como fosfato y nitrato, Bahía Culebra tiende a ser un sitio eutrófico temporalmente. Esta condición es fluctuante con los años, 44
64 donde hay meses como abril, mayo, junio, julio, agosto he incluso noviembre, donde las condiciones tienden a ser oligotróficas. En la época seca la clorofila a, el fosfato y el nitrato aumentan debido al afloramiento de aguas de profundidad ricas en nutrimentos. En la época lluviosa, principalmente entre agosto y octubre (dependiendo del año), estos picos concuerdan con los picos de mayor precipitación, es decir, que en la bahía se da escorrentía de nutrimentos por el lavado de la tierra por las lluvias, que favorecen el crecimiento de los organismos fotosintéticos, ya que en gran parte la asimilación del nitrito, nitrato y fosfato en los arrecifes en esta a cargo de estos (D`Elia y Wiebe 1990). Un indicador común de la condición eutrófica es el incremento en la biomasa de fitoplancton que se ve reflejada en la concentración de clorofila a (Tomascik y Sander 1985). Según Halfar et al. (2005) más de 1 µg/l de clorofila a en el agua se clasificaría al sitio como una zona eutrófica estacionalmente. Al comparar el promedio de clorofila a obtenido en Bahía Culebra con estos datos, las aguas de esta bahía se clasifican como eutróficas. Asimismo, según el modelo de Halfar et al. (2005) basado en temperatura y clorofila a, Bahía Culebra, con una temperatura promedio de 27.2 ºC y 1.3 µg/l de clorofila a obtenidas en este estudio (Cuadro 2.1), se ubica como un sitio eutrófico con estrés causado por nutrimentos. Además, según clasificaciones en arrecifes, de Lalli y Parson (1997) y McCook et al. (2001), con respecto a la concentración de NO - 3 y de PO -3 4, según los resultados obtenidos en este estudio, Bahía Culebra, se considera una ambiente eutrófico (Cuadro 2.8). Asimismo Bahía Culebra presenta valores mayores en la concentración de estos nutrimentos al compararlos con otras zonas donde ocurre afloramiento costero (Cuadro 2.7). 45
65 Cuadro 2.7. Clasificación y comparación del ambiente marino de Bahía Culebra, según las concentraciones de nitrato y fosfato. Nutrimento Aguas oligotróficas Aguas eutróficas Referencia NO 3 - Clasificación µm µm Lalli y Parson (1997) >1 µm McCook et al. (2001) Comparación 2.34 µm Este Estudio 1.03 µm Bahía de Panamá (D Croz y Robertson 1997) Clasificación < 0.02 µm > 0.5 µm Lalli y Parson (1997) > µm McCook et al. (2001) Comparación 0.48 µm Este Estudio PO µm Bahía de Panamá (D Croz y Robertson 1997) 0.33 µm Laguna de Tarawa en República de Kiribati (D Elia y Wiebe 1990) 0.56 µm Atolón de Canton en las Islas Phoenix (D`Elia y Wiebe 1990) Influencia de los factores ambientales sobre la población de Caulerpa sertularioides y experimentos de laboratorio El área de los parches, el porcentaje de cobertura y la densidad de las frondas de C. sertularioides muestran fluctuaciones estacionales. Esta variación es producto de las condiciones ambientales (Scrosati 2001), que se presentan en Bahía Culebra. El fosfato, el nitrato, los sedimentos en suspensión, la tasa de sedimentación y temperatura (según el ACP) juegan un papel importante en la dinámica del ecosistema marino de la bahía. Por otro lado, la clorofila, el nitrito, el silicato y la salinidad no muestran ser factores que jueguen un papel importante en la dinámica de la bahía. En la época seca cuando se da el afloramiento costero y las aguas son eutróficas, aumenta el porcentaje de cobertura y la densidad de las frondas de C. sertularioides. En general, las altas 46
66 abundancias de algas son encontradas en las zonas de afloramiento y en estas zonas los nutrimentos juegan un papel importante en la biomasa de las algas (Bell 1992, Lapointe 1997, Szmant 2002). En Bahía Culebra, esto se ha observado también con otras algas como Ulva intestinalis, Ulva lactuca y algunas especies de Dictyota spp. donde su abundancia aumenta en época de afloramiento y luego desaparecen (Obs pers). Los nutrimentos, aportados por el afloramiento, son aprovechados en cuestión de semanas y estos son consumidos en lapsos relativamente cortos (Rodríguez 2005, Jenaro Acuña com. pers.). Es así como, en marzo (2004, 2005) la cobertura y densidad de frondas de C. sertularioides caen un 40% de lo que alcanzaron en febrero. Esto mismo observó Rodríguez (2005) donde en los meses siguientes al afloramiento las concentraciones de fitoplancton y la densidad del zooplancton disminuyeron. Asimismo, en las poblaciones de Ulva spp. y Dictyota spp., después de aumentar su biomasa en el pico del afloramiento, su abundancia cae drásticamente en los meses siguientes. Sin embargo, en el caso de C. sertularioides, a pesar del descenso esta permanece cubriendo en promedio un 10% del sustrato. Por el contrario, en época lluviosa, en los meses oligotróficos el área de los parches, la cobertura y la densidad de frondas del alga tienden a disminuir. Específicamente, en junio y julio los parches se ven disminuidos en casi su totalidad, dejando talos aislados y límites difusos. En estos meses la concentración de nutrimentos tiende a caer por debajo del promedio de la bahía (Fig. 2.8). El aumento en el área de los parches, la cobertura y la densidad de frondas del alga, entre agosto y setiembre, se debe al aporte de materia orgánica y nutrimentos que entran a la bahía vía escorrentía de aguas y por el Estero Iguanita. Estos nutrimentos están siendo aprovechados por C. sertularioides. Además, en Bahía Culebra la dirección de las corrientes potencialmente pueden transportar las aguas residuales ricas en nutrimentos de una zona a otra y la difusión ocurre por distancias y períodos de tiempo considerables (Jiménez 1998). Esto mismo observó Rodríguez (2005) en un estudio sobre zooplancton gelatinoso en la bahía, donde las abundancias de estas poblaciones también mostraron algunos valores altos en estos meses debido al aumento en la biomasa del fitoplancton (medido indirectamente con µg/l de clorofila a). Esto es importante si se toma en cuenta que la infraestructura de la zona no tiene plantas para el tratamiento de aguas, y los que sí, utilizan las aguas tratadas para el riego de zonas verdes (Jiménez 1998). Las aguas tratadas y utilizadas para la irrigación pueden percolarse por el suelo y filtrarse hacia el mar, como se ha observado en otros ambientes y se ha demostrado que las 47
67 aguas cargadas de nutrimentos son un factor responsable del crecimiento de macroalgas (Bell 1992, Lapointe 1997, Schaffelke y Klumpp 1997, Little 2000). Específicamente, el fosfato y el nitrato, dos factores que determinan la dinámica de la bahía, son nutrimentos limitantes en el crecimiento de las algas, naturalmente pueden venir por los ríos, escorrentía del suelo y por afloramiento de aguas de profundidad (Begon et al. 1996). En general, alrededor del mundo la calidad del agua en las zonas costeras esta siendo modificada rápidamente por la deforestación, construcción de infraestructura y por el uso de fertilizantes para la agricultura y campos verdes, que por escorrentía los suelos se lavan y se depositan nutrimentos y sedimentos en los ambientes marinos. Cuando los nutrimentos aumentan en un ambiente, las comunidades arrecifales cambian (Fabricius 2005). Esto da como resultado un ambiente menos habitable para los herbívoros, y tiene efectos directos sobre el crecimiento de los corales, al suprimir la calcificación y estimular el crecimiento de las algas aumentando la competencia con los organismos bénticos (Kinsey 1987, Lapointe 1997). Estos nutrimentos que son depositados en el ambiente marino por escorrentía, merecen particular atención y requieren de una comprensión detallada de su fuente y un manejo costero adecuado. A pesar de que, en el experimento en laboratorio, no se encontraron diferencias significativas en el largo del estolón, número de frondas y peso húmedo en los tratamientos de nutrimentos, se sabe que la disponibilidad de estos es un factor importante para el crecimiento de las algas, ya que las medidas de los talos tendieron a aumentar en el tratamiento de concentración alta. Sin embargo, las concentraciones de los nutrimentos no siempre explican únicamente las tasas de crecimiento de algas en el campo y las interacciones alga-nutrimentos no son fáciles de determinar, dado que la biomasa de las algas está limitada también por otros factores como los herbívoros, la turbidez del agua, la disponibilidad de luz según la profundidad, entre otros (Fabricius 2005). Si bien, los nutrimentos juegan un papel importante en la dinámica de C. sertularioides y no hubo diferencias significativas entre épocas, cabe preguntarse, por qué el pico del porcentaje de cobertura, el área de los parches y la densidad de frondas es mayor en época de afloramiento (febrero) que en época lluviosa (setiembre)? Es aquí donde otros factores juegan un papel sinérgico con los nutrimentos. La temperatura es uno de los factores abióticos más importantes que afectan la dinámica de Bahía Culebra, variando hasta 10 ºC en diferentes épocas. Este es uno de los principales factores ambientales que controlan la fotosíntesis y el crecimiento de las macroalgas. Los efectos 48
68 de la temperatura en el metabolismo de las algas, cambia durante el año y en algunos casos se da sensibilidad térmica y adaptación a los cambios estacionales, esto último sobre todo se nota en las algas de las zonas templadas y en las zonas donde ocurren afloramientos costeros donde la temperatura cambia varios grados según la época (Terrados y Ros 1992) Esto se demuestra también con los experimentos en laboratorio, con los tratamientos de temperatura, donde se dan diferencias significativas en el largo del estolón y en el peso húmedo de las algas. Estas medidas son mayores a 22 ºC en comparación con las medidas de los talos que estuvieron a 27 ºC y 31 ºC, donde tienden a disminuir, favoreciéndose el crecimiento de estas en las temperaturas más frías. En la bahía, temperaturas entre los 22ºC y 27 ºC son frecuentes durante el afloramiento y alcanzando los 12 m de profundidad por varios días, lo que aumenta las posibilidades de actuar sinérgicamente con los nutrimentos. Al analizar la distribución de C. sertularioides en el mundo (Fig. 2.16) se destaca su cosmopolitismo, distribuyéndose en toda la franja tropical y subtropical, colonizando zonas donde la temperatura del agua es fría como: el Pacífico Oriental Sur en Chile (Ramírez y Santelices 1991), el Atlántico Sur en Brasil (Taylor 1960, Joly 1965), África del Sur (Silva et al. 1996), Nueva Zelanda (Adams 1994) y Japón (Yoshida-Nakajima y Nakata 1990). En Panamá se encuentra colonizando sustratos rocosos, arenosos y coralinos en la zona de afloramiento de la Bahía de Panamá (Taylor 1960, Kooistra 2002, Wysor 2004). Fig Distribución mundial de Caulerpa sertularioides. 49
69 Se ha demostrado también, que otras especies del género Caulerpa se adaptan a bajas temperaturas, por ejemplo C. taxifolia (Jousson et al. 2000), se encuentra hasta profundidades de 100 m en el Mar Mediterráneo (Belsher y Meinesz 1995). La mayoría de las cepas de C. taxifolia no son invasoras, sin embargo la cepa que se ha propagado en el Mediterráneo y California posee, a diferencia de las otras, un mayor crecimiento y vigorosidad y es resistente a bajas temperaturas (Allendorf y Lundquist 2003). C. prolifera en el Mediterráneo también muestra adaptación metabólica a los cambios estacionales en la temperatura (Terrados y Ros 1992). En conclusión el incremento en la densidad de frondas, la cobertura y el área de los parches del alga, se explican por el favorecimiento de nutrimentos producto del afloramiento costero y lavado de los suelos y por las temperaturas frías de la época seca. Este estudio demuestra que los nutrimentos juegan un papel importante en el crecimiento de C. sertularioides, pero además la disminución de la temperatura es un factor que en sinergia contribuye a la propagación de C. sertularioides y en consecuencia el equilibrio del ecosistema arrecifal de Bahía Culebra. 50
70 CAPÍTULO 3. Impacto de la propagación de Caulerpa sertularioides (Chlorophyta) en los ecosistemas coralinos de Bahía Culebra, Golfo de Papagayo, Costa Rica RESUMEN El presenta trabajo describe y cuantifica los efectos que provoca la propagación de C. sertularioides sobre los organismos arrecifales de Bahía Culebra. Con datos in situ se respalda la hipótesis que las macroalgas pueden ser la causa y no la consecuencia de la degradación de los corales y en general del ecosistema arrecifal. Se realizaron mediciones en sitios con la presencia del alga y en sitios sin el alga sobre: variación en las tasas del crecimiento de coral y cambios en la diversidad y abundancia de invertebrados bénticos y macroalgas. La propagación de C. sertularioides está afectando la tasa de crecimiento de la colonias de Pocillopora elegans. La disminución en el crecimiento de los corales se da principalmente por acumulación de sedimentos, constante abrasión de las frondas sobre el tejido vivo del coral y por sobrecrecimiento en el tejido de coral, sin embargo esto último parece no tener un efecto en la sobrevivencia del coral, ya que muchas veces se da corte de frondas por los cangrejos del género Trapezia sp. Se obtuvo un mayor crecimiento en las colonias de coral en los sitio sin el alga. Además, se observó una diferencia en el crecimiento de las colonias durante las épocas muestreadas, con un mayor crecimiento en la época lluviosa. La medida en que el alga afecta a los corales varía con la cobertura del alga y con la densidad de las frondas que dependen del incremento en los nutrimentos y disminución en la temperatura, variando con la época del año. La propagación de C. sertularioides causa modificaciones en la estructura de las comunidades bénticas, disminuyendo el crecimiento de los corales ramosos, matando colonias del coral Psammocora stellata por sobre crecimiento y cambiando la abundancia y composición de especies bénticas en los sitios donde se encuentra. Esto último por disminución de especies de otras algas, disminución de especies de invertebrados y aumento de especies que se favorecen con la presencia del alga como nudibranquios y poliquetos. Asimismo, la presencia de herbívoros juega un papel importante en la dinámica anterior, por lo que es necesario realizar estudios sobre abundancia, diversidad, biomasa y sobrepesca de estas especies para determinar la influencia que tienen sobre la propagación de C. sertularioides en la bahía. 51
71 INTRODUCCIÓN La propagación descontrolada de especies nativas y no nativas se reporta en todo el mundo, siendo reconocida como uno de los principales problemas de manejo biológico de nuestros tiempos (Gacia et al.1996, Allendorf y Lundquist 2003, Dorlan y Martin 2004). Muchas de estas especies cambian los procesos, la dinámica y las propiedades de todo un ecosistema (Huenueke 1988, Mark et al. 2000, Byers 2002, Dorlan y Martin 2004). Estos organismos son exitosos ya que son capaces de explotar los recursos por su acelerado crecimiento, estrategias reproductivas exitosas y además reducen o eliminan a las poblaciones de especies con las que conviven (Lafferty y Kuris 1996, Vitousek et al. 1997, Bax et al. 2001). El impacto económico que estos organismos oportunistas causan ha promovido la investigación en todo el mundo, sin embargo, su manejo y control es controversial y muy complejo (Vitousek et al. 1996, Goodwin et al. 1999, Allendorf y Lundquist 2003). Específicamente, la propagación de especies marinas ha sido identificada como una de las mayores amenazas a la biodiversidad de los océanos. Muchas de las especies invasoras marinas ya se han establecido bien a nivel mundial y su control y manejo se encuentra aún en sus primeras etapas de investigación (Bax et al. 2001). Dentro del ambiente marino, la composición de las comunidades bénticas se ve profundamente modificada por la proliferación de especies oportunistas (Bax et al. 2001, Grall y Chauvaud 2002) ya que los organismos compiten fuertemente por espacio y recursos con otras especies (Vitousek et al. 1996, Goodwin et al. 1999, Allendorf y Lundquist 2003). Es así como una propagación de macroalgas bénticas puede modificar el equilibrio del ecosistema marino en su totalidad (Grall y Chauvaud 2002) Las macroalgas juegan un papel importante en los arrecifes tanto saludables como degradados, ya que la abundancia y composición de las macroalgas son críticas en la ecología, estética y valor económico del ambiente arrecifal (McCook 1999). Esto debido a que al ser productores primarios inician las cadenas tróficas y a la vez dan refugio a una gran cantidad de especies como: moluscos, cangrejos, poliquetos, equinodermos y peces, entre otros (Connell 1978). Otro factor importante es la competencia entre escleractineos y macroalgas. Este es un proceso crítico en determinar la abundancia de ambos grupos en los arrecifes, especialmente durante la degradación de estos ambientes por sobrepesca y procesos de eutroficación (McCook 2001). 52
72 En muchos lugares se han reportado cambios en la comunidades costeras, asociados a aumentos en la cobertura de especies de algas como Codium fragile (Suringar) Hariot (Ramus 1971), Sargassum muticum (Yendo) Fensholt (Viejo 1997), y en especial el género Caulerpa (Vahl) C. Agardh, tiene gran potencial para propagarse e invadir hectáreas de sustrato rocoso, arenoso o coralino (Verlaque y Fritayre 1994, Bellan-Santini et al. 1996). En muchos ambientes marinos las especies de este género han mostrado patrones de crecimiento masivo, cubriendo hasta miles de hectáreas de sustrato, lo que ha resultado en mortalidad de colonias de coral y disminución de la biodiversidad de peces, moluscos y otros organismos (Ceccherelli et al. 2000). Caulerpa taxifolia es una de las especies invasoras más estudiadas del ambiente marino (Meinesz y Hesse 1991, Meinesz et al. 1993, Smith y Walters 1999, Fama et al. 2002b). Es nativa de los mares tropicales, pero en los acuarios de Alemania se ha observado creciendo rápidamente en aguas frías (Dalton 2000). En 1984 se descubrieron grandes extensiones de esta especie en las costas de Francia, en el Mar Mediterráneo, adonde se cree que salió por accidente del Acuario de Mónaco (Kaiser 2000, Meusnier et al. 2001, 2002), desarrollándose conspicuamente entre los 0 y 30 m de profundidad (Belsher y Meinesz 1995). Esta especie ha reemplazado a las especies de algas y de pastos marinos nativos, alcanzando a cubrir Ha del suelo costero marino de seis naciones del Mediterráneo (Withgott 2002). En California, se le descubrió en el 2000 y su expansión ha causado cambios en la biodiversidad, así como efectos negativos en el turismo y en las pesquerías locales. Caulerpa racemosa, es otra especie que tiene la característica de propagarse fácilmente. Fue introducida al Mediterráneo posiblemente como inmigrante del Mar Rojo (Ceccherelli et al. 2000) y posee características similares, así como impactos biológicos parecidos al de C. taxifolia. En Panamá las cepas de C. sertularioides y C. racemosa aparecieron cubriendo el fondo marino en alfombras densas, entre julio 1988 y octubre 1989, en la Isla Uva, Golfo de Chiriquí. En este caso la propagación fue efímera, sin embargo, el resultado fue un 100% de mortalidad del coral Psammocora stellata por sobrecrecimiento y desplazamiento de otras especies de algas bénticas (Glynn y Maté 1997). Recientemente en Bahía Culebra en el Pacífico de Costa Rica, se ha observado una propagación de Caulerpa sertularioides en los últimos cinco años. Su efecto en las comunidades bénticas se refleja en el reemplazo de la flora algal, sobrecrecimiento en colonias de coral y cambios en la abundancia y diversidad de organismos (Fernández y Cortés 2005, Bezy et al. 2006). Muchos de los sitios en donde se ha observado el crecimiento rápido de C. sertularioides 53
73 son de gran importancia por su desarrollo arrecifal, tienen gran potencial turístico, e importancia para la pesca, así como para la extracción de peces para acuarios. Sin embargo hasta el momento no se ha cuantificado el efecto de la propagación del alga sobre los organismos arrecifales que conviven con esta alga. Este estudio describe y mide los efectos directos que provoca la propagación de C. sertularioides sobre los organismos de la bahía, especialmente los efectos del alga sobre los corales del género Pocillopora, que son los corales más abundantes de la bahía (Jiménez 1998), sobre las macroalgas y sobre otros invertebrados sésiles y no sésiles de las zonas rocosas y arenosas. En un estudio realizado por McCook et al. (2001) donde se analizan 57 artículos publicados sobre competencia entre 1974 y 1999 se encontró que solo 7 presentaron evidencia experimental de la interacción entre corales y algas y sus consecuencias, por lo que este estudio contribuirá con datos in situ para respaldar la hipótesis que la abundancia y distribución de las macroalgas pueden ser la causa, y no la consecuencia, de la degradación de los corales y en general del ecosistema arrecifal. MATERIALES Y MÉTODOS Área de estudio El presente trabajo se llevó acabo en Bahía Culebra (10º 35 N, 85º 40 O), Golfo de Papagayo, entre mayo 2004 y junio 2005 (ver Capítulo 1). Para determinar el efecto de C. sertularioides en los organismos bénticos, se realizaron recorridos por toda la bahía para explorar los sitios de muestreo y se escogieron tres sitios: Playa La Penca, Playa Blanca y Punta Arenilla (Fig. 3.1). Se realizaron una serie de mediciones en áreas con la presencia del alga y en áreas con ausencia de ésta, sobre los efectos en el crecimiento de coral, cambios en la diversidad y en la abundancia de invertebrados bénticos y otras macroalgas. Impacto de la cobertura y densidad de frondas de Caulerpa sertularioides sobre el coral Pocillopora elegans Para cuantificar el efecto del alga sobre el crecimiento del coral, se colocaron colonias de Pocillopora elegans en Playa La Penca a una profundidad de 6 m, las cuales fueron teñidas con alizarina roja siguiendo la metodología de Lamberts (1978). Se colocaron 13 colonias del coral, sujetas a varillas de acero de 20 cm de longitud, sobre un parche de C. sertularioides y otras 13 54
74 colonias en un sitio sin el alga a una distancia no mayor de 30 m unas de otras (Fig. 3.2 A y B). Se escogieron colonias de esta especie de coral por ser este el más abundante de la bahía según Jiménez (1998). Este tratamiento se repitió dos veces, dejando las colonias durante un periodo de siete meses. El primer periodo desde mayo 2004 a noviembre 2004 (incluyó la estación lluviosa) y el segundo desde diciembre 2004 a junio 2005 (incluyó la estación seca). Luego de la extracción de los corales, al finalizar cada época, se midieron 10 puntas de crecimiento de cada colonia con un Vernier (+0.05) y se obtuvo un promedio de crecimiento (cm/mes) por colonia. Se realizó un análisis de varianza de una vía (ANDEVA) para determinar diferencias entre los promedios del crecimiento de los corales situados en los parches del alga y los que no estuvieron expuestos a las algas, así como para determinar diferencias en el promedio de crecimiento entre la estación seca y la lluviosa. Además se midió el porcentaje de cobertura de C. sertularioides a lo largo de los meses de muestreo, por medio de 5 cuadrículas permanentes de 50 cm 2, marcadas con varillas, que fueron ubicadas en medio del parche del alga. En cada cuadrícula se contabilizó el número de frondas en 6 cuadrantes de 10 cm 2 escogidos por medio de una tabla de números al azar. Se realizó una prueba de varianza de una vía (ANDEVA) para determinar si existían diferencias entre la cobertura y la densidad de frondas entre las épocas. Impacto de la cobertura y densidad de frondas Caulerpa sertularioides sobre la diversidad y abundancia de otros organismos bénticos Para comparar la diversidad y abundancia de especies de invertebrados y macroalgas en sitios con presencia y ausencia de C. sertularioides se escogieron dos sitios rocosos a aproximadamente 3 m de profundidad. El primero ubicado en Playa La Penca donde se da un porcentaje de cobertura alta del alga verde y el segundo en Punta Arenilla (Fig. 3.1) donde el alga esta ausente. En cada sitio se realizaron 3 transectos de 10 m de largo, paralelos a la costa, distanciados unos de otros por 5 m. Cada transecto fue recorrido con una cuadrícula de 50 cm 2, completando un área total de 5 m 2 por transecto. En cada cuadrícula se contabilizaron e identificaron todos los invertebrados bénticos y en el caso de la abundancia de macroalgas se realizó mediante la presencia o ausencia en cada cuadrícula. Se utilizó una prueba no paramétrica de Kruskal-Wallis para determinar si existían diferencias en la abundancia de organismos en 55
75 ambos sitios y se realizó un análisis de la diversidad de los sitios mediante los índices de diversidad y uniformidad de Shannon-Wiener y el índice de dominancia de Simpson. Asimismo se realizaron conteos de poliquetos de la familia Sabellidae, los cuales habitan el fondo arenoso de Playa La Penca y de la cantidad de nudibranquios de la especie Elysia diomedea sobre las frondas del alga, en Playa Blanca, ya que en observaciones previas se notaron cambios en sus abundancias con la presencia de C. sertularioides. Ambos invertebrados fueron muestreados por medio de 10 cuadrículas de 50 cm 2 colocadas al azar en un sitio cubierto de C. sertularioides y en 10 cuadrículas de 50 cm 2 en un sitio descubierto del alga. Para el análisis estadístico se utilizó una prueba no paramétrica de Kruskal-Wallis para determinar diferencias entre la abundancia de los organismos en los sitios. En todos los análisis estadísticos se utilizó Systat 8.0. y JMP IN Fig Ubicación de los sitios de muestreo: Playa La Penca, Playa Blanca y Punta Arenilla, Bahía Culebra, Golfo de Papagayo, Pacífico norte de Costa Rica. 56
76 Fig Colonias de Pocillopora elegans teñidas con alizarina roja en Playa La Penca, Bahía Culebra. A. Colonias sobre un parche de arena sin C. sertularioides, B. Colonias sobre un parche de C. sertularioides. RESULTADOS Impacto de la cobertura y densidad de frondas Caulerpa sertularioides sobre el coral Pocillopora elegans Al finalizar el primer periodo (mayo 2004 a noviembre 2004, estación lluviosa) del experimento sobre el crecimiento de P. elegans, se lograron recuperar vivas las 26 colonias que se colocaron inicialmente, mientras que en el segundo periodo (diciembre 2004 a junio 2005, estación seca), se recuperaron solamente 12 colonias vivas. En este segundo periodo muchas de las colonias muertas se encontraron cubiertas de arena (Cuadro 3.1) y al final del experimento el alga logró llegar hasta las colonias que se encontraban en el parche de arena con ausencia de esta. Es importante recalcar que durante la mayor parte del periodo de estudio, se observaron cangrejos de los géneros Trapezia sp. y Stenorhynchus sp. (cangrejo flecha) entre las ramas de las colonias de P. elegans. Especialmente los cangrejos del género Trapezia se observaron cortando las algas que crecían sobre el coral. Al analizar al crecimiento de P. elegans se obtuvieron diferencias significativas en los sitios con y sin Caulerpa y entre las épocas muestreadas (F 3,34 =15.7, p< ), dándose un 57
77 mayor crecimiento en las colonias en el sitio sin el alga (Fig. 3.3., Cuadro 3.1) y un mayor crecimiento en la época lluviosa (Fig. 3.3., Cuadro 3.1). El máximo crecimiento medido de P. elegans fue de 3.5 cm/mes en la época lluviosa, en una colonia sobre un parche de arena sin C. sertularioides, mientras que el mínimo crecimiento, 0.2 cm/mes, se encontró en una colonia, sobre el parche de C. sertularioides, en la época seca (Cuadro 3.1). Al analizar el cambio en la cobertura y la densidad de frondas de C. sertularioides en Playa La Penca se obtuvieron diferencias significativas entre las dos épocas (F 2,189 =4.7, p<0.05; F 2,189 = 3.4, p<0.05, respectivamente), dándose mayor cobertura del alga y mayor densidad de frondas en la época seca (Fig. 3.4). Cuadro 3.1. Crecimiento promedio (+ desviación estándar), máximo y mínimo (mm/mes) medidos en las colonias del coral Pocillopora elegans en un sitio con C. sertularioides y en un sitio sin C. sertularioides, entre mayo 2004 y junio 2005 en Bahía Culebra, Golfo de Papagayo. Con Caulerpa Sin Caulerpa Diferencia del promedio Lluviosa n=13 Max=2.9 Min=0.6 n=13 Max=3.5 Min= Seca n=7 Max=2.4 Min=0.2 n=5 Max=1.7 Min=
78 Fig Crecimiento promedio y desviación estándar de Pocillopora elegans en sitios con y sin Caulerpa en época lluviosa (mayo 2004 a noviembre 2004) y seca (diciembre 2004 a junio 2005) en Playa La Penca, Bahía Culebra. Fig Promedio y desviación estándar del porcentaje cobertura y densidad de frondas (# frondas/10 cm 2 ) de C. sertularioides, en época seca y en época lluviosa, entre mayo 2004 y junio 2005, en Playa La Penca, Bahía Culebra. 59
79 Impacto de la cobertura y densidad de frondas Caulerpa sertularioides sobre la diversidad y abundancia de otros organismos bénticos En los transectos realizados, se obtuvieron nueve especies de algas y 19 especies de invertebrados en Playa La Penca con la presencia de C. sertularioides, mientras que en Punta Arenilla con ausencia de C. sertularioides se obtuvieron 17 especies de macroalgas y 20 especies de invertebrados bénticos (Cuadro 3.2 y 3.3). Según el Índice de Jackard ambos sitios se asemejan en un 60% y no se encontraron diferencias significativas en la abundancia de macroalgas (KW=110.0, p= gl=1, n=34) y en la abundancia de invertebrados bénticos (KW=273.0, p= 0.851, gl=1, n=46) de ambos sitios. Es importante indicar que aunque no se obtuvieron diferencias en la abundancia de especies de macroalgas de los sitios con y sin C. sertularioides, sí obtuvo una diferencia al comparar la diversidad de los sitios (t= 9.064, p<0.005). En el sitio con el alga (Playa la Penca) se da una disminución de especies de macroalgas. Las especies Bryopsis pennata, Codium isabelae, Halimeda discoidea, Dictyopteris delicatula, dos algas rojas no identificadas, Spatoglossum sp. y Colpomenia sinuosa, muy comunes en toda la bahía, disminuyeron en presencia de C. sertularioides (Cuadro 3.2). Asimismo se encontraron diferencias significativas al comparar la diversidad de organismos bénticos en los sitios con presencia y ausencia del alga (t= 9.332, p<0.005). Al desglosar el número de organismos por especie, como se indica en el Cuadro 3.3, se observó que hay especies que disminuyen drásticamente su abundancia cuando está presente el alga como las anémonas y los poliquetos de la familia Serpulidae o aumentan su abundancia como los cangrejos hermitaños, los cangrejos flecha, los briozoarios y las ascidias. Según los resultados del índice de Shannon-Wiener, el sitio con presencia C. sertularioides posee mayor equidad tanto para las macroalgas (82%) como para los invertebrados bénticos (44%), comparado con el sitio sin el alga (macroalgas 63%, invertebrados 23%) (Cuadro 3.2 y 3.4). Al analizar los resultados de las cuadrículas de poliquetos de la Familia Sabellidae sobre sustrato arenoso de dos sitios con la presencia y ausencia de C. sertularioides se obtuvieron diferencias significativas en el número promedio de gusanos por cuadrícula (KW = 100.0, p= 0.000, gl=1, n=10), dándose un mayor número de poliquetos en el sitio cubierto por C. sertularioides. Lo mismo sucedió al analizar la cantidad de nudibranquios del género Elysia 60
80 diomedea, obteniéndose una diferencias significativas en los dos sitios (KW=99.5, p=0.000, gl=1, n=10), con una mayor cantidad de nudibranquios sobre las frondas de C. sertularioides, en comparación con la cantidad de nudibranquios presentes en un parche de algas sin C. sertularioides (Cuadro 3.4). Cuadro 3.2. Índices de diversidad y número total de cuadrículas donde aparecieron de macroalgas encontradas en los transectos en Playa La Penca y Punta Arenilla, Bahía Culebra, Golfo de Papagayo. División Especie Playa La Penca Presencia de C. sertularioides Punta Arenilla Ausencia de C. sertularioides Cianophyta Cianobacteria Chlorophyta Cladophora sp Caulerpa peltata 3 2 Bryopsis pennata 0 41 Codium isabelae 0 2 Halimeda discoidea 0 2 Phaeophyta Dictyota spp Padina sp Dictyopteris delicatula 0 6 Spatoglossum sp. 0 9 Colpomenia sinuosa 0 4 Rhodophyta Algas calcáreas Amphiroa spp Polysiphonia sp Laurencia sp Roja no identificada Roja no identificada N Total de especies 9 17 Índice de Simpson Índice de Shannon Hmax J
81 Cuadro 3.3. Índices de Diversidad y densidad (ind/m 2 ) de invertebrados encontrados en los transectos en Playa La Penca y Punta Arenilla, Bahía Culebra, Golfo de Papagayo. Filo Especie Playa La Penca Presencia de C. sertularioides Punta Arenilla Ausencia de C. sertularioides Porifera Esponja Cnidaria Pocillopora spp Anémona Mollusca Fam. Muricidae Fam. Collumbelidae Conus nux Jenneria pustulata Opeatostoma pseudodon Nudibranquios Ostras Pulpo Crustacea Cangrejo Cangrejo hermitaño Stenorhynchus sp Trapezia sp Camarones Panulirus sp Polychaeta Fam. Serpulidae Echinodermata Holoturoidea Ophiocoma aethiops Diadema mexicanum Briozoa Brizoario Chordata Ascidias N Total de especies Índice de Simpson Índice de Shannon Hmax J
82 Cuadro 3.4. Promedio y desviación estándar de la densidad de nudibranquios y poliquetos en sitios con presencia y ausencia de C. sertularioides. Grupo taxonómico Especie Densidad con presencia de C. sertularioides Densidad con ausencia de C. sertularioides Nudibranquia Elysia diomedea ind/50 cm ind/50 cm 2 Polychaeta Fam. Sabellidae ind/50 cm ind/50 cm 2 DISCUSIÓN Impacto de la cobertura y densidad de frondas Caulerpa sertularioides sobre el coral Pocillopora elegans En Bahía Culebra, la propagación de C. sertularioides está afectando la tasa de crecimiento de la colonias de Pocillopora elegans. La tasa de crecimiento del coral es una medida frecuentemente usada como un indicador de la salud ambiental del ecosistema arrecifal, dado que el estrés fisiológico por cambios en el ambiente está asociado con un descenso en las tasas de crecimiento de las diferentes especies de coral (Cortés y Risk 1985, Edinger et al. 2000). Las interacciones entre algas y corales es un proceso importante, que determina la estructura y composición de las comunidades bénticas en los arrecifes coralinos (Little 2000, McCook 2001). Muchos autores señalan que las algas compiten fuertemente con los corales por el espacio, inhiben el reclutamiento de larvas, bloquean la penetración de luz y pueden sobrecrecer las colonias o afectar físicamente el tejido por el roce de las frondas (Kinsey 1987). Otros estudios apuntan que el incremento en la abundancia de las macroalgas puede ser una consecuencia y no la causa de la mortalidad de coral. Sin embargo, evidencias experimentales indican que la competencia entre las macroalgas y los corales puede inhibir el crecimiento y la sobrevivencia de estos (Hughes 1979, Miller y Hay 1996, McCook et al. 2001), aunque estos experimentos son todavía muy escasos (McCook et al. 2001). Solo algunos de ellos 63
83 han demostrado las interacciones entre los corales y las algas. En el Caribe se observó el sobrecrecimiento y abrasión de algas (especialmente de Sargassum hystrix) en el coral Porites astreoides, la inhibición del reclutamiento del coral Oculina arbusculata y la disminución en el crecimiento de Acropora spp. (River y Edmunds 2001). Según McCook et al. (2001) y River y Edmunds (2001), las algas pueden afectar a los corales por medio de varios mecanismos: 1) sobrecrecimiento, 2) sombreado, 3) abrasión, 4) liberación de químicos, 5) barrera para el reclutamiento y 6) modificación del flujo de sedimentos y corrientes en el ambiente béntico. En Bahía Culebra, C. sertularioides afecta los corales por acumulación de sedimento. Se ha demostrado que en las aglomeraciones de algas generalmente el sedimento es atrapado y muchas veces los invertebrados sésiles son dañados al ser cubiertos por las partículas de sedimento (Fabricius 2005). Además, se da interferencia en el crecimiento del coral por sobrecrecimiento del tejido de coral (Fig. 3.5 A) y por la constante abrasión de las frondas sobre el tejido vivo del coral (Fig. 3.5 B). La medida en que el alga afecta los corales varía con la cobertura del alga y la densidad de las frondas. Aunque se observó C. sertularioides sobrecreciendo las colonias de P. elegans (Fig. 3.5 A), parece no haber un efecto en la sobrevivencia del coral, debido a la presencia de cangrejos que defienden a las colonias, liberando a su hospedero de los efectos de las macroalgas al cortar las frondas. Estos cangrejos han desarrollado en conjunto con el coral una relación mutualista donde el coral aporta protección y alimentación de lípidos por medio de mucus al cangrejo y este le brinda protección de depredadores como estrellas y erizos de mar (Castro 1978, 1982, Stimson 1990). La abrasión de las frondas de C. sertularioides sobre las colonias de P. elegans es la principal causa de la disminución en las tasas de crecimiento encontradas en este estudio. Este mecanismo de competencia causa la retracción de los pólipos y en muchos casos se ha observado que la retracción constante reduce el crecimiento de los corales, ya que se limita el acceso a energía y metabolitos necesarios para el crecimiento y calcificación (River y Edmunds 2001). Además, se ha documentado que los pocilopóridos tienen capacidad de depredación (Titlyanov et al. 2000) y los pólipos retraídos no pueden capturar zooplancton y se ven reducidas las tasas de fotosíntesis de las zooxantelas (River y Edmunds 2001). 64
84 A. 1 cm B. C. 1 cm 1cm Fig Interacciones entre las colonias de los corales de Bahía Culebra y el alga C. sertularioides. A. Sobrecrecimiento de C. sertularioides sobre una colonia de Pocillopora elegans, B. Roce de las frondas del alga en una colonia de Pocillopora sp., C. Roce de las frondas del alga en una colonia de Psammocora stellata. Caulerpa sertularioides esta afectando el crecimiento de P. elegans en gran medida, ya que en condiciones normales el crecimiento de las colonias de coral por lo general es mayor en época seca, como lo demuestran los estudios en Bahía Culebra (Jiménez y Cortés 2003) y en la Isla de Caño (Guzmán y Cortés 1989). Esto se debe a que en la época lluviosa aumenta la turbidez del agua por el material suspendido, hay menos luz y aumenta la tasa de sedimentación por lo que el crecimiento de las colonias de coral disminuye. Sin embargo, al estar expuestas las colonias del coral en competencia con C. sertularioides la tasa de crecimiento es menor en época seca, que es cuando la cobertura del alga es mayor (35%) que en época lluviosa (24% de cobertura) (Cuadro 3.5). 65
85 Este cambio en la cobertura durante las diferentes épocas se da por el incremento en los nutrimentos y disminución en la temperatura que favorecen el crecimiento del alga durante la época seca (Capítulo 2), ya que esta zona está fuertemente influenciada por los vientos alisios del noreste, que se dan entre noviembre y abril. Estos vientos desplazan el agua superficial en dirección opuesta a la costa, la cual es sustituida por aguas de fondo, ricas en nutrimentos y de baja temperatura. Cuadro 3.5. Promedio del crecimiento (mm/mes) del coral Pocillopora elegans en el Pacífico Oriental. Sitio Crecimiento (mm/mes) Profundidad (m) Referencia Bahía Culebra con C. sertularioides 1.39 (época lluviosa) 1.10 (época seca) 6 Este estudio Bahía Culebra Islas Murciélago Jiménez y Cortés Jiménez y Cortés 2003 Islas Galápagos Glynn 1994 Isla del Caño Guzmán y Cortés 1989 Isla del Caño Guzmán y Cortés 1989 En Bahía Culebra, la propagación de C. sertularioides no solo afecta a los corales pocilopóridos. En otro estudio realizado por Bezy et al. (2006), mostró un descenso en la cobertura de un 95% del coral Psammocora stellata en Playa La Penca (Fig. 3.1), por sobrecrecimiento del alga (Fig. 3.5 C), con un descenso en la cobertura de este coral de 0.3 hectáreas a solo 1-3 m 2. En condiciones de alta cobertura del alga, P. stellata no puede competir contra ésta por espacio. Esto mismo encontraron Glynn y Maté (1997), en la Isla Uva en Panamá, con una propagación de C. sertularioides y C. racemosa, en este caso se reportó un 100 % de mortalidad de la comunidad de Psammocora. Una disminución en el crecimiento del coral sugiere una degradación de los ambientes marinos de Bahía Culebra, que es consecuencia de la influencia antropogénica que rodea estos ambientes. 66
86 Impacto de la cobertura y densidad de frondas Caulerpa sertularioides sobre la diversidad y abundancia de otros organismos bénticos En general, la propagación de C. sertularioides da como resultado una alteración en la dinámica y composición del ecosistema, notándose en cambios de la abundancia de especies. Donde hay especies que se ven disminuidas por eliminación de sus hábitats, depredación o competencia o al contrario son favorecidas. En los transectos realizados en el sitio sin Caulerpa se comprobó la ausencia de algunas especies de algas que son muy comunes en toda la bahía. Esto se da por la presión competitiva por espacio que se da entre las algas. El desplazamiento de algas por otras oportunistas es un evento reportado ampliamente, lo que resulta en cambios en la composición de especies y en las cadenas tróficas del ecosistema (Piazzi et al. 2001). En el Mediterráneo, las algas C. taxifolia y C. racemosa han reemplazado otras especies de algas y pastos marinos, creando ambientes estructuralmente más simples y con una baja complejidad trófica. Ambas algas se observaron afectando la abundancia de algas filamentosas e incrustantes (Piazzi et al. 2001). La propagación de C. sertularioides no afecta la diversidad de invertebrados en el ambiente béntico del arrecife, sin embargo sí afecta la abundancia de éstos. En el caso de las especies de invertebrados que disminuyen su abundancia cuando está presente el alga se encuentran las anémonas y los poliquetos de la familia Serpulidae. Estos dos grupos de organismos tienen larvas que requieren de espacios libres para asentarse, espacio que no encuentran con el alga cubriendo las rocas. Especialmente los serpúlidos son gusanos sésiles que construyen tubos de carbonato de calcio adheridos a las rocas (Day 1983, Little 2000). Además, las algas atrapan sedimentos entre sus frondas por lo que los invertebrados incrustantes como los corales, anémonas, poliquetos, entre otros, son afectados por esta situación, especialmente en superficies horizontales (Day 1983, Fabricius 2005). A la vez, las algas pueden interferir con las estructuras alimentarias de algunos animales sésiles, como por ejemplo con los cirros de los cirripedios y los tentáculos de los poliquetos (Day 1983). Otros organismos por el contrario aumentan su abundancia como los cangrejos hermitaños, los briozoarios y las ascidias. En el caso de los briozoarios, estos utilizan las frondas del alga para crecer y las ascidias se logran ocultar entre las algas evitando depredadores. Los briozoarios grandes parecen ser menos afectados por las algas, lo que sugiere que los efectos de las algas son más perjudiciales sobre los juveniles (Rydland 1960, Day 1983). 67
87 Dos casos muy significativos medidos a lo largo del estudio fueron los poliquetos de la familia Sabellidae que habitan los fondos arenosos de la bahía y de los nudibranquios Elysia diomedea. En ambos casos la presencia de C. sertularioides hace que aumente la cantidad de estos animales. En el caso de los poliquetos de la Familia Sabellidae, las frondas del alga le brindan protección contra depredadores al cubrir el tubo proteínico y sus tentáculos. Asimismo, el alga es un sustrato donde se acumula materia orgánica, principal fuente de alimento de este organismo (Little 2000). Se ha descubierto que hay poliquetos de esta familia que se benefician de camas de algas donde se depositan sedimentos y materia orgánica. Esta materia natural proviene de los desechos de los organismos y de las células muertas que caen de la columna de agua (Sempéré y Cauwet 1995) y se acumulan entre las frondas de C. sertularioides. Se ha observado que en sitios donde hay exceso de materia orgánica se favorece a organismos que aprovechan este recurso como los gusanos y en consecuencia aumenta su número en el bentos (Little 2000). Lo mismo sucede al analizar la cantidad de nudibranquios Elysia diomedea, donde la presencia de C. sertularioides favorece la presencia de estos sobre las frondas del alga. Elysia diomedea es el nudibranquio más común de la costa Pacífica de Costa Rica, su coloración verdosa le permite camuflarse en las fronda de C. sertularioides evitando así a sus depredadores. Generalmente este molusco habita la zona intermareal, en sustratos rocosos o arenosos y arrecifes y siempre está asociado con algas. Se especula que se alimenta de algas verdes de las que obtiene los cloroplastos, pero esto no ha sido probado todavía, es probable que este nudibranquio también esté aprovechando la materia orgánica que se acumula en las frondas de C. sertularioides o de los epífilos rojos que en ciertas épocas de año crecen abundantemente sobre las frondas del alga verde. En el Caribe se han observado nudibranquios del género Elysia alimentándose de especies de Caulerpa, al hacer una incisión en el alga con su rádula y succiona el material líquido de la célula. Actualmente se están realizando estudios sobre estos nudibranquios para utilizarlos como control biológico de C. taxifolia en el Mediterráneo (Clark et al. 1979, Thibaut et al. 2001). En toda la dinámica de competencia entre las algas y los invertebrados es importante resaltar que la herbivoría juega un papel importante, ya que controlan el crecimiento de las algas. La transferencia de la producción primaria a los herbívoros es aceptada como uno de los mayores flujos de energía en las cadenas alimenticias de los arrecifes coralinos (McCook 1999) y en muchas áreas arrecifales, la sobrepesca ha causado la disminución en el tamaño de los peces y en 68
88 la abundancia de los mismos, provocando que muchas especies comerciales hayan casi desaparecido por completo (Little 2000). Bahía Culebra se distingue por ser un sitio donde se da ampliamente la pesca de buceo con compresor y una actividad intensa de extracción de peces de más de 30 especies diferentes y erizos para acuarios (Jiménez 1998 y obs. pers.). Según estudios de Dominici et al. (2005) con peces de arrecife, en Bahía Culebra son más abundantes los peces planctívoros y depredadores de invertebrados en comparación con los herbívoros. Estos últimos tiene bajas abundancias en comparación con otros sitios como el Atlántico este tropical incluyendo algunas áreas de Brasil. Por lo tanto en Bahía Culebra se da una fuerte eliminación del grupo de peces herbívoros, que posiblemente ha favorecido el desarrollo de C. sertularioides. La biomasa de las algas puede acumularse si la producción de tejido es mayor a la pérdida total de esta por herbívoros, esto solo puede suceder si los herbívoros están reducidos, si las tasas de crecimiento de las algas son lo suficientemente aceleradas como para saturar a los herbívoros o una combinación de ambas cosas (McCook 1999). Es bien sabido que los herbívoros protegen a las comunidades arrecifales de cambios en la producción de algas especialmente en ambientes eutróficos (McCook et al. 2001), como lo es Bahía Culebra. Pero la habilidad de estos herbívoros de controlar las algas puede verse disminuida cuando estas poblaciones son bajas ya sea naturalmente o artificialmente (Littler y Littler 1986, McCook et al. 2001). En conclusión, la propagación de C. sertularioides esta causando modificaciones en la estructura de las comunidades bénticas, disminuyendo el crecimiento de los corales ramosos, como Pocillopora, por abrasión, acumulación de sedimento y matando las colonias del coral Psammocora stellata por sobrecrecimiento. Asimismo, se dan cambios en la abundancia y composición de especies bénticas en los sitios donde se encuentra, por disminución de especies de otras algas y especies de invertebrados o por el contrario, aumento de especies oportunistas como nudibranquios y poliquetos. Asimismo la presencia de herbívoros juega un papel importante en la dinámica de C. sertularioides, por lo que es necesario realizar estudios sobre abundancia, diversidad, biomasa y sobrepesca de estas especies. 69
89 Capítulo 4. Consideraciones sociales y ambientales para el manejo de la propagación del alga verde Caulerpa sertularioides en el ambiente marino de Bahía Culebra, Golfo de Papagayo, Costa Rica RESUMEN Los ambientes arrecifales de Bahía Culebra en el Golfo de Papagayo son económica y ecológicamente muy importantes para Costa Rica. Recientemente en la bahía se describió una propagación del alga verde C. sertularioides, cuyas consecuencias se reflejan en el reemplazo de la flora algal, sobrecrecimiento y limitación en el crecimiento de colonias de coral y cambios en la abundancia de invertebrados marinos. En este trabajo se discute la problemática ambiental de la propagación de esta especie y como se favorece por factores naturales y por las actividades humanas. Asimismo se presenta la percepción de los usuarios de los recursos de la bahía y se discuten posibles recomendaciones para el manejo de esta especie. Muchos de los usuarios de la bahía se muestran preocupados por la presencia del alga y están concientes que esta afecta el equilibrio del ecosistema, y aseveran que el alga afecta su actividad, ya sea pesca, turismo o por la disminución de especies en los sitios donde el alga es muy abundante. La sinergia entre factores humanos y naturales son los que determinantes en la propagación de esta especie en la bahía. Esta alga ha logrado colonizar muchos ambientes de la bahía por sus características de ágil propagación como lo son: la dispersión por corte de frondas, reproducción sexual que da variación genética y la fácil adaptación a diversos ambientes de profundidad y sustrato, lo cual se ve favorecido por las temperaturas frías, nutrimentos que afloran en la época seca, por la escorrentía en la época lluviosa y por eliminación de herbívoros, como peces y erizos, por la pesca para acuarios. Asimismo, la mayoría de los encuestados aceptan que se ha dado corte de frondas por las anclas de sus embarcaciones lo que favorece la dispersión del alga por su crecimiento clonal. En Bahía Culebra de acuerdo con estos resultados, se desprenden las siguientes recomendaciones: 1) estudiar con mayor precisión las comunidades de herbívoros, 2) protección y monitoreo de sitios donde actualmente no se da el crecimiento del alga o esta se encuentra en baja cobertura, 3) extracción manual entre junio y julio donde la cobertura y el área de los parches disminuyen, 4) realizar una campaña divulgativa para evitar el desprendimiento de trozos del alga y 5) continuar con los monitoreos de nutrimentos en las zonas de construcción y de riego de zonas verdes para determinar posibles vertimientos de estos en el agua. 6) Reglamento de actividades responsables con los operadores de turismo. 70
90 INTRODUCCIÓN Los ambientes arrecifales de Bahía Culebra en el Golfo de Papagayo son económicamente y ecológicamente muy importantes para Costa Rica. En las políticas de desarrollo costero el gobierno de Costa Rica designó a Bahía Culebra y las áreas adyacentes como un polo para el turismo de gran escala. Bajo este contexto se han concesionado, a partir de 1972, terrenos sobre las playas y los cerros para la construcción y operación de complejos hoteleros y otras obras de infraestructura tales como, marinas, carreteras de acceso privado, canchas de golf, áreas verdes, hoteles y casas. Mucha de esta ifraestructura ya ha sido construida y se encuentra brindando servicios, mientras que otras obras están en desarrollo, o bien, están en etapa de planeamiento (Jiménez 2001, Rodríguez 2005). Esta bahía consiste de un sistema de ensenadas, pequeñas bahías, playas y estuarios que son continuamente utilizadas por turistas y por personas que se dedican a la extracción comercial de recursos marinos como peces, ostras y pulpos. A la vez, varios centros de buceo, locales y externos, a lo largo del año, llevan turistas a bucear en los arrecifes de la bahía. En una entrevista realizada a los operadores de turismo, se encontró que estos utilizan principalmente 15 distintos sitios para realizar tours de buceo y snorkel: Playa Hermosa, Punta Flor, Ocotal, Islas Huevos, Playa del Coco, Playa Blanca, Bajo Mero, Islas Pelonas, Playa Panamá, Punta Cacique, Bahía Viradores, Islas Viradores, Punta Gorda, Bahía Manzanillo y Playa Nacascolito. Los pescadores con compresor utilizan sitios como Punta Toneles, Bahía Iguanita y Punta Arenilla. Dentro y fuera de la bahía, se pueden encontrar 20 áreas arrecifales descritas ya sea como estructuras de arrecifes coralinos, comunidades coralinas en basalto y comunidades coralinas en arena. Se han reportado 16 especies de coral de 7 géneros en Bahía Culebra, dos de los cuales son extremadamente escasos en el Pacífico Oriental (Jiménez 2001). En total se han reportado 33 especies de corales a lo largo de toda la costa Pacífica de Costa Rica (Cortés y Jiménez 2003); por lo que, Bahía Culebra es un área de alta diversidad de corales. Las investigaciones hechas en la zona muestran que estos arrecifes poseen altos valores de diversidad y/o son estructuras importantes, bien desarrolladas y muchas son únicas en el Pacífico Este Tropical. Muestreos recientes en Bahía Culebra han revelado una propagación del alga verde C. sertularioides en los últimos años, cuyas consecuencias se han notado en el reemplazo de la flora algal, sobrecrecimiento y limitación en el crecimiento de colonias de coral y cambios en la 71
91 abundancia de invertebrados marinos tales como cangrejos, esponjas, anémonas y poliquetos entre otros (Fernández y Cortés 2005, Bezy et al. 2006). En Bahía Culebra, C. sertularioides se desarrolla principalmente desde la línea intermareal, en pozas entremareas, donde en marea baja llega el rocío de las olas hasta profundidades de 17 m. Se observa en extensiones continuas que han colonizado gran cantidad de sustratos incluyendo rocas, arena, corales vivos y muertos. En algunas zonas, entre 3 y 6 m de profundidad alcanza la mayor cobertura en el sustrato que puede llegar casi al 100%, con densidades de hasta 108 frondas por cada 10 cm 2. Después de los 12 a 15 m de profundidad, la densidad y cobertura del alga cae a estolones aislados y poco densos en frondas. El alga ha logrado colonizar una gran cantidad de sitios a lo largo de la bahía (Fig. 4.1) y en sitios como Ocotal, Playa La Penca y Playa Blanca se han desarrollado parches muy densos y extensos. En Islas Huevos, Islas Pelonas y Punta Flor los parches llegan a alcanzar grandes extensiones pero suelen ser temporales. El objetivo de este trabajo es discutir la problemática ambiental de la propagación de esta especie y cómo se favorece por factores naturales y por las actividades humanas. Asimismo se presenta la percepción de los usuarios de los recursos de la bahía y se integran posibles recomendaciones para el manejo de esta especie. MATERIALES Y MÉTODOS El presente trabajo se llevó acabo en Bahía Culebra (10º 35 N, 85º 40 O), ubicada dentro del Golfo de Papagayo en el litoral norte del Pacífico costarricense, desde agosto 2003 hasta marzo 2005 (Fig. 4.1). Para analizar la percepción que tienen los usuarios de los recursos de la bahía con respecto a este problema se realizó una encuesta entre setiembre y noviembre del 2004 (Anexo 1). Todos los entrevistados tuvieron entre 3 y más de 10 años de bucear en los ambientes marinos de la bahía, con dos actividades principales: la extracción de recursos (36% de los entrevistados) y el buceo recreativo (64% de los entrevistados). 72
92 Fig.4.1. Localización del área de estudio y de los sitios con presencia o ausencia de parches de C. sertularioides a lo largo de Bahía Culebra, Golfo de Papagayo. Los puntos negros indican presencia del alga y las x indican ausencia de esta. 73
93 RESULTADOS Y DISCUSIÓN Muchos de los usuarios de la bahía se muestran preocupados por la presencia del alga y están conscientes que el esta afecta el ambiente, afirmando que adonde esta el alga no hay diversidad de animales, como las ostras y peces, entre otros. Indicaron que el alga cubre las rocas eliminando los animales, cubre otras algas que comen los peces, ahoga a los corales, cubre el sustrato y en general afecta el equilibrio del ecosistema (Fig. 4.2). La mayoría de los encuestados asevera que el alga afecta su actividad, en el caso de los pescadores porque en los sitios donde está el alga casi no hay peces, pulpos, ni ostras. Para los operadores de turismo afecta la diversidad de peces que es lo que buscan como atractivo los turistas de buceo y en general afecta el ambiente arrecifal. En muchos casos los operadores de buceo no llevan a turistas a estos sitios ya que no llaman la atención y alegan que estos ambientes con C. sertularioides son muy monótonos (Fig. 4.2). La mayoría de los encuestados aceptan que se ha dado corte de frondas por las anclas de sus embarcaciones y han observado turistas inexpertos cortando trozos del alga con sus aletas (Fig. 4.2). Esto favorece la dispersión del alga, ya que los fragmentos pueden recrecer y formar un talo nuevo. El crecimiento clonal es la forma más efectiva en los ambientes acuáticos y muchas plantas y algas se fragmentan fácilmente y sus partes pueden convertirse en un clon independiente. Estos fragmentos se multiplican y se dispersan fácilmente por corrientes (Begon et al. 1996). Una vez que el alga ha colonizado un sustrato nuevo, esta expande su estolón y el número de frondas, fluctuando con las condiciones ambientales de cada mes. Fig Observaciones y opiniones de los entrevistados con respecto a diferentes situaciones que se presentan entorno a la propagación del alga Caulerpa sertularioides en Bahía Culebra. 74
Sertularioides en el pacífico de Costa Rica
 Propagación del alga verde Caulerpa Sertularioides en el pacífico de Costa Rica Cindy Fernández García * Jorge Cortés Núñez * Resumen * Escuela de Biología, Universidad de Costa Rica y Centro de Investigación
Propagación del alga verde Caulerpa Sertularioides en el pacífico de Costa Rica Cindy Fernández García * Jorge Cortés Núñez * Resumen * Escuela de Biología, Universidad de Costa Rica y Centro de Investigación
ESTRUCTURA COMUNITARIA DE ERIZOS DE MAR (Echinoidea: Regularia) EN EL COMPLEJO INSULAR ESPÍRITU SANTO-LA PARTIDA BAJA CALIFORNIA SUR, MÉXICO
 XX CONGRESO NACIONAL DE CIENCIA Y TECNOLOGÍA DEL MAR ESTRUCTURA COMUNITARIA DE ERIZOS DE MAR (Echinoidea: Regularia) EN EL COMPLEJO INSULAR ESPÍRITU SANTO-LA PARTIDA BAJA CALIFORNIA SUR, MÉXICO Por: José
XX CONGRESO NACIONAL DE CIENCIA Y TECNOLOGÍA DEL MAR ESTRUCTURA COMUNITARIA DE ERIZOS DE MAR (Echinoidea: Regularia) EN EL COMPLEJO INSULAR ESPÍRITU SANTO-LA PARTIDA BAJA CALIFORNIA SUR, MÉXICO Por: José
ESTIMACIÓN DE PRODUCCIÓN PRIMARIA DEL FITOPLANCTON DE BAHIA MAGDALENA BCS, MÉXICO (FASE II).
 ESTIMACIÓN DE PRODUCCIÓN PRIMARIA DEL FITOPLANCTON DE BAHIA MAGDALENA BCS, MÉXICO (FASE II). Resumen.- En el periodo de febrero a diciembre del 7 se realizaron seis muestreos en catorce estaciones de Bahía
ESTIMACIÓN DE PRODUCCIÓN PRIMARIA DEL FITOPLANCTON DE BAHIA MAGDALENA BCS, MÉXICO (FASE II). Resumen.- En el periodo de febrero a diciembre del 7 se realizaron seis muestreos en catorce estaciones de Bahía
Riqueza y distribución florística de comunidades de macroalgas marinas en Water Cay, Cayos Perlas; RAAS Nicaragua, años 2007 y 2008
 Riqueza y distribución florística de comunidades de macroalgas marinas en Water Cay, Cayos Perlas; RAAS Nicaragua, años 2007 y 2008 Autores: Br. Levy C. Coleman Morris Br. Delrey W. Simon Chavarría Tutor:
Riqueza y distribución florística de comunidades de macroalgas marinas en Water Cay, Cayos Perlas; RAAS Nicaragua, años 2007 y 2008 Autores: Br. Levy C. Coleman Morris Br. Delrey W. Simon Chavarría Tutor:
ANEXO FOTOGRAFICO. Imágenes de los diferentes tipos de fondos marinos presentes en la zona marina de Chabihau, Yucatán.
 ANEXO FOTOGRAFICO Imágenes de los diferentes tipos de fondos marinos presentes en la zona marina de Chabihau, Yucatán. Se trazaron 4 transectos de Norte a Sur con una separación de aproximadamente 500
ANEXO FOTOGRAFICO Imágenes de los diferentes tipos de fondos marinos presentes en la zona marina de Chabihau, Yucatán. Se trazaron 4 transectos de Norte a Sur con una separación de aproximadamente 500
Distribución y abundancia del género Ulva (CHLOROPHYTA), en la Bahía de La Paz, México
 Distribución y abundancia del género Ulva (CHLOROPHYTA), en la Bahía de La Paz, México M. C. Chávez-Sánchez Tonatiuh, Dra. Piñón-Gimate Alejandra y Dra. Casas-Valdez María Margarita 1 1. Introducción Las
Distribución y abundancia del género Ulva (CHLOROPHYTA), en la Bahía de La Paz, México M. C. Chávez-Sánchez Tonatiuh, Dra. Piñón-Gimate Alejandra y Dra. Casas-Valdez María Margarita 1 1. Introducción Las
VARIACIÓN TEMPORAL DEL FUNCIONAMIENTO DE UNA LAGUNA FACULTATIVA UBICADA EN LA COSTA DE LA PATAGONIA (42 º S; ARGENTINA)
 8 th IWA Specialist Group Conference on Waste Stabilization Ponds 2 nd Latin-American Conferenfe on Waste Stabilization Ponds VARIACIÓN TEMPORAL DEL FUNCIONAMIENTO DE UNA LAGUNA FACULTATIVA UBICADA EN
8 th IWA Specialist Group Conference on Waste Stabilization Ponds 2 nd Latin-American Conferenfe on Waste Stabilization Ponds VARIACIÓN TEMPORAL DEL FUNCIONAMIENTO DE UNA LAGUNA FACULTATIVA UBICADA EN
Arribazón atípica de sargazo en el Caribe mexicano
 1 Arribazón atípica de sargazo en el Caribe mexicano I. INTRODUCCIÓN 2 3 II. ANTECEDENTES 2011 2014 2015 Arribazón en Isla del Caribe, desde trinidad hasta República Dominicana y Costa Oeste de Africa.
1 Arribazón atípica de sargazo en el Caribe mexicano I. INTRODUCCIÓN 2 3 II. ANTECEDENTES 2011 2014 2015 Arribazón en Isla del Caribe, desde trinidad hasta República Dominicana y Costa Oeste de Africa.
LA PLATAFORMA CONTINENTAL
 LA PLATAFORMA CONTINENTAL Limite costero: la mas baja marea; Límite oceánico: el borde o talud continental. El fondo se denomina submareal o sublitoral. La columna de agua es la zona nerítica. Comprenden
LA PLATAFORMA CONTINENTAL Limite costero: la mas baja marea; Límite oceánico: el borde o talud continental. El fondo se denomina submareal o sublitoral. La columna de agua es la zona nerítica. Comprenden
Concesión y Planta de Desalinización de Agua Reserva Conchal. Juan Diego Pacheco Polanco SETENA
 Concesión y Planta de Desalinización de Agua Reserva Conchal Juan Diego Pacheco Polanco SETENA Ubicación Administrativa Guanacaste Santa Cruz Cabo Velas Cuatro Módulos de 500 m³/d cada uno Componentes
Concesión y Planta de Desalinización de Agua Reserva Conchal Juan Diego Pacheco Polanco SETENA Ubicación Administrativa Guanacaste Santa Cruz Cabo Velas Cuatro Módulos de 500 m³/d cada uno Componentes
CENTRO DE ESTUDIOS TECNOLOGICOS DEL MAR, NO.12 MANZANILLO, COLIMA
 CENTRO DE ESTUDIOS TECNOLOGICOS DEL MAR, NO.12 MANZANILLO, COLIMA DESARROLLO DE COLONIA DE CORALES EN ESTRUCTURA METÁLICA, EMPLEANDO TECNOLOGÍA DEL ELECTROMAGNETISMO EN LA PLAYA BOQUITA DE MIRAMAR, COLIMA,
CENTRO DE ESTUDIOS TECNOLOGICOS DEL MAR, NO.12 MANZANILLO, COLIMA DESARROLLO DE COLONIA DE CORALES EN ESTRUCTURA METÁLICA, EMPLEANDO TECNOLOGÍA DEL ELECTROMAGNETISMO EN LA PLAYA BOQUITA DE MIRAMAR, COLIMA,
4. RESULTADOS. 4.1 Variación de la temperatura superficial del mar
 4. RESULTADOS 4.1 Variación de la temperatura superficial del mar Durante 1997 la temperatura superficial del mar en la Isla Cabinzas presentó dos máximos, en febrero (18,3 C) y junio (18,6 C), y dos mínimos,
4. RESULTADOS 4.1 Variación de la temperatura superficial del mar Durante 1997 la temperatura superficial del mar en la Isla Cabinzas presentó dos máximos, en febrero (18,3 C) y junio (18,6 C), y dos mínimos,
Laboratorio de Protistas. RECONOCIMIENTO TAXONOMICO Y MORFOLOGICO DE LAS CLOROPHYTAS (Niveles de organización)
 Laboratorio de Protistas RECONOCIMIENTO TAXONOMICO Y MORFOLOGICO DE LAS CLOROPHYTAS (Niveles de organización) INTRODUCCIÓN Las algas pueden definirse como el grupo de organismos que carecen de raíz, tallo
Laboratorio de Protistas RECONOCIMIENTO TAXONOMICO Y MORFOLOGICO DE LAS CLOROPHYTAS (Niveles de organización) INTRODUCCIÓN Las algas pueden definirse como el grupo de organismos que carecen de raíz, tallo
CLASIFICACIÓN ECOLÓGICA DE LOS ORGANISMOS DE AGUA DULCE
 CLASIFICACIÓN ECOLÓGICA DE LOS ORGANISMOS DE AGUA DULCE seston tripton epilitica epifitas CARACTERÍSTICAS DEL NECTON El tamaño de los organismos oscila desde unos pocos centímetros hasta 40 o 50 cm. Son
CLASIFICACIÓN ECOLÓGICA DE LOS ORGANISMOS DE AGUA DULCE seston tripton epilitica epifitas CARACTERÍSTICAS DEL NECTON El tamaño de los organismos oscila desde unos pocos centímetros hasta 40 o 50 cm. Son
IMPORTANCIA DE LA BIODIVERSIDAD
 AVANCES V INFORME NACIONAL ACTUALIZACIÓN DEL ESTADO, LAS TENDENCIAS Y LAS AMENAZAS PARA LA DIVERSIDAD BIOLÓGICA Y LAS REPERCUSIONES PARA EL BIENESTAR HUMANO Proyecto Plan Nacional de Biodiversidad para
AVANCES V INFORME NACIONAL ACTUALIZACIÓN DEL ESTADO, LAS TENDENCIAS Y LAS AMENAZAS PARA LA DIVERSIDAD BIOLÓGICA Y LAS REPERCUSIONES PARA EL BIENESTAR HUMANO Proyecto Plan Nacional de Biodiversidad para
Facultad de Ciencias del Mar, Universidad Marítima Internacional de Panamá (UMIP) 1, Universidad Autónoma de Baja California Sur (UABCS) 2
 Teófila Delgado R 1, Arturo Ayala B 2 y Humberto Garcés B 1 Facultad de Ciencias del Mar, Universidad Marítima Internacional de Panamá (UMIP) 1, Universidad Autónoma de Baja California Sur (UABCS) 2 Panamá,
Teófila Delgado R 1, Arturo Ayala B 2 y Humberto Garcés B 1 Facultad de Ciencias del Mar, Universidad Marítima Internacional de Panamá (UMIP) 1, Universidad Autónoma de Baja California Sur (UABCS) 2 Panamá,
Praderas Marinas en el Litoral Andaluz Proyecto LIFE + NATURALEZA
 Praderas Marinas en el Litoral Andaluz Proyecto LIFE + NATURALEZA Conservación de las Praderas de Posidonia oceanica en el Mediterráneo andaluz LIFE 09/NAT/ES/00534 El Mar Mediterráneo El Mar Mediterráneo
Praderas Marinas en el Litoral Andaluz Proyecto LIFE + NATURALEZA Conservación de las Praderas de Posidonia oceanica en el Mediterráneo andaluz LIFE 09/NAT/ES/00534 El Mar Mediterráneo El Mar Mediterráneo
CAPÍTULO V: RESULTADOS
 32 CAPÍTULO V: RESULTADOS 5.1 Determinación de espesores de recubrimientos Se determinó el grosor del recubrimiento de zinc en las láminas mediante el método electromagnético, como se describe en el punto
32 CAPÍTULO V: RESULTADOS 5.1 Determinación de espesores de recubrimientos Se determinó el grosor del recubrimiento de zinc en las láminas mediante el método electromagnético, como se describe en el punto
Historia de la Ecofisiología
 Historia de la Ecofisiología Años 1895 Geografos Distribución global de las plantas Observaciones consistentes de patrones de morfología asociados con diferentes tipos de ambientes. Geografía de plantas
Historia de la Ecofisiología Años 1895 Geografos Distribución global de las plantas Observaciones consistentes de patrones de morfología asociados con diferentes tipos de ambientes. Geografía de plantas
Zonas costeras. Teresita Aguilar A. REDICA Panamá, octubre 2013
 Zonas costeras Teresita Aguilar A. REDICA Panamá, octubre 2013 Costas de Erosión, Procesos Erosivos y Costas de Depositación o Acumulativas Las costas pueden ser zonas de erosión o depositación y su naturaleza
Zonas costeras Teresita Aguilar A. REDICA Panamá, octubre 2013 Costas de Erosión, Procesos Erosivos y Costas de Depositación o Acumulativas Las costas pueden ser zonas de erosión o depositación y su naturaleza
Capítulo 3. La vida acuática
 Capítulo 3 La vida acuática Primera prueba (50 puntos) Próximo miércoles 6 de octubre 7:30 a 8:30 pm Salón B-280 Conceptos clave El ciclo hidrológico intercambia agua entre reservas. En términos generales,
Capítulo 3 La vida acuática Primera prueba (50 puntos) Próximo miércoles 6 de octubre 7:30 a 8:30 pm Salón B-280 Conceptos clave El ciclo hidrológico intercambia agua entre reservas. En términos generales,
Reserva de la Biosfera Banco Chinchorro tras el huracán Dean, su en su rehabilitación.
 Reserva de la Biosfera Banco Chinchorro tras el huracán Dean, su característica insular como ventaja en su rehabilitación. García Rivas. M. C*, Hernández A**. F Rodríguez***, Domínguez J*., Fonseca F.*,
Reserva de la Biosfera Banco Chinchorro tras el huracán Dean, su característica insular como ventaja en su rehabilitación. García Rivas. M. C*, Hernández A**. F Rodríguez***, Domínguez J*., Fonseca F.*,
APLICACIÓN DEL MODELO DE TRANSPORTE DE SEDIMENTOS UNIBEST CL 6.0 A LA BAHÍA DE MIRAFORES RESUMEN
 APLICACIÓN DEL MODELO DE TRANSPORTE DE SEDIMENTOS UNIBEST CL 6.0 A LA BAHÍA DE MIRAFORES Bach. Ing. Mec. de Fluidos Emanuel GUZMAN Zorrilla I.-INTRODUCCIÓN RESUMEN En el presente trabajo se realizaron
APLICACIÓN DEL MODELO DE TRANSPORTE DE SEDIMENTOS UNIBEST CL 6.0 A LA BAHÍA DE MIRAFORES Bach. Ing. Mec. de Fluidos Emanuel GUZMAN Zorrilla I.-INTRODUCCIÓN RESUMEN En el presente trabajo se realizaron
Clima CO08/2701 CO08/2700
 Clima La climatología se describe con base en datos recolectados desde 1961 a 1991 de una estación sinóptica principal, del IDEAM, localizada en el aeropuerto Sesquicentenario en la Isla de San Andrés,
Clima La climatología se describe con base en datos recolectados desde 1961 a 1991 de una estación sinóptica principal, del IDEAM, localizada en el aeropuerto Sesquicentenario en la Isla de San Andrés,
FACTORES LIMITANTES Y ADAPTACIONES AL ECOSISTEMA
 FACTORES LIMITANTES Y ADAPTACIONES AL ECOSISTEMA Los ecosistemas mantienen unas condiciones físico-químicas más o menos constantes, lo que permite que los seres vivos vivan en ellos. El mantenimiento de
FACTORES LIMITANTES Y ADAPTACIONES AL ECOSISTEMA Los ecosistemas mantienen unas condiciones físico-químicas más o menos constantes, lo que permite que los seres vivos vivan en ellos. El mantenimiento de
Generalidades sobre el clima de la Antártica según la clasificación de Koppen
 Generalidades sobre el clima de la Antártica según la clasificación de Koppen Gabriela Etcheverry Alday Profesora de Biología y Ciencias Naturales Monografía Módulo II 27/09/2016 Índice Resumen. 3 Introducción......
Generalidades sobre el clima de la Antártica según la clasificación de Koppen Gabriela Etcheverry Alday Profesora de Biología y Ciencias Naturales Monografía Módulo II 27/09/2016 Índice Resumen. 3 Introducción......
Nitritos (umol/l) (mg/l)
 Aplicación: Estudio exploratorio de la distribución de datos fisicoquímicos y biológicos medidos en el estuario Ciénaga Grande de Santa Marta en Marzo de 1997. Con información de algunas variables fisicoquímicas
Aplicación: Estudio exploratorio de la distribución de datos fisicoquímicos y biológicos medidos en el estuario Ciénaga Grande de Santa Marta en Marzo de 1997. Con información de algunas variables fisicoquímicas
L A A D DI IN N Á Á M MI IC C A A O O C C E E Á Á N NI IC C A
 LA LA DINÁMICA DINÁMICA OCEÁNICA OCEÁNICA OLAS, OLAS, MAREAS MAREAS Y Y CORRIENTES CORRIENTES MARINAS MARINAS 1.- 1.-El El ambiente ambiente marino marino 2.- 2.-Mares y y océanos océanos 3.- 3.-Movimientos
LA LA DINÁMICA DINÁMICA OCEÁNICA OCEÁNICA OLAS, OLAS, MAREAS MAREAS Y Y CORRIENTES CORRIENTES MARINAS MARINAS 1.- 1.-El El ambiente ambiente marino marino 2.- 2.-Mares y y océanos océanos 3.- 3.-Movimientos
Municipio de Cozumel. Exposición Inicial municipio Piloto PACMUN
 Municipio de Exposición Inicial municipio Piloto PACMUN Extensión Características: Municipio de El municipio de tiene una extensión total de 684.48 km² lo que representa el 1.35 % del estado. Comprende
Municipio de Exposición Inicial municipio Piloto PACMUN Extensión Características: Municipio de El municipio de tiene una extensión total de 684.48 km² lo que representa el 1.35 % del estado. Comprende
Foto 1. Caulerpa racemosa f. cylindracea en Punta Javana, Parque Natural de Cabo de GataNíjar, a 23 m de profundidad (12. de abril de 2012).
 Informe sobre la presencia e intento de erradicación del alga exótica invasora Caulerpa racemosa en Punta Javana, Parque Natural de Cabo de Gata-Níjar (Almería) En el Mediterráneo, entre las especies marinas,
Informe sobre la presencia e intento de erradicación del alga exótica invasora Caulerpa racemosa en Punta Javana, Parque Natural de Cabo de Gata-Níjar (Almería) En el Mediterráneo, entre las especies marinas,
Facultad de ciencias biológicas. Gustavo Rivera Velázquez
 UNIVERSIDAD DE CIENCIAS Y ARTES DE CHIAPAS Facultad de ciencias biológicas Determinación de la sustentabilidad de la pesquería del camarón: caso de estudio El sistema lagunar Carretas Pereyra PRESENTA
UNIVERSIDAD DE CIENCIAS Y ARTES DE CHIAPAS Facultad de ciencias biológicas Determinación de la sustentabilidad de la pesquería del camarón: caso de estudio El sistema lagunar Carretas Pereyra PRESENTA
Ecología de Comunidades Clase 4
 Ecología de Comunidades Clase 4 La semana pasada Características de las Comunidades Composición de especies Número de especies = S Distribución de la Abundancia (Equitatividad)= J Diversidad de especies
Ecología de Comunidades Clase 4 La semana pasada Características de las Comunidades Composición de especies Número de especies = S Distribución de la Abundancia (Equitatividad)= J Diversidad de especies
UNIVERSIDAD DE MAGALLANES FACULTAD DE CIENCIAS DEPARTAMENTO CIENCIAS Y RECURSOS NATURALES TITULO DEL TEMA
 UNIVERSIDAD DE MAGALLANES FACULTAD DE CIENCIAS DEPARTAMENTO CIENCIAS Y RECURSOS NATURALES TITULO DEL TEMA Composición y abundancia estacional de ensambles de moluscos presentes en dos praderas naturales
UNIVERSIDAD DE MAGALLANES FACULTAD DE CIENCIAS DEPARTAMENTO CIENCIAS Y RECURSOS NATURALES TITULO DEL TEMA Composición y abundancia estacional de ensambles de moluscos presentes en dos praderas naturales
CAPITULO II REVISIÓN DE LITERATURA
 CAPITULO I 1. INTRODUCCIÓN... 1 1.1 EL PROBLEMA... 2 1.2 JUSTIFICACIÓN... 3 1.3 OBJETIVOS... 4 1.3.1 GENERAL... 4 1.3.2 ESPECÍFICOS... 4 1.4. PREGUNTA DIRECTRIZ... 4 CAPITULO II REVISIÓN DE LITERATURA
CAPITULO I 1. INTRODUCCIÓN... 1 1.1 EL PROBLEMA... 2 1.2 JUSTIFICACIÓN... 3 1.3 OBJETIVOS... 4 1.3.1 GENERAL... 4 1.3.2 ESPECÍFICOS... 4 1.4. PREGUNTA DIRECTRIZ... 4 CAPITULO II REVISIÓN DE LITERATURA
Variabilidad Espacial y Temporal de la Concentración de Clorofila_a en el mar peruano usando imágenes MODIS AQUA
 Variabilidad Espacial y Temporal de la Concentración de Clorofila_a en el mar peruano usando imágenes MODIS AQUA Joel Rojas Acuña 1 Rosa Inés Paredes Peñafiel 1, María Giuliana Quezada García 1 Flavio
Variabilidad Espacial y Temporal de la Concentración de Clorofila_a en el mar peruano usando imágenes MODIS AQUA Joel Rojas Acuña 1 Rosa Inés Paredes Peñafiel 1, María Giuliana Quezada García 1 Flavio
C Á M A R A D E C O M E R C I O D E C O S T A R I C A
 C Á M A R A D E C O M E R C I O D E C O S T A R I C A ÍNDICE DE CONFIANZA DEL SECTOR COMERCIAL MEDICIÓN I TRIMESTRE DEL 2016 Informe del Departamento Económico de la Cámara de Comercio de Costa Rica. Í
C Á M A R A D E C O M E R C I O D E C O S T A R I C A ÍNDICE DE CONFIANZA DEL SECTOR COMERCIAL MEDICIÓN I TRIMESTRE DEL 2016 Informe del Departamento Económico de la Cámara de Comercio de Costa Rica. Í
BOLETIN DIARIO DE LAS CONDICIONES OCEANOGRÁFICAS
 TEMPERATURA SUPERFICIAL DEL MAR La Dirección de Hidrografía y Navegación (DHN) como miembro del Comité Multisectorial del Estudio Nacional del Fenómeno El Niño (ENFEN), tiene el compromiso de la evaluación
TEMPERATURA SUPERFICIAL DEL MAR La Dirección de Hidrografía y Navegación (DHN) como miembro del Comité Multisectorial del Estudio Nacional del Fenómeno El Niño (ENFEN), tiene el compromiso de la evaluación
INSTITUTO METEOROLÓGICO NACIONAL COSTA RICA BOLETIN DEL ENOS No. 15
 INSTITUTO METEOROLÓGICO NACIONAL COSTA RICA BOLETIN DEL ENOS No. 15 RESUMEN FASE NEUTRA DEL ENOS SE DESCARTA EVENTO DE EL NIÑO 16 de setiembre, 2008 El fenómeno ENOS se encuentra actualmente en la fase
INSTITUTO METEOROLÓGICO NACIONAL COSTA RICA BOLETIN DEL ENOS No. 15 RESUMEN FASE NEUTRA DEL ENOS SE DESCARTA EVENTO DE EL NIÑO 16 de setiembre, 2008 El fenómeno ENOS se encuentra actualmente en la fase
VULNERABILIDAD Y ADAPTACION DEL SECTOR PESQUERO EN MÉXICO ANTE EL CAMBIO CLIMÁTICO
 VULNERABILIDAD Y ADAPTACION DEL SECTOR PESQUERO EN MÉXICO ANTE EL CAMBIO CLIMÁTICO Martínez Arroyo Amparo 1, Manzanilla Silvia 2 y Zavala Hidalgo Jorge 1 1 Centro de Ciencias de la Atmósfera, UNAM 2 Centro
VULNERABILIDAD Y ADAPTACION DEL SECTOR PESQUERO EN MÉXICO ANTE EL CAMBIO CLIMÁTICO Martínez Arroyo Amparo 1, Manzanilla Silvia 2 y Zavala Hidalgo Jorge 1 1 Centro de Ciencias de la Atmósfera, UNAM 2 Centro
DISTRIBUCIÓN DE TEMPERATURA, SALINIDAD, OXÍGENO DISUELTO Y NUTRIENTES ENTRE LA BOCA DEL GUAFO Y EL CANAL PULLUCHE. (CRUCERO CIMAR 8 FIORDOS)
 DISTRIBUCIÓN DE TEMPERATURA, SALINIDAD, OXÍGENO DISUELTO Y NUTRIENTES ENTRE LA BOCA DEL GUAFO Y EL CANAL PULLUCHE. (CRUCERO CIMAR 8 FIORDOS) Alexander Valdenegro M & Nelson Silva S. Escuela de Ciencias
DISTRIBUCIÓN DE TEMPERATURA, SALINIDAD, OXÍGENO DISUELTO Y NUTRIENTES ENTRE LA BOCA DEL GUAFO Y EL CANAL PULLUCHE. (CRUCERO CIMAR 8 FIORDOS) Alexander Valdenegro M & Nelson Silva S. Escuela de Ciencias
UNIVERSIDAD DE MAGALLANES FACULTAD DE CIENCIAS DEPARTAMENTO DE CIENCIAS Y RECURSOS NATURALES
 UNIVERSIDAD DE MAGALLANES FACULTAD DE CIENCIAS DEPARTAMENTO DE CIENCIAS Y RECURSOS NATURALES EFECTOS DE FOTOPERIODO, TEMPERATURA E INTENSIDAD LUMÍNICA EN LA FORMACION Y CRECIMIENTO DE LA FASE CONCHOCELIS
UNIVERSIDAD DE MAGALLANES FACULTAD DE CIENCIAS DEPARTAMENTO DE CIENCIAS Y RECURSOS NATURALES EFECTOS DE FOTOPERIODO, TEMPERATURA E INTENSIDAD LUMÍNICA EN LA FORMACION Y CRECIMIENTO DE LA FASE CONCHOCELIS
Forzamiento atmosférico de eventos fríos en la temperatura subsuperficial del mar de Bahía Culebra, Costa Rica
 Forzamiento atmosférico de eventos fríos en la temperatura subsuperficial del mar de Bahía Culebra, Costa Rica Eric J. Alfaro 1,2,3 & Jorge Cortés 1,4 1 Centro de Investigación en Ciencias del Mar y Limnología,
Forzamiento atmosférico de eventos fríos en la temperatura subsuperficial del mar de Bahía Culebra, Costa Rica Eric J. Alfaro 1,2,3 & Jorge Cortés 1,4 1 Centro de Investigación en Ciencias del Mar y Limnología,
ZONA DE REFUGIO PESQUERO AKUMAL. Por Iván Penié, Paul Sánchez-Navarro, Miguel A. Lozano, Ixchel García Centro Ecológico Akumal
 ZONA DE REFUGIO PESQUERO AKUMAL Por Iván Penié, Paul Sánchez-Navarro, Miguel A. Lozano, Ixchel García Centro Ecológico Akumal Fundamentación de la creación de una Zona de Refugio Pesquero en Akumal. Los
ZONA DE REFUGIO PESQUERO AKUMAL Por Iván Penié, Paul Sánchez-Navarro, Miguel A. Lozano, Ixchel García Centro Ecológico Akumal Fundamentación de la creación de una Zona de Refugio Pesquero en Akumal. Los
UNIVERSIDAD DE CANTABRIA
 UNIVERSIDAD DE CANTABRIA E.T.S. INGENIEROS DE CAMINOS, CANALES Y PUERTOS. DPTO. DE CIENCIAS Y TÉCNICAS DEL AGUA Y DEL MEDIO AMBIENTE. AREA DE ECOLOGÍA TESIS DOCTORAL CONTRIBUCIÓN AL CONOCIMIENTO DEL ERIZO
UNIVERSIDAD DE CANTABRIA E.T.S. INGENIEROS DE CAMINOS, CANALES Y PUERTOS. DPTO. DE CIENCIAS Y TÉCNICAS DEL AGUA Y DEL MEDIO AMBIENTE. AREA DE ECOLOGÍA TESIS DOCTORAL CONTRIBUCIÓN AL CONOCIMIENTO DEL ERIZO
REPORTE N 1 EVALUACIÓN DE LA CONDICIÓN DE LA BAHIA DE MEJILLONES. Centro de Investigación Aplicada del Mar S.A., CIAM Universidad de Antofagasta, UA
 REPORTE N 1 EVALUACIÓN DE LA CONDICIÓN DE LA BAHIA DE MEJILLONES Centro de Investigación Aplicada del Mar S.A., CIAM Universidad de Antofagasta, UA MAYO 2016 EVALUACIÓN DE LA CONDICIÓN OCEANOGRÁFICA EN
REPORTE N 1 EVALUACIÓN DE LA CONDICIÓN DE LA BAHIA DE MEJILLONES Centro de Investigación Aplicada del Mar S.A., CIAM Universidad de Antofagasta, UA MAYO 2016 EVALUACIÓN DE LA CONDICIÓN OCEANOGRÁFICA EN
Efectos del cambio climático en los organismos marinos
 Efectos del cambio climático en los organismos marinos José Luis Carballo jlcarballo@ola.icmyl.unam.mx Instituto de Ciencias del Mar y Limnología Universidad Nacional Autónoma de México Cuales son las
Efectos del cambio climático en los organismos marinos José Luis Carballo jlcarballo@ola.icmyl.unam.mx Instituto de Ciencias del Mar y Limnología Universidad Nacional Autónoma de México Cuales son las
Olas Durante un evento El Niño. Comportamiento de las olas frente a un evento anómalo
 Olas Durante un evento El Niño Comportamiento de las olas frente a un evento anómalo INTRODUCCIÓN CÓMO SE FORMAN LAS OLAS POR VIENTOS La magnitud, El área donde sopla y el tiempo de duración, son factores
Olas Durante un evento El Niño Comportamiento de las olas frente a un evento anómalo INTRODUCCIÓN CÓMO SE FORMAN LAS OLAS POR VIENTOS La magnitud, El área donde sopla y el tiempo de duración, son factores
Introducción de refugios artificiales para la pesca selectiva de langosta
 Introducción de refugios artificiales para la pesca selectiva de langosta CINVESTAV Unidad Mérida Silvia Salas Márquez Miguel A. Cabrera Vázquez Carlos Zapata Araujo Antecedentes del uso de casitas en
Introducción de refugios artificiales para la pesca selectiva de langosta CINVESTAV Unidad Mérida Silvia Salas Márquez Miguel A. Cabrera Vázquez Carlos Zapata Araujo Antecedentes del uso de casitas en
EVALUACION DE LA ECOTOXICIDAD DEL AGUA EN LA ZONA INTERNA DEL ESTUARIO DE BAHÍA BLANCA 2016 Dra. Elisa R. Parodi
 EVALUACION DE LA ECOTOXICIDAD DEL AGUA EN LA ZONA INTERNA DEL ESTUARIO DE BAHÍA BLANCA 2016 Dra. Elisa R. Parodi Las microalgas, como componentes del fitoplancton, constituyen el grupo de productores primario
EVALUACION DE LA ECOTOXICIDAD DEL AGUA EN LA ZONA INTERNA DEL ESTUARIO DE BAHÍA BLANCA 2016 Dra. Elisa R. Parodi Las microalgas, como componentes del fitoplancton, constituyen el grupo de productores primario
EL NIÑO: FASE CÁLIDA DEL ENOS
 EL NIÑO: FASE CÁLIDA DEL ENOS El Niño es el término popular con el cual se conoce la fase cálida del ENOS. Es el calentamiento anormal de las aguas ecuatoriales del Océano Pacífico Tropical. Por lo general,
EL NIÑO: FASE CÁLIDA DEL ENOS El Niño es el término popular con el cual se conoce la fase cálida del ENOS. Es el calentamiento anormal de las aguas ecuatoriales del Océano Pacífico Tropical. Por lo general,
2012 ENERO. Pronóstico Mensual ELABORADO POR: Revisión: MA2MOF Rodríguez Cáceres Deymar Fabián (Pronosticador procesos convectivos)
 001 Pronóstico Mensual ELABORADO POR: MA2MOF Rodríguez Cáceres Deymar Fabián (Pronosticador procesos convectivos) Revisión: 2012 ENERO S1MOF Leswis Cabeza Durango (Responsable de Meteorología) Tabla de
001 Pronóstico Mensual ELABORADO POR: MA2MOF Rodríguez Cáceres Deymar Fabián (Pronosticador procesos convectivos) Revisión: 2012 ENERO S1MOF Leswis Cabeza Durango (Responsable de Meteorología) Tabla de
Comunidades de macroinvertebrados en un río tropical altoandino: la importancia del microhábitat, el caudal y la estacionalidad
 Comunidades de macroinvertebrados en un río tropical altoandino: la importancia del microhábitat, el caudal y la estacionalidad PARAMUNDI. Loja 23 de Junio de 2009 Introducción altitud Estabilidad de Temperatura
Comunidades de macroinvertebrados en un río tropical altoandino: la importancia del microhábitat, el caudal y la estacionalidad PARAMUNDI. Loja 23 de Junio de 2009 Introducción altitud Estabilidad de Temperatura
Amenazas climáticas. Elevación del nivel del mar/inundación por tormentas
 Amenazas climáticas. Elevación del nivel del mar/inundación por tormentas Impactos esperados Pérdida de nidos inundación o por erosión Pérdida o reducción de áreas de Alteración del perfil que obstaculiza
Amenazas climáticas. Elevación del nivel del mar/inundación por tormentas Impactos esperados Pérdida de nidos inundación o por erosión Pérdida o reducción de áreas de Alteración del perfil que obstaculiza
Contenido. 24 Manual Técnico sobre el Cultivo de Engorde de Ostra
 24 Manual Técnico sobre el Cultivo de Engorde de Ostra Contenido I. Sistemas de Cultivo... 25 1.1 Sistemas Sumergidos... 25 1.1.1 Balsa... 25 1.1.2 Línea subsuperficial... 26 1.2 Sistema Intermareal...
24 Manual Técnico sobre el Cultivo de Engorde de Ostra Contenido I. Sistemas de Cultivo... 25 1.1 Sistemas Sumergidos... 25 1.1.1 Balsa... 25 1.1.2 Línea subsuperficial... 26 1.2 Sistema Intermareal...
Pacífico Oriental, Golfo de México, Mar Caribe y Atlántico
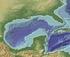 Boletín Tropical No. 36/2012 Xalapa, Ver. 06 de Julio de 2012 En base a las discusiones tropicales y avisos de las 07:00 hora local del NWS TPC/NATIONAL HURRICANE CENTER Miami Florida. Pacífico Oriental,
Boletín Tropical No. 36/2012 Xalapa, Ver. 06 de Julio de 2012 En base a las discusiones tropicales y avisos de las 07:00 hora local del NWS TPC/NATIONAL HURRICANE CENTER Miami Florida. Pacífico Oriental,
ANÁLISIS DEL MONITOREO EN LOS ACUÍFEROS COSTEROS DE CARRILLO
 ANÁLISIS DEL MONITOREO EN LOS ACUÍFEROS COSTEROS DE CARRILLO Monitoreo de Aguas Subterráneas El monitoreo es un programa diseñado científicamente de continua supervisión que incluye observaciones, mediciones,
ANÁLISIS DEL MONITOREO EN LOS ACUÍFEROS COSTEROS DE CARRILLO Monitoreo de Aguas Subterráneas El monitoreo es un programa diseñado científicamente de continua supervisión que incluye observaciones, mediciones,
Oceanos. Geosistemas ID Juan C. Benavides
 Oceanos Geosistemas ID 026671 Juan C. Benavides Composición química Componentes de los ambientes costeros Movimientos de las olas Barreras en islas Corales, ciénagas y manglares Oceanos Solidos en solución
Oceanos Geosistemas ID 026671 Juan C. Benavides Composición química Componentes de los ambientes costeros Movimientos de las olas Barreras en islas Corales, ciénagas y manglares Oceanos Solidos en solución
OFERTA AMBIENTAL PRODUCCION CAFETERA CHINCHINA- COLOMBIA. Oscar Piedrahíta Y
 OFERTA AMBIENTAL PRODUCCION CAFETERA CHINCHINA- COLOMBIA Oscar Piedrahíta Y. 2009 oscarc.piedrahita@gmail.com PRODUCCION DE CAFÉ DURANTE LA ULTIMA DECADA La tendencia de la producción cafetera durante
OFERTA AMBIENTAL PRODUCCION CAFETERA CHINCHINA- COLOMBIA Oscar Piedrahíta Y. 2009 oscarc.piedrahita@gmail.com PRODUCCION DE CAFÉ DURANTE LA ULTIMA DECADA La tendencia de la producción cafetera durante
CRECIMIENTO Y FIJACION DE SEMILLAS DE CHORITO
 CRECIMIENTO Y FIJACION DE SEMILLAS DE CHORITO Mytilus chilensis EN FUNCIÓN DE LA PROFUNDIDAD EN UN SISTEMA DE CULTIVO SUSPENDIDO (REGIÓN DE MAGALLANES). O. Mancilla 1, J.A. Díaz Ochoa 2, S. Oyarzún 3,
CRECIMIENTO Y FIJACION DE SEMILLAS DE CHORITO Mytilus chilensis EN FUNCIÓN DE LA PROFUNDIDAD EN UN SISTEMA DE CULTIVO SUSPENDIDO (REGIÓN DE MAGALLANES). O. Mancilla 1, J.A. Díaz Ochoa 2, S. Oyarzún 3,
MA2MOF Ricardo Romero Betancourt 1. Tecnólogo en Oceanografía Física. Auxiliar pronostico. MA2MOF. Manuel Guzmán Guzmán. Auxiliar Pronósticos
 BOLETÍN METEOMARINO MENSUAL DEL PACÍFICO COLOMBIANO JUNIO-2012 COMITÉ EDITORIAL DIRECTOR Capitán de Fragata Rafael Ricardo Torres Parra Director Centro de Investigaciones Oceanográficas e Hidrográficas
BOLETÍN METEOMARINO MENSUAL DEL PACÍFICO COLOMBIANO JUNIO-2012 COMITÉ EDITORIAL DIRECTOR Capitán de Fragata Rafael Ricardo Torres Parra Director Centro de Investigaciones Oceanográficas e Hidrográficas
"LA VULNERABILIDAD DE LAS ZONAS COSTERAS MEXICANAS ANTE EL CAMBIO CLIMÁTICO
 INSTITUTO DE CIENCIAS DEL MAR Y LIMNOLOGÍA LABORATORIO DE CONTAMINACIÓN MARINA "LA VULNERABILIDAD DE LAS ZONAS COSTERAS MEXICANAS ANTE EL CAMBIO CLIMÁTICO DR. ALFONSO V. BOTELLO pomito69@gmail.com ENERO,
INSTITUTO DE CIENCIAS DEL MAR Y LIMNOLOGÍA LABORATORIO DE CONTAMINACIÓN MARINA "LA VULNERABILIDAD DE LAS ZONAS COSTERAS MEXICANAS ANTE EL CAMBIO CLIMÁTICO DR. ALFONSO V. BOTELLO pomito69@gmail.com ENERO,
Antecedentes El Plan Nacional de Desarrollo Turístico establece la división del país en 10 Unidades de Planeamiento que representan
 Guanacaste Norte. Antecedentes El Plan Nacional de Desarrollo Turístico 2002-2012 establece la división del país en 10 Unidades de Planeamiento que representan espacios geográficos con características
Guanacaste Norte. Antecedentes El Plan Nacional de Desarrollo Turístico 2002-2012 establece la división del país en 10 Unidades de Planeamiento que representan espacios geográficos con características
Estudio Sedimentológico de las Playas del Municipio de Solidaridad, Quintana Roo.
 NOMBRE: Zuelhen Florez Erazo MATRICULA: 200329626 TELEFONO: 91166360 LICENCIATURA: Hidrobiólogia DIVISIÓN: Ciencias Básicas y de la Salud (CBS) UNIDAD UNIVERSITARIA: Iztapalapa TRIMESTRE LECTIVO: 05-P
NOMBRE: Zuelhen Florez Erazo MATRICULA: 200329626 TELEFONO: 91166360 LICENCIATURA: Hidrobiólogia DIVISIÓN: Ciencias Básicas y de la Salud (CBS) UNIDAD UNIVERSITARIA: Iztapalapa TRIMESTRE LECTIVO: 05-P
Macroal lgas M Marinas
 Macroalgas Marinas Las Macroalgas marinas se pueden dividir en 3 grupos Verdes (Chlorophyta) + 4038 especies en el mundo Pardas (Phaeophyta) + 3054 especies en el mundo Y. .y las rojas (Rhodophyta) Rojas
Macroalgas Marinas Las Macroalgas marinas se pueden dividir en 3 grupos Verdes (Chlorophyta) + 4038 especies en el mundo Pardas (Phaeophyta) + 3054 especies en el mundo Y. .y las rojas (Rhodophyta) Rojas
Anexo 2. Protocolo de Monitoreo No. 30: Monitoreo de corales en el Parque Nacional Cabo Pulmo, Baja California Sur
 Protocolo de Monitoreo No. 30: Monitoreo de corales en el Parque Nacional Cabo Pulmo, Baja California Sur ANTECEDENTES La necesidad de conservar el arrecife coralino de Cabo Pulmo, el más septentrional
Protocolo de Monitoreo No. 30: Monitoreo de corales en el Parque Nacional Cabo Pulmo, Baja California Sur ANTECEDENTES La necesidad de conservar el arrecife coralino de Cabo Pulmo, el más septentrional
Informe Técnico Inspección Tramo Final del Emisario Submarino
 INSTITUTO COSTARRICENSE DE ACUEDUCTOS Y ALCANTARILLADOS Informe Técnico Inspección Tramo Final del Emisario Submarino de Limón Inspección realizada por: Ing. Álvaro Araya García, MSc. Ing. Rafael Barboza
INSTITUTO COSTARRICENSE DE ACUEDUCTOS Y ALCANTARILLADOS Informe Técnico Inspección Tramo Final del Emisario Submarino de Limón Inspección realizada por: Ing. Álvaro Araya García, MSc. Ing. Rafael Barboza
EFECTO DE LA PESCA INDUSTRIAL DE CAMARÓN CON REDES DE ARRASTRE DE FONDO SOBRE LA ICTIOFAUNA EN AGUAS PROFUNDAS DEL PACÍFICO COLOMBIANO
 EFECTO DE LA PESCA INDUSTRIAL DE CAMARÓN CON REDES DE ARRASTRE DE FONDO SOBRE LA ICTIOFAUNA EN AGUAS PROFUNDAS DEL PACÍFICO COLOMBIANO ROSA VANESSA RIASCOS CUERO Trabajo de grado presentado como requisito
EFECTO DE LA PESCA INDUSTRIAL DE CAMARÓN CON REDES DE ARRASTRE DE FONDO SOBRE LA ICTIOFAUNA EN AGUAS PROFUNDAS DEL PACÍFICO COLOMBIANO ROSA VANESSA RIASCOS CUERO Trabajo de grado presentado como requisito
5. LOS DOMINIOS CLIMÁTICOS EN ESPAÑA
 5. LOS DOMINIOS CLIMÁTICOS EN ESPAÑA ESQUEMA DE LA UNIDAD 1. LOS FUNDAMENTOS DE LA DIVERSIDAD CLIMÁTICA ESPAÑOLA 2. LOS PRINCIPALES TIPOS DE CLIMA DE ESPAÑA: CARACTERÍSTICAS Y DISTRIBUCIÓN GEOGRÁFICA 2.1.
5. LOS DOMINIOS CLIMÁTICOS EN ESPAÑA ESQUEMA DE LA UNIDAD 1. LOS FUNDAMENTOS DE LA DIVERSIDAD CLIMÁTICA ESPAÑOLA 2. LOS PRINCIPALES TIPOS DE CLIMA DE ESPAÑA: CARACTERÍSTICAS Y DISTRIBUCIÓN GEOGRÁFICA 2.1.
Programa de Vigilancia y Seguimiento Ambiental del Proyecto del Espigón Central de la ampliación del Puerto de Bilbao.
 Programa de Vigilancia y Seguimiento Ambiental del Proyecto del Espigón Central de la ampliación del Puerto de Bilbao. Acciones 2016 Resumen ejecutivo Para: Autoridad Portuaria de Bilbao Pasaia, 16 de
Programa de Vigilancia y Seguimiento Ambiental del Proyecto del Espigón Central de la ampliación del Puerto de Bilbao. Acciones 2016 Resumen ejecutivo Para: Autoridad Portuaria de Bilbao Pasaia, 16 de
4. CLIMA CONTENIDO 4. CLIMA
 4. CLIMA CONTENIDO pág. 4. CLIMA... 357 4.1 INFORMACIÓN METEOROLÓGICA ORIGINAL Y TRATADA... 358 4.1.1 Información Meteorológica Original... 358 4.1.2 Información de Parámetros Registrados en las Estaciones
4. CLIMA CONTENIDO pág. 4. CLIMA... 357 4.1 INFORMACIÓN METEOROLÓGICA ORIGINAL Y TRATADA... 358 4.1.1 Información Meteorológica Original... 358 4.1.2 Información de Parámetros Registrados en las Estaciones
Posgrado en Ciencias del Mar y Limnología. Unidad Académica Mazatlán. Universidad Nacional Autónoma de México
 Posgrado en Ciencias del Mar y Limnología Unidad Académica Mazatlán Universidad Nacional Autónoma de México "COMPOSICIÓN ISOTÓPICA DEL CARBONO ( 13 C/ 12 C) EN MACROALGAS DEL GOLFO DE CALIFORNIA" P r e
Posgrado en Ciencias del Mar y Limnología Unidad Académica Mazatlán Universidad Nacional Autónoma de México "COMPOSICIÓN ISOTÓPICA DEL CARBONO ( 13 C/ 12 C) EN MACROALGAS DEL GOLFO DE CALIFORNIA" P r e
Los arrecifes de coral
 Carmen González Toro Especialista en ambiente Servicio de Extensión n Agrícola Rev. Enero 2010 Objetivos Relacionar distintos conceptos vinculados a los arrecifes. Señalar las regiones en PR en donde
Carmen González Toro Especialista en ambiente Servicio de Extensión n Agrícola Rev. Enero 2010 Objetivos Relacionar distintos conceptos vinculados a los arrecifes. Señalar las regiones en PR en donde
Descripción General. Clima
 CLIMATOLOGÍA DE LOS PRINCIPALES PUERTOS DEL CARIBE COLOMBIANO PUERTO BOLÍVAR-ALTA GUAJIRA Descripción General Puerto Bolívar se encuentra en el extremo noroccidental de la Alta Guajira localizado en la
CLIMATOLOGÍA DE LOS PRINCIPALES PUERTOS DEL CARIBE COLOMBIANO PUERTO BOLÍVAR-ALTA GUAJIRA Descripción General Puerto Bolívar se encuentra en el extremo noroccidental de la Alta Guajira localizado en la
Comité Regional de Recursos Hidráulicos del Itsmo Centroamericano
 Comité Regional de Recursos Hidráulicos del Itsmo Centroamericano Tel. (506) 231-5791 / (506) 296-4641 Fax: (506) 296-0047 Correo el.: crrhcr@racsa.co.cr Apartado 1527-1200 San José Costa Rica Introducción
Comité Regional de Recursos Hidráulicos del Itsmo Centroamericano Tel. (506) 231-5791 / (506) 296-4641 Fax: (506) 296-0047 Correo el.: crrhcr@racsa.co.cr Apartado 1527-1200 San José Costa Rica Introducción
Efecto de la temperatura en la reproducción.
 Efecto de la temperatura en la reproducción. Environmental Temperature and Reproductive Seasonality in Japanese Macaques (Macaca fuscata) Roberto Cozzolino, Carla Cordischi, Filippo Aureli, Stefano Scucchi.
Efecto de la temperatura en la reproducción. Environmental Temperature and Reproductive Seasonality in Japanese Macaques (Macaca fuscata) Roberto Cozzolino, Carla Cordischi, Filippo Aureli, Stefano Scucchi.
Estado de sistema de alerta: No Activo 1
 COMUNICADO OFICIAL ENFEN N 12-2017 Estado de sistema de alerta: No Activo 1 La Comisión Multisectorial ENFEN mantiene el estado de sistema de alerta No Activo debido a que en la actualidad la temperatura
COMUNICADO OFICIAL ENFEN N 12-2017 Estado de sistema de alerta: No Activo 1 La Comisión Multisectorial ENFEN mantiene el estado de sistema de alerta No Activo debido a que en la actualidad la temperatura
INFORME TECNICO INFORMACION HISTORICA OCEANOGRAFICA DEL PACIFICO COLOMBIANO
 INFORME TECNICO INFORMACION HISTORICA OCEANOGRAFICA DEL PACIFICO COLOMBIANO Cabrera (1992), realizó un estudio del comportamiento de la capa de mezcla para un área del Pacífico colombiano, comparando esta
INFORME TECNICO INFORMACION HISTORICA OCEANOGRAFICA DEL PACIFICO COLOMBIANO Cabrera (1992), realizó un estudio del comportamiento de la capa de mezcla para un área del Pacífico colombiano, comparando esta
CLIMAPESCA. Nota Informativa # 6 2/10/2014
 I. CAMBIO DE SITUACIÓN CLIMAPESCA Nota Informativa # 6 2/10/2014 Después de una época lluviosa deficitaria, con graves consecuencias para la región centroamericana, se acerca la estación seca con otros
I. CAMBIO DE SITUACIÓN CLIMAPESCA Nota Informativa # 6 2/10/2014 Después de una época lluviosa deficitaria, con graves consecuencias para la región centroamericana, se acerca la estación seca con otros
Proyecciones de pesca de anchoveta en la Región Norte Centro (Semestre biológico : Abril Setiembre 2012)
 Proyecciones de pesca de anchoveta en la Región Norte Centro (Semestre biológico : Abril Setiembre 2012) Antecedentes Mediante la R.M. N 303-2011-PRODUCE, se establece el Límite Máximo Total de Captura
Proyecciones de pesca de anchoveta en la Región Norte Centro (Semestre biológico : Abril Setiembre 2012) Antecedentes Mediante la R.M. N 303-2011-PRODUCE, se establece el Límite Máximo Total de Captura
UNIVERSIDAD DE COSTA RICA SISTEMA DE ESTUDIOS DE POSGRADO
 UNIVERSIDAD DE COSTA RICA SISTEMA DE ESTUDIOS DE POSGRADO FACTORES FÍSICO-QUÍMICOS Y BIOLÓGICOS QUE MEDIAN EN EL DESARROLLO DE LOS ARRECIFES Y COMUNIDADES CORALINAS DEL PARQUE NACIONAL MARINO BALLENA,
UNIVERSIDAD DE COSTA RICA SISTEMA DE ESTUDIOS DE POSGRADO FACTORES FÍSICO-QUÍMICOS Y BIOLÓGICOS QUE MEDIAN EN EL DESARROLLO DE LOS ARRECIFES Y COMUNIDADES CORALINAS DEL PARQUE NACIONAL MARINO BALLENA,
Presentación 8 Las Estadísticas del Medio Ambiente en la Revolución 9
 ÍNDICE Presentación 8 Las Estadísticas del Medio Ambiente en la Revolución 9 Capítulo 1- Condiciones generales del Medio Ambiente en Cuba Características ambientales 16 División Político - Administrativa
ÍNDICE Presentación 8 Las Estadísticas del Medio Ambiente en la Revolución 9 Capítulo 1- Condiciones generales del Medio Ambiente en Cuba Características ambientales 16 División Político - Administrativa
Dinámica de poblaciones
 Dinámica de poblaciones OBJETIVO: DESCRIBIR LAS CARACTERÍSTICAS PROPIAS DE UNA POBLACIÓN. II Medio 2016 Plan común Prof. María José Escalona Verónica Martínez Niveles de organización ecológica Especie
Dinámica de poblaciones OBJETIVO: DESCRIBIR LAS CARACTERÍSTICAS PROPIAS DE UNA POBLACIÓN. II Medio 2016 Plan común Prof. María José Escalona Verónica Martínez Niveles de organización ecológica Especie
Derrotero de las costas y áreas insulares de Colombia
 Derrotero de las costas y áreas insulares de Colombia GORGONA Y GORGONILLA Centro de Investigaciones Oceanográficas e Hidrográficas del Caribe DIRECCION GENARAL MARITIMA DIMAR Gorgona ISLA GORGONA Y GORGONILLA
Derrotero de las costas y áreas insulares de Colombia GORGONA Y GORGONILLA Centro de Investigaciones Oceanográficas e Hidrográficas del Caribe DIRECCION GENARAL MARITIMA DIMAR Gorgona ISLA GORGONA Y GORGONILLA
TRABAJO DE 1º DE BACHILLERATO DE CIENCIAS DEL IES LAS SALINAS DEL MAR MENOR. LAS AGUAS QUE NOS RODEAN.- ALGUNOS PARAMETROS QUIMICOS
 TRABAJO DE 1º DE BACHILLERATO DE CIENCIAS DEL IES LAS SALINAS DEL MAR MENOR. LAS AGUAS QUE NOS RODEAN.- ALGUNOS PARAMETROS QUIMICOS Imagen del satélite sobre el Mar Mediterráneo Imagen satélite Mar Menor
TRABAJO DE 1º DE BACHILLERATO DE CIENCIAS DEL IES LAS SALINAS DEL MAR MENOR. LAS AGUAS QUE NOS RODEAN.- ALGUNOS PARAMETROS QUIMICOS Imagen del satélite sobre el Mar Mediterráneo Imagen satélite Mar Menor
Asignatura: Biología 3. Curso: 3 ro. de Media. Proyecto Nº 2. Mes: Sept.-Oct. Año: Prof.: Lic. Manuel B. Noboa G.
 Asignatura: Biología 3. Curso: 3 ro. de Media. Proyecto Nº 2. Mes: Sept.-Oct. Año: 2014-2015. Prof.: Lic. Manuel B. Noboa G. Unidad Nº 2: Estructura, Dinámica de los Ecosistemas y Recursos Naturales. Propósito
Asignatura: Biología 3. Curso: 3 ro. de Media. Proyecto Nº 2. Mes: Sept.-Oct. Año: 2014-2015. Prof.: Lic. Manuel B. Noboa G. Unidad Nº 2: Estructura, Dinámica de los Ecosistemas y Recursos Naturales. Propósito
M.C. Carlos Delgado Trejo. Profesor e Investigador Asociado C de Tiempo Completo
 M.C. Carlos Delgado Trejo Profesor e Investigador Asociado C de Tiempo Completo Biólogo por la Facultad de Biología de la Universidad Michoacana de San Nicolás de Hidalgo. Maestro en Ciencias en Conservación
M.C. Carlos Delgado Trejo Profesor e Investigador Asociado C de Tiempo Completo Biólogo por la Facultad de Biología de la Universidad Michoacana de San Nicolás de Hidalgo. Maestro en Ciencias en Conservación
Variaciones de la turbidez del agua litoral: coeficiente de atenuación difusa (K-490). Evolución Situación Tendencia
 1. Título del indicador Variaciones de la turbidez del agua litoral: coeficiente de atenuación difusa (K-490). 2. Equivalencia con otros sistemas de indicadores Ministerio de Agricultura, Alimentación
1. Título del indicador Variaciones de la turbidez del agua litoral: coeficiente de atenuación difusa (K-490). 2. Equivalencia con otros sistemas de indicadores Ministerio de Agricultura, Alimentación
Frente No. 15 ZCIT ZCIT. Vaguada monzónica
 Boletín Tropical No. 183/2011 Xalapa, Ver. 30 de Noviembre de 2011 en base a las discusiones tropicales de las 07:00 hora local y avisos de las 07:00 hora local del NWS TPC/NATIONAL HURRICANE CENTER Miami
Boletín Tropical No. 183/2011 Xalapa, Ver. 30 de Noviembre de 2011 en base a las discusiones tropicales de las 07:00 hora local y avisos de las 07:00 hora local del NWS TPC/NATIONAL HURRICANE CENTER Miami
El Evento El Niño y sus impactos en la pesquería peruana
 CUT PERÚ Sectorial Pesquero Seminario Cambio Climático y Fenómeno El Niño: Impactos en la pesca El Evento El Niño y sus impactos en la pesquería peruana Blga. Cecilia Peña Tercero Dirección de Investigaciones
CUT PERÚ Sectorial Pesquero Seminario Cambio Climático y Fenómeno El Niño: Impactos en la pesca El Evento El Niño y sus impactos en la pesquería peruana Blga. Cecilia Peña Tercero Dirección de Investigaciones
guía educativa 8º básico
 guía educativa 8º básico Nombre: Fecha: Apellido: Objetivos: Reforzar los conocimientos adquiridos enfocados en lo visto en la visita pedagógica realizada al Acuario Valparaíso. Lee detenidamente cada
guía educativa 8º básico Nombre: Fecha: Apellido: Objetivos: Reforzar los conocimientos adquiridos enfocados en lo visto en la visita pedagógica realizada al Acuario Valparaíso. Lee detenidamente cada
FERTILIZACION DE GIRASOL EN SIEMBRA DIRECTA
 FERTILIZACION DE GIRASOL EN SIEMBRA DIRECTA Martin Díaz-Zorita y María Virginia Fernández Canigia CONICET-FAUBA mdzorita@agro.uba.ar El girasol en Argentina se extiende en un rango variado de condiciones
FERTILIZACION DE GIRASOL EN SIEMBRA DIRECTA Martin Díaz-Zorita y María Virginia Fernández Canigia CONICET-FAUBA mdzorita@agro.uba.ar El girasol en Argentina se extiende en un rango variado de condiciones
C Á M A R A D E C O M E R C I O D E C O S T A R I C A
 C Á M A R A D E C O M E R C I O D E C O S T A R I C A ÍNDICE DE CONFIANZA DEL SECTOR COMERCIAL MEDICIÓN IV TRIMESTRE DEL 2016 Informe del Departamento Económico de la Cámara de Comercio de Costa Rica.
C Á M A R A D E C O M E R C I O D E C O S T A R I C A ÍNDICE DE CONFIANZA DEL SECTOR COMERCIAL MEDICIÓN IV TRIMESTRE DEL 2016 Informe del Departamento Económico de la Cámara de Comercio de Costa Rica.
C Á M A R A D E C O M E R C I O D E C O S T A R I C A
 C Á M A R A D E C O M E R C I O D E C O S T A R I C A ÍNDICE DE CONFIANZA DEL SECTOR COMERCIAL MEDICIÓN IV TRIMESTRE DEL 2015 Informe del Departamento Económico de la Cámara de Comercio de Costa Rica.
C Á M A R A D E C O M E R C I O D E C O S T A R I C A ÍNDICE DE CONFIANZA DEL SECTOR COMERCIAL MEDICIÓN IV TRIMESTRE DEL 2015 Informe del Departamento Económico de la Cámara de Comercio de Costa Rica.
BOLETÍN AGROMETEOROLÓGICO correspondiente a la segunda decena del mes de diciembre Nº Chaco
 BOLETÍN AGROMETEOROLÓGICO correspondiente a la segunda del mes de diciembre Nº 1229 Chaco Contenido 1. CUADRO DE INFORMACIÓN Y PRONÓSTICOS AGROMETEOROLÓGICOS. 2. RESUMEN AGROMETEOROLÓGICO 3. ANALISIS DE
BOLETÍN AGROMETEOROLÓGICO correspondiente a la segunda del mes de diciembre Nº 1229 Chaco Contenido 1. CUADRO DE INFORMACIÓN Y PRONÓSTICOS AGROMETEOROLÓGICOS. 2. RESUMEN AGROMETEOROLÓGICO 3. ANALISIS DE
Regulación intraespecífica de la población
 Universidad de Sonora Licenciatura en Biología Curso: Ecología Regulación intraespecífica de la población Francisco Molina Freaner freaner@unam.mx biosfera región paisaje ecosistema comunidad interacción
Universidad de Sonora Licenciatura en Biología Curso: Ecología Regulación intraespecífica de la población Francisco Molina Freaner freaner@unam.mx biosfera región paisaje ecosistema comunidad interacción
Índice de Calidad de Agua (ICA) del Canal del Dique
 Índice de Calidad de Agua (ICA) del Canal del Dique Localizada en la zona norte del departamento y central de la jurisdicción de la corporación, está conformada por los municipios de Calamar, Arroyo Hondo,
Índice de Calidad de Agua (ICA) del Canal del Dique Localizada en la zona norte del departamento y central de la jurisdicción de la corporación, está conformada por los municipios de Calamar, Arroyo Hondo,
Respuesta morfo-fisiológica del regenerado de Pinus pinea a la sombra y la sequía moderada: es la procedencia un factor diferenciador?
 Respuesta morfo-fisiológica del regenerado de Pinus pinea a la sombra y la sequía moderada: es la procedencia un factor diferenciador? Marta Pardos Mar Conde, Guillermo Madrigal, Rafael Calama INIA-CIFOR.
Respuesta morfo-fisiológica del regenerado de Pinus pinea a la sombra y la sequía moderada: es la procedencia un factor diferenciador? Marta Pardos Mar Conde, Guillermo Madrigal, Rafael Calama INIA-CIFOR.
INNOVACIÓN TECNOLÓGICA ARRECIFES ARTIFICIALES UPMAR
 INNOVACIÓN TECNOLÓGICA ARRECIFES ARTIFICIALES UPMAR ARRECIFES ARTIFICIALES UPMAR FUNDACIÓN PRODUCE DE VERACRUZ, A.C. INNOVACIO N TECNOLO GICA EN LA IMPLEMENTACIO N DE ARRECIFES ARTIFICIALES, COMO UNIDADES
INNOVACIÓN TECNOLÓGICA ARRECIFES ARTIFICIALES UPMAR ARRECIFES ARTIFICIALES UPMAR FUNDACIÓN PRODUCE DE VERACRUZ, A.C. INNOVACIO N TECNOLO GICA EN LA IMPLEMENTACIO N DE ARRECIFES ARTIFICIALES, COMO UNIDADES
Boletín Climatológico Anual de Estación meteorológica convencional y Telemétrica de Perquin, departamento de Morazán.
 Boletín Climatológico Anual de 2013 Estación meteorológica convencional y Telemétrica de Perquin, departamento de Morazán. ÍNDICE 1 Ubicación Geográfica de las Estaciones 3 2 Condiciones Climatológicas
Boletín Climatológico Anual de 2013 Estación meteorológica convencional y Telemétrica de Perquin, departamento de Morazán. ÍNDICE 1 Ubicación Geográfica de las Estaciones 3 2 Condiciones Climatológicas
PRONOSTICO CLIMATICO 2017
 PRONOSTICO CLIMATICO 2017 El pronóstico climático del 2017 está marcado por el posible retorno del fenómeno del Niño, por lo tanto, como consecuencia, de un aumento significativo de las temperaturas en
PRONOSTICO CLIMATICO 2017 El pronóstico climático del 2017 está marcado por el posible retorno del fenómeno del Niño, por lo tanto, como consecuencia, de un aumento significativo de las temperaturas en
