ESTRUCTURA DE LA MATERIA
|
|
|
- Vanesa Zúñiga Rico
- hace 5 años
- Vistas:
Transcripción
1 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 5/23/17 Interacciones Moleculares 0 5/23/17 Interacciones Moleculares 1 5/23/17 Interacciones Moleculares 2 1
2 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA Departamento de Física y Química Teórica Asesorias Física y Estructura de la materia Horario Lunes Martes Miércoles Jueves Viernes Martínez Anaya Oliver Ortega Bernal Pilar González Guadalupe Velásquez Escamilla González Guadalupe Zempoalteca 11:00-12:00 Castro Carlos Castro Ortega Raúl Martínez Anaya Oliver Ortega Bernal Pilar Castro González Guadalupe Velásquez Escamilla Carlos Castro González Guadalupe Ortega Zempoalteca Raúl 12:00-13:00 13:00-14:00 Martínez Anaya Oliver Flores Jerónimo Joaquín López Yépez Wendi Olga Flores Jerónimo Joaquín 14:00-15:00 Martínez Anaya Oliver Flores Jerónimo Joaquín López Yépez Wendi Olga 5/23/17 Interacciones Moleculares 3 5/23/17 Interacciones Moleculares 4 5/23/17 Interacciones Moleculares 5 2
3 ESTRUCTURA DE LA MATERIA Introducción Interacciones moleculares H-H 436 C-C 348 O-H 463 C=C 614 O-O 145 CºC 839 O=O 498 NºN 945 5/23/17 Interacciones Moleculares 6 5/23/17 Interacciones Moleculares 7 5/23/17 Interacciones Moleculares 8 3
4 Interacciones moleculares Interacciones moleculares Interacciones moleculares 5/23/17 Interacciones Moleculares 9 5/23/17 Interacciones Moleculares 10 5/23/17 Interacciones Moleculares 11 4
5 Polaridad del enlace Polaridad del enlace Polaridad del enlace 5/23/17 Interacciones Moleculares 12 5/23/17 Interacciones Moleculares 13 5/23/17 Interacciones Moleculares 14 5
6 Electronegatividad y polarización Electronegatividad y polarización Electronegatividad y polarización Compuesto F 2 HF LiF Δχ = (χ A -χ B ) = = =3.0 Tipo Covalente nopolar Covalente polar Iónico 5/23/17 Interacciones Moleculares 15 5/23/17 Interacciones Moleculares 16 5/23/17 Interacciones Moleculares 17 6
7 Redistribución de carga 5/23/17 Interacciones Moleculares 18 5/23/17 Interacciones Moleculares 19 5/23/17 Interacciones Moleculares 20 7
8 5/23/17 Interacciones Moleculares 21 5/23/17 Interacciones Moleculares 22 5/23/17 Interacciones Moleculares 23 8
9 Dipolos de enlace Dipolos de enlace Dipolo total Dipolo total cero 5/23/17 Interacciones Moleculares 24 5/23/17 Interacciones Moleculares 25 5/23/17 Interacciones Moleculares 26 9
10 Momento dipolo CH 4 = H H C H = H H C H = H H Cl Cl CCl 4 = Cl C Cl = Cl C Cl Cl Cl CH 3 Cl = H H C Cl = H H C Cl = H H CH 2 Cl 2 = H Cl C Cl = H Cl C Cl = CHCl 3 = H H Cl C Cl = H H Cl C Cl Cl Cl!"=1.90!"=1.60!"=1.04! µ = q r e 5/23/17 Interacciones Moleculares 27 5/23/17 Interacciones Moleculares 28 5/23/17 Interacciones Moleculares 29 10
11 Momento dipolo Cálculo del momento dipolo Porcentaje de carácter iónico! µ χ χ = Δ χ AB A B! µ χ χ = HCl Cl H ( )D = 0.9D #30!C!m! m = C 5/23/17 Interacciones Moleculares 30 5/23/17 Interacciones Moleculares = /23/17 Interacciones Moleculares 32 11
12 Porcentaje de carácter iónico Porcentaje de carácter iónico y χ Porcentaje de carácter iónico y c HF r(pm) 92 μ calc (D) 4.41 μ obs (D) 1.90 % CI=(μ obs / μ cal ) 43 %CI = 16( Δχ )+3.5( Δχ ) 2! HCl HBr HI %CI = 16( 0.54)+3.5( 0.54) 2 = 9.7! %CI AB = 1 e 1 4 χ A χ ( B) 100! 5/23/17 Interacciones Moleculares 33 5/23/17 Interacciones Moleculares 34 5/23/17 Interacciones Moleculares 35 12
13 Interacciones moleculares Interacciones moleculares E = Z + Z e 2 4πε 0 r Campo eléctrico Cercanía Iones 5/23/17 Interacciones Moleculares 36 5/23/17 Interacciones Moleculares 37 5/23/17 Interacciones Moleculares 38 13
14 Interacciones Ión-Dipolo Interacciones Ión-Dipolo E = Z ± µe 2 4πε 0 r 2 Sin campo eléctrico Con campo eléctrico 5/23/17 Interacciones Moleculares 39 5/23/17 Interacciones Moleculares 40 5/23/17 Interacciones Moleculares 41 14
15 Interacciones Dipolo-Dipolo Interacciones Dipolo-Dipolo E = 2µ 1 µ 2 4πε 0 r 3 E = 2µ µ 1 2 4πε 0 r 6 5/23/17 Interacciones Moleculares 43 5/23/17 Interacciones Moleculares 42 5/23/17 Interacciones Moleculares 44 15
16 Interacciones Dipolo-Dipolo Interacciones Dipolo-Dipolo 5/23/17 Interacciones Moleculares 45 5/23/17 Interacciones Moleculares 46 5/23/17 Interacciones Moleculares 47 16
17 5/23/17 Interacciones Moleculares 48 5/23/17 Interacciones Moleculares 49 Puente de Hidrógeno Energía (kj/mol) F H :F 160 O H :N 29 O H :O 21 HO H :OH H 2 N-H NH 3 17 N H :N 13 N H :O 8 HS-H SH 2 7 5/23/17 Interacciones Moleculares 50 17
18 5/23/17 Interacciones Moleculares 51 5/23/17 Interacciones Moleculares 52 5/23/17 Interacciones Moleculares 53 18
19 CH 4 Gas NH 3 Gas H 2 O Líquido HF Gas H 2 S Gas 5/23/17 Interacciones Moleculares 54 5/23/17 Interacciones Moleculares 55 5/23/17 Interacciones Moleculares 56 19
20 Estado líquido Estado sólido 5/23/17 Interacciones Moleculares 57 5/23/17 Interacciones Moleculares 58 5/23/17 Interacciones Moleculares 59 20
21 H 2 O HF H 2 Te H 2 S H 2 Se SbH 3 HI NH 3 AsH HCl 3 HBr SnH 4 PH 3 GeH 4 SiH CH 4 4 Interacciones de dispersión Interacciones de dispersión! E = 2µ α 1 dispersión r 6 Dipolo inducido Dipolo instantáneo Atracción 5/23/17 Interacciones Moleculares 60 5/23/17 Interacciones Moleculares 61 5/23/17 Interacciones Moleculares 62 21
22 Interacciones de dispersión Interacciones de dispersión Interacciones de dispersión 5/23/17 Interacciones Moleculares 63 5/23/17 Interacciones Moleculares 64 5/23/17 Interacciones Moleculares 65 22
23 Interacciones de dispersión Interacciones de dispersión Potencial de Lennard-Jones σ V LJ = 4ε r 12 σ 6 r 5/23/17 Interacciones Moleculares 66 5/23/17 Interacciones Moleculares 67 5/23/17 Interacciones Moleculares 68 23
24 Potencial de Lennard-Jones σ V LJ = 4ε r 12 σ 6 r 5/23/17 Interacciones Moleculares 69 Interacciones moleculares Int e r acc i ó n Covalente Ió nica Mod e l o Cuán tica Fu e rza mu y fuerte E = Z + Z mu y fuerte r Io n - dip olo E = Z ± µ fuer te r 2 Dipolo-dip olo E = 2µ 1 µ 2 moderad o r 3 Io n-dipolo induci do Dipolo-dip olo induci do Dispers ión de Lo ndon E = Z 2 α débil 2r 4 E = µ 2 1 α mu y débil r 6 E = 2µ 1 α mu y débil r 6 Función de r e -r, {r} cort o 1/r, {r} largo 1/r 2, {r} cort o 1/r 3, {r} cort o 1/r 4, {r} muy cort o 1/r 6, {r} cortís imo 1/r 6, {r} cortís imo 5/23/17 Interacciones Moleculares 70 TAREA 5/23/17 Interacciones Moleculares 71 24
25 TAREA 5/23/17 Interacciones Moleculares 72 25
10/1/18. Introducción. Interacciones moleculares. Interacciones moleculares H-H 436 C-C 348 O-H 463 C=C 614 O-O 145 CºC 839 O=O 498 NºN 945
 Introducción H-H 436 C-C 348 O-H 463 C=C 614 O-O 145 CºC 839 O=O 498 NºN 945 1/10/18 Interacciones Moleculares 1 Interacciones moleculares 1/10/18 Interacciones Moleculares 2 Interacciones moleculares
Introducción H-H 436 C-C 348 O-H 463 C=C 614 O-O 145 CºC 839 O=O 498 NºN 945 1/10/18 Interacciones Moleculares 1 Interacciones moleculares 1/10/18 Interacciones Moleculares 2 Interacciones moleculares
QUÍMICA INORGÁNICA I
 QUÍMICA INORGÁNICA I QUÍMICA INORGÁNICA I QUÍMICA INORGÁNICA I 15/09/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 0 15/09/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 1 15/09/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA
QUÍMICA INORGÁNICA I QUÍMICA INORGÁNICA I QUÍMICA INORGÁNICA I 15/09/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 0 15/09/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 1 15/09/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA
Fuerzas. Figura II.10: Las moléculas polares se atraen entre sí debido a la interacción de las cargas parciales de sus dipolos eléctricos.
 Fuerzas En las secciones anteriores se estudiaron las fuerzas de atracción entre átomos. Se considerarán ahora las fuerzas de atracción intermoleculares, es decir, las que actúan entre moléculas, iones
Fuerzas En las secciones anteriores se estudiaron las fuerzas de atracción entre átomos. Se considerarán ahora las fuerzas de atracción intermoleculares, es decir, las que actúan entre moléculas, iones
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 5/4/18 ESTRUCTURA MOLECULAR 0 5/4/18 ESTRUCTURA MOLECULAR 1 5/4/18 ESTRUCTURA MOLECULAR 2 1 ESTRUCTURA DE LA MATERIA ESTRUCTURA
ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 5/4/18 ESTRUCTURA MOLECULAR 0 5/4/18 ESTRUCTURA MOLECULAR 1 5/4/18 ESTRUCTURA MOLECULAR 2 1 ESTRUCTURA DE LA MATERIA ESTRUCTURA
qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos?
 qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos? Academia de Química, ITESM, campus Qro. 1 FUERZAS INTERMOLECULARES Academia de Química, ITESM, campus Qro. 2 FUERZAS INTERMOLECULARES
qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos? Academia de Química, ITESM, campus Qro. 1 FUERZAS INTERMOLECULARES Academia de Química, ITESM, campus Qro. 2 FUERZAS INTERMOLECULARES
Décimo novena sesión. Fuerzas Intermoleculares
 Décimo novena sesión Fuerzas Intermoleculares Introducción Las fuerzas que unen a los átomos en una molécula se deben al enlace químico. La energía requerida para romper este tipo de enlaces se llama energía
Décimo novena sesión Fuerzas Intermoleculares Introducción Las fuerzas que unen a los átomos en una molécula se deben al enlace químico. La energía requerida para romper este tipo de enlaces se llama energía
20.-/ a) Cu: Metálico ; BCl 3 : Covalente ; H 2 O: Covalente ; CsF: Iónico b) BCl 3 : Triangular plana y APOLAR ; H 2 O: Angular y POLAR.
 SOLUCIONES EL Y PROPIEDADES HOJA Nº 7 1.-/ a) Lineal b) Tetraédrica c) Angular d) Angular e) Piramidal trigonal 2.-/ a) Tetraédrica b) Tetraédrica c) Lineal d) Triangular e) Tetraédrica 3.-/ a) 769,2 kj/mol
SOLUCIONES EL Y PROPIEDADES HOJA Nº 7 1.-/ a) Lineal b) Tetraédrica c) Angular d) Angular e) Piramidal trigonal 2.-/ a) Tetraédrica b) Tetraédrica c) Lineal d) Triangular e) Tetraédrica 3.-/ a) 769,2 kj/mol
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 5/4/17 ESTRUCTURA MOLECULAR 0 5/4/17 ESTRUCTURA MOLECULAR 1 5/4/17 ESTRUCTURA MOLECULAR 2 1 ESTRUCTURA DE LA MATERIA ESTRUCTURA
ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 5/4/17 ESTRUCTURA MOLECULAR 0 5/4/17 ESTRUCTURA MOLECULAR 1 5/4/17 ESTRUCTURA MOLECULAR 2 1 ESTRUCTURA DE LA MATERIA ESTRUCTURA
ESTRUCTURA DE LA MATERIA
 04/04/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 0 04/04/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 1 04/04/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 2 1 Departamento de Física y Química Teórica Asesorias 2017-2
04/04/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 0 04/04/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 1 04/04/17 FUNDAMENTOS DE LA MECÁNICA CUÁNTICA 2 1 Departamento de Física y Química Teórica Asesorias 2017-2
Parámetros de enlace. Jesús Gracia Mora
 Parámetros de enlace Jesús Gracia Mora La presentación, material adicional, ejercicios y bibliografía se encuentran a su disposición en: http://depa.pquim.unam.mx/qi/ Que es un enlace químico? Diferentes
Parámetros de enlace Jesús Gracia Mora La presentación, material adicional, ejercicios y bibliografía se encuentran a su disposición en: http://depa.pquim.unam.mx/qi/ Que es un enlace químico? Diferentes
Clase de Interacciones Intermoleculares. Milton de la Fuente. 27 de marzo de 2007
 27 de marzo de 2007 intermoleculares Porqué se derrite el helado pero no el cono? intermoleculares Son responsables de 1. Las propiedades macroscópicas de la materia 2. Los estados condensados 3. El comportamiento
27 de marzo de 2007 intermoleculares Porqué se derrite el helado pero no el cono? intermoleculares Son responsables de 1. Las propiedades macroscópicas de la materia 2. Los estados condensados 3. El comportamiento
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 5/4/17 ESTRUCTURA MOLECULAR 0 5/4/17 ESTRUCTURA MOLECULAR 1 5/4/17 ESTRUCTURA MOLECULAR 1 ESTRUCTURA DE LA MATERIA ESTRUCTURA
ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 5/4/17 ESTRUCTURA MOLECULAR 0 5/4/17 ESTRUCTURA MOLECULAR 1 5/4/17 ESTRUCTURA MOLECULAR 1 ESTRUCTURA DE LA MATERIA ESTRUCTURA
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
ESTRUCTURA DE LA MATERIA FUERZAS INTERMOLECULARES Introducción Semestre Rafael Moreno Esparza
 ESTRUCTURA DE LA MATERIA FUERZAS INTERMOLECULARES Introducción Semestre 2009-1 Rafael Moreno Esparza 26/11/08 FUERZAS INTERMOLECULARES 0 Polaridad del enlace Pareciera claro, que cuando dos átomos de un
ESTRUCTURA DE LA MATERIA FUERZAS INTERMOLECULARES Introducción Semestre 2009-1 Rafael Moreno Esparza 26/11/08 FUERZAS INTERMOLECULARES 0 Polaridad del enlace Pareciera claro, que cuando dos átomos de un
MOLÉCULAS POLAReS Y NO POLAReS
 MOLÉCULAS POLAReS Y NO POLAReS Una molécula polar presenta distribución asimétrica de las cargas eléctricas debido a la diferencia de electronegatividad de los átomos que la forman. Presenta dos zonas
MOLÉCULAS POLAReS Y NO POLAReS Una molécula polar presenta distribución asimétrica de las cargas eléctricas debido a la diferencia de electronegatividad de los átomos que la forman. Presenta dos zonas
Parámetros de enlace. Jesús Gracia Mora
 Parámetros de enlace Jesús Gracia Mora Que es un enlace químico? Diferentes definiciones: Se establece un enlace químico entre dos átomos o grupos de átomos cuando las fuerzas que actúan entre ellos son
Parámetros de enlace Jesús Gracia Mora Que es un enlace químico? Diferentes definiciones: Se establece un enlace químico entre dos átomos o grupos de átomos cuando las fuerzas que actúan entre ellos son
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
QUÍMICA ESTRUCTURAL II
 transparent www.profesorjrc.es 7 de noviembre de 2013 Enlace Covalente Enlace Covalente Compartición electrónica entre los átomos implicados Enlace Covalente Compartición electrónica entre los átomos implicados
transparent www.profesorjrc.es 7 de noviembre de 2013 Enlace Covalente Enlace Covalente Compartición electrónica entre los átomos implicados Enlace Covalente Compartición electrónica entre los átomos implicados
UNIONES Y ENLACES QUÍMICOS Elaborado por: Lic. Raúl Hernández Mazariegos
 UNIONES Y ENLACES QUÍMICOS Elaborado por: Lic. Raúl Hernández Mazariegos Defina o explique los siguientes términos: 1. Enlace iónico: 2. Catión: 3. Enlace covalente: 4. Enlace covalente coordinado: 5.
UNIONES Y ENLACES QUÍMICOS Elaborado por: Lic. Raúl Hernández Mazariegos Defina o explique los siguientes términos: 1. Enlace iónico: 2. Catión: 3. Enlace covalente: 4. Enlace covalente coordinado: 5.
Interacciones moleculares
 Interacciones moleculares Recuerde Gas: Interacciones entre partículas son mínimas. Sólido y líquido: Interacciones entre partículas son suficientes para mantenerlas cerca (aunque los sólidos tienen diferentes
Interacciones moleculares Recuerde Gas: Interacciones entre partículas son mínimas. Sólido y líquido: Interacciones entre partículas son suficientes para mantenerlas cerca (aunque los sólidos tienen diferentes
FUERZAS INTERMOLECULARES. Elementos de Fisicoquímica UNEXPO
 FUERZAS INTERMOLECULARES Elementos de Fisicoquímica UNEXPO Las fuerzas intermoleculares son interacciones entre moléculas. Las propiedades físicas de los sólidos y líquidos moleculares (fases condensadas)
FUERZAS INTERMOLECULARES Elementos de Fisicoquímica UNEXPO Las fuerzas intermoleculares son interacciones entre moléculas. Las propiedades físicas de los sólidos y líquidos moleculares (fases condensadas)
TEMA 3 ENLACE QUÍMICO (PARTE 2)
 TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
Fuerzas intermoleculares
 Fuerzas intermoleculares Las fuerzas intermoleculares son aquellas interacciones que se dan entre las moléculas y hacen que éstas se mantengan unidas. Momento dipolar El momento dipolar se da en las sustancias
Fuerzas intermoleculares Las fuerzas intermoleculares son aquellas interacciones que se dan entre las moléculas y hacen que éstas se mantengan unidas. Momento dipolar El momento dipolar se da en las sustancias
Tipos de enlaces. Intramoleculares: Intermoleculares: Metálico. Iónico. Covalente. Fuerzas de Van de Waals Enlaces de hidrógeno.
 El enlace químico Tipos de enlaces Intramoleculares: Iónico. Covalente. Intermoleculares: Fuerzas de Van de Waals Enlaces de hidrógeno. Metálico. Enlace iónico Se define como la fuerza electrostática
El enlace químico Tipos de enlaces Intramoleculares: Iónico. Covalente. Intermoleculares: Fuerzas de Van de Waals Enlaces de hidrógeno. Metálico. Enlace iónico Se define como la fuerza electrostática
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2018 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 018 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 018 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2017 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 017 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 017 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva,
INSTITUCIÒN EDUCATIVA JUAN MARIA CESPEDES. DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 10º FUERZAS INTERMOLECULARES
 INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 10º FUERZAS INTERMOLECULARES
INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 10º FUERZAS INTERMOLECULARES
Modelo Pregunta 1A a) b) c) d) Septiembre Pregunta A1 a) b) c) d) Junio Pregunta B1.- a) b) c) d) Junio Pregunta A1.
 Modelo 2018. Pregunta 1A.- Considere las sustancias I 2, Cu y CaO y conteste razonadamente: a) Qué tipo de enlace presenta cada una de ellas. b) Cuál tiene menor punto de fusión. c) Cuál conduce la electricidad
Modelo 2018. Pregunta 1A.- Considere las sustancias I 2, Cu y CaO y conteste razonadamente: a) Qué tipo de enlace presenta cada una de ellas. b) Cuál tiene menor punto de fusión. c) Cuál conduce la electricidad
Clase 16 Tema: Indicadores y ph metros
 Bimestre: III Número de clase: 16 Ciencias 9 Clase 16 Tema: Indicadores y ph metros Actividad 46 Lea el siguiente texto para desarrollar a partir de él, el laboratorio que le sigue. Lectura 27 Cómo elaborar
Bimestre: III Número de clase: 16 Ciencias 9 Clase 16 Tema: Indicadores y ph metros Actividad 46 Lea el siguiente texto para desarrollar a partir de él, el laboratorio que le sigue. Lectura 27 Cómo elaborar
Energías de Interacción
 Química General e Inorgánica A Energías de Interacción Tema 7 Fuerzas intermoleculares Fuerzas intermoleculares son fuerzas de atracción entre las moléculas Fuerzas intramoleculares mantienen juntos a
Química General e Inorgánica A Energías de Interacción Tema 7 Fuerzas intermoleculares Fuerzas intermoleculares son fuerzas de atracción entre las moléculas Fuerzas intramoleculares mantienen juntos a
transparent ENLACE QUÍMICO Prof. Jorge Rojo Carrascosa 11 de diciembre de 2014
 transparent www.profesorjrc.es 11 de diciembre de 2014 Enlace Iónico I Atomo muy metálico + Atomo no metálico Cristal iónico Enlace Iónico I Atomo muy metálico + Atomo no metálico Cristal iónico Propiedades:
transparent www.profesorjrc.es 11 de diciembre de 2014 Enlace Iónico I Atomo muy metálico + Atomo no metálico Cristal iónico Enlace Iónico I Atomo muy metálico + Atomo no metálico Cristal iónico Propiedades:
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
QUÍMICA ESTRUCTURAL II. ENLACE COVALENTE.
 QUÍMICA ESTRUCTURAL II. ENLACE COVALENTE. 1. Para las siguientes especies químicas: F 2, NaCl, CsF, H 2 S, AsH 3 y SiH 4, explica razonadamente: a) Cuáles tendrán enlaces covalentes puros. b) Cuáles tendrán
QUÍMICA ESTRUCTURAL II. ENLACE COVALENTE. 1. Para las siguientes especies químicas: F 2, NaCl, CsF, H 2 S, AsH 3 y SiH 4, explica razonadamente: a) Cuáles tendrán enlaces covalentes puros. b) Cuáles tendrán
Propiedades de los enlaces y de las moléculas
 Propiedades de los enlaces y de las moléculas Dr. Enrique Ruiz Trejo Las leyes fundamentales necesarias para el tratamiento matemático de gran parte de la física y para toda la química ya son conocidas
Propiedades de los enlaces y de las moléculas Dr. Enrique Ruiz Trejo Las leyes fundamentales necesarias para el tratamiento matemático de gran parte de la física y para toda la química ya son conocidas
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
TEMA 4. EL ENLACE QUIMICO
 @quimicapau: Podríamos decir que los osos polares son más solubles en agua?... Piénsalo TEMA 4. EL ENLACE QUIMICO Cuáles son los conceptos y ejercicios clave de este tema? CONCEPTO A REPASAR EJERCICIO
@quimicapau: Podríamos decir que los osos polares son más solubles en agua?... Piénsalo TEMA 4. EL ENLACE QUIMICO Cuáles son los conceptos y ejercicios clave de este tema? CONCEPTO A REPASAR EJERCICIO
Tema 7: Otros tipos de enlace - 1 -
 Tema 7: Otros tipos de enlace - 1 - BIBLIOGRAFÍA: * Fundamentos de Química General J.L. Lozano y J.L. Vigata * Temas básicos de Química J. Morcillo * Química General R.H. Petrucci, W.S. Harwood y F.G.
Tema 7: Otros tipos de enlace - 1 - BIBLIOGRAFÍA: * Fundamentos de Química General J.L. Lozano y J.L. Vigata * Temas básicos de Química J. Morcillo * Química General R.H. Petrucci, W.S. Harwood y F.G.
Preguntas Propuestas
 Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
Tema 2: Fuerzas intermoleculares
 Tema 2: Fuerzas intermoleculares Fuerzas intermoleculares: definición y tratamiento general. Interacciones iónicas. Energía reticular. Moléculas polares. Puentes de Hidrógeno. Moléculas apolares. Gases
Tema 2: Fuerzas intermoleculares Fuerzas intermoleculares: definición y tratamiento general. Interacciones iónicas. Energía reticular. Moléculas polares. Puentes de Hidrógeno. Moléculas apolares. Gases
INORGÁNICA I. TERMODINÁMICA QUÍMICA Introducción Semestre QUÍMICA. Termodinámica. Rafael Moreno Esparza
 QUÍMICA INORGÁNICA I TERMODINÁMICA QUÍMICA Introducción Semestre 2009-1 Rafael Moreno Esparza 26/11/08 TERMODINÁMICA QUÍMICA 0 Termodinámica Sistema: es el pedazo del universo que estudiamos. Entorno:
QUÍMICA INORGÁNICA I TERMODINÁMICA QUÍMICA Introducción Semestre 2009-1 Rafael Moreno Esparza 26/11/08 TERMODINÁMICA QUÍMICA 0 Termodinámica Sistema: es el pedazo del universo que estudiamos. Entorno:
Geometría molecular: Teoría de Repulsión de los Pares de Electrones de la Capa de Valencia (RPECV) Terminología:
 Geometría molecular: Teoría de Repulsión de los Pares de Electrones de la Capa de Valencia (RPECV) Terminología: Geometría molecular: distribución tridimensional de los núcleos atómicos en una molécula.
Geometría molecular: Teoría de Repulsión de los Pares de Electrones de la Capa de Valencia (RPECV) Terminología: Geometría molecular: distribución tridimensional de los núcleos atómicos en una molécula.
Capitulo 8 Fuerzas intermoleculares.
 Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
ENLACES SECUNDARIOS O DÉBILES
 ENLACES SECUNDARIOS O DÉBILES Fuerzas intramoleculares o enlaces primarios 2 Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (interior de la molécula) y son los enlaces
ENLACES SECUNDARIOS O DÉBILES Fuerzas intramoleculares o enlaces primarios 2 Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (interior de la molécula) y son los enlaces
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Regla del octeto. Gilbert Newton Lewis
 Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
QUÍMICA ESTRUCTURAL I-II
 QUÍMICA ESTRUCTURAL I-II 1. Para las siguientes especies químicas: F 2, NaCl, CsF, H 2 S, AsH 3 y SiH 4, explica razonadamente: a) Cuáles tendrán enlaces covalentes puros. b) Cuáles tendrán enlaces covalentes
QUÍMICA ESTRUCTURAL I-II 1. Para las siguientes especies químicas: F 2, NaCl, CsF, H 2 S, AsH 3 y SiH 4, explica razonadamente: a) Cuáles tendrán enlaces covalentes puros. b) Cuáles tendrán enlaces covalentes
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
M A T E R I A L E S ENLACES QUIMICOS
 M A T E R I A L E S ENLACES QUIMICOS I FUERZAS DE ATRACCIÓN Intramoleculares: entre átomos de una molécula Determinan tipo de sustancia y propiedades químicas. Intermoleculares: entre moléculas Determinan
M A T E R I A L E S ENLACES QUIMICOS I FUERZAS DE ATRACCIÓN Intramoleculares: entre átomos de una molécula Determinan tipo de sustancia y propiedades químicas. Intermoleculares: entre moléculas Determinan
Tema 10. FUERZAS INTERMOLECULARES
 Tema 10. FUERZAS INTERMOLECULARES Introducción Polaridad de las moléculas Interacciones de dipolos Interacciones de dipolos inducidos Enlace de hidrógeno Efectos de las fuerzas químicas Tipos de estructuras
Tema 10. FUERZAS INTERMOLECULARES Introducción Polaridad de las moléculas Interacciones de dipolos Interacciones de dipolos inducidos Enlace de hidrógeno Efectos de las fuerzas químicas Tipos de estructuras
n = = 1; 1234; 4; l l= = 0; 1; m m = = 0; 0 ; + 0; s 12; 2; = s s s = ½ ½
 ENLACE QUÍMICO 2012 6p 5d Energía 6s 4 f 5p 4d 5s 4s 4p 3d 3p 3s 2s 1s 2p nn == 4; 1; 2; 3; 0; 2; + 0; 2; ss = s= += +½ 1; ll == 1; 2; 3; 4; 0; m 2; 1; m == + 1; 0; 2; 1; s= +½ +½ ½ Enlaces según
ENLACE QUÍMICO 2012 6p 5d Energía 6s 4 f 5p 4d 5s 4s 4p 3d 3p 3s 2s 1s 2p nn == 4; 1; 2; 3; 0; 2; + 0; 2; ss = s= += +½ 1; ll == 1; 2; 3; 4; 0; m 2; 1; m == + 1; 0; 2; 1; s= +½ +½ ½ Enlaces según
Uniones Intermoleculares
 Fuerzas y uniones intermoleculares Uniones Intermoleculares Se establecen entre cargas eléctricas de dos moléculas o especies químicas Distinguimos 3 tipos principales: Unión entre dos iones (unión iónica)
Fuerzas y uniones intermoleculares Uniones Intermoleculares Se establecen entre cargas eléctricas de dos moléculas o especies químicas Distinguimos 3 tipos principales: Unión entre dos iones (unión iónica)
UNIONES INTERMOLECULARES
 UNIONES INTERMOLECULARES Los átomos se unen para formar moléculas por uniones INTRAMOLECULARES (enlaces iónicos, covalentes, metálicos). Estas fuerzas son las que deben vencerse para producir un CAMBIO
UNIONES INTERMOLECULARES Los átomos se unen para formar moléculas por uniones INTRAMOLECULARES (enlaces iónicos, covalentes, metálicos). Estas fuerzas son las que deben vencerse para producir un CAMBIO
Unidad I Sub-Unidad 1.2.
 Unidad I Sub-Unidad 1.2. Objetivos: Conocer qué es un enlace químico. Estudiar los tipos de enlaces químicos. Conocer las diferentes fuerzas intermoleculares y su importancia. Qué es un ENLACE QUÍMICO?
Unidad I Sub-Unidad 1.2. Objetivos: Conocer qué es un enlace químico. Estudiar los tipos de enlaces químicos. Conocer las diferentes fuerzas intermoleculares y su importancia. Qué es un ENLACE QUÍMICO?
QUÍMICA 2º BACHILLERATO
 Y PROPIEDADES 1.-/ Represente las estructuras de Lewis y utilizando el Modelo de Repulsión de los Pares de Electrones de la Capa de Valencia (Teoría V.S.E.P.R.) prediga la geometría de las siguientes especies:
Y PROPIEDADES 1.-/ Represente las estructuras de Lewis y utilizando el Modelo de Repulsión de los Pares de Electrones de la Capa de Valencia (Teoría V.S.E.P.R.) prediga la geometría de las siguientes especies:
Tema 6- Enlace químico en sistemas moleculares
 Tema 6- Enlace químico en sistemas moleculares Diagrama de energía frente a distancia interatómica 2 Enlace en moléculas Intramolecular: El enlace entre átomos en las moléculas es enlace covalente Intermolecular:
Tema 6- Enlace químico en sistemas moleculares Diagrama de energía frente a distancia interatómica 2 Enlace en moléculas Intramolecular: El enlace entre átomos en las moléculas es enlace covalente Intermolecular:
Tema 4. Fuerzas intermoleculares
 Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Enlace químico. 5. Dadas las siguientes sustancias: CS 2 (lineal), HCN (lineal), NH 3 (piramidal) y H 2 O (angular):
 Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
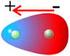 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
20.-/ a) Cu: Metálico ; BCl 3 : Covalente ; H 2 O: Covalente ; CsF: Iónico b) BCl 3 : Triangular plana y APOLAR ; H 2 O: Angular y POLAR.
 SOLUCIONES EL Y PROPIEDADES HOJA Nº 7 1.-/ a) Lineal b) Tetraédrica c) Angular d) Angular e) Piramidal trigonal 2.-/ a) Tetraédrica b) Tetraédrica c) Lineal d) Triangular e) Tetraédrica 3.-/ a) 769,2 kj/mol
SOLUCIONES EL Y PROPIEDADES HOJA Nº 7 1.-/ a) Lineal b) Tetraédrica c) Angular d) Angular e) Piramidal trigonal 2.-/ a) Tetraédrica b) Tetraédrica c) Lineal d) Triangular e) Tetraédrica 3.-/ a) 769,2 kj/mol
Regla del octeto Gilbert Newton Lewis
 Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
Regla del dueto. Regla del octeto
 ENLACES QUIMICOS Los ENLACES QUÍMICOS son las fuerzas de atracción que mantienen unidos a los átomos o iones formando agrupaciones de mayor estabilidad (contienen menor energía). Los átomos en general
ENLACES QUIMICOS Los ENLACES QUÍMICOS son las fuerzas de atracción que mantienen unidos a los átomos o iones formando agrupaciones de mayor estabilidad (contienen menor energía). Los átomos en general
ENLACE QUÍMICO. Elemento F O Cl N C S H Electronegatividad 4,0 3,5 3,0 3,0 2,5 2,5 2,1
 ENLACE QUÍMICO 1 - a) Diseñe un ciclo de Born-Haber para el MgCl 2. b) Defina el menos cuatro de los siguientes conceptos: - Energía de ionización. - Energía de disociación. - Afinidad electrónica. - Energía
ENLACE QUÍMICO 1 - a) Diseñe un ciclo de Born-Haber para el MgCl 2. b) Defina el menos cuatro de los siguientes conceptos: - Energía de ionización. - Energía de disociación. - Afinidad electrónica. - Energía
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias
 Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
COMPARACIÓN MOLECULAR DE LOS ESTADOS DE LA MATERIA. 27/05/2014 Carlos Urzúa Stricker 1
 COMPARACIÓN MOLECULAR DE LOS ESTADOS DE LA MATERIA 27/05/2014 Carlos Urzúa Stricker 1 CARACTERISTICAS GENERALES DE LOS LÍQUIDOS Y DE SUS SOLUCIONES Aun cuando las partículas (átomos o moléculas)que constituyen
COMPARACIÓN MOLECULAR DE LOS ESTADOS DE LA MATERIA 27/05/2014 Carlos Urzúa Stricker 1 CARACTERISTICAS GENERALES DE LOS LÍQUIDOS Y DE SUS SOLUCIONES Aun cuando las partículas (átomos o moléculas)que constituyen
2
 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Estructura de Lewis, geometría y polaridad. TEMA 3: ENLACE QUÍMICO 1. Dadas las siguientes sustancias: CS 2, HCN, NH 3 y H 2 O,
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Estructura de Lewis, geometría y polaridad. TEMA 3: ENLACE QUÍMICO 1. Dadas las siguientes sustancias: CS 2, HCN, NH 3 y H 2 O,
QUIMICA EN SOLUCION ACUOSA
 QUIMICA EN SOLUCION ACUOSA EQUILIBRIOS Soluciones (mezclas) Solubilidad Acido base Complejos Oxidación Reducción Química Analítica Cualitativa: SOLUCIONES 1 MEZCLA Sistema continuo constituido por más
QUIMICA EN SOLUCION ACUOSA EQUILIBRIOS Soluciones (mezclas) Solubilidad Acido base Complejos Oxidación Reducción Química Analítica Cualitativa: SOLUCIONES 1 MEZCLA Sistema continuo constituido por más
Tema 17. Tema 17. Fuerzas intermoleculares Concepto de fuerza intermolecular Concepto de fuerza intermolecular
 Tema 7 uerzas intermoleculares 7. Concepto e fuerza intermolecular 7. Tipos e fuerzas intermoleculares 7. Concepto e fuerza intermolecular Las fuerzas intermoleculares son fuerzas e atracción entre átomos
Tema 7 uerzas intermoleculares 7. Concepto e fuerza intermolecular 7. Tipos e fuerzas intermoleculares 7. Concepto e fuerza intermolecular Las fuerzas intermoleculares son fuerzas e atracción entre átomos
Medicina Veterinaria. Parte I
 Medicina Veterinaria QUÍMICA ORGÁNICA Parte I Moléculas Polares y No Polares Moléculas No Polares: Los electrones están distribuidos simétricamente en la molécula y el centro de las cargas eléctricas coincide
Medicina Veterinaria QUÍMICA ORGÁNICA Parte I Moléculas Polares y No Polares Moléculas No Polares: Los electrones están distribuidos simétricamente en la molécula y el centro de las cargas eléctricas coincide
Enlace Químico: Enlace Iónico y Enlace Covalente. AUTHOR: VICENTE GUZMÁN BROTÓNS
 Ejercicio nº 1 De los compuestos iónicos KBr y NaBr, cuál será el más duro y cuál el de mayor temperatura de fusión? Por qué? Ejercicio nº 1 Coloca las siguientes moléculas por orden creciente de su polaridad:
Ejercicio nº 1 De los compuestos iónicos KBr y NaBr, cuál será el más duro y cuál el de mayor temperatura de fusión? Por qué? Ejercicio nº 1 Coloca las siguientes moléculas por orden creciente de su polaridad:
ENLACE QUÍMICO. NaCl. Grafito: láminas de átomos de carbono
 NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
TEMA 2.2 ENLACE QUÍMICO
 IES TURANIANA TEMA 2.2 ENLACE QUÍMICO QUÍMICA 2º BACHILLERATO CUESTIONES SOBRE SUSTANCIAS COVALENTES 1. Dada la gráfica adjunta, justifique: a) El tipo de enlace dentro de cada compuesto. b) La variación
IES TURANIANA TEMA 2.2 ENLACE QUÍMICO QUÍMICA 2º BACHILLERATO CUESTIONES SOBRE SUSTANCIAS COVALENTES 1. Dada la gráfica adjunta, justifique: a) El tipo de enlace dentro de cada compuesto. b) La variación
2/15/2013. Estructura ENLACE QUIMICO Y MOLÉCULAS. Tipos de enlace Enlace iónico Enlace metálico Enlace covalente CH 4 CH 3 OH.
 ENLACE QUIMICO Y MOLÉCULAS Tipos de enlace Enlace iónico Enlace metálico Enlace covalente Símbolos de Lewis y regla dl del octeto Compuestos químicos: Representaciones Metano CH 4 Etanol CH 3 OH Ácido
ENLACE QUIMICO Y MOLÉCULAS Tipos de enlace Enlace iónico Enlace metálico Enlace covalente Símbolos de Lewis y regla dl del octeto Compuestos químicos: Representaciones Metano CH 4 Etanol CH 3 OH Ácido
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
En general, las fuerzas intermoleculares poseen solo un 15% en magnitud que la fuerza de los enlaces iónicos o covalentes.
 Fuerzas intramoleculares La fuerza que mantiene unidos a los átomos de una molécula. Es una fuerza química o intramolecular. Fuerzas intermoleculares La fuerza que une a las moléculas unas con otras. Es
Fuerzas intramoleculares La fuerza que mantiene unidos a los átomos de una molécula. Es una fuerza química o intramolecular. Fuerzas intermoleculares La fuerza que une a las moléculas unas con otras. Es
Química Orgánica Licenciatura en Nutrición. Docentes: Alejandro A. Orden Mónica Ferrari Martín Palazzolo
 Química Orgánica Licenciatura en Nutrición Docentes: Alejandro A. Orden Mónica Ferrari Martín Palazzolo Por qué estudiar química orgánica??? La química orgánica en los alimentos Lípidos Hidratos de carbono
Química Orgánica Licenciatura en Nutrición Docentes: Alejandro A. Orden Mónica Ferrari Martín Palazzolo Por qué estudiar química orgánica??? La química orgánica en los alimentos Lípidos Hidratos de carbono
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables.
 TEMA 3. ENLACE QUÍMICO Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables. Para explicar el enlace químico,
TEMA 3. ENLACE QUÍMICO Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables. Para explicar el enlace químico,
SEMANA 3 ESTRUCTURAS DE LEWIS Y FUERZAS INTERMOLECULARES Elaborado por: Lic. Raúl Hernández M.
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 201 SEMANA ESTRUCTURAS DE LEWIS Y FUERZAS INTERMOLECULARES Elaborado por:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 201 SEMANA ESTRUCTURAS DE LEWIS Y FUERZAS INTERMOLECULARES Elaborado por:
Uniones Químicas. Iónicas Covalentes Metálicas
 Uniones Químicas Iónicas Covalentes Metálicas Unión iónica Propiedades de los Compuestos iónicos - Puntos de fusión y ebullición elevados - Sólidos duros y quebradizos - Baja conductividad eléctrica y
Uniones Químicas Iónicas Covalentes Metálicas Unión iónica Propiedades de los Compuestos iónicos - Puntos de fusión y ebullición elevados - Sólidos duros y quebradizos - Baja conductividad eléctrica y
07/02/2015 EL ENLACE QUÍMICO. Tema 5
 EL ENLACE QUÍMICO Tema 5 Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
EL ENLACE QUÍMICO Tema 5 Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
FORMAS MOLECULARES. La geometría molecular estudia la distribución espacial de los átomos en la molécula.
 GEOMETRÍA MOLECULAR FORMAS MOLECULARES Anteriormente utilizamos las estructuras de Lewis para explicar las fórmulas de los compuestos covalentes. Sin embargo, estas estructuras no indican las formas de
GEOMETRÍA MOLECULAR FORMAS MOLECULARES Anteriormente utilizamos las estructuras de Lewis para explicar las fórmulas de los compuestos covalentes. Sin embargo, estas estructuras no indican las formas de
Enlace Químico. Principios de Estructura de la Materia. Sigfrido Escalante Tovar feb-2010
 Enlace Químico Principios de Estructura de la Materia Sigfrido Escalante Tovar feb-2010 El enlace químico Es un concepto tan común para los químicos que, muchas veces, nos olvidamos que es solamente eso,
Enlace Químico Principios de Estructura de la Materia Sigfrido Escalante Tovar feb-2010 El enlace químico Es un concepto tan común para los químicos que, muchas veces, nos olvidamos que es solamente eso,
ESTRUCTURA DEL NÚCLEO
 ESTRUCTURA DEL NÚCLEO 1. Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes átomos: 7 75 10 12 a) 3Li b) 33As c) 5B d) 6C 2. Calcula
ESTRUCTURA DEL NÚCLEO 1. Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes átomos: 7 75 10 12 a) 3Li b) 33As c) 5B d) 6C 2. Calcula
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES
 ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
Taller de Recuperación de química Grado: Octavo
 I N S T I T U C I Ó N E D U C A T I V A A L T A V I S T A MEDELLÍN - ANTIOQUIA Creada mediante Resolución N 014898 de diciembre 3 de 2015, y Modificada mediante Resolución N 001263 de febrero 7 de 2017
I N S T I T U C I Ó N E D U C A T I V A A L T A V I S T A MEDELLÍN - ANTIOQUIA Creada mediante Resolución N 014898 de diciembre 3 de 2015, y Modificada mediante Resolución N 001263 de febrero 7 de 2017
Estructura de la Materia
 Estructura de la Materia Décimo quinta sesión Estructura Molecular Propiedades que dependen del enlace químico Longitud de enlace Es la distancia entre dos núcleos en un enlace químico Energía de enlace
Estructura de la Materia Décimo quinta sesión Estructura Molecular Propiedades que dependen del enlace químico Longitud de enlace Es la distancia entre dos núcleos en un enlace químico Energía de enlace
Geometría molecular. Molécula angular
 Geometría molecular Geometría o forma molecular es la disposición tridimensional de los átomos que constituyen la molécula. Debido al carácter direccional de enlace covalente, las moléculas tienen una
Geometría molecular Geometría o forma molecular es la disposición tridimensional de los átomos que constituyen la molécula. Debido al carácter direccional de enlace covalente, las moléculas tienen una
Química Inorgánica I Curso Intersemestral semestre: 16-2
 Química Inorgánica I Curso Intersemestral semestre: 6-2 EJERCICIOS COMPLEMENTARIOS Indica cuál es el núcleo X que se produce en la siguiente reacción nuclear. 5 N + p + X + α a) 3 C b) 5 º c) 2 C d) 4
Química Inorgánica I Curso Intersemestral semestre: 6-2 EJERCICIOS COMPLEMENTARIOS Indica cuál es el núcleo X que se produce en la siguiente reacción nuclear. 5 N + p + X + α a) 3 C b) 5 º c) 2 C d) 4
Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES
 Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES Todo gas, si se enfría y comprime suficientemente, se transforma en un líquido. La causa son las fuerzas intermoleculares, fuerzas de atracción
Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES Todo gas, si se enfría y comprime suficientemente, se transforma en un líquido. La causa son las fuerzas intermoleculares, fuerzas de atracción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Enlaces químicos I: conceptos básicos. Capítulo 9
 Enlaces químicos I: conceptos básicos Capítulo 9 Los electrones de valencia son los últimos electrones de un orbital en un átomo, que son los causantes de los enlaces químicos. Grupo e - configuración
Enlaces químicos I: conceptos básicos Capítulo 9 Los electrones de valencia son los últimos electrones de un orbital en un átomo, que son los causantes de los enlaces químicos. Grupo e - configuración
2 cuerpos = enlace 3 cuerpos = angulo 4 cuerpos = angulo torsional
 2 cuerpos = enlace 3 cuerpos = angulo 4 cuerpos = angulo torsional La estructura de una molécula depende de su energía ya que la distribución electrónica define ángulos de enlaces existen distintas conformaciones
2 cuerpos = enlace 3 cuerpos = angulo 4 cuerpos = angulo torsional La estructura de una molécula depende de su energía ya que la distribución electrónica define ángulos de enlaces existen distintas conformaciones
Fuerzas de Van der Waals. Fuerzas de dispersión London
 FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
