IES La Magdalena. Avilés. Asturias. El átomo
|
|
|
- Ramón Farías Villalba
- hace 7 años
- Vistas:
Transcripción
1 El átomo IES La Magdalena. Avilés. Asturias Demócrito ( a.c) En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la materia estaba formada por pequeñas partículas indivisibles, llamadas átomos. Entre los átomos habría vacío. Aristóteles era partidario de la teoría de los cuatro elementos, según la cual toda la materia estaría formada por la combinación de cuatro elementos: aire, agua, tierra y fuego. La teoría de los cuatro elementos fue la aceptada durante muchos siglos. Siguiendo la teoría aristotélica los alquimistas (que están considerados como los primeros químicos) intentaban obtener la Piedra Filosofal que les permitiría transmutar los metales en oro, curar cualquier enfermedad y evitar, incluso, la vejez y la muerte. Su incesante trabajo en el laboratorio dio como fruto la invención o perfeccionamiento de muchos procedimientos aún hoy usados en los laboratorios (entre ellos la destilación), la síntesis de numerosos compuestos (como el ácido clorhídrico, sulfúrico o nítrico), el descubrimiento de técnicas metalúrgicas, la producción de tintes, pinturas o cosméticos etc. Aristóteles ( a.c) En 1808 John Dalton recupera la teoría atómica de Demócrito y considera que los átomos (partículas indivisibles) eran los constituyentes últimos de la materia que se combinaban para formar los compuestos. John Dalton ( ) J. J. Thomson ( ) En 1897 los experimentos realizados sobre la conducción de la electricidad por los gases dieron como resultado el descubrimiento de una nueva partícula con carga negativa: el electrón. Los rayos catódicos, estaban formados por electrones que saltan de los átomos del gas que llena el tubo cuando es sometido a descargas eléctricas. Los átomos, por tanto, no eran indivisibles. J.J Thomson propone entonces el primer modelo de átomo: Los electrones (pequeñas partículas con carga negativa) se encontraban incrustados en una nube de carga positiva. La carga positiva de la nube compensaba exactamente la negativa de los electrones siendo el átomo eléctricamente neutro. Primer modelo de átomo compuesto (Thomson, 1897) Los electrones, diminutas partículas con carga eléctrica negativa, están incrustadas en una nube de carga positiva de forma similar a las pasas en un pastel. Nube con carga eléctrica positiva. La carga positiva de la nube compensa la negativa de los electrones. 1
2 E. Rutherford ( ) E. Rutherford realiza en 1911 un experimento crucial con el que se trataba de comprobar la validez del modelo atómico de Thomson. Un esquema del montaje experimental usado se muestra más abajo: Las partículas alfa ( procedentes de un material radiactivo, se aceleran y se hacen incidir sobre una lámina de oro muy delgada. Tras atravesar la lámina las partículas chocan contra una pantalla recubierta interiormente de sulfuro de zinc, produciéndose un chispazo. De esta forma era posible observar si las partículas sufrían alguna desviación al atravesar la lámina. Lámina de oro Qué es una partícula? (ver iones) Las llamadas partículas son unas partículas muy pequeñas, con carga eléctrica positiva y con una masa 7000 veces superior a la del electrón. La mayor parte de las partículas atravesaban la lámina de oro sin sufrir ninguna desviación. Muy pocas (una de cada aproximadamente) se desviaba un ángulo mayor de 10 0 (trazo a rayas) En rarísimas ocasiones las partículas rebotaban (líneas de puntos) Partícula rebotada Fuente de partículas Cuando las partículas chocan contra el recubrimiento interior se produce un chispazo Partícula desviada Recubrimiento interior de sulfuro de cinc. La interpretación dada por Rutherford fue la siguiente: Si el modelo atómico propuesto por Thomson fuera cierto no deberían observarse desviaciones ni rebotes de las partículas incidentes. Éstas atravesarían limpiamente los átomos sin desviarse. Para que las partículas se desvíen deben encontrar en su trayectoria una zona (núcleo) en la que se concentre carga de signo positivo y cuya masa sea comparable o mayor a la de las partículas La zona en la que se concentra la masa y la carga positiva debería de ser muy pequeña comparada con la totalidad del átomo. Los electrones orbitan en círculos alrededor del núcleo Modelo planetario de átomo propuesto por Rutherford en 1911 Si la partícula golpea contra el núcleo, sale rebotada hacia atrás. La partícula (que tiene carga positiva) es repelida por el núcleo si pasa cerca de él. 2
3 La crisis del modelo de Rutherford El modelo de átomo planetario propuesto por Rutherford mostró pronto algunos inconvenientes teóricos que lo hacían inviable: Contradecía la teoría electromagnética de Maxwell. Según esta teoría una carga eléctrica acelerada debería de emitir ondas electromagnéticas. Un electrón al girar en círculos alrededor del núcleo debería emitir, por tanto, ondas electromagnéticas. Dicha emisión provocaría una pérdida de energía que haría que el electrón describiera órbitas de radio decreciente hasta caer sobre el núcleo. El modelo atómico de Rutherford era inviable desde el punto de vista de la física clásica. J.C. Maxwell ( ) Maxwell, apoyándose en trabajos anteriores de Oersted, Faraday y Ampere, que relacionaban electricidad y magnetismo, dio forma matemática a la teoría electromagnética durante la década de Dicha teoría predecía la existencia de ondas electromagnéticas. Hertz confirmó en 1888 la predicción de Maxwell al generar y recibir ondas electromagnéticas en el laboratorio. No daba una explicación satisfactoria a los espectros atómicos. Si encerramos en un tubo hidrógeno o helio y sometemos el gas a voltajes elevados, el gas emite luz. Si hacemos pasar esa luz a través de un prisma, los colores que la constituyen se separan dándonos el espectro de la luz analizada (ver figura). Pronto se concluyó que la emisión de luz podría deberse a que los electrones absorbían energía de la corriente eléctrica y saltaban a órbitas superiores para, a continuación, caer a las órbitas más próximas al núcleo emitiendo el exceso de energía en forma de energía luminosa. Esta interpretación conducía, sin embargo, a afirmar que los espectros deberían de ser continuos, ya que al existir órbitas de cualquier radio (y energía) todos los saltos son posibles. La experiencia, por el contrario, mostraba que los espectros de los átomos son discontinuos. Constan de rayas de diversos colores sobre un fondo negro (ver imagen). Espectro continuo. Se observan todos los colores que el ojo puede percibir. Espectros de emisión de H (arriba) y del He (abajo). No son continuos. Constan de rayas de diversos colores separadas por amplias zonas negras en las que no se observa luz. 3
4 El inicio de la Física Cuántica. Modelo atómico de Bohr (1913) Con el fin de resolver los problemas acumulados sobre el modelo de átomo planetario, y para explicar el espectro del átomo de hidrógeno, Niels Bohr propone en 1913 un nuevo modelo atómico sustentado en tres postulados: 1. Cualquiera que sea la órbita descrita por un electrón, éste no emite energía. Las órbitas son consideradas como estados estacionarios de energía. A cada una de ellas le corresponde una energía, tanto mayor, cuanto más alejada se encuentre del núcleo. 2. No todas las órbitas son posibles. Sólo pueden existir aquellas órbitas que tengan ciertos valores de energía, dados por el número cuántico principal, n. Solamente son posibles las órbitas para las cuales el número cuántico principal (n) toma valores enteros: n = 1, 2, 3, 4. Las órbitas que se correspondan con valores no enteros del número cuántico principal, no existen. 3. La energía liberada al caer un electrón desde una órbita superior, de energía E 2, a otra inferior, de energía E 1, se emite en forma de pequeños paquetes o cuantos de luz (hoy los llamaríamos fotones). La frecuencia (f) del cuanto emitido viene dada por la expresión: Niels Bohr ( ) E2 E1 h f h (constante de Planck) = 6, J.s Modelo atómico de Bohr (1913) Los cálculos basados en los postulados de Bohr daban excelentes resultados a la hora de interpretar el espectro del átomo de hidrógeno, pero hay que tener en cuenta que contradecían algunas de las leyes más asentadas de la Física: El primer postulado iba en contra de la teoría electromagnética de Maxwell, ya que según esta teoría cualquier carga eléctrica acelerada debería de emitir energía en forma de radiación electromagnética. El segundo postulado era aún más sorprendente. En la física clásica era inaceptable suponer que el electrón no pudiera orbitar a determinadas distancias del núcleo, o que no pudiera tener determinados valores de energía. La afirmación era equivalente a suponer que un objeto que describe circunferencias atado a una cuerda, solo puede describir órbitas cuyo radio tenga determinado valor. El tercer postulado afirmaba que la luz se emitía en forma de pequeños paquetes o cuantos, lo cual a pesar de que ya había sido propuesto por Planck en 1900, no dejaba de sorprender en una época en la que la idea de que la luz era una onda estaba firmemente arraigada. El átomo de Bohr era, simplemente, un síntoma de que la física clásica, que tanto éxito había tenido en la explicación del mundo macroscópico, no servía para describir el mundo de lo muy pequeño, el dominio de los átomos. Posteriormente, en la década de 1920, una nueva generación de físicos (Schrödinger, Heisenberg, Dirac ) elaborarán una nueva física, la Física Cuántica, destinada a la descripción de los átomos, que supuso una ruptura con la física existente hasta entonces. 4
5 EL ÁTOMO. CONCEPTOS FUNDAMENTALES Núcleo del átomo Dimensiones muy reducidas comparadas con el tamaño del átomo En el núcleo radica la masa del átomo Partículas: protones y neutrones (nucleones). El número total de nucleones viene dado por el número másico, A. Los nucleones están unidos muy fuertemente por la llamada fuerza nuclear fuerte El número de protones del núcleo es lo que distingue a un elemento de otro. El número atómico, Z, nos da el número de protones del átomo y el número de la casilla que éste ocupa en la tabla periódica. Corteza del átomo Los electrones orbitan en torno al núcleo. Los electrones (carga ) son atraídos por el núcleo (carga ). El número de electrones coincide con el de protones, por eso los átomos, en conjunto, no tienen carga eléctrica. Los átomos de elementos distintos se diferencian en que tiene distinto número de protones en el núcleo (distinto Z). Los átomos de un mismo elemento no son exactamente iguales, aunque todos poseen el mismo número de protones en el núcleo (igual Z), pueden tener distinto número de neutrones (distinto A). El número de neutrones de un átomo se calcula así: n = A Z Los átomos de un mismo elemento (igual Z) que difieren en el número de neutrones (distinto A), se denominan isótopos. Todos los isótopos tienen las mismas propiedades químicas, solamente se diferencian en que unos son un poco más pesados que otros. Muchos isótopos pueden desintegrarse espontáneamente emitiendo energía. Son los llamados isótopos radioactivos. CARACTERÍSTICAS DE LAS PARTÍCULAS ATÓMICAS Protón: m p = 1, kg = 1,007 u ; q p = 1, C Neutrón: m n = 1, kg = 1,009 u ; q n = 0 Electrón: m e = 9, kg = 0,0005 u ; q e = 1, C Observa que m p m e m p m n q p = q e (aunque con signo contrario) NOMENCLATURA DE LOS ISÓTOPOS nº másico A nº atómico (se puede suprimir) Z x Símbolo del átomo Ejemplos: 4 He : Helio 4 14 C : Carbono U : Uranio 235 5
6 El átomo. Formación de iones Si a un electrón se le comunica suficiente energía, puede saltar del átomo venciendo la fuerza de atracción que lo une al núcleo. Esto es tanto más fácil cuanto más alejado se encuentre del núcleo. Al quitar un electrón el átomo quedará con carga (), ya que habrá un electrón menos (una carga negativa menos) y los mismos protones (cargas positivas) en el núcleo. El átomo ya no sería eléctricamente neutro, tiene carga. Se convierte en un ion. Átomo neutro nº de protones (3) = nº de electrones (3) El proceso de obtener iones con carga (), o cationes, no puede hacerse añadiendo protones en el núcleo. Si hiciéramos esto alteraríamos el número atómico del elemento (Z) y se produciría la transmutación del elemento en otro con número atómico superior. Ion positivo 3 protones y 2 electrones Nomenclatura de iones Símbolo átomo X n Carga del ion Ejemplos: En determinadas condiciones un átomo puede captar un electrón. Sucede entonces que, al haber un electrón de más, el átomo queda cargado negativamente. Obtenemos un ion negativo o anión. Iones positivos (cationes) Li, Al 3, Fe 2 Iones positivos (aniones) O 2, Cl, N 3 Si al isótopo más abundante del hidrógeno se le arranca su único electrón lo que queda es un protón: H e H De aquí que una de las formas de referirnos al protón sea como H H Protón H Si al átomo de He se le arrancan sus dos electrones obtenemos un núcleo de He con carga 2. Es lo que se llama una partícula alfa ( ) He 2 e He 2 He He 2 (partícula ) 6
7 El átomo. Estructura de la corteza Los electrones del átomo se distribuyen en órbitas o capas alrededor del núcleo. En cada capa existen subcapas o subniveles que se notan por las letras s, p, d y f Las distintas órbitas se identifican por un número entero, n, llamado número cuántico principal. Así para la primera capa (la más próxima al núcleo, n = 1; para la segunda n = 2; para la tercera n = 3... El número de capas u órbitas que posee un elemento viene dado por el número del periodo en que está situado en la tabla periódica. La última capa es muy importante desde el punto de vista químico, ya que su estructura va a estar íntimamente relacionada con las propiedades químicas del elemento. Recibe el nombre de capa de valencia. Para distribuir los electrones en las capas se deben tener en cuenta unas reglas obtenidas empíricamente: 1. Los electrones se distribuyen en las capas ocupando los distintos subniveles que en ellas existen. CAPA 1 s 2 s, p 3 s, p, d SUBNIVELES 4 s, p, d, f 5 s, p, d, f 6 s, p, d, f 7 s, p, d, f 2. Cada subnivel puede alojar un número máximo de electrones: SUBNIVELES Nº Max s 2 p 6 d 10 f Los subniveles se van llenando por orden de energía, y hasta que un nivel no está lleno no se pasa a llenar el siguiente. El orden de llenado de los niveles se obtiene a partir del diagrama de Möeller: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 6f 7s 7p 7d Orden de energía creciente: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p,7s, 5f, 6d... Se puede observar que a partir de la tercera capa estados con un valor de n superior (por ejemplo el 4s) tienen menos energía que otros con un valor de n inferior (por ejemplo el 3d). 7
8 El átomo. Configuración electrónica Para obtener la configuración electrónica de un átomo: 1. Considerar el número de electrones que se deben distribuir. Recordar que el número de electrones en un átomo neutro viene dado por el número atómico Z. 2. Los electrones se van distribuyendo entre los estados de energía posibles llenando primero los de menor energía. Cuando un nivel se complete, pasar al siguiente (recordar el número máximo de electrones para cada subnivel y para establecer el orden de llenado usar el diagrama de Möeller). 3. La configuración final debe darse ordenada por capas. Li Z = 3 1s 2 2s 1 N Z = 7 1s 2 2s 2 2p 3 Mg Z = 12 1s 2 2s 2 2p 6 3s 2 Si Z = 14 1s 2 2s 2 2p 6 3s 2 3p 2 S Z = 16 1s 2 2s 2 2p 6 3s 2 3p 4 Ar Z = 18 1s 2 2s 2 2p 6 3s 2 3p 6 Ti Z = 22 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 Ga Z = 31 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1 Br Z = 35 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 Br: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 ; Br: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 orden de llenado estructura ordenada por capas capa 1: 2 electrones capa 2: 8 electrones capa 3: 18 electrones capa 4 (capa de valencia): 7 electrones 8
9 El átomo. Masa de los átomos Los átomos son extraordinariamente pequeños y su masa, en consecuencia, pequeñísima, tanto que si usamos como unidad para medirla las unidades de masa a las que estamos acostumbrados (kg),obtendríamos valores muy pequeños, difícilmente manejables. Por ejemplo, el átomo de hidrógeno tiene una masa de 1, kg y el de carbono 2, kg. Por esta razón para medir la masa de los átomos se adopta una nueva unidad: la unidad de masa atómica (uma.). La uma (se abrevia con u) se define de la siguiente manera: Considera que coges un átomo del isótopo más abundante de C, el 12 C, lo divides en doce partes iguales y tomas una de ellas. La masa de esta parte sería la unidad de masa atómica. Considerando esta nueva unidad el 12 C tiene una masa de 12 u. A la hora de calcular la masa de un elemento hay que tener en cuenta que no todos los átomos son iguales, ya que pueden existir varios isótopos. La masa se obtiene como masa ponderada de todos sus isótopos. Por eso las masas que puedes leer en las tablas no son enteras. 1/12 parte del átomo de 12 C. Su masa en kg es 1, kg 1 unidad de masa atómica Teniendo en cuenta lo anterior podríamos preguntarnos: Cuántos átomos de 12 C sería necesario reunir para tener una masa manejable en el laboratorio, por ejemplo, 12,0 g (valor de la masa atómica expresada en gramos)? 12 1 u 0,012 kg C 27 1,66.10 kg 1átomo de 12 u 12 C ,02.10 átomos de C Otros ejemplos Átomos que hay en una cantidad igual a su masa Elemento masa en u. m.a masa en kg atómica expresada en gramos H 1,00 1, ,00 g de H contiene átomos N 14,00 2, ,00 g de N contienen átomos O 16,00 2, ,00 g de O contienen átomos Cl 35,45 5, ,45 g de Cl contienen átomos Fe 55,85 9, ,85 g defe contienen átomos Pb 207,19 3, ,19 g de Pb contienen átomos 9
MODELOS ATÓMICOS. Aristóteles ( a.c) Demócrito ( a.c)
 Demócrito (460-370 a.c) MODELOS ATÓMICOS En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la materia estaba
Demócrito (460-370 a.c) MODELOS ATÓMICOS En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la materia estaba
J.J Thomson propone el primer modelo de átomo:
 MODELOS ATÓMICOS. DALTON En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son: 1.
MODELOS ATÓMICOS. DALTON En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son: 1.
MODELOS ATOMICOS DE DALTON A BHOR
 MODELO DE DEMOCRITO MODELOS ATOMICOS DE DALTON A BHOR En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la
MODELO DE DEMOCRITO MODELOS ATOMICOS DE DALTON A BHOR En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la
Un modelo atómico, por lo tanto consiste en representar de manera grafica, la dimensión atómica de la materia. El objetivo de estos modelos es que el
 Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
QUÍMICA 4º ESO ESTRUCTURA DE LA MATERIA
 QUÍMICA 4º ESO ESTRUCTURA DE LA MATERIA Página 1 de 9 PRIMEROS MODELOS ATÓMICOS A lo largo del siglo XIX fueron realizándose experimentos que sugerían que el átomo era divisible. La confirmación de que
QUÍMICA 4º ESO ESTRUCTURA DE LA MATERIA Página 1 de 9 PRIMEROS MODELOS ATÓMICOS A lo largo del siglo XIX fueron realizándose experimentos que sugerían que el átomo era divisible. La confirmación de que
El átomo. Aristóteles (384-322 a.c) Demócrito (460-370 a.c)
 El átomo Demócrito (460-370 a.c) En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la materia estaba formada
El átomo Demócrito (460-370 a.c) En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la materia estaba formada
2.- Los átomos de un mismo elemento son iguales en masa y propiedades. Y los átomos de elementos diferentes son diferentes en masa y propiedades.
 FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS. TEMA 7 Pág. 155 libro nuevo
 PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
Modelo atómico de Bohr-Sommerfeld
 Modelo atómico de Bohr-Sommerfeld En 1897 los experimentos realizados sobre la conducción de la electricidad por los gases dieron como resultado el descubrimiento de una nueva partícula con carga negativa:
Modelo atómico de Bohr-Sommerfeld En 1897 los experimentos realizados sobre la conducción de la electricidad por los gases dieron como resultado el descubrimiento de una nueva partícula con carga negativa:
b) La zona externa del átomo se llama CORTEZA. y ahí es donde se mueven los ELECTRONES
 PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
El átomo. Conceptos fundamentales.
 El átomo. Conceptos fundamentales. IES La Magdalena. Avilés. Asturias Núcleo Dimensiones muy reducidas (10-14 m) comparadas con el tamaño del átomo (10-10 m). En el núcleo radica la masa del átomo. Partículas:
El átomo. Conceptos fundamentales. IES La Magdalena. Avilés. Asturias Núcleo Dimensiones muy reducidas (10-14 m) comparadas con el tamaño del átomo (10-10 m). En el núcleo radica la masa del átomo. Partículas:
MODELOS ATÓMICOS. Nombre y Apellidos:... Grupo:... Correctas Incorrectas Nota
 MODELOS ATÓMICOS Nombre y Apellidos:........................................ Grupo:........... 1.- Cuestionario (7 ptos) Correctas Incorrectas Nota 1.- El siguiente dibujo corresponde al modelo de: a)
MODELOS ATÓMICOS Nombre y Apellidos:........................................ Grupo:........... 1.- Cuestionario (7 ptos) Correctas Incorrectas Nota 1.- El siguiente dibujo corresponde al modelo de: a)
Como esta formada la materia?
 Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3.
 El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
EL ÁTOMO, EL SISTEMA PERIÓDICO Y ENLACE QUÍMICO
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE EL ÁTOMO, EL SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1.- MODELOS ATÓMICOS * TEORÍA ATÓMICA DE DALTON (1808) - La materia está formada por átomos, que son pequeñas
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE EL ÁTOMO, EL SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1.- MODELOS ATÓMICOS * TEORÍA ATÓMICA DE DALTON (1808) - La materia está formada por átomos, que son pequeñas
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia I: estructura atómica, modelos atómicos y tipos de átomos
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia I: estructura atómica, modelos atómicos y tipos de átomos Química Técnico Profesional Intensivo SCUACTC001TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia I: estructura atómica, modelos atómicos y tipos de átomos Química Técnico Profesional Intensivo SCUACTC001TC83-A16V1 Ítem Alternativa
LiceoTolimense Química Séptimo 1 Periodo ESTRUCTURA INTERNA DE LA MATERIA
 ESTRUCTURA INTERNA DE LA MATERIA Lectura comprensiva Desde la antigüedad los filósofos se preguntaban de qué estaban formadas las cosas que los rodeaban. Primero pensaron que la materia era continua, es
ESTRUCTURA INTERNA DE LA MATERIA Lectura comprensiva Desde la antigüedad los filósofos se preguntaban de qué estaban formadas las cosas que los rodeaban. Primero pensaron que la materia era continua, es
Elemento Neutrones Protones Electrones
 PROBLEMAS DE ÁTOMOS 1. Argumenta cómo se explica la ley de conservación de la masa en las reacciones químicas mediante su teoría atómica de Dalton. Calcula cuánto carbono se necesita para reaccionar exactamente
PROBLEMAS DE ÁTOMOS 1. Argumenta cómo se explica la ley de conservación de la masa en las reacciones químicas mediante su teoría atómica de Dalton. Calcula cuánto carbono se necesita para reaccionar exactamente
Clase N 1. Modelo Atómico I
 Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico I ICAL ATACAMA Módulo Plan Común Modelos Atómicos Teoría Atómica De Dalton Los elementos están formados por partículas extremadamente
Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico I ICAL ATACAMA Módulo Plan Común Modelos Atómicos Teoría Atómica De Dalton Los elementos están formados por partículas extremadamente
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Teoría atómica I: modelos atómicos, estructura atómica y tipos de átomos SGUICES001CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 B Aplicación
SOLUCIONARIO Guía Estándar Anual Teoría atómica I: modelos atómicos, estructura atómica y tipos de átomos SGUICES001CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 B Aplicación
MODELOS ATÓMICOS 2ª PARTE
 MODELOS ATÓMICOS 2ª PARTE Teoría Atómica de Joseph John Thomson Diseño Experimental de Joseph John Thomson (1856-1940) Utiliza Tubos de Rayos Catódicos, en los cuales estudia el comportamiento de los gases
MODELOS ATÓMICOS 2ª PARTE Teoría Atómica de Joseph John Thomson Diseño Experimental de Joseph John Thomson (1856-1940) Utiliza Tubos de Rayos Catódicos, en los cuales estudia el comportamiento de los gases
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico.
 EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
EL ÁTOMO CONTENIDOS. ANTECEDENTES HISTÓRICOS. ( ) MODELOS ATÓMICOS. RAYOS CATÓDICOS. MODELO DE THOMSON.
 EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
LA TEORIA ATOMICA John Dalton
 LA TEORIA ATOMICA En 1808, un científico inglés, el profesor John Dalton, formuló una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos 1766-1844
LA TEORIA ATOMICA En 1808, un científico inglés, el profesor John Dalton, formuló una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos 1766-1844
EL ÁTOMO Modelos Atómicos
 EL ÁTOMO Modelos Atómicos Cómo está formada la materia en su interior? Desde los tiempos de la antigua Grecia,los pensadores venían haciéndose esta pregunta, acerca de cómo estaba constituida la materia
EL ÁTOMO Modelos Atómicos Cómo está formada la materia en su interior? Desde los tiempos de la antigua Grecia,los pensadores venían haciéndose esta pregunta, acerca de cómo estaba constituida la materia
Modelo atómico de la materia.
 Modelo atómico de la materia. La Teoría Atómica se basa en la suposición (ratificada después por datos experimentales) de que la materia no es continua, sino que está formada por partículas distintas.
Modelo atómico de la materia. La Teoría Atómica se basa en la suposición (ratificada después por datos experimentales) de que la materia no es continua, sino que está formada por partículas distintas.
Colegio Pasionista de Quilpué Departamento de Ciencias Ciencias Naturales 8 año básico 2015 Miss. Cecilia Rojas Olguín. El átomo.
 Colegio Pasionista de Quilpué Departamento de Ciencias Ciencias Naturales 8 año básico 2015 Miss. Cecilia Rojas Olguín El átomo 06 de Marzo 2015 Objetivos de la clase Comprender el Modelo corpuscular de
Colegio Pasionista de Quilpué Departamento de Ciencias Ciencias Naturales 8 año básico 2015 Miss. Cecilia Rojas Olguín El átomo 06 de Marzo 2015 Objetivos de la clase Comprender el Modelo corpuscular de
M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV
 M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV Comprender la utilidad de los modelos atómicos y de la teoría atómica para explicar los procesos de transformación físico-química de la materia
M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV Comprender la utilidad de los modelos atómicos y de la teoría atómica para explicar los procesos de transformación físico-química de la materia
Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B
 Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B * Historia del Átomo: -El átomo en la antigüedad (pág. 3) -Leucipo y Demócrito (pág.4)
Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B * Historia del Átomo: -El átomo en la antigüedad (pág. 3) -Leucipo y Demócrito (pág.4)
2º Bachillerato. Química. Unidad 1 (Estructura atómica de la materia). Fotocopia 1.
 Partículas subatómicas Los átomos están formados por un núcleo (formado por protones y neutrones) rodeado por una nube de electrones, que se encuentran en la corteza. Entre núcleo y corteza hay espacio
Partículas subatómicas Los átomos están formados por un núcleo (formado por protones y neutrones) rodeado por una nube de electrones, que se encuentran en la corteza. Entre núcleo y corteza hay espacio
ESQUEMA. De él cabe destacar el experimento que demostró que el modelo de Thompson era falso y los postulados que llevaron a que formulara su modelo:
 TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO. Lola Castelao
 ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO DALTON: el átomo es indivisible. MODELOS ATÓMICOS THOMSON: el átomo es una especie de pudín, formado por una masa cargada positivamente, dentro del cual se
ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO DALTON: el átomo es indivisible. MODELOS ATÓMICOS THOMSON: el átomo es una especie de pudín, formado por una masa cargada positivamente, dentro del cual se
Tercero: una reacción química incluye sólo la separación combinación o reordenamiento de átomos sin crearlos o destruirlos.
 Coomppoonneennt teess ffuunnddaameennt taalleess ddeell áát toomoo El filósofo griego demócrito en el siglo V a.c. propuso la idea de que la materia estaba formada por partículas muy pequeñas indivisibles
Coomppoonneennt teess ffuunnddaameennt taalleess ddeell áát toomoo El filósofo griego demócrito en el siglo V a.c. propuso la idea de que la materia estaba formada por partículas muy pequeñas indivisibles
Unidad 1 Estructura atómica de la materia. Teoría cuántica
 Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA.
 Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
U N A M. Facultad de Ingeniería MODELO ATÓMICO DE J. J. THOMSON MODELO ATÓMICO DE ERNEST RUTHERFORD DESCUBRIMIENTO DEL PROTÓN Y DEL NEUTRON
 MODELO ATÓMICO DE J. J. THOMSON MODELO ATÓMICO DE ERNEST RUTHERFORD DESCUBRIMIENTO DEL PROTÓN Y DEL NEUTRON M. C. Q. Alfredo Velásquez Márquez Modelo Atómico de J. J. Thomson Electrones de Carga Negativa
MODELO ATÓMICO DE J. J. THOMSON MODELO ATÓMICO DE ERNEST RUTHERFORD DESCUBRIMIENTO DEL PROTÓN Y DEL NEUTRON M. C. Q. Alfredo Velásquez Márquez Modelo Atómico de J. J. Thomson Electrones de Carga Negativa
EXTRUCTURA ATOMICA ACTUAL
 ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO
 UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO 1. PRIMERAS TEORÍAS ATÓMICAS Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería
UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO 1. PRIMERAS TEORÍAS ATÓMICAS Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería
Física y Química 4 ESO EL ÁTOMO Pág. 1
 Física y Química 4 ESO EL ÁTOMO Pág. 1 UN POCO DE HISTORIA Demócrito y Leucipo (Siglo V a.c.) Algunos filósofos griegos creían que toda la materia estaba formada por una combinación de unas pocas sustancias
Física y Química 4 ESO EL ÁTOMO Pág. 1 UN POCO DE HISTORIA Demócrito y Leucipo (Siglo V a.c.) Algunos filósofos griegos creían que toda la materia estaba formada por una combinación de unas pocas sustancias
LA LA ESTRUCTURA DE LA MATERIA. 1.-Desarrollo histórico del concepto de átomo. Teoría de Demócrito. Teoría de Dalton. Componentes del átomo
 ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
TEMA 3: Hasta el momento, hemos visto que la materia se consideraba algo continuo e indivisible hasta que se
 TEMA 3: ESTRUCTURA ATÓMICA I Hasta el momento, hemos visto que la materia se consideraba algo continuo e indivisible hasta que se confirmó que era posible dividirla en partículas más pequeñas, a las que
TEMA 3: ESTRUCTURA ATÓMICA I Hasta el momento, hemos visto que la materia se consideraba algo continuo e indivisible hasta que se confirmó que era posible dividirla en partículas más pequeñas, a las que
Enseñanza - Aprendizaje
 El primer modelo atómico con bases científicas, fue formulado por John Dalton descubrió a los átomos en 1804. Pensaba que eran las partículas más pequeñas de la materia, que no podían ser divididas en
El primer modelo atómico con bases científicas, fue formulado por John Dalton descubrió a los átomos en 1804. Pensaba que eran las partículas más pequeñas de la materia, que no podían ser divididas en
Modelo atómico de Dalton(1808)
 El átomo Modelos atómicos Como no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
El átomo Modelos atómicos Como no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
Qué ocurriría si dividiéramos un trozo de materia muchas veces? Llegaríamos hasta una parte indivisible o podríamos seguir dividiendo sin parar?
 3 El átomo y los modelos atómicos El átomo a través de la historia Las primeras teorías atomistas Qué ocurriría si dividiéramos un trozo de materia muchas veces? Llegaríamos hasta una parte indivisible
3 El átomo y los modelos atómicos El átomo a través de la historia Las primeras teorías atomistas Qué ocurriría si dividiéramos un trozo de materia muchas veces? Llegaríamos hasta una parte indivisible
CENTRO DE ESTUDIOS MIRASIERRA
 El ÁTOMO TEORÏAS ATÓMICAS1 Ya hemos visto el modelo atómico de Dalton, que decía que la materia estaba formada por partículas indivisibles llamadas átomos. Actualmente, se sabe que los átomos si son divisibles
El ÁTOMO TEORÏAS ATÓMICAS1 Ya hemos visto el modelo atómico de Dalton, que decía que la materia estaba formada por partículas indivisibles llamadas átomos. Actualmente, se sabe que los átomos si son divisibles
La clasificación básica de la materia muestra a los elementos y compuestos. Mezclas Heterogénea heterogéneas Mezclas. Soluciones
 La clasificación básica de la materia muestra a los elementos y compuestos. Materia Mezclas Heterogénea heterogéneas Mezclas Homogénea Soluciones Sustancias Compuestos Elementos Hemos visto que las soluciones
La clasificación básica de la materia muestra a los elementos y compuestos. Materia Mezclas Heterogénea heterogéneas Mezclas Homogénea Soluciones Sustancias Compuestos Elementos Hemos visto que las soluciones
Si nosotros observamos a nuestro alrededor podríamos predecir de qué esta formada cada una de las cosas que nos rodea?
 Introducción Si nosotros observamos a nuestro alrededor podríamos predecir de qué esta formada cada una de las cosas que nos rodea? Por ejemplo: Podrías predecir de que están elaborados los objetos y sustancias
Introducción Si nosotros observamos a nuestro alrededor podríamos predecir de qué esta formada cada una de las cosas que nos rodea? Por ejemplo: Podrías predecir de que están elaborados los objetos y sustancias
Hecho por: Patricia Arroyo Gamallo nº 2 4ºeso C
 Hecho por: Patricia Arroyo Gamallo nº 2 4ºeso C La materia es todo aquello que tiene masa, ocupa un lugar en el espacio y es cuantificable (se puede medir).la Química es la ciencia que estudia su naturaleza,
Hecho por: Patricia Arroyo Gamallo nº 2 4ºeso C La materia es todo aquello que tiene masa, ocupa un lugar en el espacio y es cuantificable (se puede medir).la Química es la ciencia que estudia su naturaleza,
Tema 9 Naturaleza eléctrica de la materia
 Tema 9 Naturaleza eléctrica de la materia 1.- El átomo Toda materia está formada por partículas como éstas llamadas átomos. Un átomo a su vez está compuesto por pequeños elementos, llamados partículas
Tema 9 Naturaleza eléctrica de la materia 1.- El átomo Toda materia está formada por partículas como éstas llamadas átomos. Un átomo a su vez está compuesto por pequeños elementos, llamados partículas
Radiación. Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler. L. Infante 1
 Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
ESTRUCTURA DE LOS ATOMOS Ing. Alfredo Luis Rojas B.
 CAPITULO 4 ESTRUCTURA DE LOS ATOMOS Ing. Alfredo Luis Rojas B. Aproximadamente 400 a.c. el filosofo griego Democrito sugirió que toda la materia esta formada por partículas minúsculas, discretas e indivisibles,
CAPITULO 4 ESTRUCTURA DE LOS ATOMOS Ing. Alfredo Luis Rojas B. Aproximadamente 400 a.c. el filosofo griego Democrito sugirió que toda la materia esta formada por partículas minúsculas, discretas e indivisibles,
Colegio Alberto Pérez Institución Teresiana Departamento de Ciencias Química Profesora Caterina González Poblete. Núcleo. (protones y neutrones)
 Colegio Alberto Pérez Institución Teresiana Departamento de Ciencias Química Profesora Caterina González Poblete EL ÁTOMO Núcleo Envoltura (electrones) (protones y neutrones) El átomo, como lo conocemos
Colegio Alberto Pérez Institución Teresiana Departamento de Ciencias Química Profesora Caterina González Poblete EL ÁTOMO Núcleo Envoltura (electrones) (protones y neutrones) El átomo, como lo conocemos
Tema 3 El Átomo. Modelos Atómicos y Configuraciones Electrónicas
 Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 3 Rev 01 El Átomo. Modelos Atómicos y Configuraciones Electrónicas
Física y Química 1º Bachillerato LOMCE FyQ 1 IES de Castuera Bloque 2 Aspectos Cuantitativos de la Química 2015 2016 Unidad Didáctica 3 Rev 01 El Átomo. Modelos Atómicos y Configuraciones Electrónicas
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
Teoría de DALTON. Hechos experimentales que evidencian una estructura interna de átomo.
 Teoría de DALTON. 1- Los elementos químicos están construidos por partículas denominadas átomos, que son invisibles e inalterables, en cualquier proceso, químico o físico. 2- Los átomos de un mismo elemento,
Teoría de DALTON. 1- Los elementos químicos están construidos por partículas denominadas átomos, que son invisibles e inalterables, en cualquier proceso, químico o físico. 2- Los átomos de un mismo elemento,
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
EL INTERIOR DE LA MATERIA
 EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
EL ÁTOMO. Se supuso que estas partículas deberían estar en todos los átomos. Thomson las llamó electrones.
 ANTECEDENTES HISTÓRICOS. () EL ÁTOMO Leucipo y Demócrito. Proponen la Discontinuidad de la materia. Dalton. Formula la primera Teoría atómica. Volta, Davy, Faraday, Berzelius, descubren la Naturaleza eléctrica
ANTECEDENTES HISTÓRICOS. () EL ÁTOMO Leucipo y Demócrito. Proponen la Discontinuidad de la materia. Dalton. Formula la primera Teoría atómica. Volta, Davy, Faraday, Berzelius, descubren la Naturaleza eléctrica
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Estructura de la materia
 Estructura de la materia Cuestiones y problemas 1. Si la energía de ionización del K gaseoso es de 418 kj.mol 1 : a) Calcule la energía mínima que ha de tener un fotón para poder ionizar un átomo de K.
Estructura de la materia Cuestiones y problemas 1. Si la energía de ionización del K gaseoso es de 418 kj.mol 1 : a) Calcule la energía mínima que ha de tener un fotón para poder ionizar un átomo de K.
ESTRUCTURA ATÓMICA DE LA MATERIA. SISTEMA PERIÓDICO ESTRUCTURA ATÓMICA DE LA MATERIA
 ESTRUCTURA ATÓMICA DE LA MATERIA. SISTEMA PERIÓDICO ESTRUCTURA ATÓMICA DE LA MATERIA La teoría atómica de Dalton se mantuvo con éxito durante casi un siglo pero tuvo que ser abandonada a partir del descubrimiento
ESTRUCTURA ATÓMICA DE LA MATERIA. SISTEMA PERIÓDICO ESTRUCTURA ATÓMICA DE LA MATERIA La teoría atómica de Dalton se mantuvo con éxito durante casi un siglo pero tuvo que ser abandonada a partir del descubrimiento
Departamento de Física y Química. 2.- Deduce el número de neutrones, protones y electrones de los átomos siguientes:
 1.- Para el átomo de Galio, 69 31Ga ; deduce el número de protones, electrones y neutrones. 2.- Deduce el número de neutrones, protones y electrones de los átomos siguientes: U ; Hg ; Th ; He; Ne 235 200
1.- Para el átomo de Galio, 69 31Ga ; deduce el número de protones, electrones y neutrones. 2.- Deduce el número de neutrones, protones y electrones de los átomos siguientes: U ; Hg ; Th ; He; Ne 235 200
Modelo Atómico. Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga (-)
 Modelo Atómico 1 Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga () Electrón Conceptos:» Neutralidad eléctrica» Carga elemental del
Modelo Atómico 1 Thompson (1898): Esfera uniforme de materia con carga (+) en la cual se encuentran embebidos los electrones con carga () Electrón Conceptos:» Neutralidad eléctrica» Carga elemental del
MODELOS ATOMICOS. Solución Å; Ultravioleta; 1106 m/s
 MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
ÁTOMO..su historia y su estudio
 ÁTOMO.su historia y su estudio LOS GRIEGOS Y SU APORTE 2000 años antes de Cristo, la civilización griega representada por varios filósofos, ya se preguntaban acerca de qué estaba formado el universo?...
ÁTOMO.su historia y su estudio LOS GRIEGOS Y SU APORTE 2000 años antes de Cristo, la civilización griega representada por varios filósofos, ya se preguntaban acerca de qué estaba formado el universo?...
QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA
 QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013)
QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013)
3 - Cómo podemos diferenciar un elemento químico de un compuesto, según la teoría de Dalton?
 TEORÍA ATÓMICA 1- A partir de los siguientes datos, cuántas veces es maor la masa del protón que la del electrón? Masa del protón =1,673 10-27 kg Masa del electrón =9,1 10-31 kg 2 - El modelo del átomo
TEORÍA ATÓMICA 1- A partir de los siguientes datos, cuántas veces es maor la masa del protón que la del electrón? Masa del protón =1,673 10-27 kg Masa del electrón =9,1 10-31 kg 2 - El modelo del átomo
Relación masa partículas subatómicas
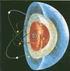
 4º ESO Relación masa partículas subatómicas Tabla periódica-ordenada según el número atómico (número de protones) Otro aspecto importante, es la Masa Atómica expresada en uma ( 1 uma= 1,66. 10-27 kg) La
4º ESO Relación masa partículas subatómicas Tabla periódica-ordenada según el número atómico (número de protones) Otro aspecto importante, es la Masa Atómica expresada en uma ( 1 uma= 1,66. 10-27 kg) La
SEMANA 01 Estructura Atómica y Tabla Periódica. Licda. Lilian Judith Guzmán Melgar
 SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
Evolución de los modelos atómicos
 Evolución de los modelos atómicos Un paso importante hacia el desarrollo de la química como ciencia fue el desarrollo de la comprensión de la estructura atómica. Por ejemplo, era posible comprender lo
Evolución de los modelos atómicos Un paso importante hacia el desarrollo de la química como ciencia fue el desarrollo de la comprensión de la estructura atómica. Por ejemplo, era posible comprender lo
Complejo Educacional Joaquín Edwards Bello QUIMICA 2º MEDIO TRABAJO 2 LEA CUIDADOSAMENTE EL SIGUIENTE TEXTO Y CONTESTE LAS PREGUNTAS
 Complejo Educacional Joaquín Edwards Bello QUIMICA 2º MEDIO TRABAJO 2 NOMBRE: CURSO: LEA CUIDADOSAMENTE EL SIGUIENTE TEXTO Y CONTESTE LAS PREGUNTAS..Naturaleza Eléctrica de la Materia La electricidad fue
Complejo Educacional Joaquín Edwards Bello QUIMICA 2º MEDIO TRABAJO 2 NOMBRE: CURSO: LEA CUIDADOSAMENTE EL SIGUIENTE TEXTO Y CONTESTE LAS PREGUNTAS..Naturaleza Eléctrica de la Materia La electricidad fue
La estructura atómica: el núcleo
 Tema 1 La estructura atómica: el núcleo Introducción. Modelos atómicos Composición del átomo. Partículas fundamentales Estructura del núcleo Estabilidad nuclear y energía de enlace nuclear Aplicaciones
Tema 1 La estructura atómica: el núcleo Introducción. Modelos atómicos Composición del átomo. Partículas fundamentales Estructura del núcleo Estabilidad nuclear y energía de enlace nuclear Aplicaciones
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
El átomo: sus partículas elementales
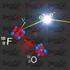
 El átomo: sus partículas elementales Los rayos catódicos estaban constituidos por partículas cargadas negativamente ( a las que se llamo electrones) y que la relación carga/masa de éstas partículas era
El átomo: sus partículas elementales Los rayos catódicos estaban constituidos por partículas cargadas negativamente ( a las que se llamo electrones) y que la relación carga/masa de éstas partículas era
EL ÁTOMO. Estructura del átomo. Núcleo. Envoltura. La materia esta constituida por pequeñas partículas llamadas átomos
 ESTRUCTURA ATOMICA EL ÁTOMO La materia esta constituida por pequeñas partículas llamadas átomos Estructura del átomo Envoltura Núcleo ESTRUCTURA Y CONSTITUCIÓN DEL ÁTOMO electrones protones neutrones CARACTERÍSTICAS
ESTRUCTURA ATOMICA EL ÁTOMO La materia esta constituida por pequeñas partículas llamadas átomos Estructura del átomo Envoltura Núcleo ESTRUCTURA Y CONSTITUCIÓN DEL ÁTOMO electrones protones neutrones CARACTERÍSTICAS
QUIMICA GENERAL. Docente : Raquel Villafrades Torres
 Universidad Pontificia Bolivariana QUIMICA GENERAL Docente : Raquel Villafrades Torres TEORIA ATOMICA DE DALTON (1808) BASES Ley de conservación de la masa: La masa total de las sustancias presentes después
Universidad Pontificia Bolivariana QUIMICA GENERAL Docente : Raquel Villafrades Torres TEORIA ATOMICA DE DALTON (1808) BASES Ley de conservación de la masa: La masa total de las sustancias presentes después
Física y Química 3º E.S.O. 2013/14
 Física y Química 3º E.S.O. 2013/14 TEMA 3: La materia. Propiedades eléctricas y el átomo 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A C E E
Física y Química 3º E.S.O. 2013/14 TEMA 3: La materia. Propiedades eléctricas y el átomo 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A C E E
3.2. PARTÍCULAS SUBATÓMICAS.
 3.2. PARTÍCULAS SUBATÓMICAS. 3.2.1. PROTONES Y ELECTRONES. Aunque Dalton creía que los átomos eran indivisibles e inalterables, a lo largo del siglo XIX aparecieron cada vez más evidencias de que los átomos
3.2. PARTÍCULAS SUBATÓMICAS. 3.2.1. PROTONES Y ELECTRONES. Aunque Dalton creía que los átomos eran indivisibles e inalterables, a lo largo del siglo XIX aparecieron cada vez más evidencias de que los átomos
- Dalton: TEORIA ATÓMICA ( inicio del SIGLO XIX) - Descubrimiento del electrónjoseph John Thomson ( )
 REPASO QUÍMICA 01 - Dalton: TEORIA ATÓMICA ( inicio del SIGLO XIX) - Descubrimiento del electrónjoseph John Thomson (1856-1940) Modelo de Thompson Modelo del budín de pasas - EN 1895 WILHELM RONTGEN Descubre
REPASO QUÍMICA 01 - Dalton: TEORIA ATÓMICA ( inicio del SIGLO XIX) - Descubrimiento del electrónjoseph John Thomson (1856-1940) Modelo de Thompson Modelo del budín de pasas - EN 1895 WILHELM RONTGEN Descubre
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
Átomos polielectrónicos Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas
 ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
IES La Magdalena. Avilés. Asturias. Física Cuántica I
 IES La Magdalena. Avilés. Asturias En los últimos años del s. XIX y principios del XX el estudio de la interacción entre la materia y las ondas electromagnéticas llevó a la formulación de importantes problemas
IES La Magdalena. Avilés. Asturias En los últimos años del s. XIX y principios del XX el estudio de la interacción entre la materia y las ondas electromagnéticas llevó a la formulación de importantes problemas
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: El átomo y sus enlaces
 1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
UNIDAD 1 LA ENERGÍA, LA MATERIA Y SUS CAMBIOS. 1.3 El sol, horno nuclear
 UNIDAD 1 LA ENERGÍA, LA MATERIA Y SUS CAMBIOS 1.3 El sol, horno nuclear RADIACTIVIDAD Y DESINTEGRACIÓN NUCLEAR HISTORIA DEL ÁTOMO Hace aproximadamente 2500 años, los filósofos griegos, afirmaron que la
UNIDAD 1 LA ENERGÍA, LA MATERIA Y SUS CAMBIOS 1.3 El sol, horno nuclear RADIACTIVIDAD Y DESINTEGRACIÓN NUCLEAR HISTORIA DEL ÁTOMO Hace aproximadamente 2500 años, los filósofos griegos, afirmaron que la
Atomos, Moléculas e Iones
 Atomo Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
Atomo Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
Atomos, Moléculas e Iones. Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo
 Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Atomo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Atomo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
TEMA 4 (I) ESTRUCTURA ATÓMICA.
 Estructura Atómica, Sistema Periódico y Enlace Químico. 1 TEMA 4 (I) ESTRUCTURA ATÓMICA. 1. DESCUBRIMIENTO DE LA ESTRUCTURA ATÓMICA. 1.- Qué experimentos condujeron a la idea del núcleo atómico? (3.12)
Estructura Atómica, Sistema Periódico y Enlace Químico. 1 TEMA 4 (I) ESTRUCTURA ATÓMICA. 1. DESCUBRIMIENTO DE LA ESTRUCTURA ATÓMICA. 1.- Qué experimentos condujeron a la idea del núcleo atómico? (3.12)
FÍSICA y QUÍMICA. Número cuántico Secundario (SUBNIVEL) l. Número cuántico Magnético (ORBITAL, como si fuera una caja) m.
 TEMA 1: ESTRUCTURA DE LA MATERIA. MODELOS ATÓMICOS 1. Modelo Atómico de RUTHERFORD a. Modelo predecesor de Thomson. b. Modelo atómico de Rutherford. c. Virtudes y defectos del Modelo de Rutherford. 2.
TEMA 1: ESTRUCTURA DE LA MATERIA. MODELOS ATÓMICOS 1. Modelo Atómico de RUTHERFORD a. Modelo predecesor de Thomson. b. Modelo atómico de Rutherford. c. Virtudes y defectos del Modelo de Rutherford. 2.
EL MODELO ATOMICO DE BOHR
 EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I
 El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
Slide 1 / 33. Slide 2 / 33. Slide 3 / El número atómico es equivalente a cuál de los siguientes? A El número de neutrones del átomo.
 Slide 1 / 33 Slide 2 / 33 3 El número atómico es equivalente a cuál de los siguientes? Slide 3 / 33 A El número de neutrones del átomo. B El número de protones del átomo C El número de nucleones del átomo.
Slide 1 / 33 Slide 2 / 33 3 El número atómico es equivalente a cuál de los siguientes? Slide 3 / 33 A El número de neutrones del átomo. B El número de protones del átomo C El número de nucleones del átomo.
Ejercicios de Física cuántica y nuclear. PAU (PAEG)
 1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
MODELO MECANO CUÁNTICO
 MODELO MECANO CUÁNTICO Primer Año A o Medio monica.ibanez@lbvm.cl Los átomos y su historia Obj. De hoy: 1. Recordar los modelos anteriores a la teoría a Cuántica. 2. Identificar las partículas subatómicas
MODELO MECANO CUÁNTICO Primer Año A o Medio monica.ibanez@lbvm.cl Los átomos y su historia Obj. De hoy: 1. Recordar los modelos anteriores a la teoría a Cuántica. 2. Identificar las partículas subatómicas
FÍSICA Y QUÍMICA TEMA 2: ESTRUCTURA ATÓMICA DE LA MATERIA
 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2016/2017 1 FÍSICA Y QUÍMICA TEMA 2: ESTRUCTURA ATÓMICA DE LA MATERIA Física y Química 3º Curso Educación Secundaria Obligatoria
Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2016/2017 1 FÍSICA Y QUÍMICA TEMA 2: ESTRUCTURA ATÓMICA DE LA MATERIA Física y Química 3º Curso Educación Secundaria Obligatoria
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Química
 Modelos atómicos Los filósofos de la antigüedad especularon sobre cómo estaba formada la materia. Demócrito (460-370 a.c) y otros filósofos anteriores a él, pensaban que el mundo material debería estar
Modelos atómicos Los filósofos de la antigüedad especularon sobre cómo estaba formada la materia. Demócrito (460-370 a.c) y otros filósofos anteriores a él, pensaban que el mundo material debería estar
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS.
 PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST
 ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST Serie A: PARTICULAS SUBATOMICAS: Serie B- ESPECTROS: Serie C- COMPOSICION DEL ÁTOMO Serie D- ESTRUCTURA ELECTRÓNICA Serie E- ATOMO DE THOMPSON Serie F- DEFECTO DE
ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST Serie A: PARTICULAS SUBATOMICAS: Serie B- ESPECTROS: Serie C- COMPOSICION DEL ÁTOMO Serie D- ESTRUCTURA ELECTRÓNICA Serie E- ATOMO DE THOMPSON Serie F- DEFECTO DE
LA MATERIA: PROPIEDADES ELÉCTRICAS Y EL ÁTOMO
 FICH 1 DE REFUERO 1. Dado el siguiente átomo: 16 8O. a) Determina cuántos protones y neutrones tiene en el núcleo. b) Escribe la representación de un isótopo suyo. 2. Determina el número atómico y el número
FICH 1 DE REFUERO 1. Dado el siguiente átomo: 16 8O. a) Determina cuántos protones y neutrones tiene en el núcleo. b) Escribe la representación de un isótopo suyo. 2. Determina el número atómico y el número
