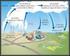
[C] c [D] d [A] a [B] b
|
|
|
- Diego Salinas Serrano
- hace 5 años
- Vistas:
Transcripción
1 M. en C. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UAM PICIPIO D L CHATLI Si se considera la reacción reversible siguiente: aa w + bb x cc y + dd z Donde a, b, c y d son los respectivos coeficientes estequiométricos de las sustancias A, B, C y D que se encuentran en los estados de agregación w, x, y y z. ntonces, se puede establecer la siguiente expresión analítica que relaciona las cantidades de reactivos y productos para cualquier tiempo, t. [C] c [D] d [A] a [B] b Donde los corchetes indican las cantidades de los componentes en términos de molaridad. Cuando las cantidades de reactivos y productos cambian conforme avanza el tiempo de reacción, el valor del cociente anterior varía, por lo cual se le denomina cociente de reacción y se le asigna la literal Q; sin embargo, cuando se alcanza el equilibrio dinámico, las cantidades de reactivos y productos no varían con el tiempo; es decir, el valor de Q, sería constante, por lo que se le denomina entonces, constante de equilibrio y se le asigna la literal K. Q = [C]c [D] d [A] a [B] b Cociente de reacción Para un tiempo t K = [C]c [D] d [A] a [B] b Constante de equilibrio Para el tiempo de equilibrio Una vez que se ha alcanzado el equilibrio, éste se puede perder debido a alguna modificación en las condiciones de trabajo y entonces, el sistema hace lo necesario para alcanzar un nuevo estado de equilibrio. Lo anterior, se enuncia en el llamado Principio de LeChatelier, que dice lo siguiente: 1
2 Cuando un sistema que se encuentra en equilibrio dinámico, es perturbado por una variación de presión, temperatura, volumen o cantidad de alguno de los componentes, el sistema pierde su estado de equilibrio; sin embargo, el mismo sistema se desplaza de tal forma que minimiza el efecto de dicha perturbación hasta alcanzar un nuevo estado de equilibrio esulta de singular importancia conocer como se comporta un sistema en equilibrio, con base en el principio de LeChatelier, y para ello se requiere hacer los análisis siguientes: Variación de la cantidad de uno de los componentes Al considerar que se encuentra en equilibrio la reacción siguiente: CO (g) + Cl 2(g) COCl 2(g) se puede establecer que en el tiempo de equilibrio el valor de su constante es K 1 K 1 = Si se aumenta en n la concentración molar de CO, el valor de la constante disminuye al aumentar el denominador, denotando con ello que se pierde el equilibrio del sistema. K 2 = [CO + n] [Cl 2 ] < K 1 = Como se observa, para que el valor de la constante sea nuevamente K 1, debe disminuir el denominador y aumentar el numerador; es decir, las cantidades de los reactivos deben disminuir y las cantidades de los productos deben aumentar, esto se logra si la reacción procede hacia la derecha hasta que se alcance el valor inicial de la constante y se dice entonces, que el sistema se desplazó hacia la derecha para alcanzar un nuevo estado de equilibrio. Lo anterior es válido para cualquier reacción reversible en la que se aumente la cantidad de alguno de los reactivos. 2
3 Por otro lado, si se aumenta en n la cantidad de COCl 2, el valor de la constante aumenta al aumentar el numerador, denotando con ello que se pierde el equilibrio del sistema. K 3 = [COCl 2 + n] > K 1 = Como se observa, para que el valor de la constante sea nuevamente K 1, debe aumentar el denominador y disminuir el numerador; es decir, las cantidades de los reactivos deben aumentar y las cantidades de los productos deben disminuir, esto se logra si la reacción procede hacia la izquierda hasta que se alcance el valor inicial de la constante y se dice entonces, que el sistema se desplazó hacia la izquierda para alcanzar un nuevo estado de equilibrio. Lo anterior es válido para cualquier reacción reversible en la que se aumente la cantidad de alguno de los productos. De forma similar a la anterior, al analizar qué sucede cuando disminuye la cantidad de alguno de los reactivos o productos, se concluye que, cuando disminuye la cantidad de alguno de los reactivos, el equilibrio se desplaza hacia la izquierda y cuando disminuye la cantidad de uno de los productos el equilibrio se desplaza hacia la derecha. Variación de la presión Si se considera que se encuentra en equilibrio la reacción siguiente: CO (g) + Cl 2(g) COCl 2(g) esulta lógico suponer que para que esta reacción se encuentre en equilibrio, debe llevarse a cabo en un recipiente cerrado herméticamente, ya que de lo contrario, se perdería continuamente cierta cantidad de reactivos y productos; por lo tanto, se puede decir que las moléculas de cada gas están limitadas a moverse dentro de cierto volumen; de tal forma que se puede afirmar que al disminuir lentamente el volumen, la presión aumenta y la temperatura se mantiene constante; sin embargo, como las moléculas de cada gas tienen un menor espacio para moverse, estarán más juntas y por lo tanto será más probable que interaccionen para formar aquellas entidades que ocupen un menor volumen. Adicionalmente a lo anterior, se debe recordar que, a las mismas condiciones de presión y temperatura, moles iguales de gases diferentes, ocupan el mismo volumen. 3
4 Aplicando estos razonamientos a la reacción anterior, se puede establecer que al disminuir el volumen, aumenta la presión y el equilibrio se desplaza hacia la derecha, ya que una molécula de COCl 2 ocupa un menor volumen que el que ocupan las moléculas de CO y Cl 2 ; o bien, hablando en términos de moles, una mol de COCl 2 ocupa un menor volumen que el que ocupan una mol de CO y una mol de Cl 2. Considerando lo anterior, se puede establecer que, cuando se tiene un sistema en equilibrio y se aumenta la presión (disminuyendo el volumen), el equilibrio se desplaza hacia el lado de la reacción donde la suma de los coeficientes estequiométricos es menor; así mismo, se establece que cuando se tiene un sistema en equilibrio y se disminuye la presión (aumentando el volumen), el equilibrio se desplaza hacia el lado de la reacción donde la suma de los coeficientes estequiométricos de los componentes gaseosos es mayor. Variación de la temperatura Como es sabido, toda reacción química que se lleva a cabo a presión constante, involucra cierta cantidad de calor denominado entalpia de reacción ( H r ), cuyo valor puede es positivo para las reacciones endotérmicas y negativo para las reacciones exotérmicas. Para la reacción en equilibrio siguiente: CO (g) + Cl 2(g) COCl 2(g) H r < 0 Colocar a la derecha de la reacción, H r < 0, implica que la formación de COCl 2 es un proceso exotérmico ya que la entalpía de la reacción es negativa; en otras palabras, durante la formación de COCl 2 se produce cierta cantidad de calor. Lo anterior permite, reescribir la ecuación de la forma siguiente: CO (g) + Cl 2(g) COCl 2(g) + Q Donde el calor producido se considera como uno más de los productos; cabe mencionar, que ésta forma de escribir la ecuación, no es estrictamente correcta; sin embargo, para fines de análisis 4
5 conviene hacerlo así. Adicionalmente a lo anterior, se puede decir que cuando un sistema se calienta, se le está adicionando calor y cuando se enfría, se le está sustrayendo calor. Aplicando lo visto anteriormente para la variación de la cantidad de uno de los componentes de un sistema en equilibrio, se puede establecer que al calentar la reacción anterior, se aumenta la cantidad de uno de los productos (Q), y por lo tanto, el equilibrio se deberá de desplazar hacia la izquierda y al enfriar la reacción anterior, se disminuye la cantidad de uno de los productos (Q), y por lo tanto, el equilibrio se deberá de desplazar hacia la derecha. Para el caso de las reacciones endotérmicas, el calor involucrado se considera como uno más de los reactivos; por lo cual, se puede establecer que al calentar el sistema, se aumentaría la cantidad de uno de los reactivos, y por lo tanto, el equilibrio se deberá de desplazar hacia la derecha y al enfriar el sistema, se disminuiría la cantidad de uno de los reactivos, y por lo tanto, el equilibrio se deberá de desplazar hacia la izquierda. Todo lo referente al comportamiento de un sistema de acuerdo al principio de LeChatelier se ilustra en la tabla siguiente: 5
6 PICIPIO D L CHATLI Variación: Comportamiento: C O C T A C I Ó Incremento en la concentración de alguno de los reactivos. Incremento en la concentración de alguno de los productos. Decremento en la concentración de alguno de los reactivos. Decremento en la concentración de alguno de los productos. l equilibrio se desplaza hacia la izquierda. l equilibrio se desplaza hacia la izquierda. P S I Ó T M P A T U A Incremento de la presión del sistema. Decremento de la presión del sistema. Incremento de la temperatura de una reacción exotérmica. Incremento de la temperatura de una reacción endotérmica. Decremento de la temperatura de una reacción exotérmica. Decremento de la temperatura de una reacción endotérmica. l equilibrio se desplaza hacia donde la suma de los coeficientes estequiométricos sea menor. l equilibrio se desplaza hacia donde la suma de los coeficientes estequiométricos sea mayor. l equilibrio se desplaza hacia la izquierda. l equilibrio se desplaza hacia la izquierda. BIBLIOGAFÍA: Brown, Theodore L.; LeMay, H. ugene, Jr.; Bursten, Bruce. Química. La Ciencia Central, 9ª edición; Pearson Prentice-Hall: México, Chang, aymond Química, 7ª edición; McGraw-Hill: México, Kotz, John C.; Treichel, Paul M. Química y eactividad Química, 5ª edición; Thomson: México,
EQUILIBRIO QUÍMICO. son las cantidades de reactivos y productos en el tiempo t 0
 M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx EQUILIBRIO QUÍMICO En el equilibrio químico, se trabaja con reacciones químicas reversibles;
M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx EQUILIBRIO QUÍMICO En el equilibrio químico, se trabaja con reacciones químicas reversibles;
aa w + bb x cc y + dd z
 M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER EJERCICIOS DE TERMOQUÍMICA Cuando se lleva a cabo una reacción química a presión
M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER EJERCICIOS DE TERMOQUÍMICA Cuando se lleva a cabo una reacción química a presión
CÓMO RESOLVER ALGUNOS EJERCICIOS DE E STEQUIOMETRÍA
 M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE E STEQUIOMETRÍA La estequiometría se emplea para determinar
M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE E STEQUIOMETRÍA La estequiometría se emplea para determinar
Tecnólogo en Minería. Equilibrio Químico. Química I
 Tecnólogo en Minería Equilibrio Químico Química I Concepto de equilibrio y constante Pocas reacciones químicas se dan en un sentido Muchas veces las reacciones químicas no se completan, sino que llegan
Tecnólogo en Minería Equilibrio Químico Química I Concepto de equilibrio y constante Pocas reacciones químicas se dan en un sentido Muchas veces las reacciones químicas no se completan, sino que llegan
DEPARTA MENTO DE FÍSICA Y QUÍMICA
 Henri-Louis Le Châtelier, nacido en París en 1850 se formó en el Colegio Rollin, Escuela Politécnica de París, así como en la Escuela de Minas de París. Tras haberse licenciado en Ciencias Químicas, trabajaría
Henri-Louis Le Châtelier, nacido en París en 1850 se formó en el Colegio Rollin, Escuela Politécnica de París, así como en la Escuela de Minas de París. Tras haberse licenciado en Ciencias Químicas, trabajaría
CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 2)
 M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 2) Para llevar a cabo una reacción
M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 2) Para llevar a cabo una reacción
Equilibrio Químico. Sra. Anlinés Sánchez Otero
 Equilibrio Químico Sra. Anlinés Sánchez Otero Introducción Cuando una reacción termina y hay una conversión casi completa de reactivos a productos los químicos afirman que la reacción se realiza por completo.
Equilibrio Químico Sra. Anlinés Sánchez Otero Introducción Cuando una reacción termina y hay una conversión casi completa de reactivos a productos los químicos afirman que la reacción se realiza por completo.
UNIDADES DE CONCENTRACIÓN (I)
 M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx UNIDADES DE CONCENTRACIÓN (I) Para que una reacción química se lleve a cabo de forma eficiente,
M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx UNIDADES DE CONCENTRACIÓN (I) Para que una reacción química se lleve a cabo de forma eficiente,
Velocidad de Reacción y Equilibrio Químico
 Velocidad de Reacción y Equilibrio Químico Semana 11 Licda. Lilian Judith Guzmán Melgar Cinética química Es el estudio de las velocidades de reacción y los factores que influyen en ellas. TEORIA DE COLISIONES
Velocidad de Reacción y Equilibrio Químico Semana 11 Licda. Lilian Judith Guzmán Melgar Cinética química Es el estudio de las velocidades de reacción y los factores que influyen en ellas. TEORIA DE COLISIONES
CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 1)
 M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 1) Cuando en una reacción química
M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 1) Cuando en una reacción química
Velocidad de Reacción y Equilibrio Químico
 Velocidad de Reacción y Equilibrio Químico Semana 11 Licda. Lilian Judith Guzmán Melgar CINÉTICA QUÍMICA Es el estudio de las velocidades de reacción y los factores que influyen en ellas. TEORIA DE COLISIONES
Velocidad de Reacción y Equilibrio Químico Semana 11 Licda. Lilian Judith Guzmán Melgar CINÉTICA QUÍMICA Es el estudio de las velocidades de reacción y los factores que influyen en ellas. TEORIA DE COLISIONES
Reacciones Reversibles Equilibrio químico
 Reacciones Reversibles Equilibrio químico Introducción El concepto de equilibrio es fundamental para conocer y entender la química y el comportamiento de las sustancias. En la constante de equilibrio se
Reacciones Reversibles Equilibrio químico Introducción El concepto de equilibrio es fundamental para conocer y entender la química y el comportamiento de las sustancias. En la constante de equilibrio se
En estas reacciones se llega a un punto de equilibrio dinámico cuando ambas velocidades se igualan.
 1 EQUILIBRIO QUIMICO Cuando se está en presencia de una reacción química reversible, los reactivos se combinan para formar productos velocidad y los productos también se combinan para formar reactivos,
1 EQUILIBRIO QUIMICO Cuando se está en presencia de una reacción química reversible, los reactivos se combinan para formar productos velocidad y los productos también se combinan para formar reactivos,
Equilibrio químico QUÍMICA III MEDIO 2018
 Equilibrio químico QUÍMICA III MEDIO 2018 Equilibrio químico con respecto a la velocidad Equilibrio químico con respecto a la concentración Equilibrio químico En una reacción química, generalmente los
Equilibrio químico QUÍMICA III MEDIO 2018 Equilibrio químico con respecto a la velocidad Equilibrio químico con respecto a la concentración Equilibrio químico En una reacción química, generalmente los
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo.
 Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
QUÍMICA. Tema 6. Equilibrio Químico
 Tema 6. Equilibrio Químico Índice - Equilibrio químico - Ley del equilibrio químico - Principio de Le Chatelier Objetivos específicos - Que el alumno pueda determinar constantes de equilibrio - Que el
Tema 6. Equilibrio Químico Índice - Equilibrio químico - Ley del equilibrio químico - Principio de Le Chatelier Objetivos específicos - Que el alumno pueda determinar constantes de equilibrio - Que el
BALANCEO POR INSPECCIÓN (TANTEO)
 M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx BALANCE PR INSPECCIÓN (TANTE) Para realizar cualquier cálculo estequiométrico, es necesario
M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx BALANCE PR INSPECCIÓN (TANTE) Para realizar cualquier cálculo estequiométrico, es necesario
Unidad 7: Equilibrio químico
 Unidad 7: Equilibrio químico 1. INTRODUCCIÓN Una reacción reversible es aquella en la cual los productos vuelven a combinarse para generar los reactivos. En estos procesos ocurren simultáneamente dos reacciones:
Unidad 7: Equilibrio químico 1. INTRODUCCIÓN Una reacción reversible es aquella en la cual los productos vuelven a combinarse para generar los reactivos. En estos procesos ocurren simultáneamente dos reacciones:
**Kc= constante hallada con la masa n
 1 EQUILIBRIO QUIMICO Cuando se está en presencia de una reacción química reversible, los reactivos se combinan para formar productos a una determinada velocidad y los productos también se combinan para
1 EQUILIBRIO QUIMICO Cuando se está en presencia de una reacción química reversible, los reactivos se combinan para formar productos a una determinada velocidad y los productos también se combinan para
Equilibrio químico. Tema 5
 Equilibrio químico Tema 5 2 1.- Concepto de equilibrio químico. Características. Aspecto dinámico de las reacciones químicas. 2.- Ley de acción de masas. K C. Cociente de reacción. 3.- K p Relación con
Equilibrio químico Tema 5 2 1.- Concepto de equilibrio químico. Características. Aspecto dinámico de las reacciones químicas. 2.- Ley de acción de masas. K C. Cociente de reacción. 3.- K p Relación con
Equilibrio químico 9/23/2010. Copyright The McGraw-Hill Companies, Inc. / Provisto por Dr. Hernández-Castillo 1. Capítulo 14
 Equilibrio es un estado en el que no hay cambios observables con el pasar del tiempo. Equilibrio químico Capítulo 14 Equilibrio químico es logrado cuando: La rapidez de la reacción en una dirección y en
Equilibrio es un estado en el que no hay cambios observables con el pasar del tiempo. Equilibrio químico Capítulo 14 Equilibrio químico es logrado cuando: La rapidez de la reacción en una dirección y en
Equilibrio químico. 1.- Concepto de equilibrio químico. Características. Aspecto dinámico de las reacciones químicas. 2.- Ley de acción de masas.
 Equilibrio químico Tema 4 3 1.- Concepto de equilibrio químico. Características. Aspecto dinámico de las reacciones químicas. 2.- Ley de acción de masas. K C. Cociente de reacción. 3.- K p Relación con
Equilibrio químico Tema 4 3 1.- Concepto de equilibrio químico. Características. Aspecto dinámico de las reacciones químicas. 2.- Ley de acción de masas. K C. Cociente de reacción. 3.- K p Relación con
GUÍA 2 DE EJERCICIOS EQUÍLIBRIO QUÍMICO
 GUÍA 2 DE EJERCICIOS EQUÍLIBRIO QUÍMICO Área Química Resultados de aprendizaje Conocer y analizar las características de un sistema en equilibrio y en base a condiciones iniciales de esté, determinar concentraciones
GUÍA 2 DE EJERCICIOS EQUÍLIBRIO QUÍMICO Área Química Resultados de aprendizaje Conocer y analizar las características de un sistema en equilibrio y en base a condiciones iniciales de esté, determinar concentraciones
UD 6. Equilibrio químico
 UD 6. Equilibrio químico 1- Equilibrio químico. Constante de equilibrio. 2- Equilibrios gaseosos. 3- Factores que modifican el equilibrio. 4- Termodinámica y constante de equilibrio. 1- Equilibrio químico.
UD 6. Equilibrio químico 1- Equilibrio químico. Constante de equilibrio. 2- Equilibrios gaseosos. 3- Factores que modifican el equilibrio. 4- Termodinámica y constante de equilibrio. 1- Equilibrio químico.
EQUILIBRIO QUÍMICO. 1. Equilibrio químico. 2. La constante de equilibrio. 3. EL principio de LeChatelier. Química 2º bachillerato Equilibrio químico 1
 EQUILIBRIO QUÍMICO 1. Equilibrio químico. 2. La constante de equilibrio. 3. EL principio de LeChatelier. Química 2º bachillerato Equilibrio químico 1 0. CONOCIMIENTOS Los conocimientos previos que son
EQUILIBRIO QUÍMICO 1. Equilibrio químico. 2. La constante de equilibrio. 3. EL principio de LeChatelier. Química 2º bachillerato Equilibrio químico 1 0. CONOCIMIENTOS Los conocimientos previos que son
GUÍA N 3: Equilibrio Químico y Cinética Química
 1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
UD 6. Equilibrio químico
 UD 6. Equilibrio químico 1- Equilibrio químico. Constante de equilibrio. 2- Equilibrios gaseosos. 3- Factores que modifican el equilibrio. 4- Termodinámica y constante de equilibrio. 1- Equilibrio químico.
UD 6. Equilibrio químico 1- Equilibrio químico. Constante de equilibrio. 2- Equilibrios gaseosos. 3- Factores que modifican el equilibrio. 4- Termodinámica y constante de equilibrio. 1- Equilibrio químico.
El equilibrio químico es un equilibrio dinámico
 Equilibrio Químico 1. Conceptos básicos. Constante de equilibrio 3. Cociente de reacción 4. Usos de la constante de equilibrio 5. Alteración de un sistema de equilibrio 6. Presiones parciales y constante
Equilibrio Químico 1. Conceptos básicos. Constante de equilibrio 3. Cociente de reacción 4. Usos de la constante de equilibrio 5. Alteración de un sistema de equilibrio 6. Presiones parciales y constante
UNIVERSIDAD DE LOS ANDES FACULTAD DE FARMACIA Y BIOANÁLISIS DEPARTAMENTO Análisis y Control CATEDRA Análisis Farmacéutico Asignatura Química General
 UNIVERSIDAD DE LOS ANDES FACULTAD DE FARMACIA Y BIOANÁLISIS DEPARTAMENTO Análisis y Control CATEDRA Análisis Farmacéutico Asignatura Química General TEMA 5 Equilibrio Químico Reacciones Irreversibles y
UNIVERSIDAD DE LOS ANDES FACULTAD DE FARMACIA Y BIOANÁLISIS DEPARTAMENTO Análisis y Control CATEDRA Análisis Farmacéutico Asignatura Química General TEMA 5 Equilibrio Químico Reacciones Irreversibles y
CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA EQUILIBRIO QUÍMICO EQUILIBRIO QUÍMICO
 CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA EQUILIBRIO QUÍMICO EQUILIBRIO QUÍMICO Desde un punto de vista termodinámico, la condición de equilibrio químico se establece a partir de la variación de la
CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA EQUILIBRIO QUÍMICO EQUILIBRIO QUÍMICO Desde un punto de vista termodinámico, la condición de equilibrio químico se establece a partir de la variación de la
5. Equilibrio químico
 5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
5. Equilibrio químico Química (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción
Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Es una reacción que nunca llega a completarse, pues se produce en ambos sentidos (los reactivos forman productos,
Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Es una reacción que nunca llega a completarse, pues se produce en ambos sentidos (los reactivos forman productos,
Equilibrio Químico. Page 1
 Equilibrio químico Equilibrio Químico Conceptos Variables que afectan el equilibrio Cociente de reacción Relación K-Kp Concepto de equilibrio químico: Es un estado en el cual no se observan cambios conforme
Equilibrio químico Equilibrio Químico Conceptos Variables que afectan el equilibrio Cociente de reacción Relación K-Kp Concepto de equilibrio químico: Es un estado en el cual no se observan cambios conforme
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Química
 Equilibrio Químico Programa de Acceso Inclusivo, Equidad y Permanencia RECUERDA QUE: el Equilibrio Químico, se presenta cuando reacciones opuestas ocurren a velocidades iguales. La velocidad a la que se
Equilibrio Químico Programa de Acceso Inclusivo, Equidad y Permanencia RECUERDA QUE: el Equilibrio Químico, se presenta cuando reacciones opuestas ocurren a velocidades iguales. La velocidad a la que se
Unidad 6 Equilibrio químico
 Unidad 6 Equilibrio químico 0.Sistemas en equilibrio Procesos físicos en equilibrio Unidad 8. Equilibrio químico 2 0.Sistemas en equilibrio Reacciones químicas en equilibrio Unidad 8. Equilibrio químico
Unidad 6 Equilibrio químico 0.Sistemas en equilibrio Procesos físicos en equilibrio Unidad 8. Equilibrio químico 2 0.Sistemas en equilibrio Reacciones químicas en equilibrio Unidad 8. Equilibrio químico
INSTITUTO TECNOLOGICO METROPOLITANO Establecimiento Público de Educación Superior, Adscrito a la Alcaldía de Medellín
 QUÍMICA BÁSICA QBX4 016-0 ORGANIZACIÓN SEMANA A SEMANA Presentación del curso: 1. 3 La química y su importancia La química y su importancia en la formación de las tecnologías e ingenierías. Surgimiento
QUÍMICA BÁSICA QBX4 016-0 ORGANIZACIÓN SEMANA A SEMANA Presentación del curso: 1. 3 La química y su importancia La química y su importancia en la formación de las tecnologías e ingenierías. Surgimiento
Actividades. 1. El proceso de formación del ácido yodhídrico se expresa gracias a la siguiente ecuación química:
 Equilibrio Químico Actividades 1. El proceso de formación del ácido yodhídrico se expresa gracias a la siguiente ecuación química: H 2 g + I 2(g) 2HI (g) de ella obtén: a. la expresión de la velocidad
Equilibrio Químico Actividades 1. El proceso de formación del ácido yodhídrico se expresa gracias a la siguiente ecuación química: H 2 g + I 2(g) 2HI (g) de ella obtén: a. la expresión de la velocidad
Problemas tipo resueltos paso a paso de EQUILIBRIO
 Problemas tipo resueltos paso a paso de EQUILIBRIO Cálculo de K c y K p.- Determine el valor de la constante de equilibrio a 40 ºC para la reacción: H (g) + I (g) HI(g) Para las siguientes condiciones:
Problemas tipo resueltos paso a paso de EQUILIBRIO Cálculo de K c y K p.- Determine el valor de la constante de equilibrio a 40 ºC para la reacción: H (g) + I (g) HI(g) Para las siguientes condiciones:
Equilibrio. Cinética vs Equilibrio. Concentración contra tiempo 3/19/2014. [P] R P Reacción irreversible (r d ) [C] [R]
![Equilibrio. Cinética vs Equilibrio. Concentración contra tiempo 3/19/2014. [P] R P Reacción irreversible (r d ) [C] [R] Equilibrio. Cinética vs Equilibrio. Concentración contra tiempo 3/19/2014. [P] R P Reacción irreversible (r d ) [C] [R]](/thumbs/84/89216320.jpg) 3/19/014 Equilibrio Concentración contra tiempo Concentración Tiempo, segundos Adaptado por: Ileana Nieves Tro: Chemistry: A Molecular Approach 1 Copyright 011 Pearson Education, Inc. Cinética vs Equilibrio
3/19/014 Equilibrio Concentración contra tiempo Concentración Tiempo, segundos Adaptado por: Ileana Nieves Tro: Chemistry: A Molecular Approach 1 Copyright 011 Pearson Education, Inc. Cinética vs Equilibrio
IES LEÓN FELIPE (GETAFE) Examen de Química de 2º de Bachillerato. 2ª evaluación. Tema 3 (cinética) y primera mitad del tema 4 (equilibrio).
 IES LEÓN FELIPE (GETAFE) Examen de Química de 2º de Bachillerato. 2ª evaluación. Tema 3 (cinética) y primera mitad del tema 4 (equilibrio). Nombre: Fecha: 1. Para la reacción A(g) + 2B(g) C(g), su ecuación
IES LEÓN FELIPE (GETAFE) Examen de Química de 2º de Bachillerato. 2ª evaluación. Tema 3 (cinética) y primera mitad del tema 4 (equilibrio). Nombre: Fecha: 1. Para la reacción A(g) + 2B(g) C(g), su ecuación
REACCIONES EN EQUILIBRIO
 Equilibrio químico REACCIONES EN EQUILIBRIO El Equilibrio es un estado en el cual no se observan variaciones a lo largo del tiempo. Se alcanza el Equilibrio químico cuando: las velocidades de reacción,
Equilibrio químico REACCIONES EN EQUILIBRIO El Equilibrio es un estado en el cual no se observan variaciones a lo largo del tiempo. Se alcanza el Equilibrio químico cuando: las velocidades de reacción,
5. Equilibrio químico. 5. Equilibrio químico
 5. Equilibrio químico uímica (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción Constante
5. Equilibrio químico uímica (1S, Grado Biología) UAM 5. Equilibrio químico Contenidos Equilibrio químico Concepto Condición de uilibro químico Energía libre de Gibbs de reacción Cociente de reacción Constante
Supongamos la reacción de formación de yoduro de hidrógeno a partir de sus componentes. I (g) + H (g) 2HI(g)
 TEMA 6: EQUILIBRIO QUÍMICO. 1.- Ley de equilibrio. En una reacción química, los reactivos se combinan entre sí para dar productos. Puede ocurrir, si el sistema de estudio es cerrado, que los productos
TEMA 6: EQUILIBRIO QUÍMICO. 1.- Ley de equilibrio. En una reacción química, los reactivos se combinan entre sí para dar productos. Puede ocurrir, si el sistema de estudio es cerrado, que los productos
Actividades. 1. El proceso de formación del ácido yodhídrico se expresa gracias a la siguiente ecuación química:
 Equilibrio Químico Actividades 1. El proceso de formación del ácido yodhídrico se expresa gracias a la siguiente ecuación química: H 2 g + I 2(g) 2HI (g) de ella obtén: a. la expresión de la velocidad
Equilibrio Químico Actividades 1. El proceso de formación del ácido yodhídrico se expresa gracias a la siguiente ecuación química: H 2 g + I 2(g) 2HI (g) de ella obtén: a. la expresión de la velocidad
Equilibrio químico EQUILIBRIO QUÍMICO QUÍMICA 2º
 Equilibrio químico Qué es un equilibrio químico? En una reacción química reversible como: a A + b B c C + d D se dan dos reacciones al mismo tiempo, por un lado A y B reaccionan para dar C y D y, conforme
Equilibrio químico Qué es un equilibrio químico? En una reacción química reversible como: a A + b B c C + d D se dan dos reacciones al mismo tiempo, por un lado A y B reaccionan para dar C y D y, conforme
2º Bachillerato EQUILIBRIO QUÍMICO
 º Bachillerato EQUILIBRIO QUÍMICO 1. Concepto de equilibrio químico.. ΔG en un proceso isotermo. 3. Constante de equilibrio Kp. 4. Constante de equilibrio Kc. 5. Constante de equilibrio Kx. 6. Equilibrio
º Bachillerato EQUILIBRIO QUÍMICO 1. Concepto de equilibrio químico.. ΔG en un proceso isotermo. 3. Constante de equilibrio Kp. 4. Constante de equilibrio Kc. 5. Constante de equilibrio Kx. 6. Equilibrio
GUIA DE EJERCICIOS (Equilibrio Químico y Cinética Química Empírica)
 Universidad de Santiago de Chile Departamento de Ingeniería Química GUIA DE EJERCICIOS (Equilibrio Químico y Cinética Química Empírica) Autor: Prof. Julio Romero 1. Describa aplicando el principio de Le
Universidad de Santiago de Chile Departamento de Ingeniería Química GUIA DE EJERCICIOS (Equilibrio Químico y Cinética Química Empírica) Autor: Prof. Julio Romero 1. Describa aplicando el principio de Le
Cinética química II: equilibrio químico SGUICEL004QM11-A16V1
 Cinética química II: equilibrio químico SGUICEL004QM11-A16V1 Ítem Alternativa Habilidad 1 E Aplicación D Aplicación 3 C Aplicación 4 A ASE 5 B Aplicación 6 E Aplicación 7 D ASE 8 B Aplicación 9 D Reconocimiento
Cinética química II: equilibrio químico SGUICEL004QM11-A16V1 Ítem Alternativa Habilidad 1 E Aplicación D Aplicación 3 C Aplicación 4 A ASE 5 B Aplicación 6 E Aplicación 7 D ASE 8 B Aplicación 9 D Reconocimiento
EQUILIBRIO. Principio de Le Chatelier Cambio en la composición de una mezcla en equilibrio.
 EQUILIBRIO Principio de Le Chatelier Cambio en la composición de una mezcla en equilibrio. Cuando se produce un cambio en una mezcla en EQ este se desplaza en la dirección que contrarreste el cambio. La
EQUILIBRIO Principio de Le Chatelier Cambio en la composición de una mezcla en equilibrio. Cuando se produce un cambio en una mezcla en EQ este se desplaza en la dirección que contrarreste el cambio. La
GUÍA 1 DE EJERCICIOS EQUILIBRIO QUÍMICO
 GUÍA 1 DE EJERCICIOS EQUILIBRIO QUÍMICO Área Química Resultados de aprendizaje Conocer y analizar las características de un sistema en equilibrio y en base a condiciones iniciales de esté, determinar concentraciones
GUÍA 1 DE EJERCICIOS EQUILIBRIO QUÍMICO Área Química Resultados de aprendizaje Conocer y analizar las características de un sistema en equilibrio y en base a condiciones iniciales de esté, determinar concentraciones
Equilibrio Químico. 2º Bachillerato IES Fuerte de Cortadura (Cádiz)
 Equilibrio Químico 2º Bachillerato IES Fuerte de Cortadura (Cádiz) 1 INTRODUCCIÓN Existen muchas reacciones en las que los productos obtenidos son capaces de reaccionar mutuamente entre sí, o descomponerse,
Equilibrio Químico 2º Bachillerato IES Fuerte de Cortadura (Cádiz) 1 INTRODUCCIÓN Existen muchas reacciones en las que los productos obtenidos son capaces de reaccionar mutuamente entre sí, o descomponerse,
Reacciones químicas. Equilibrio. Cinética. Tipos. Equilibrios ácido-base. Equilibrios de solubilidad Disoluciones Equilibrios redox. Eq.
 Estequiometría Termoquímica Espontaneidad Cuánto se produce? Cuánto reacciona? Desprende o absorbe calor? Cuánto calor? Por qué se produce? En qué dirección? Equilibrio Cuándo se alcanza? Cómo modificarlo?
Estequiometría Termoquímica Espontaneidad Cuánto se produce? Cuánto reacciona? Desprende o absorbe calor? Cuánto calor? Por qué se produce? En qué dirección? Equilibrio Cuándo se alcanza? Cómo modificarlo?
3. Formula los siguientes compuestos: a) hexafluoruro de azufre b) sulfito de litio. c) cloruro de plomo (IV) d) seleniato de francio
 1 er examen de la 2ª evaluación de Química de 2º de Bachillerato Nombre: Fecha: 1. Una mezcla gaseosa constituida inicialmente por 3,5 moles de hidrógeno y 2,5 moles de yodo se calienta a 400 ºC con lo
1 er examen de la 2ª evaluación de Química de 2º de Bachillerato Nombre: Fecha: 1. Una mezcla gaseosa constituida inicialmente por 3,5 moles de hidrógeno y 2,5 moles de yodo se calienta a 400 ºC con lo
GUIA DE ESTUDIO Nº6: Equilibrio Químico
 I.- Conceptos básicos: GUIA DE ESTUDIO Nº6: Equilibrio Químico Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio de
I.- Conceptos básicos: GUIA DE ESTUDIO Nº6: Equilibrio Químico Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio de
Química general II Equilibrio químico
 Química general II Equilibrio químico capitulo 14, Chang El equilibrio es un estado en el que no se observan cambios conforme el tiempo transcurre. Cuando una reacción química alcanza el equilibrio, las
Química general II Equilibrio químico capitulo 14, Chang El equilibrio es un estado en el que no se observan cambios conforme el tiempo transcurre. Cuando una reacción química alcanza el equilibrio, las
FÍSICA APLICADA Y FISICOQUÍMICA I. Tema 10. Equilibrio químico
 María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 10 Equilibrio químico Esquema Tema 10. Equilibrio químico 10.1 Condición de equilibrio químico y espontaneidad en
María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 10 Equilibrio químico Esquema Tema 10. Equilibrio químico 10.1 Condición de equilibrio químico y espontaneidad en
Termoquímica. Termoquímica Es la parte de la Química que estudia el intercambio energético de un sistema químico con el exterior.
 ermoquímica ermoquímica Es la parte de la Química que estudia el intercambio energético de un sistema químico con el exterior. Sistemas materiales Un SISEMA es la parte del universo que se aísla para su
ermoquímica ermoquímica Es la parte de la Química que estudia el intercambio energético de un sistema químico con el exterior. Sistemas materiales Un SISEMA es la parte del universo que se aísla para su
GUIA DE ESTUDIO Nº 7: Equilibrio Químico
 Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Cinética y Equilibrio Químico
 Cinética y Equilibrio Químico 1. La cinética química y su importancia Parte de la química que estudia la velocidad con la que suceden los procesos químicos así como los procesos moleculares que tienen
Cinética y Equilibrio Químico 1. La cinética química y su importancia Parte de la química que estudia la velocidad con la que suceden los procesos químicos así como los procesos moleculares que tienen
EQUILIBRIO QUÍMICO. Concentración. C ó D. Tiempo. Las concentraciones no cambian mucho con el tiempo. El Equilibrio es estable A+B C + D
 EQUILIBRIO QUÍMICO En química definimos equilibrio químico como el balance exacto entre dos procesos, uno de los cuales es opuesto a otro. Cuando ocurre una reacción química, los reactivos se va transformando
EQUILIBRIO QUÍMICO En química definimos equilibrio químico como el balance exacto entre dos procesos, uno de los cuales es opuesto a otro. Cuando ocurre una reacción química, los reactivos se va transformando
QUÍMICA. 2º BACHILLERATO. IES LEÓN FELIPE (GETAFE) Recuperación de la 2ª evaluación
 QUÍMICA. 2º BACHILLERATO. IES LEÓN FELIPE (GETAFE) Recuperación de la 2ª evaluación Nombre: Fecha: 1. Razona si son ciertas o falsas las siguientes afirmaciones: a) La adición de un catalizador modifica
QUÍMICA. 2º BACHILLERATO. IES LEÓN FELIPE (GETAFE) Recuperación de la 2ª evaluación Nombre: Fecha: 1. Razona si son ciertas o falsas las siguientes afirmaciones: a) La adición de un catalizador modifica
UNIDAD 3. EQULIBRIO QUÍMICO
 UNIDAD 3. EQULIBRIO QUÍMICO Equilibrio químico y características Constantes de equilibrio: K c y K p Grado de disociación Cociente de reacción Factores que afectan al equilibrio químico. Principio de Le
UNIDAD 3. EQULIBRIO QUÍMICO Equilibrio químico y características Constantes de equilibrio: K c y K p Grado de disociación Cociente de reacción Factores que afectan al equilibrio químico. Principio de Le
Tema 4. Reactividad química.
 Tema 4. Reactividad química. 1) Conservación de la masa. 2) Concepto de mol. 3) Ecuaciones químicas y su ajuste. 4) Cálculos de masa en reacciones químicas sencillas. 5) Calor de reacción. 6) Velocidad
Tema 4. Reactividad química. 1) Conservación de la masa. 2) Concepto de mol. 3) Ecuaciones químicas y su ajuste. 4) Cálculos de masa en reacciones químicas sencillas. 5) Calor de reacción. 6) Velocidad
Contenidos. Aplicación de la ley de conservación de la materia en una ecuación química.
 Contenidos Aplicación de la ley de conservación de la materia en una ecuación química. Determinación de los moles o la masa de un compuesto que participa en una reacción, conociendo los moles o la masa
Contenidos Aplicación de la ley de conservación de la materia en una ecuación química. Determinación de los moles o la masa de un compuesto que participa en una reacción, conociendo los moles o la masa
LABORATORIO QUÍMICA GENERAL GUIA 8-1. Equilibrio iónico y PH. FeSCN +2
 LABORATORIO QUÍMICA GENERAL 502501 GUIA 8-1. Equilibrio iónico y PH I. El Problema: - Estudiar el efecto de la temperatura sobre el equilibrio químico del siguiente sistema 2+ Co(H 2 O) 6 (ac) + 4Cl (ac)
LABORATORIO QUÍMICA GENERAL 502501 GUIA 8-1. Equilibrio iónico y PH I. El Problema: - Estudiar el efecto de la temperatura sobre el equilibrio químico del siguiente sistema 2+ Co(H 2 O) 6 (ac) + 4Cl (ac)
F o r m a n d o P e r s o n a s Í n t e g r a s. Guía de Contenido Unidad Equilibrio químico
 Departamento de Ciencias y Tecnología. Profesora Ana María González. O Saint Gaspar College Misio nero s de la Precio sa Sangre Guía de Contenido Unidad Equilibrio químico Muchas de las reacciones que
Departamento de Ciencias y Tecnología. Profesora Ana María González. O Saint Gaspar College Misio nero s de la Precio sa Sangre Guía de Contenido Unidad Equilibrio químico Muchas de las reacciones que
Tema 5: Equilibrio químico
 Tema 5: Equilibrio químico. Concepto. Equilibrio y energía libre. Sistemas gaseosos. Ley de velocidad. Ley de acción de masas. Equilibrios heterogéneos. Aplicaciones de la constante de equilibrio. Cociente
Tema 5: Equilibrio químico. Concepto. Equilibrio y energía libre. Sistemas gaseosos. Ley de velocidad. Ley de acción de masas. Equilibrios heterogéneos. Aplicaciones de la constante de equilibrio. Cociente
TERMODINÁMICA - PREGUNTAS DE TEST
 TERMODINÁMICA - PREGUNTAS DE TEST Grupo A: DEFINICIONES DE VARIABLES. CONCEPTOS GENERALES Grupo B: MAQUINAS TÉRMICAS: Grupo C: PRIMER PRINCIPIO: Grupo D: SEGUNDO PRINCIPIO: Grupo E: ESPONTANEIDAD DE LAS
TERMODINÁMICA - PREGUNTAS DE TEST Grupo A: DEFINICIONES DE VARIABLES. CONCEPTOS GENERALES Grupo B: MAQUINAS TÉRMICAS: Grupo C: PRIMER PRINCIPIO: Grupo D: SEGUNDO PRINCIPIO: Grupo E: ESPONTANEIDAD DE LAS
1. Primer principio de la termodinámica.
 1. Primer principio de la termodinámica. Conceptos previos La termodinámica es la parte de la Física que se encarga de estudiar los cambios en los sistemas físicos en los que interviene el calor. En primer
1. Primer principio de la termodinámica. Conceptos previos La termodinámica es la parte de la Física que se encarga de estudiar los cambios en los sistemas físicos en los que interviene el calor. En primer
I 2 (s) I 2 (g) Los cambios de fase son reversibles y ambas fases coexisten en equilibrio en unas determinadas condiciones de presión y temperatura.
 El yodo molecular es un sólido de color violeta oscuro. Si en un recipiente de vidrio, en el que previamente se ha extraído el aire de su interior; se introduce yodo sólido, puede observarse cómo rápidamente
El yodo molecular es un sólido de color violeta oscuro. Si en un recipiente de vidrio, en el que previamente se ha extraído el aire de su interior; se introduce yodo sólido, puede observarse cómo rápidamente
1 0,1 0,1 5, ,2 0,1 2, ,1 0,3 1, ,1 0,6 3,3 10-5
 CINÉTICA QUÍMICA. Ecuación de velocidad 1.- Escribe la ecuación de velocidad de las siguientes reacciones: a) NO(g) + O 3 (g) NO (g) + O (g) si sabemos que la reacción es de primer orden con respecto a
CINÉTICA QUÍMICA. Ecuación de velocidad 1.- Escribe la ecuación de velocidad de las siguientes reacciones: a) NO(g) + O 3 (g) NO (g) + O (g) si sabemos que la reacción es de primer orden con respecto a
EQUILIBRIO QUÍMICO. Dr. Hugo Cerecetto. Prof. Titular de Química
 EQUILIBRIO QUÍMICO Dr. Hugo Cerecetto Prof. Titular de Química Temario 3) Equilibrio químico: - Naturaleza y propiedades del equilibrio químico - Equilibrio gaseoso - Constante de equilibrio, interpretación
EQUILIBRIO QUÍMICO Dr. Hugo Cerecetto Prof. Titular de Química Temario 3) Equilibrio químico: - Naturaleza y propiedades del equilibrio químico - Equilibrio gaseoso - Constante de equilibrio, interpretación
Química general II Equilibrio químico
 Química general II Equilibrio químico capitulo 14, Chang El equilibrio es un estado en el que no se observan cambios conforme el tiempo transcurre. Cuando una reacción química alcanza el equilibrio, las
Química general II Equilibrio químico capitulo 14, Chang El equilibrio es un estado en el que no se observan cambios conforme el tiempo transcurre. Cuando una reacción química alcanza el equilibrio, las
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción B Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción B Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 5, Opción
EQUILIBRIO QUÍMICO. Cuando ocurre una reacción química, termina agotándose siempre, al menos, uno de los reactivos?
 EQUILIBRIO QUÍMICO Cuando ocurre una reacción química, termina agotándose siempre, al menos, uno de los reactivos? DEFINICIÓN DE EQUILIBRIO QUÍMICO Las reacciones que ocurren en un único sentido se llaman
EQUILIBRIO QUÍMICO Cuando ocurre una reacción química, termina agotándose siempre, al menos, uno de los reactivos? DEFINICIÓN DE EQUILIBRIO QUÍMICO Las reacciones que ocurren en un único sentido se llaman
Unidad Equilibrio químico IIIº Medios º Parte.
 Unidad Equilibrio químico IIIº Medios 2018 1º Parte. Muchas de las reacciones que se producen en la naturaleza son irreversibles. Una reacción irreversible es aquella en que los reactantes se transforman
Unidad Equilibrio químico IIIº Medios 2018 1º Parte. Muchas de las reacciones que se producen en la naturaleza son irreversibles. Una reacción irreversible es aquella en que los reactantes se transforman
EQUILIBRIO QUÍMICO (Reacciones de Precipitación)
 transparent www.profesorjrc.es EQUILIBRIO QUÍMICO (Reacciones de Precipitación) Prof. Jorge Rojo Carrascosa 20 de octubre de 2015 Prof. Jorge Rojo Carrascosa EQUILIBRIO QUÍMICO (Reacciones de Precipitación)
transparent www.profesorjrc.es EQUILIBRIO QUÍMICO (Reacciones de Precipitación) Prof. Jorge Rojo Carrascosa 20 de octubre de 2015 Prof. Jorge Rojo Carrascosa EQUILIBRIO QUÍMICO (Reacciones de Precipitación)
IES LEÓN FELIPE (GETAFE) EXAMEN DE LA UNIDAD 3 (CINÉTICA) DE QUÍMICA DE 2º DE BACHILLERATO
 IES LEÓN FELIPE (GETAFE) EXAMEN DE LA UNIDAD 3 (CINÉTICA) DE QUÍMICA DE 2º DE BACHILLERATO Nombre: Fecha: 1. Considerando el siguiente diagrama de energía para la reacción A B + C, contesta razonadamente
IES LEÓN FELIPE (GETAFE) EXAMEN DE LA UNIDAD 3 (CINÉTICA) DE QUÍMICA DE 2º DE BACHILLERATO Nombre: Fecha: 1. Considerando el siguiente diagrama de energía para la reacción A B + C, contesta razonadamente
CINÉTICA QUÍMICA. 1 0,1 0,1 5, ,2 0,1 2, ,1 0,3 1, ,1 0,6 3,3 10-5
 Ecuación de velocidad CINÉTICA QUÍMICA. 1.- Escribe la ecuación de velocidad de las siguientes reacciones: a) NO(g) + O 3 (g) NO 2 (g) + O 2 (g) si sabemos que la reacción es de primer orden con respecto
Ecuación de velocidad CINÉTICA QUÍMICA. 1.- Escribe la ecuación de velocidad de las siguientes reacciones: a) NO(g) + O 3 (g) NO 2 (g) + O 2 (g) si sabemos que la reacción es de primer orden con respecto
QUÍMICA BASICA UNIDAD III PRINCIPIO DE LE CHÂTELIER
 En ocasiones se necesita solamente establecer conclusiones cualitativas sobre una reacción reversible: el sentido del cambio neto, si la cantidad de una sustancia ha aumentado o disminuido cuando se alcance
En ocasiones se necesita solamente establecer conclusiones cualitativas sobre una reacción reversible: el sentido del cambio neto, si la cantidad de una sustancia ha aumentado o disminuido cuando se alcance
QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010)
QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010)
CINÉTICA QUÍMICA. 1 0,1 0,1 5, ,2 0,1 2, ,1 0,3 1, ,1 0,6 3,3 10-5
 CINÉTICA QUÍMICA. Ecuación de velocidad 1.- Escribe la ecuación de velocidad de las siguientes reacciones: a) NO(g) + O 3(g) NO 2(g) + O 2(g) si sabemos que la reacción es de primer orden con respecto
CINÉTICA QUÍMICA. Ecuación de velocidad 1.- Escribe la ecuación de velocidad de las siguientes reacciones: a) NO(g) + O 3(g) NO 2(g) + O 2(g) si sabemos que la reacción es de primer orden con respecto
Guía sexto examen parcial Ciencias III (Énfasis en Química)
 Guía sexto examen parcial Ciencias III (Énfasis en Química) ALUMNO: GRUPO: DÍA DE ENTREGA: DÍA DEL EXAMEN CALIFICACIÓN: 1. INSTRUCCIONES: completa los siguientes oraciones Una es un proceso en el que una
Guía sexto examen parcial Ciencias III (Énfasis en Química) ALUMNO: GRUPO: DÍA DE ENTREGA: DÍA DEL EXAMEN CALIFICACIÓN: 1. INSTRUCCIONES: completa los siguientes oraciones Una es un proceso en el que una
GUÍA DE EJERCICIOS TERMOQUÍMICA
 GUÍA DE EERCICIOS TERMOQUÍMICA Área Química Resultados de aprendizaje Analizar y aplicar características entregadas sobre una reacción química en la resolución de ejercicios, potenciando el pensamiento
GUÍA DE EERCICIOS TERMOQUÍMICA Área Química Resultados de aprendizaje Analizar y aplicar características entregadas sobre una reacción química en la resolución de ejercicios, potenciando el pensamiento
TEORÍA. Cinética quimica. + la velocidad media e instantánea se calculan de la
 La cinética química es la parte de la química que estudia la velocidad con la que suceden las reacciones, de los factores que influyen en ella y del mecanismo a través del cual los reactivos se transforman
La cinética química es la parte de la química que estudia la velocidad con la que suceden las reacciones, de los factores que influyen en ella y del mecanismo a través del cual los reactivos se transforman
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Modelo 2005/2006 PRIMERA PARTE
 1 PAU Química. Modelo 2005/2006 PRIMERA PARTE Cuestión 1. Para el elemento alcalino del tercer periodo y para el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones electrónicas.
1 PAU Química. Modelo 2005/2006 PRIMERA PARTE Cuestión 1. Para el elemento alcalino del tercer periodo y para el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones electrónicas.
Cómo se puede modificar la situación de equilibrio?
 Cómo se puede modificar la situación de equilibrio? Cambiando la constante de equilibrio Cambiando la temperatura Sin cambiar la constante de equilibrio Cambiando el resto de condiciones Principio de Le
Cómo se puede modificar la situación de equilibrio? Cambiando la constante de equilibrio Cambiando la temperatura Sin cambiar la constante de equilibrio Cambiando el resto de condiciones Principio de Le
En el transcurso de una reacción química se rompen enlaces de los reactivos y se forman nuevos enlaces que dan lugar a los productos.
 Termoquímica En el transcurso de una reacción química se rompen enlaces de los reactivos y se forman nuevos enlaces que dan lugar a los productos. Para romper enlaces se consume energía y al formar otros
Termoquímica En el transcurso de una reacción química se rompen enlaces de los reactivos y se forman nuevos enlaces que dan lugar a los productos. Para romper enlaces se consume energía y al formar otros
TEMA V. VELOCIDAD DE REACCIÓN. EQUILIBRIO QUÍMICO
 TEMA V. VELOCIDAD DE REACCIÓN. EQUILIBRIO QUÍMICO I. VELOCIDAD DE REACCIÓN. Hemos visto hasta ahora el efecto térmico que acompaña a la reacción química, así como la posibilidad de predecir la espontaneidad.
TEMA V. VELOCIDAD DE REACCIÓN. EQUILIBRIO QUÍMICO I. VELOCIDAD DE REACCIÓN. Hemos visto hasta ahora el efecto térmico que acompaña a la reacción química, así como la posibilidad de predecir la espontaneidad.
QUÍMICA 2º Bachillerato Ejercicios: Equilibrio Químico
 1(9) Ejercicio nº 1 A 20 ºC, la constante de equilibrio es Kc = 0,21 para la reacción: NH 4 SH (s) H 2 S (g) + NH 3 (g) En un matraz tenemos una mezcla de estas especies con las siguientes concentraciones:
1(9) Ejercicio nº 1 A 20 ºC, la constante de equilibrio es Kc = 0,21 para la reacción: NH 4 SH (s) H 2 S (g) + NH 3 (g) En un matraz tenemos una mezcla de estas especies con las siguientes concentraciones:
Universidad de los Andes Química 11 Profesor Pedro Rodríguez
 EJERCICIOS Ejercicio nº 1 A 20 ºC, la constante de equilibrio es K C = 0,21 para la reacción: NH 4 SH(s) H 2 S(g) + NH 3 (g) En un matraz tenemos una mezcla de estas especies con las siguientes concentraciones:
EJERCICIOS Ejercicio nº 1 A 20 ºC, la constante de equilibrio es K C = 0,21 para la reacción: NH 4 SH(s) H 2 S(g) + NH 3 (g) En un matraz tenemos una mezcla de estas especies con las siguientes concentraciones:
ACADEMIA ALCOVER. PALMA DE MALLORCA
 1 EQUILIBRIO QUÍMICO. VER VIDEO https://youtu.be/uucscg4wkoa El equilibrio químico es el estado del sistema en el que las velocidades de la reacción directa e inversa son iguales. En esta situación, las
1 EQUILIBRIO QUÍMICO. VER VIDEO https://youtu.be/uucscg4wkoa El equilibrio químico es el estado del sistema en el que las velocidades de la reacción directa e inversa son iguales. En esta situación, las
CINÉTICA Y EQUILIBRIO QUÍMICO
 CINÉTICA Y EQUILIBRIO QUÍMICO M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM Todos los derechos reservados 1 Cinética Química La cinética
CINÉTICA Y EQUILIBRIO QUÍMICO M. en C. Alicia Cea Bonilla Coordinadora de Enseñanza de Bioquímica y Biología Molecular. Fac. de Medicina. UNAM Todos los derechos reservados 1 Cinética Química La cinética
PROBLEMAS PROPUESTOS DE CINÉTICA QUÍMICA
 PROBLEMAS PROPUESTOS DE CINÉTICA QUÍMICA 1) Los datos de las velocidades iniciales para la reacción X + Y Z se recogen a continuación: [X] (M) 0,10 0,10 0,30 [Y] (M) 0,10 0,20 0,30 Velocidad (M/s) 0,020
PROBLEMAS PROPUESTOS DE CINÉTICA QUÍMICA 1) Los datos de las velocidades iniciales para la reacción X + Y Z se recogen a continuación: [X] (M) 0,10 0,10 0,30 [Y] (M) 0,10 0,20 0,30 Velocidad (M/s) 0,020
Tema 7: EQUILIBRIO QUÍMICO
 Tema 7: EQUILIBRIO QUÍMICO 1) Qué es un equilibrio químico? En los problemas de estequiometría del tema 1 supusimos que las reacciones químicas se detienen cuando uno o más reactivos se agotan. Estas reacciones
Tema 7: EQUILIBRIO QUÍMICO 1) Qué es un equilibrio químico? En los problemas de estequiometría del tema 1 supusimos que las reacciones químicas se detienen cuando uno o más reactivos se agotan. Estas reacciones
Universidad Técnica Federico Santa María Departamento de Química
 Universidad Técnica Federico Santa María Departamento de Química Química y Sociedad QUI - 010 Certamen 2 Casa Central (05 Noviembre año 2008) Nombre:...Rol USM... Profesor:...Paralelo... Tabla con valores
Universidad Técnica Federico Santa María Departamento de Química Química y Sociedad QUI - 010 Certamen 2 Casa Central (05 Noviembre año 2008) Nombre:...Rol USM... Profesor:...Paralelo... Tabla con valores
DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO. Equilibrio químico
 DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA º DE BACHILLERATO Actividades tema 6 Equilibrio químico Reacciones reversibles y equilibrio químico.-formula la expresión de K C para
DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA º DE BACHILLERATO Actividades tema 6 Equilibrio químico Reacciones reversibles y equilibrio químico.-formula la expresión de K C para
SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA
 I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
TEMA 6 Termoquímica y Equilibrio Químico
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE INGENIERÍA DIVISIÓN DE CIENCIAS BÁSICAS TEMA 6 Termoquímica y Equilibrio Químico Ana Laura Pérez Martínez Academia de Química; 2016 2 Ana Laura Pérez
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE INGENIERÍA DIVISIÓN DE CIENCIAS BÁSICAS TEMA 6 Termoquímica y Equilibrio Químico Ana Laura Pérez Martínez Academia de Química; 2016 2 Ana Laura Pérez
