Capítulo 7. Tinciones utilizadas en oocitos y embriones bovinos. Montaje de embriones para tinciones fluorescentes
|
|
|
- María Rosa Suárez Agüero
- hace 5 años
- Vistas:
Transcripción
1 Capítulo 7 Tinciones utilizadas en oocitos y embriones bovinos Autores: Ariel Marcel Tarazona Morales, Juan Camilo Álvarez Balvín, Juliana Victoria Bedoya Jaramillo, Zulma Tatiana Ruiz Cortés. La evaluación de oocitos y embriones bovinos mediante técnicas de tinción tiene gran relevancia para determinar los efectos que pueden tener las diferentes sustancias o condiciones utilizadas en los procesos de producción de embriones bovinos in vitro sobre la funcionalidad celular en diferentes estadios. En este capítulo se describen los procedimientos a realizar en algunas de estas técnicas. Montaje de embriones para tinciones fluorescentes Propósito: Indicar la metodología para el montaje de embriones en portaobjetos, conservando su morfología esférica para la evaluación de diferentes parámetros.
2 Cultivo de tejidos reproductivos y producción y manipulación de embriones bovinos Materiales: Láminas portaobjetos, laminillas cubreobjetos, puntas para las micropipetas de 10, 100 y 1000 µl. microscopio de epifluorescencia, incubadora de CO 2. Medios: HEPES de trabajo (ver capítulo 2), mezcla parafina-vaselina. Indumentaria: Trabajo en laboratorio (ver capítulo 1). Procedimiento: Para la realización de la mezcla parafina-vaselina: Pesar 2 gr de parafina y 40 gr de vaselina (1:10 p/p) en un beaker de 100 ml. Calentar la mezcla hasta que los componentes se disuelvan completamente y se incorporen. Colocar la mezcla líquida en jeringas de 5 o 10 ml y mantenerlas en refrigeración (ver figura 7.1). Figura 7.1. Jeringa con mezcla parafina-vaselina. Para el montaje de los embriones: Marcar la lámina portaobjeto en uno de los extremos con marcador permanente, con la información del embrión que se desea evaluar. Preparar la laminilla cubreobjeto, colocando cuatro puntos de mezcla de parafinavaselina en las cuatro esquinas para tener un espacio que evitará que el embrión pierda su forma y permitirá una mejor manipulación durante la observación bajo el microscopio de fluorescencia (ver figura 7.2). Nota: Si se requiere un conteo de las células se debe ejercer una presión controlada sobre el cubreobtejos hasta que se rompa la zona pelúcida. 152
3 Tinciones utilizadas en oocitos y embriones bovinos Poner una gota de 10 µl de medio HEPES en la lámina portaobjeto, y en ella el embrión a evaluar. Poner encima la laminilla cubreobjeto previamente preparada y evaluar al microscopio. Nota: En cada lámina portaobjeto se pueden evaluar hasta 10 embriones. Figura 7.2. Preparación del montaje para evaluación de embriones. Para una mejor observación al microscopio, utilizar una punta o aguja para mover con pequeños toques el cubreobjeto, así el embrión puede girar para buscar el ángulo deseado de evaluación. Tinción de Hoechst para evaluación nuclear Propósito: Indicar la metodología para la tinción de embriones u oocitos con el fluorocromo Hoechst. Materiales: Gradilla para tubos cónicos de 15 ml, cajas de Petri de 35 mm, puntas para las micropipetas de 10, 100 y 1000 µl. microscopio de epifluorescencia, incubadora de CO 2. Medios: HEPES, Hoechst a 10µg/ml (ver capítulo 2). de fluorocromos (ver capítulo 1). Procedimiento: En cabina de flujo laminar: Sacar los embriones u oocitos del medio de cultivo y pasarlos a una caja de Petri con gotas de 50 µl HEPES de trabajo y adicionar 10 µl de solución Hoechst de trabajo (10 mg/ml), luego incubarlos a 38,6 C y 6% CO 2 durante 5 minutos. Realizar el montaje de los embriones (ver figura 7.2). Observar en fresco inmediatamente al microscopio de epifluorescencia, utilizando el objetivo de 40X y el filtro azul. Los núcleos de las blastómeras emitirán fluorescencia azul y se verán redondos y ubicados al centro de la célula. Los resultados se expresan en número de núcleos (células) (ver figura 7.3). 153
4 Cultivo de tejidos reproductivos y producción y manipulación de embriones bovinos Figura 7.3. Embriones teñidos con Hoechst. Tinción con JC-1 potencial mitocondrial transmembranal Propósito: Indicar la metodología para la tinción de embriones u oocitos con el fluorocromo JC-1. Materiales: Gradilla para tubos cónicos de 15 ml, cajas de Petri de 35 mm, puntas para las micropipetas de 10, 100 y 1000 µl. microscopio de epifluorescencia, incubadora de CO 2. Medios: HEPES de trabajo, Solución de tinción JC-1 a 7,5 µm (ver capítulo 2). de fluorocromos (ver capítulo 1). Procedimiento: En cabina de flujo laminar: Sacar los embriones u oocitos del medio de cultivo y pasarlos a una caja de Petri con gotas de 50 µl HEPES de trabajo y 1 µm de tinción cultivo JC-1 en el mismo medio, luego incubarlos a 38,6 C y 6% CO 2 durante 25 minutos. Realizar el montaje de los embriones (ver figura 7.2). Observar en fresco inmediatamente al microscopio de epifluorescencia, utilizando el objetivo de 40X y los filtros para rodamina (BP , FT 510, LP 515) y fluoresceína (G 365, FT 395, LP 420). El control positivo se realiza con oocitos madurados in vitro incubados en medio de tinción (también se pueden usar células de granulosa); el control negativo se realiza incubando los embriones en medio de cultivo sin colorante. 154
5 Tinciones utilizadas en oocitos y embriones bovinos Las mitocondrias con alto potencial de membrana se observarán de color rojo (filtro 14) (ver figura 7.4 A) y las que tienen bajo potencial se observarán de color verde (filtro 09) (ver figura 7.4 B). Los resultados se expresan en porcentaje de coloración roja con respecto a los controles positivos. Figura 7.4. A. Embrión con mitocondrias con alto potencial de membrana; B. Embrión con mitocondrias con bajo potencial de membrana. Tinción con dihidro-rodamina (DHR) para evaluación de H 2 O 2 Propósito: Indicar la metodología para la tinción de embriones u oocitos con el fluorocromo DHR. Materiales: Gradilla para tubos cónicos de 15ml, cajas de Petri de 35 mm, puntas para las micropipetas de 10, 100 y 1000 µl incubadora de CO 2. Medios: HEPES de trabajo (ver capítulo 2), Solución DHR a 1µM. de fluorocromos (ver capítulo 1). Procedimiento: En cabina de flujo laminar: Sacar los embriones u oocitos del medio de cultivo y pasarlos a una caja de Petri con gotas de 50 µl HEPES de trabajo y 1 µm de DRH en el mismo medio, luego incubarlos a 38,6 C y 6% CO 2 durante 15 minutos. Realizar el montaje de los embriones (ver figura 7.2). Observar en fresco inmediatamente al microscopio de epifluorescencia utilizando el filtro 09 (fluoresceína) en objetivo de 40X. 155
6 Cultivo de tejidos reproductivos y producción y manipulación de embriones bovinos El control positivo se realiza incubando los embriones en el medio de tinción a una concentración final en gota de incubación de 150 µm de H 2 O 2 ; el control negativo se realiza incubando los embriones en gota de medio de cultivo sin DHR. Las células positivas se observarán de color verde intenso fluorescente, lo cual corresponde a aquellas que presentan acumulación intracelular de H 2 O 2. Los resultados se expresan en porcentaje de células positivas. Figura 7.5. Embrión con la tinción DHR. Se señalan las células positivas con punta de flecha, y se señala la célula negativa con flecha. Tinción con AO/EB para evaluación de apoptosis Propósito: Indicar la metodología para la tinción de embriones u oocitos con los fluorocromos AC (Acridine Orange) y EB (Ethidium Bromide) AO/EB. Materiales: Gradilla para tubos cónicos de 15ml, cajas de Petri de 35 mm, puntas para las micropipetas de 10, 100 y 1000 µl. microscopio de epifluorescencia, incubadora de CO 2. Medios: HEPES de trabajo, Solución AO/EB a 5 µm (concentración final) (solución stock a 0,1 mg/ml) (ver capítulo 2). de fluorocromos (ver capítulo 1). Procedimiento: En cabina de flujo laminar: Sacar los embriones u oocitos del medio de cultivo y pasarlos a una caja de Petri con gotas de 50µl HEPES de trabajo y 5 µm de AO/EB en el mismo medio, luego incubarlos a 38,6 C y 6% CO 2 durante 1 minuto. 156
7 Tinciones utilizadas en oocitos y embriones bovinos Realizar el montaje de los embriones (ver figura 7.2). Observar en fresco inmediatamente al microscopio de epifluorescencia utilizando el objetivo de 40X. El control positivo se realiza incubando embriones en 100 µm H 2 O 2 durante toda la noche para inducir apoptosis; el control negativo se realiza usando embriones sincrónicos competentes de dos células. Para la lectura: las células normales (CN) presentan cromatina verde brillante, las células en apoptosis temprana (CAT) presentan cromatina altamente condensada o fragmentada verde brillante, las células en apoptosis tardía (CATA) presentan cromatina altamente condensada o fragmentada naranja brillante, y las células necróticas (CN) presentan cromatina naranja brillante (Leite et al, 1999) (ver figura 7.6). Los resultados se expresan en porcentaje de células apoptóticas, necróticas y viables. Figura 7.6. Tinción AO/EB. A. Embrión viable (células verde brillante); B. Embrión no viable (células naranja brillante). La flecha señala presencia de cuerpos apoptóticos. Evaluación de caspasas activas, tinción con Z-VAC-FMK Propósito: Indicar la metodología para la tinción de embriones u oocitos con el fluorocromo Z-VAC-FMK, con el fin de evaluar caspasas activas. Materiales: Gradilla para tubos cónicos de 15ml, cajas de Petri de 35 mm, puntas para las micropipetas de 10, 100 y 1000 µl. microscopio de epifluorescencia, incubadora de CO 2. Medios: HEPES de trabajo, Solución Z-VAC-FMK a 1 µm (ver capítulo 2). de fluorocromos (ver capítulo 1). 157
8 Cultivo de tejidos reproductivos y producción y manipulación de embriones bovinos Procedimiento: En la cabina de flujo laminar: Sacar los embriones u oocitos del medio de cultivo y pasarlos a una caja de Petri con gotas de 50 µl HEPES de trabajo y 1 µm Z-VAC-FMK en el mismo medio, luego incubarlos a 38,6 C y 6% CO 2 durante 20 minutos. Realizar el montaje de los embriones (ver figura 7.2). Observar en fresco inmediatamente al microscopio de epifluorescencia, utilizando el objetivo de 40X y el filtro para fluoresceína. La FITC-VAD-fluorometilcetona Z-VAC-FMK es un inhibidor permeable para caspasas de amplio espectro (Zakeri, et al, 2005), que exhibe fluorescencia verde brillante en presencia de las caspasas activas 3, 6 y 9. Las células con baja activa de caspasas presentan coloración verde opaca o roja (inactivas) (ver figura 7.7). Los resultados se expresan en porcentaje de células con coloración positiva del total de células evaluadas. Figura 7.7. Coloración de caspasas. Se señalan las células con caspasas positivas con punta de flecha, y se señalan las células con caspasas negativas con flecha. Tinción con naranja de acridina para celularidad Propósito: Indicar la metodología para la tinción de embriones u oocitos con los fluorocromos AC (Acridine Orange) y EB (Ethidium Bromide) AO/EB Materiales: Gradilla para tubos cónicos de 15ml, cajas de Petri de 35 mm, puntas para las micropipetas de 10, 100 y 1000 µl. microscopio de epifluorescencia, incubadora de CO 2. Medios: HEPES de trabajo, Solución de naranja de acridina de trabajo 5µM (concentración final) (solución stock a 0,1 mg/ml) (ver capítulo 2). 158
9 Tinciones utilizadas en oocitos y embriones bovinos de flourocromos (ver capítulo 1). Procedimiento: En cabina de flujo laminar: Sacar los embriones u oocitos del medio de cultivo, pasarlos a una caja de Petri con gotas de 50 µl HEPES de trabajo y adicionar 10 µl de solución de trabajo de naranja de acridina (330 µg/ml), para una concentración final de 66 µg/ml, luego incubarlos a 38,6 C y 6% CO2 durante 5 minutos. Realizar el montaje de los embriones (ver figura 7.2). Observar en fresco inmediatamente al microscopio de epifluorescencia, utilizando el objetivo de 40X y el filtro verde. Los núcleos de las blastómeras emitirán fluorescencia verde brillante y se verán redondos y ubicados al centro de la célula. Los resultados se expresan en número de núcleos (células) (ver figura 7.8). Figura 7.8. Embriones teñidos con naranja de acridina. A. Se señalan los núcleos teñidos. B. Se señala la masa celular interna. C. Se señalan las células trofoectodermo. Técnica de túnel para la detección de apoptosis en embriones bovinos Propósito: Indicar la técnica de marcaje in situ del ADN fragmentado en blastómeras de embriones bovinos. Materiales: Cajas de Petri de 60 mm, cajas de Petri de 35 mm, puntas para las micropipetas de 10, 100 y 1000 µl, nevera de poliestireno expandido (icopor), con hielo, recipiente oscuro, tubos de microcentrífuga de 0,5 ml, portaobjetos y cubreobjetos limpios, servilletas y tijeras. microscopio de epifluorescencia y platina térmica. 159
10 Cultivo de tejidos reproductivos y producción y manipulación de embriones bovinos Medios: Solución PBS + 0,025% PVP, paraformaldehído 4%, tritón X-100 al 0,5% (v/v) + citrato de sodio al 0,1% (w/v), buffer de equilibrio, enzima rtdt (deoxinucleotidil transferasa recombinante), Mix dutps (deoxinucleótidos conjugados con fluoresceína), SSC 2X, aceite mineral, Hoechst (10 µg/ml) (ver capítulo 2), solución antifade. de fluorocromos (ver capítulo 1). Procedimiento: En cabina de flujo laminar: Sacar los embriones del medio de cultivo y realizar un doble lavado en gotas de 50 µl de PBS + 0,025% PVP (1 minuto por cada gota). Fijar los embriones en una gota de 50 µl de paraformaldehído al 4% por 30 minutos a 4 C. Repetir el paso 1. Después de la fijación de los embriones, estos pueden ser guardados en el medio de lavado a 4 C por un período de tres semanas. En caso contrario, continuar con el proceso. Someter los embriones a un proceso de permeabilización, ponerlos en una solución de tritón X-100 al 0,5% (v/v) + citrato de sodio al 0,1% (w/v) por 30 minutos a temperatura ambiente. Repetir el paso 1. Poner los embriones en una gota de 50 µl de solución buffer de equilibrio (Be) por 15 minutos a temperatura ambiente. Transferir los embriones a una gota de 50 µl del mix de reacción, cubrir con aceite mineral e incubar a 37 C por 1 hora en condiciones de completa oscuridad. Sacar los embriones de la solución de incubación y transferirlos a una gota de 50 µl de SSC 2X por 15 minutos a temperatura ambiente. Repetir el paso 1. Poner los embriones en un portaobjetos y adicionar 10 µl de Hoechst ([w] = 10 µg/ml) por 1 minuto, retirar el exceso de Hoechst y lavar con PBS + 0,025% PVP, retirar el exceso de medio de lavado, adicionar 10 µl de solución antifade y colocar el cubreobjetos (ver figura 7.2). Observar en microscopio de epifluorescencia teniendo en cuenta las longitudes para la fluoresceína (520 ± 20 nm) y el Hoechst (emisión a 352 nm y excitación a 455 nm). Realizar registro fotográfico con cada filtro para su posterior conteo (ver figura 7.9). El control positivo se realiza efectuando los pasos 1, 2, 3 y 4 del protocolo de túnel. Posteriormente, incubar los embriones en una solución de DNasa tipo I (50 U/ml) a 37 C por 1 hora en condiciones de completa oscuridad. Llevar los embriones a una gota de medio de lavado y continuar con el paso 5 (ver figura 7.10 A). El control 160
11 Tinciones utilizadas en oocitos y embriones bovinos negativo se realiza siguiendo los pasos del protocolo de túnel, pero omitiendo la adición de la enzima rtdt durante la preparación del mix de reacción (ver figura 7.10 B). Doble tinción con Hoechst/Ioduro de Propidio para la viabilidad embrionaria Propósito: Indicar la técnica de doble tinción con Hoechst e ioduro de propidio para realizar un conteo diferencial de células viables y células muertas. Materiales: Cajas de Petri de 35 mm, puntas para las micropipetas de 10, 100 y 1000 µl, portaobjetos y cubreobjetos limpios, servilletas y tijeras. microscopio de epifluorescencia y platina térmica. Medios: PBS + 0,025% PVP, Hoechst (10 µg/ml), ioduro de propidio (0,05 mg/ml), solución antifade (ver capítulo 2). de fluorocromos (ver capítulo 1). Figura 7.9. Tinción técnica TUNEL A. Presenta el conteo celular basado en una tinción de contraste con Hoechst; B. Corresponde a una fusión del registro fotográfico captado con dos filtros diferentes, empleada para verificar las células positivas para TUNEL; C. Muestra los puntos en el embrión donde se evidencia la incorporación de nucleótidos con jugados con fluoresceína (verde fluorescente). El índice de apoptosis se obtiene dividiendo la cantidad de células positivas para TUNEL sobre el total células del embrión. Figura A. Control negativo de la técnica de TUNEL (bloqueo de la incorporación de nucleótidos mediante la omisión de la enzima rtdt durante la incubación con el mix de reacción). B. Control positivo de la técnica de TUNEL (fragmentación general en las blastómeras inducido por la acción de una DNasa tipo I). 161
12 Cultivo de tejidos reproductivos y producción y manipulación de embriones bovinos Procedimiento: En cabina de flujo laminar: Sacar los embriones del medio de cultivo y realizar un doble lavado en gotas de PBS + 0,025% PVP (1 minuto por cada gota). Tomar un embrión con un volumen de 10 µl de medio de lavado y ubicarlo en el portaobjetos previamente marcado. Retirar el exceso de medio y adicionar 10 µl de solución Hoechst (10 µg/ml) por un minuto. Mantener la muestra alejada de la luz directa. Retirar el Hoechst y adicionar 10 µl de solución PBS + 0,025% PVP, realizar un pipeteo suave sin perder de vista el embrión. Retirar el medio de lavado. Adicionar 10 µl de ioduro de propidio (0,05 mg/ml) por un minuto. Tener en cuenta las recomendaciones del paso 2. Retirar el exceso de ioduro de propidio y proceder al lavado indicado en el paso 3. adicionar 10 µl de solución antifade y colocar el cubreobjetos (ver figura 7.2). Observar en microscopio de epifluorescencia empleando un filtro en capacidad de leer la intensidad de ambos fluorocromos: Hoechst (emisión a 352 nm y excitación a 455 nm) y el ioduro de propidio (emisión a 338 nm y excitación a 617 nm). Figura Ambos fluorocromos se intercalan en el ADN. El Hoechst ingresa a todas las células, pero el ioduro de propidio sólo entra en las células muertas o necróticas (con daño en membrana). 162
13 Tinciones utilizadas en oocitos y embriones bovinos Bibliografía recomendada Leite M, Quinta CM, Leite PS, Guimarães JE (1999), Critical evaluation of techniques to detect and measure cell death--study in a model of UV radiation of the leukaemic cell line HL60, Anal. Cell Pathol, 19(3-4): Zakeri Z, Lockshin RA, Criado-Rodriguez LM, Martínez AC (2005) A generalized caspase inhibitor disrupts early mammalian development, Int. J. Dev. Biol, 49:
14
Cultivo de tejidos reproductivos y producción y manipulación de embriones bovinos
 Cultivo de tejidos reproductivos y producción y manipulación de embriones bovinos Libro de procedimientos Martha Olivera Angel Carlos Andrés Giraldo Echeverri Editores académicos Ciencias Animales Cultivo
Cultivo de tejidos reproductivos y producción y manipulación de embriones bovinos Libro de procedimientos Martha Olivera Angel Carlos Andrés Giraldo Echeverri Editores académicos Ciencias Animales Cultivo
PROTOCOLO DE UTILIZACIÓN Hibridación para cortes de tejidos preservados en parafina
 PROTOCOLO DE UTILIZACIÓN Hibridación para cortes de tejidos preservados en parafina Materiales Provistos: ADN marcado con moléculas fluorescentes (sonda). Buffer de Hibridación Reactivos para preparar
PROTOCOLO DE UTILIZACIÓN Hibridación para cortes de tejidos preservados en parafina Materiales Provistos: ADN marcado con moléculas fluorescentes (sonda). Buffer de Hibridación Reactivos para preparar
6. Fundamentos de la microscopía confocal espectral
 6. Fundamentos de la microscopía confocal espectral Microscopio confocal Microscopio confocal La distinción fundamental entre la microscopía óptica convencional y la microscopía óptica confocal es la manera
6. Fundamentos de la microscopía confocal espectral Microscopio confocal Microscopio confocal La distinción fundamental entre la microscopía óptica convencional y la microscopía óptica confocal es la manera
Capítulo 8. Procedimientos para la criopreservación de células reproductivas y embriones bovinos
 Capítulo 8 Procedimientos para la criopreservación de células reproductivas y embriones bovinos Autores: Natalia Andrea Gómez Morales, Juliana Victoria Bedoya Jaramillo, Felipe Penagos Tabares, Ángela
Capítulo 8 Procedimientos para la criopreservación de células reproductivas y embriones bovinos Autores: Natalia Andrea Gómez Morales, Juliana Victoria Bedoya Jaramillo, Felipe Penagos Tabares, Ángela
Anexo 1: Enfermedades monogénicas diagnosticadas hasta la fecha, en España, mediante DGP (Fuente: datos propios del grupo de interés en DGP de
 Anexo 1: Enfermedades monogénicas diagnosticadas hasta la fecha, en España, mediante DGP (Fuente: datos propios del grupo de interés en DGP de ASEBIR). 1 2 3 4 Anexo2: Ejemplo de protocolo para translocaciones
Anexo 1: Enfermedades monogénicas diagnosticadas hasta la fecha, en España, mediante DGP (Fuente: datos propios del grupo de interés en DGP de ASEBIR). 1 2 3 4 Anexo2: Ejemplo de protocolo para translocaciones
Capítulo 2. Medios y reactivos para cultivo y evaluación celular de tejidos reproductivos y embriones in vitro
 Capítulo 2 Medios y reactivos para cultivo y evaluación celular de tejidos reproductivos y embriones in vitro Autores: Natalia Andrea Gómez Morales, Ángela Patricia López Cardona, Luisa Fernanda Ortiz
Capítulo 2 Medios y reactivos para cultivo y evaluación celular de tejidos reproductivos y embriones in vitro Autores: Natalia Andrea Gómez Morales, Ángela Patricia López Cardona, Luisa Fernanda Ortiz
Capítulo 6. Procedimientos para el sexaje de embriones bovinos por PCR
 Capítulo 6 Procedimientos para el sexaje de embriones bovinos por PCR Autores: Luisa Fernanda Ortiz Román y Diana Maritza Echeverry Berrío En los casos en los que no se puede realizar fertilización con
Capítulo 6 Procedimientos para el sexaje de embriones bovinos por PCR Autores: Luisa Fernanda Ortiz Román y Diana Maritza Echeverry Berrío En los casos en los que no se puede realizar fertilización con
PREPARACIONES Y TINCIONES
 PREPARACIONES Y TINCIONES PREPARACIONES En fresco Temporales: Microcultivos de hongos, preparaciones de tejidos Fijas: Gram, Ziehl Nielsen, Sheaffer y fulton, SEM, TEM, naranja de acridina. CONTRASTE DE
PREPARACIONES Y TINCIONES PREPARACIONES En fresco Temporales: Microcultivos de hongos, preparaciones de tejidos Fijas: Gram, Ziehl Nielsen, Sheaffer y fulton, SEM, TEM, naranja de acridina. CONTRASTE DE
ANALISIS CITOMETRICO DEL CONTENIDO EN DNA EN SANGRE Y MEDULA OSEA
 ANALISIS CITOMETRICO DEL CONTENIDO EN DNA EN SANGRE Y MEDULA OSEA Sistema DNA-Prep (Beckman-Coulter) DNA-Prep LPR: Reactivo de lisis de los eritrocitos y permeabilización de membranas celulares DNA-Prep
ANALISIS CITOMETRICO DEL CONTENIDO EN DNA EN SANGRE Y MEDULA OSEA Sistema DNA-Prep (Beckman-Coulter) DNA-Prep LPR: Reactivo de lisis de los eritrocitos y permeabilización de membranas celulares DNA-Prep
PROTOCOLO DE UTILIZACIÓN. DNA específico marcado con fluorocromo
 PROTOCOLO DE UTILIZACIÓN DNA específico marcado con fluorocromo Producto: 1. Sonda de DNA específico marcado con fluorocromo. 2. Buffer de Hibridación 3. Reactivos para preparar Solución de Montaje (DAPI
PROTOCOLO DE UTILIZACIÓN DNA específico marcado con fluorocromo Producto: 1. Sonda de DNA específico marcado con fluorocromo. 2. Buffer de Hibridación 3. Reactivos para preparar Solución de Montaje (DAPI
Crioprotectores. Dimetilsulfóxido (DMSO)
 Crioprotectores Dimetilsulfóxido (DMSO) Crioprotectores coligativos previenen la deshidratación y disminuyendo la cantidad de agua absorbida por los cristales de hielo. El DMSO es ligeramente tóxico. Atraviesa
Crioprotectores Dimetilsulfóxido (DMSO) Crioprotectores coligativos previenen la deshidratación y disminuyendo la cantidad de agua absorbida por los cristales de hielo. El DMSO es ligeramente tóxico. Atraviesa
DAÑO O INDUCIDO POR LA RADIACIÓN ULTRAVIOLETA EN LOS TEJIDOS OCULARES: VALORACIÓN N IN VITRO
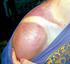 DAÑO O INDUCIDO POR LA RADIACIÓN ULTRAVIOLETA EN LOS TEJIDOS OCULARES: VALORACIÓN N IN VITRO Margarita Ronquillo Eva Romero, Carolina Lema, Isabel Jiménez 1 FOTOTOXICIDAD OCULAR Fotoqueratitis Pinguécula
DAÑO O INDUCIDO POR LA RADIACIÓN ULTRAVIOLETA EN LOS TEJIDOS OCULARES: VALORACIÓN N IN VITRO Margarita Ronquillo Eva Romero, Carolina Lema, Isabel Jiménez 1 FOTOTOXICIDAD OCULAR Fotoqueratitis Pinguécula
Inmunofluorescencia en investigación biomédica básica
 Inmunofluorescencia en investigación biomédica básica { Dra. Cecilia L. Basiglio Instituto de Fisiología Experimental (IFISE-CONICET) Area Bioquímica Clínica Facultad de Ciencias Bioquímicas y Farmacéuticas
Inmunofluorescencia en investigación biomédica básica { Dra. Cecilia L. Basiglio Instituto de Fisiología Experimental (IFISE-CONICET) Area Bioquímica Clínica Facultad de Ciencias Bioquímicas y Farmacéuticas
MANUAL DE OPERACIONES. DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 15 SUBDIRECCIÓN DE INVESTIGACIÓN BIOMÉDICA MANUAL DE TINCIONES
 A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
Preparación de muestras para microscopía confocal
 Preparación de muestras para microscopía confocal Andrés Esteban Cantos y Covadonga Alonso Martí Laboratorio de Interacción virus-célula Departamento de Biotecnología del INIA Preparación de muestras La
Preparación de muestras para microscopía confocal Andrés Esteban Cantos y Covadonga Alonso Martí Laboratorio de Interacción virus-célula Departamento de Biotecnología del INIA Preparación de muestras La
PROTOCOLO DE UTILIZACIÓN. DNA específico marcado con fluorocromo
 PROTOCOLO DE UTILIZACIÓN DNA específico marcado con fluorocromo Producto: 1. Sonda de DNA específico marcado con fluorocromo. 2. Buffer de Hibridación 3. Reactivos para preparar Solución de Montaje (DAPI
PROTOCOLO DE UTILIZACIÓN DNA específico marcado con fluorocromo Producto: 1. Sonda de DNA específico marcado con fluorocromo. 2. Buffer de Hibridación 3. Reactivos para preparar Solución de Montaje (DAPI
EVALUACIÓN DE LA ACTIVIDAD ANTIPROLIFERATIVA DE COMPUESTOS DE COORDINACIÓN COMO CERNIMIENTO DE ACTIVIDAD ANTINEOPLÁSICA.
 EVALUACIÓN DE LA ACTIVIDAD ANTIPROLIFERATIVA DE COMPUESTOS DE COORDINACIÓN COMO CERNIMIENTO DE ACTIVIDAD ANTINEOPLÁSICA. OBJETIVO ACADÉMICO Que el alumno emplee el ensayo de inhibición de la proliferación
EVALUACIÓN DE LA ACTIVIDAD ANTIPROLIFERATIVA DE COMPUESTOS DE COORDINACIÓN COMO CERNIMIENTO DE ACTIVIDAD ANTINEOPLÁSICA. OBJETIVO ACADÉMICO Que el alumno emplee el ensayo de inhibición de la proliferación
PROTOCOLO DE UTILIZACIÓN. DNA específico marcado con fluorocromo
 PROTOCOLO DE UTILIZACIÓN DNA específico marcado con fluorocromo Producto: 1. Sonda de DNA específico marcado con fluorocromo. 2. Buffer de Hibridación 3. Reactivos para preparar Solución de Montaje (DAPI
PROTOCOLO DE UTILIZACIÓN DNA específico marcado con fluorocromo Producto: 1. Sonda de DNA específico marcado con fluorocromo. 2. Buffer de Hibridación 3. Reactivos para preparar Solución de Montaje (DAPI
ANEXOS. Anexo 1. Solución Reguladora de Acetato 0.1 M, ph 4.0 y metanol al 2% (v/v).
 ANEXOS Anexo 1 Solución Reguladora de Acetato 0.1 M, ph 4.0 y metanol al 2% (v/v). 1. Tomar 6.011mL de ácido acético y aforar a 1L de agua HPLC. 2. Pesar 13.609 g de acetato de sodio y aforar a 1L de agua
ANEXOS Anexo 1 Solución Reguladora de Acetato 0.1 M, ph 4.0 y metanol al 2% (v/v). 1. Tomar 6.011mL de ácido acético y aforar a 1L de agua HPLC. 2. Pesar 13.609 g de acetato de sodio y aforar a 1L de agua
TÓPICO ESPECIAL EN INMUNOLOGÍA: TÉCNICAS PARA INDUCIR Y CUANTIFICAR LA APOPTOSIS EN CÉLULAS DEL SISTEMA INMUNE
 TÓPICO ESPECIAL EN INMUNOLOGÍA: TÉCNICAS PARA INDUCIR Y CUANTIFICAR LA APOPTOSIS EN CÉLULAS DEL SISTEMA INMUNE RESPONSABLES: SIHAM SALMEN LÉRIDA BORGES LISBETH BERRUETA (COORDINADORA) DEFINICIÓN Se trata
TÓPICO ESPECIAL EN INMUNOLOGÍA: TÉCNICAS PARA INDUCIR Y CUANTIFICAR LA APOPTOSIS EN CÉLULAS DEL SISTEMA INMUNE RESPONSABLES: SIHAM SALMEN LÉRIDA BORGES LISBETH BERRUETA (COORDINADORA) DEFINICIÓN Se trata
Alteración de la Viabilidad Celular en Células HeLa Inducida por DPS
 Alteración de la Viabilidad Celular en Células HeLa Inducida por DPS Martínez Vilchis Claudia Paulina 1, Campos Rodríguez Rafael 1, Escartin Gutiérrez Julio Rodrigo 1, Argüello García Raúl 2, Enríquez
Alteración de la Viabilidad Celular en Células HeLa Inducida por DPS Martínez Vilchis Claudia Paulina 1, Campos Rodríguez Rafael 1, Escartin Gutiérrez Julio Rodrigo 1, Argüello García Raúl 2, Enríquez
Conferencia TÉCNICAS CITOGENÉTICAS Parte 2 de 5
 Conferencia TÉCNICAS CITOGENÉTICAS Parte 2 de 5 Dra. María Teresa Lemus Valdés Especialista de 2do Grado Genética Clínica. Profesora e Investigadora Auxiliar Los cromosomas pueden estudiarse en diferentes
Conferencia TÉCNICAS CITOGENÉTICAS Parte 2 de 5 Dra. María Teresa Lemus Valdés Especialista de 2do Grado Genética Clínica. Profesora e Investigadora Auxiliar Los cromosomas pueden estudiarse en diferentes
51 Int. CI.: A61K 31/337 ( ) A61K 31/30 ( ) A61K 31/122 ( ) A61P 35/00 ( ) 73 Titular/es: 72 Inventor/es:
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 21 Número de publicación: 2 36 117 Número de solicitud: 20133133 1 Int. CI.: A61K 31/337 (2006.01) A61K 31/30 (2006.01) A61K 31/122 (2006.01) A61P 3/00
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 21 Número de publicación: 2 36 117 Número de solicitud: 20133133 1 Int. CI.: A61K 31/337 (2006.01) A61K 31/30 (2006.01) A61K 31/122 (2006.01) A61P 3/00
Biología Celular e Histología. Prácticas de Biología Celular. Cultivos celulares y Procesamiento de tejidos.
 Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
TEMA 9 MÉTODOS ÓPTICOS PARA EL DIAGNÓSTICO DE LABORATORIO DE ENFERMEDADES INFECCIOSAS
 TEMA 9 MÉTODOS ÓPTICOS PARA EL DIAGNÓSTICO DE LABORATORIO DE ENFERMEDADES INFECCIOSAS INDICE DE CONTENIDOS Introducción Tipos de microscopía óptica Microscopía de campo claro Microscopía de campo oscuro
TEMA 9 MÉTODOS ÓPTICOS PARA EL DIAGNÓSTICO DE LABORATORIO DE ENFERMEDADES INFECCIOSAS INDICE DE CONTENIDOS Introducción Tipos de microscopía óptica Microscopía de campo claro Microscopía de campo oscuro
TÓPICO ESPECIAL EN INMUNOLOGÍA: TÉCNICAS PARA INDUCIR Y CUANTIFICAR LA APOPTOSIS EN CÉLULAS DEL SISTEMA INMUNE
 TÓPICO ESPECIAL EN INMUNOLOGÍA: TÉCNICAS PARA INDUCIR Y CUANTIFICAR LA APOPTOSIS EN CÉLULAS DEL SISTEMA INMUNE RESPONSABLES: SIHAM SALMEN LÉRIDA BORGES LISBETH BERRUETA (COORDINADORA) DEFINICIÓN Se trata
TÓPICO ESPECIAL EN INMUNOLOGÍA: TÉCNICAS PARA INDUCIR Y CUANTIFICAR LA APOPTOSIS EN CÉLULAS DEL SISTEMA INMUNE RESPONSABLES: SIHAM SALMEN LÉRIDA BORGES LISBETH BERRUETA (COORDINADORA) DEFINICIÓN Se trata
EVALUACIÓN DE LA ENZIMA LACTATO DESHIDROGENASA (LDH) COMO BIOMARCADOR DE CITOTOXICIDAD EN CÉLULAS TUMORALES.
 EVALUACIÓN DE LA ENZIMA LACTATO DESHIDROGENASA (LDH) COMO BIOMARCADOR DE CITOTOXICIDAD EN CÉLULAS TUMORALES. OBJETIVOS ACADÉMICOS Que el alumno emplee una reacción colorida en microescala para la detección
EVALUACIÓN DE LA ENZIMA LACTATO DESHIDROGENASA (LDH) COMO BIOMARCADOR DE CITOTOXICIDAD EN CÉLULAS TUMORALES. OBJETIVOS ACADÉMICOS Que el alumno emplee una reacción colorida en microescala para la detección
Capítulo 4. Procedimientos para la evaluación de semen utilizado en la producción de embriones bovinos
 Capítulo 4 Procedimientos para la evaluación de semen utilizado en la producción de embriones bovinos Autores: Ariel Marcel Tarazona Morales, David Andrey Cadavid Betancur, Martha Olivera Angel y Ángela
Capítulo 4 Procedimientos para la evaluación de semen utilizado en la producción de embriones bovinos Autores: Ariel Marcel Tarazona Morales, David Andrey Cadavid Betancur, Martha Olivera Angel y Ángela
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
VALORACIÓN SEMINAL. CITÓMETRO DE FLUJO
 . CITÓMETRO DE FLUJO 1 VALORACIÓN DE LA VIABILIDAD ESPERMÁTICA MEDIANTE LA TÉCNICA DE CITOMETRÍA DE FLUJO En las últimas dos décadas, la citometría de flujo se ha convertido en una técnica importante gran
. CITÓMETRO DE FLUJO 1 VALORACIÓN DE LA VIABILIDAD ESPERMÁTICA MEDIANTE LA TÉCNICA DE CITOMETRÍA DE FLUJO En las últimas dos décadas, la citometría de flujo se ha convertido en una técnica importante gran
Alteración de la Viabilidad Celular en Células HeLa Inducida por DAS
 Alteración de la Viabilidad Celular en Células HeLa Inducida por DAS Martínez Vilchis Claudia Paulina 1, Campos Rodríguez Rafael 1, Escartin Gutiérrez Julio Rodrigo 1, Argüello García Raúl 2, Enríquez
Alteración de la Viabilidad Celular en Células HeLa Inducida por DAS Martínez Vilchis Claudia Paulina 1, Campos Rodríguez Rafael 1, Escartin Gutiérrez Julio Rodrigo 1, Argüello García Raúl 2, Enríquez
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL
 UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
DETERMINACIÓN CUALITATIVA Y CUANTITATIVA DE DAÑOS EN EL ADN MEDIANTE CITOMETRÍA DE FLUJO Y MICROSCOPÍA CONFOCAL
 DETERMINACIÓN CUALITATIVA Y CUANTITATIVA DE DAÑOS EN EL ADN MEDIANTE CITOMETRÍA DE FLUJO Y MICROSCOPÍA CONFOCAL Unidad Científico-Técnica: Laboratorios de Investigación Área de Citometría de Flujo, Microscopía
DETERMINACIÓN CUALITATIVA Y CUANTITATIVA DE DAÑOS EN EL ADN MEDIANTE CITOMETRÍA DE FLUJO Y MICROSCOPÍA CONFOCAL Unidad Científico-Técnica: Laboratorios de Investigación Área de Citometría de Flujo, Microscopía
ORGANOS, CELULAS y ATOMOS
 ORGANOS, CELULAS y ATOMOS TAMAÑO DE CÉLULAS, SUS COMPONENTES Y PODER DE RESOLUCIÓN DE LOS MICROSCOPIOS Principios del MICROSCOPIO OPTICO SISTEMA OPTICO DE UN MICROSCOPIO DE FLUORESCENCIA COLORANTES FLUORESCENTES
ORGANOS, CELULAS y ATOMOS TAMAÑO DE CÉLULAS, SUS COMPONENTES Y PODER DE RESOLUCIÓN DE LOS MICROSCOPIOS Principios del MICROSCOPIO OPTICO SISTEMA OPTICO DE UN MICROSCOPIO DE FLUORESCENCIA COLORANTES FLUORESCENTES
Citología General ThinPrep. Preparación de Muestras No Ginecológicas
 Citología General ThinPrep Preparación de Muestras No Ginecológicas Beneficios de la Tecnología ThinPrep El uso de Citología General ThinPrep para muestras No-ginecológicas: Optimiza la preservación celular.
Citología General ThinPrep Preparación de Muestras No Ginecológicas Beneficios de la Tecnología ThinPrep El uso de Citología General ThinPrep para muestras No-ginecológicas: Optimiza la preservación celular.
ANEXOS. Anexo 1. Preparación del Cultivo de G. lamblia
 ANEXOS Anexo 1. Preparación del Cultivo de G. lamblia Material Incubadora a 37 C Tubos de ensayo 13 x 100 con tapón de rosca estériles Pipetas serológicas estériles de 10, 5 y 1 ml Pipetor (Drummond Broomal,
ANEXOS Anexo 1. Preparación del Cultivo de G. lamblia Material Incubadora a 37 C Tubos de ensayo 13 x 100 con tapón de rosca estériles Pipetas serológicas estériles de 10, 5 y 1 ml Pipetor (Drummond Broomal,
ZytoLight SPEC RET Dual Color Break Apart Probe
 ZytoLight SPEC RET Dual Color Break Apart Probe Z-2148-200 Z-2148-50 20 (0,2 ml) 5 (0,05 ml) Para la detección de translocaciones que involucran al gen RET en 10q11.21 mediante hibridación in situ con
ZytoLight SPEC RET Dual Color Break Apart Probe Z-2148-200 Z-2148-50 20 (0,2 ml) 5 (0,05 ml) Para la detección de translocaciones que involucran al gen RET en 10q11.21 mediante hibridación in situ con
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
y
 juan.roman@salud.gob.mx octavio.rivera@salud.gob.mx y o o o o 2007-2011 64.27% CAMPECHE CHIAPAS JALISCO 0.15% OAXACA PUEBLA QUINTANA ROO 16.28% SINALOA TABASCO 7.95% 6.60% 4.01% VERACRUZ YUCATÁN
juan.roman@salud.gob.mx octavio.rivera@salud.gob.mx y o o o o 2007-2011 64.27% CAMPECHE CHIAPAS JALISCO 0.15% OAXACA PUEBLA QUINTANA ROO 16.28% SINALOA TABASCO 7.95% 6.60% 4.01% VERACRUZ YUCATÁN
INSTRUCTIVO PARA EL DIAGNÓSTICO DE PLUM POX VIRUS MEDIANTE ELISA
 DEPARTAMENTO LABORATORIO Y ESTACIONES CUARENTENARIAS AGRÍCOLA Y PECUARIA INSTRUCTIVO PARA EL DIAGNÓSTICO DE PLUM POX VIRUS MEDIANTE ELISA Preparación Nombre Cargo Firma Marcelo Encargado Laboratorio Cabrera
DEPARTAMENTO LABORATORIO Y ESTACIONES CUARENTENARIAS AGRÍCOLA Y PECUARIA INSTRUCTIVO PARA EL DIAGNÓSTICO DE PLUM POX VIRUS MEDIANTE ELISA Preparación Nombre Cargo Firma Marcelo Encargado Laboratorio Cabrera
DANAGENE SPIN GENOMIC DNA KIT
 DANAGENE SPIN GENOMIC DNA KIT Ref.0605.1 50 extracciones Ref.0605.2 250 extracciones Ref.0605.3 1000 extracciones 1. INTRODUCCION Este kit está designado para una rápida extracción y purificación de ADN
DANAGENE SPIN GENOMIC DNA KIT Ref.0605.1 50 extracciones Ref.0605.2 250 extracciones Ref.0605.3 1000 extracciones 1. INTRODUCCION Este kit está designado para una rápida extracción y purificación de ADN
DANAGENE microspin DNA KIT
 Ref. 0607.1 50 extracciones Ref. 0607.2 250 extracciones 1.INTRODUCCION DANAGENE microspin DNA KIT Este kit permite una eficiente extracción de ADN genómico y mitocondrial a partir de muestras de pequeño
Ref. 0607.1 50 extracciones Ref. 0607.2 250 extracciones 1.INTRODUCCION DANAGENE microspin DNA KIT Este kit permite una eficiente extracción de ADN genómico y mitocondrial a partir de muestras de pequeño
1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS
 1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS Existen diferentes métodos para la obtención de ADN bacteriano que varían en duración y complejidad del procedimiento en función de la calidad del ADN que queramos
1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS Existen diferentes métodos para la obtención de ADN bacteriano que varían en duración y complejidad del procedimiento en función de la calidad del ADN que queramos
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar
 4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
DANAGENE SPIN BLOOD DNA KIT
 DANAGENE SPIN BLOOD DNA KIT Ref. 0606.1 50 extracciones Ref. 0606.2 250 extracciones 1. INTRODUCCION Este kit está designado para una rápida extracción y purificación de ADN genómico de alta calidad a
DANAGENE SPIN BLOOD DNA KIT Ref. 0606.1 50 extracciones Ref. 0606.2 250 extracciones 1. INTRODUCCION Este kit está designado para una rápida extracción y purificación de ADN genómico de alta calidad a
PRÁCTICA 5 FASES DE LA MITOSIS. ESTIMACIÓN DE LOS ÍNDICES MITÓTICO Y DE FASE
 PRÁCTICA 5 FASES DE LA MITOSIS. ESTIMACIÓN DE LOS ÍNDICES MITÓTICO Y DE FASE INTRODUCCIÓN La mitosis es la división nuclear asociada a las células somáticas (las células de un organismo eucariótico que
PRÁCTICA 5 FASES DE LA MITOSIS. ESTIMACIÓN DE LOS ÍNDICES MITÓTICO Y DE FASE INTRODUCCIÓN La mitosis es la división nuclear asociada a las células somáticas (las células de un organismo eucariótico que
Microscopio y observación de células
 I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
MANUAL TÉCNICO. Biología reproductiva y Citogenética de la papa. M. Orrillo * M. Bonierbale
 MANUAL TÉCNICO Biología reproductiva y Citogenética de la papa M. Orrillo * M. Bonierbale Evaluación de la Ploidía en Solanum spp. CIP- Laboratorio de Citogenética CONTEO DE CROMOSOMAS Colección de raíces
MANUAL TÉCNICO Biología reproductiva y Citogenética de la papa M. Orrillo * M. Bonierbale Evaluación de la Ploidía en Solanum spp. CIP- Laboratorio de Citogenética CONTEO DE CROMOSOMAS Colección de raíces
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON
 PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
A. Anexo: Extracción de dsrna por columnas de exclusión de Sephadex G-50
 A. Anexo: Extracción de dsrna por columnas de exclusión de Sephadex G-50 (Tomado de Guzmán, 1994; Rodríguez, 2006) 1. En un tubo eppendorf tapa rosca estéril colocar 100 mg de material vegetal pulverizado
A. Anexo: Extracción de dsrna por columnas de exclusión de Sephadex G-50 (Tomado de Guzmán, 1994; Rodríguez, 2006) 1. En un tubo eppendorf tapa rosca estéril colocar 100 mg de material vegetal pulverizado
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR. PRACTICA No. 3 TINCIONES
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR PRACTICA No. 3 TINCIONES Alumnos(as): Karla Ayde Sánchez Guillen Erika Vanessa Molina Murillo Yatzeny Gpe.
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR PRACTICA No. 3 TINCIONES Alumnos(as): Karla Ayde Sánchez Guillen Erika Vanessa Molina Murillo Yatzeny Gpe.
La materia se ordena en los llamados niveles de organización biológica
 La materia se ordena en los llamados niveles de organización biológica. Diversos niveles de complejidad en donde las leyes o reglas que se cumplen en un nivel pueden no manifestarse en otros. Estudio de
La materia se ordena en los llamados niveles de organización biológica. Diversos niveles de complejidad en donde las leyes o reglas que se cumplen en un nivel pueden no manifestarse en otros. Estudio de
Profesora: Ana María Gallardo Suárez. Microscopio Óptico MITOSIS CÉLULAS VEGETALES PRACTICA Nº 6 CURSO: 3 ESO. Recursos ana.fjb.es
 Microscopio Óptico MITOSIS CÉLULAS VEGETALES PRACTICA Nº 6 CURSO: 3 ESO Recursos ana.fjb.es Introducción En esta práctica número 6 vamos a realizar la observación de la mitosis en células vegetales. Para
Microscopio Óptico MITOSIS CÉLULAS VEGETALES PRACTICA Nº 6 CURSO: 3 ESO Recursos ana.fjb.es Introducción En esta práctica número 6 vamos a realizar la observación de la mitosis en células vegetales. Para
6. RESULTADOS Y DISCUSIÓN. 6.1 Condiciones óptimas para preparar membranas por electrohilado
 6. RESULTADOS Y DISCUSIÓN 6.1 Condiciones óptimas para preparar membranas por electrohilado Para las membranas de colágeno, la mejor concentración de la solución polimérica encontrada fue de 5 % peso en
6. RESULTADOS Y DISCUSIÓN 6.1 Condiciones óptimas para preparar membranas por electrohilado Para las membranas de colágeno, la mejor concentración de la solución polimérica encontrada fue de 5 % peso en
GUIA DE LABORATORIO DE BIOLOGIA CELULAR Y MOLECULAR MEDICINA VETERINARIA Y ZOOTECNIA UNIVERSIDAD TECNOLOGICA DE PEREIRA
 GUIA DE LABORATORIO DE BIOLOGIA CELULAR Y MOLECULAR MEDICINA VETERINARIA Y ZOOTECNIA UNIVERSIDAD TECNOLOGICA DE PEREIRA NORMAS GENERALES PARA EL TRABAJO EN EL LABORATORIO 1. Usar bata de laboratorio 2.
GUIA DE LABORATORIO DE BIOLOGIA CELULAR Y MOLECULAR MEDICINA VETERINARIA Y ZOOTECNIA UNIVERSIDAD TECNOLOGICA DE PEREIRA NORMAS GENERALES PARA EL TRABAJO EN EL LABORATORIO 1. Usar bata de laboratorio 2.
3. Cubre la muestra con un cubreobjetos. El cubreobjeto debe estar plano.
 Laboratorio. Células de corcho y de cebolla PSI Biología Nombre Uno de los primeros científicos en observar las células bajo un microscopio fue un científico Inglés con el nombre de Robert Hooke. Él vio
Laboratorio. Células de corcho y de cebolla PSI Biología Nombre Uno de los primeros científicos en observar las células bajo un microscopio fue un científico Inglés con el nombre de Robert Hooke. Él vio
Manual de Laboratorio de Reproducción Animal. Edwin Mellisho y Amalia Gallegos
 Manual de Laboratorio de Reproducción Animal Edwin Mellisho y Amalia Gallegos Lima, Perú 2006 PRÁCTICA 06 Recuperación, evaluación, clasificación y manipulación de embriones Objetivos. o Adiestrar en la
Manual de Laboratorio de Reproducción Animal Edwin Mellisho y Amalia Gallegos Lima, Perú 2006 PRÁCTICA 06 Recuperación, evaluación, clasificación y manipulación de embriones Objetivos. o Adiestrar en la
ADN PuriPrep-T kit K Extracción y purificación rápida de ADN a partir de tejidos sólidos:
 K 1208 ADN PuriPrep-T kit Extracción y purificación rápida de ADN a partir de tejidos sólidos: Hueso disgregado, Bulbo capilar Cola de ratón, Tejidos fijados Biopsias, Hígado, Bazo Indice Presentación...
K 1208 ADN PuriPrep-T kit Extracción y purificación rápida de ADN a partir de tejidos sólidos: Hueso disgregado, Bulbo capilar Cola de ratón, Tejidos fijados Biopsias, Hígado, Bazo Indice Presentación...
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
CURSO INTERNACIONAL INMUNIDAD INNATA EN SALUD Y ENFERMEDADES INFECCIOSAS
 CURSO INTERNACIONAL INMUNIDAD INNATA EN SALUD Y ENFERMEDADES INFECCIOSAS 29 de agosto - 9 de septiembre de 2016 Comité Organizador: Eva María Salinas Miralles (Universidad Autónoma de Aguascalientes) y
CURSO INTERNACIONAL INMUNIDAD INNATA EN SALUD Y ENFERMEDADES INFECCIOSAS 29 de agosto - 9 de septiembre de 2016 Comité Organizador: Eva María Salinas Miralles (Universidad Autónoma de Aguascalientes) y
TÉCNICA DEL FISH. Mª Dolores Durán HGU de Alicante
 TÉCNICA DEL FISH Mª Dolores Durán HGU de Alicante HIS : hibridación in situ Capacidad que poseen los ácidos nucléicos para hibridarse entre sí. Permite detectar secuencias específicas de ácidos nucléicos
TÉCNICA DEL FISH Mª Dolores Durán HGU de Alicante HIS : hibridación in situ Capacidad que poseen los ácidos nucléicos para hibridarse entre sí. Permite detectar secuencias específicas de ácidos nucléicos
Atlas Digital del Departamento de Biología Celular y Tisular de la Facultad de Medicina
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO Atlas Digital del Departamento de Biología Celular y Tisular de la Facultad de Medicina El primer paso de toda técnica histológica es la obtención de la muestra.
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO Atlas Digital del Departamento de Biología Celular y Tisular de la Facultad de Medicina El primer paso de toda técnica histológica es la obtención de la muestra.
Trabajo Práctico: Análisis de poblaciones celulares por citometría de flujo.
 Trabajo Práctico: Análisis de poblaciones celulares por citometría de flujo. Objetivo: OBJETIVO: Identificación y enumeración de la subpoblación de linfocitos T (CD3 + ), células NK (CD3 - CD16 + CD56
Trabajo Práctico: Análisis de poblaciones celulares por citometría de flujo. Objetivo: OBJETIVO: Identificación y enumeración de la subpoblación de linfocitos T (CD3 + ), células NK (CD3 - CD16 + CD56
Material y Reactivos de Laboratorio. Marcas que manejamos:
 Marcas que manejamos: Portaobjetos y Cubreobjetos Caja de Petri Sencilla, Doble y Triple Dispensador de Laminillas Jarra de Coplin Cajas para portaobjetos Pipeta Pasteur 150mm 5.75" y 229mm 9" Puntas para
Marcas que manejamos: Portaobjetos y Cubreobjetos Caja de Petri Sencilla, Doble y Triple Dispensador de Laminillas Jarra de Coplin Cajas para portaobjetos Pipeta Pasteur 150mm 5.75" y 229mm 9" Puntas para
Descripción del equipo
 La microscopía láser confocal es una nueva técnica de observación microscópica con la cual se logran excelentes resultados en diversas ramas de la ciencia (medicina, biología, materiales, geología, etc.).
La microscopía láser confocal es una nueva técnica de observación microscópica con la cual se logran excelentes resultados en diversas ramas de la ciencia (medicina, biología, materiales, geología, etc.).
EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO
 COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de agosto y hasta el 30
COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de agosto y hasta el 30
Biología Celular e Histología. Prácticas de Biología Celular. Cultivos celulares y Procesamiento de tejidos.
 Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
Biología Celular e Histología Prácticas de Biología Celular Cultivos celulares y Procesamiento de tejidos. Suspensiones celulares. Inmunodetección directa. Identificación celular tras cultivo. Manejo del
Tema I Introducción al estudio de los agentes biológicos de importancia médica.
 Tema I Introducción al estudio de los agentes biológicos de importancia médica. - Características de las células procarióticas y eucarióticas. - Microscopía y coloraciones. 2da Parte Esporas Se forma bajo
Tema I Introducción al estudio de los agentes biológicos de importancia médica. - Características de las células procarióticas y eucarióticas. - Microscopía y coloraciones. 2da Parte Esporas Se forma bajo
0.5. Absorbancia
 GUIA DE PROBLEMAS DE FLUORESCENCIA: 1. Se registraron espectros de emisión de fluorescencia a 2 longitudes de onda de excitación diferentes de una mezcla equimolar de 2 compuestos obteniéndose los resultados
GUIA DE PROBLEMAS DE FLUORESCENCIA: 1. Se registraron espectros de emisión de fluorescencia a 2 longitudes de onda de excitación diferentes de una mezcla equimolar de 2 compuestos obteniéndose los resultados
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987)
 EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
HISTOLOGÍA. Ciencia que estudia las células, tejidos y órganos, desde el punto de vista microscópico, relacionando la estructura con la función.
 HISTOLOGÍA HISTOLOGÍA Ciencia que estudia las células, tejidos y órganos, desde el punto de vista microscópico, relacionando la estructura con la función. MICROSCOPIOS TÉCNICAS HISTOLÓGICAS 1.Pie Microscopio
HISTOLOGÍA HISTOLOGÍA Ciencia que estudia las células, tejidos y órganos, desde el punto de vista microscópico, relacionando la estructura con la función. MICROSCOPIOS TÉCNICAS HISTOLÓGICAS 1.Pie Microscopio
DANAGENE microrna KIT
 DANAGENE microrna KIT Ref.0804 1.INTRODUCCION Este kit provee un método rápido y eficiente para la extracción y purificación de moléculas pequeñas de ARN (
DANAGENE microrna KIT Ref.0804 1.INTRODUCCION Este kit provee un método rápido y eficiente para la extracción y purificación de moléculas pequeñas de ARN (
FACTORES FÍSICOS Y QUÍMICOS QUE MODIFICAN LA VELOCIDAD DE LAS REACCIONES ENZIMÁTICAS
 FACTORES FÍSICOS Y QUÍMICOS QUE MODIFICAN LA VELOCIDAD DE LAS REACCIONES ENZIMÁTICAS I. INTRODUCCIÓN En general todas las enzimas, independiente del tipo de reacción que catalizan presentan características
FACTORES FÍSICOS Y QUÍMICOS QUE MODIFICAN LA VELOCIDAD DE LAS REACCIONES ENZIMÁTICAS I. INTRODUCCIÓN En general todas las enzimas, independiente del tipo de reacción que catalizan presentan características
V Olimpiada Española de Biología: Fase Nacional
 Código de Identificación 4 últimos dígitos- letra DNI V Olimpiada Española de Biología: Fase Nacional PRÁCTICA 2: OBSERVACIÓN DE INTERCAMBIOS HÍDRICOS. PLASMÓLISIS Y TURGENCIA La diferencia de potenciales
Código de Identificación 4 últimos dígitos- letra DNI V Olimpiada Española de Biología: Fase Nacional PRÁCTICA 2: OBSERVACIÓN DE INTERCAMBIOS HÍDRICOS. PLASMÓLISIS Y TURGENCIA La diferencia de potenciales
TEMA 14. Métodos inmunológicos para la identificación microbiana
 TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente.
 CROSS MATCH QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente. Pueden estar específicamente dirigidos contra los antígenos HLA o contra
CROSS MATCH QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente. Pueden estar específicamente dirigidos contra los antígenos HLA o contra
Técnicas de observación de microorganismos
 Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
Separación de distintos tipos celulares. Por gradiente de densidad. Por métodos inmunológicos. Por cultivo selectivo
 Separación de distintos tipos celulares. Por gradiente de densidad. Por métodos inmunológicos. Por cultivo selectivo Centrifugación Dos partículas en suspensión, con masas o densidades distintas, se sedimentarán
Separación de distintos tipos celulares. Por gradiente de densidad. Por métodos inmunológicos. Por cultivo selectivo Centrifugación Dos partículas en suspensión, con masas o densidades distintas, se sedimentarán
TRANSPORTE A TRAVÉS DE LA MEMBRANA PRÁCTICA UNIDAD TEMÁTICA 9
 TRANSPORTE A TRAVÉS DE LA MEMBRANA PRÁCTICA UNIDAD TEMÁTICA 9 PERMEABILIDAD DIFERENCIAL DE LA MEMBRANA I. INTRODUCCIÓN. Las membranas que rodean a las células y organelos, poseen permeabilidad diferencial,
TRANSPORTE A TRAVÉS DE LA MEMBRANA PRÁCTICA UNIDAD TEMÁTICA 9 PERMEABILIDAD DIFERENCIAL DE LA MEMBRANA I. INTRODUCCIÓN. Las membranas que rodean a las células y organelos, poseen permeabilidad diferencial,
Que es la fluorescencia?
 INMUNOFLUORESCENCIA Que es la fluorescencia?....es la propiedad de una sustancia de emitir luz cuando es expuesta a radiaciones de baja longitud de onda y alta energía a (UV Rx). Las radiaciones absorbidas
INMUNOFLUORESCENCIA Que es la fluorescencia?....es la propiedad de una sustancia de emitir luz cuando es expuesta a radiaciones de baja longitud de onda y alta energía a (UV Rx). Las radiaciones absorbidas
ZytoLight SPEC FGFR1/CEN 8 Dual Color Probe
 ZytoLight SPEC FGFR1/CEN 8 Dual Color Probe Z-2072-200 Z-2072-50 20 (0,2 ml) 5 (0,05 ml) Para la detección del gen humano FGFR1 y el satélite alfa del cromosoma 8 mediante hibridación in situ con fluorescencia
ZytoLight SPEC FGFR1/CEN 8 Dual Color Probe Z-2072-200 Z-2072-50 20 (0,2 ml) 5 (0,05 ml) Para la detección del gen humano FGFR1 y el satélite alfa del cromosoma 8 mediante hibridación in situ con fluorescencia
Dice Debe decir Justificación* BUTILPARABENO
 COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de mayo y hasta el 30 de
COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de mayo y hasta el 30 de
CONCEPTOS BÁSICOS DE MICROSCOPÍA. Patricia Pérez-Alzola, MSc
 CONCEPTOS BÁSICOS DE MICROSCOPÍA Patricia Pérez-Alzola, MSc TÉCNICAS DE MICROSCOPÍA 1611 Kepler microscopio compuesto 1655 Hooke (célula) 1674 Leeuwenkoek (protozoos) 1838 Schleiden y Schawn Teoría Celular
CONCEPTOS BÁSICOS DE MICROSCOPÍA Patricia Pérez-Alzola, MSc TÉCNICAS DE MICROSCOPÍA 1611 Kepler microscopio compuesto 1655 Hooke (célula) 1674 Leeuwenkoek (protozoos) 1838 Schleiden y Schawn Teoría Celular
- Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio microbiológico.
 Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
EJERCICIOS: PREGUNTAS
 ATLAS de H I STOLOGÍA VEGETAL y AN I M AL TÉCNICAS HISTOLÓGICAS EJERCICIOS: PREGUNTAS Manuel Megías, Pilar Molist, Manuel A. Pombal, Manuel Departamento de Biología Funcional y Ciencias de la Salud. Facultad
ATLAS de H I STOLOGÍA VEGETAL y AN I M AL TÉCNICAS HISTOLÓGICAS EJERCICIOS: PREGUNTAS Manuel Megías, Pilar Molist, Manuel A. Pombal, Manuel Departamento de Biología Funcional y Ciencias de la Salud. Facultad
Auto Lector 3M MR Attest MR 190
 INFORMACION TECNICA Especificaciones: Equipo dual de detección de fluorescencia e incubadora para indicadores biológicos de lectura rápida para vapor, con 14 posiciones y una posición de activación. La
INFORMACION TECNICA Especificaciones: Equipo dual de detección de fluorescencia e incubadora para indicadores biológicos de lectura rápida para vapor, con 14 posiciones y una posición de activación. La
RT- PCR diagnóstica del Cotton leafroll dwarf virus (CLRDV) en plantas de algodón
 RT- PCR diagnóstica del Cotton leafroll dwarf virus (CLRDV) en plantas de algodón La identificación rápida y precisa de los patógenos que afectan a los cultivos de interés agronómico es crítica para predecir
RT- PCR diagnóstica del Cotton leafroll dwarf virus (CLRDV) en plantas de algodón La identificación rápida y precisa de los patógenos que afectan a los cultivos de interés agronómico es crítica para predecir
OBSERVACION MORFOLOGICA DE APOPTOSIS POR MICROSCOPIA DE FLUORESCENCIA EN CELULAS FRESCAS
 OBSERVACION MORFOLOGICA DE APOPTOSIS POR MICROSCOPIA DE FLUORESCENCIA EN CELULAS FRESCAS Solución de tinción de cromatina (Hoechst 33348: 1 mg/ml en DMSO) Solución de contraste de células necróticas (yoduro
OBSERVACION MORFOLOGICA DE APOPTOSIS POR MICROSCOPIA DE FLUORESCENCIA EN CELULAS FRESCAS Solución de tinción de cromatina (Hoechst 33348: 1 mg/ml en DMSO) Solución de contraste de células necróticas (yoduro
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
CULTIVO DE TEJIDOS. TARIFAS Grupos de Investigación UMU
 CULTIVO DE TEJIDOS PRESTACIÓN TARIFAS Grupos de Investigación UMU PRECIOS PÚBLICOS Org. Públicos con convenio con UMU PRECIOS PÚBLICOS Organismos Públicos PRECIOS PÚBLICOS..Empresas Privadas Autoclavado
CULTIVO DE TEJIDOS PRESTACIÓN TARIFAS Grupos de Investigación UMU PRECIOS PÚBLICOS Org. Públicos con convenio con UMU PRECIOS PÚBLICOS Organismos Públicos PRECIOS PÚBLICOS..Empresas Privadas Autoclavado
OBSERVACION DE CROMOSOMAS y CELULAS EN MITOSIS EN MERISTEMOS TERMINALES DE RAICES DE ALIUM CEPA (L.)
 PRÁCTICA 10 OBSERVACION DE CROMOSOMAS y CELULAS EN MITOSIS EN MERISTEMOS TERMINALES DE RAICES DE ALIUM CEPA (L.) Materiales: Microscopio Portaobjetos y cubreobjetos Bisturí Vidrio de de reloj o pozillos
PRÁCTICA 10 OBSERVACION DE CROMOSOMAS y CELULAS EN MITOSIS EN MERISTEMOS TERMINALES DE RAICES DE ALIUM CEPA (L.) Materiales: Microscopio Portaobjetos y cubreobjetos Bisturí Vidrio de de reloj o pozillos
Biología Celular Laboratorio. Mitosis en raíz de cebolla
 INTRODUCCIÓN El ciclo celular tiene tres etapas principales, la interfase, la mitosis o división del núcleo en dos células hijas y la citocinesis o división del citoplasma. La mitosis o fase M tiene como
INTRODUCCIÓN El ciclo celular tiene tres etapas principales, la interfase, la mitosis o división del núcleo en dos células hijas y la citocinesis o división del citoplasma. La mitosis o fase M tiene como
Vidrafoc Life Science
 Estamos muy satisfechos de poder presentarle nuestra nueva línea de Vidrafoc Life Science Desde sus inicios, en 1968, con la fabricación de vidrio científi co y posteriormente con la distribución de material
Estamos muy satisfechos de poder presentarle nuestra nueva línea de Vidrafoc Life Science Desde sus inicios, en 1968, con la fabricación de vidrio científi co y posteriormente con la distribución de material
PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA.
 AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
CYP 2C9 A1075C CYP2C9*3
 CYP 2C9 A1075C Sistema para la detección de la mutación A1075C en el gene del citocromo P450 2C9. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy
CYP 2C9 A1075C Sistema para la detección de la mutación A1075C en el gene del citocromo P450 2C9. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy
CULTIVO DE TEJIDOS. TARIFAS Grupos de Investigación UMU
 CULTIVO DE TEJIDOS PRESTACIÓN TARIFAS Grupos de Investigación UMU PRECIOS PÚBLICOS Org. Públicos con convenio con UMU PRECIOS PÚBLICOS Organismos Públicos PRECIOS PÚBLICOS..Empresas Privadas Almacenamiento
CULTIVO DE TEJIDOS PRESTACIÓN TARIFAS Grupos de Investigación UMU PRECIOS PÚBLICOS Org. Públicos con convenio con UMU PRECIOS PÚBLICOS Organismos Públicos PRECIOS PÚBLICOS..Empresas Privadas Almacenamiento
Cuestionarios PREGUNTAS
 Atlas de Histología egetal y Animal TÉCNICAS HISTOLÓGICAS Cuestionarios PREGUNTAS Manuel Megías, Pilar Molist, Manuel A. Pombal Departamento de Biología uncional y Ciencias de la Salud. cacultad de Biología.
Atlas de Histología egetal y Animal TÉCNICAS HISTOLÓGICAS Cuestionarios PREGUNTAS Manuel Megías, Pilar Molist, Manuel A. Pombal Departamento de Biología uncional y Ciencias de la Salud. cacultad de Biología.
Análisis de semen computarizado. Características del producto. Sistema básico
 AndroVision - mas que un CASA Sistema CASA AndroVision con microscopio Zeiss AxioScope y mesa robotiza ScanStage Análisis de semen computarizado AndroVision es un Sistema CASA* de alta precisión para el
AndroVision - mas que un CASA Sistema CASA AndroVision con microscopio Zeiss AxioScope y mesa robotiza ScanStage Análisis de semen computarizado AndroVision es un Sistema CASA* de alta precisión para el
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO. OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico.
 GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
