Anexo II. Conclusiones científicas
|
|
|
- José Luis Valverde Bustos
- hace 5 años
- Vistas:
Transcripción
1 Anexo II Conclusiones científicas 62
2 Conclusiones científicas El 8 de marzo de 2017, Francia inició un procedimiento de conformidad con el artículo 31 de la Directiva 2001/83/CE y solicitó al PRAC que evaluara el impacto de las inquietudes suscitadas por la eficacia de las medidas de minimización de riesgos en la relación riesgo/beneficio de los medicamentos que contienen sustancias relacionadas con el valproato y que emitiera una recomendación sobre si debía mantenerse, modificarse, suspenderse o revocarse la autorización de comercialización de estos productos. El PRAC adoptó una recomendación el 8 de febrero de 2018 que, a continuación, fue estudiada por el CMDh, de conformidad con el artículo 107k de la Directiva 2001/83/CE. Resumen general de la evaluación científica del PRAC En el transcurso de las consultas que el PRAC realizó en este procedimiento han surgido otras inquietudes, aparte de los daños conocidos y documentados para el feto durante la exposición intrauterina. Se analizaron los posibles efectos del uso paterno de valproato, el posible efecto sobre la tercera generación de descendientes y los posibles efectos sobre las mitocondrias (toxicidad mitocondrial). Con respecto a la exposición a través del esperma, se calculó el área bajo la curva (AUC) del valproato en una mujer tras la exposición vaginal al valproato a través del semen de un varón tratado con valproato. Se obtuvo un valor más de veces menor que el AUC observado en una mujer tratada por vía oral con una dosis equivalente (dosis oral única de 500 mg). Puede concluirse que es extremadamente improbable que el valproato utilizado por un paciente varón pueda causar efectos adversos en el embrión/feto por esta vía. El PRAC solicitó la realización de un estudio observacional retrospectivo para caracterizar mejor este riesgo teórico. Las alteraciones genéticas pueden dividirse en mutaciones génicas y anomalías cromosómicas. Parece teóricamente posible que las mutaciones génicas presentes en los espermatozoides puedan transmitirse a los hijos. Sin embargo, las pruebas de detección de mutaciones génicas fueron negativas. Por consiguiente, no es probable que se produzca este tipo de transmisión con valproato. Por tanto, el PRAC recomienda realizar otras pruebas (p. ej., análisis in vitro del linfoma murino) para investigar mejor esta hipótesis. Se obtuvieron resultados positivos en varias pruebas de daños cromosómicos. Es de esperar que los daños cromosómicos graves provoquen la muerte de los espermatozoides o disminuyan la fertilidad, de modo que las mutaciones no se transmitirían a la descendencia. Se desconoce si los daños cromosómicos leves podrían transmitirse a la descendencia. El PRAC recomienda que se lleven a cabo más investigaciones. El mecanismo epigenético se refiere a la posibilidad de que las alteraciones de la expresión génica experimentadas por los gametos se transmitan a la expresión génica en el embrión (p. ej., a través de cambios en la metilación del ADN). En teoría, esto es posible si se producen alteraciones de la expresión génica en los espermatozoides de varones adultos o cambios en las células germinativas en desarrollo del embrión. En un experimento se demostró que la alteración de la expresión génica (de un gen) observada en ratones macho tras la exposición a un inhibidor de la histona desacetilasa (HDAC) (distinto del valproato) también se observó en la descendencia de estos ratones (Jia et al., 2015) 1, por 1 Jia H, Morris CD, Williams RM, Loring JF, Thomas EA. HDAC inhibition imparts beneficial transgenerational effects in Huntington's disease mice via altered DNA and histone methylation. Proc Natl Acad Sci U S A Jan 6;112(1):E
3 lo que en principio sería posible. En un experimento transgeneracional realizado en ratones, se demostró que la administración de valproato durante la gestación (día 10) producía síntomas pseudoautistas y un aumento de la expresión de varias proteínas en el cerebro hasta la tercera generación. No se demostró lo mismo con los efectos teratógenos, ya que las malformaciones detectadas en la primera generación no se observaron en la segunda ni en la tercera generación (Choi et al., 2016) 2. Aunque existen varias limitaciones, el estudio indica que hubo cierto efecto transgeneracional. El PRAC está de acuerdo en que hacen falta más estudios para evaluar si el valproato puede inducir alteraciones transgeneracionales de la expresión génica en la descendencia y determinar los tipos de efectos consiguientes. Además, en una revisión bibliográfica sobre los efectos en las mitocondrias, se describieron efectos adversos conocidos, como toxicidad hepática, síndrome de tipo Reye, pancreatitis e inmunodeficiencia (leucopenia). No hay pruebas claras de que la disfunción mitocondrial causada por el valproato se asocie a la aparición de autismo. El PRAC opina que los datos actualmente disponibles no justifican nuevas investigaciones acerca de la posible asociación entre la disfunción mitocondrial y el autismo. En la revisión europea previa (2014) 3, se recomendaron varias medidas educativas para pacientes y profesionales sanitarios. No obstante, y como demuestran los datos analizados en este procedimiento, las medidas educativas no llegaron al público de interés en un grado suficiente como para repercutir significativamente en las prescripciones. Los datos sobre consumo obtenidos del estudio conjunto sobre el consumo de fármacos (ECF) en curso, así como otros datos (encuestas, encuestas nacionales, indicios aislados, etc.) que se han evaluado en el presente procedimiento de arbitraje, indican que el valproato sigue utilizándose en una proporción considerable de mujeres en edad fértil en los distintos Estados miembros para las indicaciones de epilepsia y trastorno bipolar. A petición del PRAC, se realizó una amplia consulta para reunir la información más reciente en cuanto a conocimientos científicos y clínicos con el asesoramiento de dos grupos científicos (neurología y psiquiatría), y para recabar información de los profesionales sanitarios, de las propias pacientes y sus familiares y de organizaciones de pacientes (sesiones públicas, reunión de afectados), que propugnan que se defina mejor y se aumente la concienciación acerca del riesgo de daños fetales con el uso de valproato durante el embarazo. A raíz de estas consultas se puso de manifiesto que los especialistas son conscientes de los riesgos comentados, pero la información no llega a los pacientes de manera suficiente, oportuna y eficaz. Además de las medidas dirigidas a aumentar la concienciación sobre los riesgos del valproato, las diferentes consultas a expertos proporcionaron recomendaciones claras para limitar el uso del valproato. Los expertos también aportaron su experiencia en el tratamiento de mujeres embarazadas o que desean quedarse embarazadas en la práctica clínica. En particular, se presentó la experiencia de los profesionales sanitarios en relación con la suspensión del valproato o el cambio a otro tratamiento. Con la finalidad de obtener más datos sólidos sobre el cambio de valproato y la suspensión del tratamiento, el PRAC solicitó que se realizase un estudio observacional para identificar y evaluar las mejores prácticas para la sustitución del valproato en la práctica clínica. 2 Choi CS, Gonzales EL, Kim KC, Yang SM, Kim JW, Mabunga DF, et al. The transgenerational inheritance of autism-like phenotypes in mice exposed to valproic acid during pregnancy. Sci Rep Nov 7;6: nces/human_referral_prac_ jsp&mid=wc0b01ac05805c516f 64
4 En cuanto al embarazo y la planificación familiar en la epilepsia, el PRAC destacó también que se debe consultar a un especialista con experiencia en el tratamiento de la epilepsia para que reevalúe el tratamiento con valproato y considere otras opciones de tratamiento. Deberá hacerse todo lo posible por cambiar a otro tratamiento adecuado antes de la concepción y antes de dejar de usar anticonceptivos. Si no es posible cambiar el tratamiento, la paciente deberá recibir asesoramiento adicional sobre los riesgos del valproato para el feto, que la ayudará a tomar una decisión fundada respecto a la planificación familiar. En vista de lo anterior, el PRAC recomendó que se modifique la información sobre el producto, especialmente para contraindicar su uso en mujeres en edad fértil que no cumplan los requisitos de un programa de prevención del embarazo, y que se informe a los profesionales sanitarios mediante una comunicación directa. Se aplicará un programa de prevención del embarazo según corresponda para evitar la exposición al valproato durante la gestación, ya que su uso se asocia a un riesgo considerable de sufrir daños de por vida. Se dispondrán medidas educativas para garantizar que los profesionales sanitarios y los pacientes estén informados acerca de los riesgos asociados al valproato en mujeres embarazadas y en edad fértil, así como de las medidas necesarias para reducir al mínimo el riesgo de exposición al valproato durante el embarazo. El PRAC insiste en que se distribuya una única versión de los materiales educativos en cada Estado miembro, cuando proceda. Se anima a los TAC a colaborar y mantenerse en contacto con las autoridades nacionales competentes para facilitar la difusión del material educativo acordado. El PRAC recomendó introducir mejoras en una guía para profesionales sanitarios, con el fin de garantizar que los médicos que prescriban valproato sean conscientes de los riesgos asociados al uso de este producto en niñas, mujeres en edad fértil y embarazadas, y solicitó que también las pacientes reciban información oportuna acerca de estos riesgos. En la guía se explicará el programa de prevención del embarazo y los requisitos que deben cumplirse antes de iniciar el tratamiento con valproato. Al menos una vez al año se reevaluará la necesidad del tratamiento con valproato y se considerarán otras opciones de tratamiento en las niñas que hayan experimentado la menarquia y en las mujeres en edad fértil. Además, la guía deberá familiarizar a los médicos con las principales medidas para atenuar los riesgos asociados al uso de valproato en las niñas y mujeres expuestas mediante el uso de la guía para el paciente y el documento de aceptación de riesgos. La guía para profesionales sanitarios deberá incluir la recomendación de indicar a los padres de las niñas que reciban valproato que tendrán que acudir al especialista cuando su hija experimente la menarquia, información sobre la necesidad de cambiar a otro tratamiento cuando se planifique un embarazo, y la obligatoriedad de cumplimentar el documento de aceptación de riesgos y la tarjeta del paciente al menos una vez al año. El PRAC recomendó que en todos los Estados miembros se facilite una tarjeta del paciente a todos los pacientes que reciban valproato. La información contenida en la tarjeta del paciente debe reflejar de manera breve y concisa la eficacia del producto, pero también los posibles daños para el feto si se toma durante el embarazo. Se incluirá información sobre el uso de anticonceptivos eficaces de forma ininterrumpida durante todo el tratamiento, así como un recordatorio de la reevaluación anual. También se incluirá la recomendación de no interrumpir el tratamiento y la indicación de acudir al médico cuando se planifique o sospeche un embarazo. Esta tarjeta del paciente se adjuntará al embalaje exterior de forma que recuerde la necesidad de que el farmacéutico hable con el paciente en el momento de la dispensación del producto. El PRAC recomendó que se desarrolle y mejore la guía para el paciente dirigida a las niñas, adolescentes y mujeres a las que se vaya a recetar valproato. La guía para el paciente debe proporcionar información exhaustiva sobre los riesgos para el feto secundarios a la exposición intrauterina al valproato y las sustancias relacionadas, los detalles del programa de prevención del embarazo orientado a evitar la exposición al valproato durante la gestación y las medidas que deben 65
5 adoptarse en relación con el embarazo o la intención de quedarse embarazada. Con el fin de que la información sea adecuada, debería adaptarse a las diferentes situaciones de la vida de la mujer y adecuarse a cada edad: la primera prescripción, las mujeres que mantienen el tratamiento con valproato y no están intentando tener hijos, las mujeres en edad fértil que mantienen el tratamiento con valproato y quieren tener hijos o las mujeres que se quedan embarazadas (sin planificarlo) y mantienen el tratamiento con valproato. Esta guía se entregará a la paciente. El PRAC también analizó el documento anual de aceptación de riesgos que deberá usarse y documentarse al inicio y en todas las revisiones anuales del tratamiento con valproato realizadas por un especialista. Teniendo en cuenta todas las pruebas, así como las áreas en las que existe poca información, el PRAC solicitó que se adoptasen varias medidas para definir mejor los riesgos, aumentar la concienciación acerca de los riesgos, limitar el uso y medir la eficacia de las medidas propuestas actualmente. El estudio sobre el consumo de fármacos (ECF) que se está llevando a cabo deberá adaptarse y seguir adelante para evaluar la eficacia de las medidas de minimización de riesgos actualizadas, como las condiciones del programa de prevención del embarazo, y definir mejor las pautas de prescripción del valproato. Se realizará una encuesta entre los profesionales sanitarios para evaluar sus conocimientos y actitud en relación con las nuevas restricciones de la información sobre el producto y para saber si han recibido la comunicación directa para profesionales sanitarios y los materiales educativos, así como otra encuesta entre los pacientes para evaluar si han recibido los materiales educativos. Se llevará a cabo un estudio de seguridad posterior a la autorización (PASS), que preferiblemente utilizará los datos de registros existentes, para definir mejor el síndrome fetal por anticonvulsivantes en niños con antecedentes de exposición intrauterina al valproato, en comparación con otros antiepilépticos. Además, con el fin de aumentar los conocimientos sobre la asociación entre la exposición paterna al valproato y el riesgo de anomalías congénitas y trastornos del desarrollo neurológico, como la aparición de autismo en la descendencia, se recomienda la realización de un estudio observacional retrospectivo. Se efectuará asimismo un estudio observacional para evaluar e identificar las mejores prácticas para suspender y sustituir el tratamiento con valproato. Se recomienda encarecidamente a los TAC que colaboren en las medidas solicitadas y realicen estudios conjuntos. Una de las peticiones de los pacientes y de los familiares consultados fue la incorporación de un recordatorio visual en el embalaje exterior que advierta a las mujeres sobre los posibles daños para el feto y que también les aconseje el uso de métodos anticonceptivos eficaces. El PRAC admitió que este recordatorio visual es importante para advertir del riesgo a las pacientes y para animarlas a consultar al médico, por lo que solicitó la inclusión de un recordatorio visual en el embalaje exterior. Además de un recuadro de advertencia, se podría incluir un símbolo o pictograma cuyos detalles se adaptarían en cada país. A la vista de los problemas de seguridad en cuestión y del conjunto de medidas de minimización de riesgos dirigidas a reducir al mínimo la exposición durante el embarazo, todos los TAC deberán disponer de un plan de gestión de riesgos. Los medicamentos seguirán figurando en la lista de productos sujetos a seguimiento adicional. Motivos de la recomendación del PRAC Considerando que: 66
6 El Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) examinó el procedimiento establecido en el artículo 31 de la Directiva 2001/83/CE para los medicamentos que contienen sustancias relacionadas con el valproato. El PRAC estudió la totalidad de los datos presentados sobre el valproato y sustancias relacionadas en relación con los riesgos teratógenos y para el desarrollo neurológico, el uso en la práctica clínica y la eficacia de las medidas de minimización de riesgos existentes. Esto incluye las respuestas presentadas por escrito por los titulares de las autorizaciones de comercialización, así como los resultados de los grupos de asesoramiento científico en neurología y psiquiatría. Además, el PRAC consideró las opiniones de organizaciones de pacientes y de pacientes, familiares y cuidadores, así como las opiniones de profesionales sanitarios en una sesión pública y una reunión específica. El PRAC confirmó el riesgo conocido de exposición intrauterina al valproato y sustancias relacionadas, que se asocia a un mayor riesgo de trastornos del desarrollo y anomalías congénitas en la descendencia. No se identificó información nueva e importante sobre este riesgo. El PRAC concluyó que las medidas de minimización de riesgos adoptadas no han sido suficientemente eficaces para evitar la exposición intrauterina accidental al valproato y sustancias relacionadas en todas sus indicaciones. El PRAC llegó a la conclusión de que las medidas de minimización de riesgos para los medicamentos que contienen valproato o sustancias relacionadas deben reforzarse mediante la contraindicación en todas las indicaciones (epilepsia, trastornos bipolares y profilaxis de la migraña) en mujeres/niñas en edad fértil, a menos que se cumplan las condiciones del programa de prevención del embarazo. El PRAC consideró que el programa de prevención del embarazo debería reflejar que, en la indicación de epilepsia, si una mujer desea quedarse embarazada, deberá acudir a un especialista con experiencia en el tratamiento de la epilepsia para que reevalúe el tratamiento con valproato y valore otras opciones de tratamiento. Deberá hacerse todo lo posible por cambiar a otro tratamiento adecuado antes de la concepción y antes de dejar de usar anticonceptivos. Si no es posible cambiar el tratamiento, la paciente deberá recibir asesoramiento adicional sobre los riesgos del valproato para el feto, que la ayudará a tomar una decisión fundada respecto a la planificación familiar. En cuanto al uso para el tratamiento de la epilepsia durante el embarazo, el PRAC concluyó que estos medicamentos están contraindicados a menos que no exista una alternativa de tratamiento adecuada. Con respecto al uso para el tratamiento de los trastornos bipolares y la profilaxis de la migraña, estos productos están contraindicados durante el embarazo. Además, el PRAC recomendó introducir otras modificaciones en la información sobre el producto, como advertencias y precauciones de uso, así como información actualizada sobre los riesgos relacionados con la exposición durante el embarazo, con el fin de informar mejor a los profesionales sanitarios y a los pacientes. El PRAC también concluyó que era necesario actualizar los materiales educativos para informar con detalle a los pacientes y a los profesionales sanitarios sobre los riesgos para el feto secundarios a la exposición intrauterina al valproato, así como añadir algunas medidas de minimización de riesgos, como un recordatorio visual en el embalaje exterior, una tarjeta del paciente y un documento de aceptación, para aumentar la concienciación sobre los riesgos y la necesidad de usar métodos anticonceptivos. El PRAC también recomendó la realización de estudios posteriores a la autorización para evaluar la eficacia de las medidas de minimización 67
7 de riesgos. Se acordaron los elementos esenciales que debía incluir la comunicación directa para profesionales sanitarios, además de los plazos para su distribución. El PRAC también examinó los datos científicos disponibles sobre el riesgo de malformaciones y trastornos del desarrollo neurológico en la descendencia después de la exposición paterna y el riesgo de malformaciones y trastornos del desarrollo neurológico hasta la tercera generación, y consideró que es necesario seguir investigando antes de que se puedan extraer conclusiones. El PRAC solicitó la realización de estudios posteriores a la autorización. Por todo lo expuesto, el Comité considera que la relación riesgo/beneficio de los medicamentos que contienen sustancias relacionadas con el valproato sigue siendo favorable, siempre que se cumplan las condiciones acordadas en las autorizaciones de comercialización, y teniendo en cuenta las modificaciones acordadas de la información sobre el producto y otras medidas de minimización de riesgos. En consecuencia, el Comité recomienda la modificación de los términos de las autorizaciones de comercialización de los medicamentos que contienen sustancias relacionadas con el valproato. 68
8 Dictamen del CMDh Tras revisar la recomendación del PRAC, el CMDh se mostró de acuerdo con las conclusiones generales del PRAC y los motivos para la recomendación. Explicación detallada de los motivos científicos de las divergencias con respecto a la recomendación del PRAC El CMDh confirma que ha recibido correspondencia de un TAC (Laboratoires Aguettant, Francia) referente a los medicamentos que contienen formulaciones inyectables (por vía intravenosa; IV) de valproato, por la cual solicita indicaciones más claras para la aplicación de las actividades de farmacovigilancia y las medidas de minimización de riesgos adoptadas por el PRAC para estas formulaciones IV, indicadas para el tratamiento temporal de la epilepsia cuando no es posible su administración por vía oral. El TAC solicita al CMDh que aclare cómo debe aplicarse la recomendación del PRAC para las formas inyectables, y propone establecer una diferenciación entre las actividades de minimización de riesgos sistemáticas y adicionales que deban aplicarse a los productos no inyectables y las que también sean aplicables a los productos inyectables. Por consiguiente, el CMDh aclaró que las modificaciones de la información sobre el producto y de las demás medidas habituales para informar a todos los profesionales sanitarios y pacientes sobre el riesgo para el feto secundario al uso de valproato durante el embarazo son aplicables a todos los medicamentos que contienen valproato y sustancias relacionadas, con independencia de la vía de administración. Además, todos los productos deben disponer de un plan de gestión de riesgos. Con respecto a las siguientes medidas de minimización de riesgos, el CMDh ha aclarado que: En lo referente al recordatorio visual en el embalaje exterior, se considera que es esencial para recordar a los profesionales sanitarios que no se debe administrar valproato a las mujeres en edad fértil (MEF) que no cumplan los requisitos del plan de prevención del embarazo ni a las mujeres embarazadas, y que ayuda a entablar una conversación con la paciente sobre los riesgos del valproato. Esto puede ser especialmente importante, ya que cabe esperar que los médicos prescriptores de formulaciones IV de valproato sean diferentes de los médicos a los que se dirige habitualmente la información durante la aplicación de medidas adicionales de minimización de riesgos. El recordatorio visual se considera importante, por lo que será obligatorio que aparezca en el embalaje exterior de cualquier formulación y presentación de valproato. En lo que respecta a los materiales educativos (es decir, guía para profesionales sanitarios y guía para el paciente), también se consideran relevantes para las formas inyectables de los productos que contienen valproato y sustancias relacionadas, por lo que deberán utilizarse. De hecho, la guía para profesionales sanitarios incluirá un recordatorio de los requisitos aplicables a la administración de valproato (p. ej., plan de prevención del embarazo), de la necesidad de comentar los riesgos con la paciente y de realizar una prueba de embarazo. Además, dado que es probable que las formulaciones IV de valproato sean administradas por profesionales sanitarios distintos de los médicos habitualmente responsables del tratamiento, es fundamental que dispongan de una guía sobre estos productos, por lo que también se facilitará dicha guía a los médicos que prescriban formulaciones IV de productos que contengan valproato. En las mujeres pueden darse situaciones en las que el tratamiento con valproato se inicie con una formulación IV (antes del alta y la administración oral de valproato). Se considera esencial comunicar cuanto antes toda la información relativa a los riesgos del valproato. En cuanto a la distribución de la comunicación directa para profesionales sanitarios, se anima a todos los TAC a que colaboren en la preparación y distribución de una única comunicación directa en cada 69
9 Estado miembro; además, todos los TAC que comercialicen productos que contengan valproato y sustancias relacionadas están obligados a participar en la difusión de la información, con independencia de la vía de administración de sus medicamentos. La información sobre los riesgos, las nuevas contraindicaciones y otras medidas de minimización de riesgos que se incluya en la comunicación directa para profesionales sanitarios será aplicable a todas las formulaciones. En cuanto a la tarjeta del paciente, el CMDh aclara que la información deberá servir como recordatorio para el uso prolongado de valproato. Dado que las formulaciones inyectables solo están indicadas en tratamientos de corta duración, es muy probable que la tarjeta del paciente tenga poca utilidad. Además, esta tarjeta del paciente deberá adjuntarse al acondicionamiento de los medicamentos que contengan valproato y sustancias relacionadas y servirá como recordatorio adicional durante la dispensación. En los casos en que el tratamiento comience con una formulación IV de valproato y después se cambie a una formulación oral, la tarjeta del paciente se entregará cuando se dispensen los productos que contengan valproato para administración oral. Por tanto, se considera que la tarjeta del paciente no es necesaria para las formulaciones inyectables de productos que contengan valproato y sustancias relacionadas. La finalidad del documento anual de aceptación de riesgos para las formulaciones inyectables de productos que contienen valproato y sustancias relacionadas es servir como recordatorio periódico y como reconocimiento de los riesgos del valproato para las mujeres en edad fértil (MEF). Dado que las formulaciones inyectables están indicadas en tratamientos de corta duración, este documento anual de aceptación de riesgos no se considera pertinente, por lo que no procede en este caso. Por último, los pacientes acabarán recibiendo una forma no inyectable de valproato, por lo que se considera que la revisión anual se llevará a cabo como parte de las MMR recomendadas para el tratamiento oral, en las que sí se utilizará el documento anual de aceptación de riesgos. Por tanto, el formulario anual de aceptación de riesgos no es obligatorio para las formulaciones inyectables. En lo que respecta a las demás actividades de farmacovigilancia y a los estudios necesarios para investigar más a fondo los posibles riesgos de los productos que contienen valproato y sustancias relacionadas y para medir la eficacia de las MMR, el CMDh aclaró que estos estudios no serían aplicables a los productos inyectables, ya que la información que se podría reunir acerca de estos productos sería limitada y probablemente poco relevante a la vista de la corta duración del tratamiento, que se utiliza habitualmente en situaciones de urgencia y solo cuando no pueden administrarse formulaciones orales. Por consiguiente, el PASS sobre el consumo del fármaco adaptado, las dos encuestas dirigidas a profesionales sanitarios o pacientes, el PASS realizado a partir de los registros para caracterizar el síndrome fetal por anticonvulsivantes en niños con antecedentes de exposición intrauterina a los antiepilépticos, el estudio observacional retrospectivo sobre la asociación entre la exposición paterna al valproato y el riesgo de anomalías congénitas y trastornos del desarrollo neurológico como el autismo en la descendencia y el estudio observacional para evaluar e identificar las mejores prácticas para suspender y sustituir el tratamiento con valproato, no son aplicables a las formulaciones inyectables. Conclusiones generales En consecuencia, el CMDh considera que la relación riesgo/beneficio de los medicamentos que contienen sustancias relacionadas con el valproato sigue siendo favorable, con sujeción a las modificaciones de la información sobre el producto y en las condiciones descritas anteriormente. Por consiguiente, el CMDh recomienda la modificación de los términos de las autorizaciones de comercialización de los medicamentos que contienen sustancias relacionadas con el valproato. 70
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Conclusiones científicas y motivos de las conclusiones
 Anexo II Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización y explicación pormenorizada de las diferencias con respecto a la recomendación
Anexo II Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización y explicación pormenorizada de las diferencias con respecto a la recomendación
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Conclusiones científicas
 Anexo II Conclusiones científicas y motivos para la revocación o modificación de los términos de las autorizaciones de comercialización y explicación detallada de las diferencias de la recomendación del
Anexo II Conclusiones científicas y motivos para la revocación o modificación de los términos de las autorizaciones de comercialización y explicación detallada de las diferencias de la recomendación del
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO
 ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
Conclusiones científicas y motivos de las conclusiones
 Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización y explicación pormenorizada de las diferencias con respecto a la recomendación
Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización y explicación pormenorizada de las diferencias con respecto a la recomendación
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
Denominación (de fantasía) Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé
 Anexo I Lista de las denominaciones (de fantasía), forma farmacéutica, dosis de los medicamentos, forma de administración, solicitantes/titulares de la autorización de comercialización en los Estados Miembros
Anexo I Lista de las denominaciones (de fantasía), forma farmacéutica, dosis de los medicamentos, forma de administración, solicitantes/titulares de la autorización de comercialización en los Estados Miembros
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 13 Conclusiones científicas Haldol, que contiene el principio activo haloperidol, es un antipsicótico que pertenece al grupo de las butirofenonas. Es un potente antagonista
Anexo II Conclusiones científicas 13 Conclusiones científicas Haldol, que contiene el principio activo haloperidol, es un antipsicótico que pertenece al grupo de las butirofenonas. Es un potente antagonista
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
 ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 1 Conclusiones científicas El 7 de junio de 2017, se informó a la Comisión Europea (CE) de un caso mortal de insuficiencia hepática fulminante en un paciente tratado con
Anexo IV Conclusiones científicas 1 Conclusiones científicas El 7 de junio de 2017, se informó a la Comisión Europea (CE) de un caso mortal de insuficiencia hepática fulminante en un paciente tratado con
1. Resumen general de la evaluación científica de los medicamentos en solución para perfusión que contienen hidroxietil almidón por el PRAC
 Anexo II Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización y explicación detallada de las divergencias con respecto a la recomendación
Anexo II Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización y explicación detallada de las divergencias con respecto a la recomendación
Anexo III. Modificaciones a las secciones relevantes de la información del producto
 Anexo III Modificaciones a las secciones relevantes de la información del producto Nota: Estas modificaciones a las secciones relevantes del Resumen de las Características del Producto y el prospecto son
Anexo III Modificaciones a las secciones relevantes de la información del producto Nota: Estas modificaciones a las secciones relevantes del Resumen de las Características del Producto y el prospecto son
Conclusiones científicas y explicación pormenorizada de las bases científicas de las diferencias con respecto a la recomendación del PRAC
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización sujetas a condiciones y explicación pormenorizada de las bases científicas de
Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización sujetas a condiciones y explicación pormenorizada de las bases científicas de
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO
 TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Modificaciones de la información de los medicamentos autorizados por procedimiento nacional que contienen: METOTREXATO
 DEPARTAMENTO DE MEDICAMENTOS DE USO HUMANO División de Farmacoepidemiología y Farmacovigilancia Modificaciones de la información de los medicamentos autorizados por procedimiento nacional que contienen:
DEPARTAMENTO DE MEDICAMENTOS DE USO HUMANO División de Farmacoepidemiología y Farmacovigilancia Modificaciones de la información de los medicamentos autorizados por procedimiento nacional que contienen:
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Toctino (alitretinoína)
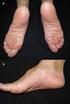 1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Anexo II. Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 12 Conclusiones científicas y motivos para la modificación de los términos de
Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización 12 Conclusiones científicas y motivos para la modificación de los términos de
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA
 Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
Toctino (alitretinoína)
 1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Anexo III Enmiendas a las secciones relevantes de la información del producto
 Anexo III Enmiendas a las secciones relevantes de la información del producto Nota: Estas enmiendas a las secciones relevantes de la información del producto son el resultado de un procedimiento de arbitraje.
Anexo III Enmiendas a las secciones relevantes de la información del producto Nota: Estas enmiendas a las secciones relevantes de la información del producto son el resultado de un procedimiento de arbitraje.
Restricciones de dispensación para isotretinoína
 Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS. Esther Salgueiro 10, 17 de Marzo de 2015
 FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España
 Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009).
 PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009). PRESCRIPCIÓN DE OSELTAMIVIR: El médico que atienda al paciente realizará la prescripción en receta
PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009). PRESCRIPCIÓN DE OSELTAMIVIR: El médico que atienda al paciente realizará la prescripción en receta
LEFLUNOMIDA. Información sobre seguridad para los profesionales sanitarios
 LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 [ D] Guía del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
[ D] Guía del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
Anexo III. Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto
 Anexo III Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto Nota: Esta Ficha Técnica, Etiquetado y Prospecto son el resultado del proceso de arbitraje.
Anexo III Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto Nota: Esta Ficha Técnica, Etiquetado y Prospecto son el resultado del proceso de arbitraje.
PROSPECTO: INFORMACIÓN PARA EL USUARIO. CITICOLINA Normon 1000 mg solución inyectable EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
Julio Estimado profesional sanitario: Resumen
 Comunicación para profesionales sanitarios Valproato ( Depakine / Depakine Crono, Ácido Valproico GES ): Nuevas restricciones de uso; puesta en práctica del Programa de Prevención de Embarazos. Julio 2018
Comunicación para profesionales sanitarios Valproato ( Depakine / Depakine Crono, Ácido Valproico GES ): Nuevas restricciones de uso; puesta en práctica del Programa de Prevención de Embarazos. Julio 2018
DIRECTIVA 92/27/CEE DEL CONSEJO, DE 31 DE MARZO DE 1992, RELATIVA AL ETIQUETADO Y AL PROSPECTO DE LOS MEDICAMENTOS DE USO HUMANO
 DIRECTIVA 92/27/CEE DEL CONSEJO, DE 31 DE MARZO DE 1992, RELATIVA AL ETIQUETADO Y AL PROSPECTO DE LOS MEDICAMENTOS DE USO HUMANO Artículo 1. Capítulo primero Definiciones y ámbito de aplicación 1. La presente
DIRECTIVA 92/27/CEE DEL CONSEJO, DE 31 DE MARZO DE 1992, RELATIVA AL ETIQUETADO Y AL PROSPECTO DE LOS MEDICAMENTOS DE USO HUMANO Artículo 1. Capítulo primero Definiciones y ámbito de aplicación 1. La presente
Resumen general de la evaluación científica de los supositorios que contienen derivados terpénicos (ver Anexo I)
 ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS DE LA REVOCACIÓN O MODIFICACIÓN DE LAS SECCIONES PERTINENTES DE LOS RESÚMENES DE LAS CARACTERÍSTICAS DEL PRODUCTO, ETIQUETADOS Y PROSPECTOS PRESENTADOS POR LA
ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS DE LA REVOCACIÓN O MODIFICACIÓN DE LAS SECCIONES PERTINENTES DE LOS RESÚMENES DE LAS CARACTERÍSTICAS DEL PRODUCTO, ETIQUETADOS Y PROSPECTOS PRESENTADOS POR LA
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), junio 2015 Disponible en
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), junio 2015 Disponible en
ANEXO II INFORMACION DEL PRODUCTO Descripción general del producto, en su caso con dibujos explicativos y
 ANEXO II INFORMACION DEL PRODUCTO Resumen de las características del producto 1. Nombre del medicamento 2. Composición del producto: 2.1. Descripción general del producto, en su caso con dibujos explicativos
ANEXO II INFORMACION DEL PRODUCTO Resumen de las características del producto 1. Nombre del medicamento 2. Composición del producto: 2.1. Descripción general del producto, en su caso con dibujos explicativos
El reservorio es humano y el modo de transmisión es por vía aérea a través de las secreciones nasofaríngeas de la persona infectada.
 Información general Rubéola La rubéola es una infección vírica que es leve en los niños, pero tiene consecuencias graves en las embarazadas porque puede causar muerte fetal o defectos congénitos en el
Información general Rubéola La rubéola es una infección vírica que es leve en los niños, pero tiene consecuencias graves en las embarazadas porque puede causar muerte fetal o defectos congénitos en el
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018
 Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018 GUÍA DE LA PACIENTE VALPROATO ( DEPAKINE / DEPAKINE CRONO ): MEDIDAS
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018 GUÍA DE LA PACIENTE VALPROATO ( DEPAKINE / DEPAKINE CRONO ): MEDIDAS
Anexo IV. Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada gramo de pomada bucal contiene:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada bucal contiene: Carbenoxolona disódica. 20 mg Excipientes: Para consultar
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada bucal contiene: Carbenoxolona disódica. 20 mg Excipientes: Para consultar
VARIACIONES RELATIVAS A LA FARMACOVIGILANCIA VETERINARIA
 VARIACIONES RELATIVAS A LA FARMACOVIGILANCIA VETERINARIA FRANCISCO DE ASÍS ORTEGA HUEDO Jefe de Sección SGMV 1 - Normativa en vigor - Estructura RD Artículo 2 -> Modificación RD 1246/2008 -> Centrándonos
VARIACIONES RELATIVAS A LA FARMACOVIGILANCIA VETERINARIA FRANCISCO DE ASÍS ORTEGA HUEDO Jefe de Sección SGMV 1 - Normativa en vigor - Estructura RD Artículo 2 -> Modificación RD 1246/2008 -> Centrándonos
(Texto pertinente a efectos del EEE)
 L 119/4 Diario Oficial de la Unión Europea 7.5.2011 REGLAMENTO (UE) N o 440/2011 DE LA COMISIÓN de 6 de mayo de 2011 sobre la autorización y la denegación de autorización de determinadas declaraciones
L 119/4 Diario Oficial de la Unión Europea 7.5.2011 REGLAMENTO (UE) N o 440/2011 DE LA COMISIÓN de 6 de mayo de 2011 sobre la autorización y la denegación de autorización de determinadas declaraciones
DIRECTRICES PARA LA RESOLUCIÓN DE VARIACIONES DE ADECUACIÓN AL RD 1345/2007 Y OTRAS VARIACIONES COEXISTENTES EN EL TIEMPO
 DIRECTRICES PARA LA RESOLUCIÓN DE VARIACIONES DE ADECUACIÓN AL RD 1345/2007 Y OTRAS VARIACIONES COEXISTENTES EN EL TIEMPO Antecedentes 21 de mayo de 2010 La Disposición transitoria tercera del Real Decreto
DIRECTRICES PARA LA RESOLUCIÓN DE VARIACIONES DE ADECUACIÓN AL RD 1345/2007 Y OTRAS VARIACIONES COEXISTENTES EN EL TIEMPO Antecedentes 21 de mayo de 2010 La Disposición transitoria tercera del Real Decreto
NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
 ANEXO I NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 1/7 Estado miembro Solicitante o titular de la autorización
ANEXO I NOMBRE, FORMA FARMACÉUTICA, DOSIS DEL MEDICAMENTO, ESPECIES DE DESTINO, VÍAS DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 1/7 Estado miembro Solicitante o titular de la autorización
INN Nombre inventado Concentración Forma farmacéutica. Caustinerf Arsenical
 Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
CINFAMUCOL ACETILCISTEÍNA 200mg
 CINFAMUCOL ACETILCISTEÍNA 200mg PROSPECTO Acetilcisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. - Conserve este
CINFAMUCOL ACETILCISTEÍNA 200mg PROSPECTO Acetilcisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. - Conserve este
Prospecto: información para el usuario. ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico
 Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
 22 de enero de 2015 EMA/PRAC/63326/2015 Comité para la Determinación del Riesgo en farmacovigilancia Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
22 de enero de 2015 EMA/PRAC/63326/2015 Comité para la Determinación del Riesgo en farmacovigilancia Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
Restricciones de uso de los medicamentos que contienen domperidona
 1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
Prospecto: información para el usuario. ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico
 Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el usuario ANTIVERRUGAS ISDIN colodión Ácido salicílico/ Ácido láctico Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL
 MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización.
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización. Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización. Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Prospecto: información para el usuario. No use PANFUNGOL 400 mg óvulos. Ketoconazol
 Prospecto: información para el usuario PANFUNGOL 400 mg óvulos Ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Prospecto: información para el usuario PANFUNGOL 400 mg óvulos Ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Anexo I. Relación de los nombres del medicamento, forma farmacéutica, dosis, vía de administración y solicitante en los estados miembros
 Anexo I Relación de los nombres del medicamento, forma farmacéutica, dosis, vía de administración y solicitante en los estados miembros 1 Estado miembro UE/EEE Solicitante nombre de compañía, dirección
Anexo I Relación de los nombres del medicamento, forma farmacéutica, dosis, vía de administración y solicitante en los estados miembros 1 Estado miembro UE/EEE Solicitante nombre de compañía, dirección
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DALMARELIN, lecirelina 25 µg/ml solución inyectable para bovino y conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DALMARELIN, lecirelina 25 µg/ml solución inyectable para bovino y conejos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Anexo III. Modificaciones en las secciones relevantes de la información del producto
 Anexo III Modificaciones en las secciones relevantes de la información del producto Nota: Estas modificaciones de las secciones relevantes de la Ficha Técnica y Prospecto son el resultado del proceso de
Anexo III Modificaciones en las secciones relevantes de la información del producto Nota: Estas modificaciones de las secciones relevantes de la Ficha Técnica y Prospecto son el resultado del proceso de
COMUNICACIÓN DE LA COMISIÓN
 COMUNICACIÓN DE LA COMISIÓN Comunicación de la Comisión sobre la aplicación de los nuevos procedimientos de autorización de la comercialización de medicamentos de uso humano y veterinario, derivados del
COMUNICACIÓN DE LA COMISIÓN Comunicación de la Comisión sobre la aplicación de los nuevos procedimientos de autorización de la comercialización de medicamentos de uso humano y veterinario, derivados del
Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro
 Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
1. Qué es Ultra Levura y para qué se utiliza.
 Introducción Prospecto: información para el paciente Ultra Levura 250 mg cápsulas duras Saccharomyces boulardii Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Introducción Prospecto: información para el paciente Ultra Levura 250 mg cápsulas duras Saccharomyces boulardii Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Notificación de acontecimientos adversos en Ensayos clínicos. 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica.
 Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
Traducción no oficial del prospecto en alemán
 Traducción no oficial del prospecto en alemán Prospecto: información para el paciente Información para usuarios Medivitan iv Ampollas 5 mg, 1 mg, 1,05 mg solución inyectable Principios activos: clorhidrato
Traducción no oficial del prospecto en alemán Prospecto: información para el paciente Información para usuarios Medivitan iv Ampollas 5 mg, 1 mg, 1,05 mg solución inyectable Principios activos: clorhidrato
Resumen. Teratogenicidad. Trastornos neuropsiquiátricos. 19 de septiembre de Estimado Profesional Sanitario:
 19 de septiembre de 2018 Retinoides ( Acitretina, Adapaleno, Alitretinoína, Bexaroteno, Isotretinoína, Tazaroteno y Tretinoína): Actualización de los efectos teratogénicos y trastornos neuropsiquiátricos
19 de septiembre de 2018 Retinoides ( Acitretina, Adapaleno, Alitretinoína, Bexaroteno, Isotretinoína, Tazaroteno y Tretinoína): Actualización de los efectos teratogénicos y trastornos neuropsiquiátricos
Guía de aprendizaje. Involucrar a las mujeres y los ensayos clínicos sobre VIH
 Guía de aprendizaje Involucrar a las mujeres y los ensayos clínicos sobre VIH Women for Positive Action está patrocinado por un subsidio de Abbott International 22/09/2009 Esta guía de aprendizaje se ha
Guía de aprendizaje Involucrar a las mujeres y los ensayos clínicos sobre VIH Women for Positive Action está patrocinado por un subsidio de Abbott International 22/09/2009 Esta guía de aprendizaje se ha
Resumen general de la evaluación científica de Kytril y denominaciones asociadas (Ver Anexo I)
 ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO, EL ETIQUETADO Y EL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 11 Conclusiones
ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO, EL ETIQUETADO Y EL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 11 Conclusiones
FICHA TECNICA. HIDROCORTISONA PENSA Crema Hidrocortisona
 FICHA TECNICA HIDROCORTISONA PENSA Crema Hidrocortisona 1. NOMBRE DEL MEDICAMENTO HIDROCORTISONA PENSA Crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 100 g contienen: Hidrocortisona (DCI)...0,5 g.
FICHA TECNICA HIDROCORTISONA PENSA Crema Hidrocortisona 1. NOMBRE DEL MEDICAMENTO HIDROCORTISONA PENSA Crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 100 g contienen: Hidrocortisona (DCI)...0,5 g.
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
Farmacovigilancia en la República Dominicana. Dr. Lucas ML Lanfranco Encargado de la Unidad de farmacovigilancia La Antigua, Guatemala Octubre 2013
 Farmacovigilancia en la República Dominicana Dr. Lucas ML Lanfranco Encargado de la Unidad de farmacovigilancia La Antigua, Guatemala Octubre 2013 Marco Legal La Ley General de Salud (No. 42-01) regula
Farmacovigilancia en la República Dominicana Dr. Lucas ML Lanfranco Encargado de la Unidad de farmacovigilancia La Antigua, Guatemala Octubre 2013 Marco Legal La Ley General de Salud (No. 42-01) regula
FICHA TÉCNICA O RECUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Para consultar la lista completa de excipientes, ver sección 6.1.
 FICHA TÉCNICA O RECUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO SOBREPIN infantil 100 mg supositorios SOBREPIN adultos 200 mg supositorios 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RECUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO SOBREPIN infantil 100 mg supositorios SOBREPIN adultos 200 mg supositorios 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PLAN NACIONAL DE PREPARACIÓN Y RESPUESTA ANTE UNA PANDEMIA DE GRIPE
 PLAN NACIONAL DE PREPARACIÓN Y RESPUESTA ANTE UNA PANDEMIA DE GRIPE Noviembre 2005 La vacunación es la principal estrategia en el control y prevención ante una pandemia de gripe, pero en las primeras
PLAN NACIONAL DE PREPARACIÓN Y RESPUESTA ANTE UNA PANDEMIA DE GRIPE Noviembre 2005 La vacunación es la principal estrategia en el control y prevención ante una pandemia de gripe, pero en las primeras
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
Anexo III. Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto
 Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
Ficha técnica Página 1
 1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
Anexo I. Conclusiones científicas y motivos de la modificación del resumen de las características del producto y el prospecto
 Anexo I Conclusiones científicas y motivos de la modificación del resumen de las características del producto y el prospecto Resumen general de la evaluación científica de los medicamentos veterinarios
Anexo I Conclusiones científicas y motivos de la modificación del resumen de las características del producto y el prospecto Resumen general de la evaluación científica de los medicamentos veterinarios
REDACCIÓN DE UN PROCEDIMIENTO NORMALIZADO DE ELABORACIÓN Y CONTROL DE UNA FORMULA MAGISTRAL. Indice
 Datos de la Farmacia PROCEDIMIENTOS NORMALIZADOS PROCEDIMIENTO GENERAL Código: Página 1 de 7 Sustituye a: Fecha de aprobación: REDACCIÓN DE UN PROCEDIMIENTO NORMALIZADO DE ELABORACIÓN Y CONTROL DE UNA
Datos de la Farmacia PROCEDIMIENTOS NORMALIZADOS PROCEDIMIENTO GENERAL Código: Página 1 de 7 Sustituye a: Fecha de aprobación: REDACCIÓN DE UN PROCEDIMIENTO NORMALIZADO DE ELABORACIÓN Y CONTROL DE UNA
Recomendaciones para el uso de oseltamivir en niños menores de 1 año
 Ministerio de Sanidad y Política Social. Agencia Española de Medicamentos y Productos Sanitarios. Nota informativa para profesionales sanitarios, 08/05/2009. Uso de oseltamivir y zanamivir en niños de
Ministerio de Sanidad y Política Social. Agencia Española de Medicamentos y Productos Sanitarios. Nota informativa para profesionales sanitarios, 08/05/2009. Uso de oseltamivir y zanamivir en niños de
Prospecto: información para el paciente. Ultra Levura 250 mg granulado para suspensión oral. Saccharomyces boulardii
 Prospecto: información para el paciente Ultra Levura 250 mg granulado para suspensión oral Saccharomyces boulardii Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
Prospecto: información para el paciente Ultra Levura 250 mg granulado para suspensión oral Saccharomyces boulardii Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
FICHA TÉCNICA. 1 ml de solución contiene 3 mg de hipromelosa y 5,5 mg de cloruro de sodio.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO COLIRCUSÍ HUMECTANTE 3 mg/ml + 5,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 3 mg de hipromelosa y 5,5 mg de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO COLIRCUSÍ HUMECTANTE 3 mg/ml + 5,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 3 mg de hipromelosa y 5,5 mg de
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 7 Conclusiones científicas Resumen general de la evaluación científica de los productos de metadona para uso oral que contienen povidona La metadona es un opioide sintético
Anexo II Conclusiones científicas 7 Conclusiones científicas Resumen general de la evaluación científica de los productos de metadona para uso oral que contienen povidona La metadona es un opioide sintético
PROSPECTO. Metrobactin 250 mg comprimidos para perros y gatos Metronidazol
 PROSPECTO Metrobactin 250 mg comprimidos para perros y gatos Metronidazol 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y DEL FABRICANTE RESPONSABLE
PROSPECTO Metrobactin 250 mg comprimidos para perros y gatos Metronidazol 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Y DEL FABRICANTE RESPONSABLE
FORMULARIO DE CONSENTIMIENTO INFORMADO PARA MUJERES CON POSIBILIDAD DE QUEDAR EMBARAZADAS
 FORMULARIO DE CONSENTIMIENTO INFORMADO PARA MUJERES CON POSIBILIDAD DE QUEDAR EMBARAZADAS Lenalinova (Lenalidomida) puede ser perjudicial para el feto. nacimiento graves que pueden poner en peligro la
FORMULARIO DE CONSENTIMIENTO INFORMADO PARA MUJERES CON POSIBILIDAD DE QUEDAR EMBARAZADAS Lenalinova (Lenalidomida) puede ser perjudicial para el feto. nacimiento graves que pueden poner en peligro la
FICHA TÉCNICA. 1) NOMBRE DEL MEDICAMENTO ARKOCAPSULAS RAÍZ DE ORTIGA 290 mg cápsulas duras
 ARKOCAPSULAS RAÍZ DE ORTIGA FICHA TÉCNICA 1) NOMBRE DEL MEDICAMENTO ARKOCAPSULAS RAÍZ DE ORTIGA 290 mg cápsulas duras 2) COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Cápsula dura de hipromelosa
ARKOCAPSULAS RAÍZ DE ORTIGA FICHA TÉCNICA 1) NOMBRE DEL MEDICAMENTO ARKOCAPSULAS RAÍZ DE ORTIGA 290 mg cápsulas duras 2) COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Cápsula dura de hipromelosa
DALMARELIN, 25 microgramos/ml solución inyectable para bovino y conejos. Principio activo: Lecirelina acetato equivalente a lecirelina
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DALMARELIN, 25 microgramos/ml solución inyectable para bovino y conejos. 2.
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DALMARELIN, 25 microgramos/ml solución inyectable para bovino y conejos. 2.
Prospecto: información para el usuario. Citicolina FERRER 100 mg/ml solución oral EFG
 Prospecto: información para el usuario Citicolina FERRER 100 mg/ml solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
Prospecto: información para el usuario Citicolina FERRER 100 mg/ml solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
Traducción no oficial del prospecto en alemán
 Traducción no oficial del prospecto en alemán Prospecto: información para el paciente Información para usuarios Medivitan iv Jeringa Precargada 5 mg, 1 mg, 1,05 mg solución inyectable Principios activos:
Traducción no oficial del prospecto en alemán Prospecto: información para el paciente Información para usuarios Medivitan iv Jeringa Precargada 5 mg, 1 mg, 1,05 mg solución inyectable Principios activos:
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SUVAXYN M. HYO-PARASUIS, suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancias activas:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SUVAXYN M. HYO-PARASUIS, suspensión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancias activas:
Prospecto: Información para el paciente. LacTEST 0,45 g polvo para solución oral Gaxilosa
 Prospecto: Información para el paciente LacTEST 0,45 g polvo para solución oral Gaxilosa Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su
Prospecto: Información para el paciente LacTEST 0,45 g polvo para solución oral Gaxilosa Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su
Informe de Agomelatina
 Informe de Agomelatina La Agomelatina se utiliza para tratar la depresión mayor en adultos. La depresión mayor es una condición en la cual los pacientes tienen trastornos del estado de ánimo que interfieren
Informe de Agomelatina La Agomelatina se utiliza para tratar la depresión mayor en adultos. La depresión mayor es una condición en la cual los pacientes tienen trastornos del estado de ánimo que interfieren
