Julio Estimado profesional sanitario: Resumen
|
|
|
- Lourdes Villalba Soler
- hace 5 años
- Vistas:
Transcripción
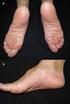
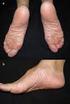
1 Comunicación para profesionales sanitarios Valproato ( Depakine / Depakine Crono, Ácido Valproico GES ): Nuevas restricciones de uso; puesta en práctica del Programa de Prevención de Embarazos. Julio 2018 Estimado profesional sanitario: Le enviamos esta carta de acuerdo con la Agencia Europea de Medicamentos (EMA) y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) para informarle de las nuevas e importantes contraindicaciones, advertencias de uso y medidas para evitar la exposición a valproato durante el embarazo. Resumen Valproato no debe utilizarse en niñas ni en mujeres con capacidad para concebir, salvo que los demás tratamientos no sean eÿcaces o no se toleren. Los niños expuestos a valproato en el útero presentan un alto riesgo de sufrir trastornos graves del desarrollo (hasta un % de los casos) y malformaciones congénitas (aproximadamente en el 10 % de los casos). Se han establecido nuevas contraindicaciones para el uso de valproato durante el embarazo y en mujeres con capacidad para concebir: En la epilepsia Valproato está contraindicado durante el embarazo, salvo que no se disponga de tratamiento alternativo adecuado. Valproato está contraindicado en mujeres con capacidad para concebir, excepto que se cumplan las condiciones del Programa de Prevención de Embarazos (que se describen a continuación). En el trastorno bipolar Valproato está contraindicado durante el embarazo. Valproato está contraindicado en mujeres con capacidad para concebir, exceptuando a las que cumplan las condiciones del Programa de Prevención de Embarazos (que se describen a continuación). En las mujeres con capacidad para concebir que actualmente estén tomando valproato puede ser necesario reevaluar el tratamiento para decidir si se cumplen las condiciones del Programa de Prevención de Embarazos (que se describen a continuación). 1.
2 Elementos clave del Programa de prevención del embarazo: El médico que prescriba este medicamento debe garantizar que: Se evalúan las circunstancias individuales en cada caso, implicando a la paciente en la discusión, para garantizar su compromiso, discutir las opciones terapéuticas y asegurar que comprende los riesgos y las medidas necesarias para minimizarlos. Se evalúa la posibilidad de embarazo en todas las pacientes. La paciente ha entendido y conoce los riesgos de malformaciones congénitas y trastornos del desarrollo neurológico para los niños expuestos a valproato en el útero, así como la magnitud de estos riesgos. La paciente entiende la necesidad de someterse a pruebas de embarazo antes del inicio del tratamiento, y durante el mismo según se considere necesario. Se asesora a la paciente sobre métodos anticonceptivos; la paciente está capacitada para cumplir con el uso de métodos anticonceptivos eÿcaces de manera ininterrumpida durante todo el tratamiento con valproato. La paciente entiende la necesidad de una revisión periódica (al menos una vez al año) del tratamiento por parte de un especialista con experiencia en el tratamiento de la epilepsia o del trastorno bipolar. La paciente entiende la necesidad de visitar a su médico tan pronto como planee o esté planeando un embarazo, para garantizar un diálogo temprano y cambiar a un tratamiento alternativo antes de la interrupción del uso de métodos anticonceptivos y de la concepción. La paciente entiende la necesidad de visitar con carácter urgente a su médico en caso de embarazo. La paciente ha recibido la guía del paciente. La paciente ha reconocido que entiende los riesgos y las precauciones necesarias asociadas al uso de valproato. La paciente ÿrma el Formulario Anual de Conocimiento de Riesgos que ha de ser incluido en su historia clínica. Estas condiciones también afectan a las mujeres no sexualmente activas a menos que el médico prescriptor considere que existen razones convincentes para indicar que no hay riesgo de embarazo. En el anexo a esta carta se proporcionan instrucciones más detalladas relacionadas con los siguientes aspectos: el uso de valproato en niñas, la necesidad de descartar un embarazo antes del inicio del tratamiento con valproato, el uso de métodos anticonceptivos eÿcaces, la revisión anual del tratamiento por parte de un especialista, el uso del Formulario Anual de Conocimiento de Riesgos (en el momento del inicio del tratamiento y durante la revisión del mismo, al menos una vez al año), qué hacer con respecto al tratamiento con valproato en el momento de planear un embarazo y durante el mismo La información del producto (ÿcha técnica y prospecto) se actualizará con esta información y nuevas condiciones de uso. Esta información también está disponible mediante los materiales informativos de seguridad de Depakine/Depakine Crono, de los cuales se pueden conseguir ejemplares adicionales a través del Departamento de Farmacovigilancia de Sanoÿ y en la página web de la AEMPS: Se recomienda a los neurólogos que participen en el registro europeo EURAP (European Registry of Antiepileptic Drugs and Pregnancy, Ello permitirá obtener un mejor conocimiento de los riesgos asociados con antiepilépticos cuando se utilizan durante el embarazo. 2.
3 Material informativo sobre seguridad (información sobre prevención de riesgos) Para ayudar a los profesionales sanitarios y a las pacientes a evitar la exposición a valproato durante el embarazo, se dispondrá de una tarjeta de información para la paciente (en el exterior de las cajas de Depakine/Depakine Crono), una guía de la paciente, un formulario anual de conocimiento de riesgos y una guía para médicos, farmacéuticos y otros profesionales sanitarios implicados en la atención a mujeres con capacidad para concebir que utilizan valproato. Estos materiales se elaboran para informar a los profesionales sanitarios y a las pacientes o a sus cuidadores sobre los riesgos del valproato y las condiciones de uso. La guía de la paciente y la tarjeta de la paciente se deben proporcionar a todas las mujeres con capacidad para concebir que estén tomando valproato. Es necesario que el especialista utilice un formulario anual de conocimiento de riesgos en el momento del inicio del tratamiento y durante cada revisión anual. Este formulario ha de ser ÿrmado por la paciente y médico prescriptor y ha de guardarse en la historia clínica. Antecedentes sobre este asunto En 2014, las advertencias y restricciones del uso de valproato en mujeres y niñas fueron reforzadas, para minimizar el riesgo de malformaciones y los problemas de desarrollo en niños expuestos a valproato en el útero. El Comité de Evaluación de Riesgos en Farmacovigilancia europeo de la EMA (Pharmacovigilance Risk Assessment Committee, PRAC), ha revisado recientemente el impacto de estas medidas debido a la preocupación de que estas no hayan sido lo suÿcientemente eÿcaces para aumentar la concienciación y reducir el uso de valproato durante el embarazo de manera apropiada. El PRAC ha concluido que esta preocupación estaba fundamentada y, por tanto, ha introducido nuevas medidas. Riesgo de desenlace anormal del embarazo Valproato está asociado a un riesgo, dependiente de la dosis, de desenlace anómalo del embarazo, ya sea en monoterapia o asociado con otros medicamentos. Los datos indican que, el uso de valproato asociado con otros antiepilépticos, incrementa el riesgo de desenlace anómalo del embarazo en mayor medida que el uso de valproato en monoterapia. Cuando el valproato se administra en monoterapia: El riesgo de malformaciones congénitas es de aproximadamente el 10 % en los niños expuestos en el útero. Los estudios realizados en niños en edad preescolar expuestos a valproato en el útero muestran que hasta el % experimentan retrasos en el desarrollo temprano, como en el habla y la marcha, tienen una capacidad intelectual baja, aptitudes lingüísticas deÿcientes y problemas de memoria. 1,2,3,4,5 El coeÿciente intelectual (CI) medido en un estudio realizado en niños de 6 años con exposición a valproato en el útero fue en promedio de 7-10 puntos por debajo del de niños expuestos a otros antiepilépticos. 6 Los datos disponibles muestran que los niños expuestos a valproato en el útero presentan un mayor riesgo de padecer alteraciones del espectro autista (aproximadamente tres veces más) y autismo infantil (aproximadamente cinco veces más) en comparación con la población general 7. Existen datos limitados que sugieren que los niños expuestos a valproato en el útero pueden tener mayor tendencia a desarrollar síntomas del trastorno de déÿcit de atención e hiperactividad (TDAH). 5 Notiÿcación de sospechas de reacciones adversas Se recuerda la importancia de notiÿcar las sospechas de reacciones adversas al Centro Autonómico de Farmacovigiliancia correspondiente mediante el sistema de tarjeta amarilla: ( o a través del formulario electrónico disponible en Adicionalmente también se pueden notiÿcar al Departamento de Farmacovigilancia de Sanoÿ y de GES en los datos de contacto indicados más abajo. 3.
4 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notiÿcar las sospechas de reacciones adversas. Ver la sección 4.8 de la ÿcha técnica, en la que se incluye información sobre cómo notiÿcarlas Información adicional Si necesita información adicional o desea cualquier aclaración, por favor contacte con el Departamento de Farmacovigilancia de Sanoÿ y de GES en los datos de contacto indicados más abajo. Xavier Marfà Carmen Cortina Responsable de Farmacovigilancia Sanoÿ Responsable de Farmacovigilancia de GES/Genfarma Teléfono de contacto: Teléfono de contacto: Correo electrónico: ES-FARMACOVIGILANCIA@sanoÿ.com Correo electrónico: farmacovigilancia@genfarma.es Anexo Información adicional sobre el Programa de Prevención de Embarazos La siguiente información deberá leerse junto con las condiciones del Programa de Prevención de Embarazos que se describen en la carta anterior, también se incluirá en las ÿchas técnicas del fármaco una vez actualizadas. Niñas No debe prescribirse valproato a niñas (ni a mujeres con capacidad para concebir), salvo que no se disponga de tratamiento alternativo adecuado. Los médicos que prescriban valproato deben garantizar que los progenitores o los cuidadores de las niñas entienden la necesidad de contactar con el especialista una vez que la niña presente la menarquia. El médico que prescriba este medicamento, debe garantizar que se proporciona a los progenitores o a los cuidadores de las niñas que han presentado la menarquía, una información completa sobre los riesgos de malformaciones congénitas y trastornos del desarrollo neurológico, incluyendo la magnitud de estos riesgos en los niños expuestos a valproato en el útero. En las pacientes que presenten la menarquia, el especialista deberá reevaluar la necesidad del tratamiento con valproato una vez al año y considerar opciones de tratamiento alternativas. Si el valproato es el único tratamiento adecuado, deberá discutirse la necesidad de utilizar un método anticonceptivo eÿcaz así como todas las demás condiciones del Programa de prevención de embarazos. El especialista hará todo lo posible por cambiar a las niñas a un tratamiento alternativo antes de llegar a la edad adulta. Prueba de embarazo Debe descartarse el embarazo antes de iniciar el tratamiento con valproato. No debe iniciarse el tratamiento con valproato en mujeres con capacidad para concebir sin un resultado negativo en la prueba de embarazo (prueba de embarazo en plasma), conÿrmado por un profesional sanitario, para evitar su uso involuntario durante el embarazo. 4.
5 Métodos anticonceptivos Las mujeres con capacidad para concebir, a las que se ha prescrito valproato, deberán utilizar un método anticonceptivo eÿcaz de manera ininterrumpida durante todo el tratamiento. Se proporcionará a estas pacientes información completa sobre la prevención del embarazo y serán derivadas para obtener asesoramiento sobre métodos anticonceptivos eÿcaces en caso necesario. Se utilizará al menos un método anticonceptivo eÿcaz (preferiblemente una forma de uso independiente de la usuaria, como el dispositivo intrauterino o el implante) o dos métodos anticonceptivos complementarios que incluyan un método de barrera. En cada caso se evaluarán las circunstancias individuales y se involucrará a la paciente en la discusión sobre la elección del método anticonceptivo, para garantizar su compromiso y cumplimiento con las medidas elegidas. Incluso si presenta amenorrea, debe seguir todos los consejos sobre anticoncepción eÿcaz. Revisiones anuales del tratamiento por parte de un especialista El especialista revisará al menos una vez al año si el valproato es el tratamiento más adecuado para la paciente. El especialista deberá discutir el Formulario Anual de Conocimiento de Riesgos, al inicio y durante cada revisión anual y asegurarse de que la paciente ha entendido su contenido. Planiÿcación de un embarazo En el caso de la indicación de epilepsia, si una mujer tiene previsto quedarse embarazada, un especialista con experiencia en el tratamiento de la epilepsia deberá reevaluar el tratamiento con valproato y considerar opciones de tratamiento alternativas. Se hará lo posible por cambiar a un tratamiento alternativo adecuado antes de la interrupción del uso de métodos anticonceptivos y concepción. Si el cambio no es posible, la mujer recibirá asesoramiento adicional con respecto a los riesgos del valproato en el feto como apoyo a la toma de una decisión informada sobre planiÿcación familiar. En el caso de la indicación de trastorno bipolar, si una mujer está planeando quedarse embarazada deberá visitar a un especialista con experiencia en el tratamiento del trastorno bipolar y, se interrumpirá o, si es necesario, se cambiará a un tratamiento alternativo antes de la interrupción del uso de métodos anticonceptivos y concepción. En caso de embarazo Valproato como tratamiento para el trastorno bipolar está contraindicado durante el embarazo. Valproato como tratamiento para la epilepsia está contraindicado en el embarazo, excepto que no se disponga de tratamiento alternativo adecuado. Si una mujer que está tomando valproato se queda embarazada, deberá ser remitida de inmediato a un especialista para la reevaluación del tratamiento con valproato y la consideración de opciones de tratamiento alternativas. Durante el embarazo, las crisis tonicoclónicas maternas y el estatus epilépticus con hipoxia materno pueden suponer un riesgo particular de muerte para la madre y el feto. Si, a pesar de los riesgos conocidos del valproato en el embarazo y tras una cuidadosa consideración del tratamiento alternativo, en circunstancias excepcionales, la mujer embarazada debe recibir valproato para la epilepsia, se recomienda: Usar la dosis eÿcaz más baja y dividir la dosis diaria de valproato en varias dosis pequeñas que se tomarán a lo largo del día. Puede ser preferible el uso de una formulación de liberación prolongada a otras formulaciones de tratamiento para evitar picos elevados de concentración en plasma. 5.
6 Todas las pacientes con exposición a valproato durante el embarazo y sus parejas deben ser remitidas a un especialista con experiencia en teratología para la evaluación y el asesoramiento sobre el embarazo expuesto. Debe iniciarse una monitorización prenatal especializada para detectar la posible aparición de defectos congénitos del tubo neural u otras malformaciones. Previamente al embarazo, los suplementos de folato pueden disminuir el riesgo de defectos del tubo neural que pueden producirse en todos los embarazos. Sin embargo, las evidencias disponibles no sugieren que impida los defectos congénitos o las malformaciones debidas a la exposición a valproato. El farmacéutico se asegurará de: Suministrar la Tarjeta de Información para la paciente cada vez que se dispense valproato y de que la paciente comprende su contenido. Resaltar los puntos clave de seguridad, incluyendo la necesidad de usar métodos anticonceptivos efectivos. Informar a la paciente de la necesidad de contactar al especialista inmediatamente y de no interrumpir el tratamiento con valproato en caso de planear un embarazo o de que sospeche que pueda estar embarazada. 1 Weston J, Bromley R, Jackson CF, et al. Monotherapy treatment of epilepsy in pregnancy: congenital malformation outcomes in the child. Cochrane Database of Systematic Reviews 2016, Issue 11. Art. No.: CD Bromley RL, et al. Early cognitive development in children born to women with epilepsy: a prospective report. Epilepsia 2010 October; 51(10): CummingsC et al. Neurodevelopment of children exposed in utero to lamotrigine, sodium valproate and carbamazepine. Arch Dis Child 2011;96: Meador K et al. Cognitive Function at 3 years of age after fetal exposure to antiepileptic drugs. NEJM 2009;360(16): Thomas SV et al. Motor and mental development of infants exposed to antiepileptic drugs in utero. Epilepsy and Behaviour 2008 (13): Meador KJ, et al. NEAD Study Group. Fetal antiepileptic drug exposure and cognitive outcomes at age 6 years (NEAD study): a prospective observational study. Lancet Neurol 2013;12(3): Christensen J et al. Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism. JAMA 2013;309(16): Cohen MJ et al. Fetal antiepileptic drug exposure: motor, adaptive and emotional/behavioural functioning at age 3 years. Epilepsy Behav.2011; 22(2):
INFORMACIÓN SOBRE PREVENCIÓN DE RIESGOS:
 Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos sanitarios (AEMPS)_febrero 2015 (Esta información también se encuentra disponible en la web de la
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos sanitarios (AEMPS)_febrero 2015 (Esta información también se encuentra disponible en la web de la
Conclusiones científicas y explicación pormenorizada de las bases científicas de las diferencias con respecto a la recomendación del PRAC
 Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización sujetas a condiciones y explicación pormenorizada de las bases científicas de
Anexo II Conclusiones científicas y motivos para la modificación de los términos de las autorizaciones de comercialización sujetas a condiciones y explicación pormenorizada de las bases científicas de
Anexo III. Modificaciones a las secciones relevantes de la información del producto
 Anexo III Modificaciones a las secciones relevantes de la información del producto Nota: Estas modificaciones a las secciones relevantes del Resumen de las Características del Producto y el prospecto son
Anexo III Modificaciones a las secciones relevantes de la información del producto Nota: Estas modificaciones a las secciones relevantes del Resumen de las Características del Producto y el prospecto son
Riesgos del uso de valproato
 Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018 GUÍA PARA PROFESIONALES SANITARIOS Riesgos del uso de valproato ( Depakine/
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018 GUÍA PARA PROFESIONALES SANITARIOS Riesgos del uso de valproato ( Depakine/
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018
 Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018 GUÍA DE LA PACIENTE VALPROATO ( DEPAKINE / DEPAKINE CRONO ): MEDIDAS
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) junio 2018 GUÍA DE LA PACIENTE VALPROATO ( DEPAKINE / DEPAKINE CRONO ): MEDIDAS
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
 ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
Anexo III. Modificaciones a las secciones relevantes del resumen de las características del producto y de los prospectos
 Anexo III Modificaciones a las secciones relevantes del resumen de las características del producto y de los prospectos Nota: Estas modificaciones a las secciones relevantes del Resumen de las Características
Anexo III Modificaciones a las secciones relevantes del resumen de las características del producto y de los prospectos Nota: Estas modificaciones a las secciones relevantes del Resumen de las Características
Toctino (alitretinoína)
 1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Toctino (alitretinoína)
 1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 GUÍA PARA EL PACIENTE Información importante de seguridad para la paciente a tratamiento con PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 [ D] Guía del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
[ D] Guía del Dermatólogo PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), junio 2015 Disponible en
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), junio 2015 Disponible en
Restricciones de dispensación para isotretinoína
 Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO
 ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
ANEXO III MODIFICACIONES AL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y AL PROSPECTO Estas modificaciones del SPC (ficha técnica) y prospecto entran en vigor en el momento de la Decisión de la Comisión.
Comunicación dirigida a Profesionales Sanitarios
 Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
Comunicación dirigida a Profesionales Sanitarios Julio de 2015 XGEVA (denosumab): medidas establecidas para minimizar el riesgo de osteonecrosis mandibular Estimado Profesional Sanitario, Amgen S.A. de
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS. Esther Salgueiro 10, 17 de Marzo de 2015
 FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
LEFLUNOMIDA. Información sobre seguridad para los profesionales sanitarios
 LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
LEFLUNOMIDA Información sobre seguridad para los profesionales sanitarios Leflunomida es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos
Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII)
 Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII) Puede consultar esta información en formato PDF COMUNICACIÓN SOBRE RIESGOS DE MEDICAMENTOS
Inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARAII) Puede consultar esta información en formato PDF COMUNICACIÓN SOBRE RIESGOS DE MEDICAMENTOS
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA
 Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
Información importante para el profesional sanitario sobre el tratamiento con LADEVINA INTRODUCCION LADEVINA es un fármaco inmunomodulador. Estudios clínicos fase III, mostraron que en pacientes pretratados
Valdoxan /Thymanax (agomelatina)
 Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
Valdoxan /Thymanax (agomelatina) Información de seguridad para profesionales sanitarios Recomendaciones sobre cómo realizar el control de la función hepática del paciente Información sobre prevención de
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACFOL 5MG COMPRIMIDOS ÁCIDO FÓLICO
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ACFOL 5MG COMPRIMIDOS ÁCIDO FÓLICO Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto ya que puede tener que volver
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACFOL 5MG COMPRIMIDOS ÁCIDO FÓLICO Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto ya que puede tener que volver
Anexo III Enmiendas a las secciones relevantes de la información del producto
 Anexo III Enmiendas a las secciones relevantes de la información del producto Nota: Estas enmiendas a las secciones relevantes de la información del producto son el resultado de un procedimiento de arbitraje.
Anexo III Enmiendas a las secciones relevantes de la información del producto Nota: Estas enmiendas a las secciones relevantes de la información del producto son el resultado de un procedimiento de arbitraje.
FORMULARIO DE CONSENTIMIENTO INFORMADO PARA MUJERES CON POSIBILIDAD DE QUEDAR EMBARAZADAS
 FORMULARIO DE CONSENTIMIENTO INFORMADO PARA MUJERES CON POSIBILIDAD DE QUEDAR EMBARAZADAS Lenalinova (Lenalidomida) puede ser perjudicial para el feto. nacimiento graves que pueden poner en peligro la
FORMULARIO DE CONSENTIMIENTO INFORMADO PARA MUJERES CON POSIBILIDAD DE QUEDAR EMBARAZADAS Lenalinova (Lenalidomida) puede ser perjudicial para el feto. nacimiento graves que pueden poner en peligro la
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO
 TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
TIOCOLCHICÓSIDO ( ADALGUR ): INFORMACIÓN IMPORTANTE CON RESPECTO A LAS INDICACIONES, DOSIFICACIÓN, CONTRAINDICACIONES Y PRECAUCIONES DE USO Estimado profesional sanitario, Febrero 2014 Teofarma S.r.l,
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS INZITAN (DEXAMETASONA, TIAMINA, CIANOCOBALAMINA, LIDOCAÍNA): SUSPENSIÓN DE COMERCIALIZACIÓN Fecha de publicación: 30 de noviembre
farmacéutico Instanyl (Fentanilo) Informacion sobre seguridad para el INSTANYL SOLUCIÓN PARA PULVERIZACIÓN NASAL
 Instanyl (Fentanilo) Informacion sobre seguridad para el farmacéutico EN ENVASE UNIDOSIS Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
Instanyl (Fentanilo) Informacion sobre seguridad para el farmacéutico EN ENVASE UNIDOSIS Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS
 Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
Stelara (ustekinumab) INFORMACIÓN DE SEGURIDAD PARA PROFESIONALES SANITARIOS Por favor, además de la ficha técnica del producto (FT) lea detenidamente esta guía. Por favor, informe a sus pacientes sobre
INFORMACIÓN IMPORTANTE PARA EL PACIENTE
 Si experimenta cualquier po de efecto adverso, consulte a su médico o farmacéu co, incluso si se trata de posibles efectos adveros que no aparecen en el prospecto. También puede comunicarlos directamente
Si experimenta cualquier po de efecto adverso, consulte a su médico o farmacéu co, incluso si se trata de posibles efectos adveros que no aparecen en el prospecto. También puede comunicarlos directamente
Comunicación dirigida a profesionales sanitarios
 Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
Comunicación dirigida a profesionales sanitarios Tecfidera (dimetilfumarato): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Intensificación de las medidas
CÓMO PODEMOS APOYAR A UN ESCOLAR CON EPILEPSIA
 CÓMO PODEMOS APOYAR A UN ESCOLAR CON EPILEPSIA ENFOQUE DESDE LA PRÁCTICA NEUROLÓGICA DR. PATRICIO GUERRA NEURÓLOGO INFANTIL Y ADOLESCENTES MAGÍSTER NEUROCIENCIAS CLÍNICA UNIVERSITARIA PUERTO MONTT - CLÍNICA
CÓMO PODEMOS APOYAR A UN ESCOLAR CON EPILEPSIA ENFOQUE DESDE LA PRÁCTICA NEUROLÓGICA DR. PATRICIO GUERRA NEURÓLOGO INFANTIL Y ADOLESCENTES MAGÍSTER NEUROCIENCIAS CLÍNICA UNIVERSITARIA PUERTO MONTT - CLÍNICA
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Toctino (alitretinoína)
 1 PROGRAMA DE PREVENCIÓN DEL EMBARAZO Información sobre la anticoncepción PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
1 PROGRAMA DE PREVENCIÓN DEL EMBARAZO Información sobre la anticoncepción PARA LA PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 FORMULARIO PARA LA NOTIFICACIÓN DE EMBARAZOS PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos
FORMULARIO PARA LA NOTIFICACIÓN DE EMBARAZOS PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos
Anexo III. Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto
 Anexo III Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto Nota: Esta Ficha Técnica, Etiquetado y Prospecto son el resultado del proceso de arbitraje.
Anexo III Correcciones a las secciones relevantes del resumen de las características del producto y del prospecto Nota: Esta Ficha Técnica, Etiquetado y Prospecto son el resultado del proceso de arbitraje.
La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos.
 Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
Pág. 1 de 5 La Drospirenona como principio activo en Anticonceptivos orales y riesgo de Eventos Tromboembólicos. El objetivo es difundir información sobre la seguridad y eficacia de los medicamentos basados
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS PROBLEMA DE SUMINISTRO DE THEOLAIR (TEOFILINA ANHIDRA) 250mg COMPRIMIDOS DE LIBERACIÓN PROLONGADA Fecha de publicación: 15
Resumen. Teratogenicidad. Trastornos neuropsiquiátricos. 19 de septiembre de Estimado Profesional Sanitario:
 19 de septiembre de 2018 Retinoides ( Acitretina, Adapaleno, Alitretinoína, Bexaroteno, Isotretinoína, Tazaroteno y Tretinoína): Actualización de los efectos teratogénicos y trastornos neuropsiquiátricos
19 de septiembre de 2018 Retinoides ( Acitretina, Adapaleno, Alitretinoína, Bexaroteno, Isotretinoína, Tazaroteno y Tretinoína): Actualización de los efectos teratogénicos y trastornos neuropsiquiátricos
Anexo III. Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto
 Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
Anexo III Modificaciones de las secciones relevantes del Resumen de las características del producto y prospecto Nota: Este resumen de las características del producto y prospecto son el resultado del
INSTRUCCIONES PARA EL USO DE LA GUÍA
 INSTRUCCIONES PARA EL USO DE LA GUÍA La presente Guía pretende ser una herramienta de consulta rápida para el médico prescriptor y otros profesionales sanitarios. Para su correcta interpretación deben
INSTRUCCIONES PARA EL USO DE LA GUÍA La presente Guía pretende ser una herramienta de consulta rápida para el médico prescriptor y otros profesionales sanitarios. Para su correcta interpretación deben
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib)
 Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Cuadernillo destinado a aquellos pacientes a quienes se les haya prescrito tratamiento con XALKORI (crizotinib) Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
MANUAL DE USUARIO INSTRUCCIONES PARA REPORTE ONLINE DE EVENTOS ADVERSOS
 MANUAL DE USUARIO INSTRUCCIONES PARA REPORTE ONLINE DE EVENTOS ADVERSOS Este formato puede ser usado por profesionales de la salud para el reporte de eventos adversos, fallas terapéuticas, problemas de
MANUAL DE USUARIO INSTRUCCIONES PARA REPORTE ONLINE DE EVENTOS ADVERSOS Este formato puede ser usado por profesionales de la salud para el reporte de eventos adversos, fallas terapéuticas, problemas de
Clasificación de las crisis epilépticas para la programación terapéutica Farmacocinética de los fármacos antiepilépticos...
 Índice Parte 1 - Bases para la terapéutica con fármacos antiepilépticos Clasificación de las crisis epilépticas para la programación terapéutica... 19 Clasificación de las Crisis Epilépticas (1981)...
Índice Parte 1 - Bases para la terapéutica con fármacos antiepilépticos Clasificación de las crisis epilépticas para la programación terapéutica... 19 Clasificación de las Crisis Epilépticas (1981)...
Anexo III. Modificaciones en las secciones relevantes de la información del producto
 Anexo III Modificaciones en las secciones relevantes de la información del producto Nota: Estas modificaciones de las secciones relevantes de la Ficha Técnica y Prospecto son el resultado del proceso de
Anexo III Modificaciones en las secciones relevantes de la información del producto Nota: Estas modificaciones de las secciones relevantes de la Ficha Técnica y Prospecto son el resultado del proceso de
ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto
 ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto Nota: Si procede, la ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados
ANEXO III Modificaciones a las secciones relevantes de Ficha Técnica y Prospecto Nota: Si procede, la ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 62 Conclusiones científicas El 8 de marzo de 2017, Francia inició un procedimiento de conformidad con el artículo 31 de la Directiva 2001/83/CE y solicitó al PRAC que
Anexo II Conclusiones científicas 62 Conclusiones científicas El 8 de marzo de 2017, Francia inició un procedimiento de conformidad con el artículo 31 de la Directiva 2001/83/CE y solicitó al PRAC que
Anexo III. Modificaciones a las secciones relevantes de ficha técnica y prospecto
 Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
Anexo III Modificaciones a las secciones relevantes de ficha técnica y prospecto Nota: La ficha técnica o resumen de las características del producto y el prospecto pueden necesitar ser actualizados posteriormente
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
valproico y embarazo un problema para la reflexión índice farmacoterapéutica de Navarra Introducción
 Boletín de información farmacoterapéutica de Navarra AÑO 2018 VOLUMEN 25, Nº 1 www.bit.navarra.es @BITNavarra.es 1993-2018 VEINTICINCO AÑOS DE INFORMACIÓN INDEPENDIENTE valproico y embarazo un problema
Boletín de información farmacoterapéutica de Navarra AÑO 2018 VOLUMEN 25, Nº 1 www.bit.navarra.es @BITNavarra.es 1993-2018 VEINTICINCO AÑOS DE INFORMACIÓN INDEPENDIENTE valproico y embarazo un problema
A NEONATE WITH DYSMORPHIC FACIAL FEATURES. Dr. Salvador Rodríguez Becerra.
 A NEONATE WITH DYSMORPHIC FACIAL FEATURES Dr. Salvador Rodríguez Becerra. Una mujer de 29 años de edad, ha tenido un niño con dismorfias faciales. El niño nació de término por cesárea. La madre tiene antecedente
A NEONATE WITH DYSMORPHIC FACIAL FEATURES Dr. Salvador Rodríguez Becerra. Una mujer de 29 años de edad, ha tenido un niño con dismorfias faciales. El niño nació de término por cesárea. La madre tiene antecedente
Guía de aprendizaje. Involucrar a las mujeres y los ensayos clínicos sobre VIH
 Guía de aprendizaje Involucrar a las mujeres y los ensayos clínicos sobre VIH Women for Positive Action está patrocinado por un subsidio de Abbott International 22/09/2009 Esta guía de aprendizaje se ha
Guía de aprendizaje Involucrar a las mujeres y los ensayos clínicos sobre VIH Women for Positive Action está patrocinado por un subsidio de Abbott International 22/09/2009 Esta guía de aprendizaje se ha
Anexo IV. Conclusiones científicas
 Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
Anexo IV Conclusiones científicas 1 Conclusiones científicas Se han notificado cuatro casos de lesión hepática grave que condujo a un trasplante hepático desde la autorización de comercialización de Esmya.
Notificación de acontecimientos adversos en Ensayos clínicos. 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica.
 Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
Notificación de acontecimientos adversos en Ensayos clínicos 08/Abril/2015 Dra. Elizabeth Barreto Quiñones Farmacóloga Clínica. ÍNDICE Definiciones Farmacovigilancia Acontecimiento adverso (AA) Reacción
UNIDAD DE SEGURIDAD DEL PACIENTE
 Página 1 de 5 DE: UNIDAD DE (USP) DIRIGIDA A: FACULTATIVOS ESPECIALISTAS Y PERSONAL DE ENFERMERÍA DEL ÁREA DE SALUD DE IBIZA Y FORMENTERA 1. ASUNTO: Prevención de errores durante la administración de medicamentos.
Página 1 de 5 DE: UNIDAD DE (USP) DIRIGIDA A: FACULTATIVOS ESPECIALISTAS Y PERSONAL DE ENFERMERÍA DEL ÁREA DE SALUD DE IBIZA Y FORMENTERA 1. ASUNTO: Prevención de errores durante la administración de medicamentos.
CINFAMUCOL ACETILCISTEÍNA 200mg
 CINFAMUCOL ACETILCISTEÍNA 200mg PROSPECTO Acetilcisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. - Conserve este
CINFAMUCOL ACETILCISTEÍNA 200mg PROSPECTO Acetilcisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. - Conserve este
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Suero Fisiológico Braun 0,9% Disolvente para uso parenteral Cloruro de sodio
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Braun 0,9% Disolvente para uso parenteral Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Braun 0,9% Disolvente para uso parenteral Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España
 Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
Capítulo 10 SEGURIDAD VACUNAL Y VIGILANCIA DE EFECTOS ADVERSOS DE LA VACUNACIÓN
 Capítulo 10 SEGURIDAD VACUNAL Y VIGILANCIA DE EFECTOS ADVERSOS DE LA VACUNACIÓN 10.1. EFECTOS ADVERSOS ASOCIADOS A LAS VACUNAS Las vacunas son productos biológicos compuestos por antígeno/s (único o múltiples)
Capítulo 10 SEGURIDAD VACUNAL Y VIGILANCIA DE EFECTOS ADVERSOS DE LA VACUNACIÓN 10.1. EFECTOS ADVERSOS ASOCIADOS A LAS VACUNAS Las vacunas son productos biológicos compuestos por antígeno/s (único o múltiples)
Farmacología de la epilepsia
 Introducción Farmacología de la epilepsia Enfermedad crónica, con presencia de episodios críticos recurrentes (crisis epilépticas) muchas veces convulsivos, de duración variable Afecta al 0,5-1% de la
Introducción Farmacología de la epilepsia Enfermedad crónica, con presencia de episodios críticos recurrentes (crisis epilépticas) muchas veces convulsivos, de duración variable Afecta al 0,5-1% de la
UTILIZACIÓN DE ANTIEPILÉPTICOS EN ESPAÑA ( ) *
 UTILIZACIÓN DE ANTIEPILÉPTICOS EN ESPAÑA (1992-2006) * Introducción La epilepsia afecta en nuestro país aproximadamente a 4-10 de cada 1.000 personas 1,2, presentándose entre 26 y 70 nuevos casos por cada
UTILIZACIÓN DE ANTIEPILÉPTICOS EN ESPAÑA (1992-2006) * Introducción La epilepsia afecta en nuestro país aproximadamente a 4-10 de cada 1.000 personas 1,2, presentándose entre 26 y 70 nuevos casos por cada
Comunicación dirigida a profesionales sanitarios
 Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
Julio 2013 Comunicación dirigida a profesionales sanitarios Diclofenaco nuevas contraindicaciones y advertencias tras la revisión europea de su seguridad cardiovascular Estimado profesional sanitario,
SERVIZO DE INFORMACIÓN PARA PROFESIONAIS SANITARIOS SOBRE EFECTOS TERATOXÉNICOS DE MEDICAMENTOS E EXPOSICIÓNS AMBIENTAIS DE RISCO
 SERVIZO DE INFORMACIÓN PARA PROFESIONAIS SANITARIOS SOBRE EFECTOS TERATOXÉNICOS DE MEDICAMENTOS E EXPOSICIÓNS AMBIENTAIS DE RISCO Dirección xeral de Asistencia Sanitaria Subdirección xeral de Planificación
SERVIZO DE INFORMACIÓN PARA PROFESIONAIS SANITARIOS SOBRE EFECTOS TERATOXÉNICOS DE MEDICAMENTOS E EXPOSICIÓNS AMBIENTAIS DE RISCO Dirección xeral de Asistencia Sanitaria Subdirección xeral de Planificación
QUÉ HACER CUANDO SUFRES UNA REACCIÓN ADVERSA A UN MEDICAMENTO (RAM)?
 QUÉ HACER CUANDO SUFRES UNA REACCIÓN ADVERSA A UN MEDICAMENTO (RAM)? Sabes qué es una reacción adversa a un medicamento? (Concepto, Estadísticas, RAM grave) Cómo actuar cuando sufres una reacción adversa?
QUÉ HACER CUANDO SUFRES UNA REACCIÓN ADVERSA A UN MEDICAMENTO (RAM)? Sabes qué es una reacción adversa a un medicamento? (Concepto, Estadísticas, RAM grave) Cómo actuar cuando sufres una reacción adversa?
Modificaciones de la información de los medicamentos autorizados por procedimiento nacional que contienen: METOTREXATO
 DEPARTAMENTO DE MEDICAMENTOS DE USO HUMANO División de Farmacoepidemiología y Farmacovigilancia Modificaciones de la información de los medicamentos autorizados por procedimiento nacional que contienen:
DEPARTAMENTO DE MEDICAMENTOS DE USO HUMANO División de Farmacoepidemiología y Farmacovigilancia Modificaciones de la información de los medicamentos autorizados por procedimiento nacional que contienen:
Información para pacientes
 Información para pacientes. ( ) Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener. Puede consultar la forma de hacerlo en el prospecto
Información para pacientes. ( ) Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener. Puede consultar la forma de hacerlo en el prospecto
SELECCIÓN DE MEDICAMENTOS Y/O INSUMOS MEDICO- QUIRÚRGICOS
 SELECCIÓN DE MEDICAMENTOS Y/O INSUMOS MEDICO- QUIRÚRGICOS CODIGO: FAR-05-02 VERSION: 0 FECHA: Marzo de 2013 PAGINAS: 5 1. OBJETIVO 1. Asegurar que la Clinica cuente con todos los medicamentos e insumos
SELECCIÓN DE MEDICAMENTOS Y/O INSUMOS MEDICO- QUIRÚRGICOS CODIGO: FAR-05-02 VERSION: 0 FECHA: Marzo de 2013 PAGINAS: 5 1. OBJETIVO 1. Asegurar que la Clinica cuente con todos los medicamentos e insumos
Comunicación para profesionales sanitarios
 30 de Noviembre de 2011 Comunicación para profesionales sanitarios INFORMACIN IMPORTANTE DE SEGURIDAD SOBRE STRATTERA (ATOMOXETINA) Y EL RIESGO DE AUMENTO DE LA PRESIN ARTERIAL Y LA FRECUENCIA CARDIACA
30 de Noviembre de 2011 Comunicación para profesionales sanitarios INFORMACIN IMPORTANTE DE SEGURIDAD SOBRE STRATTERA (ATOMOXETINA) Y EL RIESGO DE AUMENTO DE LA PRESIN ARTERIAL Y LA FRECUENCIA CARDIACA
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL
 MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
TRATAMIENTO DE LA MUJER EN LA EDAD FÉRTIL. Hormonas y epilepsia. Epilepsia catamenial
 CAPÍTULO 23 TRATAMIENTO DE LA MUJER EN LA EDAD FÉRTIL Introducción La epilepsia tiene en la mujer unas implicaciones especiales. Desde hace tiempo se conoce la influencia que ejercen las hormonales sexuales
CAPÍTULO 23 TRATAMIENTO DE LA MUJER EN LA EDAD FÉRTIL Introducción La epilepsia tiene en la mujer unas implicaciones especiales. Desde hace tiempo se conoce la influencia que ejercen las hormonales sexuales
EPILEPSIA EN EL EMBARAZO
 EPILEPSIA EN EL EMBARAZO Seminario de Verano Educación Neurológica Continua Medicina Interna y Neurología Febrero de 2013 PRESENTACIÓN DE DATOS Policlínica de Alto Riesgo Obstétrico: 01/02/10 al 01/10/12
EPILEPSIA EN EL EMBARAZO Seminario de Verano Educación Neurológica Continua Medicina Interna y Neurología Febrero de 2013 PRESENTACIÓN DE DATOS Policlínica de Alto Riesgo Obstétrico: 01/02/10 al 01/10/12
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia. Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional
 Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
FICHA TÉCNICA. 1) NOMBRE DEL MEDICAMENTO ARKOCAPSULAS RAÍZ DE ORTIGA 290 mg cápsulas duras
 ARKOCAPSULAS RAÍZ DE ORTIGA FICHA TÉCNICA 1) NOMBRE DEL MEDICAMENTO ARKOCAPSULAS RAÍZ DE ORTIGA 290 mg cápsulas duras 2) COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Cápsula dura de hipromelosa
ARKOCAPSULAS RAÍZ DE ORTIGA FICHA TÉCNICA 1) NOMBRE DEL MEDICAMENTO ARKOCAPSULAS RAÍZ DE ORTIGA 290 mg cápsulas duras 2) COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Cápsula dura de hipromelosa
Prospecto: información para el usuario. No use PANFUNGOL 400 mg óvulos. Ketoconazol
 Prospecto: información para el usuario PANFUNGOL 400 mg óvulos Ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Prospecto: información para el usuario PANFUNGOL 400 mg óvulos Ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Conclusiones científicas
 Anexo II Conclusiones científicas y motivos para la revocación o modificación de los términos de las autorizaciones de comercialización y explicación detallada de las diferencias de la recomendación del
Anexo II Conclusiones científicas y motivos para la revocación o modificación de los términos de las autorizaciones de comercialización y explicación detallada de las diferencias de la recomendación del
NorLevo 750 microgramos Comprimidos. Levonorgestrel. Cada comprimido contiene 750 microgramos de levonorgestrel como principio activo.
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico. Este medicamento
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico. Este medicamento
Informe de Agomelatina
 Informe de Agomelatina La Agomelatina se utiliza para tratar la depresión mayor en adultos. La depresión mayor es una condición en la cual los pacientes tienen trastornos del estado de ánimo que interfieren
Informe de Agomelatina La Agomelatina se utiliza para tratar la depresión mayor en adultos. La depresión mayor es una condición en la cual los pacientes tienen trastornos del estado de ánimo que interfieren
SIMETICONA 100 mg- CLORDIAZEPÓXIDO (CLORHIDRATO) 5 mg- METOCLOPRAMIDA (CLORHIDRATO) 5mg CAPSULAS
 SIMETICONA 100 mg- CLORDIAZEPÓXIDO (CLORHIDRATO) 5 mg- METOCLOPRAMIDA (CLORHIDRATO) 5mg CAPSULAS Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante
SIMETICONA 100 mg- CLORDIAZEPÓXIDO (CLORHIDRATO) 5 mg- METOCLOPRAMIDA (CLORHIDRATO) 5mg CAPSULAS Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante
Anexo II. Conclusiones científicas
 Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Anexo II Conclusiones científicas 7 Conclusiones científicas Solu-Medrol 40 mg polvo y disolvente para solución inyectable (en adelante, «Solu-Medrol») contiene metilprednisolona y, como excipiente, lactosa
Prospecto: información para el usuario. VAMIN 14 SIN ELECTROLITOS solución para perfusión Aminoácidos
 Prospecto: información para el usuario VAMIN 14 SIN ELECTROLITOS solución para perfusión Aminoácidos Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información para el usuario VAMIN 14 SIN ELECTROLITOS solución para perfusión Aminoácidos Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Nota mensual. Medicamentos. Marzo. sobre. de Uso Humano y Productos Sanitarios. Medicamentos
 Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro
 Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Noviembre MANUAL DE FARMACOVIGILANCIA PARA PACIENTES
 Noviembre 2017. MANUAL DE FARMACOVIGILANCIA PARA PACIENTES 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37 MANUAL DE FARMACOVIGILANCIA PARA PACIENTES Cuadro 1. Seguridad de fármacos en el embarazo. Clasificación
Noviembre 2017. MANUAL DE FARMACOVIGILANCIA PARA PACIENTES 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37 MANUAL DE FARMACOVIGILANCIA PARA PACIENTES Cuadro 1. Seguridad de fármacos en el embarazo. Clasificación
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Atosiban NORMON 7,5 mg/ ml solución inyectable EFG. Atosiban
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Atosiban NORMON 7,5 mg/ ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información
PROSPECTO: INFORMACIÓN PARA EL USUARIO Atosiban NORMON 7,5 mg/ ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información
Farmacovigilancia. Curso de Diplomado en Sanidad
 Farmacovigilancia Curso de Diplomado en Sanidad 2010 FARMACOVIGILANCIA Conjunto de procedimientos de detección, registro y evaluación de las reacciones adversas, para la determinación de su incidencia,
Farmacovigilancia Curso de Diplomado en Sanidad 2010 FARMACOVIGILANCIA Conjunto de procedimientos de detección, registro y evaluación de las reacciones adversas, para la determinación de su incidencia,
RESOLUCIÓN DE CASOS PRÁCTICOS: ANTIEPILÉPTICOS
 RESOLUCIÓN DE CASOS PRÁCTICOS: ANTIEPILÉPTICOS Mª José Otero López Dolores Santos Buelga Silvia Jiménez Cabrera David García González Eva Mª Saez Fernández Paulo Teixeira Da Silva DEPARTAMENTO DE FARMACIA
RESOLUCIÓN DE CASOS PRÁCTICOS: ANTIEPILÉPTICOS Mª José Otero López Dolores Santos Buelga Silvia Jiménez Cabrera David García González Eva Mª Saez Fernández Paulo Teixeira Da Silva DEPARTAMENTO DE FARMACIA
CONSENTIMIENTO INFORMADO TEST DE ADN LIBRE CIRCULANTE FETAL EN SANGRE MATERNA PARA EL CRIBADO DE TRISOMÍAS 21, 18 Y 13.
 ADENDUM 2 CONSENTIMIENTO INFORMADO TEST DE ADN LIBRE CIRCULANTE FETAL EN SANGRE MATERNA PARA EL CRIBADO DE TRISOMÍAS 21, 18 Y 13. Hoja informativa para realización de la prueba de cribado con ADN libre
ADENDUM 2 CONSENTIMIENTO INFORMADO TEST DE ADN LIBRE CIRCULANTE FETAL EN SANGRE MATERNA PARA EL CRIBADO DE TRISOMÍAS 21, 18 Y 13. Hoja informativa para realización de la prueba de cribado con ADN libre
Información para el cliente para un consentimiento informado ASESORAMIENTO GENÉTICO Y PRUEBAS DE DIAGNÓSTICO PARA DETECTAR DEFECTOS DE NACIMIENTO
 OR 714.922.4100 SB 909.890.5511 Información para el cliente para un consentimiento informado ASESORAMIENTO GENÉTICO Y PRUEBAS DE DIAGNÓSTICO PARA DETECTAR DEFECTOS DE NACIMIENTO Las mujeres, con frecuencia,
OR 714.922.4100 SB 909.890.5511 Información para el cliente para un consentimiento informado ASESORAMIENTO GENÉTICO Y PRUEBAS DE DIAGNÓSTICO PARA DETECTAR DEFECTOS DE NACIMIENTO Las mujeres, con frecuencia,
POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS.
 POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS. Los fármacos biosimilares son fármacos biológicos aprobados por la Agencia Europea del Medicamento (EMA)
POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS. Los fármacos biosimilares son fármacos biológicos aprobados por la Agencia Europea del Medicamento (EMA)
Prospecto: Información para el paciente. LacTEST 0,45 g polvo para solución oral Gaxilosa
 Prospecto: Información para el paciente LacTEST 0,45 g polvo para solución oral Gaxilosa Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su
Prospecto: Información para el paciente LacTEST 0,45 g polvo para solución oral Gaxilosa Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su
Una versión MOATT- estilo tarjeta, de una sola página, MOATT (PDF) también está disponible en la web de la MASCC.
 MOATT V1.2 2/28/17 MOATT MASCC Herramienta de enseñanza para pacientes que reciben medicación oral antineoplásica Esta herramienta de enseñanza ha sido preparada para ayudar a los profesionales de la salud
MOATT V1.2 2/28/17 MOATT MASCC Herramienta de enseñanza para pacientes que reciben medicación oral antineoplásica Esta herramienta de enseñanza ha sido preparada para ayudar a los profesionales de la salud
Atención Farmacéutica
 Atención Farmacéutica a) INTRODUCCIÓN La Atención Farmacéutica es considerada como la actividad práctica esencial del quehacer farmacéutico, lo que se asocia a un interés amplio y creciente por desarrollar
Atención Farmacéutica a) INTRODUCCIÓN La Atención Farmacéutica es considerada como la actividad práctica esencial del quehacer farmacéutico, lo que se asocia a un interés amplio y creciente por desarrollar
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO TERAPÉUTICO C09 AGENTES QUE ACTÚAN SOBRE EL SISTEMA RENINA ANGIOTENSINA
 ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO TERAPÉUTICO C09 AGENTES QUE ACTÚAN SOBRE EL SISTEMA RENINA ANGIOTENSINA CLASIFICACIÓN ATC C09A INHIBIDORES DE LA ECA, MONOFÁRMACOS C09AA - Inhibidores de la ECA,
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO TERAPÉUTICO C09 AGENTES QUE ACTÚAN SOBRE EL SISTEMA RENINA ANGIOTENSINA CLASIFICACIÓN ATC C09A INHIBIDORES DE LA ECA, MONOFÁRMACOS C09AA - Inhibidores de la ECA,
