TEMA 2. ENLACES QUIMICOS
|
|
|
- Carla Valverde Martin
- hace 9 años
- Vistas:
Transcripción
1 TEMA 2. ENLACES QUIMICOS En la naturaleza los átomos que constituyen la materia se encuentran unidos formando moléculas o agrupaciones más complejas. A pesar de ello existen una serie de elementos que si se encuentran en forma de átomos libres en la naturaleza, estos son los que pertenecen al grupo de los gases nobles. Como sabéis los elementos que pertenecen a este grupo tienen completa su capa externa con 8 electrones por lo que tienen la estructura electrónica más estable posible. El resto de los elementos tienden a unirse para tener 8 electrones en su última capa, y obtener la mayor estabilidad posible. Los átomos se enlazan, formando moléculas y compuestos con el fin de adquirir conjuntamente configuraciones electrónicas estables. Un enlace químico lo podemos definir como la fuerza de atracción que mantiene unidos a los átomos en las distintas agrupaciones atómicas. 1. El enlace iónico Existen elementos que para completar su capa externa ganan o pierden electrones para enlazarse con otros átomos o al formar compuestos. Los compuestos iónicos son agrupaciones neutras de cationes y aniones que se mantienen unidos por la atracción entre iones de cargas opuestas. Esto ocurre cuando un elemento metálico se encuentra con un elemento no metálico: el primero cede electrones al segundo, así los dos adquieren cargas de signos opuestos y se atraen. Un buen ejemplo: el cloruro de sodio (NaCl) o la sal de mesa - El Na tiene un electrón en su última capa exterior que si lo pierde se quedaría con 8 electrones en su última capa y con carga positiva porque tendría un protón de más, ya que ha perdido un electrón. Recibe el nombre de catión. - El Cl tiene 7 electrones en su última capa exterior y adquiere el electrón del Na con lo que consigue 8 electrones y carga negativa, ya que tiene más electrones que protones y recibiendo el nombre de anión. - Al tener ambos electrones cargas opuestas, se atraen estableciendo el enlace iónico. La suma de las cargas opuestas hace que el compuesto en sí sea neutro. Propiedades de los compuestos iónicos 1. Son cristalinos a temperatura ambiente, ya que cada ión está rodeado por un ión de signo contrario. 2. Tienen elevados puntos de fusión y ebullición, ya que su red cristalina es muy estable. 3. Presenta gran dureza o resistencia a ser rayados, ya que supondría romper muchos enlaces.
2 4. La mayoría son solubles en agua. 5. Son malos conductores de la electricidad en estado sólido, ya que sus electrones no se pueden mover. 6. Son buenos conductores de la electricidad en estado fundido, ya que quedan los iones libres entre las moléculas de agua. 7. Son frágiles y quebradizos, son capaces de romperse en los planos entre las filas de los iones.
3 2. El enlace covalente. Los átomos que adquieren su estabilidad electrónica compartiendo con otros átomos están unidos mediante un enlace covalente. Este tipo de enlace se estable entre átomos no metálicos, los situados a la derecha de la tabla periódica. Ejemplos: - En el caso de la formación de las moléculas de dihidrógeno: los dos átomos de hidrógeno comparten un electrón cada uno obteniendo así una estructura estable similar a la del gas noble más próximo, el helio. - En el caso del dicloro, en la capa externa cada átomo tiene siete electrones en su última capa, cuando se acercan dos átomos de cloro y se unen sus capas se comparten dos electrones, uno de cada átomo. Así el átomo tiene ocho electrones en su última capa por lo ya ha obtenido su estabilidad. - En el caso del dioxígeno son 2 electrones por átomo los que se comparten - En el caso del dinitrógeno, se comparten 3 electrones por cada átomo Cuando los átomos comparten 1 electrón cada uno, se dice que en el enlace es simple Cuando los átomos comparten 2 electrones cada uno, se dice que en el enlace es doble Cuando los átomos comparten 3 electrones cada uno, se dice que en el enlace es triple También se pueden combinar diferentes elementos para formar un compuesto covalente. Por ejemplo, H y O se combinan, formando moléculas de agua: Hay dos tipos de compuestos formados con el enlace covalente: las moléculas y los cristales covalentes atómicos.
4 Propiedades de las moléculas 1. A temperatura ambiente, son frecuencia son gaseosos y con menor frecuencia líquidos. Son raros las moléculas halladas en estado sólido a temperatura ambiente 2. Sus puntos de fusión de ebullición y fusión son muy bajos. 3. Las moléculas son insolubles o muy pocos solubles en agua. 4. Rara vez son conductores de electricidad aunque existen casos, sobre todo si son solubles en agua. Cristales atómicos covalentes y sus propiedades Los enlaces covalentes en ciertas sustancias son capaces de formar redes tridimensionales de gran estabilidad. Un ejemplo de ello es el diamante que es uno de los materiales más duros de la naturaleza. El Carbono es uno de los elementos capaces de formar dichos enlaces formando dos materiales diferentes, entre otros: el diamante y el grafito. - El carbono tiene en su última capa 4 electrones, por lo que para obtener la estabilidad le faltan otros cuatros electrones y así obtienen la configuración similar a la del gas noble, el neón. - Cuando se forma el enlace solo un átomo de carbono completa su última capa quedando así los otros 4 átomos con electrones libres para formar nuevos enlaces y así formar una red cristalina. - En el caso del diamante los átomos de carbono se sitúan en una red tridimensional en todas las direcciones. - En el grafito los átomos de carbono se distribuyen en anillos de 6 miembros. Cada átomo esta unido a otros tres átomos quedando electrones libres los que permite al grafito ser conductor de electricidad. También se rompe fácilmente en ciertas direcciones. Existen muchos más sólidos covalentes atómicos, tanto los que están compuestos por el carbono (como el grafeno o el fullureno), como por otros no-metales (cuarzo, ametista...) En general 1. A temperatura ambiente, se hallan en estado sólido. Son compuestos muy duros 2. Sus temperaturas de fusión son muy altas 3. El Yodo, caso especial, forma un cristal covalente molecular. Está en forma de sólido blando, con un punto de ebullición y fusión bajo. 4. Los cristales covalentes atómicos de carbono son tan fuertes que se necesitan gran cantidad de energía para romper su estructura. 5. No son solubles en agua 6. No son conductores de electricidad, con excepción de algunos cristales covalentes atómicos de carbono. Esto se debe a la configuración geométrica de la estructura cristalina de dichos compuestos.
5 3. El enlace metálico. Una de las características que poseen los elementos metálicos es que hay entre 1 y 3 electrones en su capa externa, débilmente unidos a su núcleo y que pueden ser cedidos con cierta facilidad. Cuando se forma un enlace metálico las capas exteriores de los átomos se solapan quedando los electrones entremezclados y no asociados a ningún átomo en concreto. De esta forma los electrones son compartidos por los diferentes núcleos que forman el compuesto. Los núcleos, de carga positiva, se organizan en forma de red cristalina, mientras que los electrones compartidos se desplazan a su alrededor de manera aleatoria. Propiedades del enlace metálico. 1. Los metales son duros pero dúctiles ya que se pueden mover una capa de átomos sobre otra sin modificar demasiado la estructura cristalina. Por eso, se usan mucho en la industria: se pueden deformar y laminar fácilmente. 2. Como los electrones se pueden mover con facilidad, son buenos conductores de la electricidad. 3. También son buenos conductores del calor, ya que los átomos está muy cercanos entre sí. 4. Poseen brillo.
Enlace químico Educación Secundaria Obligatoria Física y Química
 EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
UNIDAD 3: EL ENLACE QUÍMICO
 UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción En la naturaleza, son muy pocos los átomos que se encuentran libres y aislados, sólo los átomos de
UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción En la naturaleza, son muy pocos los átomos que se encuentran libres y aislados, sólo los átomos de
El enlace químico 3 ESO SEK-CATALUNYA
 El enlace químico 3 ESO SEK-CATALUNYA Contenidos Enlace químico Enlace metálico Propiedades de los metales Enlace iónico Propiedades de los compuestos iónicos Enlace covalente Propiedades de los compuestos
El enlace químico 3 ESO SEK-CATALUNYA Contenidos Enlace químico Enlace metálico Propiedades de los metales Enlace iónico Propiedades de los compuestos iónicos Enlace covalente Propiedades de los compuestos
TEMA 5. Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS
 TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
ENLACE QUÍMICO. NaCl. Grafito: láminas de átomos de carbono
 NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
Tema 2. La agrupación de los átomos en la materia.
 Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
TEMA 4: EL ENLACE QUÍMICO
 TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES Niveles de energía Modelo atómico actual Orbitales Configuración electrónica Tabla periódica Cada electrón puede encontrarse con más probabilidad en
FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES Niveles de energía Modelo atómico actual Orbitales Configuración electrónica Tabla periódica Cada electrón puede encontrarse con más probabilidad en
10/11/2016 EL ENLACE QUÍMICO
 EL ENLACE QUÍMICO Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
EL ENLACE QUÍMICO Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
Los compuestos químicos
 Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico
 Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico Naturaleza del enlace químico Los átomos tienden a adquirir la máxima estabilidad y esto se consigue
Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico Naturaleza del enlace químico Los átomos tienden a adquirir la máxima estabilidad y esto se consigue
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
TEMA 3. ENLACE QUÍMICO FÍSICA Y QUÍMICA 4º ESO
 TEMA 3. ENLACE QUÍMICO FÍSICA Y QUÍMICA 4º ESO ÍNDICE 1. 2. 3. 4. 5. Enlace químico. Enlace iónico. Enlace covalente. Enlace metálico. Cantidad de sustancia: mol 1. ENLACE QUÍMICO 1. ENLACE QUÍMICO Enlace
TEMA 3. ENLACE QUÍMICO FÍSICA Y QUÍMICA 4º ESO ÍNDICE 1. 2. 3. 4. 5. Enlace químico. Enlace iónico. Enlace covalente. Enlace metálico. Cantidad de sustancia: mol 1. ENLACE QUÍMICO 1. ENLACE QUÍMICO Enlace
EL ENLACE QUÍMICO (FisQuiWeb)
 EL ENLACE QUÍMICO (FisQuiWeb) Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden a unirse y no permanecen
EL ENLACE QUÍMICO (FisQuiWeb) Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden a unirse y no permanecen
4º E.S.O. FÍSICA Y QUÍMICA 3. ENLACE QUÍMICO. Dpto. de Física y Química. R. Artacho
 4º E.S.O. FÍSICA Y QUÍMICA 3. ENLACE QUÍMICO R. Artacho Dpto. de Física y Química Índice CONTENIDOS 1. Enlace químico en las sustancias 2. Tipos de enlace entre átomos 3. Enlace iónico 4. Enlace covalente
4º E.S.O. FÍSICA Y QUÍMICA 3. ENLACE QUÍMICO R. Artacho Dpto. de Física y Química Índice CONTENIDOS 1. Enlace químico en las sustancias 2. Tipos de enlace entre átomos 3. Enlace iónico 4. Enlace covalente
Física y Química (4º ESO): Estructura del átomo y enlaces químicos 11
 Física y Química (4º ESO): Estructura del átomo y enlaces químicos 11 EL ENLACE QUÍMICO 10.- Concepto y naturaleza del enlace químico Se denomina enlace químico al conjunto de fuerzas que mantiene unidos
Física y Química (4º ESO): Estructura del átomo y enlaces químicos 11 EL ENLACE QUÍMICO 10.- Concepto y naturaleza del enlace químico Se denomina enlace químico al conjunto de fuerzas que mantiene unidos
SOLUCIONARIO Guía Técnico Profesional
 SOLUCIONARIO Guía Técnico Profesional El enlace químico SGUICTC004TC33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 A Comprensión 4 A Comprensión 5 C Comprensión 6 D Aplicación 7
SOLUCIONARIO Guía Técnico Profesional El enlace químico SGUICTC004TC33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 A Comprensión 4 A Comprensión 5 C Comprensión 6 D Aplicación 7
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias
 Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
Tema 5: Propiedades de las sustancias en función n del tipo de enlace que poseen.
 Tema 5: Propiedades de las sustancias en función n del tipo de enlace que poseen. Relacionar las propiedades de las sustancias, con el tipo de enlace que tiene lugar entre los átomos que la constituyen,
Tema 5: Propiedades de las sustancias en función n del tipo de enlace que poseen. Relacionar las propiedades de las sustancias, con el tipo de enlace que tiene lugar entre los átomos que la constituyen,
1. Los elementos químicos
 RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
EL ENLACE QUÍMICO. Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o iones.
 EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
1- Enlaces entre átomos Por qué se unen los átomos? 2- Distintos tipos de enlaces 2.1- Enlace iónico Compuestos iónicos y sus propiedades 2.
 1- Enlaces entre átomos Por qué se unen los átomos? 2- Distintos tipos de enlaces 2.1- Enlace iónico 2.1.1- Compuestos iónicos y sus propiedades 2.2- Enlace covalente 2.2.1-Estructura de Lewis 2.2.2- Compuestos
1- Enlaces entre átomos Por qué se unen los átomos? 2- Distintos tipos de enlaces 2.1- Enlace iónico 2.1.1- Compuestos iónicos y sus propiedades 2.2- Enlace covalente 2.2.1-Estructura de Lewis 2.2.2- Compuestos
QUÍMICA - 2º BACHILLERATO ENLACE QUÍMICO RESUMEN CONCEPTO DE ENLACE QUÍMICO
 Javier Robledano Arillo Química 2º Bachillerato Enlace Químico - 1 QUÍMICA - 2º BACHILLERATO ENLACE QUÍMICO RESUMEN CONCEPTO DE ENLACE QUÍMICO 1. Enlace químico: conjunto de fuerzas que mantienen unidos
Javier Robledano Arillo Química 2º Bachillerato Enlace Químico - 1 QUÍMICA - 2º BACHILLERATO ENLACE QUÍMICO RESUMEN CONCEPTO DE ENLACE QUÍMICO 1. Enlace químico: conjunto de fuerzas que mantienen unidos
3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos
 3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES
 ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
Química General. Clase 3 FECHA: 19/05
 Química General Clase 3 FECHA: 19/05 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura de los compuestos iónicos.
Química General Clase 3 FECHA: 19/05 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura de los compuestos iónicos.
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
ENLACE QUIMICO. Q.F. Luis José Torres Santillán
 ENLACE QUIMICO Q.F. Luis José Torres Santillán Enlace Químico Se define como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial
ENLACE QUIMICO Q.F. Luis José Torres Santillán Enlace Químico Se define como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial
Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO. Fundamentos y Didáctica de la Física y la Química
 Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO Fundamentos y Didáctica de la Física y la Química Según la regla del octeto, una de las estructuras más estables de los elementos es tener ocho
Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO Fundamentos y Didáctica de la Física y la Química Según la regla del octeto, una de las estructuras más estables de los elementos es tener ocho
Numero másico (A). Suma del numero de protones y el numero de neutrones de un átomo.
 PROPIEDADES DE LOS MATERIALES. UNIDAD El Estado Solido. Estructura Atómica. Protón- partícula con carga positiva. Neutro-partícula con carga neutra. Electron-particula con carga negativa. Numero atómico
PROPIEDADES DE LOS MATERIALES. UNIDAD El Estado Solido. Estructura Atómica. Protón- partícula con carga positiva. Neutro-partícula con carga neutra. Electron-particula con carga negativa. Numero atómico
Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados..
 ENLACE QUÍMICO Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados.. Son de tipo eléctrico. Al formarse un enlace
ENLACE QUÍMICO Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados.. Son de tipo eléctrico. Al formarse un enlace
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
Uniones químicas o enlaces químicos
 Uniones químicas o enlaces químicos En la naturaleza es muy difícil encontrar átomos libres de los diferentes elementos ya que la gran mayoría (excepto los átomos de los gases inertes) son muy inestables
Uniones químicas o enlaces químicos En la naturaleza es muy difícil encontrar átomos libres de los diferentes elementos ya que la gran mayoría (excepto los átomos de los gases inertes) son muy inestables
Metales Alcalinos. Propiedades periódicas. Propiedades periódicas
 Tabla periódica: es un rearreglo tabular de los elementos químicos. Ley periódica: las propiedades físicas como químicas de los elementos varían en forma periódica conforme aumenta la masa atómica. 1 Radios
Tabla periódica: es un rearreglo tabular de los elementos químicos. Ley periódica: las propiedades físicas como químicas de los elementos varían en forma periódica conforme aumenta la masa atómica. 1 Radios
Unidad 3. Átomos y moléculas
 Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Ejercicios tabla periódica. Enlace 4º ESO
 1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
Electrónica SODIO CLORO NEÓN ARGÓN
 Capítulo 3: UNIONES QUÍMICAS Uniones químicas Los elementos que encontramos en la tabla periódica, en la naturaleza no se hallan aislados. Por qué? Porque buscan lograr la estabilidad, como la piedra que
Capítulo 3: UNIONES QUÍMICAS Uniones químicas Los elementos que encontramos en la tabla periódica, en la naturaleza no se hallan aislados. Por qué? Porque buscan lograr la estabilidad, como la piedra que
FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES 1.* Indiquen cuántos electrones tienen en la última capa cada uno de estos elementos. a) C f) O k) K b) F g) P l) S c) Ne h) H m) He d) Br
FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES 1.* Indiquen cuántos electrones tienen en la última capa cada uno de estos elementos. a) C f) O k) K b) F g) P l) S c) Ne h) H m) He d) Br
5. ELEMENTOS Y COMPUESTOS IES ATENEA 3º DE ESO FÍSICA Y QUÍMICA
 5. ELEMENTOS Y COMPUESTOS IES ATENEA 3º DE ESO FÍSICA Y QUÍMICA 1. CLASIFICACIÓN DE LOS ELEMENTOS QUÍMICOS. 1.1. METALES Y NO METALES En términos generales, se clasifican como: METALES: Poseen brillo metálico.
5. ELEMENTOS Y COMPUESTOS IES ATENEA 3º DE ESO FÍSICA Y QUÍMICA 1. CLASIFICACIÓN DE LOS ELEMENTOS QUÍMICOS. 1.1. METALES Y NO METALES En términos generales, se clasifican como: METALES: Poseen brillo metálico.
Los átomos y sus enlaces
 Los átomos y sus enlaces Unidad 11 El modelo nuclear de átomo Demócrito Dalton Thompson Rutherford 1 El modelo nuclear de átomo Núcleo central / carga positiva / protones. Corteza / carga negativa / electrones.
Los átomos y sus enlaces Unidad 11 El modelo nuclear de átomo Demócrito Dalton Thompson Rutherford 1 El modelo nuclear de átomo Núcleo central / carga positiva / protones. Corteza / carga negativa / electrones.
ENLACES QUÍMICOS. Enlace iónico
 ENLACES QUÍMICOS De los aproximadamente 90 elementos químicos que se encuentran en la naturaleza sólo en unos pocos casos, los gases nobles, sus átomos constituyen entidades individuales. En los demás
ENLACES QUÍMICOS De los aproximadamente 90 elementos químicos que se encuentran en la naturaleza sólo en unos pocos casos, los gases nobles, sus átomos constituyen entidades individuales. En los demás
Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza.
 Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza. Tipos de sustancias Sustancias metálicas: tienen puntos de fusión variables,
Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza. Tipos de sustancias Sustancias metálicas: tienen puntos de fusión variables,
ENLACES QUÍMICOS. Prof.: Grettel Azofeifa Lizano
 ENLACES QUÍMICOS Prof.: Grettel Azofeifa Lizano Estructura de Lewis Es una representación de símbolos y puntos, propuesta pro Gilbert Lewis. Según las configuraciones electrónicas, se tiene el tronco electrónico
ENLACES QUÍMICOS Prof.: Grettel Azofeifa Lizano Estructura de Lewis Es una representación de símbolos y puntos, propuesta pro Gilbert Lewis. Según las configuraciones electrónicas, se tiene el tronco electrónico
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA El enlace químico Nº Ejercicios PSU 1. Con respecto a la razón por la que se enlazan los átomos, cuál de las siguientes alternativas es correcta? A) Los átomos se enlazan
Programa Técnico Profesional QUÍMICA El enlace químico Nº Ejercicios PSU 1. Con respecto a la razón por la que se enlazan los átomos, cuál de las siguientes alternativas es correcta? A) Los átomos se enlazan
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
TABLA PERIÓDICA. La colocación de los elementos en la tabla periódica se hace teniendo en cuenta la configuración electrónica.
 TABLA PERIÓDICA La historia de la tabla periódica está marcada principalmente por el descubrimiento de los elementos químicos. Elementos como oro, plata, hierro o cobre eran conocidos desde la antigüedad;
TABLA PERIÓDICA La historia de la tabla periódica está marcada principalmente por el descubrimiento de los elementos químicos. Elementos como oro, plata, hierro o cobre eran conocidos desde la antigüedad;
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS
 I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
FÍSICA Y QUÍMICA 4º ESO Tema 8: Átomo, sistema periódico y enlace.
 FÍSICA Y QUÍMICA 4º ESO Tema 8: Átomo, sistema periódico y enlace. 1. El modelo atómico de Rutherford: (www. cdpdp. blogspot. com) El experimento que realizó Rutherfurd demostró que la materia está prácticamente
FÍSICA Y QUÍMICA 4º ESO Tema 8: Átomo, sistema periódico y enlace. 1. El modelo atómico de Rutherford: (www. cdpdp. blogspot. com) El experimento que realizó Rutherfurd demostró que la materia está prácticamente
Enlace iónico. Propiedades de los compuestos iónicos
 Enlace iónico Un ión no es más que un átomo o molécula que ha perdido su neutralidad eléctrica, debido a que ha perdido o ganado electrones de su capa externa El enlace iónico está presente en todos los
Enlace iónico Un ión no es más que un átomo o molécula que ha perdido su neutralidad eléctrica, debido a que ha perdido o ganado electrones de su capa externa El enlace iónico está presente en todos los
Enlace Químico. AUTHOR: VICENTE GUZMÁN BROTÓNS
 Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las distintas sustancias se denominan enlaces
Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las distintas sustancias se denominan enlaces
Solución: Son sustancias moleculares la a) y la e), porque los átomos que las forman son de elementos no metálicos.
 1 El azufre es un elemento que está en el período 3 y el grupo 6 del sistema periódico. Escribe su distribución electrónica en capas. Si capta 2 electrones, qué configuración electrónica adquiere? Será
1 El azufre es un elemento que está en el período 3 y el grupo 6 del sistema periódico. Escribe su distribución electrónica en capas. Si capta 2 electrones, qué configuración electrónica adquiere? Será
Unidad didáctica Sistema Periódico y enlace químico
 Física Química 4º de ESO Unidad didáctica Sistema Periódico y enlace químico. Ficha nº 2: S.P. y enlace químico Física Química 4º de ESO 1.- Características de las partículas constituyentes del átomo.
Física Química 4º de ESO Unidad didáctica Sistema Periódico y enlace químico. Ficha nº 2: S.P. y enlace químico Física Química 4º de ESO 1.- Características de las partículas constituyentes del átomo.
Semana 8 Bimestre I Número de clases 22 24
 Semana 8 Bimestre I Número de clases 22 24 Clase 22 Enlaces químicos Formación de compuestos Actividad 1 Desarrolle la siguiente actividad con la plastilina y los palillos que le entregue el profesor.
Semana 8 Bimestre I Número de clases 22 24 Clase 22 Enlaces químicos Formación de compuestos Actividad 1 Desarrolle la siguiente actividad con la plastilina y los palillos que le entregue el profesor.
1. Sistemas materiales: propiedades 2. Estados de agregación g de los sistemas materiales 3. Teoría cinético molecular
 UNIDAD 1: DIVERSIDAD Y UNIDAD DE ESTRUCTURA DE LA MATERIA 1. Sistemas materiales: propiedades 2. Estados de agregación g de los sistemas materiales 3. Teoría cinético molecular 4. Sustanciaspuras puras,
UNIDAD 1: DIVERSIDAD Y UNIDAD DE ESTRUCTURA DE LA MATERIA 1. Sistemas materiales: propiedades 2. Estados de agregación g de los sistemas materiales 3. Teoría cinético molecular 4. Sustanciaspuras puras,
Los átomos no pueden tener en su última capa electrónica más de ocho. electrones, pero intentan tener esos ocho electrones, salvo el hidrógeno, que
 3.3. ENLACE QUÍMICO. 3.3.1. ENLACE COVALENTE. MOLÉCULAS. Los átomos no pueden tener en su última capa electrónica más de ocho electrones, pero intentan tener esos ocho electrones, salvo el hidrógeno, que
3.3. ENLACE QUÍMICO. 3.3.1. ENLACE COVALENTE. MOLÉCULAS. Los átomos no pueden tener en su última capa electrónica más de ocho electrones, pero intentan tener esos ocho electrones, salvo el hidrógeno, que
TEMA 5: construyen todas las sustancias: agua, madera, metales...varias son las preguntas que surgen:
 TEMA 5: ENLACE QUÍMICO Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias: agua, madera, metales...varias son las preguntas
TEMA 5: ENLACE QUÍMICO Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias: agua, madera, metales...varias son las preguntas
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
IES LEOPOLDO QUEIPO. DEPARTAMENTO FÍSICA Y QUÍMICA 4ºESO. Tema 2 : El átomo y sus uniones
 Tema 2 : El átomo y sus uniones Esquema de trabajo: 1.- El átomo. A. Partículas subatómicas. B. Número atómico y número másico C. Estructura interna del átomo: clásica y actual. 2.- Organización de los
Tema 2 : El átomo y sus uniones Esquema de trabajo: 1.- El átomo. A. Partículas subatómicas. B. Número atómico y número másico C. Estructura interna del átomo: clásica y actual. 2.- Organización de los
Electrón: LAS PARTÍCULAS SUBATÓMICAS. Electrón: e - Carga eléctrica: 1,602x10-19 C Masa: 9,109x10-31 C
 ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
Física y Química 4º ESO Enlace químico página 1 de 6. Enlace químico
 Física y Química 4º ESO Enlace químico página 1 de 6 Concepto de enlace químico Enlace químico Generalmente los átomos libres tienen, por separado, una estabilidad menor que cuando están combinados. Todo
Física y Química 4º ESO Enlace químico página 1 de 6 Concepto de enlace químico Enlace químico Generalmente los átomos libres tienen, por separado, una estabilidad menor que cuando están combinados. Todo
EL ÁTOMO, EL SISTEMA PERIÓDICO Y ENLACE QUÍMICO
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE EL ÁTOMO, EL SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1.- MODELOS ATÓMICOS * TEORÍA ATÓMICA DE DALTON (1808) - La materia está formada por átomos, que son pequeñas
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE EL ÁTOMO, EL SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1.- MODELOS ATÓMICOS * TEORÍA ATÓMICA DE DALTON (1808) - La materia está formada por átomos, que son pequeñas
Liceo nº3 Nocturno Química 4º año Repartido nº4 Enlace químico
 Repartido nº4 Enlace químico Formulas de Lewis o Diagramas de Lewis: Para representar la formación del enlace químico utilizamos representaciones gráficas que se denominan diagramas de puntos (o diagramas
Repartido nº4 Enlace químico Formulas de Lewis o Diagramas de Lewis: Para representar la formación del enlace químico utilizamos representaciones gráficas que se denominan diagramas de puntos (o diagramas
07/02/2015 EL ENLACE QUÍMICO. Tema 5
 EL ENLACE QUÍMICO Tema 5 Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
EL ENLACE QUÍMICO Tema 5 Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO
 TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO. Objetivos / Criterios de evaluación O.5.1 Conocer la importancia de la búsqueda de los elementos químicos. O.5.2 Diferenciar entre metales y no metales. O.5.3
TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO. Objetivos / Criterios de evaluación O.5.1 Conocer la importancia de la búsqueda de los elementos químicos. O.5.2 Diferenciar entre metales y no metales. O.5.3
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
ENLACE QUÍMICO. La fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman una sustancia
 ENLACE QUÍMICO La fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman una sustancia Concepto importante para la química: Diversidad de sustancias Características y propiedades
ENLACE QUÍMICO La fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman una sustancia Concepto importante para la química: Diversidad de sustancias Características y propiedades
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
GUÍA DE APOYO PARA EXAMEN DE QUÍMICA 1 MEDIO ALUMNAS NO INSCRITAS. ITEM I.- VERDADERO O FALSO: Marque con V o F en cada oración. Fundamente las falsas
 GUÍA DE APOYO PARA EXAMEN DE QUÍMICA 1 MEDIO ALUMNAS NO INSCRITAS Recuerden que el día del examen deben traer su TABLA PERIÓDICA. ITEM I.- VERDADERO O FALSO: Marque con V o F en cada oración. Fundamente
GUÍA DE APOYO PARA EXAMEN DE QUÍMICA 1 MEDIO ALUMNAS NO INSCRITAS Recuerden que el día del examen deben traer su TABLA PERIÓDICA. ITEM I.- VERDADERO O FALSO: Marque con V o F en cada oración. Fundamente
Objetivo. Introducción. Palabras clave. Desarrollo. Química Unidad 8 Enlace químico. 1. Interacciones entre átomos
 Química Unidad 8 Enlace químico Objetivo Comprender los conceptos básicos de los modelos de enlace iónico, covalente y metálico. Introducción Los electrones cumplen un papel fundamental en la formación
Química Unidad 8 Enlace químico Objetivo Comprender los conceptos básicos de los modelos de enlace iónico, covalente y metálico. Introducción Los electrones cumplen un papel fundamental en la formación
Enlace Químico. Química General I 2012
 Enlace Químico Química General I 2012 Los electrones de valencia son los electrones del último orbital en un átomo, son los causantes de los enlaces químicos. Grupo e - configuración # de valencia 1A ns
Enlace Químico Química General I 2012 Los electrones de valencia son los electrones del último orbital en un átomo, son los causantes de los enlaces químicos. Grupo e - configuración # de valencia 1A ns
PROPIEDADES DE LOS METALES
 PROPIEDADES DE LOS METALES Átomos, moléculas, iones. Transparencia nº Enunciados relativos a lo que observamos (propiedades observables en los metales) Son en general sólidos de alto punto de fusión y
PROPIEDADES DE LOS METALES Átomos, moléculas, iones. Transparencia nº Enunciados relativos a lo que observamos (propiedades observables en los metales) Son en general sólidos de alto punto de fusión y
Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales.
 ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
QUÍMICA 1ºBAT ENLACE QUÍMICO
 1 1. EL ENLACE QUÍMICO En la naturaleza los elementos químicos se hallan habitualmente combinados entre sí, formando compuestos químicos. En éstos los átomos se unen mediante "enlaces químicos". Los átomos
1 1. EL ENLACE QUÍMICO En la naturaleza los elementos químicos se hallan habitualmente combinados entre sí, formando compuestos químicos. En éstos los átomos se unen mediante "enlaces químicos". Los átomos
El átomo de S recibe 2 electrones y se transforma en un ión azufre, adquiriendo la configuración del gas noble Argón.
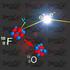 FUNDACIÓN EDUCACIONAL COLEGIO DE LOS SS.CC. - MANQUEHUE - Átomos, iones y moléculas. ENLACE QUÍMICO DEPARTAMENTO DE CIENCIAS PROFESORA: SILVINA IRIBERRI CURSO: SEGUNDO MEDIO Todos los objetos materiales
FUNDACIÓN EDUCACIONAL COLEGIO DE LOS SS.CC. - MANQUEHUE - Átomos, iones y moléculas. ENLACE QUÍMICO DEPARTAMENTO DE CIENCIAS PROFESORA: SILVINA IRIBERRI CURSO: SEGUNDO MEDIO Todos los objetos materiales
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
CUESTIONARIOS FÍSICA 4º ESO
 DPTO FÍSICA QUÍMICA. IES POLITÉCNICO CARTAGENA CUESTIONARIOS FÍSICA º ESO UNIDADES 8 y 10 Átomos, elementos y compuestos. Las reacciones químicas Mª Teresa Gómez Ruiz 2010 HTTP://WWW. POLITECNICOCARTAGENA.
DPTO FÍSICA QUÍMICA. IES POLITÉCNICO CARTAGENA CUESTIONARIOS FÍSICA º ESO UNIDADES 8 y 10 Átomos, elementos y compuestos. Las reacciones químicas Mª Teresa Gómez Ruiz 2010 HTTP://WWW. POLITECNICOCARTAGENA.
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
Longitud y energía de enlace
 Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
ELEMENTOS Y COMPUESTOS. EL ENLACE QUÍMICO CURSO 2013/2014
 ELEMENTOS Y COMPUESTOS. EL ENLACE QUÍMICO CURSO 2013/2014 ÍNDICE 1. El átomo 1.1. Partículas subatómicas 1.2. Modelos atómicos 2. Caracterización de los átomos 2.1. Número atómico y número másico 2.2.
ELEMENTOS Y COMPUESTOS. EL ENLACE QUÍMICO CURSO 2013/2014 ÍNDICE 1. El átomo 1.1. Partículas subatómicas 1.2. Modelos atómicos 2. Caracterización de los átomos 2.1. Número atómico y número másico 2.2.
Unidad 4 Enlace iónico y metálico
 Evaluación unidad 4. Enlace iónico y metálico CRITERIOS DE EVALUACIÓN. Utilizar el modelo de enlace correspondiente para explicar la formación de moléculas, de cristales y estructuras macroscópicas, y
Evaluación unidad 4. Enlace iónico y metálico CRITERIOS DE EVALUACIÓN. Utilizar el modelo de enlace correspondiente para explicar la formación de moléculas, de cristales y estructuras macroscópicas, y
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Materia.- Realidad primaria de la que están hechas las cosas.
 TEORÍA FÍSICA Y QUÍMICA, 2º TRIMESTRE TEMA 4 EL ÁTOMO Materia.- Realidad primaria de la que están hechas las cosas. Un átomo es la unidad constituyente más pequeña de la materia ordinaria que tiene las
TEORÍA FÍSICA Y QUÍMICA, 2º TRIMESTRE TEMA 4 EL ÁTOMO Materia.- Realidad primaria de la que están hechas las cosas. Un átomo es la unidad constituyente más pequeña de la materia ordinaria que tiene las
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
1 MODELACIÓN (Por ejemplo): Con ayuda de la tabla periódica, completo el siguiente cuadro:
 Área: Ciencias naturales Nombre: Fecha: Grado: 8º Asignatura: Biologia Docente :Jorge Alexander Agudelo Badillo Tema ENLACES QUÍMICOS Y SUS CLASES De todos los elementos de la tabla periódica, solo el
Área: Ciencias naturales Nombre: Fecha: Grado: 8º Asignatura: Biologia Docente :Jorge Alexander Agudelo Badillo Tema ENLACES QUÍMICOS Y SUS CLASES De todos los elementos de la tabla periódica, solo el
elementos reaccionan compuestos
 Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
4 Elementos y compuestos
 4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
Unidad 9. Enlace químico ÍNDICE
 Unidad 9 Enlace químico 1 ÍNDICE 1. Átomos unidos por enlace químico. 2. Enlace iónico. Ciclo de Born-Haber. Energía de red. Estructura cristalina de los compuestos iónicos. Propiedades de los compuestos
Unidad 9 Enlace químico 1 ÍNDICE 1. Átomos unidos por enlace químico. 2. Enlace iónico. Ciclo de Born-Haber. Energía de red. Estructura cristalina de los compuestos iónicos. Propiedades de los compuestos
EL INTERIOR DE LA MATERIA
 EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
ENLACE QUÍMICO COVALENTE IÓNICO METÁLICO
 ENLACE QUÍMICO IÓNICO COVALENTE METÁLICO 1- DEFINICIÓN DE ENLACE Enlace químico: fuerza que hace que los átomos se unan para formar un sistema químico más estable Situación antienlazante: predominan las
ENLACE QUÍMICO IÓNICO COVALENTE METÁLICO 1- DEFINICIÓN DE ENLACE Enlace químico: fuerza que hace que los átomos se unan para formar un sistema químico más estable Situación antienlazante: predominan las
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
ENLACE COVALENTE. Z = 1 Hidrógeno H: 1s 1 Z = 6 Carbono C: 1s 2 2s 2 2p 2 Z = 7 Nitrógeno N: 1s 2 2s 2 2p 3 Z = 8 Oxígeno O: 1s 2 2s 2 2p 4 H H H 2
 ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
QUÍMICA. Tema 3. Enlace Químico
 Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
SOLUCIONES BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO.
 SOLUCIONES BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos 1. Solución: Descubrimiento de los dos «tipos» de electricidad. Siglo XVIII. Descubrimiento del electrón. 1897.
SOLUCIONES BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos 1. Solución: Descubrimiento de los dos «tipos» de electricidad. Siglo XVIII. Descubrimiento del electrón. 1897.
