ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE
|
|
|
- Laura Espejo Botella
- hace 6 años
- Vistas:
Transcripción
1 1. FUNDAMENTO TEÓRICO ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE Departamento de Bioquímica La electroforesis es una técnica de separación de moléculas cargadas por migración en un campo eléctrico. Las moléculas se separan en función de su carga eléctrica, desplazándose al electrodo de carga contraria y a mayor velocidad cuanto mayor es la carga de la molécula. Cada molécula se desplaza en el campo eléctrico alcanzando una velocidad constante. En el estado estacionario, la fuerza impulsora (fuerza del campo eléctrico) se equilibra con la resistencia al avance (fuerza de fricción hidrodinámica) en el medio en que se desplaza. Se define la movilidad electroforética como la velocidad de desplazamiento por unidad de campo eléctrico. En unas condiciones determinadas de electroforesis, la diferente movilidad de cada molécula define su comportamiento y separación en el espacio. Diferentes moléculas tendrán diferente movilidad electroforética en un medio determinado. Hay tres tipos de electroforesis: De frente móvil. Zonal. Continua. Se pueden utilizar diferentes medios de soporte para evitar perturbaciones mecánicas y los efectos de las corrientes de convección en la separación. Como medios de soporte se pueden utilizar papel, acetato de celulosa, geles de almidón, geles de agarosa o geles de poliacrilamida. Los geles de poliacrilamida son el resultado de la polimerización química de una mezcla de acrilamida y bisacrilamida. Controlando la concentración de ambas obtenemos geles de diferente grado de reticulación (diferente diámetro de poro). Uno de los métodos de electroforesis más comúnmente aplicado para proteínas es el que emplea geles de poliacrilamida (PAGE = polyacrylamide gel electrophoresis) en presencia del detergente aniónico dodecilsulfato sódico (SDS). Esta técnica es conocida como SDS-PAGE. Para ello se prepara un gel en placa vertical. En la preparación del gel, la polimerización de los monómeros de acrilamida produce cadenas lineales. Al incluir bisacrilamida, ésta da lugar a puntos de ramificación en el polímero, lo que permite formar una matriz tridimensional, dando lugar al gel de poliacrilamida. El tamaño de los huecos o poros que forma la retícula del polímero depende de la concentración de acrilamida y del grado de entrecruzamiento (es decir, de la proporción de bisacrilamida con respecto al total). Así, variando la concentración de acrilamida y bisacrilamida en la preparación del gel se consiguen distintos grados de porosidad y, por tanto, distintos intervalos de separación de proteínas. También se añade un tampón (comúnmente Tris-HCl). Además, se añade un agente iniciador de la polimerizacón como el persulfato amónico, que al disolverse en agua genera radicales 1
2 libres que transforman la acrilamida en radical libre y se inicia la polimerización. También se añade al medio TEMED (N,N,N,N -tetrametil-etileno-diamina) como catalizador porque puede existir en forma de radical libre. Las muestras proteicas se tratan, previamente a su fraccionamiento, con SDS a 100 ºC. Como consecuencia de este tratamiento y de la presencia posterior de SDS durante toda la separación (tanto en el tampón de electroforesis como en la composición del gel), las proteínas se mantienen desnaturalizadas. El SDS tiene la propiedad de unirse a las cadenas polipeptídicas en una proporción masa:masa constante (1.4 g SDS/g de proteína), de modo que en el complejo SDS-proteína la carga de la proteína queda enmascarada por la de las múltiples moléculas de SDS y ésta es proporcional al tamaño (nº de aminoácidos). Esta electroforesis es discontinua pues utiliza dos geles: Un gel concentrador con bajo grado de reticulación y ph 6,8 ( gel acumulador o stacking gel ). Un gel separador con grado de reticulación mayor con valores entre 6% y 15%, pudiéndose también utilizar gradientes de concentración de acrilamida (gel separador). En la electroforesis en gel de poliacrilamida con SDS, la separación de proteínas se hace en función de la masa molecular. Tanto es así que la representación del logaritmo de la masa molecular frente a la distancia migrada obedece a una línea recta para gran número de proteínas. Para que esta dependencia sea correcta, es preciso romper los puentes disulfuro intra- e intercatenarios, para lo cual es frecuente añadir durante la preparación de la muestra un agente reductor, generalmente 2-mercaptoetanol. De este modo, la masa molecular observada corresponde a la de cada subunidad de una proteína, no a la proteína completa, al existir una relación lineal. Para aplicar la muestra al gel, se le suele añadir un agente que la haga más densa, generalmente glicerina o sacarosa. Además, para seguir el avance de la separación, se añade un colorante, como azul de bromofenol, que sirve como referencia (tracking dye). Éste tiene una movilidad mayor que la de cualquier macromolécula y, por tanto, si se aplica corriente hasta que el colorante esté a poca distancia del extremo inferior del gel, se tiene la seguridad de que ninguna macromolécula se ha salido del gel por avance excesivo. 2.PROCEDIMIENTO EXPERIMENTAL 2.1 Montaje del sistema de electroforesis. Se utilizará un gel plano de 1,5 mm de grosor. Montar el sandwich con dos placas de vidrio (uno tiene un rebaje) y los dos separadores en vertical entre ellas y a ambos lados. Introducirlo en el soporte formador de geles. Sujetar el conjunto. Se empleará un gel separador con un 7,5 % de acrilamida y un gel acumulador con un 4,8% de acrilamida. Los geles se preparan mezclando, en un vaso de precipitados, los componentes indicados en la tabla (el persulfato y el TEMED inician la reacción de polimerización, por lo que se deben añadir en último lugar) y rápidamente proceder al llenado con la mezcla (las cantidades indicadas dan para dos geles). La solución de acrilamida/bisacrilamida se debe utilizar con guantes y pipetear con propipeta. Primero se polimeriza el gel separador (ver tabla). Para ello se rellena, con la mezcla todavía líquida, el espacio entre las dos placas hasta unos 3 cm del borde superior del cristal corto, usando una pipeta pasteur. Añadir encima una pequeña cantidad de agua destilada (esto hace que la superficie del gel quede recta). Esperar a que polimerice el gel (entre 30 y 60 min, observar la mezcla sobrante en el vaso). Volcar para retirar el agua destilada. Secar con un papel de filtro. 2
3 Añadir sobre este gel separador la mezcla (ver tabla) del gel acumulador y antes de que polimerice introducir en la parte superior el peine, que formará en el gel acumulador los pocillos para luego poder aplicar las muestras. Se guarda el gel en la cámara fría hasta el día siguiente. Gel separador (7,5%): Agua destilada 12 ml Acrilamida/Bisacrilamida 6,25 ml Tris 1 M ph 8,8 6,25 ml SDS 10% 250 µl TEMED 12,5 µl Persulfato amónico (100 mg/1 ml) 200 µl Gel concentrador : Agua destilada 5,8 ml Acrilamida/Bisacrilamida 1,65 ml Tris 0,5 M ph 6,8 2,5 ml SDS 10% 100 µl TEMED 6,5 µl Persulfato amónico (100 mg/ 1 ml) 94 µl 2.2 Separación de las proteinas por SDS-PAGE Preparación de las muestras Una vez polimerizado el gel concentrador se aplica la muestra. 3 Las muestras deben de contener una masa proteica en torno a μg. Como todas las muestras tienen que tener la misma cantidad de proteína, se toma el volumen que se necesite de cada una de las proteínas problema. Para ello, se toman 24 μl de la solución con la proteína problema y se añade a la muestra tampón de ruptura 5X en una relación 4:1 (volumen:volumen) (por tanto, 6 μl). Utilizar un tubo con 10 μl de patrones preteñidos de peso molecular conocido. Esta mezcla ya contiene el tampón de ruptura. Las patrones preteñidos (con diferentes colorantes) contienen diferentes proteínas con diferentes peso molecular aparente. Peso molecular aparente (daltons) (azul) (azul) (azul) (rojo) (azul) (azul) (rojo) (azul) (azul) (azul)
4 Mantener las muestras durante 5 minutos a 100 ºC. Centrifugar los tubos a baja velocidad durante un minuto para concentrar toda la muestra en el fondo del tubo. Retirar con cuidado el peine al gel preparado el día anterior. Sacar del formador de geles el sandwich de placas de vidrio, separadores y gel y sujetarlo en vertical en la cubeta de electroforesis. Llenar las cámaras superior e inferior de la cubeta de electroforesis que contienen los electrodos con tampón de electroforesis, de modo que entre en contacto con ambos extremos del gel. Se aplican las muestras y los patrones de peso molecular en los pocillos del gel, usando micropipetas con puntas finas. Se completa cada pocillo con tampón de ruptura 1X preparado diluyendo el tampón de ruptura 5X en tampón de electroforesis. Se añade al pocillo. Es conveniente anotar el orden de aplicación de las muestras, así como identificar el gel en el que están las muestras que corresponden a cada taquilla. Desarrollo de la electroforesis Conectar los cables de la cubeta a una fuente de corriente continua (comprobar la polaridad: rojo (+), negro (-)). Aplicar 80 V hasta que el frente (visible por la banda azul de bromofenol) entre en el gel separador; después subir a 120 V. Cuando el frente, se acerce al extremo inferior del gel, desconectar la corriente y sacar el sandwich (tarda aproximadamente una hora y cuarto). Separar las placas de vidrio con ayuda de una espátula y sacar el gel (usar guantes para evitar tocar el gel con los dedos) con cuidado de no invertir su orientación. Una vez finalizada la transferencia, se tiñe el gel de electroforesis mediante su inclusión en solución de tinción que contiene Azul de Coomassie, ácido acético, metanol durante 2 horas a temperatura ambiente. Posteriormente, se pasa el gel a solución de destinción que contiene ácido acético 10% y metanol 10% en agua, destiñendo el gel durante toda la noche. 4. TRATAMIENTO Y DISCUSIÓN DE LOS RESULTADOS En una electroforesis en gel de poliacrilamida en presencia de SDS, qué proteínas presentan mayor movilidad electroforética en el gel separador? Qué sustancia se usa como marcador de frente? Por qué se utilizan dos geles (concentrador y separador) en la electroforesis en gel de poliacrilamida en presencia de SDS? Qué posibles aplicaciones presenta este método? Qué patrón de bandas se obtiene en la muestra de marcadores? Representar las movilidades electroforéticas de los patrones de peso molecular preteñidos frente al logaritmo del peso molecular de cada patrón (en papel milimetrado). 4
5 4.7.- Calcular la movilidad electroforética de la proteína problema (a partir de la banda que aparece en el gel tras tinción y distinción del mismo) Calcular el peso molecular de la proteína problema. 5. MATERIAL Y REACTIVOS Materiales Fuente de electroforesis. Baño de incubación Cubeta de electroforesis con cristales, peines y separadores. Formador de geles Pipetas Reactivos Solución de acrilamida/bisacrilamida: Contiene 30 % acrilamida % bisacrilamida preparada en agua destilada Disolución de SDS: 10 % en agua destilada Disolución de persulfato amónico: 100 mg/ml en agua destilada TEMED (solución comercial) Tampón del gel separador: Tris 1M; ph = 8,8 Tampón del gel acumulador: Tris 0,5 M; ph = 6,8 Tampón de Ruptura 5X que contiene: 2,5 ml de solución de SDS 10%; 0,2 ml de 2- mercaptoetanol; 0,5 ml de azul de bromofenol 0,05%; 0,3 ml de tampón de electroforesis; 1 ml de glicerol y 0,5 ml de Tris 0,5 M ph 6,8. Tampón de electroforesis: contiene 14,4 g/l de glicina, 3 g/l de Tris (base) y 10 ml/l de SDS 10%. Marcadores preteñidos de peso molecular 5
ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE
 Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE 1. FUNDAMENTO TEÓRICO La electroforesis es una técnica de
Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE 1. FUNDAMENTO TEÓRICO La electroforesis es una técnica de
ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE
 ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE FUNDAMENTO TEÓRICO La electroforesis es una técnica de separación de moléculas cargadas por migración en un campo eléctrico. Las moléculas se separan
ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE FUNDAMENTO TEÓRICO La electroforesis es una técnica de separación de moléculas cargadas por migración en un campo eléctrico. Las moléculas se separan
Electroforesis de proteínas en geles de poliacrilamida
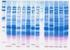 Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B
 ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B 2 0 1 7 Que es la electroforesis? Qué permite analizar? Que factores influyen? Separar y analizar
ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B 2 0 1 7 Que es la electroforesis? Qué permite analizar? Que factores influyen? Separar y analizar
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS. Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo (+)
 GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa.
 MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa. Qué es la electroforesis? Es la técnica que permite la
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa. Qué es la electroforesis? Es la técnica que permite la
Monitoreo de un proceso de purificación de proteínas. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa
 Monitoreo de un proceso de purificación de proteínas Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
Monitoreo de un proceso de purificación de proteínas Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
BIOLOGIA CELULAR Y MOLECULAR. LABORATORIO No 9: ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE)
 BIOLOGIA CELULAR Y MOLECULAR LABORATORIO No 9: ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE) 1. INTRODUCCIÓN Uno de los métodos que permite la purificación y separación de proteínas de un organismo
BIOLOGIA CELULAR Y MOLECULAR LABORATORIO No 9: ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE) 1. INTRODUCCIÓN Uno de los métodos que permite la purificación y separación de proteínas de un organismo
PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA
 INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDS-PAGE. Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE)
 ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDSPAGE Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE) Método rápido, reproducible y de bajo costo Utilizado para cuantificar, comparar
ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDSPAGE Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE) Método rápido, reproducible y de bajo costo Utilizado para cuantificar, comparar
TP3: Electroforesis en gel de poliacrilamida
 Objetivos TP3: Electroforesis en gel de poliacrilamida Comparar los perfiles proteicos obtenidos mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas. Introducción La
Objetivos TP3: Electroforesis en gel de poliacrilamida Comparar los perfiles proteicos obtenidos mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas. Introducción La
Diagnóstico Avanzado en Enfermedades Tropicales
 Diagnóstico Avanzado en Enfermedades Tropicales Máster universitario en Enfermedades Tropicales Código 302731 (3 créditos ECTS) Área de Parasitología Departamento de Biología Animal, Parasitología, Ecología,
Diagnóstico Avanzado en Enfermedades Tropicales Máster universitario en Enfermedades Tropicales Código 302731 (3 créditos ECTS) Área de Parasitología Departamento de Biología Animal, Parasitología, Ecología,
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Virología y Micología Veterinaria Trabajo Práctico No. 4 ELECTROFORESIS La electroforesis es una técnica utilizada para separar grandes moléculas por tamaño a través de la aplicación de un campo eléctrico
1 Virología y Micología Veterinaria Trabajo Práctico No. 4 ELECTROFORESIS La electroforesis es una técnica utilizada para separar grandes moléculas por tamaño a través de la aplicación de un campo eléctrico
TP3: Electroforesis en gel de poliacrilamida
 TP3: Electroforesis en gel de poliacrilamida Objetivos Comparar las fracciones de proteínas obtenidas en el TP Nº2 mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas.
TP3: Electroforesis en gel de poliacrilamida Objetivos Comparar las fracciones de proteínas obtenidas en el TP Nº2 mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas.
Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa
 Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa OBJETIVO: -Realizar electroforesis de las proteínas presentes en suero utilizando acetato de celulosa
Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa OBJETIVO: -Realizar electroforesis de las proteínas presentes en suero utilizando acetato de celulosa
CROMATOGRAFÍA DE AMINOÁCIDOS
 CROMATOGRAFÍA DE AMINOÁCIDOS Electroforesis.- Es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar aminoácidos (y otras biomoléculas) según su
CROMATOGRAFÍA DE AMINOÁCIDOS Electroforesis.- Es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar aminoácidos (y otras biomoléculas) según su
DETERMINACIÓN DEL PESO MOLECULAR DE PROTEÍNAS
 DETERMINACIÓN DEL PESO MOLECULAR DE PROTEÍNAS 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar el conocimiento de la estructura de las proteínas y determinar
DETERMINACIÓN DEL PESO MOLECULAR DE PROTEÍNAS 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar el conocimiento de la estructura de las proteínas y determinar
ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS
 ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS Marcelo Castillo Navarrrete, T.M. MsCs (C) Facultad de Medicina Carrera Tecnología Médica 18 de Noviembre de 2004 Fundamentos de Electroforesis Alta
ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS Marcelo Castillo Navarrrete, T.M. MsCs (C) Facultad de Medicina Carrera Tecnología Médica 18 de Noviembre de 2004 Fundamentos de Electroforesis Alta
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987)
 EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
Electroforesis de proteínas
 Electroforesis de proteínas Introducción general La electroforesis es un método de separación basado en la tasa diferencial de migración de especies cargadas al estar en un campo eléctrico de DC La electroforesis
Electroforesis de proteínas Introducción general La electroforesis es un método de separación basado en la tasa diferencial de migración de especies cargadas al estar en un campo eléctrico de DC La electroforesis
Al igual que en la centrifugación también hay dos criterios de separación con el mismo concepto:
 Electroforesis En la técnica de separación anterior hemos utilizado la fuerza centrífuga para que asociada a la diferencia de masa o densidad de las partículas a separar nos las diferencie, ahora vamos
Electroforesis En la técnica de separación anterior hemos utilizado la fuerza centrífuga para que asociada a la diferencia de masa o densidad de las partículas a separar nos las diferencie, ahora vamos
DESARROLLO COGNOSCITIVO Y APRENDIZAJE
 Prof. Jhonis Valbuena Cátedra: Análisis Instrumental La Electrofóresis es un método de la Química Analítica que utiliza corriente eléctrica controlada con la finalidad de separar biomolèculas según su
Prof. Jhonis Valbuena Cátedra: Análisis Instrumental La Electrofóresis es un método de la Química Analítica que utiliza corriente eléctrica controlada con la finalidad de separar biomolèculas según su
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar
 4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
Electroforesis. Dr. Héctor L. Ayala del Río AMGEN Bruce Wallace Program Departamento de Biología UPR-Humacao VER VIDEO CARGADO GEL
 Electroforesis Dr. Héctor L. Ayala del Río AMGEN Bruce Wallace Program Departamento de Biología UPR-Humacao VER VIDEO CARGADO GEL 1 Electroforesis l Método utilizado para separar y purificar macromoléculas:
Electroforesis Dr. Héctor L. Ayala del Río AMGEN Bruce Wallace Program Departamento de Biología UPR-Humacao VER VIDEO CARGADO GEL 1 Electroforesis l Método utilizado para separar y purificar macromoléculas:
Tema 6 Cuantificación de proteínas
 Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Proyecto de Fin de Cursos
 Universidad de la República Oriental del Uruguay Proyecto de Fin de Cursos ELECTROFORESIS EN GEL DE MOLÉCULAS DE ADN Noviembre de 2006 Carolina Etchart C.I. 3.757.708-8 Marcelo Lavagna C.I. 3.508.715-8
Universidad de la República Oriental del Uruguay Proyecto de Fin de Cursos ELECTROFORESIS EN GEL DE MOLÉCULAS DE ADN Noviembre de 2006 Carolina Etchart C.I. 3.757.708-8 Marcelo Lavagna C.I. 3.508.715-8
Práctica laboratorio: Reacciones de polimerización. Determinación del peso molecular de un polímero mediante análisis de grupos finales
 Práctica laboratorio: Reacciones de polimerización. Determinación del peso molecular de un polímero mediante análisis de grupos finales Enrique Dans. Creative Commons. http://www.flickr.com/photos/edans/1239
Práctica laboratorio: Reacciones de polimerización. Determinación del peso molecular de un polímero mediante análisis de grupos finales Enrique Dans. Creative Commons. http://www.flickr.com/photos/edans/1239
PURIFICACIÓN DE PROTEÍNAS
 PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
ELECTROFORESIS AVANZADA
 Ref. ELECAVANZADA (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref. ELECAVANZADA (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
ELECTROFORESIS Fundamento.
 ELECTROFORESIS La electroforesis es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar biomoleculas según su tamaño y carga eléctrica a través
ELECTROFORESIS La electroforesis es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar biomoleculas según su tamaño y carga eléctrica a través
Técnicas de Caracterización y purificación
 Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
CROMATOGRAFIA DE TAMIZADO MOLECULAR / FILTRACION EN GEL / EXCLUSION MOLECULAR
 CROMATOGRAFIA DE TAMIZADO MOLECULAR / FILTRACION EN GEL / EXCLUSION MOLECULAR 1.-FUNDAMENTOS DE LA CROMATOGRAFIA DE TAMIZADO MOLECULAR. Las biomoléculas presentan una serie de propiedades físicas (tamaño,
CROMATOGRAFIA DE TAMIZADO MOLECULAR / FILTRACION EN GEL / EXCLUSION MOLECULAR 1.-FUNDAMENTOS DE LA CROMATOGRAFIA DE TAMIZADO MOLECULAR. Las biomoléculas presentan una serie de propiedades físicas (tamaño,
Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS
 Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS DICIEMBRE 2006 Tratamiento de Imágenes por Computadora Proyecto
Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS DICIEMBRE 2006 Tratamiento de Imágenes por Computadora Proyecto
Electroforesis de proteínas en geles de poliacrilamida. Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica
 Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
ELECTROFORESIS VERTICAL DE PROTEÍNAS
 6 grupos de estudiantes ELECTROFORESIS VERTICAL DE PROTEÍNAS 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es aprender el uso de la ELECTOFORESIS DESNATURALIZANTE EN GEL DE POLIACRILAMIDA-SDS
6 grupos de estudiantes ELECTROFORESIS VERTICAL DE PROTEÍNAS 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es aprender el uso de la ELECTOFORESIS DESNATURALIZANTE EN GEL DE POLIACRILAMIDA-SDS
Se van a purificar dos proteínas, una de origen animal, la lisozima de la clara de huevo y otra vegetal la galactosidasa de hojas de espinaca.
 PRÁCTICA 1 PURIFICACIÓN DE ENZIMAS OBJETIVO: Extraer y purificar enzimas mediante cromatografía de intercambio iónico utilizando SP Sepharose y Q Sepharose, para posteriormente cuantificarlas en las diferentes
PRÁCTICA 1 PURIFICACIÓN DE ENZIMAS OBJETIVO: Extraer y purificar enzimas mediante cromatografía de intercambio iónico utilizando SP Sepharose y Q Sepharose, para posteriormente cuantificarlas en las diferentes
Electroforesis en gel de poliacrilamida y electrotransferencia
 Electroforesis en gel de poliacrilamida y electrotransferencia INDICE ELECTROFORESIS Fundamento y características Tipos de electroforesis: libre y de zona Electroforesis en papel, acetato de celulosa Electroforesis
Electroforesis en gel de poliacrilamida y electrotransferencia INDICE ELECTROFORESIS Fundamento y características Tipos de electroforesis: libre y de zona Electroforesis en papel, acetato de celulosa Electroforesis
Técnicas de Estudio de las células
 Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Módulo 2 Biología Molecular Genética Molecular II Módulo 2. Clonación y Selección de moléculas recombinantes
 Módulo 2 Clonación y Selección de moléculas recombinantes El fragmento de ADN amplificado por PCR en el módulo anterior se introdujo en un vector pgem T Easy (Ver Anexo 2) utilizando una ligasa. En la
Módulo 2 Clonación y Selección de moléculas recombinantes El fragmento de ADN amplificado por PCR en el módulo anterior se introdujo en un vector pgem T Easy (Ver Anexo 2) utilizando una ligasa. En la
PRÁCTICA 1: MÉTODOS DE RUPTURA CELULAR
 PRÁCTICA 1: MÉTODOS DE RUPTURA CELULAR FUNDAMENTO TEÓRICO Para estudiar la estructura y/o función de un orgánulo celular determinado, lo primero que hay que hacer es purificarlo, es decir, separarlo del
PRÁCTICA 1: MÉTODOS DE RUPTURA CELULAR FUNDAMENTO TEÓRICO Para estudiar la estructura y/o función de un orgánulo celular determinado, lo primero que hay que hacer es purificarlo, es decir, separarlo del
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas.
 Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
PRÁCTICA 2 Determinación espectrofotométrica del pk de un indicador
 Laboratorio de Química Física 1 Grado en Química PRÁCTICA 2 Determinación espectrofotométrica del pk de un indicador Material 2 matraces aforados de 250 ml 1 varilla de vidrio/ 1 pesasustancias/ 1 cuentagotas/
Laboratorio de Química Física 1 Grado en Química PRÁCTICA 2 Determinación espectrofotométrica del pk de un indicador Material 2 matraces aforados de 250 ml 1 varilla de vidrio/ 1 pesasustancias/ 1 cuentagotas/
PCR SIMULADA. Ref.PCR Simulada (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO
 Ref.PCR Simulada (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO PCR SIMULADA El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Ref.PCR Simulada (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO PCR SIMULADA El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
CROMATOGRAFÍA DE FILTRACIÓN EN GEL
 1.- FUNDAMENTO TEÓRICO CROMATOGRAFÍA DE FILTRACIÓN EN GEL Filtración en gel - 1 (Farmacia) La cromatografía de exclusión o filtración en gel es una clase de cromatografía sólido-líquido que permite la
1.- FUNDAMENTO TEÓRICO CROMATOGRAFÍA DE FILTRACIÓN EN GEL Filtración en gel - 1 (Farmacia) La cromatografía de exclusión o filtración en gel es una clase de cromatografía sólido-líquido que permite la
Purificación de Proteínas Parte II
 Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
CUANTIFICACIÓN DE LA ACTIVIDAD ENZIMÁTICA Y DE LA ACTIVIDAD ESPECÍFICA DE LAS ENZIMAS
 CUANTIFICACIÓN DE LA ACTIVIDAD ENZIMÁTICA Y DE LA ACTIVIDAD ESPECÍFICA DE LAS ENZIMAS I. INTRODUCCIÓN No siendo posible medir la cantidad de enzima directamente de los líquidos y estructuras biológicas
CUANTIFICACIÓN DE LA ACTIVIDAD ENZIMÁTICA Y DE LA ACTIVIDAD ESPECÍFICA DE LAS ENZIMAS I. INTRODUCCIÓN No siendo posible medir la cantidad de enzima directamente de los líquidos y estructuras biológicas
POLÍMEROS. Los polímeros son macromoléculas formadas por la repetición de entidades
 1. INTRODUCCIÓN Los polímeros son macromoléculas formadas por la repetición de entidades estructurales que denominamos monómeros o unidades MONOMÉRICAS mediante enlace químico fuerte, normalmente de tipo
1. INTRODUCCIÓN Los polímeros son macromoléculas formadas por la repetición de entidades estructurales que denominamos monómeros o unidades MONOMÉRICAS mediante enlace químico fuerte, normalmente de tipo
Ensayos de restricción
 Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
Estudio del efecto de la temperatura sobre la velocidad de reacción
 Laboratorio de Química Física Grado en Química PRÁCTICA 4 Estudio del efecto de la temperatura sobre la velocidad de reacción Material cubeta de metacrilato, termostato y unidad refrigeradora compartidos
Laboratorio de Química Física Grado en Química PRÁCTICA 4 Estudio del efecto de la temperatura sobre la velocidad de reacción Material cubeta de metacrilato, termostato y unidad refrigeradora compartidos
OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución.
 OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución. FUNDAMENTO TEÓRICO Una disolución es una mezcla homogénea
OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución. FUNDAMENTO TEÓRICO Una disolución es una mezcla homogénea
PRÁCTICA Nº 6 EQUILIBRIO QUÍMICO
 PRÁCTICA Nº 6 EQUILIBRIO QUÍMICO OBJETIVOS Comprobar la perturbación en un sistema en equilibrio de complejos de cobalto (II), cuando se modifican la concentración de las sustancias implicadas y la temperatura.
PRÁCTICA Nº 6 EQUILIBRIO QUÍMICO OBJETIVOS Comprobar la perturbación en un sistema en equilibrio de complejos de cobalto (II), cuando se modifican la concentración de las sustancias implicadas y la temperatura.
Práctica 15. Cinética química.
 Materiales Vasos de precipitados Vidrio de reloj Varilla agitadora Matraces aforados Tubos de ensayo Tapones Gradilla Balanza Placa calefactora Reactivos Bisulfato sódico Agua destilada Almidón soluble
Materiales Vasos de precipitados Vidrio de reloj Varilla agitadora Matraces aforados Tubos de ensayo Tapones Gradilla Balanza Placa calefactora Reactivos Bisulfato sódico Agua destilada Almidón soluble
PRÁCTICA 1: MÉTODOS DE RUPTURA CELULAR
 PRÁCTICA 1: MÉTODOS DE RUPTURA CELULAR FUNDAMENTO TEÓRICO Para estudiar la estructura y/o las funciones metabólicas de los distintos compartimentos celulares hay que aislarlos del resto de los orgánulos.
PRÁCTICA 1: MÉTODOS DE RUPTURA CELULAR FUNDAMENTO TEÓRICO Para estudiar la estructura y/o las funciones metabólicas de los distintos compartimentos celulares hay que aislarlos del resto de los orgánulos.
Biología Celular y Molecular. Guía de TP Nro. 5. Actividad proteolítica celular.
 Biología Celular y Molecular. Guía de TP Nro. 5 Actividad proteolítica celular. Introducción La actividad proteolítica secretada por las células es un elemento indispensable para la proliferación y migración
Biología Celular y Molecular. Guía de TP Nro. 5 Actividad proteolítica celular. Introducción La actividad proteolítica secretada por las células es un elemento indispensable para la proliferación y migración
Hoefer SG15, SG30, SG50 y SG100
 man ual del usuario Español Hoefer SG15, SG30, SG50 y SG100 Grandiente fabricantes mu SG100-IM/Spanish/Rev.C0/08-12 Tabla de contenidos 1. Introducción: Hoefer SG15, SG30, SG50, SG100 y fabricantes de
man ual del usuario Español Hoefer SG15, SG30, SG50 y SG100 Grandiente fabricantes mu SG100-IM/Spanish/Rev.C0/08-12 Tabla de contenidos 1. Introducción: Hoefer SG15, SG30, SG50, SG100 y fabricantes de
PURIFICACIÓN Y DETERMINACIÓN DEL TAMAÑO DE PROTEÍNAS FLUORESCENTES VERDES Y AZULES
 PURIFICACIÓN Y DETERMINACIÓN DEL TAMAÑO DE PROTEÍNAS FLUORESCENTES VERDES Y AZULES 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO En este experimento los estudiantes aprenderán a purificar parcialmente
PURIFICACIÓN Y DETERMINACIÓN DEL TAMAÑO DE PROTEÍNAS FLUORESCENTES VERDES Y AZULES 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO En este experimento los estudiantes aprenderán a purificar parcialmente
CINÉTICA ENZIMÁTICA: VALORACIÓN DE FOSFATASA ALCALINA
 Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular CINÉTICA ENZIMÁTICA: VALORACIÓN DE FOSFATASA ALCALINA 1.- FUNDAMENTO TEÓRICO Cinética enzimática Las reacciones químicas
Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular CINÉTICA ENZIMÁTICA: VALORACIÓN DE FOSFATASA ALCALINA 1.- FUNDAMENTO TEÓRICO Cinética enzimática Las reacciones químicas
CINÉTICA ENZIMÁTICA: VALORACIÓN DE FOSFATASA ALCALINA
 Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular CINÉTICA ENZIMÁTICA: VALORACIÓN DE FOSFATASA ALCALINA 1.- FUNDAMENTO TEÓRICO Cinética enzimática Las reacciones químicas
Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular CINÉTICA ENZIMÁTICA: VALORACIÓN DE FOSFATASA ALCALINA 1.- FUNDAMENTO TEÓRICO Cinética enzimática Las reacciones químicas
ANEXOS. Anexo 1. Solución Reguladora de Acetato 0.1 M, ph 4.0 y metanol al 2% (v/v).
 ANEXOS Anexo 1 Solución Reguladora de Acetato 0.1 M, ph 4.0 y metanol al 2% (v/v). 1. Tomar 6.011mL de ácido acético y aforar a 1L de agua HPLC. 2. Pesar 13.609 g de acetato de sodio y aforar a 1L de agua
ANEXOS Anexo 1 Solución Reguladora de Acetato 0.1 M, ph 4.0 y metanol al 2% (v/v). 1. Tomar 6.011mL de ácido acético y aforar a 1L de agua HPLC. 2. Pesar 13.609 g de acetato de sodio y aforar a 1L de agua
CINÉTICA. Puede suponerse que la ecuación de velocidad es:
 CINÉTICA OBJETIVO: Determinación de la ecuación de velocidad de la reacción de oxidación de yoduro (I - ) por persulfato(s O - ). Estudio del efecto de la temperatura. MATERIAL: Baño termostático Cronómetro
CINÉTICA OBJETIVO: Determinación de la ecuación de velocidad de la reacción de oxidación de yoduro (I - ) por persulfato(s O - ). Estudio del efecto de la temperatura. MATERIAL: Baño termostático Cronómetro
Los principales mecanismos que intervienen en la separación cromatográfica son:
 TP 8 CROMATOGRAFIA EN PAPEL, Introducción Los métodos cromatográficos son un conjunto de técnicas empleadas para separar compuestos químicos de una mezcla. Su nombre significa escribir con color ya que
TP 8 CROMATOGRAFIA EN PAPEL, Introducción Los métodos cromatográficos son un conjunto de técnicas empleadas para separar compuestos químicos de una mezcla. Su nombre significa escribir con color ya que
Guía de laboratorio: Reconocimiento de moléculas orgánicas.
 Departamento de Ciencias / Biología Primeros medios Prof. Daniela Gutiérrez G. Instrucciones generales: Guía de laboratorio: Reconocimiento de moléculas orgánicas. - Lean con detención cada una de las
Departamento de Ciencias / Biología Primeros medios Prof. Daniela Gutiérrez G. Instrucciones generales: Guía de laboratorio: Reconocimiento de moléculas orgánicas. - Lean con detención cada una de las
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
DETERMINACIÓN DEL PORCENTAJE DE PLOMO MTC E
 DETERMINACIÓN DEL PORCENTAJE DE PLOMO MTC E 1219 2000 Este Modo Operativo está basado en la Norma ASTM D 49, el mismo que se han adaptado al nivel de implementación y a las condiciones propias de nuestra
DETERMINACIÓN DEL PORCENTAJE DE PLOMO MTC E 1219 2000 Este Modo Operativo está basado en la Norma ASTM D 49, el mismo que se han adaptado al nivel de implementación y a las condiciones propias de nuestra
Laboratorio De Química TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES
 TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Materi al Porción de materia que se aisla para su estudio. - Sistema Homogéneo Es
TRABAJO PRÁCTICO Nº 3 SISTEMAS MATERIALES - Materia Es todo lo que posee masa, y ocupa un lugar en el espacio. - Sistema Materi al Porción de materia que se aisla para su estudio. - Sistema Homogéneo Es
Práctica 6. Reactivo limitante
 Práctica 6. Reactivo limitante PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué especie actúa como reactivo limitante en el siguiente proceso químico? CaCl 2 (ac) + K 2 CO 3 (ac) CaCO 3 + 2 KCl (ac) PRIMERA
Práctica 6. Reactivo limitante PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué especie actúa como reactivo limitante en el siguiente proceso químico? CaCl 2 (ac) + K 2 CO 3 (ac) CaCO 3 + 2 KCl (ac) PRIMERA
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo
 Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
PRÁCTICA No. DETERMINACIÓN DE LA CONSTANTE DE VELOCIDAD Y ORDEN DE UNA REACCIÓN
 PRÁCTICA No. DETERMINACIÓN DE LA CONSTANTE DE VELOCIDAD Y ORDEN DE UNA REACCIÓN OBJETIVOS EL ALUMNO Comprenderá la influencia de la concentración en la velocidad de una reacción química. Determinará el
PRÁCTICA No. DETERMINACIÓN DE LA CONSTANTE DE VELOCIDAD Y ORDEN DE UNA REACCIÓN OBJETIVOS EL ALUMNO Comprenderá la influencia de la concentración en la velocidad de una reacción química. Determinará el
PRÁCTICA III. AISLAMIENTO DE MITOCONDRIAS: ACTIVIDAD MALATO DESHIDROGENASA
 PRÁCTICA III. AISLAMIENTO DE MITOCONDRIAS: ACTIVIDAD MALATO DESHIDROGENASA 1. Fundamento Teórico La mayoría de los procesos bioquímicos que producen energía química se realizan en orgánulos intracelulares
PRÁCTICA III. AISLAMIENTO DE MITOCONDRIAS: ACTIVIDAD MALATO DESHIDROGENASA 1. Fundamento Teórico La mayoría de los procesos bioquímicos que producen energía química se realizan en orgánulos intracelulares
Practica No 6. Reactivo Limitante. Determinar la especie que actúa como reactivo limitante en la siguiente reacción química:
 Practica No 6 Reactivo Limitante Objetivo Determinar la especie que actúa como reactivo limitante en la siguiente reacción química: Material y Reactivos Disolución de cloruro de calcio 1M. Disolución de
Practica No 6 Reactivo Limitante Objetivo Determinar la especie que actúa como reactivo limitante en la siguiente reacción química: Material y Reactivos Disolución de cloruro de calcio 1M. Disolución de
PNT 9: DETERMINACIÓN DEL ÁCIDO ACETILSALICÍLICO EN COMPRIMIDOS MEDIANTE DIFERENTES MÉTODOS.
 PNT 9: Análisis instrumental PNT 9 ÍNDICE 1. Objetivo...Página 1 2. Fundamento teórico...página 1 y 2 3. Materiales...Página 2 4. Reactivos...Página 2 5. Equipos...Página 2 6. Procedimiento experimental...página
PNT 9: Análisis instrumental PNT 9 ÍNDICE 1. Objetivo...Página 1 2. Fundamento teórico...página 1 y 2 3. Materiales...Página 2 4. Reactivos...Página 2 5. Equipos...Página 2 6. Procedimiento experimental...página
CaCl 2(ac) + K 2 CO 3(ac) CaCO KCl (ac)
 Equipo: Nombre: Nombre: Nombre: Práctica 5. Reactivo Limitante Problema Qué especie actúa como reactivo limitante en la siguiente reacción química? CaCl 2(ac) + K 2 CO 3(ac) CaCO 3 + 2 KCl (ac) Tarea previa.
Equipo: Nombre: Nombre: Nombre: Práctica 5. Reactivo Limitante Problema Qué especie actúa como reactivo limitante en la siguiente reacción química? CaCl 2(ac) + K 2 CO 3(ac) CaCO 3 + 2 KCl (ac) Tarea previa.
PRACTICA N 10. DETERMINACIÓN DE CARBOHIDRATOS.
 PRACTICA N 10. DETERMINACIÓN DE CARBOHIDRATOS. 10.1.- OBJETIVOS: Diferenciar carbohidratos simples y complejos por sus propiedades químicas. Determinar el contenido de azúcar de una muestra por medio de
PRACTICA N 10. DETERMINACIÓN DE CARBOHIDRATOS. 10.1.- OBJETIVOS: Diferenciar carbohidratos simples y complejos por sus propiedades químicas. Determinar el contenido de azúcar de una muestra por medio de
CORPORACION MUNICIPAL DE DESARROLLO SOCIAL LICEO INDUSTRIAL EULOGIO GORDO MONEO ANTOFAGASTA FONO FAX:
 CORPORACION MUNICIPAL DE DESARROLLO SOCIAL LICEO INDUSTRIAL EULOGIO GORDO MONEO ANTOFAGASTA FONO FAX:55-2231189 WWW.LICEOINDUSTRIALEGM.CL GUÍA DE APRENDIZAJE Profesor Asignatura Objetivo de Aprendizaje
CORPORACION MUNICIPAL DE DESARROLLO SOCIAL LICEO INDUSTRIAL EULOGIO GORDO MONEO ANTOFAGASTA FONO FAX:55-2231189 WWW.LICEOINDUSTRIALEGM.CL GUÍA DE APRENDIZAJE Profesor Asignatura Objetivo de Aprendizaje
16. Electroforesis desnaturalizante en geles de poliacrilamida. Análisis de proteínas de hojas de Arabidopsis thaliana
 16. Electroforesis desnaturalizante en geles de poliacrilamida. Análisis de proteínas de hojas de Arabidopsis thaliana Ana María Maldonado Alconada, Jesús V. Jorrín Novo Departamento de Bioquímica y Biología
16. Electroforesis desnaturalizante en geles de poliacrilamida. Análisis de proteínas de hojas de Arabidopsis thaliana Ana María Maldonado Alconada, Jesús V. Jorrín Novo Departamento de Bioquímica y Biología
Código: IDK-003 Ver: 1. Factor V Leiden
 Sistema para detección de la alteración G1691A en el gene que codifica para el Factor V de la coagulación humana Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71
Sistema para detección de la alteración G1691A en el gene que codifica para el Factor V de la coagulación humana Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71
1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS
 1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS Existen diferentes métodos para la obtención de ADN bacteriano que varían en duración y complejidad del procedimiento en función de la calidad del ADN que queramos
1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS Existen diferentes métodos para la obtención de ADN bacteriano que varían en duración y complejidad del procedimiento en función de la calidad del ADN que queramos
ANEXO 1 ELECTROFORESIS DE PROTEINAS EN GELES DE POLIACRILAMIDA
 ANEXO 1 ELECTROFORESIS DE PROTEINAS EN GELES DE POLIACRILAMIDA Las proteínas son las macromoléculas más grandes y de más amplia distribución en la célula. Sus propiedades biológicas, así como muchas de
ANEXO 1 ELECTROFORESIS DE PROTEINAS EN GELES DE POLIACRILAMIDA Las proteínas son las macromoléculas más grandes y de más amplia distribución en la célula. Sus propiedades biológicas, así como muchas de
Ensayos southwestern y northwestern
 Búsqueda de proteínas que se unen a DNA (secuencia conocida, promotor) Ensayo southwestern encontrar proteínas ligantes de DNA que reconozcan en éste una determinada secuencia de nucleótidos Ensayo northwestern
Búsqueda de proteínas que se unen a DNA (secuencia conocida, promotor) Ensayo southwestern encontrar proteínas ligantes de DNA que reconozcan en éste una determinada secuencia de nucleótidos Ensayo northwestern
ELABORACIÓN N DE MEZCLA PARA PCR. Raquel Asunción Lima Cordón
 ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
PRÁCTICA Nº 3 PREPARACIÓN DE SOLUCIONES ACUOSAS
 PRÁCTICA Nº 3 PREPARACIÓN DE SOLUCIONES ACUOSAS OBJETIVOS Preparar soluciones acuosas a partir de la medición directa de reactivos sólidos y líquidos. Preparar soluciones acuosas por dilución. I. ASPECTOS
PRÁCTICA Nº 3 PREPARACIÓN DE SOLUCIONES ACUOSAS OBJETIVOS Preparar soluciones acuosas a partir de la medición directa de reactivos sólidos y líquidos. Preparar soluciones acuosas por dilución. I. ASPECTOS
TÍTULO: Determinación de pigmentos vegetales en muestras de hoja mediante cromatografía líquida de alta eficacia
 Página 1 de 9 1.- INTRODUCCIÓN El presente protocolo es aplicable para el análisis cuantitativo de algunos pigmentos en muestras de vegetales. Los analitos son extraídos de la muestra por medio de acetona
Página 1 de 9 1.- INTRODUCCIÓN El presente protocolo es aplicable para el análisis cuantitativo de algunos pigmentos en muestras de vegetales. Los analitos son extraídos de la muestra por medio de acetona
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERMINACIÓN DE LA MASA MOLECULAR DE UN SOLUTO PROBLEMA POR CRIOSCOPIA
 PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS.
 PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
Western Blotting (o inmunotransferencia) es un procedimiento estándar de laboratorio que permite a
 Introducción Western Blotting (o inmunotransferencia) es un procedimiento estándar de laboratorio que permite a los investigadores verificar la expresión de una proteína, determinar la cantidad relativa
Introducción Western Blotting (o inmunotransferencia) es un procedimiento estándar de laboratorio que permite a los investigadores verificar la expresión de una proteína, determinar la cantidad relativa
PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS. Es un ácido capaz de formar sales con iones cargados
 Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
PROCEDIMIENTO. 1. Si todavía no lo has hecho, ponte los guantes y las gafas de seguridad. Cinética química Página 2
 CINÉTICA QUÍMICA DETERMINACIÓN DEL EFECTO DE LA TEMPERATURA SOBRE LA VELOCIDAD DE REACCIÓN Las reacciones tienen lugar más deprisa a altas temperaturas, porque al incrementar la temperatura también se
CINÉTICA QUÍMICA DETERMINACIÓN DEL EFECTO DE LA TEMPERATURA SOBRE LA VELOCIDAD DE REACCIÓN Las reacciones tienen lugar más deprisa a altas temperaturas, porque al incrementar la temperatura también se
Código: KIT-005 Ver: 1 MTHFR C677T
 Sistema para detección de la alteración C677T en el gene que codifica para la Metilen-tetrahidrofolato reductasa humana 1 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598)
Sistema para detección de la alteración C677T en el gene que codifica para la Metilen-tetrahidrofolato reductasa humana 1 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598)
Estudio cinético de la reacción entre el yodo y la acetona catalizada por ácido
 Laboratorio de Química Física 1 Curso 2011-2012 Grado en Química PRÁCTICA 5 Estudio cinético de la reacción entre el yodo y la acetona catalizada por ácido Material 1 probeta de 100 ml 1 aforado de 500
Laboratorio de Química Física 1 Curso 2011-2012 Grado en Química PRÁCTICA 5 Estudio cinético de la reacción entre el yodo y la acetona catalizada por ácido Material 1 probeta de 100 ml 1 aforado de 500
QG II Reactivo limitante Página 1
 6. Problema Reactivo limitante Modificaciones realizadas por: QFB Rosario Velázquez Miranda Q. Brenda Lizette Ruiz Herrera Dr. Víctor Manuel Ugalde Saldívar Qué especie actúa como reactivo limitante en
6. Problema Reactivo limitante Modificaciones realizadas por: QFB Rosario Velázquez Miranda Q. Brenda Lizette Ruiz Herrera Dr. Víctor Manuel Ugalde Saldívar Qué especie actúa como reactivo limitante en
Determinación de la Masa Molar del Magnesio
 Determinación de la Masa Molar del Magnesio Introducción teórica Como en muchas reacciones químicas, los reactivos o sus productos o ambos son gases, es más común medir éstos en función del volumen usando
Determinación de la Masa Molar del Magnesio Introducción teórica Como en muchas reacciones químicas, los reactivos o sus productos o ambos son gases, es más común medir éstos en función del volumen usando
15. Electroforesis: electroforesis en papel de proteínas séricas
 15. Electroforesis: electroforesis en papel de proteínas séricas Isaac Túnez Fiñana Departamento de Bioquímica y Biología Molecular, Facultad de Medicina, Universidad de Córdoba, Avda. Menéndez Pidal s/n,
15. Electroforesis: electroforesis en papel de proteínas séricas Isaac Túnez Fiñana Departamento de Bioquímica y Biología Molecular, Facultad de Medicina, Universidad de Córdoba, Avda. Menéndez Pidal s/n,
Separación e identificación de lípidos de membrana
 Separación e identificación de lípidos de membrana Objetivos Separación e identificación de especies de fosfolípidos por cromatografía de capa fina (TLC, Thin Layer Chromatography) TLC monodimensional
Separación e identificación de lípidos de membrana Objetivos Separación e identificación de especies de fosfolípidos por cromatografía de capa fina (TLC, Thin Layer Chromatography) TLC monodimensional
CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN
 II PRÁCTICA 2 CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
II PRÁCTICA 2 CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
Hidrólisis del acetato de metilo
 Hidrólisis del acetato de metilo Trabajo práctico Módulo de Cinética Fisicoquímica - UNQ Dra. Noelia I. Burgardt 2010 Cinética Química Estudio de la velocidad y el mecanismo de las reacciones químicas.
Hidrólisis del acetato de metilo Trabajo práctico Módulo de Cinética Fisicoquímica - UNQ Dra. Noelia I. Burgardt 2010 Cinética Química Estudio de la velocidad y el mecanismo de las reacciones químicas.
INMUNOELECTROFORESIS
 10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO INMUNOELECTROFORESIS En esta práctica, los estudiantes se introducen en el uso de la inmunoelectroforesis para separar y caracterizar una mezcla de
10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO INMUNOELECTROFORESIS En esta práctica, los estudiantes se introducen en el uso de la inmunoelectroforesis para separar y caracterizar una mezcla de
PRÁCTICA # 01 PREPARACIÓN DE DISOLUCIONES
 REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA DEFENSA AVIACIÓN MILITAR VENEZOLANA U.E.A.M LIBERTADOR ASIGNATURA: QUÍMICA PROF(A): ANGÉLICA RODRÍGUEZ MARBELIS MELENDEZ CURSO: 4to
REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA DEFENSA AVIACIÓN MILITAR VENEZOLANA U.E.A.M LIBERTADOR ASIGNATURA: QUÍMICA PROF(A): ANGÉLICA RODRÍGUEZ MARBELIS MELENDEZ CURSO: 4to
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
LABORATORIO 6. TITULO : Propiedades de los Gases
 37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN
 II- PRÁCTICA- CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
II- PRÁCTICA- CINÉTICA QUÍMICA DETERMINACIÓN DEL ORDEN DE REACCIÓN Y ENERGÍA DE ACTIVACIÓN En esta experiencia comprobaremos la influencia de la concentración de los reactivos, de la temperatura, y de
