Capítulo 3. Interacciones químicas débiles
|
|
|
- Hugo Ortíz Chávez
- hace 6 años
- Vistas:
Transcripción
1 Capítulo 3. Interacciones químicas débiles Momento dipolar Por qué algunas sustancias moleculares tienen puntos de ebullición más altos que otras? a sido fácil comprender que en las sustancias de mayor punto de ebullición las moléculas están más atraídas unas con otras, por lo que se requiere mayor cantidad de energía para romper esas atracciones. Ahora la pregunta interesante es entonces: Por qué en algunas sustancias moleculares las moléculas se encuentran más atraídas entre sí que en otras? Sabemos que en la materia hay partículas cargadas (protones y electrones) y también sabemos que las cargas opuestas se atraen. Esta naturaleza eléctrica es la causa fundamental de todos los tipos de enlace químico. Sin embargo en una molécula, el número de partículas con carga negativa es igual al número de partículas con carga positiva, por lo que las moléculas son eléctricamente neutras. Analizaremos un conjunto de sustancias muy sencillas y similares entre sí, compuestas por moléculas diatómicas: las de los halógenos. A temperatura ambiente el flúor y el cloro son gases, mientras que el bromo es líquido y el yodo es sólido. En la tabla 3.a se muestran sus masas molares y sus temperaturas de ebullición. Estas temperaturas son una medida de la cantidad de energía que hay que darle a un líquido, para separar sus moléculas y formar un gas. Tabla 3.a Algunas propiedades de los halógenos alógeno masa molar (g/mol) # de electrones T. de ebullición ( C) Cl Br I Por qué las moléculas de mayor tamaño se encuentren más atraídas entre sí que las más pequeñas? Estas moléculas están formadas por dos núcleos cargados positivamente y alrededor de ellos hay electrones formando nubes de carga negativa, como se muestra en la figura 3.1. Cl Cl Br Br I I igura 3.1 Moléculas diatómicas de los halógenos Aunque los electrones tienden a distribuirse uniformemente a través de toda la nube, debido a su continuo movimiento, existe la probabilidad de que en un instante cualquiera, los electrones se concentren en un extremo de la molécula, creando momentáneamente una distribución desigual de cargas, como se muestra en la figura 3.2.
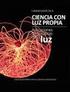
2 I I igura 3.2 Molécula de yodo en la que los electrones se han distribuido de manera desigual. Cuando, como en este caso, hay cargas de la misma magnitud q pero de signo opuesto separadas por una distancia r, se dice que existe un momento dipolar, o momento dipolo: = qr En este caso particular, como el de la molécula de I2, se le llama dipolo instantáneo, pues la separación de cargas no es permanente. Sin embargo la probabilidad de que las cargas se distribuyan momentáneamente de manera no homogénea, aumenta con el número de electrones en la nube, así como del volumen total en el que éstos se mueven. Como se generan polos de carga, se dice que la molécula se polariza. La polarizabilidad en las moléculas de los halógenos aumenta con el tamaño, es decir Menos polarizable 2 < Cl2 < Br2 < I2 Más polarizable Ahora imaginemos lo que sucede cuando una molécula de yodo que se encuentra polarizada, se acerca a una molécula de yodo no polarizada. (igura 3.3) Un dipolo instantáneo en una molécula, puede inducir un momento dipolo en una molécula vecina, y el efecto puede propagarse a todo el material. I I I I I I igura 3.3 interacción entre moléculas de yodo polarizadas. A este tipo de interacciones entre moléculas se le llama dipolo instantáneo dipolo inducido. 1 Aunque es una interacción débil, es la responsable de las variaciones en las temperaturas de ebullición de los halógenos y es más importante a medida que aumenta el tamaño de la molécula. Este efecto también explica el aumento en las temperaturas de ebullición (y aun de fusión) de algunos hidrocarburos, como se ve en tabla 3.b. Idea clave: Las interacciones dipolo instantáneodipolo inducido son mayores entre mayor sea la polarizabilidad de la molécula. La polarizabilidad de una molécula aumenta entre mayor volumen y mayor número de electrones en ella. Los átomos menos electronegativos son más polarizables. 1 A este tipo de interacciones también se les conoce como uerzas de London, o uerzas de dispersión.
3 Tabla 3.b idrocarburos lineales, sus masas molares y temperaturas de ebullición y fusión. idrocarburo Masa molar (g/mol) Temperatura de ebullición ( C) Temperatura de fusión ( C) Metano Etano Propano nbutano npentano nhexano nheptano noctano nnonano ndecano Dipolos permanentes No en todos los átomos la atracción de los electrones hacia el núcleo es igual. Esto es importante cuando se forma un enlace covalente entre dos átomos con distinta capacidad de atraer a los electrones, o electronegatividad. Un ejemplo es el Cl. Como el cloro atrae más a la nube electrónica que el hidrógeno, en esta molécula hay mayor densidad electrónica negativa cerca de él, mientras que cerca del hidrógeno, hay una deficiencia de carga negativa. En esta molécula la nube electrónica se encuentra polarizada; en el Cl hay un dipolo permanente.(igura 3.4) Esto se representa mediante la letra griega seguida del signo correspondiente a la carga en exceso. Cl igura 3.4 Nube electrónica polarizada de la molécula de Cl Cuando un enlace covalente presenta un dipolo se dice que se forma un enlace covalente polar. Las moléculas que están formadas por átomos diferentes, generalmente forman enlaces covalentes polares. En general, los electrones que participan en un enlace covalente están más cercanos del átomo con mayor electronegatividad, y la carga parcial negativa ( ) se sitúa sobre ese átomo. De manera correspondiente, la carga parcial positiva ( ) queda en el átomo menor electronegatividad. Las moléculas que poseen dipolos permanentes, se atraen unas a otras con mucha más fuerza que moléculas de estructura similar y tamaño semejante, sin dipolos permanentes; se dice que entre ellas hay una interacción dipolodipolo. Esto se refleja en mayores temperaturas de ebullición para las
4 sustancias polares, pues es necesario aplicar una mayor cantidad de energía para romper las atracciones entre las moléculas. En la igura 3.5 se muestran algunas parejas de sustancias no polares y polares de masa molar muy parecida, con sus temperaturas de ebullición. En cada caso, la flecha indica la posición del vector momento dipolo para la molécula. Sustancias no polares Sustancias polares igura 3.5 Temperaturas de ebullición de algunas sustancias polares y no polares. Cuidado: Una molécula puede ser no polar aunque tenga enlaces polares. Dado que el momento dipolo es un vector definido entre dos átomos unidos por un enlace, en las moléculas poliatómicas con varios enlaces polares, los vectores momento dipolar pueden cancelarse unos con otros debido a su arreglo geométrico. Este es el caso de las siguientes moléculas, (igura 3.6) que a pesar de tener enlaces polares, su momento dipolar global es igual a cero.
5 igura 3.6 moléculas no polares con enlaces polares. Una molécula polar colocada junto a una molécula no polar, induce un dipolo en esta última, estableciéndose en ellas lo que se conoce como una interacción dipolodipolo inducido. Este tipo de interacción es la responsable de que haya sustancias polares miscibles con sustancias no polares, como el caso de los hidrocarburos y los alcoholes, como en el caso de algunas gasolinas. Puentes de hidrógeno Entre los enlaces polares, un caso particularmente importante es aquél formado por un átomo de hidrógeno y un átomo que tenga un alto valor de electronegatividad, como el, el ó el N. Este tipo de átomos, siempre tiene pares de electrones no compartidos al formar moléculas. Un ejemplo de moléculas en las que tenemos este tipo de enlaces serían los alcoholes, que tienen fórmula general R ( ) ( ), donde los símbolos y, se refieren a que sobre el átomo junto al cual se escribieron, hay una carga negativa o positiva parcial, lo que justamente genera el momento dipolar. Como se puede ver en la igura 3.7, un átomo de hidrógeno enlazado a una molécula de metanol, puede interactuar fuertemente con uno de los pares de electrones no compartidos en el átomo de oxígeno de una molécula vecina, formando un "puente" entre dos moléculas de metanol. Esta interacción es mucho más fuerte que una interacción dipolodipolo en la que no exista puente de hidrógeno. Esto se manifiesta en las elevadas temperaturas de ebullición de los líquidos cuyas moléculas forman puentes de hidrógeno entre sí. Resulta muy ilustrativo comparar el éter metílico C3C3, con el etanol C3C2. Estas dos sustancias son isómeros, es decir tienen la misma fórmula condensada, pero el acomodo de sus átomos es distinto. Ambas tienen un momento dipolar diferente de cero (1.3D para el éter y 1.69D para el etanol). Sin embargo, entre moléculas de éter metílico, C3C3, no pueden formarse puentes de hidrógeno, pues en ellas los átomos de hidrógeno solamente se encuentran formando enlaces muy poco polares con los átomos de carbono. En el etanol, C3C2, existe un enlace que es muy polar, de manera que ese átomo de hidrógeno puede formar puentes con otros átomos de oxígeno en moléculas vecinas. Las diferencias físicas son muy notables: el etanol es un líquido a temperatura ambiente, y su punto de ebullición es de 78 C, mientras que el éter metílico es un gas con punto de ebullición de 25 C. tros ejemplos pueden verse en la igura 3.8. Idea clave: Existen puentes de hidrógeno entre moléculas que poseen enlaces entre átomos de hidrógeno y átomos muy electronegativos como nitrógeno, oxígeno o flúor.
6 C C C C igura 3.7 Puentes de hidrógeno en el metanol. Las flechas indican los vectores momento dipolo de los enlaces polares. igura 3.8 Comparación en las temperaturas de ebullición de sustancias polares de masa molar semejante sin puente de hidrógeno y con él.
7 El agua, la sustancia más importante en nuestro planeta, está compuesta por moléculas polares capaces de formar puentes de hidrógeno de una manera única. Comparemos a la molécula de agua, 2, con algunas que podríamos considerar parecidas, compuestas sólo por átomos de hidrógeno y algún átomo muy electronegativo: el N3, el, el 2S, el Cl. Todas estas moléculas pueden formar enlaces tipo puente de hidrógeno, y de hecho los forman, pero los puntos de ebullición (Tabla 3.c estas sustancias nos dicen que las atracciones entre sus moléculas son mucho menores que las que se dan entre las moléculas de agua. Qué característica estructural es la que hace al agua tan diferente? Tabla 3.c Temperaturas de ebullición de algunas sustancias con puentes de hidrógeno Sustancia Temperatura ebullición ( C) Momento dipolar (D) N Cl S En la igura 3.9 se muestran los puentes de hidrógeno posibles entre las moléculas de las diferentes sustancias analizadas. Podemos ver que, mientras el tiene sólo un átomo de hidrógeno para establecer puentes, el amoniaco, aunque tiene tres, sólo tiene un par de electrones no compartidos sobre el nitrógeno. El agua, en cambio, tiene dos átomos de hidrógeno unidos al átomo de oxígeno, que a su vez tiene dos pares de electrones no compartidos. Esto permite que cada molécula de agua pueda participar simultáneamente en cuatro enlaces de puente de hidrógeno. En el 2S, el número de átomos de hidrógeno y el número de electrones no compartidos en el átomo electronegativo, es el mismo que en el agua, sin embargo, su comportamiento es muy distinto al del agua, pues es un gas a temperatura ambiente. Esto puede explicarse mediante la diferencia en los valores de electronegatividad entre el (3.5) y el S(2.5). El carácter polar del enlace es mucho más marcado que el del enlace S, ya es mayor la diferencia de electronegatividades.
8 N N N N N N igura 3.9 Puentes de hidrógeno en, N 3 y 2 Interacciones iondipolo Los compuestos formados por iones, como el NaCl, forman sólidos cristalinos en los que las partículas que los constituyen se encuentran fuertemente atraídos por lo que se lama una interacción ionion. Esta interacción, sin embargo puede en muchos casos, ser vencida al poner a esa sustancia iónica en contacto con agua. Las moléculas de agua, con sus dipolos permanentes, pueden interactuar fuertemente con ambos tipos de iones, según se muestra en la igura Algunos disolventes
9 polares, como los alcoholes, también pueden ser capaces, en algunos casos, de vencer las interacciones ionion, para disolver a un compuesto iónico mediante interacciones iondipolo. Na Cl igura 3.10 Interacciones iondipolo. Una reflexión para cerrar el capítulo titulado Interacciones débiles : Qué tan débiles son éstas? En el capítulo 2 se presentaron en las tablas 2.II y 2.III algunos ejemplos de energías de enlace para enlaces covalentes comunes. Los valores para estos ejemplos varían bastante, ya que van aproximadamente desde los 100 hasta los 1000 kj/mol. Como puede verse en la tabla 3.IV, algunas de las interacciones débiles que hemos discutido en este capítulo tienen energías de asociación dentro del intervalo de los valores correspondientes para algunos enlaces covalentes. Un caso particularmente interesante es en de las interacciones ióndipolo: el valor de la energía de asociación para K 2 es de 52.5 kj/mol, mientras que para el Ni 2 2 es kj/mol, casi siete veces mayor y del orden de un enlace covalente típico (ver tablas 3.d, 2.b y 2.c). Tabla 3.d Tipo de interacción Ejemplo Energía de asociación Dipolo instantáneo dipolo Cl 2, 2, C 4, CCl a 5 kj/mol inducido Dipolodipolo inducido I 2acetona 2 a 5 kj/mol Dipolodipolo Acetona 5 a 20 kj/mol Puente de hidrógeno Alcoholes, agua 5 a 50 kj/mol Iondipolo Na( 2), Cu( 2) kj/(mol de pares iondipolo) Ionion KCl, Mg kj/(mol de pares iónicos) Enlace covalente sencillo 2, kj/mol Efectivamente en una disolución acuosa de una sal de níquel (como por ejemplo el NiS4) las moléculas de agua están tan fuertemente enlazadas con este catión, que al evaporar el agua, lo que se obtiene es cloruro de níquel hexahidratado, NiS4 62. Esta sustancia tiene propiedades fisicoquímicas distintas a las del NiS4 anhidro, debido a que realmente está constituida por cationes complejos de Ni(2)6 2 (hexaacuo níquel II) en los que las moléculas de agua y el ion Ni 2 están unidos mediante enlaces covalentes.
10 igura 3.11 Estructura del sulfato de níquel hexahidratado Entonces, tratándose de energías de asociación, hasta dónde puede considerarse que se trata de una interacción ión dipolo y a partir de dónde que se trata de un enlace covalente? El célebre Linus Pauling aseveraba que Diremos que existe un enlace químico entre dos átomos o grupos de átomos en el caso en el que las fuerzas que actúan entre ellos son tales que llevan a la formación de un agregado con suficiente estabilidad como para hacerle conveniente a un químico considerarlo como una especie molecular independiente. Es importante hacer énfasis en la palabra conveniente y en la palabra considerarlo. Como ya se comentó ampliamente en el capítulo anterior, los químicos estamos continuamente intentando clasificar tanto a las sustancias como a las interacciones. Sin embargo las propiedades de éstas varían de manera continua, por lo que muy a menudo la clasificación fracasa o se termina por crear una nueva categoría para las sustancias o las interacciones que se resisten a caer en alguna de las existentes. En otros casos, como éste, en que la división entre las categorías puede darse basándonos en alguna cantidad medible, suele ser arbitrario el valor de los límites que se le pone a esta cantidad para separar las categorías. Este es el caso ahora, ya que todas las interacciones que hemos descrito, tienen asociada una entalpía y recordemos que, como se discutió en el capítulo 2, la formación de cualquier enlace es un proceso exotérmico. A B AB < 0 La entalpía de hidratación se ha determinado experimentalmente para una gran cantidad de iones. La mayoría de los iones metálicos de los bloques s, p y d se enlazan con seis moléculas de agua cuando se encuentran en disolución. Por esto es que la entalpía de hidratación corresponde el cambio de energía para el siguiente proceso: En la tabla 3.e se presentan los valores de entalpía de hidratación para un conjunto de cationes metálicos, agrupados según su carga eléctrica y en orden creciente de tamaño. Puede verse claramente que el proceso de hidratación es más exotérmico entre más grande sea la carga de un ion y más pequeño sea su tamaño. Tabla 3.e Valores de entalpía de hidratación para diversos cationes. M hidr (kj/mol) M 2 hidr (kj/mol) M 3 hidr (kj/mol) Na 405 Mg Al K 321 Ca Cr Rb 296 Sr e Cs 263 Ba In
11 Una aplicación: La expulsión salina Muchas sustancias polares son solubles en agua gracias a las interacciones dipolodipolo que sus moléculas establecen con ella. Un ejemplo muy conocido es el del alcohol etílico (o etanol), que forma parte de muchas bebidas alcohólicas en combinación con el agua. Si a una mezcla de agua con etanol se le añade una cantidad suficiente de sal común (cloruro de sodio), el alcohol y el agua se pueden separar formando dos fases. Se sabe que los alquimistas descubrieron esto, ya que existen textos del siglo XII donde describen como añadiéndole sal al vino, podían obtener un agua inflamable. En la actualidad a este procedimiento de le conoce como expulsión salina (salting out) y se utiliza con frecuencia como método de separación. Preguntas y Ejercicios 1. En cada una de los incisos siguientes se presenta una pareja de sustancias, de las cuales una es gaseosa a temperatura ambiente, y la otra no. En cada pareja, señala cuál es la sustancia gaseosa y explica a qué se debe la diferencia a. C2 CCl2 b. CCl4 C4 c. Cl2 Br2 d. C3 C3 C3C2 e. C2Cl2 C4 f. Cl Na g. CS2 C2 h. N23 As23 2. Relacionar las siguientes columnas, asociando los hechos de la izquierda con el tipo de interacción que los gobierna La sal se disuelve en agua El etanol y el agua son miscibles El Br 2 es un líquido El Br 2 es una molécula diatómica El NaCl tiene una alta temperatura de fusión La acetona y el éter son miscibles Al mezclar I 2 con I se forma I 3 El I 2 se disuelve un poco en agua Interacción dipolo instantáneo dipolo inducido Interacción iónión Enlace covalente Interacción ión dipolo inducido Puente de hidrógeno Interacción dipolodipolo inducido Interacción dipolodipolo Interacción ióndipolo
12 3. El octano, que es un hidrocarburo contenido en las gasolinas, flota sobre el agua porque es menos denso que ésta. Explica, mediante fuerzas intermoleculares, esta diferencia en la densidad de estas dos sustancias. 4. Al agregar sal a un refresco con gas, éste se sale. Por qué? Qué tipo de interacción existe entre el gas (C2) y el agua del refresco, y cuál es la que existe entre la sal (NaCl) y el agua? 5. Antiguamente los tanques oxígeno para buceo se diluían con nitrógeno (N2), pero hace tiempo que se utiliza helio para este fin ya que el nitrógeno se disuelve considerablemente en la sangre a presiones elevadas, y al salir a la superficie, forma burbujas que pueden causar hasta la muerte del buceador. Con base en las interacciones químicas débiles, explica por qué el helio se disuelve menos en la sangre que el nitrógeno.
Interacciones químicas de no enlace. Fuerzas de van der Waals
 Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
Longitud y energía de enlace
 Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace.
 EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
1. Los elementos químicos
 RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
Actividad introductoria: Aplicación en la industria de las fuerzas intermoleculares.
 Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Práctica 6. Propiedades físicas y enlace químico
 Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
M +n X -n EL ENLACE QUIMICO. Clase 05
 EL ENLACE QUIMICO Clase 05 Cuando dos átomos se aproximan entre sí, se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tienden a unir los átomos, otras tienden a separarlos. En la mayoría
EL ENLACE QUIMICO Clase 05 Cuando dos átomos se aproximan entre sí, se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tienden a unir los átomos, otras tienden a separarlos. En la mayoría
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015)
 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS - (2015) Serie A - RADIOS ATOMICOS, VOLUMENES ATÓMICOS, PROPIEDADES GENERALES Serie B - ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA y ELECTRONEGATIVIDAD: Serie A:
Enlace químico. 5. Dadas las siguientes sustancias: CS 2 (lineal), HCN (lineal), NH 3 (piramidal) y H 2 O (angular):
 Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
SOLUCIONES EJERCICIOS DE ENLACE QUÍMICO. 1º BCT
 SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
OLIMPIADA DEPARTAMENTAL DE QUÍMICA NIVEL 2. iii. H 2 SO 3 iv. HF
 Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA NIVEL 2 NOMENCLATURA Y FORMULACIÓN (1) Nombre los siguientes compuestos (en una hoja aparte): i. NaBr ii. NaClO iii. H 2 SO 3 iv.
Nombre: Cédula de Identidad: Liceo: OLIMPIADA DEPARTAMENTAL DE QUÍMICA NIVEL 2 NOMENCLATURA Y FORMULACIÓN (1) Nombre los siguientes compuestos (en una hoja aparte): i. NaBr ii. NaClO iii. H 2 SO 3 iv.
Tema 4. Fuerzas intermoleculares
 Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos.
 Evolución histórica de la Tabla Periódica 1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos. 1869: Mendeleev y Meyer: las propiedades
Evolución histórica de la Tabla Periódica 1817: Döbreiner. Triadas de elementos con propiedades semejantes. 1865: Newlands. Ley de las octavas. Ordenó 55 elementos. 1869: Mendeleev y Meyer: las propiedades
Disoluciones. Química General II 2011
 Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
2. Cuál(es) de las siguientes propiedades periódicas aumenta(n) al incrementarse el número atómico en un grupo?
 Programa Estándar Anual Nº Guía práctica Teoría atómica III: tabla periódica y propiedades periódicas Ejercicios PSU 1. En un sistema periódico muy simplificado, como el que se muestra en la figura, los
Programa Estándar Anual Nº Guía práctica Teoría atómica III: tabla periódica y propiedades periódicas Ejercicios PSU 1. En un sistema periódico muy simplificado, como el que se muestra en la figura, los
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
Contenidos. 1.- Primeras clasificaciones periódicas.
 LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
LA TABLA PERIÓDICA. Contenidos 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 3.- Propiedades periódicas: 3.1. Tamaño de los átomos. Radios atómicos
EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA
 EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA Las 6 preguntas siguientes se refieren a la tabla periódica que se presenta. Los símbolos han sido asignados arbitrariamente. D H B A E M G J L R X Y N P Q Z T
EJERCICIO DE EXAMEN DE QUÍMICA INORGÁNICA Las 6 preguntas siguientes se refieren a la tabla periódica que se presenta. Los símbolos han sido asignados arbitrariamente. D H B A E M G J L R X Y N P Q Z T
QUÍMICA FUNDAMENTAL. Tabla Periódica
 QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
RESPUESTA Guía de ejercicios #5 Enlace químico
 Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
ESTRUCTURA DE LA MATERIA QCA 01 ANDALUCÍA. 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad.
 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
ORGANIZACIÓN DE LOS ELEMENTOS EN LA TABLA PERIÓICA PROPIEDADES PERIÓDICAS
 Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Nombre del estudiante: Grado: Asignatura: Química Tema: Organización de los elementos en la tabla periódica. Propiedades periódicas. Indicador de logro: Ubico un determinado elemento en la tabla periódica
Unidad I: Propiedades Periódicas: Masa y Enlace
 Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1
 GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
EJERCICIOS DE ENLACE. a) Amoniaco. b) Tricloruro de boro. c) Metano.
 EJERCICIOS DE ENLACE 1. Deduzca, según la teoría de Repulsión de Pares de Electrones de la Capa de Valencia, la geometría de las siguientes moléculas e indique la polaridad de las mismas: a) Amoniaco.
EJERCICIOS DE ENLACE 1. Deduzca, según la teoría de Repulsión de Pares de Electrones de la Capa de Valencia, la geometría de las siguientes moléculas e indique la polaridad de las mismas: a) Amoniaco.
LA TABLA PERIÓDICA. 1
 LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Contenido. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades periódicas:
 LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
LA TABLA PERIÓDICA Contenido Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica. 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades
Fuerzas de Van der Waals. Momento Dipolar
 Momento Dipolar Muchas moléculas eléctricamente neutras, esto es, sin carga neta, poseen una distribución de cargas no homogénea. Esto se debe a que los átomos que las forman tienen diferente electronegatividad,
Momento Dipolar Muchas moléculas eléctricamente neutras, esto es, sin carga neta, poseen una distribución de cargas no homogénea. Esto se debe a que los átomos que las forman tienen diferente electronegatividad,
DISOLUCIONES UNIDAD IV. Licda. Miriam Marroquín Leiva
 DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES
 Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES Todo gas, si se enfría y comprime suficientemente, se transforma en un líquido. La causa son las fuerzas intermoleculares, fuerzas de atracción
Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES Todo gas, si se enfría y comprime suficientemente, se transforma en un líquido. La causa son las fuerzas intermoleculares, fuerzas de atracción
CLASE Nº 4 ENLACE QUÍMICO
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
MÓDULO A: ácido-base y espectroscópicas de los compuestos orgánicos
 MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
Enlaces Químicos y Estados de la Materia
 Enlaces Químicos y Estados de la Materia 1.- Concepto de enlace químico Mientras que sólo hay alrededor de 118 elementos catalogados en la tabla periódica, obviamente hay más substancias en la naturaleza
Enlaces Químicos y Estados de la Materia 1.- Concepto de enlace químico Mientras que sólo hay alrededor de 118 elementos catalogados en la tabla periódica, obviamente hay más substancias en la naturaleza
LA MATERIA. Características de los átomos
 LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos
 3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
Líquido. Sólido. Gas Plasma. educacionsanitariaymas.blogspot.com.
 Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS
 TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS E2A.S2010 Para la molécula CH 3 Cl: a) Establezca su geometría mediante la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. b) Razone
TEMA 3- ENLACE QUÍMICO Y PROPIEDADES DE LA SUSTANCIAS E2A.S2010 Para la molécula CH 3 Cl: a) Establezca su geometría mediante la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. b) Razone
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato
 Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Preguntas Propuestas
 Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
A. VIVENCIA Elabora la siguiente sopa de letras y define los conceptos:
 INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
INSTITUCIÓN EDUCATIVA COLEGIO ARTISTICO RAFAEL CONTRERAS NAVARRO AREA: CIENCIAS NATURALES PROFESOR; JESÚS ALONSO PABA LEÓN ENLACES QUIMICOS Cómo se forman las sustancias químicas? COMPETENCIA: Construye
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
Capacidad de combinación. Capacidad de combinación La última capa de electrones de un átomo, se le conoce como capa de electrones de valencia
 Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
ANDALUCÍA / JUNIO 2000 LOGSE / QUÍMICA / OPCIÓN A /EXAMEN COMPLETO OPCIÓN A
 OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
4 Elementos y compuestos
 4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica.
 SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Teoría atómica III: tabla periódica y propiedades periódicas Nº Ejercicios PSU 1. En la tabla periódica, los elementos están ordenados según un valor creciente de su
Programa Técnico Profesional QUÍMICA Teoría atómica III: tabla periódica y propiedades periódicas Nº Ejercicios PSU 1. En la tabla periódica, los elementos están ordenados según un valor creciente de su
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
DIVERSIDAD Y ESTRUCTURA DE LA MATERIA. 2º ESO Ciencias de la naturaleza
 DIVERSIDAD Y ESTRUCTURA DE LA MATERIA 2º ESO Ciencias de la naturaleza Todo lo que vemos es materia CLASIFICACIÓN DE LA MATERIA La materia se presenta en la naturaleza en forma de sustancias puras y mezclas,
DIVERSIDAD Y ESTRUCTURA DE LA MATERIA 2º ESO Ciencias de la naturaleza Todo lo que vemos es materia CLASIFICACIÓN DE LA MATERIA La materia se presenta en la naturaleza en forma de sustancias puras y mezclas,
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13
 CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
TABLA PERIODICA. Ciencias naturales Ambientes Raymond Chang
 TABLA PERIODICA Ciencias naturales Ambientes Raymond Chang TABLA PERIODICA La organización más satisfactoria de los elementos fue obra de Dmitri Mendeleev, quien señalo que las propiedades, tanto físicas
TABLA PERIODICA Ciencias naturales Ambientes Raymond Chang TABLA PERIODICA La organización más satisfactoria de los elementos fue obra de Dmitri Mendeleev, quien señalo que las propiedades, tanto físicas
PRIMERAS CLASIFICACIONES PERIÓDICAS
 LA TABLA PERIÓDICA PRIMERAS CLASIFICACIONES PERIÓDICAS Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades variaban periódicamente
LA TABLA PERIÓDICA PRIMERAS CLASIFICACIONES PERIÓDICAS Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades variaban periódicamente
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
Problemario de Talleres de Estructura de la Materia. DCBI/UAM-I. Obra Colectiva del. / Revisión octubre del 2012 UNIDAD 2
 UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
UNIDAD 2 CAPAS ELECTRÓNICAS Y TAMAÑO DE LOS ÁTOMOS, ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA 1.- De acuerdo al modelo atómico propuesto por la mecánica cuántica, consideras que tiene sentido hablar
Introducción: La importancia del enlace. químicos. Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen
 Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
EJERCICIOS RESUELTOS DE ENLACE QUIMICO
 EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
Química Orgánica General
 Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres).
 Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
Capitulo 8 Fuerzas intermoleculares.
 Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
BIOQUÍMICA Y BIOLOGÍA MOLECULAR I CURSO 2003/04 ENLACE QUÍMICO
 BIQUÍMIA Y BILGÍA MLEULAR I URS 2003/04 Problemas 1º de Medicina UIVERSIDAD DE AVARRA DEPARTAMET DE BIQUÍMIA ELAE QUÍMI 1. rdenar por su estabilidad relativa (menor energía de ionización) los siguientes
BIQUÍMIA Y BILGÍA MLEULAR I URS 2003/04 Problemas 1º de Medicina UIVERSIDAD DE AVARRA DEPARTAMET DE BIQUÍMIA ELAE QUÍMI 1. rdenar por su estabilidad relativa (menor energía de ionización) los siguientes
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. LA TABLA PERIÓDICA.
 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. LA TABLA PERIÓDICA. A partir de la posición de los elementos en la tabla periódica formando grupos y períodos podemos deducir la evolución de algunas propiedades
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. LA TABLA PERIÓDICA. A partir de la posición de los elementos en la tabla periódica formando grupos y períodos podemos deducir la evolución de algunas propiedades
ACADEMIA DE QUÍMICA TURNO VESPERTINO
 INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
EJERCICIOS PROPUESTOS
 Solucionario 14 El enlace químico EJERCICIOS PROPUESTOS 14.1 Diferencia los cuatro tipos de estructuras sólidas: multimolecular, gigante covalente, gigante metálica y gigante iónica. Especifica cuáles
Solucionario 14 El enlace químico EJERCICIOS PROPUESTOS 14.1 Diferencia los cuatro tipos de estructuras sólidas: multimolecular, gigante covalente, gigante metálica y gigante iónica. Especifica cuáles
Conceptos básicos en estequiometría
 Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Ejercicios UD. 4 Elementos y Compuestos Física y Química CEPA COSLADA
 1.- En qué consistía la ley de las triadas? Quién la propuso? 2.- Por qué la tabla donde se ordenan los elementos químicos se llama tabla periódica? Los elementos están ordenados en la tabla periódica
1.- En qué consistía la ley de las triadas? Quién la propuso? 2.- Por qué la tabla donde se ordenan los elementos químicos se llama tabla periódica? Los elementos están ordenados en la tabla periódica
CIENCIAS II CON ENFASIS EN QUIMICA
 CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
ENLACE QUÍMICO. Cátedra de Química General e Inorgánica Año 2016
 ENLACE QUÍMIC Cátedra de Química General e Inorgánica Año 2016 ns (1-2) ns2 np (1-6) La cantidad y disposición de los electrones en la capa más externa determinan las propiedades físicas y químicas de
ENLACE QUÍMIC Cátedra de Química General e Inorgánica Año 2016 ns (1-2) ns2 np (1-6) La cantidad y disposición de los electrones en la capa más externa determinan las propiedades físicas y químicas de
Guía de Estudio para 1er Parcial Temas Selectos de Química
 Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
COLEGIO SAN JOSÉ - Hijas de María Auxiliadora C/ Emilio Ferrari, 87 - Madrid Departamento de Ciencias Naturales
 TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS Y SOLUCIONES 4. El sistema periódico 1. Escribe la configuración electrónica de los 3 primeros elementos alcalinotérreos y explica razonadamente si estos elementos
TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS Y SOLUCIONES 4. El sistema periódico 1. Escribe la configuración electrónica de los 3 primeros elementos alcalinotérreos y explica razonadamente si estos elementos
2/17/2013. La fuerza que mantiene unidos a los átomos de unamolécula. Es una fuerza química o intramolecular.
 FUERZAS INTERMOLECULARES Comparación molecular de gases, líquidos y sólidos Viscosidad y tensión superficial Cambios de fase Volatilidad, presión de vapor y punto de ebullición Fuerzas intramoleculares
FUERZAS INTERMOLECULARES Comparación molecular de gases, líquidos y sólidos Viscosidad y tensión superficial Cambios de fase Volatilidad, presión de vapor y punto de ebullición Fuerzas intramoleculares
