FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. OCTAGAMOCTA 100 mg/ml, solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
|
|
|
- Sergio Farías Serrano
- hace 6 años
- Vistas:
Transcripción
1 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO OCTAGAMOCTA 100 mg/ml, solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana normal para administración intravenosa (IGIV) * 100 mg/ml * Correspondiente a proteína total, de la cual al menos el 95% es inmunoglobulina G humana normal Distribución de las subclases de IgG: IgG1 ca. 60% IgG2 ca. 32% IgG3 ca. 7% IgG4 ca. 1% Contenido máximo en Ig A: 400 microgramos/ml Cada vial de 20 ml contiene 2 g de inmunoglobulina humana normal. Cada frasco de 50 ml contiene 5 g de inmunoglobulina humana normal. Cada frasco de 60 ml contiene 6 g de inmunoglobulina humana normal. Cada frasco de 100 ml contiene 10 g de inmunoglobulina humana normal. Cada frasco de 200 ml contiene 20 g de inmunoglobulina humana normal. Preparado a partir de plasma de donantes humanos. Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Solución para perfusión. El preparado líquido es transparente o ligeramente opalescente, e incoloro o ligeramente amarillo. El ph del preparado líquido es 4,5 5,0; la osmolalidad es 240 mosmol/kg. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Terapia de sustitución en adultos, así como en niños y adolescentes (de 0 a 18 años) con: Síndromes de inmunodeficiencia primaria con producción deficiente de anticuerpos (ver sección 4.4). Hipogammaglobulinemia e infecciones bacterianas recurrentes en pacientes con leucemia linfocítica crónica, en los que los antibióticos profilácticos no han resultado efectivos. Hipogammaglobulinemia e infecciones bacterianas recurrentes en pacientes que se encuentran en la fase de meseta de un mieloma múltiple que no han respondido a la inmunización antineumocócica. Hipogammaglobulinemia en pacientes tras someterse a un alotrasplante de células madre hematopoyéticas (HSCT por sus siglas en inglés). SIDA congénito con infecciones bacterianas recurrentes Inmunomodulación en adultos, así como niños y adolescentes (de 0 a 18 años) con: Púrpura trombocitopénica inmunitaria (PTI), en pacientes con un alto riesgo de hemorragia o antes de una intervención quirúrgica para corregir el recuento plaquetario. Síndrome de Guillain Barré Enfermedad de Kawasaki 1 de 14
2 Polineuropatía desmielinizante inflamatoria crónica (CIDP). Solamente se dispone de experiencia limitada sobre el uso de las inmunoglobulinas intravenosas en niños con CIDP. 4.2 Posología y forma de administración Los tratamientos de reemplazo deberían iniciarse y monitorizarse bajo la supervisión de un médico experimentado en el tratamiento de inmunodeficiencias Posología La dosis y la pauta posológica dependen de la indicación. En la terapia de sustitución es posible que se deba individualizar la dosis para cada paciente dependiendo de su respuesta farmacocinética y clínica. Las siguientes pautas posológicas se pueden usar como referencia: Terapia de sustitución en síndromes de inmunodeficiencia primaria: La pauta posológica debe alcanzar un nivel valle de IgG (medido antes de la perfusión siguiente) de al menos 5-6 g/l. Se requieren de tres a seis meses después del inicio de la terapia para llegar al equilibrio. La dosis inicial recomendada es de 0,4 0,8 g/kg en una sola dosis, seguida de al menos 0,2 g/kg cada tres o cuatro semanas. La dosis requerida para alcanzar un nivel valle de 5-6 g/l es del orden de 0,2 0,8 g/kg/mes. El intervalo de dosificación cuando se ha alcanzado el estado de equilibrio varía de 3 a 4 semanas. Deberían medirse y evaluarse los niveles mínimos, junto con la incidencia de la infección. Para reducir la tasa de infección puede resultar necesario incrementar la dosificación y perseguir niveles mínimos mayores. Hipogammaglobulinemia e infecciones bacterianas recurrentes en pacientes con leucemia linfocítica crónica, en los que los antibióticos profilácticos no han resultado efectivos; hipogammaglobulinemia e infecciones bacterianas recurrentes en pacientes que se encuentran en la fase de meseta de un mieloma múltiple que no han respondido a la inmunización antineumocócica; SIDA congénito con infecciones bacterianas recurrentes: La dosis recomendada es de 0,2 0,4 g/kg cada tres o cuatro semanas. Hipogammaglobulinemia en pacientes tras someterse a un alotrasplante de células madre hematopoyéticas: La dosis recomendada es de 0,2-0,4 g/kg cada tres o cuatro semanas. El nivel mínimo debería mantenerse por encima de los 5 g/l. Púrpura trombocitopénica inmunitaria: Existen dos pautas de tratamiento alternativas: 0,8-1g/kg administrado una vez al día; esta dosis debería repetirse una vez en el plazo de 3 días 0,4 g/kg administrado diariamente durante 2-5 días. El tratamiento se puede repetir si hay una recaída. Síndrome de Guillain Barré: 0,4 g/kg/día durante 5 días. Enfermedad de Kawasaki: Deben administrarse 1,6 2,0 g/kg en dosis fraccionadas durante 2-5 días, o bien 2,0 g/kg en una sola dosis. Los pacientes han de recibir un tratamiento concomitante con ácido acetilsalicílico. Polineuropatía desmielinizante inflamatoria crónica (CIDP): 2 g (20 ml)/kg Peso Corporal como dosis inicial en dosis fraccionadas hasta 5 días consecutivos cada 4 semanas. 2 de 14
3 La dosis de mantenimiento (dosificación e intervalo del mismo) debe ser adaptado a la respuesta clínica individual. Si no hay mejora dentro de los 3 primeros meses, la terapia deberá ser descontinuada. Las dosis recomendadas se resumen en la siguiente tabla: Indicación Dosis Frecuencia de inyección Terapia de sustitución en inmunodeficiencia primaria - Dosis inicial: 0,4 0,8 g/kg - Posteriormente: 0,2 0,8 g/kg cada 3 4 semanas para obtener un nivel mínimo de IgG de al menos 5 6 g/l Terapia de sustitución en inmunodeficiencia secundaria SIDA congénito Hipogammaglobulinemia (< 4 g/l) en pacientes tras someterse a un alotrasplante de células madre hematopoyéticas Inmunomodulación: Púrpura trombocitopénica inmunitaria 0,2 0,4 g/kg 0,2 0,4 g/kg 0,2 0,4 g/kg 0,8 1 g/kg o 0,4 g/kg/día cada 3 4 semanas para obtener un nivel mínimo de IgG de al menos 5 6 g/l cada 3 4 semanas cada 3-4 semanas para obtener un nivel mínimo de IgG superior a 5 g/l. el primer día, posiblemente repetido una vez en el plazo de 3 días durante 2 5 días Síndrome de Guillain Barré 0,4 g/kg/día durante 5 días Enfermedad de Kawasaki Polineuropatía desmielinizante inflamatoria crónica (CIDP) 1,6 2 g/kg o en dosis fraccionadas durante 2-5 días, en asociación con ácido acetilsalicílico 2 g/kg en una dosis, en asociación con ácido acetilsalicílico Dosis inicial 2 g/kg en dosis fraccionadas hasta 5 días consecutivos cada 4 semanas Dosis de mantenimiento la dosificación y su intervalo deberá ser adaptado a la respuesta clínica individual. Población pediátrica La posología en niños y adolescentes (de 0 a 18 años) no se diferencia de la de los adultos, dado que la posología correspondiente a cada indicación viene dada por el peso corporal y se ajusta al resultado clínico de las enfermedades mencionadas anteriormente. Polineuropatía desmielinizante inflamatoria crónica (CIDP): 3 de 14
4 La experiencia con el uso de inmunoglobulinas intravenosas en niños con CIDP solamente es limitada. Los datos publicados muestran que las inmunoglobulinas intravenosas son igual de eficaces en niños que en adultos con CIDP Forma de administración Para uso intravenoso. Octagamocta 100 mg/ml debe administrarse como perfusión intravenosa a una velocidad inicial de 0,01 ml/kg de peso corporal por minuto durante 30 minutos. Si se tolera bien (ver sección 4.4), la velocidad de administración se puede aumentar gradualmente hasta un máximo de 0,12 ml/kg de peso corporal por minuto. 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes de Octagamocta 100 mg/ml (ver sección 4.4). Hipersensibilidad a inmunoglobulinas humanas, especialmente en pacientes con anticuerpos contra IgA. 4.4 Advertencias y precauciones especiales de empleo Esta especialidad farmacéutica contiene 90 mg de maltosa por ml a modo de excipiente. La interferencia de la maltosa en los análisis de glucosa en sangre puede provocar falsos valores elevados de glucosa y, como consecuencia, conducir a la administración inadecuada de insulina, dando lugar a una grave hipoglucemia e incluso la muerte. Asimismo, casos reales de hipoglucemia podrían quedarse sin tratamiento si el estado de la hipoglucemia queda enmascarado por los falsos valores elevados de glucosa (ver sección 4.5). Consulte más adelante la información sobre el fallo renal agudo. Algunas reacciones farmacológicas adversas graves pueden estar relacionadas con la velocidad de perfusión. Debe seguirse rigurosamente la velocidad de perfusión recomendada indicada bajo sección 4.2. Los pacientes han de ser atentamente controlados y cuidadosamente observados por si aparece algún síntoma durante el periodo de perfusión. Ciertas reacciones adversas pueden aparecer con mayor frecuencia: en caso de una velocidad de perfusión elevada en pacientes que reciben inmunoglobulina humana normal por primera vez o, en casos raros, cuando se cambia el producto de inmunoglobulina humana normal o cuando ha transcurrido un intervalo prolongado desde la perfusión anterior Con frecuencia, las complicaciones potenciales se pueden evitar si se asegura que los pacientes: no sean sensibles a la inmunoglobulina humana normal mediante una primera inyección lenta del producto (0,01 a 0,02 ml/kg de peso corporal por minuto); sean monitorizados cuidadosamente para comprobar la aparición de cualquier síntoma durante el periodo de perfusión; en particular, los pacientes a los que no se ha administrado previamente inmunoglobulina humana normal, los pacientes a los que se ha cambiado de un producto de IGIV distinto a Octagamocta 100 mg/ml o cuando ha transcurrido un intervalo prolongado desde la perfusión anterior, deben monitorizarse durante la primera perfusión y durante la primera hora siguiente para detectar signos de potenciales efectos adversos. El resto de pacientes deben ser observados como mínimo durante los 20 minutos siguientes a la administración. En el caso de una reacción adversa, debe reducirse la velocidad de administración o interrumpirse la perfusión. El tratamiento requerido dependerá de la naturaleza y gravedad del efecto secundario. En caso de shock, deberá aplicarse el tratamiento médico estándar para la terapia de shocks. 4 de 14
5 En todos los pacientes, la administración de IGIV requiere: una hidratación adecuada antes de iniciar la perfusión con IGIV un control de la excreción de orina un control de los niveles séricos de creatinina evitar el uso concomitante de diuréticos de asa Esta especialidad farmacéutica no contiene más de 0,03 mmol (o 0,69 mg) de sodio por ml. Dato que deben tener en cuenta aquellos pacientes que estén sometidos a una dieta de sodio controlada. Hipersensibilidad Son raras las reacciones de hipersensibilidad verdaderas. Éstas pueden aparecer en casos de deficiencia de IgA con anticuerpos anti-iga que son muy infrecuentes. La IGIV no está indicada en pacientes con deficiencia selectiva de IgA, donde la deficiencia de IgA es la única anomalía relevante. Raramente, la inmunoglobulina humana normal puede provocar un descenso en la presión sanguínea con reacción anafiláctica, incluso en pacientes que habían tolerado tratamientos previos con inmunoglobulina humana normal. Tromboembolismo Existen pruebas clínicas de una asociación entre la administración de IGIV y eventos tromboembólicos, como infarto de miocardio, accidente cerebrovascular (incluido ictus), embolismo pulmonar y trombosis venosa profunda, que se supone que están relacionados con un aumento relativo de la viscosidad sanguínea por el flujo elevado de inmunoglobulina en pacientes de riesgo. Debe tenerse precaución al prescribir e administrar por perfusión IGIV a pacientes obesos y a pacientes con factores de riesgo preexistentes de eventos trombóticos (como edad avanzada, hipertensión, diabetes mellitus y un historial de enfermedades vasculares o episodios trombóticos, pacientes con alteraciones trombofílicas adquiridas o heredadas, pacientes con períodos prolongados de inmovilización, pacientes con hipovolemia grave, pacientes con enfermedades que aumentan la viscosidad sanguínea). En pacientes con riesgo de sufrir reacciones adversas tromboembólicas, los productos IGIV deberían administrarse a las dosis y velocidades mínimas posibles. Fallo renal agudo Se ha informado de casos de insuficiencia renal aguda en pacientes a los que se les estaba administrando una terapia de IGIV. En la mayoría de los casos, se han identificado factores de riesgo, como insuficiencia renal preexistente, diabetes mellitus, hipovolemia, sobrepeso, productos medicinales nefrotóxicos concomitantes o una edad superior a 65 años. En caso de insuficiencia renal, debe considerarse la posibilidad de interrumpir la terapia con IGIV. A pesar de que estos informes de disfunción renal y de fallo renal agudo se han asociado con el uso de muchos de los productos de IGIV autorizados que contienen varios excipientes como la sacarosa, la glucosa y la maltosa, los que contienen sacarosa como estabilizante representan una parte desproporcionada del número total. En los pacientes de riesgo, debe considerarse el uso de productos de IGIV que no contengan tales excipientes. Octagamocta 100 mg/ml contiene maltosa (ver excipientes). En los pacientes con riesgo de fallo renal agudo, los productos de IGIV deben administrarse a las dosis y velocidades de perfusión mínimas posibles. Síndrome de meningitis aséptica (SMA) Se ha notificado la aparición del síndrome de meningitis aséptica asociada con el tratamiento IGIV. La interrupción del tratamiento con IGIV ha resultado en la remisión del SMA en un plazo de varios días y sin secuelas. El síndrome suele comenzar entre unas horas y 2 días después del tratamiento con IGIV. Los estudios del líquido cefalorraquídeo son a menudo positivos, mostrando pleocitosis de hasta varios miles de células por mm 3, predominantemente de la serie granulocítica, así como elevados niveles de proteínas hasta varios cientos de mg/dl. 5 de 14
6 El SMA puede darse con más frecuencia asociado a tratamientos con altas dosis de IGIV (2 g/kg). Anemia hemolítica Los productos IGIV pueden contener anticuerpos de grupo sanguíneo que pueden actuar como hemolisinas, induciendo un recubrimiento in vivo de los glóbulos rojos con inmunoglobulina, causando una reacción de antiglobulina directa positiva (prueba de Coombs) y, rara vez, hemólisis. La anemia hemolítica puede desarrollarse a consecuencia del tratamiento con IGIV, debido al aumento del secuestro de glóbulos rojos. El desarrollo de la hemolisis está asociado con los siguientes factores de riesgo: administración de altas dosis de IGIV a dosis única o fraccionada a lo largo de varios días; grupos sanguíneos distintos del grupo O; enfermedad inflamatoria subyacente. La hemolisis solo se ha observado raramente en pacientes con terapia de sustitución en IDP.Deben monitorizarse los signos y síntomas clínicos de hemólisis en los receptores de IGIV. (Ver sección 4.8.). Interferencia con pruebas serológicas Tras la inyección de inmunoglobulina, el aumento transitorio de diversos anticuerpos transferidos pasivamente a la sangre de los pacientes puede dar lugar a falsos positivos en pruebas serológicas. La transmisión pasiva de anticuerpos a antígenos eritrocitarios, por ejemplo, A, B, D, puede interferir con algunas pruebas serológicas de anticuerpos de glóbulos rojos, como por ejemplo la prueba directa de antiglobulina (DAT, prueba directa de Coombs). Agentes susceptibles de transmisión Para prevenir la transmisión de enfermedades infecciosas cuando se administran medicamentos derivados de la sangre o plasma humanos, se toman medidas estándar como la selección de donantes, análisis de marcadores específicos de infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar / inactivar virus. A pesar de esto, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente. Esto también se refiere a virus y agentes infecciosos emergentes o de naturaleza desconocida. Estas medidas se consideran efectivas para virus envueltos como VIH, VHB y VHC. Las medidas tomadas pueden tener un valor limitado frente a virus no envueltos, como el VHA y parvovirus B19. Existe experiencia clínica que confirma la ausencia de transmisión de hepatitis A o parvovirus B19 con las inmunoglobulinas y se asume asimismo que el contenido de anticuerpos constituye una importante contribución a la seguridad vírica. A fin de mantener la trazabilidad del producto se recomienda encarecidamente que, cada vez que se administre a un paciente Octagamocta 100 mg/ml se deje constancia del nombre del medicamento y número de lote administrado. Lesión pulmonar aguda relacionada con la transfusión (TRALI) Hay notificación de casos de edema pulmonar no cardiogénico [lesión pulmonar aguda relacionada con la transfusión (TRALI)] en pacientes a los que se había tratado con IGIV. Por ello, este efecto adverso no se puede excluir totalmente para Octagamocta 100 mg/ml, aun cuando no se ha observado ningún caso hasta la fecha con Octagamocta 100 mg/ml. TRALI se caracteriza por presentar síndrome de distrés respiratorio agudo, edema pulmonar, función ventricular izquierda normal y fiebre; normalmente se produce dentro de las 1-6 horas posteriores a la transfusión. Velocidad de sedimentación globular (falsamente) elevada En pacientes que estén recibiendo IGIV como terapia, la velocidad de sedimentación globular (VSG) puede verse falsamente incrementada (aumento no inflamatorio). Sobrecarga (de volumen) circulatorio 6 de 14
7 La sobrecarga (de volumen) de la circulación puede producirse cuando el volumen perfundido de IGIV (o de cualquier otro producto derivado de plasma o sangre) y otras transfusiones coincidentes causan hipervolemia aguda y edema pulmonar agudo. Reacciones locales en el lugar de la inyección: Se han identificado reacciones locales en el lugar de la inyección entre las que se que podrían incluir extravasación, eritema en el lugar de la inyección, prurito en el lugar de la inyección y síntomas similares Población pediátrica No existen advertencias o precauciones específicas o adicionales aplicables a la población pediátrica 4.5 Interacción con otros medicamentos y otras formas de interacción Con el fin de terminar la perfusión del producto que haya podido quedar en los tubos al finalizar la perfusión, puede hacerse circular por el tubo una solución salina al 0,9% o de dextrosa al 5%. Vacunas con virus vivos atenuados La administración de inmunoglobulina puede disminuir durante un periodo de como mínimo 6 semanas y hasta 3 meses la eficacia de vacunas con virus vivos atenuados, tales como el sarampión, la rubéola, las paperas y la varicela. Tras la administración de este producto, deberá transcurrir un período de 3 meses antes de la vacunación con virus vivos atenuados. En el caso del sarampión, esta disminución puede persistir hasta un año. Por lo tanto, en los pacientes a los que se les administre la vacuna contra el sarampión deberá controlarse el estado de sus anticuerpos. Prueba de glucosa en sangre Algunos tipos de sistemas de pruebas de glucosa (por ejemplo, los basados en los métodos de la glucosa deshidrogenasa pirroloquinolinequinona (GDH PQQ) o la glucosa-coloranteoxidorreductasa) interpretan de forma errónea la maltosa (90 mg/ml) contenida en Octagamocta 100 mg/ml como glucosa. Esto puede provocar lecturas elevadas de glucosa falsas durante una perfusión o un periodo de unas 15 horas tras finalizar la perfusión y, como consecuencia, conducir a la administración inadecuada de insulina, dando lugar a una hipoglucemia que puede provocar la muerte. Asimismo, los casos de hipoglucemia auténtica pueden ser pasados por alto y no ser tratados si el estado hipoglucémico queda enmascarado por lecturas elevadas de glucosa falsas. Como consecuencia, a la hora de administrar Octagamocta 100 mg/ml u otros productos parenterales que contengan maltosa, la medición de la glucosa en sangre debe realizarse con un método específico para la glucosa. Debe revisarse detenidamente la información del material del Kit de ensayo para las pruebas de glucosa en sangre, incluyendo las tiras de glucosa, para determinar si el sistema es apropiado para utilizarlo con productos parenterales que contengan maltosa. Si tiene alguna duda, contacte con el fabricante del sistema de pruebas, para determinar si el sistema es apropiado para utilizarlo con productos parenterales que contengan maltosa Población pediátrica No se observaron interacciones específicas o adicionales para la población pediátrica. 4.6 Fertilidad, embarazo y lactancia Embarazo La seguridad de este producto durante el embarazo no se ha determinado en ensayos clínicos controlados y, por lo tanto, debe administrarse con precaución a mujeres embarazadas y lactantes. Se ha demostrado que los productos IGIV atraviesan con frecuencia la placenta, especialmente durante el tercer trimestre. La experiencia clínica con inmunoglobulinas indica que no deben esperarse efectos perjudiciales durante el embarazo, ni en el feto ni en el recién nacido. 7 de 14
8 4.6.2 Lactancia Las inmunoglobulinas se excretan en la leche materna y pueden contribuir a proteger al neonato frente a los patógenos que penetran a través de las mucosas Fertilidad La experiencia clínica con inmunoglobulinas sugiere que no cabe esperar efectos perjudiciales sobre la fertilidad. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas La capacidad para conducir y utilizar máquinas puede verse afectada por algunas reacciones adversas asociadas con el uso de Octagamocta 100 mg/ml. Los pacientes que experimentan reacciones adversas durante el tratamiento deberán esperar a que estas se resuelvan antes de conducir o utilizar máquinas. 4.8 Reacciones adversas Resumen del perfil de seguridad Pueden producirse ocasionalmente reacciones adversas como escalofríos, dolor de cabeza, mareos, fiebre, vómitos, reacciones alérgicas, náuseas, artralgia, presión arterial baja y lumbalgia moderada. Las reacciones a las inmunoglobulinas intravenosas tienden a estar relacionadas con la dosis y la frecuencia de la perfusión. Raramente las inmunoglobulinas humanas normales pueden provocar un descenso repentino de la presión arterial y, en casos aislados, shocks anafilácticos, incluso aunque el paciente no haya demostrado ningún tipo de hipersensibilidad en administraciones previas. Se han observado casos de meningitis aséptica reversible y casos raros de reacciones cutáneas transitorias con inmunoglobulina humana normal. Se han observado reacciones hemolíticas reversibles en pacientes, y especialmente en aquellos con los grupos sanguíneos A, B, y AB. Rara vez puede desarrollarse anemia hemolítica que requiere transfusión sanguínea tras administrar tratamientos con dosis altas de IGIV (ver también sección 4.4). Se ha observado también un aumento del nivel de creatinina en el suero y/o un fallo renal agudo. Muy raramente: reacciones tromboembólicas como infarto de miocardio, ictus, embolismo pulmonar y trombosis venosa profunda. Al administrar medicamentos preparados a partir de sangre o plasma humano, no puede excluirse totalmente la posibilidad de transmitir agentes infecciosos. Esto también incluye virus desconocidos o emergentes y otros patógenos. Para más información sobre agentes susceptibles de transmisión, véase la sección 4.4. Tabla de reacciones adversas La tabla presentada a continuación ha sido elaborada conforme al sistema de clasificación de órganos de MedDRA (Grupo SOC -del inglés System Organ Class, Grupo Sistémico- y Nivel de Término Preferente). Las frecuencias han sido evaluadas conforme a los valores: muy frecuentes ( 1/10); frecuentes ( 1/100 a < 1/10); poco frecuentes ( 1/1.000 a < 1/100); raras ( 1/ a < 1/1.000); muy raras (< 1/10.000), desconocido (no se puede estimar con los datos existentes). La frecuencia en la siguiente tabla, deriva de los ensayos clínicos que se han realizado con Octagamocta, (las columnas nombradas como Frecuentes y Poco frecuentes ) y de la experiencia post autorización con Octagamocta (columna Muy raras ) Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. 8 de 14
9 Conforme a MedDRA 8.1 Frecuentes 1/100 a < 1/10 Poco frecuentes 1/1.000 a < 1/100 Muy raras < 1/ Trastornos de la sangre y del sistema linfático anemia hemolítica; leucopenia; Trastornos del sistema inmunológico (ver sección 4.4) hipersensibilidad shock anafiláctico; reacción anafiláctica; reacción anafilactoide; angioedema; edema facial Trastornos del metabolismo y de la nutrición sobrecarga de líquidos; (pseudo)hiponatremia Trastornos psiquiátricos estado de confusión; agitación ; ansiedad; nerviosismo Trastornos del sistema nervioso cefalea accidente cerebrovascular (ver sección 4.4); meningitis aséptica; pérdida de conocimiento; trastornos del habla; migraña; mareos; hipoestesia; parestesia; fotofobia;; temblor Trastornos oculares alteración visual Trastornos cardíacos infarto de miocardio (ver sección 4.4); angina de pecho; bradicardia; taquicardia; palpitaciones; cianosis Trastornos vasculares Trombosis (ver sección 4.4); colapso circulatorio; fallo circulatorio periférico; fallo circulatorio periférico; flebitis; hipotensión; hipertensión; palidez Trastornos respiratorios, torácicos y mediastínicos fallo respiratorio; embolismo pulmonar (ver sección 4.4); edema pulmonar; broncoespasmo; hipoxia; disnea; tos Trastornos gastrointestinales náuseas vómitos; diarrea; dolor abdominal Trastornos de la piel y del tejido subcutáneo eczema exfoliación de la piel; urticaria; erupción cutánea; 9 de 14
10 Trastornos musculoesqueléticos y del tejido conjuntivo Trastornos renales y urinarios Trastornos generales y alteraciones en el lugar de administración Exploraciones complementarias fiebre; fatiga; reacción en el lugar de la inyección dolor lumbar escalofríos; dolor en el pecho erupción eritematosa; dermatitis; prurito; alopecia; eritema artralgia; mialgia; dolor en las extremidades dolor de cuello; espasmos musculares; debilidad muscular; rigidez musculoesquelética fallo renal agudo (ver sección 4.4); dolor renal edema; enfermedad de tipo gripal; sofocos; rubor; sensación de frío; sensación de calor; hiperhidrosis; malestar; malestar torácico; astenia; letargia; sensación de quemazón; aumento de las enzimas hepáticas; falso positivo de glucosa en sangre (ver sección 4.4) Descripción de reacciones adversas seleccionadas Para ver la descripción de las reacciones adversas seleccionadas, véase la sección Población pediátrica En estudios clínicos con Octagamocta, la mayor parte de las reacciones adversas observadas en niños fueron clasificadas como leves y muchas de ellas respondían a medidas simples tales como la reducción de la velocidad de perfusión o la interrupción temporal de la misma. Respecto al tipo de reacción adversa, todas fueron reconocidas para preparados de IGIV. La reacción adversa más frecuente observada en la población pediátrica fue la cefalea. Notificación de sospechas de reacciones adversas Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Esto permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar cualquier sospecha de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: Sobredosis Una sobredosis puede producir una sobrecarga de fluidos e hiperviscosidad, particularmente en pacientes de riesgo, incluyendo ancianos y pacientes con insuficiencias cardíacas o renales. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: inmunoglobulinas y sueros inmunes: inmunoglobulinas humanas normales para administración intravascular 10 de 14
11 Código ATC: J06B A02 La inmunoglobulina humana normal contiene principalmente inmunoglobulina G (IgG) con un amplio espectro de anticuerpos contra agentes infecciosos. La inmunoglobulina humana normal contiene los anticuerpos de IgG presentes en la población normal. Se prepara a partir de plasma almacenado de no menos de 1000 donaciones. Tiene una distribución de las subclases G de inmunoglobulina prácticamente proporcional a la del plasma humano natural. Unas dosis adecuadas de este medicamento pueden devolver un nivel de inmunoglobulina G anormalmente bajo a la condición normal. El mecanismo de acción en indicaciones distintas a la terapia de sustitución no se conoce totalmente, pero incluye efectos inmunomoduladores. Estudios clínicos En un estudio prospectivo, abierto, multicéntrico, de fase III, se estudió la eficacia y la seguridad de Octagamocta 100 mg/ml en pacientes con púrpura trombocitopénica idiopática (inmune) (PTI). Se administró Octagamocta 100 mg/ml por perfusión en 2 días consecutivos a una dosis de 1 g/kg/día, y se observó a los pacientes durante un periodo de 21 días y en una visita de seguimiento 63 días tras la perfusión. Los parámetros de hematología se evaluaron en los días 2 a 7, 14 y 21. Se incluyó un total de 31 sujetos en el análisis; 15 sujetos padecían PTI crónica, 15 sujetos eran recién diagnosticados, y 1 sujeto se inscribió por error en el estudio (no padecía PTI), por lo que fue excluido del análisis de eficacia. En total, 25 sujetos (83%) mostraron una respuesta clínica. Se apreció una respuesta clínica más alta en los sujetos recién diagnosticados (93%) que en los sujetos con PTI crónica (73%). En los sujetos que mostraron respuesta clínica, el plazo medio de respuesta plaquetaria fue de 2 días, con un margen de 1 a 5 días. En 24 sujetos (77%), Octagamocta 100 mg/ml se administró a la velocidad máxima permitida de perfusión de 0,06 ml/kg/min. Tras una revisión del protocolo, a 2 pacientes del análisis presentado se les administró el producto a una velocidad de 0,08 ml/kg/min, lo cual no produjo incidentes notables en ninguno de ambos casos. En la continuación de este estudio en curso, 22 sujetos han sido tratados con la velocidad máxima permitida de perfusión de 0,12 ml/kg/min. En 9 de las 62 perfusiones (14,5%) se han observado reacciones adversas a la perfusión relacionadas con el tratamiento. La reacción adversa farmacológica más frecuente fue la cefalea, seguida de la taquicardia y la pirexia. No se produjeron casos de hemólisis relacionados con el fármaco del estudio. No se dio tratamiento previo para aliviar la intolerancia a la perfusión. Polineuropatía desmielinizante inflamatoria crónica (CIDP): Un estudio retrospectivo incluyó datos de 46 pacientes con polineuropatía desmielinizante inflamatoria crónica (CIDP), que habían sido tratados con Octagamocta 50 mg/ml. El análisis de eficacia incluyó a 24 pacientes de los que 11 de ellos no fueron tratados (grupo 1) y 13 que no habían recibido inmunoglobulina en las 12 semanas previas al inicio de la terapia con Octagamocta 50 mg/ml (grupo2). El grupo 3 estaba compuesto por 13 pacientes que habían sido tratados previamente con inmunoglobulinas (administradas durante las 12 semanas previas al inicio de la administración de Octagamocta 50 mg/ml). El tratamiento fue considerado como eficaz si el ONLS -Overall Neuropathy Limitations Scale (escala global de limitaciones por neuropatía)- se reducía en al menos un punto dentro de los 4 primeros meses desde el inicio del tratamiento. En los grupos 1 y 2, la puntuación se redujo significativamente en un 41,7% de los pacientes (p = 0,02). Sólo 3 de los 13 pacientes (23,08%) del grupo 3 (tratados previamente con IGIV) mostraron una mejora en el ONLS; 10 pacientes se mantuvieron 11 de 14
12 estables. Para los pacientes tratados previamente con IGIV no hubo una mejoría más marcadade lo esperado según la ONSL (Escala global de limitaciones por neuropatía). La edad media de los pacientes examinados fue de 65 años, lo cual es mayor que en otros estudios CIDP. En pacientes mayores de 65 años, la tasa de respuesta fue menor que en pacientes más jóvenes. Esto está en concordancia con los datos publicados Población pediátrica No se han realizado estudios específicos con Octagamocta 100 mg/ml en población pediátrica. Sin embargo, se realizó un estudio prospectivo abierto de fase III de Octagamocta 50 mg/ml con 17 niños/adolescentes (edad media de 14,0 años, rango de 10,5 a 16,8) que padecían desórdenes de inmunodeficiencia primaria. Los pacientes fueron tratados durante un período de 6 meses. La eficacia clínica fue satisfactoria, dado que el número de días con infecciones o fiebre, así como el número de días de absentismo escolar, fueron bajos, y el tipo y gravedad de las infecciones fue comparable a los observados en la población normal. No se observaron infecciones graves que conllevaran hospitalización. También es digno de mención que el número de episodios infecciosos fue menor cuando los niveles de plasma IgG se mantuvieron alrededor de los 6 g/l que cuando estuvieron alrededor de los 4 g/l. 5.2 Propiedades farmacocinéticas La inmunoglobulina humana normal está biodisponible inmediata y completamente en la circulación del individuo receptor tras la administración intravenosa. Se distribuye de modo relativamente rápido desde el plasma y el fluido extravascular. Al cabo de aproximadamente 3 5 días, se alcanza el equilibrio entre los compartimentos intra- y extravasculares. La inmunoglobulina humana normal tiene una vida media que oscila de 26 a 41 días, según se ha determinado en pacientes inmunodeficientes. Esta vida media varía de un paciente a otro, en particular en la inmunodeficiencia primaria. Para Octagamocta 100 mg/ml, no se han obtenido datos formales de farmacocinética en pacientes inmunodeficientes. La IgG y los complejos de IgG se fragmentan en las células del sistema reticuloendotelial. Población pediátrica No se han realizado estudios específicos con Octagamocta 100 mg/ml en población pediátrica. Sin embargo, se realizó un estudio prospectivo abierto de fase III de Octagamocta 50 mg/ml con 17 niños/adolescentes (edad media de 14,0 años, rango de 10,5 a 16,8) que padecían desórdenes de inmunodeficiencia primaria. Los pacientes fueron tratados durante un período de 6 meses. Durante el período de tratamiento, la C max media en estado de equilibrio fue de 11,1 ± 1,9 g/l; el nivel mínimo medio fue de 6,2 ± 1,8 g/l. La vida media terminal del IgG total fue de 36 ± 11 días, con un promedio de 34 días. El volumen de distribución del IgG total fue de 3,7 ± 1,4 L, y el aclaramiento corporal total fue de 0,07 ± 0,02 L/al día. 5.3 Datos preclínicos sobre seguridad Las inmunoglobulinas son componentes normales del cuerpo humano. Estudios de toxicidad, genotoxicidad y toxicidad en la reproducción de animales con dosis repetidas, no se puede realizar, por la inducción e interferencia debida al desarrollo de anticuerpos ante las proteínas heterólogas. Dado que la experiencia clínica no evidencia un potencial carcinogénico o mutagénico de las inmunoglobulinas, no se han realizado estudios experimentales en especies heterólogas. 12 de 14
13 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Maltosa Agua para preparaciones inyectables 6.2 Incompatibilidades En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros productos medicinales. 6.3 Periodo de validez 2 años 6.4 Precauciones especiales de conservación Conservar en nevera (entre 2 C y 8 C). No congelar. Conservar el envase en el embalaje exterior para protegerlo de la luz. El producto puede ser sacado de la nevera por un solo periodo de 9 meses (sin sobrepasar la fecha de caducidad) y ser almacenado a una temperatura no superior a 25ºC. Al final, de este periodo, el medicamento, no debe ser refrigerado de nuevo y debe ser eliminado. La fecha en la que el medicamento ha salido de la nevera debe ser registrada en el cartonaje exterior. 6.5 Naturaleza y contenido del envase Tamaños: 2 g en 20 ml 5 g en 50 ml 6 g en 60 ml 10 g en 100 ml 20 g en 200 ml 3 x 10 g en 3 x 100 ml 3 x 20 g en 3 x 200 ml Puede que solamente estén comercializados algunos tamaños de envases. 20 ml de solución en un vial de 30 ml. 50 ml de solución en un frasco de 70 ml. 60 ml de solución en un frasco de 70 ml. 100 ml de solución en un frasco de 100 ml. 200 ml de solución en un frasco de 250 ml. Los viales/frascos están fabricados en vidrio de tipo II y sellados con tapones de goma de bromobutilo. 6.6 Precauciones especiales de eliminación y otras manipulaciones El producto debe llevarse a temperatura ambiente o a temperatura corporal antes de su administración. La solución debe ser desde transparente a ligeramente opalescente y de incolora a ligeramente amarilla. No utilice soluciones que estén turbias o tengan sedimentos. 13 de 14
14 La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. Debido a la posibilidad de contaminación bacteriana, el producto sobrante deberá ser desechado. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Octapharma S.A. Avda. Castilla, 2. (P.E. San Fernando) Ed. Berlín, bajo San Fernando de Henares Madrid 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN Fecha de la primera autorización: 2 de Noviembre de 2009 Fecha de la última renovación: 20 de Mayo de FECHA DE LA REVISIÓN DEL TEXTO Marzo de 14
600 U.I. 480 mg 95% Ig. 67,5 mg 9,0 mg 3 ml. Solución inyectable con inmunoglobulinas, principalmente inmunoglobulina G (IgG).
 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
100 UI 80 mg 95% IgG
 1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
Producido a partir de plasma humano procedente de donantes humanos.
 1. NOMBRE DEL MEDICAMENTO Flebogamma DIF 50 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana normal (IgIV) Un ml contiene: Inmunoglobulina humana normal 50
1. NOMBRE DEL MEDICAMENTO Flebogamma DIF 50 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana normal (IgIV) Un ml contiene: Inmunoglobulina humana normal 50
Producido a partir de plasma humano procedente de donantes humanos.
 1. NOMBRE DEL MEDICAMENTO Flebogamma DIF 100 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana normal (IgIV) Un ml contiene: Inmunoglobulina humana normal 100
1. NOMBRE DEL MEDICAMENTO Flebogamma DIF 100 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana normal (IgIV) Un ml contiene: Inmunoglobulina humana normal 100
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Prospecto: información para el usuario. Plangamma 50 mg/ml solución para perfusión Inmunoglobulina humana normal (IgIV)
 Prospecto: información para el usuario Plangamma 50 mg/ml solución para perfusión Inmunoglobulina humana normal (IgIV) Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Plangamma 50 mg/ml solución para perfusión Inmunoglobulina humana normal (IgIV) Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
0,5 g. 0,5 g. D-Sorbitol Agua inyectable cbp 10 ml 50 ml 100 ml 200 ml 400 ml
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA FLEBOGAMMA I.V. 5% 2. DENOMINACIÓN GENÉRICA Inmunoglobulina humana normal endovenosa 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución inyectable
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA FLEBOGAMMA I.V. 5% 2. DENOMINACIÓN GENÉRICA Inmunoglobulina humana normal endovenosa 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución inyectable
Un ml contiene 50 mg de inmunoglobulina humana normal, de los cuales al menos el 97% es IgG.
 1. NOMBRE DEL MEDICAMENTO Flebogamma 5% DIF solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de inmunoglobulina humana normal, de los cuales al menos el 97% es IgG.
1. NOMBRE DEL MEDICAMENTO Flebogamma 5% DIF solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de inmunoglobulina humana normal, de los cuales al menos el 97% es IgG.
Producido a partir de plasma humano procedente de donantes humanos.
 1. NOMBRE DEL MEDICAMENTO Flebogamma 10% DIF solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana normal (IgIV) Un ml contiene: Inmunoglobulina humana normal 100 mg
1. NOMBRE DEL MEDICAMENTO Flebogamma 10% DIF solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana normal (IgIV) Un ml contiene: Inmunoglobulina humana normal 100 mg
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Flebogamma DIF 50 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Flebogamma DIF 50 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
Inmunoglobulina humana normal (IgIV) mg* *correspondiente al contenido en proteína humana, de la cual al menos el 98% es IgG.
 1. NOMBRE DEL MEDICAMENTO KIOVIG 100 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Inmunoglobulina humana normal (IgIV)...100 mg* *correspondiente al contenido
1. NOMBRE DEL MEDICAMENTO KIOVIG 100 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Inmunoglobulina humana normal (IgIV)...100 mg* *correspondiente al contenido
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
FICHA TÉCNICA. Albutein 5% es una solución que contiene 50 g/l de proteína total, de las cuales al menos un 95% es albúmina humana.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 5% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 5% es una solución que contiene 50 g/l de proteína total,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Albutein 5% solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Albutein 5% es una solución que contiene 50 g/l de proteína total,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Medicamento con autorización anulada
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ImmunoGam 312 UI/ml, solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene 312
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ImmunoGam 312 UI/ml, solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene 312
Octalbin 200 mg/ml solución para perfusión
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Inmunoglobulina humana normal (IgIV) mg* *correspondiente al contenido en proteína humana, de la cual al menos el 98% es IgG.
 1. NOMBRE DEL MEDICAMENTO KIOVIG 100 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Inmunoglobulina humana normal (IgIV)...100 mg* *correspondiente al contenido
1. NOMBRE DEL MEDICAMENTO KIOVIG 100 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Inmunoglobulina humana normal (IgIV)...100 mg* *correspondiente al contenido
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
- Como disolvente de medicamentos en polvo o liofilizados, previamente a su administración. - Como diluyente de soluciones y/o medicamentos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-181) 15 microgramos HA** Cepa derivada de A/Victoria/361/2011 (H3N2): (IVR-165)
 1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA. Rhophylac 300 microgramos / 2 ml de solución inyectable en jeringa precargada.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Rhophylac 300 microgramos / 2 ml de solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Cada jeringa precargada
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Rhophylac 300 microgramos / 2 ml de solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Descripción general Cada jeringa precargada
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TECNICA ROPHYLAC
 FICHA TECNICA ROPHYLAC RHOPHYLAC Solución INYECTABLE 300 mcg/2 Ml Jeringa de vidrio (Vidrio de Clase 1) prellenada con 2 ml de solución inyectable (1500 UI de inmunoglobulina anti D Indicaciones: Profilaxis
FICHA TECNICA ROPHYLAC RHOPHYLAC Solución INYECTABLE 300 mcg/2 Ml Jeringa de vidrio (Vidrio de Clase 1) prellenada con 2 ml de solución inyectable (1500 UI de inmunoglobulina anti D Indicaciones: Profilaxis
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
FICHA TÉCNICA. HIERRO SACAROSA NORMON 20 mg/ml Solución inyectable o concentrado para solución para perfusión EFG.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIERRO SACAROSA NORMON 20 mg/ml Solución inyectable o concentrado para solución para perfusión EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 5 ml
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO HIERRO SACAROSA NORMON 20 mg/ml Solución inyectable o concentrado para solución para perfusión EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 5 ml
Ficha Técnica. La solución contiene un 20% de proteína, de la que al menos el 95% es albúmina humana.
 Ficha Técnica 1 Denominación del medicamento ALBÚMINA HUMANA 20% Baxter, Solución para perfusión intravenosa 2 Composición cualitativa y cuantitativa Albúmina humana. La solución contiene un 20% de proteína,
Ficha Técnica 1 Denominación del medicamento ALBÚMINA HUMANA 20% Baxter, Solución para perfusión intravenosa 2 Composición cualitativa y cuantitativa Albúmina humana. La solución contiene un 20% de proteína,
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
La actividad específica de Trypsan es 0,5 mg de alfa-1-antitripsina activa/mg de proteína. Para información sobre excipientes, ver 6.1.
 FOLLETO DE INFORMACIÓN AL PROFESIONAL 1. NOMBRE DEL MEDICAMENTO Trypsan 0,5 g Polvo liofilizado para solución inyectable con solvente Trypsan 1 g Polvo liofilizado para solución inyectable con solvente
FOLLETO DE INFORMACIÓN AL PROFESIONAL 1. NOMBRE DEL MEDICAMENTO Trypsan 0,5 g Polvo liofilizado para solución inyectable con solvente Trypsan 1 g Polvo liofilizado para solución inyectable con solvente
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV suspensión inyectable para gatos 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV suspensión inyectable para gatos 2. COMPOSICIÓN
IGAMAD 750 UI/ml SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA. 213 mg 95% IgG. Cloruro sódico 4 mg 5 mg 6 mg
 1. NOMBRE DEL MEDICAMENTO IGAMAD 750 UI/ml SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 1000 UI/1,33 ml 1250 UI/1,67 ml 1500 UI/2 ml Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO IGAMAD 750 UI/ml SOLUCIÓN INYECTABLE EN JERINGA PRECARGADA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 1000 UI/1,33 ml 1250 UI/1,67 ml 1500 UI/2 ml Inmunoglobulina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Plasbumin 20 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasbumin 20 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Solución de 200 g de proteínas plasmáticas/l con un 95% como mínimo
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasbumin 20 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Albúmina humana. Solución de 200 g de proteínas plasmáticas/l con un 95% como mínimo
Enfermedad de Kawasaki
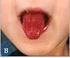 www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
PROSPECTO. CEFTRIAXONA REIG JOFRÉ 1 g IM. Polvo y disolvente para solución inyectable. E.F.G. Ceftriaxona (D.C.I.)
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO: INFORMACIÓN PARA EL USUARIO. CITICOLINA Normon 1000 mg solución inyectable EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
 INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO KIOVIG 100 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO KIOVIG 100 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Inmunoglobulina humana
Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp
 Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
La osmolaridad calculada de la solución es de 154 mosm/l y el ph de 4,5-7,0. El contenido teórico en sodio y en cloruro es de 77 mmol/l.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de Sodio Grifols 0,45% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio, 0,45 g La osmolaridad
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de Sodio Grifols 0,45% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio, 0,45 g La osmolaridad
FICHA TÉCNICA. 1. NOMBRE COMERCIAL DEL MEDICAMENTO Rhesuman Berna P 1250 UI (250 µg) polvo liofilizado y disolvente para solución inyectable
 FICHA TÉCNICA 1. NOMBRE COMERCIAL DEL MEDICAMENTO Rhesuman Berna P 1250 UI (250 µg) polvo liofilizado y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa:
FICHA TÉCNICA 1. NOMBRE COMERCIAL DEL MEDICAMENTO Rhesuman Berna P 1250 UI (250 µg) polvo liofilizado y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
* producido en levadura Saccharomyces cerevisiae (cepa ) mediante tecnología recombinante de ADN.
 1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
Prospecto: información para el usuario
 Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
Mujeres - De R00 a R99
 R00. Anormalidades del latido cardíaco R01. Soplos y otros sonidos cardíacos R02. Gangrena, no clasificada en otra R03. Lectura de presión sanguínea anormal, sin diagnóstico R04. Hemorragias de las vías
R00. Anormalidades del latido cardíaco R01. Soplos y otros sonidos cardíacos R02. Gangrena, no clasificada en otra R03. Lectura de presión sanguínea anormal, sin diagnóstico R04. Hemorragias de las vías
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA. Vispring 500 microgramos/ml colirio en solución en envases unidosis
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
SERPIENTES Definición:
 SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA. La vacuna MSD Antirrubéola cumple los requisitos de la OMS para productos biológicos y vacunas Antirrubéola.
 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
Para la lista completa de excipientes, véase la sección Indicaciones de uso, especificando las especies de destino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
Anexo III. Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos
 Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
FICHA TÉCNICA. Niños menores de 1 año: no se ha establecido la seguridad y eficacia de Thrombocid Forte en niños menores de 1 año.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Thrombocid Forte 5 mg/g pomada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene: Pentosano polisulfato sódico...5 mg Excipientes: Alcohol
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Thrombocid Forte 5 mg/g pomada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene: Pentosano polisulfato sódico...5 mg Excipientes: Alcohol
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
PROSPECTO: INFORMACIÓN PARA EL USUARIO. ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1.
 1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA
PROSPECTO. NOVARTIS FARMACEUTICA, S.A. Ronda Santa Maria, 158. Barbera del Valles 08210 (Barcelona) España
 PROSPECTO Lea todo el prospecto detenidamente antes de que a usted o a su hijo le sea administrado Lioresal por vía intratecal, ya que contiene información importante. Conserve este prospecto. Puede tener
PROSPECTO Lea todo el prospecto detenidamente antes de que a usted o a su hijo le sea administrado Lioresal por vía intratecal, ya que contiene información importante. Conserve este prospecto. Puede tener
Prospecto: información para el usuario
 Prospecto: información para el usuario Grafalon 20 mg/ml concentrado para solución para perfusión Inmunoglobulina anti-linfocitos T humanos de conejo Lea todo el prospecto detenidamente Conserve este prospecto.
Prospecto: información para el usuario Grafalon 20 mg/ml concentrado para solución para perfusión Inmunoglobulina anti-linfocitos T humanos de conejo Lea todo el prospecto detenidamente Conserve este prospecto.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1. Qué es Actithiol Mucolítico adultos y para qué se utiliza
 Introducción PROSPECTO: INFORMACIÓN PARA EL USUARIO Actithiol Mucolítico adultos 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente porque contiene información importante para usted.
Introducción PROSPECTO: INFORMACIÓN PARA EL USUARIO Actithiol Mucolítico adultos 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente porque contiene información importante para usted.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por gramo: Principio activo: Lactobacilos acidófilos 120 millones de unidades formadoras
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lactofilus polvo oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición por gramo: Principio activo: Lactobacilos acidófilos 120 millones de unidades formadoras
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Aminoplasmal B.Braun 10% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La solución para perfusión
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Aminoplasmal B.Braun 10% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La solución para perfusión
Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1.
 1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2014/2015) 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2014/2015) 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
Inmunizaciones. Vacunas Infantiles. Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Objetivo:
 Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Lacovin 20 mg/ml solución cutánea. Lacovin 50 mg/ml solución cutánea.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lacovin 20 mg/ml solución cutánea. Lacovin 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de Lacovin 20 mg/ml solución cutánea contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lacovin 20 mg/ml solución cutánea. Lacovin 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de Lacovin 20 mg/ml solución cutánea contiene
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE
 TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), julio 2015 Índice
TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), julio 2015 Índice
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Bioselenium 25 mg/ml suspensión cutánea 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sulfuro de selenio,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Bioselenium 25 mg/ml suspensión cutánea 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sulfuro de selenio,
FICHA TÉCNICA. La dosis debe ajustarse según los requerimientos individuales de agua y electrolitos:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Suero Fisiológico Vitulia 0,9 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición Principio Activo Cloruro de sodio Por 100 ml 0,9 g
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Suero Fisiológico Vitulia 0,9 % solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición Principio Activo Cloruro de sodio Por 100 ml 0,9 g
TEST DE INTOLERANCIA ALIMENTARIA
 TEST DE INTOLERANCIA ALIMENTARIA PUNTOS CLAVE Permite determinar la presencia y niveles de anticuerpos del tipo IgG frente a más de 200 alimentos diferentes. Se realiza el análisis de cada alimento por
TEST DE INTOLERANCIA ALIMENTARIA PUNTOS CLAVE Permite determinar la presencia y niveles de anticuerpos del tipo IgG frente a más de 200 alimentos diferentes. Se realiza el análisis de cada alimento por
Inmunizaciones Esc. "José Ma. Vargas"
 Inmunizaciones Esc. "José Ma. Vargas" 2016 Objetivos de la clase 1.- Generalidades: Definición, Antecedentes Históricos. 2.- Tipos de Inmunizaciones: a) Inmunización Activa: - Principios generales - Vías
Inmunizaciones Esc. "José Ma. Vargas" 2016 Objetivos de la clase 1.- Generalidades: Definición, Antecedentes Históricos. 2.- Tipos de Inmunizaciones: a) Inmunización Activa: - Principios generales - Vías
IM cara anterolateral del muslo en los lactantes o el músculo deltoides de la parte superior del brazo en los niños.
 ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO BERIGLOBINA P 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO BERIGLOBINA P 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Composición cualitativa Inmunoglobulina humana normal 2.2 Composición cuantitativa 1 ml contiene: Proteína
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO BERIGLOBINA P 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 2.1 Composición cualitativa Inmunoglobulina humana normal 2.2 Composición cuantitativa 1 ml contiene: Proteína
FICHA TECNICA. P R A M O X Pramocaína
 FICHA TECNICA P R A M O X Pramocaína 1. NOMBRE DEL MEDICAMENTO PRAMOX Gel PRAMOX Crema PRAMOX Emulsión 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRAMOX Gel y Crema :. Cada 100 g contienen: Pramocaína (DCI)
FICHA TECNICA P R A M O X Pramocaína 1. NOMBRE DEL MEDICAMENTO PRAMOX Gel PRAMOX Crema PRAMOX Emulsión 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PRAMOX Gel y Crema :. Cada 100 g contienen: Pramocaína (DCI)
