Experimento: Espectro de gases
|
|
|
- Ana María Mendoza Lozano
- hace 8 años
- Vistas:
Transcripción
1 FACULTAD DE CIENCIAS FÍSICO - MATEMÁTICAS Experimento: Espectro de gases Equipo α-pulpo Alma Elena Piceno Martínez Luke Goodman Ernesto Benítez Rodríguez 2012 F Í S I C A M O D E R N A C O N L A B O R A T O R IO
2 Introducción Desde el siglo XVII sabemos, con los trabajos de Newton y Huygens, que la radiación electromagnética se desvía al atravesar un medio de densidad distinta, a la del medio en que viajaba; sufre una dispersión. Resulta que sus componentes de distintas longitudes de onda se desvían con diferente ángulo, por lo que al salir del medio que atraviesan salen las componentes separadas y se pueden identificar los diferentes colores que muestran. La longitud de onda de la radiación puede ser desde muy pequeña, en el caso de la llamada radiación gamma, hasta muy grande en las ondas de radio. Las radiaciones que van desde el violeta (alrededor de 400nm) al rojo (alrededor de unos 700nm) forman el espectro visible, las radiaciones de longitud de onda inferior al violeta se llaman radiación ultravioleta, rayos X y rayos gamma por orden decreciente en la longitud de onda. Las radiaciones de longitud de onda superior al rojo son las denominadas infrarrojo, microondas y ondas de radio, por orden creciente en la longitud de onda. En determinadas condiciones, los cuerpos emiten energía en forma de radiación. También los cuerpos absorben la radiación que emiten otros cuerpos. El espectro es resultado de la separación de los componentes de distinta longitud de onda de la radiación electromagnética. Los espectros pueden ser de emisión o de absorción y cada uno de ellos a su vez puede ser continuo o discontinuo (de bandas o rayos). Los espectros de emisión se obtienen a partir de la radiación emitida directamente sobre el cuerpo. Los espectros de emisión continuos se obtienen al pasar la luz de un cuerpo incandescente a través de un prisma óptico. Los espectros de emisión discontinuo los producen gases o vapores a elevadas temperaturas. Los rayos proceden de emisiones de átomos excitados, mientras que los de banda proceden de las moléculas excitadas. En ambos casos la emisión de rayas o bandas se debe a la liberación de exceso de energía que poseen los átomos o moléculas excitadas, en forma de radiación electromagnética, cuya frecuencia caracteriza al átomo o molécula que la emite. Los espectros de absorción se forman cuando una radiación electromagnética compuesta pasa a través de un cuerpo y este la absorbe total o parcialmente. Cuando la absorción es total en un rango de frecuencias, se obtiene un espectro continuo porque faltan todas las radiaciones absorbidas entre dos frecuencias distintas. Cada uno de los elementos químicos tiene su propio espectro de emisión; y esto sirve para identificarlo. Algunos ejemplos de espectros de emisión:
3 Diremos que el hidrógeno emite, dentro del visible, en una cierta longitud de onda del naranja (6560 Å), en el azul (4858 Å), añil (4337 Å) y violeta (4098 Å). El sodio (Na) emite en el amarillo (bandas de longitudes de onda de 5896 Å y 5890 Å). El neón (Ne) emite en el espectro visible en las longitudes de onda de 6402 Å (naranja), 5852 Å (amarillo) y 5400 Å (verde). El calcio emite en la longitud de onda del espectro visible 6162 Å (amarillo-naranja), 4454 Å y 4435 Å (color añil) y 4226 Å (violeta). El mercurio (Hg) emite radiación en dos longitudes de onda del visible: 5460 Å (color verde) y 4358 Å (color añil). Los cuerpos también absorben radiación emitida desde otros cuerpos, eliminando del espectro de radiación que reciben aquellas bandas absorbidas, que quedan de color negro. También ocurre con la absorción, que unos cuerpos absorben la radiación de unas determinadas longitudes de onda y no absorben la radiación de otras longitudes de onda, por lo que cada cuerpo, cada elemento químico en realidad, tiene su propio espectro de absorción, correspondiéndose en la mayoría de los casos con su espectro de emisión.
4 Objetivos Observar el espectro de emisión de algunos gases y, comparándolo con los espectros de los elementos conocidos, determinar de qué gas se trata. Desarrollo Materiales Rejilla de difracción Tubos espectrales Fuente de voltaje Soporte Variac Se montaron uno a uno los tubos espectrales en el soporte, usando la fuente de voltaje y el variac se calentaron hasta que comenzaron a emitir radiación. A continuación, usando las rejillas de difracción se observó el espectro de la luz emitida. Resultados y Análisis Se observaron en total seis gases, de los cuales se muestra una imagen de su espectro a continuación, y se hace una comparación con los espectros encontrados en la literatura, así como su identificación. Gas 1.
5 Comparándolo con el espectro del hidrógeno podemos observar que estos espectros son muy parecidos, comparten las mismas líneas principales; emitiendo principalmente en la parte azul del espectro y en una longitud de onda correspondiente al rojo. Ilustración 1. Espectro de emisión del hidrógeno. Gas 2. Notemos que este gas emitió en casi toda la región visible del espectro, predominantemente en la región azul de este. El espectro más parecido a éste que se encontró en la literatura fue el del argón; notemos que este gas emite en muchas longitudes de onda visibles, mayormente en la región azul del espectro, como nuestro gas a identificar. Ilustración 2. Espectro de emisión del argón.
6 Gas 3. Encontramos que este espectro es muy parecido al del neón; notablemente se emitió principalmente en la región roja y amarilla del espectro, con unas cuantas líneas verdes y otro grupo marcado en el azul. Ilustración 3. Espectro de emisión del neón. Gas 4. Sabíamos de antemano que este gas se trataba de ozono, no nos fue posible encontrar el espectro de emisión del ozono para poder hacer una comparación adecuada. Sin embargo, si encontramos
7 el espectro de emisión del oxígeno, y podemos ver que el espectro que observamos es notablemente similar a éste. Gas 5. Ilustración 4. Espectro de emisión del oxígeno. Observemos las siguientes imágenes encontradas del espectro de emisión del mercurio notamos que hay en ellas dos líneas importantes, una en el azul y otra en el verde, además de algunas otras líneas; comparando ahora con el espectro del gas visto podemos notar que la mayoría de las líneas coinciden con esta, pudiéndose observar tanto la línea azul como la verde, también una emisión en el morado y otra en el amarillo que se pueden encontrar en la primera imagen del espectro mostrada. Así concluimos que este gas se trata de mercurio. Ilustración 5. Espectro de emisión del mercurio. Referencias Espectros atómicos. casanchi.com/fis/espectros/espectros01.htm#2 El espectro de la radiación. personales.ya.com/casanchi/did/er.htm
Radiación. Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler. L. Infante 1
 Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
EL ESPECTRO ELECTROMAGNÉTICO
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico.
 EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
EL ÁTOMO CONTENIDOS. ANTECEDENTES HISTÓRICOS. ( ) MODELOS ATÓMICOS. RAYOS CATÓDICOS. MODELO DE THOMSON.
 EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
J.J Thomson propone el primer modelo de átomo:
 MODELOS ATÓMICOS. DALTON En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son: 1.
MODELOS ATÓMICOS. DALTON En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son: 1.
LOS ESPECTROS DE ONDAS
 LOS ESPECTROS DE ONDAS Introducción Nos detenemos para explicar dos innovaciones, introducidas en la física del siglo XIX, que han tenido una importancia trascendental en el desarrollo de la Cosmología
LOS ESPECTROS DE ONDAS Introducción Nos detenemos para explicar dos innovaciones, introducidas en la física del siglo XIX, que han tenido una importancia trascendental en el desarrollo de la Cosmología
Como esta formada la materia?
 Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS. Partícula Masa (g) Carga (Coulombs) Carga unitaria. Electrón
 MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
Problemas de Ondas Electromagnéticas
 Problemas de Ondas Electromagnéticas AP Física B de PSI Nombre Multiopción 1. Cuál de las siguientes teorías puede explicar la curvatura de las ondas detrás de los obstáculos en la "región de sombra"?
Problemas de Ondas Electromagnéticas AP Física B de PSI Nombre Multiopción 1. Cuál de las siguientes teorías puede explicar la curvatura de las ondas detrás de los obstáculos en la "región de sombra"?
Se tiene para tener una idea el siguiente cuadro de colores perceptibles por el ojo humano dependiendo de la longitud de onda.
 La luz es una forma de energía la cual llega a nuestros ojos y nos permite ver, es un pequeño conjunto de radiaciones electromagnéticas de longitudes de onda comprendidas entre los 380 nm y los 770 nm.(nm
La luz es una forma de energía la cual llega a nuestros ojos y nos permite ver, es un pequeño conjunto de radiaciones electromagnéticas de longitudes de onda comprendidas entre los 380 nm y los 770 nm.(nm
Naturaleza de la luz. La Luz
 Naturaleza de la luz La Luz Introduciendo la luz ayos de luz - Se reciben y no se emiten por los ojos - Viajan en línea recta - No necesitan un medio para propagarse - Se disipan al atravesar un medio
Naturaleza de la luz La Luz Introduciendo la luz ayos de luz - Se reciben y no se emiten por los ojos - Viajan en línea recta - No necesitan un medio para propagarse - Se disipan al atravesar un medio
Introducción al calor y la luz
 Introducción al calor y la luz El espectro electromagnético es la fuente principal de energía que provee calor y luz. Todos los cuerpos, incluído el vidrio, emiten y absorben energía en forma de ondas
Introducción al calor y la luz El espectro electromagnético es la fuente principal de energía que provee calor y luz. Todos los cuerpos, incluído el vidrio, emiten y absorben energía en forma de ondas
Radiación. La radiación electromagnética
 Radiación Curso Introducción a las Ciencias de la Tierra y el Espacio II La radiación electromagnética Es el portador de la información de los objetos astronómicos. Es la forma en que la energía electromagnética
Radiación Curso Introducción a las Ciencias de la Tierra y el Espacio II La radiación electromagnética Es el portador de la información de los objetos astronómicos. Es la forma en que la energía electromagnética
LOS OBJETOS. Textos y fotos Fernando Moltini
 LOS OBJETOS Textos y fotos Fernando Moltini Como son percibidos los colores de los objetos. Un cuerpo opaco, es decir no transparente absorbe gran parte de la luz que lo ilumina y refleja una parte más
LOS OBJETOS Textos y fotos Fernando Moltini Como son percibidos los colores de los objetos. Un cuerpo opaco, es decir no transparente absorbe gran parte de la luz que lo ilumina y refleja una parte más
FUNDAMENTOS DE ESPECTROSCOPÍA
 FUNDAMENTOS DE ESPECTROSCOPÍA EMPLEANDO PHYSICSSENSORS Por: Diego Luis Aristizábal Ramírez, Roberto Restrepo Aguilar y Carlos Alberto Ramírez Martínez Profesores asociados de la Escuela de Física de la
FUNDAMENTOS DE ESPECTROSCOPÍA EMPLEANDO PHYSICSSENSORS Por: Diego Luis Aristizábal Ramírez, Roberto Restrepo Aguilar y Carlos Alberto Ramírez Martínez Profesores asociados de la Escuela de Física de la
La luz y las ondas electromagnéticas
 La luz y las ondas electromagnéticas Cuestiones (96-E) a) Qué se entiende por interferencia de la luz? b) Por qué no observamos la interferencia de la luz producida por los dos faros de un automóvil? (96-E)
La luz y las ondas electromagnéticas Cuestiones (96-E) a) Qué se entiende por interferencia de la luz? b) Por qué no observamos la interferencia de la luz producida por los dos faros de un automóvil? (96-E)
Espectro electromagnético
 RADIOCOMUNICACIONES 11-03-2015 Espectro electromagnético La naturaleza de la luz ha sido estudiada desde hace muchos años por científicos tan notables como Newton y Max Plank. Para los astrónomos conocer
RADIOCOMUNICACIONES 11-03-2015 Espectro electromagnético La naturaleza de la luz ha sido estudiada desde hace muchos años por científicos tan notables como Newton y Max Plank. Para los astrónomos conocer
Dpto. de Física y Química. IES N. Salmerón A. Ondas 6.2 ( )
 CUESTIONES 1. (2004) a) Por qué la profundidad real de una piscina llena de agua es siempre mayor que la profundidad aparente? b) Explique qué es el ángulo límite y bajo qué condiciones puede observarse.
CUESTIONES 1. (2004) a) Por qué la profundidad real de una piscina llena de agua es siempre mayor que la profundidad aparente? b) Explique qué es el ángulo límite y bajo qué condiciones puede observarse.
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS. Tipos de radiaciones electromagnéticas según λ.
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
CONSTRUCCIÓN DE UN ESPECTROSCOPIO
 CONSTRUCCIÓN DE UN ESPECTROSCOPIO Patricia Lago Santolaya IES Vicenta Ferrer Escrivá Valencia Introducción: Los espectroscopios son instrumentos destinados al análisis de la luz. Con este análisis se puede
CONSTRUCCIÓN DE UN ESPECTROSCOPIO Patricia Lago Santolaya IES Vicenta Ferrer Escrivá Valencia Introducción: Los espectroscopios son instrumentos destinados al análisis de la luz. Con este análisis se puede
El Proceso del Color. Luz y Espectro Visible
 Luz y Espectro Visible Onda larga Radio Radio VHF Radar Infrarrojo Ultravioleta Rayos Gama Televisión Microondas Luz visible Rayos X Rayos cósmicos Rojo Naranja Amarillo Verde Azul Azul oscuro Violeta
Luz y Espectro Visible Onda larga Radio Radio VHF Radar Infrarrojo Ultravioleta Rayos Gama Televisión Microondas Luz visible Rayos X Rayos cósmicos Rojo Naranja Amarillo Verde Azul Azul oscuro Violeta
Espectroscopía Clase integradora
 Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
Ensayo a la llama. ( Práctica nº 14 de 3º de la ESO curso )
 Ensayo a la llama. ( Práctica nº 14 de 3º de la ESO curso 2015 2016 ) Objetivos: A).- Asumir que cada elemento puede emitir radiaciones (luz) que tiene un conjunto de longitudes de onda que son características
Ensayo a la llama. ( Práctica nº 14 de 3º de la ESO curso 2015 2016 ) Objetivos: A).- Asumir que cada elemento puede emitir radiaciones (luz) que tiene un conjunto de longitudes de onda que son características
6. ESPECTROS DE EMISIÓN ATÓMICA
 6. ESPECTROS DE EMISIÓN ATÓMICA 6.1. OBJETIVOS Medir la longitud de onda de las líneas espectrales emitidas en la región visible por varios gases altamente diluidos. Medir la constante de Rydberg a partir
6. ESPECTROS DE EMISIÓN ATÓMICA 6.1. OBJETIVOS Medir la longitud de onda de las líneas espectrales emitidas en la región visible por varios gases altamente diluidos. Medir la constante de Rydberg a partir
Práctica 1. Dispersión óptica. Estudio del prisma
 Práctica 1. Dispersión óptica. Estudio del prisma 1. OBJETIVOS Aprender el manejo del espectrómetro. Determinar del índice de refracción de un prisma y de un líquido problema. Realizar la curva de calibrado
Práctica 1. Dispersión óptica. Estudio del prisma 1. OBJETIVOS Aprender el manejo del espectrómetro. Determinar del índice de refracción de un prisma y de un líquido problema. Realizar la curva de calibrado
radiación electromagnética
 radiación electromagnética ondas propagándose en el espacio con velocidad c crestas amplitud l valles longitud de onda [ l]=cm, nm, μm, A Frecuencia=n=c/l [ n ]=HZ=1/s l= numero de ondas por unidad de
radiación electromagnética ondas propagándose en el espacio con velocidad c crestas amplitud l valles longitud de onda [ l]=cm, nm, μm, A Frecuencia=n=c/l [ n ]=HZ=1/s l= numero de ondas por unidad de
EL MODELO ATOMICO DE BOHR
 EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
Ejercicio 1. Ejercicio 2. Ejercicio 3.
 Ejercicio 1. Suponiendo que la antena de una espacio de radio de 10 [kw] radia ondas electromagnéticas esféricas. Calcular el campo eléctrico máximo a 5 [km] de la antena. Ejercicio 2. La gente realiza
Ejercicio 1. Suponiendo que la antena de una espacio de radio de 10 [kw] radia ondas electromagnéticas esféricas. Calcular el campo eléctrico máximo a 5 [km] de la antena. Ejercicio 2. La gente realiza
RADIACIÓN ELECTROMAGNÉTICA Y TÉCNICAS DE OBSERVACIÓN. Curso Introducción a la Astronomía 1
 RADIACIÓN ELECTROMAGNÉTICA Y TÉCNICAS DE OBSERVACIÓN Curso 2011-12 Introducción a la Astronomía 1 Brillo Magnitud aparente El ojo detecta la luz de forma logarítmica, es decir, detecta cambios no de manera
RADIACIÓN ELECTROMAGNÉTICA Y TÉCNICAS DE OBSERVACIÓN Curso 2011-12 Introducción a la Astronomía 1 Brillo Magnitud aparente El ojo detecta la luz de forma logarítmica, es decir, detecta cambios no de manera
LA LUZ. 1.- Qué es la luz?
 1.- Qué es la luz? LA LUZ La luz es una radiación que se propaga en forma de ondas. Las ondas que se pueden propagar en el vacío se llaman ONDAS ELECTROMAGNÉTICAS. La luz es una radiación electromagnética.
1.- Qué es la luz? LA LUZ La luz es una radiación que se propaga en forma de ondas. Las ondas que se pueden propagar en el vacío se llaman ONDAS ELECTROMAGNÉTICAS. La luz es una radiación electromagnética.
FORMACIÓN DE IMÁGENES EN ESPEJOS
 FORMACIÓN DE IMÁGENES EN ESPEJOS La reflexión que producen los objetos depende de las características de los cuerpos, de esta forma existen dos tipos de reflexiones a saber: 1.- Reflexión especular o regular.
FORMACIÓN DE IMÁGENES EN ESPEJOS La reflexión que producen los objetos depende de las características de los cuerpos, de esta forma existen dos tipos de reflexiones a saber: 1.- Reflexión especular o regular.
Práctica 7. Dispersión de la luz mediante un prisma
 Dispersión de la luz mediante un prisma 1 Práctica 7. Dispersión de la luz mediante un prisma 1. OBJETIVOS - Aprender el manejo del espectrómetro. - Determinar del índice de refracción de un prisma y de
Dispersión de la luz mediante un prisma 1 Práctica 7. Dispersión de la luz mediante un prisma 1. OBJETIVOS - Aprender el manejo del espectrómetro. - Determinar del índice de refracción de un prisma y de
El Espectro Electromagnético
 El Espectro Electromagnético ONDAS ELECTROMAGNETICAS Se componen de un campo eléctrico y un campo magnético, ambos variando en el tiempo Su energía aumenta con la frecuencia Se distinguen ondas ionizantes
El Espectro Electromagnético ONDAS ELECTROMAGNETICAS Se componen de un campo eléctrico y un campo magnético, ambos variando en el tiempo Su energía aumenta con la frecuencia Se distinguen ondas ionizantes
Ondas - Las ondas sonoras - El eco
 Ciencias de la Naturaleza 2.º ESO Unidad 11 Ficha 1 Ondas - Las ondas sonoras - El eco La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas
Ciencias de la Naturaleza 2.º ESO Unidad 11 Ficha 1 Ondas - Las ondas sonoras - El eco La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas
Espectros Atómicos. Química General I 2012
 Espectros Atómicos Química General I 2012 Estudios de las ondas Que es una onda? Es una alteración vibracional a través de la cual se transmite energía. Existen muchos tipos de ondas, por ejemplo, las
Espectros Atómicos Química General I 2012 Estudios de las ondas Que es una onda? Es una alteración vibracional a través de la cual se transmite energía. Existen muchos tipos de ondas, por ejemplo, las
CAPITULO I: La Luz CAPITULO I: LA LUZ 1
 CAPITULO I: La Luz CAPITULO I: LA LUZ 1 1.- La luz 1.1.- El nanómetro 1.2.- El espectro visible 1.3.- Naturaleza de la luz 1.4.- Fuentes de luz 2.- La Materia y la luz 2.1.- Fórmula R.A.T. 22-2.2. Absorción
CAPITULO I: La Luz CAPITULO I: LA LUZ 1 1.- La luz 1.1.- El nanómetro 1.2.- El espectro visible 1.3.- Naturaleza de la luz 1.4.- Fuentes de luz 2.- La Materia y la luz 2.1.- Fórmula R.A.T. 22-2.2. Absorción
COLOR. Pag.1/7. Área: FÍSICO-QUÍMICA Asignatura: FÍSICA. Título. Curso: 4 TO Año: 2012 AÑO
 Área: FÍSICO-QUÍMICA Asignatura: FÍSICA Título COLOR Prof: BOHORQUEZ MARTINEZ LARGHI STRUM - TAITZ WALITZKY -IGNACIO D AMORE EZEQUIEL Curso: 4 TO Año: 2012 AÑO Pag.1/7 Dispersión de la luz Ya sabemos que
Área: FÍSICO-QUÍMICA Asignatura: FÍSICA Título COLOR Prof: BOHORQUEZ MARTINEZ LARGHI STRUM - TAITZ WALITZKY -IGNACIO D AMORE EZEQUIEL Curso: 4 TO Año: 2012 AÑO Pag.1/7 Dispersión de la luz Ya sabemos que
- RADIACIÓN SOLAR. Leyes. Variabilidad. Balance de la radiación solar entre la que llega y sale de la superficie terrestre.
 - RADIACIÓN SOLAR. Leyes. Variabilidad. Balance de la radiación solar entre la que llega y sale de la superficie terrestre. La radiación solar es el conjunto de radiaciones electromagnéticas emitidas por
- RADIACIÓN SOLAR. Leyes. Variabilidad. Balance de la radiación solar entre la que llega y sale de la superficie terrestre. La radiación solar es el conjunto de radiaciones electromagnéticas emitidas por
TEORÍA DEL COLOR COLORES LUZ Y MEZCLA ADITIVA
 COLORES LUZ Y MEZCLA ADITIVA Newton (1642-1727) primero y Young (1773-1829) después, establecieron un principio que hoy nadie discute: la luz es color. Para llegar a este convencimiento, Isaac Newton se
COLORES LUZ Y MEZCLA ADITIVA Newton (1642-1727) primero y Young (1773-1829) después, establecieron un principio que hoy nadie discute: la luz es color. Para llegar a este convencimiento, Isaac Newton se
Ejercicios de Física cuántica y nuclear. PAU (PAEG)
 1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
FÍSICA LAB. 8. la polarización. Comprender la técnica de análisis por espectroscopia. Visualización de los
 FÍSICA LAB. 8 ÓPTICA FÍSICA Objetivos: Comprender y visualizar los espectros de difracción e interferencia y el fenómeno de la polarización. Comprender la técnica de análisis por espectroscopia. Visualización
FÍSICA LAB. 8 ÓPTICA FÍSICA Objetivos: Comprender y visualizar los espectros de difracción e interferencia y el fenómeno de la polarización. Comprender la técnica de análisis por espectroscopia. Visualización
Estructura de la materia y Sistema Periódico
 Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
Índice. 1. Qué es la luz? Pág.2
 Página1 TP1 Teoría de la luz Desarrollar una investigación teniendo como base el origen de la luz como fenómeno físico y su comportamiento. Dicho trabajo práctico requiere rigor en los datos técnicos recabados
Página1 TP1 Teoría de la luz Desarrollar una investigación teniendo como base el origen de la luz como fenómeno físico y su comportamiento. Dicho trabajo práctico requiere rigor en los datos técnicos recabados
BLOQUE 4.1 ÓPTICA FÍSICA
 BLOQUE 4.1 ÓPTICA FÍSICA 1. NATURALEZA DE LA LUZ Hasta ahora hemos considerado a la luz como algo que transporta energía de un lugar a otro. Por otra parte, sabemos que existen dos formas básicas de transportar
BLOQUE 4.1 ÓPTICA FÍSICA 1. NATURALEZA DE LA LUZ Hasta ahora hemos considerado a la luz como algo que transporta energía de un lugar a otro. Por otra parte, sabemos que existen dos formas básicas de transportar
Módulo 5: La luz. Ondas electromagnéticas
 Módulo 5: La luz 1 Ondas electromagnéticas Partículas cargadas eléctricamente (cargas) en movimiento forman una corriente eléctrica Una corriente eléctrica que cambia (debida al movimiento) crea un campo
Módulo 5: La luz 1 Ondas electromagnéticas Partículas cargadas eléctricamente (cargas) en movimiento forman una corriente eléctrica Una corriente eléctrica que cambia (debida al movimiento) crea un campo
ESQUEMA. De él cabe destacar el experimento que demostró que el modelo de Thompson era falso y los postulados que llevaron a que formulara su modelo:
 TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
Practica nº n 5: Fenómenos de Difracción.
 Facultad de Farmacia Universidad de Granada Departamento de Química Física Practica nº n 5: Fenómenos de Difracción. OBJETIVOS 1.Observar los fenómenos de difracción Rendija simple Rendija doble 2.Calcular
Facultad de Farmacia Universidad de Granada Departamento de Química Física Practica nº n 5: Fenómenos de Difracción. OBJETIVOS 1.Observar los fenómenos de difracción Rendija simple Rendija doble 2.Calcular
espectro de línea espectroscopia de emisión. espectrómetro espectroscopia de absorción
 Todos los objetos emiten una radiación térmica, caracterizada por una distribución continua de longitudes de onda. En marcado contraste con este espectro de distribución continua, esta el espectro de línea
Todos los objetos emiten una radiación térmica, caracterizada por una distribución continua de longitudes de onda. En marcado contraste con este espectro de distribución continua, esta el espectro de línea
FUNDAMENTOS DE ESPECTROSCOPÍ A
 FUNDAMENTOS DE ESPECTROSCOPÍ A EMPLEANDO PHYSICSSENSOR Por: Diego Luis Aristizábal Ramírez, Roberto Restrepo Aguilar y Carlos Alberto Ramírez Martínez Profesores asociados de la Facultad de Ciencias, Escuela
FUNDAMENTOS DE ESPECTROSCOPÍ A EMPLEANDO PHYSICSSENSOR Por: Diego Luis Aristizábal Ramírez, Roberto Restrepo Aguilar y Carlos Alberto Ramírez Martínez Profesores asociados de la Facultad de Ciencias, Escuela
Espectros de emisión y absorción.
 Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
Del LASER I Principio de funcionamiento del láser
 Del LASER I Principio de funcionamiento del láser Gilberto Basilio Sánchez La palabra láser proviene del acrónimo en inglés Ligth Amplification by Stimulated Emission of Radiation; en español, láser(1)
Del LASER I Principio de funcionamiento del láser Gilberto Basilio Sánchez La palabra láser proviene del acrónimo en inglés Ligth Amplification by Stimulated Emission of Radiation; en español, láser(1)
Por qué efecto invernadero? Cálculos acerca del equilibrio calórico de la Tierra. No creas todo lo que has leído! Preguntas
 Educación en el cambio global Cambios en la atmósfera - Sección CA4-1 CA4 Actividades Qué es el efecto invernadero? Por qué efecto invernadero? Vemos al Sol como un cuerpo brillante. La Tierra es otra
Educación en el cambio global Cambios en la atmósfera - Sección CA4-1 CA4 Actividades Qué es el efecto invernadero? Por qué efecto invernadero? Vemos al Sol como un cuerpo brillante. La Tierra es otra
FOTOSÍNTESIS. Objetivo: reconocer a la fotosíntesis como un proceso anabólico donde participan particulares componentes.
 FOTOSÍNTESIS Objetivo: reconocer a la fotosíntesis como un proceso anabólico donde participan particulares componentes. introducción De la energía solar que alcanza la superficie de la tierra, un 1% es
FOTOSÍNTESIS Objetivo: reconocer a la fotosíntesis como un proceso anabólico donde participan particulares componentes. introducción De la energía solar que alcanza la superficie de la tierra, un 1% es
LA FOTOSÍNTESIS LA FASE LUMINOSA:
 LA FOTOSÍNTESIS LA FASE LUMINOSA: Fotofosforilación Acíclica FOTOSISTEMAS I Y II CADENA DE TRANSPORTE DE ELECTRONES FOTOLISIS DEL AGUA SÍNTESIS DE ATP POR FOTOFOSFORILACIÓN Fotofosforilación Cíclica LA
LA FOTOSÍNTESIS LA FASE LUMINOSA: Fotofosforilación Acíclica FOTOSISTEMAS I Y II CADENA DE TRANSPORTE DE ELECTRONES FOTOLISIS DEL AGUA SÍNTESIS DE ATP POR FOTOFOSFORILACIÓN Fotofosforilación Cíclica LA
DESARROLLO. La frecuencia tiene una relación inversa con el concepto de longitud de onda, a mayor frecuencia menor
 CONSIGNAS TP1 Teoría de la luz Desarrollar una investigación teniendo como base el origen de la luz como fenómeno físico y su comportamiento. Dicho trabajo práctico requiere rigor en los datos técnicos
CONSIGNAS TP1 Teoría de la luz Desarrollar una investigación teniendo como base el origen de la luz como fenómeno físico y su comportamiento. Dicho trabajo práctico requiere rigor en los datos técnicos
EJERCICIOS DE SELECTIVIDAD LA LUZ Y LAS ONDAS ELECTROMAGNÉTICAS
 EJERCICIOS DE SELECTIVIDAD LA LUZ Y LAS ONDAS ELECTROMAGNÉTICAS 1. Un foco luminoso puntual está situado bajo la superficie de un estanque de agua. a) Un rayo de luz pasa del agua al aire con un ángulo
EJERCICIOS DE SELECTIVIDAD LA LUZ Y LAS ONDAS ELECTROMAGNÉTICAS 1. Un foco luminoso puntual está situado bajo la superficie de un estanque de agua. a) Un rayo de luz pasa del agua al aire con un ángulo
Introducción a la teoría del COLOR
 Introducción a la teoría del COLOR Qué es la LUZ? La luz es una corriente de partículas infinitamente pequeñas llamadas fotones que se irradia desde cualquier fuente luminosa a la fantástica velocidad
Introducción a la teoría del COLOR Qué es la LUZ? La luz es una corriente de partículas infinitamente pequeñas llamadas fotones que se irradia desde cualquier fuente luminosa a la fantástica velocidad
TEMA 4: OPTICA. Cómo puede un buceador estimar la profundidad a la que se encuentra?
 Cómo puede un buceador estimar la profundidad a la que se encuentra? http://www.buceando.es/ Física A qué distancia podemos distinguir los ojos de un gato montés? Soy daltónico? La luz: naturaleza dual
Cómo puede un buceador estimar la profundidad a la que se encuentra? http://www.buceando.es/ Física A qué distancia podemos distinguir los ojos de un gato montés? Soy daltónico? La luz: naturaleza dual
LOS COLORES DE LOS ELEMENTOS
 LOS COLORES DE LOS ELEMENTOS Expresiones tan comunes y sugestivas como "rojo cadmio", "verde esmeralda", "blanco de titanio" o "azul turquesa" relacionan muy directamente un color con un material. Como
LOS COLORES DE LOS ELEMENTOS Expresiones tan comunes y sugestivas como "rojo cadmio", "verde esmeralda", "blanco de titanio" o "azul turquesa" relacionan muy directamente un color con un material. Como
Cuál es tu temperatura favorita? Cuán brillante es el Sol? Educación en el cambio global Cambios en la atmósfera - Sección CA3-1
 Educación en el cambio global Cambios en la atmósfera - Sección CA3-1 CA3 Actividades Cuál es tu temperatura favorita? Si alguien te preguntase a qué temperatura te gustaría vivir, seguramente elegirías
Educación en el cambio global Cambios en la atmósfera - Sección CA3-1 CA3 Actividades Cuál es tu temperatura favorita? Si alguien te preguntase a qué temperatura te gustaría vivir, seguramente elegirías
VENTAJAS DE LA ILUMINACIÓN LED
 VENTAJAS DE LA ILUMINACIÓN LED Qué es un LED? LED viene de las siglas en inglés Lighting Emitting Diode (Diodo emisor de Luz). El LED es un diodo semiconductor que al ser atravesado por una corriente eléctrica
VENTAJAS DE LA ILUMINACIÓN LED Qué es un LED? LED viene de las siglas en inglés Lighting Emitting Diode (Diodo emisor de Luz). El LED es un diodo semiconductor que al ser atravesado por una corriente eléctrica
Módulo 1.2 Lámparas: tipos y características. Héctor Beltrán San Segundo Universitat Jaume I - Fundación F2e
 Módulo 1.2 Lámparas: tipos y características. Héctor Beltrán San Segundo Universitat Jaume I - Fundación F2e Contenido: Fenómenos que producen luz (principios físicos). Tipos de las lámparas según su modo
Módulo 1.2 Lámparas: tipos y características. Héctor Beltrán San Segundo Universitat Jaume I - Fundación F2e Contenido: Fenómenos que producen luz (principios físicos). Tipos de las lámparas según su modo
La Molécula de agua y el efecto microondas
 La Molécula de agua y el efecto microondas Prof. Víctor J. García 1, Prof. Hernán Galindo, Br. Teobaldo Torres, Br. Eduardo de J. Rondón, Universidad de Los Andes, Departamento de Física, la Hechicera,
La Molécula de agua y el efecto microondas Prof. Víctor J. García 1, Prof. Hernán Galindo, Br. Teobaldo Torres, Br. Eduardo de J. Rondón, Universidad de Los Andes, Departamento de Física, la Hechicera,
Fluorescencia. Jaime Gómez Delfín Àgora Sant Cugat International School (Sant Cugat del Valles) 4º ESO D Curso Física i Química
 Fluorescencia Jaime Gómez Delfín Àgora Sant Cugat International School (Sant Cugat del Valles) 4º ESO D Curso 2014-2015 Física i Química ÍNDICE Apartado Página 1. Objetivo 3 2. Introducción. 4-2.1. Qué
Fluorescencia Jaime Gómez Delfín Àgora Sant Cugat International School (Sant Cugat del Valles) 4º ESO D Curso 2014-2015 Física i Química ÍNDICE Apartado Página 1. Objetivo 3 2. Introducción. 4-2.1. Qué
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León.
 Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
La luz y las ondas electromagnéticas
 La luz y las ondas electromagnéticas Cuestiones (96-E) a) Qué se entiende por interferencia de la luz? b) Por qué no observamos la interferencia de la luz producida por los dos faros de un automóvil? (96-E)
La luz y las ondas electromagnéticas Cuestiones (96-E) a) Qué se entiende por interferencia de la luz? b) Por qué no observamos la interferencia de la luz producida por los dos faros de un automóvil? (96-E)
El espectro electromagnético y los colores
 Se le llama espectro visible o luz visible a aquella pequeña porción del espectro electromagnético que es captada por nuestro sentido de la vista. La luz visible está formada por ondas electromagnéticas
Se le llama espectro visible o luz visible a aquella pequeña porción del espectro electromagnético que es captada por nuestro sentido de la vista. La luz visible está formada por ondas electromagnéticas
La formación de la visión humana del color
 COLOR DEFINICIÓN El color es una percepción visual que se genera en el cerebro al interpretar las señales nerviosas que le envían los foto receptores de la retina del ojo y que a su vez interpretan y distinguen
COLOR DEFINICIÓN El color es una percepción visual que se genera en el cerebro al interpretar las señales nerviosas que le envían los foto receptores de la retina del ojo y que a su vez interpretan y distinguen
MODELOS ATOMICOS. Solución Å; Ultravioleta; 1106 m/s
 MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA
 INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA Objetivos Al finalizar el trabajo práctico los estudiantes estarán en capacidad de: - Conocer el principio que rige la espectrofotometría. - Interpretar el basamento
INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA Objetivos Al finalizar el trabajo práctico los estudiantes estarán en capacidad de: - Conocer el principio que rige la espectrofotometría. - Interpretar el basamento
QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA.
 Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
3- LUZ Y COLOR. CURVA V Y EFECTO PURKINJE (Purkinje Shift) CAPITULO 3 - Página 1 de 7
 3- LUZ Y COLOR El color es un factor muy importante en el efecto emocional de cualquier espacio. Sin luz no hay color. Hay dos formas de reconocimiento del color: el color de la luz, que involucra la composición
3- LUZ Y COLOR El color es un factor muy importante en el efecto emocional de cualquier espacio. Sin luz no hay color. Hay dos formas de reconocimiento del color: el color de la luz, que involucra la composición
Capítulo 24. Emisión y absorción de la luz. Láser
 Capítulo 24 Emisión y absorción de la luz. Láser 1 Absorción y emisión La frecuencia luminosa depende de los niveles atómicos entre los que se produce la transición electrónica a través de: hν = E f E
Capítulo 24 Emisión y absorción de la luz. Láser 1 Absorción y emisión La frecuencia luminosa depende de los niveles atómicos entre los que se produce la transición electrónica a través de: hν = E f E
Unidad 1 Estructura atómica de la materia. Teoría cuántica
 Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Corteza atómica: Estructura electrónica
 Corteza atómica: Estructura electrónica Aunque los conocimientos actuales sobre la estructura electrónica de los átomos son bastante complejos, las ideas básicas son las siguientes: 1. Existen 7 niveles
Corteza atómica: Estructura electrónica Aunque los conocimientos actuales sobre la estructura electrónica de los átomos son bastante complejos, las ideas básicas son las siguientes: 1. Existen 7 niveles
Interacción de neutrones con la materia. Laura C. Damonte 2014
 Interacción de neutrones con la materia Laura C. Damonte 2014 Interacción de neutrones con la materia La interacción de los neutrones con la materia tiene interés tanto experimental y teórico como también
Interacción de neutrones con la materia Laura C. Damonte 2014 Interacción de neutrones con la materia La interacción de los neutrones con la materia tiene interés tanto experimental y teórico como también
INTRODUCCIÓN A LA TELEDETECCIÓN CUANTITATIVA
 INTRODUCCIÓN A LA TELEDETECCIÓN CUANTITATIVA Haydee Karszenbaum Veronica Barrazza [email protected] [email protected] Clase 1.2: ondas y leyes de la radiación Teledetección cuantitativa 1 Características
INTRODUCCIÓN A LA TELEDETECCIÓN CUANTITATIVA Haydee Karszenbaum Veronica Barrazza [email protected] [email protected] Clase 1.2: ondas y leyes de la radiación Teledetección cuantitativa 1 Características
Núcleo Atómico. El núcleo es una masa muy compacta formada por protones y neutrones.
 Núcleo Atómico Profesor: Robinson Pino H. 1 COMPONENTES DEL NÚCLEO ATÓMICO El núcleo es una masa muy compacta formada por protones y neutrones. PROTÓN PROTÓN(p + ) Es una partícula elemental con carga
Núcleo Atómico Profesor: Robinson Pino H. 1 COMPONENTES DEL NÚCLEO ATÓMICO El núcleo es una masa muy compacta formada por protones y neutrones. PROTÓN PROTÓN(p + ) Es una partícula elemental con carga
Las estrellas. Las grandes masas de gases incandescentes
 Las estrellas Las grandes masas de gases incandescentes I. Las estrellas en el universo 1. Definición a) Qué es una estrella? Las estrellas son unos cuerpos celestes formados por gases (mayoritariamente
Las estrellas Las grandes masas de gases incandescentes I. Las estrellas en el universo 1. Definición a) Qué es una estrella? Las estrellas son unos cuerpos celestes formados por gases (mayoritariamente
J.M.L.C. IES Aguilar y Cano ALGUNOS DERECHOS RESERVADOS
 La radiactividad o radioactividad es un fenómeno físico natural, por el cual algunas sustancias o elementos químicos llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas
La radiactividad o radioactividad es un fenómeno físico natural, por el cual algunas sustancias o elementos químicos llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas
INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3.
 El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
SUPERFICIE ESPECULAR Y LAMBERTIANA
 SUPERFICIE ESPECULAR Y LAMBERTIANA Especular: es la superficie ideal en la que se cumple perfectamente la ley de la reflexión (ángulo incidente = ángulo reflejado). Lambertiana: es la superficie, también
SUPERFICIE ESPECULAR Y LAMBERTIANA Especular: es la superficie ideal en la que se cumple perfectamente la ley de la reflexión (ángulo incidente = ángulo reflejado). Lambertiana: es la superficie, también
4. Identificar un isótopo radiactivo del carbono e indicar su uso. 5. Cuál es la configuración electrónica del vanadio?
 ESTRUCTURA ATÓMICA 1. Qué afirmación sobre el número de electrones, protones y neutrones del átomo es correcta? A El número de neutrones menos el número de electrones es cero. B. El número de protones
ESTRUCTURA ATÓMICA 1. Qué afirmación sobre el número de electrones, protones y neutrones del átomo es correcta? A El número de neutrones menos el número de electrones es cero. B. El número de protones
Visión Nocturna. El Museo de la Ciencia y el Cosmos presenta su taller sobre. La Universidad de La Laguna. por Alberto Molino Benito
 El Museo de la Ciencia y el Cosmos presenta su taller sobre Visión Nocturna por En colaboración con La 1. Tienes claro lo que es una onda? 1.1 Mirando con lupa a las ondas. Cómo podemos expresar una ONDA?
El Museo de la Ciencia y el Cosmos presenta su taller sobre Visión Nocturna por En colaboración con La 1. Tienes claro lo que es una onda? 1.1 Mirando con lupa a las ondas. Cómo podemos expresar una ONDA?
Calibración de un espectrómetro y medición de longitudes de onda de las líneas de un espectro.
 Calibración de un espectrómetro y medición de longitudes de onda de las líneas de un espectro. Objetivo Obtener la curva de calibración de un espectrómetro de red de difracción. Determinar la longitud
Calibración de un espectrómetro y medición de longitudes de onda de las líneas de un espectro. Objetivo Obtener la curva de calibración de un espectrómetro de red de difracción. Determinar la longitud
LASER DE HELIO-NEON. (Juan Israel Rivas Sánchez)
 LASER DE HELIO-NEON (Juan Israel Rivas Sánchez) El láser de Helio-Neón fue el primer láser de gas construido y actualmente sigue siendo uno de los láseres más útil y frecuentemente utilizado. Esto a pesar
LASER DE HELIO-NEON (Juan Israel Rivas Sánchez) El láser de Helio-Neón fue el primer láser de gas construido y actualmente sigue siendo uno de los láseres más útil y frecuentemente utilizado. Esto a pesar
Color, temperatura y espectro
 Color, temperatura y espectro El color de una estrella es un indicador de su temperatura. Según una relación conocida con el nombre de ley de Wien, cuanto mayor es la temperatura de una estrella, más corta
Color, temperatura y espectro El color de una estrella es un indicador de su temperatura. Según una relación conocida con el nombre de ley de Wien, cuanto mayor es la temperatura de una estrella, más corta
EXTRUCTURA ATOMICA ACTUAL
 ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
LAS LEYES DE LA RADIACIÓN EN LA TIERRA Y EN EL ESPACIO OBJETIVO RESUMEN. GENERACIÓN DE LINEAS: Leyes de Kirchhoff
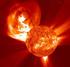 LAS LEYES DE LA RADIACIÓN EN LA TIERRA Y EN EL ESPACIO OBJETIVO Aproximarnos a los procesos que absorben y generan radiación electromagnética en la Tierra y en el espacio. Basada en presentación de Tabaré
LAS LEYES DE LA RADIACIÓN EN LA TIERRA Y EN EL ESPACIO OBJETIVO Aproximarnos a los procesos que absorben y generan radiación electromagnética en la Tierra y en el espacio. Basada en presentación de Tabaré
Tema 2: Propiedades y medición de la radiación electromagnética
 Tema 2: Propiedades y medición de la radiación electromagnética Espectro de la radiación electromagnética Conceptos básicos para la medición: Densidad de flujo Luminosidad Intensidad Brillo superficial
Tema 2: Propiedades y medición de la radiación electromagnética Espectro de la radiación electromagnética Conceptos básicos para la medición: Densidad de flujo Luminosidad Intensidad Brillo superficial
FUNDAMENTOS DE ENERGÍA SOLAR
 FUNDAMENTOS DE ENERGÍA SOLAR Dr. Ricardo Guerrero Lemus 1 DUALIDAD ONDA/PARTÍCULA DE LA LUZ: A partir de finales del siglo XVII empezó a prevalecer el punto de vista mecánico de Newton por el que la luz
FUNDAMENTOS DE ENERGÍA SOLAR Dr. Ricardo Guerrero Lemus 1 DUALIDAD ONDA/PARTÍCULA DE LA LUZ: A partir de finales del siglo XVII empezó a prevalecer el punto de vista mecánico de Newton por el que la luz
Teoría de la luz y el color
 Teoría de la luz y el color La luz es una radiación electromagnética. El espectro electromagnético incluye desde los rayos gamma hasta las ondas de radio. La luz visible está formada por vibraciones electromagnéticas
Teoría de la luz y el color La luz es una radiación electromagnética. El espectro electromagnético incluye desde los rayos gamma hasta las ondas de radio. La luz visible está formada por vibraciones electromagnéticas
CLASE 2. RADIACIÓN SOLAR Y TERRESTRE.
 CLASE 2. RADIACIÓN SOLAR Y TERRESTRE. El Sol es la principal fuente de energía para todos los procesos en el sistema tierra - atmósfera - océano, más del 99.9 % de la energía que este sistema recibe proviene
CLASE 2. RADIACIÓN SOLAR Y TERRESTRE. El Sol es la principal fuente de energía para todos los procesos en el sistema tierra - atmósfera - océano, más del 99.9 % de la energía que este sistema recibe proviene
(380) violeta (400) añil (440) azul (470) verde (500) amarillo (560) anaranjado ( ) rojo (780)
 SINOPSIS DE TEORÍA Y USO DEL COLOR Esta sinopsis no es autónoma. Se complementa con los ejercicios de color domiciliarios y los comentarios hechos en clase, así como con la visualización de ejemplos de
SINOPSIS DE TEORÍA Y USO DEL COLOR Esta sinopsis no es autónoma. Se complementa con los ejercicios de color domiciliarios y los comentarios hechos en clase, así como con la visualización de ejemplos de
Astronomía fuera del visible Beatriz García, Ricardo Moreno, Rosa M. Ros
 Astronomía fuera del visible Beatriz García, Ricardo Moreno, Rosa M. Ros International Astronomical Union Universidad Tecnológica Nacional, Argentina Colegio Retamar de Madrid, España Universidad Politécnica
Astronomía fuera del visible Beatriz García, Ricardo Moreno, Rosa M. Ros International Astronomical Union Universidad Tecnológica Nacional, Argentina Colegio Retamar de Madrid, España Universidad Politécnica
