PRACTICA 2 DE TERMODINAMICA:
|
|
|
- Lucía Inés Moya Vera
- hace 8 años
- Vistas:
Transcripción
1 PRACTICA 2 DE TERMODINAMICA: Determinación del coeficiente adiabático del aire Grupo V 15:00 S-3 (M 201) Jorge Guillermo Fernández Yáñez Lucas Esteban González Miguel Delgado Pérez Katsu Toshi Dextre Fernández
2 Presión Método de Clement-Desormes Introducción El objetivo de esta práctica es obtener el coeficiente adiabático del aire a través de este método en el cual, al enfriar un gas, en un proceso adiabático, se expande. En esta práctica se realizaremos 2 expansiones, considerándolos adiabáticos (Q=0), y lo tendremos que hacer en un tiempo corto ya que si no es así, el sistema recibirá el calor equivalente al trabajo que realiza en la expansión. pero como es adiabático (Q=0) entonces: du = Variación de energía interna dq = Calor dw = Trabajo según esta fórmula, si hay una expansión, disminuye la temperatura y viceversa, como se ha mencionado antes. Vamos a representar 2 isotermas (T 1 >T 2 ), una isóbara (V=cte.) y otra adiabática: 1 2 Proceso adiabático: se enfría el gas por la expansión. 2 3 Proceso isóbara: se calienta a volumen constante hasta la temperatura T Proceso isotérmico: se mantiene a temperatura constante (T 2 ) Isoterma (T1) Isoterma (T2) Isobara Adiabatica ,05 0,1 0,15 0,2 Volumen
3 En una transformación isotérmica se cumple esta condición: y la pendiente de esa recta es: ; ( ) En una transformación adiabática se cumple esta condición: y la pendiente de la recta es: ; ( ) Como el coeficiente adiabático es mayor que 1, la pendiente en las adiabáticas es mayor que en los procesos isotérmicos. Ahora que tenemos las pendientes de la adiabática y de la isotérmica se deduce que: ( ) ( ) En la transformación adiabática (1 2) la pendiente sería igual a En la transformación isotérmica (3 1) la pendiente sería igual a Entonces:
4 Procedimiento experimental Utilizaremos un botellón de vidrio, un compresor de aire y un manómetro diferencial de agua. Pasos a seguir: 1) Teniendo ya todo colocado, conectaremos el compresor al botellón de vidrio e inyectamos aire hasta que en el manómetro diferencial suba unos 200mm de agua. 2) Cerraremos la válvula (para que no se escape el aire) donde conectamos el compresor (y desconectamos éste), así la compresión del aire hará que se caliente y esperamos un tiempo para que alcance la temperatura ambiente (T 1 ) y a la presión p 1. Anotaremos la diferencia de las alturas (h 1) que aparece en el manómetro. 3) Ahora abrimos la válvula y la cerramos rápidamente para que se escape el aire. Con esto conseguiríamos una expansión y una disminución de la temperatura hasta T 2 con una presión p 2. Anotaremos la diferencia de las alturas (h 2 ) que aparece en el manómetro. 4) Repetiremos estos pasos 5 veces y anotaremos los datos en una tabla. 5) Según la fórmula del coeficiente adiabático: Utilizaremos una recta cuya pendiente sería, la ordenada sería h 1 y la abscisa (h 1 -h 2 ) utilizando el método de los mínimos cuadrados (para calcular los errores también).
5 h 1 (mm) Cálculo del coeficiente adiabático: h 1 (mm) h 2 (mm) h 1- h 2 (mm) *Los cálculos están hechos por Excel Recta de ajuste y = 1,3814x - 13, h 1 -h 2 (mm)
6 Método de Oscilador de Flammersfeld Datos: Masa= 4,6 g =4,6*10-3 kg Diámetro =1,1 cm ± 0,05 cm Radio =0,55 cm = 0,55*10-2 m Presión atmosférica =704,9mmHg ± 0,01mmHg Material: Procedimiento:
7 Resultados: Nº oscilaciones Ti T(s)/n γ 20 12,7 0,565 0, ,85 0,42 1, ,15 0,35 1, ,09 0,283 3, ,3 0,27 3,34 P= Pa P at = (704,4/760)*101375=93858,97 γ=(64*m*v) (T^2*p*d^4) Error del coeficiente.
8 Coeficiente medio γ =2,1 ± 0,4 Demostración de las fórmulas. A partir de esa fórmula deducimos la del coeficiente adiabático Error del coeficiente. Coeficiente medio. Aquí le dejamos como realizamos la práctica. En primer lugar procedemos a medir todos los datos necesarios para los cálculos prácticos, la presión, la masa del oscilador el diámetro
9 Después medimos el periodo de la oscilación antes comentada, con el que haremos el cálculo aproximado del coeficiente adiabático. Para ello hacemos 5 mediciones con distintas oscilaciones, así intentaremos que el error cometido sea el mínimo. Fundamento teórico: Este trabajo consiste en calcular el coeficiente adiabático del aire (γ) con el uso del Oscilador de Flammersfeld. Equipo que consta de una bomba de aire, una botella de Mariotte y un matraz volumétrico conectado a un tubo en cuyo interior se encuentra un cilindro que debido al aire bombeado comienza a oscilar armónicamente; de manera que su frecuencia de oscilación depende de cantidades físicas fácilmente medibles como la presión, volumen iniciales, y las dimensiones del cilindro. Este experimento permite explicar a los estudiantes los procesos adiabáticos en termodinámica y relacionarlos con el movimiento armónico simple, es decir relacionar la termodinámica de procesos con la mecánica clásica. El coeficiente adiabático () de los gases ideales solamente depende de los grados de libertad de una molécula de gas, es decir, del número de átomos de la molécula. En la instalación histórica de Rüchardat, la oscilación se amortigua. La instalación modificada de Flammersfeld presenta las siguientes ventajas : * Oscilación no amortiguada, alimentación de energía mediante vapor de gas. * Un gran número de oscilaciones mejora la precisión del resultado CONCLUSIÓN. Hemos tenido grandes errores en el cálculo del coeficiente adiabático del aire, ya que al contar los números de oscilaciones hemos tenido errores, debido a que no oscilaba constantemente y las oscilaciones no eran perfectas. También nos hemos dado cuenta que nuestro error es mucho más grande que el del grupo que lo hizo con las mismas oscilaciones, ya que miden 5 veces las mismas oscilaciones y varia el tiempo.
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Determinación de la relación Cp/Cv en gases
 Determinación de la relación p/v en gases Objetivo. En esta práctica se determinará la relación entre p/vγ o coeficiente isentrópico de un gas combinando un sencillo proceso de expansión en condiciones
Determinación de la relación p/v en gases Objetivo. En esta práctica se determinará la relación entre p/vγ o coeficiente isentrópico de un gas combinando un sencillo proceso de expansión en condiciones
Determinación de entalpías de vaporización
 Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Termodinámica y Máquinas Térmicas
 Termodinámica y Máquinas Térmicas Tema 04. Funciones de Estado Inmaculada Fernández Diego Severiano F. Pérez Remesal Carlos J. Renedo Estébanez DPTO. DE INGENIERÍA ELÉCTRICA Y ENERGÉTICA Este tema se publica
Termodinámica y Máquinas Térmicas Tema 04. Funciones de Estado Inmaculada Fernández Diego Severiano F. Pérez Remesal Carlos J. Renedo Estébanez DPTO. DE INGENIERÍA ELÉCTRICA Y ENERGÉTICA Este tema se publica
PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]
![PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica] PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]](/thumbs/50/26203302.jpg) Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
LAS MEDICIONES FÍSICAS. Estimación y unidades
 LAS MEDICIONES FÍSICAS Estimación y unidades 1. Cuánto tiempo tarda la luz en atravesar un protón? 2. A cuántos átomos de hidrógeno equivale la masa de la Tierra? 3. Cuál es la edad del universo expresada
LAS MEDICIONES FÍSICAS Estimación y unidades 1. Cuánto tiempo tarda la luz en atravesar un protón? 2. A cuántos átomos de hidrógeno equivale la masa de la Tierra? 3. Cuál es la edad del universo expresada
Formatos para prácticas de laboratorio
 CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF-04 LABORATORIO DE NOMBRE DE LA PRÁCTICA MECÁNICA
CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF-04 LABORATORIO DE NOMBRE DE LA PRÁCTICA MECÁNICA
PRÁCTICA Nº 5. MEDIDORES DE FLUJO PARA FLUIDOS COMPRESIBLES
 República bolivariana de Venezuela La Universidad del Zulia Facultad de Ingeniería Escuela de Ingeniería Química Laboratorio de Operaciones Unitarias I PRÁCTICA Nº 5. MEDIDORES DE FLUJO PARA FLUIDOS COMPRESIBLES
República bolivariana de Venezuela La Universidad del Zulia Facultad de Ingeniería Escuela de Ingeniería Química Laboratorio de Operaciones Unitarias I PRÁCTICA Nº 5. MEDIDORES DE FLUJO PARA FLUIDOS COMPRESIBLES
Formatos para prácticas de laboratorio
 CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF -01 1. INTRODUCCIÓN LABORATORIO DE NOMBRE DE LA
CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF -01 1. INTRODUCCIÓN LABORATORIO DE NOMBRE DE LA
TEMPERATURA DILATACIÓN. 9. En la escala Celsius una temperatura varía en 45 C. Cuánto variará en la escala Kelvin y
 TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
TEMPERATURA 1. A cuántos grados kelvin equivalen 50 grados centígrados? a) 303 b) 353 c) 453 d) 253 2. Si un cuerpo presenta una temperatura de 20 C Cuál será la lectura de esta en la escala Fahrenheit?
1. FLUIDOS (1 punto) Enuncie la ecuación de Bernoulli y describa cada uno de los términos.
 Física Forestales. Examen A. 7-0-0 Instrucciones. La parte de teoría se contestará en primer lugar utilizando la hoja de color, sin consultar libros ni apuntes, durante el tiempo que el estudiante considere
Física Forestales. Examen A. 7-0-0 Instrucciones. La parte de teoría se contestará en primer lugar utilizando la hoja de color, sin consultar libros ni apuntes, durante el tiempo que el estudiante considere
Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo.
 ! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
CAPITULO V TERMODINAMICA - 115 -
 CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
Ley de Boyle P 1/V (T y n constante) Ley de Charles Gay-Lussac V T (P y n constante) Ley de Amonton P T (V y n constante)
 Práctica 6 Ecuación de los Gases Ideales 6.1 Objetivo El estado de un gas puede describirse en términos de cuatro variables (denominadas variables de estado): presión (P), volumen (V), temperatura (T)
Práctica 6 Ecuación de los Gases Ideales 6.1 Objetivo El estado de un gas puede describirse en términos de cuatro variables (denominadas variables de estado): presión (P), volumen (V), temperatura (T)
El tubo De Vénturi. Introducción
 El tubo De Vénturi Recopilado a partir de http://www.monografias.com/trabajos6/tube/tube.shtml por: Jose Carlos Suarez Barbuzano. Técnico Superior Química Ambiental. Técnico del Centro Canario del Agua
El tubo De Vénturi Recopilado a partir de http://www.monografias.com/trabajos6/tube/tube.shtml por: Jose Carlos Suarez Barbuzano. Técnico Superior Química Ambiental. Técnico del Centro Canario del Agua
8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO
 8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO OBJETIVO El objetivo de la practica es determinar la densidad de un sólido. Para ello vamos a utilizar dos métodos: Método 1 : Cálculo de la densidad de un
8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO OBJETIVO El objetivo de la practica es determinar la densidad de un sólido. Para ello vamos a utilizar dos métodos: Método 1 : Cálculo de la densidad de un
Tema 3. Máquinas Térmicas II
 Asignatura: Tema 3. Máquinas Térmicas II 1. Motores Rotativos 2. Motores de Potencia (Turbina) de Gas: Ciclo Brayton 3. Motores de Potencia (Turbina) de Vapor: Ciclo Rankine Grado de Ingeniería de la Organización
Asignatura: Tema 3. Máquinas Térmicas II 1. Motores Rotativos 2. Motores de Potencia (Turbina) de Gas: Ciclo Brayton 3. Motores de Potencia (Turbina) de Vapor: Ciclo Rankine Grado de Ingeniería de la Organización
ENERGÍA INTERNA PARA GASES NO IDEALES.
 DEPARTAMENTO DE FISICA UNIERSIDAD DE SANTIAGO DE CHILE ENERGÍA INTERNA PARA GASES NO IDEALES. En el caso de los gases ideales o cualquier cuerpo en fase no gaseosa la energía interna es función de la temperatura
DEPARTAMENTO DE FISICA UNIERSIDAD DE SANTIAGO DE CHILE ENERGÍA INTERNA PARA GASES NO IDEALES. En el caso de los gases ideales o cualquier cuerpo en fase no gaseosa la energía interna es función de la temperatura
2 La densidad de una sustancia es ρ, el volumen es V, y la masa es m. Si el volumen se triplica y la densidad no cambia Cuál es la masa?
 Slide 1 / 20 1 Dos sustancias, A tiene una densidad de 2000 kg/m 3 y la B tiene una densidad de 3000 kg/m 3 son seleccionadas para realizar un experimento. Si el experimento necesita de igual masa de cada
Slide 1 / 20 1 Dos sustancias, A tiene una densidad de 2000 kg/m 3 y la B tiene una densidad de 3000 kg/m 3 son seleccionadas para realizar un experimento. Si el experimento necesita de igual masa de cada
DEPARTAMENTO DE INGENIERÍA QUÍMICA. Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESTADO NO ESTACIONARIO
 DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
FÍSICA CICLO 5 CAPACITACIÓN La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades.
 UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
V B. g (1) V B ) g, (2) +ρ B. =( m H. m H (3) ρ 1. ρ B. Aplicando al aire la ecuación de estado de los gases perfectos, en la forma.
 Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
HIDRAULICA DE POTENCIA. Unidad 1. Bases físicas de la hidráulica
 HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
MATERIAL DE APOYO DE USO ESCLUSIVO DEL CENTRO DE ESTUDIOS MATEMÁTICOS. C.E.M.
 1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
HUMEDAD ATMOSFÉRICA
 www.uwm.edu/~vlarson/research.htm HUMEDAD ATMOSFÉRICA Cantidad de vapor de agua que contiene el aire; es la fuente de precipitaciones; influye en los procesos de evapotranspiración y derretimiento de nieves.
www.uwm.edu/~vlarson/research.htm HUMEDAD ATMOSFÉRICA Cantidad de vapor de agua que contiene el aire; es la fuente de precipitaciones; influye en los procesos de evapotranspiración y derretimiento de nieves.
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
EFECTO JOULE-THOMSON
 PRACTICA nº 4 EFECTO JOULE-THOMSON Fundamentos teóricos El proceso de Joule-Thomson consiste en el paso de un gas desde un contenedor a presión constante a otro a presión también constante y menor (Pf
PRACTICA nº 4 EFECTO JOULE-THOMSON Fundamentos teóricos El proceso de Joule-Thomson consiste en el paso de un gas desde un contenedor a presión constante a otro a presión también constante y menor (Pf
EFECTO DEL CALOR SOBRE LA MATERIA
 EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES. Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile
 Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA
 PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI
 Laboratorio de Física de Procesos Biológicos COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI Fecha: 13/1/006 1. Obetivo de la práctica Comprobación experimental de la ecuación de Bernoulli de la dinámica de fluidos
Laboratorio de Física de Procesos Biológicos COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI Fecha: 13/1/006 1. Obetivo de la práctica Comprobación experimental de la ecuación de Bernoulli de la dinámica de fluidos
Laboratorio 4. Cocientes de capacidades de calor de gases
 Laboratorio 4. Cocientes de capacidades de calor de gases Objetivo Determinar el cociente de capacidades de calor () para gases como dióxido de carbono (CO ) y nitrógeno (N ) utilizando la expansión adiabática.
Laboratorio 4. Cocientes de capacidades de calor de gases Objetivo Determinar el cociente de capacidades de calor () para gases como dióxido de carbono (CO ) y nitrógeno (N ) utilizando la expansión adiabática.
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón. Trabajo Práctico: Leyes de los gases
 Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
Concepto de trabajo, Primera Ley. energía, y calor.
 Concepto de trabajo, Primera Ley energía, y calor. Trabajo micro 1 2 En general: W= F. dr = m( v2 2 1 Si hay una parte de fuerzas conservativa: W= 1-2 F.dr=φ 2 -φ 1 De manera que: W total =W=W nc -φ 2
Concepto de trabajo, Primera Ley energía, y calor. Trabajo micro 1 2 En general: W= F. dr = m( v2 2 1 Si hay una parte de fuerzas conservativa: W= 1-2 F.dr=φ 2 -φ 1 De manera que: W total =W=W nc -φ 2
Capítulo 17. Temperatura. t(h) = 100 h h 0
 Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
LABORATORIO #6 DEMOSTRACIÓN DEL TOREMA DE BERNOULLI LUIS CARLOS DE LA CRUZ TORRES GILDARDO DIAZ CARLOS ROJAS PRESENTADO EN LA CÁTEDRA:
 LABORATORIO #6 DEMOSTRACIÓN DEL TOREMA DE BERNOULLI LUIS CARLOS DE LA CRUZ TORRES GILDARDO DIAZ CARLOS ROJAS PRESENTADO EN LA CÁTEDRA: LABORATORIO DE MECÁNICA DE FLUIDOS PRESENTADO A: ING. VLADIMIR QUIROZ
LABORATORIO #6 DEMOSTRACIÓN DEL TOREMA DE BERNOULLI LUIS CARLOS DE LA CRUZ TORRES GILDARDO DIAZ CARLOS ROJAS PRESENTADO EN LA CÁTEDRA: LABORATORIO DE MECÁNICA DE FLUIDOS PRESENTADO A: ING. VLADIMIR QUIROZ
BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES
 BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES 1.1 INTRODUCCION Proceso: Cualquier operación o serie de operaciones que produce un cambio físico o químico en una sustancia o en una mezcla
BALANCES DE MASA Y ENERGÍA CAPITULO 1: BALANCES DE MATERIALES 1.1 INTRODUCCION Proceso: Cualquier operación o serie de operaciones que produce un cambio físico o químico en una sustancia o en una mezcla
LÍNEAS DEL DIAGRAMA DE MOLLIER
 DIAGRAMA DE MOLLIER El refrigerante cambia de estado a lo largo del ciclo frigorífico como hemos visto en el capítulo anterior. Representaremos sobre el diagrama de p-h las distintas transformaciones que
DIAGRAMA DE MOLLIER El refrigerante cambia de estado a lo largo del ciclo frigorífico como hemos visto en el capítulo anterior. Representaremos sobre el diagrama de p-h las distintas transformaciones que
III Tema Segunda ley de la termodinámica
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA PESQUERA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA III Tema Segunda ley de
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA PESQUERA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA III Tema Segunda ley de
F. Aclarando conceptos sobre termodinámica
 IES Antonio Glez Glez Principios de máquinas Página 1 F. Aclarando conceptos sobre termodinámica Termodinámica La termodinámica es la parte de la física que analiza los fenómenos en los que interviene
IES Antonio Glez Glez Principios de máquinas Página 1 F. Aclarando conceptos sobre termodinámica Termodinámica La termodinámica es la parte de la física que analiza los fenómenos en los que interviene
EQUIVALENCIA CALOR-TRABAJO. Elaborado por M en C Omar Hernández Segura
 EQUIVALENCIA CALOR-TRABAJO TRABAJO 1 TRABAJO Y SUS VARIEDADES Tipo de trabajo: δw Donde: Unidades δw (J) Expansión-compresión P op dv P op es la presión de oposición dv es el cambio de volumen Superficial
EQUIVALENCIA CALOR-TRABAJO TRABAJO 1 TRABAJO Y SUS VARIEDADES Tipo de trabajo: δw Donde: Unidades δw (J) Expansión-compresión P op dv P op es la presión de oposición dv es el cambio de volumen Superficial
( Práctica nº 6 de 3º de la ESO curso )
 LEY DE GAY LUSSAC ( Práctica nº 6 de 3º de la ESO curso 2015 2016 ) Objetivos: A).- Significado del coeficiente de dilatación volumica (o cúbica ), B).- Comprobar la 1ª ley de Gay Lussac (se basa en la
LEY DE GAY LUSSAC ( Práctica nº 6 de 3º de la ESO curso 2015 2016 ) Objetivos: A).- Significado del coeficiente de dilatación volumica (o cúbica ), B).- Comprobar la 1ª ley de Gay Lussac (se basa en la
COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI
 Laboratorio de Física General (Fluidos) COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI Fecha: 0/10/013 1. Obetivo de la práctica Comprobación experimental de la ecuación de Bernoulli de la dinámica de fluidos
Laboratorio de Física General (Fluidos) COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI Fecha: 0/10/013 1. Obetivo de la práctica Comprobación experimental de la ecuación de Bernoulli de la dinámica de fluidos
Termodinámica del aire: experimento de expansión adiabática de un gas y medida de γ = C p / C v con el método de Clément y Desormes (*)
 Termodinámica del aire: experimento de expansión adiabática de un gas y medida de γ = C p / C v con el método de Clément y Desormes (*) 1. Introducción El cociente de calores específicos a presión constante
Termodinámica del aire: experimento de expansión adiabática de un gas y medida de γ = C p / C v con el método de Clément y Desormes (*) 1. Introducción El cociente de calores específicos a presión constante
Respuesta: a) La fracción molar de NaCl es 0,072 b) La concentración másica volumétrica de NaCl es 0,231 g/cc
 Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
La energía interna. Nombre Curso Fecha
 Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
- Determinar experimentalmente la relación entre la presión y el volumen. - Comprender la Ley de Boyle.
 LEY DE BOYLE Objetivos: - Determinar experimentalmente la relación entre la presión y el volumen. - Comprender la Ley de Boyle. Equipo y materiales: - Aparato de la Ley de Gases (pasco TD 8572) - Sensor
LEY DE BOYLE Objetivos: - Determinar experimentalmente la relación entre la presión y el volumen. - Comprender la Ley de Boyle. Equipo y materiales: - Aparato de la Ley de Gases (pasco TD 8572) - Sensor
y 2 Considere que el viento no sopla en la dirección AB sino que lo hace de forma que v r
 P1. Anemometría sónica. Hoy en día, los Centros Meteorológicos disponen de aparatos muy sofisticados para medir la velocidad del viento que, además y simultáneamente, miden la temperatura del aire. El
P1. Anemometría sónica. Hoy en día, los Centros Meteorológicos disponen de aparatos muy sofisticados para medir la velocidad del viento que, además y simultáneamente, miden la temperatura del aire. El
NOCIONES BASICAS ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS.
 SUSTANCIA: ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS. SUSTANCIA DE TRABAJO: ES LA PORCIÓN DE MATERIA QUE ACTUANDO EN UN SISTEMA ES CAPAZ DE ABSORBER O CEDER ENERGÍA. EN ESE PROCESO
SUSTANCIA: ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS. SUSTANCIA DE TRABAJO: ES LA PORCIÓN DE MATERIA QUE ACTUANDO EN UN SISTEMA ES CAPAZ DE ABSORBER O CEDER ENERGÍA. EN ESE PROCESO
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Unidad I: ropiedades y Leyes de la ermodinámica! Ciclos de potencia! Ciclo de refrigeración 8/7/0 Ctenido! Ciclos termodinámicos!! Ciclo Rankine! ariantes del Ciclo Rankine! Ciclos
ERMODINÁMICA AANZADA Unidad I: ropiedades y Leyes de la ermodinámica! Ciclos de potencia! Ciclo de refrigeración 8/7/0 Ctenido! Ciclos termodinámicos!! Ciclo Rankine! ariantes del Ciclo Rankine! Ciclos
Prácticas de Laboratorio de Hidráulica
 Universidad Politécnica de Madrid E.T.S. Ingenieros de Caminos, Canales y Puertos Prácticas de Laboratorio de Hidráulica Jaime García Palacios Francisco V. Laguna Peñuelas 2010 Índice general 3. Venturi
Universidad Politécnica de Madrid E.T.S. Ingenieros de Caminos, Canales y Puertos Prácticas de Laboratorio de Hidráulica Jaime García Palacios Francisco V. Laguna Peñuelas 2010 Índice general 3. Venturi
INGENIERO. JOSMERY SÁNCHEZ
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
Longitud. Unidades de medida. Superficie. Unidades de medida. Volumen. Unidades de medida. Nociones sobre calor y temperatura. Escalas de temperatura.
 Unidad 1: Conceptos Básicos Longitud. Unidades de medida. Superficie. Unidades de medida. Volumen. Unidades de medida Peso específico. Unidades de medida. Presión. Unidades de medida. Elementos de medición
Unidad 1: Conceptos Básicos Longitud. Unidades de medida. Superficie. Unidades de medida. Volumen. Unidades de medida Peso específico. Unidades de medida. Presión. Unidades de medida. Elementos de medición
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA
 TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
Determinación de la constante de los gases ideales
 Prácticas de Química. Determinación de la constante de los gases ideales I. Introducción teórica y objetivos........................................ 2 II. Material................................................................
Prácticas de Química. Determinación de la constante de los gases ideales I. Introducción teórica y objetivos........................................ 2 II. Material................................................................
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
PPT DE APOYO CCNN FÍSICA NIVEL: 8 BÁSICO PROFESORA: GUISLAINE LOAYZA TEMA: LA FUERZA Y LA PRESIÓN
 PPT DE APOYO CCNN FÍSICA NIVEL: 8 BÁSICO PROFESORA: GUISLAINE LOAYZA TEMA: LA FUERZA Y LA PRESIÓN TEMA DE LA CLASE: LA FUERZA Y LA PRESIÓN OBJETIVO DE LA CLASE: Describir la relación entre la fuerza y
PPT DE APOYO CCNN FÍSICA NIVEL: 8 BÁSICO PROFESORA: GUISLAINE LOAYZA TEMA: LA FUERZA Y LA PRESIÓN TEMA DE LA CLASE: LA FUERZA Y LA PRESIÓN OBJETIVO DE LA CLASE: Describir la relación entre la fuerza y
Estudiar el fenómeno de trasferencia de calor en los procesos de fundido y evaporación del agua. Calcular el calor latente de vaporización del agua.
 CAMBIOS DE FASE. OBJETIVO: Estudiar el fenómeno de trasferencia de calor en los procesos de fundido y evaporación del agua. Calcular el calor latente de vaporización del agua. INTRODUCCION. Los procesos
CAMBIOS DE FASE. OBJETIVO: Estudiar el fenómeno de trasferencia de calor en los procesos de fundido y evaporación del agua. Calcular el calor latente de vaporización del agua. INTRODUCCION. Los procesos
TRABAJO PRÁCTICO. Estudio de la compresión y expansión de gases ideales, en procesos adiabáticos e isotérmicos
 FACULTAD DE CIENCIAS EXACTAS, INGENIERÍA Y AGRIMENSURA ESCUELA DE CIENCIAS BÁSICAS DEPARTAMENTO DE FÍSICA Y QUÍMICA FÍSICA II - Termodinámica TRABAJO PRÁCTICO Estudio de la compresión y expansión de gases
FACULTAD DE CIENCIAS EXACTAS, INGENIERÍA Y AGRIMENSURA ESCUELA DE CIENCIAS BÁSICAS DEPARTAMENTO DE FÍSICA Y QUÍMICA FÍSICA II - Termodinámica TRABAJO PRÁCTICO Estudio de la compresión y expansión de gases
Soluciones. DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I)
 Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Ejercicios relacionados con líquidos y sólidos
 Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
INGENIERIA DE EJECUCIÓN EN MECANICA PROGRAMA PROSECUCION DE ESTUDIOS VESPERTINO GUIA DE LABORATORIO
 INGENIERIA DE EJECUCIÓN EN MECANICA PROGRAMA PROSECUCION DE ESTUDIOS VESPERTINO GUIA DE LABORATORIO ASIGNATURA 9562 EQUIPOS E INSTALACIONES TÉRMICAS E HIDRAULICAS TOPICO II NIVEL 05 EXPERIENCIA E-952 TURBINA
INGENIERIA DE EJECUCIÓN EN MECANICA PROGRAMA PROSECUCION DE ESTUDIOS VESPERTINO GUIA DE LABORATORIO ASIGNATURA 9562 EQUIPOS E INSTALACIONES TÉRMICAS E HIDRAULICAS TOPICO II NIVEL 05 EXPERIENCIA E-952 TURBINA
ECUACIÓN DE ESTADO DE LOS GASES IDEALES
 ECUACIÓN DE ESTADO DE LOS GASES IDEALES Laboratorio de Física 1. OBJETIVO Se estudiará, tomando como ejemplo el aire, el comportamiento de un gas ideal cuando varían sus variables de estado, y se comprobarán
ECUACIÓN DE ESTADO DE LOS GASES IDEALES Laboratorio de Física 1. OBJETIVO Se estudiará, tomando como ejemplo el aire, el comportamiento de un gas ideal cuando varían sus variables de estado, y se comprobarán
MEDIDA DE LA DENSIDAD DE UN CUERPO. DETERMINACIÓN DE π
 1 Objetivos Departamento de Física Curso cero MEDIDA DE LA DENSIDAD DE UN CUERPO. DETERMINACIÓN DE π Utilización de un calibre en la determinación de las dimensiones de un objeto y de una balanza digital
1 Objetivos Departamento de Física Curso cero MEDIDA DE LA DENSIDAD DE UN CUERPO. DETERMINACIÓN DE π Utilización de un calibre en la determinación de las dimensiones de un objeto y de una balanza digital
PRÁCTICA: BANCO DE ENSAYO DE BOMBAS
 PRÁCTICA: BANCO DE ENSAYO DE BOMBAS htttp://www.uco.es/moodle Descripción del equipo y esquema de la instalación La instalación en la que se lleva a cabo esta práctica es un banco de ensayos preparado
PRÁCTICA: BANCO DE ENSAYO DE BOMBAS htttp://www.uco.es/moodle Descripción del equipo y esquema de la instalación La instalación en la que se lleva a cabo esta práctica es un banco de ensayos preparado
TEMA 2: PROPIEDADES FÍSICAS DE LOS FLUIDOS
 Manual para el diseño de una red hidráulica de climatización 3 A ntes de comenzar a estudiar cualquier problema de flujo, es necesario conocer algunas características y propiedades físicas de los fluidos,
Manual para el diseño de una red hidráulica de climatización 3 A ntes de comenzar a estudiar cualquier problema de flujo, es necesario conocer algunas características y propiedades físicas de los fluidos,
Clase 2: Sustancias puras
 Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
FUNDAMENTOS DE REFRIGERACION
 FUNDAMENTOS DE REFRIGERACION PRESENTACION EN ESPAÑOL Mayo 2010 Renato C. OLvera Index ESTADOS DE LA MATERIA LOS DIFERENTES ESTADOS DE LA MATERIA SON MANIFESTACIONES DE LA CANTIDAD DE ENERGIA QUE DICHA
FUNDAMENTOS DE REFRIGERACION PRESENTACION EN ESPAÑOL Mayo 2010 Renato C. OLvera Index ESTADOS DE LA MATERIA LOS DIFERENTES ESTADOS DE LA MATERIA SON MANIFESTACIONES DE LA CANTIDAD DE ENERGIA QUE DICHA
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Universidad Nacional de Córdoba. Facultad de Ciencias Exactas Físicas y Naturales. Cátedra de Mecánica de los Fluidos. Carrea de Ingeniería Civil
 Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
Ley de Boyle. A temperatura constante, el volumen de una muestra dada de gas es inversamente proporcional a su presión
 LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
MEDICIÓN DEL VOLUMEN
 MEDICIÓN DEL VOLUMEN CONCEPTOS BÁSICOS Volumen: porción de espacio que ocupa un cuerpo ya sea sólido, líquido o gaseoso. Capacidad: es el volumen de un fluido que puede contener o suministrar un instrumento
MEDICIÓN DEL VOLUMEN CONCEPTOS BÁSICOS Volumen: porción de espacio que ocupa un cuerpo ya sea sólido, líquido o gaseoso. Capacidad: es el volumen de un fluido que puede contener o suministrar un instrumento
Problemas de Estática y Dinámica DINÁMICA DE FLUIDOS
 Problemas de Estática y Dinámica DINÁMICA DE FLUIDOS (1 er Q.:prob pares, 2 ndo Q.:prob impares) 1. En el esquema adjunto las secciones de la tubería son 40 y 12 cm 2, y la velocidad del agua en la primera
Problemas de Estática y Dinámica DINÁMICA DE FLUIDOS (1 er Q.:prob pares, 2 ndo Q.:prob impares) 1. En el esquema adjunto las secciones de la tubería son 40 y 12 cm 2, y la velocidad del agua en la primera
Madrid, 25 y 26 de mayo de 2015 ABB Automation Days. Nuevas tecnologías para una mayor reducción de emisiones y de consumo de combustible
 Madrid, 25 y 26 de mayo de 2015 ABB Automation Days Nuevas tecnologías para una mayor reducción de emisiones y de consumo de combustible 1. Descripción de la situación inicial Cada vez las exigencias del
Madrid, 25 y 26 de mayo de 2015 ABB Automation Days Nuevas tecnologías para una mayor reducción de emisiones y de consumo de combustible 1. Descripción de la situación inicial Cada vez las exigencias del
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora 1 emas 5. Segunda ley de la ermodinámica. i. Máquinas térmicas y su eficiencia. ii. Segunda
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora 1 emas 5. Segunda ley de la ermodinámica. i. Máquinas térmicas y su eficiencia. ii. Segunda
El Equilibrio Termodinámico. Tipos de Equilibrios.
 TEMA 1.) CONCEPTOS BASICOS Sistema Termodinámico. Paredes. Tipos de Sistemas. Criterio de Signos. Estado Termodinámico. El Equilibrio Termodinámico. Tipos de Equilibrios. Variables Termodinámicas. Procesos
TEMA 1.) CONCEPTOS BASICOS Sistema Termodinámico. Paredes. Tipos de Sistemas. Criterio de Signos. Estado Termodinámico. El Equilibrio Termodinámico. Tipos de Equilibrios. Variables Termodinámicas. Procesos
INGENIERIA DE EJECUCIÓN EN MECANICA PROGRAMA PROSECUCION DE ESTUDIOS VESPERTINO GUIA DE LABORATORIO
 INGENIERIA DE EJECUCIÓN EN MECANICA PROGRAMA PROSECUCION DE ESTUDIOS VESPERTINO GUIA DE LABORATORIO ASIGNATURA 9555 M85 MECÁNICA DE FLUIDOS NIVEL 03 EXPERIENCIA E-6 PÉRDIDA DE CARGA EN SINGULARIDADES HORARIO:
INGENIERIA DE EJECUCIÓN EN MECANICA PROGRAMA PROSECUCION DE ESTUDIOS VESPERTINO GUIA DE LABORATORIO ASIGNATURA 9555 M85 MECÁNICA DE FLUIDOS NIVEL 03 EXPERIENCIA E-6 PÉRDIDA DE CARGA EN SINGULARIDADES HORARIO:
Clase 2. Estructura de la Atmósfera
 Clase 2 Estructura de la Atmósfera Preguntas claves 1. Qué es la presión y temperatura? 2. Cómo varían con la altura? 3. Cuál es la estructura de la atmósfera? La física y dinámica de la atmósfera puede
Clase 2 Estructura de la Atmósfera Preguntas claves 1. Qué es la presión y temperatura? 2. Cómo varían con la altura? 3. Cuál es la estructura de la atmósfera? La física y dinámica de la atmósfera puede
Ingeniería. Instrumentos de Procesos Industriales. Instrumentos de medición de presión. Introducción
 Ingeniería Instrumentos de Procesos Industriales Instrumentos de medición de presión Introducción Junto con la temperatura, la presión es la variable más comúnmente medida en plantas de proceso. Su persistencia
Ingeniería Instrumentos de Procesos Industriales Instrumentos de medición de presión Introducción Junto con la temperatura, la presión es la variable más comúnmente medida en plantas de proceso. Su persistencia
GUIA DE EJERCICIOS I. Gases Primera Ley de la Termodinámica Equilibrio Térmico (Ley Cero).
 UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS I. Gases Primera Ley de la Termodinámica Equilibrio Térmico (Ley Cero). Gases - Primera ley de la Termodinámica Ley Cero. 1. Se mantiene
UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS I. Gases Primera Ley de la Termodinámica Equilibrio Térmico (Ley Cero). Gases - Primera ley de la Termodinámica Ley Cero. 1. Se mantiene
Lección: Primer principio de la termodinámica
 Lección: Primer principio de la termodinámica TEMA: Introducción 1 Adolfo Bastida Pascual Universidad de Murcia. España... 2 I.A. Energía interna..................... 2 I.B. Enunciado del primer principio......
Lección: Primer principio de la termodinámica TEMA: Introducción 1 Adolfo Bastida Pascual Universidad de Murcia. España... 2 I.A. Energía interna..................... 2 I.B. Enunciado del primer principio......
DENSIDAD Y PESO ESPECÍFICO
 DENSIDAD Y PESO ESPECÍFICO Adaptación del Experimento Nº 2 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 43-47. Autorizado por el Autor. Materiales: Cilindros graduados
DENSIDAD Y PESO ESPECÍFICO Adaptación del Experimento Nº 2 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 43-47. Autorizado por el Autor. Materiales: Cilindros graduados
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO. Nombre Grupo Matrícula PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P)
 Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
PROBLEMAS. Segundo Principio. Problema 1
 PROBLEMAS Segundo Principio Problema 1 La figura muestra un sistema que capta radiación solar y la utiliza para producir electricidad mediante un ciclo de potencia. El colector solar recibe 0,315 kw de
PROBLEMAS Segundo Principio Problema 1 La figura muestra un sistema que capta radiación solar y la utiliza para producir electricidad mediante un ciclo de potencia. El colector solar recibe 0,315 kw de
PROBLEMAS DE NAVIDAD 2001
 PROBLEMAS DE NAVIDAD 2001 PROBLEMAS DE NAVIDAD 2001 Navidad 2001-1 Para la conducción cuya sección transversal se representa en la figura se pide: Calcular el caudal de agua que puede trasegar suponiendo
PROBLEMAS DE NAVIDAD 2001 PROBLEMAS DE NAVIDAD 2001 Navidad 2001-1 Para la conducción cuya sección transversal se representa en la figura se pide: Calcular el caudal de agua que puede trasegar suponiendo
Capítulo 10. Efectos de superficie. Sistema respiratorio
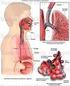 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
El propósito principal de la deshidratación de alimentos es prolongar la durabilidad
 1.1 INTRODUCCIÓN El propósito principal de la deshidratación de alimentos es prolongar la durabilidad del producto final. El objetivo primordial del proceso de deshidratación es reducir el contenido de
1.1 INTRODUCCIÓN El propósito principal de la deshidratación de alimentos es prolongar la durabilidad del producto final. El objetivo primordial del proceso de deshidratación es reducir el contenido de
HIDRODINÁMICA. Profesor: Robinson Pino H.
 HIDRODINÁMICA Profesor: Robinson Pino H. 1 CARACTERÍSTICAS DEL MOVIMIENTO DE LOS FLUIDOS Flujo laminar: Ocurre cuando las moléculas de un fluido en movimiento siguen trayectorias paralelas. Flujo turbulento:
HIDRODINÁMICA Profesor: Robinson Pino H. 1 CARACTERÍSTICAS DEL MOVIMIENTO DE LOS FLUIDOS Flujo laminar: Ocurre cuando las moléculas de un fluido en movimiento siguen trayectorias paralelas. Flujo turbulento:
Sistemas de vacío de múltiples etapas a chorro de vapor operando en circuito cerrado alcalino (Alkaline Closed Loop - ACL)
 Sistemas de vacío de múltiples etapas a chorro de vapor operando en circuito cerrado alcalino (Alkaline Closed Loop - ACL) Sistemas de vacío de múltiples etapas a chorro de vapor Los sistemas de vacío
Sistemas de vacío de múltiples etapas a chorro de vapor operando en circuito cerrado alcalino (Alkaline Closed Loop - ACL) Sistemas de vacío de múltiples etapas a chorro de vapor Los sistemas de vacío
Prof. Jorge Rojo Carrascosa
 Asignatura: FÍSICA Y QUÍMICA EJERCICIOS DE AMPLIACIÓN - SOLUCIONES Fecha finalización: Martes, 8 de marzo de 2011 Nombre y Apellidos JRC 1 Un submarino se encuentra a una profundidad de 400 metros. Cuál
Asignatura: FÍSICA Y QUÍMICA EJERCICIOS DE AMPLIACIÓN - SOLUCIONES Fecha finalización: Martes, 8 de marzo de 2011 Nombre y Apellidos JRC 1 Un submarino se encuentra a una profundidad de 400 metros. Cuál
PRODUCCIÓN DE ENERGÍA ELÉCTRICA DE FUGA DE CALOR:
 PRODUCCIÓN DE ENERGÍA ELÉCTRICA DE FUGA DE CALOR: ciclo doble / simple etapa ORC con un innovador motor rotativo termovolumetrico patentada de alta eficiencia 0.Resumen Se presentan algunos resultados
PRODUCCIÓN DE ENERGÍA ELÉCTRICA DE FUGA DE CALOR: ciclo doble / simple etapa ORC con un innovador motor rotativo termovolumetrico patentada de alta eficiencia 0.Resumen Se presentan algunos resultados
IC18DV/92 Equipo Destilación Multifuncional
 QUÍMICA INDUSTRIAL IC18DV/92 - Equipo Destilación Multifuncional - Cód. 991200 IC18DV/92 Equipo Destilación Multifuncional DIDACTA Italia S.r.l. - Strada del Cascinotto, 139/30-10156 Torino - Italy Tel.
QUÍMICA INDUSTRIAL IC18DV/92 - Equipo Destilación Multifuncional - Cód. 991200 IC18DV/92 Equipo Destilación Multifuncional DIDACTA Italia S.r.l. - Strada del Cascinotto, 139/30-10156 Torino - Italy Tel.
