PRÁCTICA DE LABORATORIO NO. 2 ESPECTROFOTOMETRÍA
|
|
|
- Julia Plaza Muñoz
- hace 6 años
- Vistas:
Transcripción
1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS UD BIOQUIMICA CIENCIAS BASICAS Y BIOLOGICAS MANUAL DE LABORATORIOS Y CASOS CLINICOS 2018 PRÁCTICA DE LABORATORIO NO. 2 ESPECTROFOTOMETRÍA Con el estudio y desarrollo de la presente práctica de laboratorio el estudiante adquiere el conocimiento y desarrolla la habilidad para utilizar el espectrofotómetro y los instrumentos de laboratorio que lo capacitan para calcular correctamente la concentración de sustancias en muestras biológicas. GENERALIDADES: Un espectrofotómetro es un aparato electrónico que se utiliza para medir las proporciones de luz de diferentes longitudes de onda, que son absorbidas y trasmitidas por una solución usualmente coloreada. La luz del sol es una forma de energía conocida como energía electromagnética, también llamada RADIACIÓN que viaja en ondas rítmicas. La distancia entre las crestas de las ondas electromagnéticas se conoce con el nombre de longitud de onda, se representa por una letra griega llamada lambda ( ) y su dimensional se expresa en nanómetros (1 nm = 10-9 m). La radiación nos proporciona un espectro electromagnético que posee longitudes de onda que van desde 10-5 nm hasta un poco más de 1,000 m. Este espectro electromagnético está constituido por los rayos gamma, los rayos X, la energía ultravioleta, la luz visible, la energía infrarroja, las microondas y las ondas de radio. Los rayos gamma poseen las longitudes de onda más cortas (10-5 a 10-3 nm), luego los rayos X (10-3 a 1 nm) y después la energía ultravioleta (1 nm a 400 nm). La luz visible es el segmento de energía más importante para la vida y posee una banda estrecha de longitudes de onda que van desde los 400 nm a los 700 nm. Esta radiación es conocida como la luz visible porque el ojo humano puede detectarla en la forma de diversos colores. En el espectro de luz visible el color violeta corresponde al extremo de longitud de onda más corta y el color rojo corresponde al extremo de longitud de onda más larga. Los rayos Infrarrojos poseen longitudes de onda que van desde los 700 nm a los 10 6 nm, la banda de microondas va de 10 6 nm a 1 m y finalmente las ondas de radio van desde 1 m hasta un poco más de 1000 m (1) Los espectrofotómetros que utilizaremos proporcionan longitudes de onda que van de los 325 a los 1100 nm. Poseen lámpara incandescente de tungsteno-halógeno como fuente de emisiones. (5) Por qué tenemos que cambiar el color de la luz al usar el fotómetro? Debemos recordar algunos aspectos fundamentales de física de la luz y el color: PÁGINA 1 DE 9
2 La energía del sol y la de una bombilla encendida incluye al total de la energía luminosa. Si un rayo de esa luz pasa por un prisma, se descompone: es el origen del arco iris. Cuando la energía incide en un objeto que no absorbe energía luminosa, lo vemos de color blanco porque refleja toda la energía: El blanco es la suma de todos los colores. En contraste, a un objeto que absorbe la totalidad de la energía luminosa, lo vemos negro (no refleja nada de la energía luminosa) y se recalienta muy rápido: el negro es la ausencia de color. En este momento recuerde el experimento del disco de Newton: coloreado con los colores primarios y secundarios: AL GIRAR A ALTA VELOCIDAD SE VE BLANCO porque reúne a todos los colores del espectro luminoso. Los objetos coloreados absorben una parte del espectro luminoso y reflejan lo demás. Lo que perciben nuestros ojos es la energía que es reflejada. Para poder saber qué energía fue absorbida debemos recordar la definición del color complementario : El color complementario de un color primario es un color secundario (y viceversa), siempre que juntos den como resultado la combinación de los 3 colores primarios. Ejemplos: Para el color primario ROJO, el complementario es el secundario VERDE que incluye los dos primarios amarillo + azul. Para el secundario VIOLETA (que ya incluye a 2 primarios, rojo + azul), el complementario es el primario AMARILLO. Página 2 de 9
3 Por qué razón las hojas de las plantas son VERDES? Porque la clorofila y los cloroplastos absorben la energía del color ROJO (alrededor de 650 nm): En la figura de semicírculos adjunta, retire el semicírculo rojo y al quedar el amarillo y el azul, nuestros ojos perciben el verde (el complementario del que quedó absorbido). Por qué razón la sangre es roja? Porque la hemoglobina (en sus grupos hem) absorbe la energía del VERDE (alrededor de 530 nm): Si retira los semicírculos amarillo y azul que forman al verde, nuestros ojos solo percibirán el rojo (el complementario del que quedó absorbido). DESCRIPCIÓN DEL FUNCIONAMIENTO DEL FOTÓMETRO. La luz blanca que emite la lámpara, se hace pasar a través de un prisma, el cual descompone la luz, separándola en sus colores constituyentes (según su longitud de onda), formando un abanico de colores, como en los experimentos de física de la luz. El espectrofotómetro tiene un mecanismo que modifica la posición del prisma de acuerdo a la cifra de longitud de onda que se programa. Para cada cifra programada corresponde diferente color. El rayo de luz es dirigido hacia una rejilla metálica (monocromador), por la cual podrá pasar la luz del color que en ese momento se haya escogido. Simultáneamente, cuando cambia el color, aparece en la ventana de lectura la longitud de onda del color que estamos usando. % Log. absorbancia y transmitancia Después de la rejilla, está el espacio donde se colocan los tubos de ensayo con las sustancias que se están estudiando. El tubo de ensayo (denominado en estos casos cubeta óptica) recibe un rayo de luz monocromática que posee una determinada longitud de onda, en función de su color (*Io = luz incidente), con 100% de intensidad. El contenido de la cubeta óptica (que tendrá solvente y soluto) podrá absorber alguna parte de la energía de ese rayo luminoso a su paso a través de la misma, y la luz que logre atravesar la solución (**I = luz emergente), llevará una intensidad menor. Este rayo más débil seguirá su curso hasta chocar contra un dispositivo (foto celda o tubo fotoeléctrico) sensible a la Página 3 de 9
4 cantidad de energía que logra pasar, convirtiéndola en electricidad y trasladándola, por medio de un galvanómetro, a una pantalla, donde aparece la cifra que demuestra la cantidad de energía que logró llegar a la foto celda. Si el rayo luminoso no hubiera encontrado ningún obstáculo en su camino, impactaría la foto celda con toda su potencia y la pantalla mostraría su energía en el 100%. En la figura anterior se ejemplifica el caso de una sustancia que absorbe la mitad de la energía del rayo luminoso: en la pantalla veríamos la cifra correspondiente al 50%. TRANSMITANCIA Y ABSORBANCIA: En la pantalla se pueden mostrar dos dimensionales: Una escala de TRANSMITANCIA (expresada en porcentaje), en la cual se expresa la cantidad de energía que logró atravesar el medio absorbente de la cubeta óptica y llegar hasta la foto celda. Y una escala de ABSORBANCIA que expresa el logaritmo de (100 / %T), en la cual se expresa la cantidad de energía que quedó absorbida en las moléculas del medio absorbente, sin lograr atravesarlo. sorbancia Transmitancia A mayor concentración Son escalas inversas y si estuvieran expresadas en la misma dimensional nos mostrarían que, por ejemplo, una sustancia que absorba el 30 % de la energía del rayo, mostraría en la pantalla 70 % de transmitancia y 30 % de absorbancia. El concepto se aplica de la misma forma y por esa razón una sustancia que logre absorber el 50% de la energía del rayo luminoso nos dará una transmitancia del 50% y una absorbancia de 0.3, el logaritmo correspondiente a (100 / 50% T) absorbido. Como norma general usaremos la escala de sorbancia, porque las cifras obtenidas en logaritmos pueden graficarse en mejor forma cuando el procedimiento de fotometría es utilizado en estudios de investigación médica. Página 4 de 9
5 BASES DE LA FOTOMETRÍA La mayoría de los compuestos biológicos, tales como las proteínas, las grasas, los carbohidratos y los ácidos nucleicos, absorben energía en alguna parte de las regiones ultravioleta, luz visible e infrarroja. (4) Cuando el rayo de luz llega a la cubeta óptica lleva el 100% de su energía. A medida que penetra en la sustancia, las moléculas presentes gradualmente absorberán cada vez más energía por lo que la intensidad de la energía del rayo luminoso progresivamente irá perdiendo su potencia, en función de tres variables: a) el grado de concentración de solutos en la sustancia que se analiza, b) la longitud del medio absorbente o sea la distancia que el rayo debe recorrer que depende del ancho del tubo que se está utilizando y c) la longitud de onda (o color) del rayo que se está usando, porque si la sustancia que se analiza tiene un color determinado, se comporta de forma diferente (en cuanto a la cantidad de energía que puede absorber) frente a los diferentes colores de luz que se puedan hacer pasar a través de ella. En eso se basa la afirmación de que la fracción de la luz incidente (Io) absorbida por una solución, a una determinada longitud de onda, está relacionada con la concentración de la especie que absorbe y con el espesor de la capa absorbente. (4) Las relaciones anteriores se expresan en las Leyes de Beer y Lambert de la manera siguiente: LEY DE BEER: Cuando un rayo de luz monocromática pasa a través de un medio absorbente, su intensidad disminuye exponencialmente a medida que la concentración del medio absorbente aumenta. LEY DE LAMBERT: Cuando un rayo de luz monocromática pasa a través de un medio absorbente, su intensidad disminuye exponencialmente a medida que la longitud del medio absorbente aumenta. La combinación de ambas leyes puede expresarse en forma integral de la manera siguiente: Log Io (100) I (%T) = e c l Donde Io es la intensidad de la luz incidente (que va llegando a la cubeta óptica), I es la intensidad de la luz emergente o transmitida (que atravesó la cubeta óptica y se dirige a la foto celda), e es el coeficiente de absorción molar (en unidades de litros por mol por cm.) el cual varía según la naturaleza específica de cada sustancia (por esto, un gramo de sal y un gramo de azúcar se comportan molecularmente tan diferentes a la hora de usarlos como reactivos), c la concentración de la especie absorbente en moles por litro y l (longitud = 1cm), el espesor de la muestra absorbente en centímetros. La Ley de Beer-Lambert supone que la luz incidente es paralela y monocromática y que las moléculas del solvente y el soluto están orientadas al azar, de manera uniforme. La expresión log (Io / I) se denomina ABSORBANCIA y se designa por A. Es la base matemática que permite calcular cuánta energía puede haber sido absorbida por la sustancia que Página 5 de 9
6 se estudia. Es importante observar que cada milímetro de espesor de una solución absorbente en una cubeta óptica de 1.0 cm. (medida estándar de todas las cubetas que usaremos en nuestras prácticas de laboratorio) no absorbe una cantidad constante de la luz incidente. Sin embargo, con una capa absorbente de espesor constante (como será nuestro caso cada vez que hagamos uso del procedimiento fotométrico), la absorbancia (A) es directamente proporcional a la concentración de la solución absorbente. El coeficiente de absorción molar varía tanto con la naturaleza del compuesto absorbente, como con las propiedades del solvente, la longitud de onda del rayo utilizado, el ph de la solución, y del estado de oxidorreducción de los componentes, los cuales pueden presentar pérdida o ganancia de protones o electrones al asociarse. Con el uso del Espectrofotómetro se pueden obtener los datos para elaborar una gráfica del espectro de absorción de cualquier sustancia, en la cual podemos comparar objetivamente las diferencias de cada sustancia en función de su coeficiente de absorción molar y de la longitud de onda del rayo empleado. Esta gráfica, que nos muestra la absorbancia a diferentes longitudes de onda, nos proporciona la información necesaria para saber cuál es la longitud de onda a la que absorbe más luz un compuesto en solución. Cuando necesitemos hacer un análisis de ese compuesto en especial, tendremos que ajustar nuestro fotómetro a la longitud de onda de máxima absorbancia, porque en esa calibración obtendremos las determinaciones más exactas ante cualquier variación de la concentración de las muestras que obtengamos, conteniendo ese compuesto. Los ordenamientos específicos de los átomos o de las moléculas, poseen espectros de absorción característicos y por eso pueden utilizarse para identificar moléculas y medir sus concentraciones. Debe tenerse algún cuidado al hacer uso de la ley de Beer, pues esta no toma en cuenta la luz dispersada o reflejada y no se cumple para altas concentraciones del material absorbente. La base de la Colorimetría y de la Espectrofotometría, radica en que muchas sustancias tienen color propio o pueden dar lugar a productos finales coloreados en ciertas reacciones químicas. Hay una relación directa entre la intensidad de este color y la concentración del producto final o sea la concentración de uno o varios de los reactivos. De esta manera, la intensidad del color puede utilizarse para medir la concentración. (4) CÁLCULO DE LA CONCENTRACIÓN DE COMPUESTOS: Cuando se desea determinar la concentración de un compuesto en una solución mediante el uso de un espectrofotómetro, en casi todas las Técnicas de laboratorio debe procederse a la preparación de tres tubos: Un tubo blanco, un tubo estándar, y un tubo muestra. TUBO BLANCO Contiene diluyente, estabilizadores químicos del ph, reactivos colorantes y todos los ingredientes que sean necesarios para esa Técnica, pero no debe contener la sustancia que se va a estudiar. El blanco sirve para hacer la calibración del espectrofotómetro, desechando la absorbancia de todos los componentes diferentes de la sustancia de estudio, lo cual se logra haciendo que en presencia de esta cubeta óptica en el recipiente respectivo del fotómetro, ajustemos la absorbancia de la pantalla en cero. De tal forma estas mismas sustancias en los otros tubos ya no interferirán en las próximas lecturas de absorbancia. Página 6 de 9
7 TUBO ESTÁNDAR Contiene lo mismo que el blanco, y se le agrega la sustancia de estudio a una concentración conocida. Se prepara en el laboratorio y sirve para comparar su absorbancia (que será función de su concentración conocida) con la absorbancia de la muestra. Define una sorbancia patrón dependiente de su concentración, con la que se harán operaciones matemáticas para encontrar la absorbancia de la(s) muestra(s). TUBO MUESTRA Contiene lo mismo que el blanco, pero no sabemos cuánto contiene de la sustancia que estamos estudiando. Se prepara a partir de fluidos biológicos (sangre, líquido cefalorraquídeo, orina u otro). La fórmula para calcular la CONCENTRACIÓN de la sustancia en la solución será la siguiente: Concentración sorbancia Concentración Del Estándar x de la Muestra De la = Muestra sorbancia del Estándar reviadamente se escribe: [M] = [S] x -M / -S EQUIPO Y REACTIVOS: Solución de Azul de Bromofenol. 3 cubetas ópticas. 2 pipetas de 5 ml. 1 tubo de ensayo. 1 Gradilla. 1 espectrofotómetro. PROCEDIMIENTO: 1) Rotule las cubetas ópticas con B (blanco), E (estándar) y M (muestra). 2) Prepare el blanco ( B ) con 3ml de agua destilada (sólo esta vez será agua). 3) Prepare el estándar ( E ) con 3ml de la preparación de azul de bromofenol constituida por una solución de 20mg de azul de bromofenol en 100ml de agua destilada, elaborado previamente por el personal del laboratorio. 4) Identifique las diferentes partes del Espectrofotómetro y aprenda a utilizarlo eficientemente. Usaremos un ESPECTROFOTOMETRO GENESYS TM 20 y podremos ejecutar mediciones de absorbancia y transmitancia, así como cálculos de concentraciones usando un estándar conocido o un factor de conversión. Página 7 de 9
8 5) Por favor tome en cuenta las siguientes recomendaciones: a. Encienda el aparato hasta que falten entre 5 a 10 minutos para hacer las lecturas fotométricas para lograr que la sobrevida de la lámpara especial del aparato (que viene especificada para llegar aproximadamente a 1000 horas), pueda prolongarse. b. Asegúrese de cerrar la tapa del compartimiento de muestras antes de hacer sus anotaciones de lecturas de absorbancia, porque si llega luz ambiental a la fotocelda, hay interferencias que alteran las lecturas. c. No ponga objetos alrededor del aparato, que puedan bloquear las entradas de ventilación: el recalentamiento daña los mecanismos y acorta la vida de la lámpara. d. Asegúrese de alinear las superficies de lectura de las cubetas ópticas en forma perpendicular a la fuente de luz, para evitar sesgos en el aprovechamiento de la energía luminosa. e. No debe usar los botones utility / print para no modificar los ajustes internos del aparato. 6) Seleccione el modo A porque en todas las prácticas haremos cálculos de Concentración con la misma fórmula. 7) Ajuste la longitud de onda. Para el propósito de nuestra práctica, haremos varios ajustes, para encontrar el espectro de absorción. En las próximas prácticas, la cifra de longitud de onda necesaria, vendrá definida en el procedimiento de cada práctica. 8) Ajustar la absorbancia en cero con el blanco, preparado esta vez sólo con agua. 9) Determinar la absorbancia del tubo estándar. 10) Sólo en esta ocasión obtendremos el Espectro de absorción de una solución de Azul de bromofenol usando las longitudes de onda 400 nm, 420 nm, 460 nm, 500 nm, 540 nm, 580 nm, 600 nm, 620 nm, 660 nm y 700 nm. Defina en cuál ocurre la máxima absorbancia y explique su utilidad. Utilice la gráfica en blanco del siguiente espacio. 11) Para poner en práctica el uso de la Fórmula para calcular la Concentración, a manera de ejemplo, tendrá que preparar una muestra poniendo 3 ml de la solución estándar anterior en un tubo de ensayo, al cual le agregará 3 ml de agua destilada. 12) Con esta nueva solución (dilución a la mitad del estándar) debe preparar la cubeta óptica de la muestra, leer su absorbancia siguiendo el procedimiento anterior y aplicar la fórmula para encontrar su concentración. 13) Con los resultados anteriores explique la correlación entre las diferencias de la concentración y los conceptos teóricos de la LEY DE BEER. Página 8 de 9
9 Gráfica del Espectro de sorción del Azul de Bromofenol En base a lo anterior discuta y analice lo siguiente: Si uso del pigmento azul de bromofenol Será necesario usar energía de acuerdo a su capacidad de absorción o dará lo mismo usar cualquier rango de longitud de onda? Si usamos luz azul o amarilla o verde, tendrá la misma absorción? En qué longitud de onda espera encontrar su mínima y su máxima absorbancia? Cuando el fotómetro esté listo, En qué calibración se podrá lograr mayor precisión al momento de medir muestras con diferente concentración de la sustancia azul de bromofenol? BIBLIOGRAFÍA: 1. Rex Montgomery, Thomas W. Conway, Arthur A. Spector y David Chappell: Bioquímica. 6ª. Edición. Edit. Harcourt Brace de España, S. A Lehninger A. L. Bioquímica. 2ª. Ed. Ediciones Omega, S. A. Barcelona Robert K. Murray, Meter A. Mayes, Daryl K. Granner, Victor Rodwell. Bioquímica, de Harper. 16 y 17 Edición. Editorial El Manual Moderno Strother G. K. Física aplicada a las ciencias de la Salud. McGraw-Hill Latinoamericana, S. A. Bogotá Colombia, Thermo Spectronic Genesys 20 Spectrophotometer Operator s Manual. Rochester, N.Y. U.S.A Bioquímica 3ª. Ed, Mathews, C. K., et. Al, Pearson Educación, S. A. Madrid, Conclusión: NOTAS IMPORTANTES HEPS/HEPS. Página 9 de 9
INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA
 INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA Objetivos Al finalizar el trabajo práctico los estudiantes estarán en capacidad de: - Conocer el principio que rige la espectrofotometría. - Interpretar el basamento
INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA Objetivos Al finalizar el trabajo práctico los estudiantes estarán en capacidad de: - Conocer el principio que rige la espectrofotometría. - Interpretar el basamento
PRACTICO N 1: ESPECTROFOTOMETRIA
 UNIVERSIDAD MAYOR FACULTAD DE MEDICINA ESCUELA DE TECNOLOGIA MEDICA BIOQUIMICA PRACTICO N 1: ESPECTROFOTOMETRIA 1.- INTRODUCCIÓN Utilizando términos quizás excesivamente simplistas puede definirse la espectrofotometría
UNIVERSIDAD MAYOR FACULTAD DE MEDICINA ESCUELA DE TECNOLOGIA MEDICA BIOQUIMICA PRACTICO N 1: ESPECTROFOTOMETRIA 1.- INTRODUCCIÓN Utilizando términos quizás excesivamente simplistas puede definirse la espectrofotometría
Química Biológica TP 1: ESPECTROFOTOMETRIA.
 TP 1: ESPECTROFOTOMETRIA. Introducción Al observar una solución acuosa de un colorante a trasluz, observamos una leve coloración, la cual se debe a la interacción entre las moléculas del colorante y la
TP 1: ESPECTROFOTOMETRIA. Introducción Al observar una solución acuosa de un colorante a trasluz, observamos una leve coloración, la cual se debe a la interacción entre las moléculas del colorante y la
ESPECTROFOTOMETRIA. BASES FISICAS
 ESPECTROFOTOMETRIA. BASES FISICAS Radiación Electromagnética y su Interacción con la Materia El principio de funcionamiento de la espectrofotometría se basa en el empleo de las interacciones entre la radiación
ESPECTROFOTOMETRIA. BASES FISICAS Radiación Electromagnética y su Interacción con la Materia El principio de funcionamiento de la espectrofotometría se basa en el empleo de las interacciones entre la radiación
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA
 REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
UNIVERSIDAD TECNOLÓGICA METROPOLITANA INGENIERIA EN QUIMICA LABORATORIO ANALISIS INSTRUMENTAL. INFORME N 1: ESPECTROFOTOMETRÍA UV VISIBLE INTRODUCCION
 UNIVERSIDAD TECNOLÓGICA METROPOLITANA INGENIERIA EN QUIMICA LABORATORIO ANALISIS INSTRUMENTAL. INFORME N 1: ESPECTROFOTOMETRÍA UV VISIBLE INTRODUCCION En este laboratorio utilizaremos el método de la espectrofotometría
UNIVERSIDAD TECNOLÓGICA METROPOLITANA INGENIERIA EN QUIMICA LABORATORIO ANALISIS INSTRUMENTAL. INFORME N 1: ESPECTROFOTOMETRÍA UV VISIBLE INTRODUCCION En este laboratorio utilizaremos el método de la espectrofotometría
DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR
 DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR 1 OBJETIVOS 1) Obtener el pk del naranja de metilo 2) Obtener el espectro de absorción del naranja de metilo en disoluciones i de diferente ph.
DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR 1 OBJETIVOS 1) Obtener el pk del naranja de metilo 2) Obtener el espectro de absorción del naranja de metilo en disoluciones i de diferente ph.
BIOQUIMICA: PRÁCTICA DE LABORATORIO NO. 2 ESPECTROFOTOMETRÍA
 BIOQUIMICA: PRÁCTICA DE LABORATORIO NO. 2 ESPECTROFOTOMETRÍA Con el estudio y desarrollo de la presente práctica de laboratorio el estudiante adquiere el conocimiento y desarrolla la habilidad para utilizar
BIOQUIMICA: PRÁCTICA DE LABORATORIO NO. 2 ESPECTROFOTOMETRÍA Con el estudio y desarrollo de la presente práctica de laboratorio el estudiante adquiere el conocimiento y desarrolla la habilidad para utilizar
Experimento: Espectro de gases
 FACULTAD DE CIENCIAS FÍSICO - MATEMÁTICAS Experimento: Espectro de gases Equipo α-pulpo Alma Elena Piceno Martínez Luke Goodman Ernesto Benítez Rodríguez 2012 F Í S I C A M O D E R N A C O N L A B O R
FACULTAD DE CIENCIAS FÍSICO - MATEMÁTICAS Experimento: Espectro de gases Equipo α-pulpo Alma Elena Piceno Martínez Luke Goodman Ernesto Benítez Rodríguez 2012 F Í S I C A M O D E R N A C O N L A B O R
Departament de Químiques CURS TÈNIQUES INTEGRADES 2nCFGS
 IES CASTELL I DOMENECH Departament de Químiques CURS TÈNIQUES INTEGRADES 2nCFGS UD 5 NA 1: ESPECTROFOTOMETRÍA VISIBLE ULTRAVIOLETA. -Curs 2010-11- PROFESSOR: LUIS ALVAREZ RODRÍGUEZ 1 ESPECTROFOTOMETRÍA
IES CASTELL I DOMENECH Departament de Químiques CURS TÈNIQUES INTEGRADES 2nCFGS UD 5 NA 1: ESPECTROFOTOMETRÍA VISIBLE ULTRAVIOLETA. -Curs 2010-11- PROFESSOR: LUIS ALVAREZ RODRÍGUEZ 1 ESPECTROFOTOMETRÍA
FARMACOPEA MERCOSUR: MÉTODO GENERAL PARA ESPECTROFOTOMETRIA ULTRAVIOLETA Y VISIBLE
 MERCOSUL/XLIII SGT Nº 11/P.RES. Nº FARMACOPEA MERCOSUR: MÉTODO GENERAL PARA ESPECTROFOTOMETRIA ULTRAVIOLETA Y VISIBLE VISTO: El Tratado de Asunción, el Protocolo de Ouro Preto y las Resoluciones N 31/11
MERCOSUL/XLIII SGT Nº 11/P.RES. Nº FARMACOPEA MERCOSUR: MÉTODO GENERAL PARA ESPECTROFOTOMETRIA ULTRAVIOLETA Y VISIBLE VISTO: El Tratado de Asunción, el Protocolo de Ouro Preto y las Resoluciones N 31/11
CAPITULO I: La Luz CAPITULO I: LA LUZ 1
 CAPITULO I: La Luz CAPITULO I: LA LUZ 1 1.- La luz 1.1.- El nanómetro 1.2.- El espectro visible 1.3.- Naturaleza de la luz 1.4.- Fuentes de luz 2.- La Materia y la luz 2.1.- Fórmula R.A.T. 22-2.2. Absorción
CAPITULO I: La Luz CAPITULO I: LA LUZ 1 1.- La luz 1.1.- El nanómetro 1.2.- El espectro visible 1.3.- Naturaleza de la luz 1.4.- Fuentes de luz 2.- La Materia y la luz 2.1.- Fórmula R.A.T. 22-2.2. Absorción
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
ESTRUCTURA DEL SEMINARIO:
 ESTRUCTURA DEL SEMINARIO: S1.1. Introducción a la espectrofotometría 1 S1.2. Radiación electromagnética 1 S1.3. Espectroscopía ultravioleta/visible 2 S1.4. Colorimetría 5 S1.1. Introducción a la espectrofotometría
ESTRUCTURA DEL SEMINARIO: S1.1. Introducción a la espectrofotometría 1 S1.2. Radiación electromagnética 1 S1.3. Espectroscopía ultravioleta/visible 2 S1.4. Colorimetría 5 S1.1. Introducción a la espectrofotometría
QUÍMICA FÍSICA BIOLÓGICA - QUIMICA FISICA I TRABAJO PRACTICO N 3
 QUÍMICA FÍSICA BIOLÓGICA - QUIMICA FISICA I TRABAJO PRACTICO N 3 TEMA: EQUILIBRIO QUÍMICO. OBJETO: Determinación de la constante de equilibrio de disociación del rojo de metilo (indicador visual ácido-base)
QUÍMICA FÍSICA BIOLÓGICA - QUIMICA FISICA I TRABAJO PRACTICO N 3 TEMA: EQUILIBRIO QUÍMICO. OBJETO: Determinación de la constante de equilibrio de disociación del rojo de metilo (indicador visual ácido-base)
TÉCNICAS BASADAS EN LA ABSORCIÓN DE RADIACIÓN
 TÉCNICAS BASADAS EN LA ABSORCIÓN DE RADIACIÓN Absorción de radiación y concentración. Ley de Beer. La espectroscopia de absorción molecular se basa en la medida de la transmitancia T o de la absorbancia
TÉCNICAS BASADAS EN LA ABSORCIÓN DE RADIACIÓN Absorción de radiación y concentración. Ley de Beer. La espectroscopia de absorción molecular se basa en la medida de la transmitancia T o de la absorbancia
Slide 1 / 52. Las Ondas Electromagnéticas Problemas de Práctica
 Slide 1 / 52 Las Ondas Electromagnéticas Problemas de Práctica Slide 2 / 52 Multiopcion Slide 3 / 52 1 Cuál de las siguientes teorías puede explicar la curvatura de las ondas detrás de los obstáculos en
Slide 1 / 52 Las Ondas Electromagnéticas Problemas de Práctica Slide 2 / 52 Multiopcion Slide 3 / 52 1 Cuál de las siguientes teorías puede explicar la curvatura de las ondas detrás de los obstáculos en
TRABAJO PRÁCTICO N 14 ESPECTROMETRÍA REDES DE DIFRACCIÓN
 TRABAJO PRÁCTICO N 14 Introducción La luz blanca ordinaria (luz del sol, luz de lámparas incandescentes, etc.) es una superposición de ondas cuyas longitudes de onda cubren, en forma continua, todo el
TRABAJO PRÁCTICO N 14 Introducción La luz blanca ordinaria (luz del sol, luz de lámparas incandescentes, etc.) es una superposición de ondas cuyas longitudes de onda cubren, en forma continua, todo el
ESTUDIOS DE LOS ESPECTROS DE ABSORCION IDENTIFICACION Y DETERMINACION CUANTITATIVA DE SUSTANCIAS, EN PPM
 1. INTRODUCCION Por medio del estudio de los espectros de absorción de una sustancia así como la realización de una curva de Absorbancia en función de la concentración, se puede determinar cuantitativamente
1. INTRODUCCION Por medio del estudio de los espectros de absorción de una sustancia así como la realización de una curva de Absorbancia en función de la concentración, se puede determinar cuantitativamente
Química Biológica I TP 1: ESPECTROFOTOMETRIA
 Química Biológica I TP 1: ESPECTROFOTOMETRIA OBJETIVOS: - Reforzar el aprendizaje del uso del espectrofotómetro. - Realizar espectro de absorción de sustancias puras: soluciones de dicromato de potasio.
Química Biológica I TP 1: ESPECTROFOTOMETRIA OBJETIVOS: - Reforzar el aprendizaje del uso del espectrofotómetro. - Realizar espectro de absorción de sustancias puras: soluciones de dicromato de potasio.
Problemas de Ondas Electromagnéticas
 Problemas de Ondas Electromagnéticas AP Física B de PSI Nombre Multiopción 1. Cuál de las siguientes teorías puede explicar la curvatura de las ondas detrás de los obstáculos en la "región de sombra"?
Problemas de Ondas Electromagnéticas AP Física B de PSI Nombre Multiopción 1. Cuál de las siguientes teorías puede explicar la curvatura de las ondas detrás de los obstáculos en la "región de sombra"?
EL ESPECTRO ELECTROMAGNÉTICO
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
Bioquímica Médica I. Jorge Contreras Pineda. Práctica: Espectrofotometría GENERALIDADES:
 Bioquímica Médica I Jorge Contreras Pineda Práctica: Espectrofotometría GENERALIDADES: Un espectrofotómetro o colorímetro hace uso de la transmisión de la luz a través de una solución para determinar la
Bioquímica Médica I Jorge Contreras Pineda Práctica: Espectrofotometría GENERALIDADES: Un espectrofotómetro o colorímetro hace uso de la transmisión de la luz a través de una solución para determinar la
Espectroscopía de Absorción Molecular
 Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Constante de equilibrio de un ácido débil (Indicador visual)
 Constante de equilibrio de un ácido débil (dicador visual) Laboratorio Química Física I QUIM 4051 Ileana Nieves Martínez agosto 2014 1 Propósito Determinar la constante de equilibrio de la disociación
Constante de equilibrio de un ácido débil (dicador visual) Laboratorio Química Física I QUIM 4051 Ileana Nieves Martínez agosto 2014 1 Propósito Determinar la constante de equilibrio de la disociación
PRÁCTICA 9 CINÉTICA FOTOQUÍMICA 1.- FUNDAMENTO TEÓRICO. Radiación Electromagnética
 PRÁCTICA 9 CINÉTICA FOTOQUÍMICA 1.- FUNDAMENTO TEÓRICO Radiación Electromagnética Las ondas de radio, la radiación de microondas, los infrarrojos, la luz visible, la radiación ultravioleta, los rayos X
PRÁCTICA 9 CINÉTICA FOTOQUÍMICA 1.- FUNDAMENTO TEÓRICO Radiación Electromagnética Las ondas de radio, la radiación de microondas, los infrarrojos, la luz visible, la radiación ultravioleta, los rayos X
DETERMINACIÓN CUANTITATIVA DE PROTEINAS
 DETERMIAIÓ UATITATIVA DE PRTEIAS bjetivos: Al finalizar este trabajo práctico los alumnos estarán en capacidad de: - onocer el principio que rige la espectrofotometría. - Interpretar el basamento químico
DETERMIAIÓ UATITATIVA DE PRTEIAS bjetivos: Al finalizar este trabajo práctico los alumnos estarán en capacidad de: - onocer el principio que rige la espectrofotometría. - Interpretar el basamento químico
Dpto. de Física y Química. IES N. Salmerón A. Ondas 6.2 ( )
 CUESTIONES 1. (2004) a) Por qué la profundidad real de una piscina llena de agua es siempre mayor que la profundidad aparente? b) Explique qué es el ángulo límite y bajo qué condiciones puede observarse.
CUESTIONES 1. (2004) a) Por qué la profundidad real de una piscina llena de agua es siempre mayor que la profundidad aparente? b) Explique qué es el ángulo límite y bajo qué condiciones puede observarse.
ÓPTICA FÍSICA. (luz) Física 2º bachillerato Óptica física (luz) 1
 ÓPTICA FÍSICA (luz) 1. Ondas electromagnéticas. 2. Espectro electromagnético 3. Naturaleza de la luz. 4. Propagación de la luz. 5. Fenómenos ondulatorios. 6. Fenómenos corpusculares. Física 2º bachillerato
ÓPTICA FÍSICA (luz) 1. Ondas electromagnéticas. 2. Espectro electromagnético 3. Naturaleza de la luz. 4. Propagación de la luz. 5. Fenómenos ondulatorios. 6. Fenómenos corpusculares. Física 2º bachillerato
DESARROLLO. La frecuencia tiene una relación inversa con el concepto de longitud de onda, a mayor frecuencia menor
 CONSIGNAS TP1 Teoría de la luz Desarrollar una investigación teniendo como base el origen de la luz como fenómeno físico y su comportamiento. Dicho trabajo práctico requiere rigor en los datos técnicos
CONSIGNAS TP1 Teoría de la luz Desarrollar una investigación teniendo como base el origen de la luz como fenómeno físico y su comportamiento. Dicho trabajo práctico requiere rigor en los datos técnicos
DETERMINACIÓN COLORIMÉTRICA DEL HIERRO
 DETERMINACIÓN COLORIMÉTRICA DEL HIERRO OBJETIVO Familiarizarse con los principios del análisis colorimétrico. INTRODUCCIÓN La base para lo que los químicos llaman análisis colorimétrico es la variación
DETERMINACIÓN COLORIMÉTRICA DEL HIERRO OBJETIVO Familiarizarse con los principios del análisis colorimétrico. INTRODUCCIÓN La base para lo que los químicos llaman análisis colorimétrico es la variación
Preguntas del capítulo Ondas electromagnéticas
 Preguntas del capítulo Ondas electromagnéticas 1. Isaac Newton fue uno de los primeros físicos en estudiar la luz. Qué propiedades de la luz explicó usando el modelo de partícula? 2. Quién fue la primer
Preguntas del capítulo Ondas electromagnéticas 1. Isaac Newton fue uno de los primeros físicos en estudiar la luz. Qué propiedades de la luz explicó usando el modelo de partícula? 2. Quién fue la primer
ESPECTROSCOPIA DE FLUORESCENCIA, FOSFORESCENCIA Y QUIMIOLUMINISCENCIA MOLECULAR Q.F. ALEX SILVA ARAUJO
 FOSFORESCENCIA Y QUIMIOLUMINISCENCIA Q.F. ALEX SILVA ARAUJO GENERALIDADES Aquí se considerarán tres tipos de métodos ópticos relacionados entre sí: fluorescencia, fosforescencia y quimioluminiscencia.
FOSFORESCENCIA Y QUIMIOLUMINISCENCIA Q.F. ALEX SILVA ARAUJO GENERALIDADES Aquí se considerarán tres tipos de métodos ópticos relacionados entre sí: fluorescencia, fosforescencia y quimioluminiscencia.
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. Grupo: Equipo: Fecha: Nombre(s):
 CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA Laboratorio de equilibrio y cinética Grupo: Equipo: Fecha: Nombre(s): I. OBJETIVO GENERAL Conocer y aplicar los fundamentos
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA Laboratorio de equilibrio y cinética Grupo: Equipo: Fecha: Nombre(s): I. OBJETIVO GENERAL Conocer y aplicar los fundamentos
Ejercicio 1. Ejercicio 2. Ejercicio 3.
 Ejercicio 1. Suponiendo que la antena de una espacio de radio de 10 [kw] radia ondas electromagnéticas esféricas. Calcular el campo eléctrico máximo a 5 [km] de la antena. Ejercicio 2. La gente realiza
Ejercicio 1. Suponiendo que la antena de una espacio de radio de 10 [kw] radia ondas electromagnéticas esféricas. Calcular el campo eléctrico máximo a 5 [km] de la antena. Ejercicio 2. La gente realiza
Problemas de Óptica I. Óptica física 2º de bachillerato. Física
 Problemas de Óptica I. Óptica física 2º de bachillerato. Física 1. Calcular la energía de un fotón de luz amarilla de longitud de onda igual a 5,8.10 3 A. Solución: 3,43.10-19 J. 2. Una de las frecuencias
Problemas de Óptica I. Óptica física 2º de bachillerato. Física 1. Calcular la energía de un fotón de luz amarilla de longitud de onda igual a 5,8.10 3 A. Solución: 3,43.10-19 J. 2. Una de las frecuencias
PRÁCTICA 7 INSTRUMENTACIÓN BÁSICA EN QUÍMICA
 PRÁCTICA 7 INSTRUMENTACIÓN BÁSICA EN QUÍMICA OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con la instrumentación básica utilizada en química, haciendo especial hincapié en la
PRÁCTICA 7 INSTRUMENTACIÓN BÁSICA EN QUÍMICA OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con la instrumentación básica utilizada en química, haciendo especial hincapié en la
Objetivo EL PROCESO DE FOTOSÍNTESIS. Las plantas. Fotosíntesis Conocer características particulares del proceso de fotosíntesis.
 EL PROCESO DE FOTOSÍNTESIS Objetivo Conocer características particulares del proceso de fotosíntesis. Comprender la importancia de los pigmentos en el proceso. Relacionar los conceptos eucariontes, seres
EL PROCESO DE FOTOSÍNTESIS Objetivo Conocer características particulares del proceso de fotosíntesis. Comprender la importancia de los pigmentos en el proceso. Relacionar los conceptos eucariontes, seres
INTRODUCCION A LA ESPECTROSCOPIA DE ABSORCION MOLECULAR UV/VIS Y DE INFRARROJO CERCANO. Cap. 13
 INTRODUCCION A LA ESPECTROSCOPIA DE ABSORCION MOLECULAR UV/VIS Y DE INFRARROJO CERCANO Cap. 13 Medición de la absorbancia y la transmitancia Recipiente produce pérdidas por: reflexión (aire/pared, pared/solución)
INTRODUCCION A LA ESPECTROSCOPIA DE ABSORCION MOLECULAR UV/VIS Y DE INFRARROJO CERCANO Cap. 13 Medición de la absorbancia y la transmitancia Recipiente produce pérdidas por: reflexión (aire/pared, pared/solución)
Problema Interferencia de N ranuras.
 Problema 9. 4. Interferencia de N ranuras. Considere un obstáculo con tres ranuras separadas por una distancia d e iluminado con una onda plana de longitud de onda λ. Emplee el método de los fasores para
Problema 9. 4. Interferencia de N ranuras. Considere un obstáculo con tres ranuras separadas por una distancia d e iluminado con una onda plana de longitud de onda λ. Emplee el método de los fasores para
ESPECTROFOTOMETRÍA. 1. Naturaleza de la radiación electromagnética: 1 nm = 10-9 m
 ESPECTROFOTOMETRÍA 1. Naturaleza de la radiación electromagnética: La radiación electromagnética es una forma de energía radiante. Tiene propiedades ondulatorias, propagándose en forma de ondas. En este
ESPECTROFOTOMETRÍA 1. Naturaleza de la radiación electromagnética: La radiación electromagnética es una forma de energía radiante. Tiene propiedades ondulatorias, propagándose en forma de ondas. En este
ESPECTROSCOPIA UV-VISIBLE
 ESPECTROSCOPIA UV-VISIBLE FUNDAMENTOS INSTRUMENTACION FUNCIONAMIENTO APLICACIONES FUNDAMENTOS La espectroscopia UV-Vis está basada en el proceso de absorción de la radiación ultravioleta-visible (radiación
ESPECTROSCOPIA UV-VISIBLE FUNDAMENTOS INSTRUMENTACION FUNCIONAMIENTO APLICACIONES FUNDAMENTOS La espectroscopia UV-Vis está basada en el proceso de absorción de la radiación ultravioleta-visible (radiación
PRÁCTICA DE LABORATORIO DE QUÍMICA ANÁLISIS POR ESPECTROFOTOMETRÍA DE ABSORCIÓN
 PRÁCTICA DE LABORATORIO DE QUÍMICA ANÁLISIS POR ESPECTROFOTOMETRÍA DE ABSORCIÓN 1. OBJETIVOS. Conocer y aplicar la ley de Lambert - Beer Determinar la concentración de una solución por espectrofotometría.
PRÁCTICA DE LABORATORIO DE QUÍMICA ANÁLISIS POR ESPECTROFOTOMETRÍA DE ABSORCIÓN 1. OBJETIVOS. Conocer y aplicar la ley de Lambert - Beer Determinar la concentración de una solución por espectrofotometría.
15/03/2010. Espectrofotometría INTRODUCCIÓN
 Espectrofotometría Daniel Olave Tecnología Médica 2007 INTRODUCCIÓN Espectrofotometría Es la medida de la cantidad de energía radiante absorbida por las moléculas a longitudes de onda específicas. La espectrofotometría
Espectrofotometría Daniel Olave Tecnología Médica 2007 INTRODUCCIÓN Espectrofotometría Es la medida de la cantidad de energía radiante absorbida por las moléculas a longitudes de onda específicas. La espectrofotometría
Teoría de la luz y el color
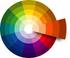 Teoría de la luz y el color La luz es una radiación electromagnética. El espectro electromagnético incluye desde los rayos gamma hasta las ondas de radio. La luz visible está formada por vibraciones electromagnéticas
Teoría de la luz y el color La luz es una radiación electromagnética. El espectro electromagnético incluye desde los rayos gamma hasta las ondas de radio. La luz visible está formada por vibraciones electromagnéticas
Espectroscopia de absorción visible-ultravioleta
 Práctica 6 Espectroscopia de absorción visible-ultravioleta Objetivo Parte A.- Comprobación de la Ley de Beer-Lambert y determinación del coeficiente de absorción molar para disoluciones acuosas de NiSO
Práctica 6 Espectroscopia de absorción visible-ultravioleta Objetivo Parte A.- Comprobación de la Ley de Beer-Lambert y determinación del coeficiente de absorción molar para disoluciones acuosas de NiSO
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS II TÉRMINO PRIMERA EVALUACIÓN DE FÍSICA D.
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS II TÉRMINO 2011-2012 PRIMERA EVALUACIÓN DE FÍSICA D Nombre: Paralelo: PRIMERA PARTE: Ejercicios de opción múltiple (2 puntos c/u)
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS II TÉRMINO 2011-2012 PRIMERA EVALUACIÓN DE FÍSICA D Nombre: Paralelo: PRIMERA PARTE: Ejercicios de opción múltiple (2 puntos c/u)
FOTOSÍNTESIS. Objetivo: reconocer a la fotosíntesis como un proceso anabólico donde participan particulares componentes.
 FOTOSÍNTESIS Objetivo: reconocer a la fotosíntesis como un proceso anabólico donde participan particulares componentes. introducción De la energía solar que alcanza la superficie de la tierra, un 1% es
FOTOSÍNTESIS Objetivo: reconocer a la fotosíntesis como un proceso anabólico donde participan particulares componentes. introducción De la energía solar que alcanza la superficie de la tierra, un 1% es
El Color. Javiera Arenas Z. Diseño Gráfico.
 El Color Javiera Arenas Z. Diseño Gráfico. Que es el color? El color es una percepción visual que se genera en el cerebro al interpretar las señales nerviosas que le envían los foto receptores de la retina
El Color Javiera Arenas Z. Diseño Gráfico. Que es el color? El color es una percepción visual que se genera en el cerebro al interpretar las señales nerviosas que le envían los foto receptores de la retina
ANÁLISIS CUANTITATIVO DE LA ABSORCIÓN DE RADIACIÓN ELECTROMAGNÉTICA
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 3 LECTURA N 5 ANÁLISIS CUANTITATIVO DE LA ABSORCIÓN DE RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL,
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 3 LECTURA N 5 ANÁLISIS CUANTITATIVO DE LA ABSORCIÓN DE RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL,
MÉTODOS ESPECTROMÉTRICOS DE ANÁLISIS
 MÉTODOS ESPECTROMÉTRICOS DE ANÁLISIS Introducción: Además de las volumetrías y gravimetrías estudiadas, el químico analítico posee otros métodos de análisis que se basan, en general, en las propiedades
MÉTODOS ESPECTROMÉTRICOS DE ANÁLISIS Introducción: Además de las volumetrías y gravimetrías estudiadas, el químico analítico posee otros métodos de análisis que se basan, en general, en las propiedades
Índice. 1. Qué es la luz? Pág.2
 Página1 TP1 Teoría de la luz Desarrollar una investigación teniendo como base el origen de la luz como fenómeno físico y su comportamiento. Dicho trabajo práctico requiere rigor en los datos técnicos recabados
Página1 TP1 Teoría de la luz Desarrollar una investigación teniendo como base el origen de la luz como fenómeno físico y su comportamiento. Dicho trabajo práctico requiere rigor en los datos técnicos recabados
B Fig. 2. Ley de Lambert
 INTRODUCCION TEORICA FUNDAMENTOS DE ESPECTROFOTOMETRÍA Introducción : La espectrofotometría es uno de los métodos de análisis más usados, y se basa en la relación que existe entre la absorción de luz por
INTRODUCCION TEORICA FUNDAMENTOS DE ESPECTROFOTOMETRÍA Introducción : La espectrofotometría es uno de los métodos de análisis más usados, y se basa en la relación que existe entre la absorción de luz por
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS II TÉRMINO SEGUNDA EVALUACIÓN DE FÍSICA D.
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS II TÉRMINO 2011-2012 SEGUNDA EVALUACIÓN DE FÍSICA D Nombre: Paralelo: PRIMERA PARTE: Ejercicios de opción múltiple (2 puntos c/u)
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS II TÉRMINO 2011-2012 SEGUNDA EVALUACIÓN DE FÍSICA D Nombre: Paralelo: PRIMERA PARTE: Ejercicios de opción múltiple (2 puntos c/u)
22. DETERMINACIÓN DE ÍNDICES DE REFRACCIÓN
 22. DETERMINACIÓN DE ÍNDICES DE REFRACCIÓN OBJETIVOS Determinación del índice de refracción de un cuerpo semicircular, así como del ángulo límite. Observación de la dispersión cromática. Determinación
22. DETERMINACIÓN DE ÍNDICES DE REFRACCIÓN OBJETIVOS Determinación del índice de refracción de un cuerpo semicircular, así como del ángulo límite. Observación de la dispersión cromática. Determinación
22. DETERMINACIÓN DE ÍNDICES DE REFRACCIÓN
 22. DETERMINACIÓN DE ÍNDICES DE REFRACCIÓN OBJETIVOS Determinación del índice de refracción de un cuerpo semicircular, así como del ángulo límite. Observación de la dispersión cromática. Determinación
22. DETERMINACIÓN DE ÍNDICES DE REFRACCIÓN OBJETIVOS Determinación del índice de refracción de un cuerpo semicircular, así como del ángulo límite. Observación de la dispersión cromática. Determinación
DETERMINACIONES ESPECTROFOTOMETRICAS EN ALIMENTOS. Carotenoides totales y nitritos.
 1 PRACTICA Nº 5 DETERMINACIONES ESPECTROFOTOMETRICAS EN ALIMENTOS. Carotenoides totales y nitritos. I. INTRODUCCIÓN: En espectrofotometría se usa como fuente luminosa la luz blanca natural o artificial
1 PRACTICA Nº 5 DETERMINACIONES ESPECTROFOTOMETRICAS EN ALIMENTOS. Carotenoides totales y nitritos. I. INTRODUCCIÓN: En espectrofotometría se usa como fuente luminosa la luz blanca natural o artificial
La formación de la visión humana del color
 COLOR DEFINICIÓN El color es una percepción visual que se genera en el cerebro al interpretar las señales nerviosas que le envían los foto receptores de la retina del ojo y que a su vez interpretan y distinguen
COLOR DEFINICIÓN El color es una percepción visual que se genera en el cerebro al interpretar las señales nerviosas que le envían los foto receptores de la retina del ojo y que a su vez interpretan y distinguen
Laboratorio 10. Constante de disociación ácida de un tinte
 Objetivo Laboratorio 10. Constante de disociación ácida de un tinte Determinar la constante de equilibrio de la disociación de un indicador visual ácido-base (rojo de metilo) utilizando medidas espectrofotométricas.
Objetivo Laboratorio 10. Constante de disociación ácida de un tinte Determinar la constante de equilibrio de la disociación de un indicador visual ácido-base (rojo de metilo) utilizando medidas espectrofotométricas.
COLORIMETRÍA: ANÁLISIS ESPECTROFOTOMÉTRICO DE LA RIBOFLAVINA
 COLORIMETRÍA: ANÁLISIS ESPECTROFOTOMÉTRICO DE LA RIBOFLAVINA INTRODUCCION La colorimetría es una de las técnicas empleadas con mayor asiduidad en los laboratorios de Bioquímica. Esta técnica suministra
COLORIMETRÍA: ANÁLISIS ESPECTROFOTOMÉTRICO DE LA RIBOFLAVINA INTRODUCCION La colorimetría es una de las técnicas empleadas con mayor asiduidad en los laboratorios de Bioquímica. Esta técnica suministra
TEMA 3: Interacción de la radiación solar con la superficie de la Tierra y la atmósfera
 TEMA 3: Interacción de la radiación solar con la superficie de la Tierra y la atmósfera Objetivo Entender por qué la Tierra tiene un temperatura promedio global moderada que permite su habitabilidad, y
TEMA 3: Interacción de la radiación solar con la superficie de la Tierra y la atmósfera Objetivo Entender por qué la Tierra tiene un temperatura promedio global moderada que permite su habitabilidad, y
Se tiene para tener una idea el siguiente cuadro de colores perceptibles por el ojo humano dependiendo de la longitud de onda.
 La luz es una forma de energía la cual llega a nuestros ojos y nos permite ver, es un pequeño conjunto de radiaciones electromagnéticas de longitudes de onda comprendidas entre los 380 nm y los 770 nm.(nm
La luz es una forma de energía la cual llega a nuestros ojos y nos permite ver, es un pequeño conjunto de radiaciones electromagnéticas de longitudes de onda comprendidas entre los 380 nm y los 770 nm.(nm
Ejercicios Física PAU Comunidad de Madrid Enunciados Revisado 24 septiembre 2013.
 2013-Septiembre B. Pregunta 3.- Se tiene un prisma rectangular de vidrio de indice de refracción 1,48. Del centro de su cara A se emite un rayo que forma un ánguto α con el eje vertical del prisma, como
2013-Septiembre B. Pregunta 3.- Se tiene un prisma rectangular de vidrio de indice de refracción 1,48. Del centro de su cara A se emite un rayo que forma un ánguto α con el eje vertical del prisma, como
MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA
 MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA y EL VISIBLE La espectroscopia de absorción molecular en el ultravioleta y visible se emplea en el análisis cuantitativo y es
MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA y EL VISIBLE La espectroscopia de absorción molecular en el ultravioleta y visible se emplea en el análisis cuantitativo y es
LABORATORIO DE FÍSICA 2 - E.T.S.E.T.-CURSO 2004/2005 PRÁCTICA 4 MICROONDAS
 MICROONDAS Libro de texto: Francis W. Sears, Mark W. Zemansky, et al., Física Universitaria, Tomo 2, 11ª edición, Pearson Educación, Mexico (2004), Capítulos: 32-6 El espectro electromagnético (páginas
MICROONDAS Libro de texto: Francis W. Sears, Mark W. Zemansky, et al., Física Universitaria, Tomo 2, 11ª edición, Pearson Educación, Mexico (2004), Capítulos: 32-6 El espectro electromagnético (páginas
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS
 REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de ADN. Conocer el manejo de micropipetas y espectrofotómetros. Espectrofotometría Es la
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de ADN. Conocer el manejo de micropipetas y espectrofotómetros. Espectrofotometría Es la
Las Ondas y la Luz. Las Ondas
 Las Ondas Una onda consiste en la propagación de una perturbación física en un medio que puede ser material (aire, agua, tierra, etc) o inmaterial (vacío), según la cual existe transporte de energía, pero
Las Ondas Una onda consiste en la propagación de una perturbación física en un medio que puede ser material (aire, agua, tierra, etc) o inmaterial (vacío), según la cual existe transporte de energía, pero
ONDAS PARA COMPLETAR VUESTROS APUNTES DEL LIBRO
 ONDAS PARA COMPLETAR VUESTROS APUNTES DEL LIBRO ONDAS Una onda es una perturbación que se propaga. Con la palabra perturbación se quiere indicar cualquier tipo de alteración del medio: una ondulación en
ONDAS PARA COMPLETAR VUESTROS APUNTES DEL LIBRO ONDAS Una onda es una perturbación que se propaga. Con la palabra perturbación se quiere indicar cualquier tipo de alteración del medio: una ondulación en
FÍSICA MODERNA. a) Explique las transformaciones energéticas en el proceso de fotoemisión y calcule la
 FÍSICA MODERNA 2001 1. Un haz de luz de longitud de onda 546 10-9 m incide en una célula fotoeléctrica de cátodo de cesio, cuyo trabajo de extracción es de 2 ev: a) Explique las transformaciones energéticas
FÍSICA MODERNA 2001 1. Un haz de luz de longitud de onda 546 10-9 m incide en una célula fotoeléctrica de cátodo de cesio, cuyo trabajo de extracción es de 2 ev: a) Explique las transformaciones energéticas
Qué es el espectro cromático
 Qué es el espectro cromático La concepción moderna del color nació con el descubrimiento de la naturaleza espectral de la luz que hizo Isaac Newton en el siglo XVII. Newton creía que la luz era un flujo
Qué es el espectro cromático La concepción moderna del color nació con el descubrimiento de la naturaleza espectral de la luz que hizo Isaac Newton en el siglo XVII. Newton creía que la luz era un flujo
Laboratorio 1. Efecto fotoeléctrico
 Laboratorio 1 Efecto fotoeléctrico 1.1 Objetivos 1. Determinar la constante de Planck h 2. Determinar la dependencia del potencial de frenado respecto de la intensidad de la radiación incidente. 1.2 Preinforme
Laboratorio 1 Efecto fotoeléctrico 1.1 Objetivos 1. Determinar la constante de Planck h 2. Determinar la dependencia del potencial de frenado respecto de la intensidad de la radiación incidente. 1.2 Preinforme
TRONCO COMUN DIVISIONAL DE CIENCIAS BIOLOGICAS Y DE LA SALUD. MODULO: ENERGIA Y CONSUMO DE SUSTANCIAS FUNDAMENTALES. PRACTICA No.
 TRONCO COMUN DIVISIONAL DE CIENCIAS BIOLOGICAS Y DE LA SALUD. MODULO: ENERGIA Y CONSUMO DE SUSTANCIAS FUNDAMENTALES. PRACTICA No. 2 DETERMINACIÓN DE PROTEÍNAS. METODO DE BIURET OBJETIVO: Manejar en el
TRONCO COMUN DIVISIONAL DE CIENCIAS BIOLOGICAS Y DE LA SALUD. MODULO: ENERGIA Y CONSUMO DE SUSTANCIAS FUNDAMENTALES. PRACTICA No. 2 DETERMINACIÓN DE PROTEÍNAS. METODO DE BIURET OBJETIVO: Manejar en el
INTRODUCCIÓN: Las proteínas son precipitadas de sus soluciones por ciertos ácidos tales como Zn +++, Hg ++, Fe ++, Cu ++ y Pb ++.
 INTRODUCCIÓN: Las proteínas pueden formar soluciones estables debido a las cargas de hidratación de las moléculas de proteína y a las cargas eléctricas que ellas poseen. Las proteínas ligan agua por formación
INTRODUCCIÓN: Las proteínas pueden formar soluciones estables debido a las cargas de hidratación de las moléculas de proteína y a las cargas eléctricas que ellas poseen. Las proteínas ligan agua por formación
Esquema general de un fotómetro sencillo
 Esquema general de un fotómetro sencillo 1. Una fuente de radiaciones (lámpara) que genera la señal emitiendo un espectro continuo o de líneas según el instrumento. 2. Un sistema selector que permite seleccionar
Esquema general de un fotómetro sencillo 1. Una fuente de radiaciones (lámpara) que genera la señal emitiendo un espectro continuo o de líneas según el instrumento. 2. Un sistema selector que permite seleccionar
Mediciones Eléctricas
 UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE INGENIERIA ELECTRICA Y ELECTRONICA Mediciones Eléctricas Ing. Roberto Solís Farfán CIP 84663 EL LUXOMETRO El luxómetro es una célula fotoeléctrica que sirve
UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE INGENIERIA ELECTRICA Y ELECTRONICA Mediciones Eléctricas Ing. Roberto Solís Farfán CIP 84663 EL LUXOMETRO El luxómetro es una célula fotoeléctrica que sirve
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA.
 CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
ESPECTROFOTOMETRÍA UV-VISIBLE. Mª Luisa Fernández de Córdova Universidad de Jaén
 ESPECTROFOTOMETRÍA UV-VISIBLE 1. Propiedades de la luz 2. Absorción de luz 2.1. Fenómeno de la absorción 2.2. Espectros de absorción molecular 2.3. Tipos de transiciones electrónicas 3. Ley de Lambert-Beer
ESPECTROFOTOMETRÍA UV-VISIBLE 1. Propiedades de la luz 2. Absorción de luz 2.1. Fenómeno de la absorción 2.2. Espectros de absorción molecular 2.3. Tipos de transiciones electrónicas 3. Ley de Lambert-Beer
Física III clase 22 (09/06/2011) Partícula cuántica
 Física III clase 22 (09/06/2011) Profesor: M. Antonella Cid Departamento de Física, Facultad de Ciencias Universidad del Bío-Bío Carreras: Ingeniería Civil Civil, Ingeniería Civil Mecánica, Ingeniería
Física III clase 22 (09/06/2011) Profesor: M. Antonella Cid Departamento de Física, Facultad de Ciencias Universidad del Bío-Bío Carreras: Ingeniería Civil Civil, Ingeniería Civil Mecánica, Ingeniería
Serie 2 Fundamentos de Espectroscopia. = kg m/(s 2 A 2 2
 Serie Fundamentos de Espectroscopia. Las cuatro ecuaciones de Maxwell están dadas por: E B () E () t B E (3) B j (4) t Donde E y B son los campos eléctrico y magnético respectivamente, la densidad de carga,
Serie Fundamentos de Espectroscopia. Las cuatro ecuaciones de Maxwell están dadas por: E B () E () t B E (3) B j (4) t Donde E y B son los campos eléctrico y magnético respectivamente, la densidad de carga,
Para lograr una radiación de las características necesarias la fuente más común son las lámparas de cátodo hueco.
 Fundamento teórico El fundamento más elemental de los métodos espectrométricos es la Teoría Cuántica, propuesta en 1900 por Max Planck, que postula que los átomos, iones y moléculas sólo pueden existir
Fundamento teórico El fundamento más elemental de los métodos espectrométricos es la Teoría Cuántica, propuesta en 1900 por Max Planck, que postula que los átomos, iones y moléculas sólo pueden existir
TEMA 1.- TÉCNICAS DE LABORATORIO DE BIOQUÍMICA CLÍNICA (I) 1ª PARTE (1.1 a 1.3)
 TEMA 1.- TÉCNICAS DE LABORATORIO DE BIOQUÍMICA CLÍNICA (I) 1ª PARTE (1.1 a 1.3) 1.1.- Introducción a las técnicas bioquímicas 1.2.- Las técnicas espectrofotométricas 1.3.-Espectrofotometría de absorción
TEMA 1.- TÉCNICAS DE LABORATORIO DE BIOQUÍMICA CLÍNICA (I) 1ª PARTE (1.1 a 1.3) 1.1.- Introducción a las técnicas bioquímicas 1.2.- Las técnicas espectrofotométricas 1.3.-Espectrofotometría de absorción
Espectro electromagnético
 RADIOCOMUNICACIONES 11-03-2015 Espectro electromagnético La naturaleza de la luz ha sido estudiada desde hace muchos años por científicos tan notables como Newton y Max Plank. Para los astrónomos conocer
RADIOCOMUNICACIONES 11-03-2015 Espectro electromagnético La naturaleza de la luz ha sido estudiada desde hace muchos años por científicos tan notables como Newton y Max Plank. Para los astrónomos conocer
Cinética de Decoloración de Fenoftaleína en Medio Alcalino Efecto de la Fuerza Iónica
 LABORATORIO DE FISICOQUÍMICA QMC-313 Cinética de Decoloración de Fenoftaleína en Medio Alcalino Efecto de la Fuerza Iónica Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 22/06/2014
LABORATORIO DE FISICOQUÍMICA QMC-313 Cinética de Decoloración de Fenoftaleína en Medio Alcalino Efecto de la Fuerza Iónica Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 22/06/2014
Práctica de espectrofotometría UV-Visible (Cumplimiento de la Ley de Lambert-Beer y análisis de mezclas)
 Práctica de espectrofotometría UV-Visible (Cumplimiento de la Ley de Lambert-Beer y análisis de mezclas) FUNDAMENTO DE LA TÉCNICA Como es sabido, las técnicas espectroscópicas se basan en la interacción
Práctica de espectrofotometría UV-Visible (Cumplimiento de la Ley de Lambert-Beer y análisis de mezclas) FUNDAMENTO DE LA TÉCNICA Como es sabido, las técnicas espectroscópicas se basan en la interacción
LOS OBJETOS. Textos y fotos Fernando Moltini
 LOS OBJETOS Textos y fotos Fernando Moltini Como son percibidos los colores de los objetos. Un cuerpo opaco, es decir no transparente absorbe gran parte de la luz que lo ilumina y refleja una parte más
LOS OBJETOS Textos y fotos Fernando Moltini Como son percibidos los colores de los objetos. Un cuerpo opaco, es decir no transparente absorbe gran parte de la luz que lo ilumina y refleja una parte más
La luz y las ondas electromagnéticas
 La luz y las ondas electromagnéticas Cuestiones (96-E) a) Qué se entiende por interferencia de la luz? b) Por qué no observamos la interferencia de la luz producida por los dos faros de un automóvil? (96-E)
La luz y las ondas electromagnéticas Cuestiones (96-E) a) Qué se entiende por interferencia de la luz? b) Por qué no observamos la interferencia de la luz producida por los dos faros de un automóvil? (96-E)
Curso... /... DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR GRADO EN ODONTOLOGÍA PRÁCTICAS DE BIOQUÍMICA, BIOLOGÍA MOLECULAR Y GENÉTICA
 DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR GRADO EN ODONTOLOGÍA PRÁCTICAS DE BIOQUÍMICA, BIOLOGÍA MOLECULAR Y GENÉTICA Curso... /... NOMBRE Y APELLIDOS: CURSO Y GRUPO: Taquilla nº: . 17 de octubre
DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR GRADO EN ODONTOLOGÍA PRÁCTICAS DE BIOQUÍMICA, BIOLOGÍA MOLECULAR Y GENÉTICA Curso... /... NOMBRE Y APELLIDOS: CURSO Y GRUPO: Taquilla nº: . 17 de octubre
COLOR. Pag.1/7. Área: FÍSICO-QUÍMICA Asignatura: FÍSICA. Título. Curso: 4 TO Año: 2012 AÑO
 Área: FÍSICO-QUÍMICA Asignatura: FÍSICA Título COLOR Prof: BOHORQUEZ MARTINEZ LARGHI STRUM - TAITZ WALITZKY -IGNACIO D AMORE EZEQUIEL Curso: 4 TO Año: 2012 AÑO Pag.1/7 Dispersión de la luz Ya sabemos que
Área: FÍSICO-QUÍMICA Asignatura: FÍSICA Título COLOR Prof: BOHORQUEZ MARTINEZ LARGHI STRUM - TAITZ WALITZKY -IGNACIO D AMORE EZEQUIEL Curso: 4 TO Año: 2012 AÑO Pag.1/7 Dispersión de la luz Ya sabemos que
PRÁCTICA 2 Determinación espectrofotométrica del pk de un indicador
 Laboratorio de Química Física 1 Grado en Química PRÁCTICA 2 Determinación espectrofotométrica del pk de un indicador Material 2 matraces aforados de 250 ml 1 varilla de vidrio/ 1 pesasustancias/ 1 cuentagotas/
Laboratorio de Química Física 1 Grado en Química PRÁCTICA 2 Determinación espectrofotométrica del pk de un indicador Material 2 matraces aforados de 250 ml 1 varilla de vidrio/ 1 pesasustancias/ 1 cuentagotas/
SENSOR COLORÍMETRO BT29i
 SENSOR COLORÍMETRO BT29i GUÍA DE USUARIO CENTRE FOR MICROCOMPUTER APPLICATIONS http://www.cma-science.nl Breve Descripción El sensor Colorímetro BT29i CMA mide la cantidad de luz transmitida a través de
SENSOR COLORÍMETRO BT29i GUÍA DE USUARIO CENTRE FOR MICROCOMPUTER APPLICATIONS http://www.cma-science.nl Breve Descripción El sensor Colorímetro BT29i CMA mide la cantidad de luz transmitida a través de
PRÁCTICA 2 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE
 PRÁCTICA 2 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE MnO 4-1.- FUNDAMENTO TEÓRICO. 1.1.- Introducción Un método espectrofotométrico está basado en la medida directa de la absorción de radiación electromagnética
PRÁCTICA 2 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE MnO 4-1.- FUNDAMENTO TEÓRICO. 1.1.- Introducción Un método espectrofotométrico está basado en la medida directa de la absorción de radiación electromagnética
1. a) Explique los fenómenos de reflexión y refracción de la luz. siempre refracción?
 ÓPTICA 2001 1. a) Indique qué se entiende por foco y por distancia focal de un espejo. Qué es una imagen virtual? b) Con ayuda de un diagrama de rayos, describa la imagen formada por un espejo convexo
ÓPTICA 2001 1. a) Indique qué se entiende por foco y por distancia focal de un espejo. Qué es una imagen virtual? b) Con ayuda de un diagrama de rayos, describa la imagen formada por un espejo convexo
Universidad de Antioquia F.Q.F. Ingeniería de Alimentos Lab. Análisis Instrumental
 Universidad de Antioquia F.Q.F. Ingeniería de Alimentos Lab. Análisis Instrumental 1.OBTENCIÓN DEL ESPECTRO DE ABSORCIÓN DE UNA SUSTANCIA Profesor: Lucas Blandón Deymer Gómez Emilson León Froilan PRÁCTICA
Universidad de Antioquia F.Q.F. Ingeniería de Alimentos Lab. Análisis Instrumental 1.OBTENCIÓN DEL ESPECTRO DE ABSORCIÓN DE UNA SUSTANCIA Profesor: Lucas Blandón Deymer Gómez Emilson León Froilan PRÁCTICA
ESPECTROSCOPIA DE ABSORCIÓN UV - VISIBLE Q.F. ALEX SILVA ARAUJO
 ESPECTROSCOPIA DE ABSORCIÓN UV - VISIBLE Q.F. ALEX SILVA ARAUJO TÉRMINOS EMPLEADOS EN ESPECTROSCOPIA DE ABSORCIÓN Transmitancia (T): Es la fracción de radiación incidente transmitida por la solución. A
ESPECTROSCOPIA DE ABSORCIÓN UV - VISIBLE Q.F. ALEX SILVA ARAUJO TÉRMINOS EMPLEADOS EN ESPECTROSCOPIA DE ABSORCIÓN Transmitancia (T): Es la fracción de radiación incidente transmitida por la solución. A
EL MÉTODO DE JOB OBJETIVO
 EL MÉTODO DE JOB OBJETIVO Identificar las diferentes especies que se forman en solución usando el método de las variaciones continuas (Método de Job) en el sistema níquel etilendiamina. INTRODUCCIÓN En
EL MÉTODO DE JOB OBJETIVO Identificar las diferentes especies que se forman en solución usando el método de las variaciones continuas (Método de Job) en el sistema níquel etilendiamina. INTRODUCCIÓN En
ESPECTROFOTOMETRÍA. Lic. José Manuel Arriaga Romero
 ESPECTROFOTOMETRÍA Lic. José Manuel Arriaga Romero PRINCIPIOS ESPECTROFOTOMÉTRICOS Características de la luz Longitud de onda Es igual a la distancia entre dos puntos idénticos sobre ondas de luz consecutivas
ESPECTROFOTOMETRÍA Lic. José Manuel Arriaga Romero PRINCIPIOS ESPECTROFOTOMÉTRICOS Características de la luz Longitud de onda Es igual a la distancia entre dos puntos idénticos sobre ondas de luz consecutivas
PRÁCTICA 4 COLORIMETRÍA. LEY DE LAMBERT-BEER
 PRÁCTICA 4 COLORIMETRÍA. LEY DE LAMBERT-BEER OBJETIVOS Adquirir los conocimientos básicos sobre espectrofotometría de absorción visible, incluyendo la Ley de Lambert-Beer y sus aplicaciones en Química.
PRÁCTICA 4 COLORIMETRÍA. LEY DE LAMBERT-BEER OBJETIVOS Adquirir los conocimientos básicos sobre espectrofotometría de absorción visible, incluyendo la Ley de Lambert-Beer y sus aplicaciones en Química.
Laboratorio 10. Constante de disociación ácida de un tinte
 Objetivo Laboratorio 10. Constante de disociación ácida de un tinte Determinar la constante de equilibrio de la disociación de un indicador visual ácido-base (rojo de metilo) utilizando medidas espectrofotométricas.
Objetivo Laboratorio 10. Constante de disociación ácida de un tinte Determinar la constante de equilibrio de la disociación de un indicador visual ácido-base (rojo de metilo) utilizando medidas espectrofotométricas.
III. CONCEPTOS TEORICOS
 III. CONCEPTOS TEORICOS Los conceptos que se presentan en este capitulo son términos que permitirán entender mejor este trabajo de tesis. Asimismo en el anexo N G se muestra el Diagrama de Procesos de
III. CONCEPTOS TEORICOS Los conceptos que se presentan en este capitulo son términos que permitirán entender mejor este trabajo de tesis. Asimismo en el anexo N G se muestra el Diagrama de Procesos de
PRÁCTICA NO 7 CUANTIFICACIÓN DE CAFEÍNA POR ESPECTROFOTOMETRÍA
 PRÁCTICA NO 7 CUANTIFICACIÓN DE CAFEÍNA POR ESPECTROFOTOMETRÍA INTRODUCCIÓN Las técnicas espectroscópicas o espectrofotométricas se basan en la utilización de energía luminosa de cierta longitud de onda
PRÁCTICA NO 7 CUANTIFICACIÓN DE CAFEÍNA POR ESPECTROFOTOMETRÍA INTRODUCCIÓN Las técnicas espectroscópicas o espectrofotométricas se basan en la utilización de energía luminosa de cierta longitud de onda
