Tema 13. Estructura del átomo
|
|
|
- Felipe Ávila Cruz
- hace 6 años
- Vistas:
Transcripción
1 Tema 13 Estructura del átomo
2 13.1 El Electrón 13.2 Núcleo atómico y Radiactividad 13.3 Radiación y materia 13.4 Espectros de emisión y absorción 13.5 La naturaleza dual del electrón 2
3 13.1 El electrón Al hacer pasar la electricidad a través de tubos de vidrio sometidos al vacío, Faraday descubrió los RAYOS CATÓDICOS, un tipo de radiación emitida por el polo negativo o cátodo que atravesaba el tubo evacuado hacia el polo positivo o ánodo. 3
4 Faraday construyó los primeros tubos de rayos catódicos hace 150 años - vidrio Alto vacío Rayos catódicos + Cátodo (electrodo negativo) Ánodo (electrodo positivo) 4
5 - Rayos catódicos + En ausencia de campos magnéticos los rayos catódicos viajan en línea recta. Los rayos catódicos son partículas fundamentales de la materia cargadas negativamente y que se encuentran en todos los átomos. Si se les somete a campos eléctricos y magnéticos variables se puede obtener su relación q/m = -1.76x10 8 C/g (Thomson, 1897) 5
6 Esa relación q/m es independiente del material de cátodo (Fe,Pt...) Los rayos catódicos son un constituyente universal de la materia Hoy los conocemos como ELECTRONES 6
7 Millikan (1913) determinó por primera vez su carga y su masa por separado q(e - ) = C = -q(p) m(e - ) = g m(p) = m(n) = (g) La m(p) es aprox veces la m(e - ) 7
8 Roentgen (1895) Los tubos de los rayos catódicos (RC) emitían otro tipo de radiación que se descubrió al comprobar que materiales que formaban el anticátodo (lámina colocada delante del ánodo) emitían radiación con longitud de onda mínima dependiendo del material del anticátodo (ley de Moseley). Este tipo de radiación se conoce como Rayos X - e - Rayos catódicos + RAYOS X 8
9 Propiedades de los Rayos X Son muy energéticos Pueden atravesar la materia y velar placas fotográficas No se desvían de su trayectoria mediante campos magnéticos No son partículas cargadas Ahora sabemos que son una radiación electromagnética de alta energía 9
10 13.2 Núcleo atómico y radiactividad a) Núcleo atómico Experimento de Rutherford Bombardeo de una lámina de oro con partículas alfa LA MAYORIA LA TRASPASABAN SIN DESVIARSE!!! 10
11 Conclusiones del experimento de Rutherford La mayor parte de la masa y toda la carga + están concentradas en una zona muy pequeña denominada núcleo. La cantidad de carga + es diferente para distintos átomos y es aproximadadamente la mitad del peso atómico. Esta carga está contrarrestada con la de los electrones fuera del núcleo. 11
12 Radio del Núcleo: m Radio de la corteza m 12
13 b) Radiactividad: Becquerel (1896) descubrió que algunos materiales (sales de uranio) velaban las placas fotográficas en ausencia de luz. Eran materiales radiactivos Radiactividad: Emisión espontánea de radiación y partículas. El nombre de radiactividad fue sugerido por Marie Curie 13
14 Tipos de radiaciones producidos por los materiales radiactivos Material radiactivo Aislante de Pb Si un material radiactivo está encerrado en un bloque de Pb, toda la radiación excepto la que pasa a través de la abertura estrecha es absorbida por el Pb. Cuando esta radiación emitida pasa a través de un campo eléctrico, se descompone en 3 haces. Un haz permanece sin desviarse son los rayos γ. Los rayos γ son radiación del mismo tipo que los Rayos X pero más energética. Otro haz es atraído por la placa cargada negativamente, son las partículas α y el tercer haz se desvía hacia la placa positiva, son las partículas β. 14
15 Radiación y partículas emitidas en fenómenos de radiactividad α β γ núcleo de 4 He ( 4 2He 2+, 4 2α,α) electrón ( 0-1e,β -,β) fotón (radiación de alta energía) β + p n positrón ( 0 1e,β + ) protón ( 1 1H +, 1 1p, p) neutrón ( 1 0n,n) 15
16 Efectos de la radiactividad Radiación Poder penetrante relativo Protección requerida α 1 papel, piel β 100 aluminio 3mm γ cemento, plomo 16
17 Reacciones nucleares Núclido = núcleo específico con un número determinado de neutrones y protones (valores de Z y A) A X Z Símbolo Isótopo = átomo con un Z y un A fijos Reacción nuclear = Transformación de un núclido en otro. Libera gran cantidad de energía 17
18 Reacción nuclear Reacción Química Se producen nuevos elementos Cambios de energía muy grandes (1 g 235 U = 8.2 x 10 7 kj) Depende del tipo de isótopo No se producen nuevos elementos Cambios de energía moderados (combustión de 1 g CH 4 = 52 kj) No depende del isótopo 18
19 Tipos de reacciones nucleares Fisión = Un núcleo pesado (A > 200) se divide para formar núcleos más pequeños y uno o más neutrones Sr U Xe 19
20 Estabilidad nuclear Balance entre la repulsión entre los protones debida a la carga y la atracción entre las partículas del núcleo (p y n, nucleones) n 0 p n 0 n 20
21 Series radiactivas Conjunto de reacciones nucleares que conducen a un núclido estable La mayoría de las series radiactivas terminan en un isótopo del Pb Serie radiactiva del 238 U 238 U 206 Pb 235 U 207 Pb 232 U 208 Pb 21
22 Fusión = Unión de dos o más núclidos para formar otro mayor y alguna que otra partícula 14 7 N + 4 2He 17 8O + 1 1H Al + 4 2He 30 15P + 1 0n Es la base de la energía del sol 22
23 Velocidad de desintegración radiactiva Los radionúclidos tienen estabilidades diferentes y se desintegran a velocidades diferentes. Algunos se desintegran casi completamente en una fracción de segundo y otros sólo después de millones de años. Las velocidades de todas las desintegraciones radiactivas son independientes de la temperatura y obedecen a una cinética de primer orden. velocidades de desintegración = k [A] La semivida, t 1/2, de una reacción es el tiempo necesario para que reaccione la mitad de la muestra original. t 1/2 = /k 23
24 Datación radiactiva La desintegración de núclidos, de vida media conocida es la base de la datación radiactiva DATACIÓN DE MUESTRAS ORGÁNICAS El 14 C se produce continuamente en la atmósfera superior, cuando los átomos de N capturan neutrones de los rayos cósmicos N + n 14 6C + p presente en la alta atmósfera asimilado en los seres vivos MIENTRAS ESTAN VIVOS 24
25 Los átomos de C-14 reaccionan con moléculas de O 2 para formar 14 CO 2 radiactivo, que se retira de la atmósfera por fotosíntesis. El 14 CO 2 se incorpora a los organismos vivos igual que el 12 CO 2 ordinario, así que una cierta fracción de todos los átomos de C de las sustancias vivas es C
26 EQUILIBRIO Organismo VIVO 14 CO Excreción y 2 14 C/ 12 C = 1/10 12 respiración Cuando el organismo muere, el 14 C empieza a desintegrarse y ya no se produce ningún aporte más n = n 0 e -k t 14 C que queda después 14 C inicial ( 12 C/10 12 ) del tiempo t /t 1/2 despejar t 26
27 La vida media y la precisión de las medidas determinan hasta donde se puede datar con fiabilidad un resto orgánico La vida media del 14 C es de 5730 años -(t 1/2 / ln 2) ln [n / n 0 ] = t Si la máxima precisión en obtener n es el 1% n/n 0 = 0.01 como máximo t puede ser como máximo años 27
28 El 90 Sr es un isótopo radiactivo de vida media corta (28 años) Fue introducido en la atmósfera mediante las pruebas de armas nucleares, de allí pasó a al agua y a la cadena alimentaria Por su semejanza con el Ca se acumula en los huesos y puede producir leucemia y otros tipos de cáncer. 28
29 13.3 Radiación y materia La RADIACIÓN ELECTROMAGNÉTICA es una forma de transmisión de energía en la que los campos eléctricos y magnéticos se propagan por ondas a través del espacio o a través de un medio como el vidrio. Una ONDA es una perturbación que transmite energía a través de un medio. 29
30 La luz es el tipo de radiación electromagnética que somos capaces de ver La luz y todas las demás ondas electromagnéticas son ondas transversales 30
31 Relación entre longitud de onda, λ, y frecuencia, ν λ ν = c c es la velocidad de todas las ondas electromagnéticas incluyendo la luz m/s El espectro electromagnético es el conjunto de todas las posibles longitudes de onda. 31
32 Ondas de Radio Microondas Infrarojo Ultravioleta Rayos X Rayos γ El espectro electromagnético Rotaciones Vibraciones Transiciones electrónicas UV-A nm UV-B nm UV-C nm Transiciones electrónicas internas Transiciones nucleares 32
33 13.4 Espectros de emisión y absorción Espectros de emisión: Cuando se hace pasar una descarga eléctrica a través de hidrógeno atómico a baja presión, el H reemite solamente radiación de unas pocas longitudes de onda características ENERGÍA MUESTRA EMISIÓN Se analiza la emisión de radiación por la muestra 33
34 Espectros de absorción: Energía inicial Muestra Energía final E final = E inicial E absorbida por la muestra 34
35 Absorción Emisión E E 3 h ν = E 3 -E 1 E 3 h ν = E 3 -E 1 E 2 E 2 h ν = E 2 -E 1 h ν = E 2 -E 1 E 1 E 1 35
36 Ejemplo: Espectro de absorción del O 3 Espectro de absorción de O 3 Absorción relativa λ / nm Está en la zona del UV 36
37 Intensidad relativa Sobre la estratosfera En la troposfera Como el O 3 de la estratosfera absorbe radiación UV, ésta no llega a la superficie 300 UV λ / nm Visible 37
38 EFECTO INVERNADERO El gran incremento en el uso de combustibles fósiles ha causado un aumento significativo en la concentración de CO 2 en la atmósfera. La E del sol alcanza la tierra en forma de luz. Ni el CO 2 ni el vapor de H 2 O absorbe la luz visible de la luz solar, de modo que no evitan que llegue a la superficie de la tierra. 38
39 Sin embargo, la E proporcionada por la tierra en forma de radiación IR (calor) es absorbida por el CO 2 y H 2 O. Así parte del calor que la tierra debe perder para permanecer en equilibrio térmico, queda atrapado por la atmósfera, causando que la temperatura de la tierra suba. Este fenómeno se llama EFECTO INVERNADERO. 39
40 Las principales moléculas que causan e.i. son CO 2 y H 2 O Radiación IR Luz visible (procede del Sol) Molécula de efecto invernadero Otra molécula Tierra 40
41 13.5 Naturaleza dual del electrón La idea de que la luz puede exhibir tanto propiedades ondulatorias como corpusculares, le sugirió a LOUIS DE BROGLIE (1924) que partículas muy pequeñas, como los e -, podrían también presentar propiedades ondulatorias en circunstancias apropiadas. 41
42 Deducción de la ecuación de De Broglie Ecuación de Einstein E = m c 2 m c 2 = h ν m c = h ν / c Ecuación de Planck E = h ν momento del fotón: p = m c p = h ν / λ ν c = λ ν Para aplicar esta ecuación a una partícula material, como un e - p = m v h h m v = λ = λ m v 42
43 De Broglie predijo que una partícula con una masa m y una velocidad v tendría una longitud de onda asociada. El valor numérico de esta λ está dada por esta expresión: λ = h m v 43
44 La hipótesis de De Broglie fue confirmada por Davisson y Germer en 1925 Demostraron la difracción de e - por un cristal de Ni. Este comportamiento es una característica importante de las ondas. Demostrando que los e- tienen propiedades ondulatorias Bombardeo con e - sobre un cristal de Ni Aparición de un patrón de difracción Cristal de Ni 44
EL ÁTOMO CONTENIDOS. ANTECEDENTES HISTÓRICOS. ( ) MODELOS ATÓMICOS. RAYOS CATÓDICOS. MODELO DE THOMSON.
 EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
Esta parte de la Física estudia el comportamiento de los núcleos atómicos. Física nuclear
 Esta parte de la Física estudia el comportamiento de los núcleos atómicos Física nuclear CORTEZA Electrones NÚCLEO Protones Neutrones PARTÍCULA CARGA MASA Electrón (e - ) -1,6.10-19 C 9,1.10-31 kg Protón
Esta parte de la Física estudia el comportamiento de los núcleos atómicos Física nuclear CORTEZA Electrones NÚCLEO Protones Neutrones PARTÍCULA CARGA MASA Electrón (e - ) -1,6.10-19 C 9,1.10-31 kg Protón
TEMA 6.- EL NÚCLEO 1.- LA NATURALEZA DE LAS REACCIONES NUCLEARES 2.- ESTABILIDAD NUCLEAR. Energía de enlace nuclear 3.- RADIACTIVIDAD NATURAL
 TEMA 6.- EL NÚCLEO.- LA NATURALEZA DE LAS REACCIONES NUCLEARES 2.- ESTABILIDAD NUCLEAR Energía de enlace nuclear 3.- RADIACTIVIDAD NATURAL 4.- RADIACTIVIDAD ARTIFICIAL 5.- FISIÓN NUCLEAR 6.- FUSIÓN NUCLEAR
TEMA 6.- EL NÚCLEO.- LA NATURALEZA DE LAS REACCIONES NUCLEARES 2.- ESTABILIDAD NUCLEAR Energía de enlace nuclear 3.- RADIACTIVIDAD NATURAL 4.- RADIACTIVIDAD ARTIFICIAL 5.- FISIÓN NUCLEAR 6.- FUSIÓN NUCLEAR
A. Lavoisier (mediciones de masas reaccionantes): la materia no se crea ni se destruye
 Características esenciales de las reacciones químicas A. Lavoisier (mediciones de masas reaccionantes): la materia no se crea ni se destruye Joseph Louis Proust (formación de CuCO 3 ): los elementos que
Características esenciales de las reacciones químicas A. Lavoisier (mediciones de masas reaccionantes): la materia no se crea ni se destruye Joseph Louis Proust (formación de CuCO 3 ): los elementos que
Núcleo Atómico. El núcleo es una masa muy compacta formada por protones y neutrones.
 Núcleo Atómico Profesor: Robinson Pino H. 1 COMPONENTES DEL NÚCLEO ATÓMICO El núcleo es una masa muy compacta formada por protones y neutrones. PROTÓN PROTÓN(p + ) Es una partícula elemental con carga
Núcleo Atómico Profesor: Robinson Pino H. 1 COMPONENTES DEL NÚCLEO ATÓMICO El núcleo es una masa muy compacta formada por protones y neutrones. PROTÓN PROTÓN(p + ) Es una partícula elemental con carga
La estructura atómica: el núcleo
 Tema 1 La estructura atómica: el núcleo Introducción. Modelos atómicos Composición del átomo. Partículas fundamentales Estructura del núcleo Estabilidad nuclear y energía de enlace nuclear Aplicaciones
Tema 1 La estructura atómica: el núcleo Introducción. Modelos atómicos Composición del átomo. Partículas fundamentales Estructura del núcleo Estabilidad nuclear y energía de enlace nuclear Aplicaciones
J.M.L.C. IES Aguilar y Cano ALGUNOS DERECHOS RESERVADOS
 La radiactividad o radioactividad es un fenómeno físico natural, por el cual algunas sustancias o elementos químicos llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas
La radiactividad o radioactividad es un fenómeno físico natural, por el cual algunas sustancias o elementos químicos llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas
La Teoría Cuántica Preguntas de Multiopcion
 Slide 1 / 71 La Teoría Cuántica Preguntas de Multiopcion Slide 2 / 71 1 El experimento de "rayos catódicos" se asocia con: A B C D E Millikan Thomson Townsend Plank Compton Slide 3 / 71 2 La carga del
Slide 1 / 71 La Teoría Cuántica Preguntas de Multiopcion Slide 2 / 71 1 El experimento de "rayos catódicos" se asocia con: A B C D E Millikan Thomson Townsend Plank Compton Slide 3 / 71 2 La carga del
Física P.A.U. FÍSICA MODERNA 1 FÍSICA MODERNA
 Física P.A.U. FÍSICA MODERNA FÍSICA MODERNA PROBLEMAS MECÁNICA CUÁNTICA.. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 5 nm, el potencial de frenado para los electrones
Física P.A.U. FÍSICA MODERNA FÍSICA MODERNA PROBLEMAS MECÁNICA CUÁNTICA.. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 5 nm, el potencial de frenado para los electrones
RADIOACTIVIDAD - (2015)
 RADIOACTIVIDAD - (2015) A- CONCEPTOS GENERALES SOBRE RADIACTIVIDAD B- ISÓTOPOS C- TIPOS Y PROPIEDADES DE LAS RADIACCIONES D- REACCIONES NUCLEARES E- VIDA MEDIA A- CONCEPTOS GENERALES SOBRE RADIACTIVIDAD
RADIOACTIVIDAD - (2015) A- CONCEPTOS GENERALES SOBRE RADIACTIVIDAD B- ISÓTOPOS C- TIPOS Y PROPIEDADES DE LAS RADIACCIONES D- REACCIONES NUCLEARES E- VIDA MEDIA A- CONCEPTOS GENERALES SOBRE RADIACTIVIDAD
Física Cuántica Problemas de Practica AP Física B de PSI
 Física Cuántica Problemas de Practica AP Física B de PSI Nombre 1. El experimento de "rayos catódicos" se asocia con: (A) R. A. Millikan (B) J. J. Thomson (C) J. S. Townsend (D) M. Plank (E) A. H. Compton
Física Cuántica Problemas de Practica AP Física B de PSI Nombre 1. El experimento de "rayos catódicos" se asocia con: (A) R. A. Millikan (B) J. J. Thomson (C) J. S. Townsend (D) M. Plank (E) A. H. Compton
Qué es la energía nuclear? Tema1
 Toda la materia del universo está formada por moléculas que a su vez están constituidas por átomos, pequeñísimas unidades que durante mucho tiempo se consideraron invisibles. En la actualidad sabemos que
Toda la materia del universo está formada por moléculas que a su vez están constituidas por átomos, pequeñísimas unidades que durante mucho tiempo se consideraron invisibles. En la actualidad sabemos que
FÍSICA NUCLEAR. I WANT TO KNOW GOD S THOUGHTS; THE REST ARE DETAILS (Albert Einstein )
 FÍSICA NUCLEAR I WANT TO KNOW GOD S THOUGHTS; THE REST ARE DETAILS (Albert Einstein. 879 955) . INTRODUCCIÓN. RESEÑA HISTÓRICA Radiactividad propiedad de los núcleos atómicos de ciertos isótopos de modificar
FÍSICA NUCLEAR I WANT TO KNOW GOD S THOUGHTS; THE REST ARE DETAILS (Albert Einstein. 879 955) . INTRODUCCIÓN. RESEÑA HISTÓRICA Radiactividad propiedad de los núcleos atómicos de ciertos isótopos de modificar
2 La carga del electrón fue determinada por primera vez en: D Difracción de electrones a partir del papel de aluminio.
 Slide 1 / 32 1 Un Tubo de Crooke (un tubo que contiene gas rarificado a través del cual se hace pasar una corriente entre un cátodo y un ánodo) fue utilizado en el descubrimiento del electrón por: A R.
Slide 1 / 32 1 Un Tubo de Crooke (un tubo que contiene gas rarificado a través del cual se hace pasar una corriente entre un cátodo y un ánodo) fue utilizado en el descubrimiento del electrón por: A R.
Principios Básicos de la Radiación
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE ODONTOLOGÍA AREA BÁSICA CURSO: FÍSICO-MATEMÁTICA DOCENTES: DR. EDWIN LÓPEZ ING. FREDY CONTRERAS DOCUMENTO ELABORADO POR DRA. BRENDA MARÍA LÓPEZ LEIVA
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE ODONTOLOGÍA AREA BÁSICA CURSO: FÍSICO-MATEMÁTICA DOCENTES: DR. EDWIN LÓPEZ ING. FREDY CONTRERAS DOCUMENTO ELABORADO POR DRA. BRENDA MARÍA LÓPEZ LEIVA
Física nuclear. Núcleo atómico
 Física nuclear La configuración de los electrones de un átomo determina si este puede unirse a otros para formar compuestos y la manera para hacerlo. Además, los electrones causan efectos tales como la
Física nuclear La configuración de los electrones de un átomo determina si este puede unirse a otros para formar compuestos y la manera para hacerlo. Además, los electrones causan efectos tales como la
Modelo de Thomson Modelo de Rutherford. Estructura atómica. José Mariano Lucena Cruz 10 de mayo de 2010
 José Mariano Lucena Cruz chenalc@gmail.com 10 de mayo de 2010 Propiedades periódicas Aquellas cuyo valor se puede estimar según la posición que ocupen los elementos en la tabla periódica. Estas son: Tamaño
José Mariano Lucena Cruz chenalc@gmail.com 10 de mayo de 2010 Propiedades periódicas Aquellas cuyo valor se puede estimar según la posición que ocupen los elementos en la tabla periódica. Estas son: Tamaño
Radiación. Tipos de radiación
 Radiación Las radiaciones son ondas electromagnéticas o partículas que se propagan con una velocidad dada. Contienen energía, carga eléctrica y magnética. Pueden ser generadas por fuentes naturales o instrumentos
Radiación Las radiaciones son ondas electromagnéticas o partículas que se propagan con una velocidad dada. Contienen energía, carga eléctrica y magnética. Pueden ser generadas por fuentes naturales o instrumentos
LA TEORIA ATOMICA John Dalton
 LA TEORIA ATOMICA En 1808, un científico inglés, el profesor John Dalton, formuló una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos 1766-1844
LA TEORIA ATOMICA En 1808, un científico inglés, el profesor John Dalton, formuló una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos 1766-1844
UNIDAD 1 LA ENERGÍA, LA MATERIA Y SUS CAMBIOS. 1.3 El sol, horno nuclear
 UNIDAD 1 LA ENERGÍA, LA MATERIA Y SUS CAMBIOS 1.3 El sol, horno nuclear RADIACTIVIDAD Y DESINTEGRACIÓN NUCLEAR HISTORIA DEL ÁTOMO Hace aproximadamente 2500 años, los filósofos griegos, afirmaron que la
UNIDAD 1 LA ENERGÍA, LA MATERIA Y SUS CAMBIOS 1.3 El sol, horno nuclear RADIACTIVIDAD Y DESINTEGRACIÓN NUCLEAR HISTORIA DEL ÁTOMO Hace aproximadamente 2500 años, los filósofos griegos, afirmaron que la
QUÍMICA COMÚN Y ELECTIVO
 QUÍMICA COMÚN Y ELECTIVO GENERALIDADES 1. MODELOS ATÓMICOS 2. EL AGUA, EL AIRE Y EL PETRÓLEO COMÚN 3. QUÍMICA ORGÁNICA 4. DISOLUCIONES QUÍMICAS 1. EQUILIBRIO QUÍMICO 2. CINÉTICA 3. ACTIVIDAD NUCLEAR ELECTIVO
QUÍMICA COMÚN Y ELECTIVO GENERALIDADES 1. MODELOS ATÓMICOS 2. EL AGUA, EL AIRE Y EL PETRÓLEO COMÚN 3. QUÍMICA ORGÁNICA 4. DISOLUCIONES QUÍMICAS 1. EQUILIBRIO QUÍMICO 2. CINÉTICA 3. ACTIVIDAD NUCLEAR ELECTIVO
Física Nuclear y Reacciones Nucleares
 Slide 1 / 34 Física Nuclear y Reacciones Nucleares El Núcleo Slide 2 / 34 Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa
Slide 1 / 34 Física Nuclear y Reacciones Nucleares El Núcleo Slide 2 / 34 Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa
Slide 1 / 34. Física Nuclear y Reacciones Nucleares
 Slide 1 / 34 Física Nuclear y Reacciones Nucleares Slide 2 / 34 El Núcleo Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa
Slide 1 / 34 Física Nuclear y Reacciones Nucleares Slide 2 / 34 El Núcleo Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa
02/06/2014. Química Plan Común
 Química Plan Común Limitaciones del Modelo Atómico de Rutherford Según el modelo atómico de Rutherford, los electrones se mueven en órbitas circulares y tienen una aceleración normal. Pero según los principios
Química Plan Común Limitaciones del Modelo Atómico de Rutherford Según el modelo atómico de Rutherford, los electrones se mueven en órbitas circulares y tienen una aceleración normal. Pero según los principios
Formas de energía. Energía Térmica
 Formas de energía Las propiedades de la energía se manifiestan de modos diferentes, es decir, a través de las diferentes formas de energía que conocemos. Las formas de energías pueden clasificarse en:
Formas de energía Las propiedades de la energía se manifiestan de modos diferentes, es decir, a través de las diferentes formas de energía que conocemos. Las formas de energías pueden clasificarse en:
FÍSICA NUCLEAR. El núcleo atómico
 1. El núcleo atómico. 2. Energía de enlace nuclear. 3. La radiactividad nuclear. 4. Leyes de la desintegración radiactiva. 5. Reacciones nucleares: su aspecto energético. 6. Fisión nuclear: reactores nucleares.
1. El núcleo atómico. 2. Energía de enlace nuclear. 3. La radiactividad nuclear. 4. Leyes de la desintegración radiactiva. 5. Reacciones nucleares: su aspecto energético. 6. Fisión nuclear: reactores nucleares.
Unidad N 11 QUIMICA NUCLEAR
 Unidad N 11 QUIMICA NUCLEAR Estructura básica del átomo Electrones: CAMBIOS: generan las propiedades Químicas y Físicas más o menos comunes de un dado átomo. Núcleo: CAMBIOS: modifican en forma sustancial
Unidad N 11 QUIMICA NUCLEAR Estructura básica del átomo Electrones: CAMBIOS: generan las propiedades Químicas y Físicas más o menos comunes de un dado átomo. Núcleo: CAMBIOS: modifican en forma sustancial
QUIMICA GENERAL. Docente : Raquel Villafrades Torres
 Universidad Pontificia Bolivariana QUIMICA GENERAL Docente : Raquel Villafrades Torres TEORIA ATOMICA DE DALTON (1808) BASES Ley de conservación de la masa: La masa total de las sustancias presentes después
Universidad Pontificia Bolivariana QUIMICA GENERAL Docente : Raquel Villafrades Torres TEORIA ATOMICA DE DALTON (1808) BASES Ley de conservación de la masa: La masa total de las sustancias presentes después
Química General III. Tema 13. Química Nuclear. Sulfato doble de K y U, emite radiación fuente de rayos radiactivos.
 Química General III. Tema 3. Química Nuclear Introducción. Reacción Química Wilhelm Röntgen Henri Becquerel solo 896 895 participan electrones. Rayos X Sulfato doble de K y U, emite radiación fuente de
Química General III. Tema 3. Química Nuclear Introducción. Reacción Química Wilhelm Röntgen Henri Becquerel solo 896 895 participan electrones. Rayos X Sulfato doble de K y U, emite radiación fuente de
---- Debe indicarse claramente nombres y números de lista de los alumnos integrantes del grupo.
 LICEO Confederación Suiza SECTOR: Química GUÍA DE APRENDIZAJE NIVEL: 4 Medio PROFESOR(A): Genny Astudillo Castillo UNIDAD TEMÁTICA: Química Nuclear CONTENIDO: Fisión y fusión nuclear OBJETIVO DE APRENDIZAJE:
LICEO Confederación Suiza SECTOR: Química GUÍA DE APRENDIZAJE NIVEL: 4 Medio PROFESOR(A): Genny Astudillo Castillo UNIDAD TEMÁTICA: Química Nuclear CONTENIDO: Fisión y fusión nuclear OBJETIVO DE APRENDIZAJE:
Recordando. Primer Modelo atómico (1900) Segundo Modelo atómico (1910) J. J. Thomson Budín de pasas. E. Rutherford Modelo planetario
 ANTECEDENTES DEL MODELO ACTUAL DEL ATOMO Raquel Villafrades Torres Universidad Pontificia Bolivariana Química General Química General Ingeniera Química Raquel Villafrades Torres Abril de 2009 Primer Modelo
ANTECEDENTES DEL MODELO ACTUAL DEL ATOMO Raquel Villafrades Torres Universidad Pontificia Bolivariana Química General Química General Ingeniera Química Raquel Villafrades Torres Abril de 2009 Primer Modelo
Física Nuclear Preguntas de Opción Múltiple
 Física Nuclear Preguntas de Opción Múltiple PSI Física Nombre: 1. Un elemento químico desconocido se representa como: Z X. Cuál es el nombre de Z? A. Número de masa atómica B. Número atómico C. Número
Física Nuclear Preguntas de Opción Múltiple PSI Física Nombre: 1. Un elemento químico desconocido se representa como: Z X. Cuál es el nombre de Z? A. Número de masa atómica B. Número atómico C. Número
FÍSICA MODERNA FÍSICA NUCLEAR Y DE PARTÍCULAS. José Luis Rodríguez Blanco
 FÍSICA MODERNA FÍSICA NUCLEAR Y DE PARTÍCULAS José Luis Rodríguez Blanco Fenómenos radiactivos H. Becquerel (1896): Sales de uranio emiten una radiación sumamente penetrante independiente del estado de
FÍSICA MODERNA FÍSICA NUCLEAR Y DE PARTÍCULAS José Luis Rodríguez Blanco Fenómenos radiactivos H. Becquerel (1896): Sales de uranio emiten una radiación sumamente penetrante independiente del estado de
Z, ( a veces se suprime Z),donde X es el símbolo químico del elemento. Así por ejemplo tenemos los isótopos del carbono:
 RADIACTIVIDAD El núcleo atómico está constituido por nucleones: Z protones y N neutrones, ( en total A ). Como sabemos los nucleones son partículas elementales y están constituidos por la agrupación de
RADIACTIVIDAD El núcleo atómico está constituido por nucleones: Z protones y N neutrones, ( en total A ). Como sabemos los nucleones son partículas elementales y están constituidos por la agrupación de
Física P.A.U. FÍSICA MODERNA 1 FÍSICA MODERNA
 Física P.A.U. FÍSICA MODERNA 1 FÍSICA MODERNA PROBLEMAS EFECTO FOTOELÉCTRICO 1. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 175 nm, el potencial de frenado para
Física P.A.U. FÍSICA MODERNA 1 FÍSICA MODERNA PROBLEMAS EFECTO FOTOELÉCTRICO 1. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 175 nm, el potencial de frenado para
Física Nuclear y Reacciones Nucleares Problemas de Práctica Multiopción 1 El núcleo atómico se compone de: A electrones
 Slide 1 / 58 Física Nuclear y Reacciones Nucleares Problemas de Práctica Slide 2 / 58 Multiopción 1 l núcleo atómico se compone de: Slide 3 / 58 electrones protones protones y electrones protones y neutrones
Slide 1 / 58 Física Nuclear y Reacciones Nucleares Problemas de Práctica Slide 2 / 58 Multiopción 1 l núcleo atómico se compone de: Slide 3 / 58 electrones protones protones y electrones protones y neutrones
Atomos, Moléculas e Iones
 Atomo Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
Atomo Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
Atomos, Moléculas e Iones. Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo
 Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Atomo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
Atomos, Moléculas e Iones Basado en Capítulo 2 de Química (Chang, 2010) Dr. Hernández Castillo Atomo Grecia Demócrito Filosofía Química??? Materialismo monista atomos significaba indivisible Teoría Atómica
Capítulo 1. Antecedentes de la Química Cuántica y primeras Teorías Atómicas
 Capítulo 1. Antecedentes de la Química Cuántica y primeras Teorías Atómicas Objetivos: Recordar y actualizar los conocimientos sobre las características de electrones, protones y neutrones Describir la
Capítulo 1. Antecedentes de la Química Cuántica y primeras Teorías Atómicas Objetivos: Recordar y actualizar los conocimientos sobre las características de electrones, protones y neutrones Describir la
La radioactividad es una propiedad intrínseca de los núcleos de los átomos.
 Radiactividad y Reacciones Nucleares Tema 3-1/23 1. DESCUBRIIMIIENTO DE LA RADIIACTIIVIIDAD Descubrimiento: Henri Becquerel (1896) La radioactividad es una propiedad intrínseca de los núcleos de los átomos.
Radiactividad y Reacciones Nucleares Tema 3-1/23 1. DESCUBRIIMIIENTO DE LA RADIIACTIIVIIDAD Descubrimiento: Henri Becquerel (1896) La radioactividad es una propiedad intrínseca de los núcleos de los átomos.
Unidad 1 Estructura atómica de la materia. Teoría cuántica
 Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Espectros atómicos y Modelos atómicos
 Estructura de la Materia Espectros atómicos y Modelos atómicos Martha M. Flores Leonar FQ UNAM 23 de febrero de 2016 CONTENIDO Espectro electromagnético Espectros atómicos Series espectroscópicas del Hidrógeno
Estructura de la Materia Espectros atómicos y Modelos atómicos Martha M. Flores Leonar FQ UNAM 23 de febrero de 2016 CONTENIDO Espectro electromagnético Espectros atómicos Series espectroscópicas del Hidrógeno
Slide 1 / 33. Slide 2 / 33. Slide 3 / El número atómico es equivalente a cuál de los siguientes? A El número de neutrones del átomo.
 Slide 1 / 33 Slide 2 / 33 3 El número atómico es equivalente a cuál de los siguientes? Slide 3 / 33 A El número de neutrones del átomo. B El número de protones del átomo C El número de nucleones del átomo.
Slide 1 / 33 Slide 2 / 33 3 El número atómico es equivalente a cuál de los siguientes? Slide 3 / 33 A El número de neutrones del átomo. B El número de protones del átomo C El número de nucleones del átomo.
Tema 2. Estructura atómica y sistema periódico
 Tema 2. Estructura atómica y sistema periódico Dalton: átomos par9culas indivisibles Nuevos experimentos: átomos cons>tuidos por unidades más pequeñas: par9culas subatómicas 1. Primeras evidencias de la
Tema 2. Estructura atómica y sistema periódico Dalton: átomos par9culas indivisibles Nuevos experimentos: átomos cons>tuidos por unidades más pequeñas: par9culas subatómicas 1. Primeras evidencias de la
Ejercicios de Física cuántica y nuclear. PAU (PAEG)
 1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
Modelos Atómicos Objetivo:
 CORPORACION EDUCACIONAL JUAN XXIII COLEGIO "CARDENAL RAÚL SILVA HENRÍQUEZ" DEPARTAMENTO DE CIENCIAS QUÍMICA Modelos Atómicos Objetivo: Comprender la utilidad de los modelos atómicos y la teoría atómica
CORPORACION EDUCACIONAL JUAN XXIII COLEGIO "CARDENAL RAÚL SILVA HENRÍQUEZ" DEPARTAMENTO DE CIENCIAS QUÍMICA Modelos Atómicos Objetivo: Comprender la utilidad de los modelos atómicos y la teoría atómica
PPTCEL001QM11-A16V1 Clase. Fenómenos nucleares I: partículas radiactivas
 PPTCEL001QM11-A16V1 Clase Fenómenos nucleares I: partículas radiactivas Aprendizajes esperados Conocer las partículas radiactivas. Conocer el concepto de isótopos. Aplicar el concepto de masa atómica promedio.
PPTCEL001QM11-A16V1 Clase Fenómenos nucleares I: partículas radiactivas Aprendizajes esperados Conocer las partículas radiactivas. Conocer el concepto de isótopos. Aplicar el concepto de masa atómica promedio.
ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA.
 ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA. INDICE Qué es la materia? Modelos de la materia Fuerzas Fundamentales
ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA. INDICE Qué es la materia? Modelos de la materia Fuerzas Fundamentales
Modelo atómico de Thomson
 Modelo atómico de Dalton. Ésta es la primera teoría científica que considera que la materia está dividida en átomos Modelo atómico de Thomson Introduce la idea de que el átomo puede dividirse en las llamadas
Modelo atómico de Dalton. Ésta es la primera teoría científica que considera que la materia está dividida en átomos Modelo atómico de Thomson Introduce la idea de que el átomo puede dividirse en las llamadas
CENTRO DE ESTUDIOS MIRASIERRA
 El ÁTOMO TEORÏAS ATÓMICAS1 Ya hemos visto el modelo atómico de Dalton, que decía que la materia estaba formada por partículas indivisibles llamadas átomos. Actualmente, se sabe que los átomos si son divisibles
El ÁTOMO TEORÏAS ATÓMICAS1 Ya hemos visto el modelo atómico de Dalton, que decía que la materia estaba formada por partículas indivisibles llamadas átomos. Actualmente, se sabe que los átomos si son divisibles
Átomo. Posee protones y neutrones. Estos se llaman Nucleones. Alrededor giran los electrones en. forma de nube. Son eléctricamente neutro
 Átomo Posee protones y neutrones Estos se llaman Nucleones Alrededor giran los electrones en forma de nube Son eléctricamente neutro Por eso Z(número de Protones)=Ne(Número de Electrones) Átomo Su dimensión
Átomo Posee protones y neutrones Estos se llaman Nucleones Alrededor giran los electrones en forma de nube Son eléctricamente neutro Por eso Z(número de Protones)=Ne(Número de Electrones) Átomo Su dimensión
1. Conceptos Básicos. Estructura del átomo
 1. Conceptos Básicos Estructura del átomo En química y física, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento químico que mantiene su identidad
1. Conceptos Básicos Estructura del átomo En química y física, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento químico que mantiene su identidad
EVALUACIÓN. Nombre del alumno (a): Escuela: Grupo:
 EVALUACIÓN Nombre del alumno (a): Escuela: Grupo: PREGUNTAS Por: Yuri Posadas Velázquez Contesta lo siguiente y haz lo que se pide. 1. Menciona los problemas que la física clásica no pudo resolver y que
EVALUACIÓN Nombre del alumno (a): Escuela: Grupo: PREGUNTAS Por: Yuri Posadas Velázquez Contesta lo siguiente y haz lo que se pide. 1. Menciona los problemas que la física clásica no pudo resolver y que
EL ESPECTRO ELECTROMAGNÉTICO
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
Problemas de Física moderna. Nuclear 2º de bachillerato. Física
 1 Problemas de Física moderna. Nuclear º de bachillerato. Física 1. El isótopo 34 U tiene un periodo de semidesintegración de 50000 años. Si partimos de una muestra de 10 gramos de dicho isótopo, determine:
1 Problemas de Física moderna. Nuclear º de bachillerato. Física 1. El isótopo 34 U tiene un periodo de semidesintegración de 50000 años. Si partimos de una muestra de 10 gramos de dicho isótopo, determine:
Descubrimiento del Núcleo
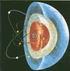 Física Nuclear Descubrimiento del Núcleo Componentes del núcleo: protones y neutrones Propiedades de la fuerza nuclear fuerte Debe ser de atracción y suficientemente grande para vencer la repulsión culombiana
Física Nuclear Descubrimiento del Núcleo Componentes del núcleo: protones y neutrones Propiedades de la fuerza nuclear fuerte Debe ser de atracción y suficientemente grande para vencer la repulsión culombiana
N está formado por 7 protones y 8 neutrones, luego su masa teórica debería ser:
 1. Calcular la energía de enlace por nucleón del isótopo 15 N sabiendo que su masa es 15,189 u. Datos: 1 u = 1,6 1-2 g ; m p = 1,26 u; m n = 1,8665 u El núcleo 15 N está formado por protones y 8 neutrones,
1. Calcular la energía de enlace por nucleón del isótopo 15 N sabiendo que su masa es 15,189 u. Datos: 1 u = 1,6 1-2 g ; m p = 1,26 u; m n = 1,8665 u El núcleo 15 N está formado por protones y 8 neutrones,
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico.
 EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
Física Cuántica y Modelos atómicos. Preguntas de Capítulo. 1. Cómo se determinó que los rayos catódicos poseían una carga negativa?
 Física Cuántica y Modelos atómicos. Preguntas de Capítulo 1. Cómo se determinó que los rayos catódicos poseían una carga negativa? 2. J. J. Thomson encontró que los rayos catódicos están partículas, a
Física Cuántica y Modelos atómicos. Preguntas de Capítulo 1. Cómo se determinó que los rayos catódicos poseían una carga negativa? 2. J. J. Thomson encontró que los rayos catódicos están partículas, a
N está formado por 7 protones y 8 neutrones, luego su masa teórica debería ser:
 01. Calcular la energía de enlace por nucleón del isótopo 15 N sabiendo que su masa es 15,0001089 u. Datos: 1 u = 1, 10-2 g ; m p = 1,002 u; m n = 1,0085 u El núcleo 15 N está formado por protones y 8
01. Calcular la energía de enlace por nucleón del isótopo 15 N sabiendo que su masa es 15,0001089 u. Datos: 1 u = 1, 10-2 g ; m p = 1,002 u; m n = 1,0085 u El núcleo 15 N está formado por protones y 8
QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA.
 Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
FÍSICA. 2º BACHILLERATO BLOQUE V: INTRODUCCIÓN A LA FÍSICA MODERNA Examen 1
 Examen 1 1. En la explosión de una bomba atómica se produce Sr-90, que es un peligroso contaminante radiactivo, cuyo periodo de semidesintegración es de 28,8 años. Cuánto tiempo debe transcurrir para que
Examen 1 1. En la explosión de una bomba atómica se produce Sr-90, que es un peligroso contaminante radiactivo, cuyo periodo de semidesintegración es de 28,8 años. Cuánto tiempo debe transcurrir para que
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS. TEMA 7 Pág. 155 libro nuevo
 PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS. Tipos de radiaciones electromagnéticas según λ.
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
Preguntas de Física Nuclear. 1. Qué partículas forman el núcleo? Cuál es el término general para nombrarlas? De qué están compuestas esas partículas?
 Preguntas de Física Nuclear 1. Qué partículas forman el núcleo? Cuál es el término general para nombrarlas? De qué están compuestas esas partículas? 2. Cuál es la definición de número atómico? Cuál es
Preguntas de Física Nuclear 1. Qué partículas forman el núcleo? Cuál es el término general para nombrarlas? De qué están compuestas esas partículas? 2. Cuál es la definición de número atómico? Cuál es
Estructura de la Materia. Quinta Sesión Modelo Atómico de Bohr (2)
 Estructura de la Materia Quinta Sesión Modelo Atómico de Bohr () Postulados del Modelo de Bohr Postulado 1 (o de Rutherford): El átomo consta de una parte central llamada núcleo en la que se encuentra
Estructura de la Materia Quinta Sesión Modelo Atómico de Bohr () Postulados del Modelo de Bohr Postulado 1 (o de Rutherford): El átomo consta de una parte central llamada núcleo en la que se encuentra
Espectroscopía de Absorción Molecular
 Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
[a] Consulta el libro de Física. Recuerda que la explicación del efecto fotoeléctrico, debida a Einstein, reafirma la teoría corpuscular de la luz.
![[a] Consulta el libro de Física. Recuerda que la explicación del efecto fotoeléctrico, debida a Einstein, reafirma la teoría corpuscular de la luz. [a] Consulta el libro de Física. Recuerda que la explicación del efecto fotoeléctrico, debida a Einstein, reafirma la teoría corpuscular de la luz.](/thumbs/69/61893136.jpg) Actividad 1 [a] En qué consiste el efecto fotoeléctrico? Es una reafirmación de la teoría corpuscular o de la teoría ondulatoria? [b] Cómo es posible que los protones y neutrones que constituyen un núcleo
Actividad 1 [a] En qué consiste el efecto fotoeléctrico? Es una reafirmación de la teoría corpuscular o de la teoría ondulatoria? [b] Cómo es posible que los protones y neutrones que constituyen un núcleo
Teoría atómica de Dalton (1803)
 EL ÁTOMO DIVISIBLE El átomo Desde los tiempos de la antigua Grecia,los pensadores se preguntaban cómo estaba constituida la materia en su interior? Demócrito (S.V a.c.) introduce el término de átomo como
EL ÁTOMO DIVISIBLE El átomo Desde los tiempos de la antigua Grecia,los pensadores se preguntaban cómo estaba constituida la materia en su interior? Demócrito (S.V a.c.) introduce el término de átomo como
MODELOS ATÓMICOS 2ª PARTE
 MODELOS ATÓMICOS 2ª PARTE Teoría Atómica de Joseph John Thomson Diseño Experimental de Joseph John Thomson (1856-1940) Utiliza Tubos de Rayos Catódicos, en los cuales estudia el comportamiento de los gases
MODELOS ATÓMICOS 2ª PARTE Teoría Atómica de Joseph John Thomson Diseño Experimental de Joseph John Thomson (1856-1940) Utiliza Tubos de Rayos Catódicos, en los cuales estudia el comportamiento de los gases
INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE DE LA ALUMNA: CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: CIENCIAS NATURALES NOTA:
 INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE DE LA ALUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: CIENCIAS NATURALES NOTA: DOCENTE: JOSÉ ROMÁN TIPO DE GUIA: CONCEPTUAL - EJERCITACION.
INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE DE LA ALUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: CIENCIAS NATURALES NOTA: DOCENTE: JOSÉ ROMÁN TIPO DE GUIA: CONCEPTUAL - EJERCITACION.
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS. Partícula Masa (g) Carga (Coulombs) Carga unitaria. Electrón
 MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
ME4010: Introducción a la Ingeniería Nuclear
 : Introducción a la Ingeniería Nuclear Sergio Courtin V. Marzo 2016 Departamento de Ingeniería Mecánica FCFM - Universidad de Chile Estabilidad Nuclear Los nucleidos que se encuentran en la naturaleza
: Introducción a la Ingeniería Nuclear Sergio Courtin V. Marzo 2016 Departamento de Ingeniería Mecánica FCFM - Universidad de Chile Estabilidad Nuclear Los nucleidos que se encuentran en la naturaleza
Origen del Concepto Átomo MODELOS ATÓMICOS. Teoría o Modelo Atómico de Dalton (1808) Qué es un modelo en Ciencias?
 MODELOS ATÓMICOS Origen del Concepto Átomo Demócrito: Siglo IV (A.C.) Fundador de la Escuela Atomista los átomos son indivisibles (átomo), y se distinguen por forma, tamaño, orden y posición. Los átomos
MODELOS ATÓMICOS Origen del Concepto Átomo Demócrito: Siglo IV (A.C.) Fundador de la Escuela Atomista los átomos son indivisibles (átomo), y se distinguen por forma, tamaño, orden y posición. Los átomos
Tema 12. ESTRUCTURA DEL ÁTOMO. 1º Bachillerato Física y Química Santa María del Carmen Alicante
 Tema 12. ESTRUCTURA DEL ÁTOMO 1º Bachillerato Física y Química Santa María del Carmen Alicante 1. Los modelos atómicos DEMÓCRITO s Va.d.C. DALTON 1808 THOMSON 1904 RUTHERFORD 1911 BORH 1913 SOMMERFELD
Tema 12. ESTRUCTURA DEL ÁTOMO 1º Bachillerato Física y Química Santa María del Carmen Alicante 1. Los modelos atómicos DEMÓCRITO s Va.d.C. DALTON 1808 THOMSON 1904 RUTHERFORD 1911 BORH 1913 SOMMERFELD
FÍSICA MODERNA. a) Explique las transformaciones energéticas en el proceso de fotoemisión y calcule la
 FÍSICA MODERNA 2001 1. Un haz de luz de longitud de onda 546 10-9 m incide en una célula fotoeléctrica de cátodo de cesio, cuyo trabajo de extracción es de 2 ev: a) Explique las transformaciones energéticas
FÍSICA MODERNA 2001 1. Un haz de luz de longitud de onda 546 10-9 m incide en una célula fotoeléctrica de cátodo de cesio, cuyo trabajo de extracción es de 2 ev: a) Explique las transformaciones energéticas
Tema 8. Radiactividad. Fundamento físico de la atenuación de las radiaciones ionizantes
 Tema 8. Radiactividad Fundamento físico de la atenuación de las radiaciones ionizantes Qué es la radiactividad? Estructura de la materia - - NÚCLEO (Z y N) + + + + + - - electrones: q e = -1,6 10 19 C
Tema 8. Radiactividad Fundamento físico de la atenuación de las radiaciones ionizantes Qué es la radiactividad? Estructura de la materia - - NÚCLEO (Z y N) + + + + + - - electrones: q e = -1,6 10 19 C
3 Estructura atómica de la materia
 3 Estructura atómica de la materia 1 Las leyes fundamentales de la química onservación de la masa y proporciones definidas uando hacemos reaccionar dos elementos químicos para formar un compuesto, se cumplen
3 Estructura atómica de la materia 1 Las leyes fundamentales de la química onservación de la masa y proporciones definidas uando hacemos reaccionar dos elementos químicos para formar un compuesto, se cumplen
Resolución PRÁCTICO 9
 Resolución PRÁCTICO 9 1- Complete las siguientes ecuaciones nucleares, remplazando las X por los símbolos o números correspondientes (Nota: X toma diferentes números y símbolos en cada una de las situaciones):
Resolución PRÁCTICO 9 1- Complete las siguientes ecuaciones nucleares, remplazando las X por los símbolos o números correspondientes (Nota: X toma diferentes números y símbolos en cada una de las situaciones):
Atomos, Moleculas, y Iones
 Atomos, Moleculas, y Iones La teoría atómica de la materia John Dalton: Cada elemento esta compuesto por átomos. Todos los átomos de un elemento son iguales. En las reacciones químicas los átomos no sufren
Atomos, Moleculas, y Iones La teoría atómica de la materia John Dalton: Cada elemento esta compuesto por átomos. Todos los átomos de un elemento son iguales. En las reacciones químicas los átomos no sufren
Tercero: una reacción química incluye sólo la separación combinación o reordenamiento de átomos sin crearlos o destruirlos.
 Coomppoonneennt teess ffuunnddaameennt taalleess ddeell áát toomoo El filósofo griego demócrito en el siglo V a.c. propuso la idea de que la materia estaba formada por partículas muy pequeñas indivisibles
Coomppoonneennt teess ffuunnddaameennt taalleess ddeell áát toomoo El filósofo griego demócrito en el siglo V a.c. propuso la idea de que la materia estaba formada por partículas muy pequeñas indivisibles
Relación Problemas Tema 11: Física Cuántica
 1.- Determinar la energía de un fotón para: a) Ondas de radio de 1500 khz b) Luz verde de 550 nm c) Rayos X de 0,06 nm Relación Problemas Tema 11: Física Cuántica Problemas (para todas, el medio de propagación
1.- Determinar la energía de un fotón para: a) Ondas de radio de 1500 khz b) Luz verde de 550 nm c) Rayos X de 0,06 nm Relación Problemas Tema 11: Física Cuántica Problemas (para todas, el medio de propagación
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Química
 Modelos atómicos Los filósofos de la antigüedad especularon sobre cómo estaba formada la materia. Demócrito (460-370 a.c) y otros filósofos anteriores a él, pensaban que el mundo material debería estar
Modelos atómicos Los filósofos de la antigüedad especularon sobre cómo estaba formada la materia. Demócrito (460-370 a.c) y otros filósofos anteriores a él, pensaban que el mundo material debería estar
Conceptos Básicos de la Energía Nuclear
 Conceptos Básicos de la Energía Nuclear El átomo En la naturaleza el átomo más simple que hay es el hidrógeno, cuenta con un protón y un electrón. Por tanto, para explicar el resto de los átomos, ha de
Conceptos Básicos de la Energía Nuclear El átomo En la naturaleza el átomo más simple que hay es el hidrógeno, cuenta con un protón y un electrón. Por tanto, para explicar el resto de los átomos, ha de
Un modelo atómico, por lo tanto consiste en representar de manera grafica, la dimensión atómica de la materia. El objetivo de estos modelos es que el
 Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
FISICA 2º BACHILLERATO
 A) Física Cuántica Introducción La física o mecánica cuántica es una rama de la física que se ocupa de cómo funciona la naturaleza a una escala muy pequeña. Surge a principios del sxx porque es cuando
A) Física Cuántica Introducción La física o mecánica cuántica es una rama de la física que se ocupa de cómo funciona la naturaleza a una escala muy pequeña. Surge a principios del sxx porque es cuando
TEMA 7: ELEMENTOS Y COMPUESTOS
 TEMA 7: ELEMENTOS Y COMPUESTOS FÍSICA Y QUÍMICA 4º ESO IES ZOCO LAS PARTÍCULAS DEL ÁTOMO MODELO ATÓMICO DE DALTON Cada elemento químico se compone de partículas diminutas e indestructibles denominadas
TEMA 7: ELEMENTOS Y COMPUESTOS FÍSICA Y QUÍMICA 4º ESO IES ZOCO LAS PARTÍCULAS DEL ÁTOMO MODELO ATÓMICO DE DALTON Cada elemento químico se compone de partículas diminutas e indestructibles denominadas
PROBLEMAS DE FÍSICA MODERNA
 PROBLEMAS DE FÍSICA MODERNA 1.- Para un metal la frecuencia umbral es de 4,5.10 14 Hz. Cuál es la energía mínima para arrancarle un electrón?. Si el metal se ilumina con una luz de 5.10-7 m de longitud
PROBLEMAS DE FÍSICA MODERNA 1.- Para un metal la frecuencia umbral es de 4,5.10 14 Hz. Cuál es la energía mínima para arrancarle un electrón?. Si el metal se ilumina con una luz de 5.10-7 m de longitud
Clase 4:Radiación del cuerpo, efecto fotoeléctrico y modelos atómicos
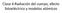 Clase 4:Radiación del cuerpo, efecto fotoeléctrico y modelos atómicos El experimento de Millikan Determina la carga del electrón 1.602 x 10-19 C Atomizador de gotas de aceite Fuente de Rayos X (ioniza
Clase 4:Radiación del cuerpo, efecto fotoeléctrico y modelos atómicos El experimento de Millikan Determina la carga del electrón 1.602 x 10-19 C Atomizador de gotas de aceite Fuente de Rayos X (ioniza
Actividad y Leyes del Decaimiento Radiactivo
 ctividad y Leyes del Decaimiento Radiactivo Características del Fenómeno de la Transformación Radiactiva Se denomina radiactividad al proceso de transformación espontánea nea de núcleos atómicos mediante
ctividad y Leyes del Decaimiento Radiactivo Características del Fenómeno de la Transformación Radiactiva Se denomina radiactividad al proceso de transformación espontánea nea de núcleos atómicos mediante
25 12 Mg. 1. En la especie el numero atómico corresponde a: A) 22 B) 12 C) 25 D) 13 E) ninguna de las anteriores.
 MINIPRUEBA CLASE 02 25 12 Mg 1. En la especie el numero atómico corresponde a: A) 22 B) 12 C) 25 D) 13 E) ninguna de las anteriores. 25 12 Mg Z 2. Se puede afirmar que: I) La masa del electrón es aproximadamente
MINIPRUEBA CLASE 02 25 12 Mg 1. En la especie el numero atómico corresponde a: A) 22 B) 12 C) 25 D) 13 E) ninguna de las anteriores. 25 12 Mg Z 2. Se puede afirmar que: I) La masa del electrón es aproximadamente
Robert A. MILLIKAN ( )
 Robert A. MILLIKAN (1906 1914) Modelo atómico de Rutherford - Todo átomo está formado por un núcleo y corteza. - El núcleo, muy pesado, y de muy pequeño tamaño, formado por un número de protones igual
Robert A. MILLIKAN (1906 1914) Modelo atómico de Rutherford - Todo átomo está formado por un núcleo y corteza. - El núcleo, muy pesado, y de muy pequeño tamaño, formado por un número de protones igual
H Deuterio (1p+1n); ,02310 = = = 1uma = 1u = = 1,6610 kg
 El átomo Física uclear Es la parte más pequeña de un elemento químico que mantiene sus propiedades. Está formado por protones y neutrones, que forman el núcleo, y por electrones que giran en la corteza.
El átomo Física uclear Es la parte más pequeña de un elemento químico que mantiene sus propiedades. Está formado por protones y neutrones, que forman el núcleo, y por electrones que giran en la corteza.
ESQUEMA. De él cabe destacar el experimento que demostró que el modelo de Thompson era falso y los postulados que llevaron a que formulara su modelo:
 TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
EXTRUCTURA ATOMICA ACTUAL
 ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
Temas X y XI: Radiactividad
 Física Médica Grupo 1B Temas X y XI: Radiactividad Dpto. de Radiología (Física Médica) Facultad de Medicina Transiciones nucleares 1. Desex. gamma: A Z X * A Z X+γ 1. Emisión alfa: A Z X A 4 Z 2 Y+α 2.
Física Médica Grupo 1B Temas X y XI: Radiactividad Dpto. de Radiología (Física Médica) Facultad de Medicina Transiciones nucleares 1. Desex. gamma: A Z X * A Z X+γ 1. Emisión alfa: A Z X A 4 Z 2 Y+α 2.
UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO
 UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO 1. PRIMERAS TEORÍAS ATÓMICAS Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería
UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO 1. PRIMERAS TEORÍAS ATÓMICAS Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería
Ejercicios de Física cuántica y nuclear. PAEG
 1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
1. Con respecto a la radiación gamma, cuál(es) de las siguientes afirmaciones es(son) correcta(s)?
 Nº GUÍA PRÁCTICA Fenómenos nucleares I: partículas radiactivas Ejercicios PSU 1. Con respecto a la radiación gamma, cuál(es) de las siguientes afirmaciones es(son) correcta(s)? I) Puede penetrar a través
Nº GUÍA PRÁCTICA Fenómenos nucleares I: partículas radiactivas Ejercicios PSU 1. Con respecto a la radiación gamma, cuál(es) de las siguientes afirmaciones es(son) correcta(s)? I) Puede penetrar a través
